【免费下载】分析化学2期中试卷 答案

云南大学2011至2012学年上学期化学科学与工程学院
《分析化学(2)》期中考试(闭卷)试卷A
满分:100分 考试时间:120分钟 任课教师:_________专业 学号 姓名 题号
一二三四五总分
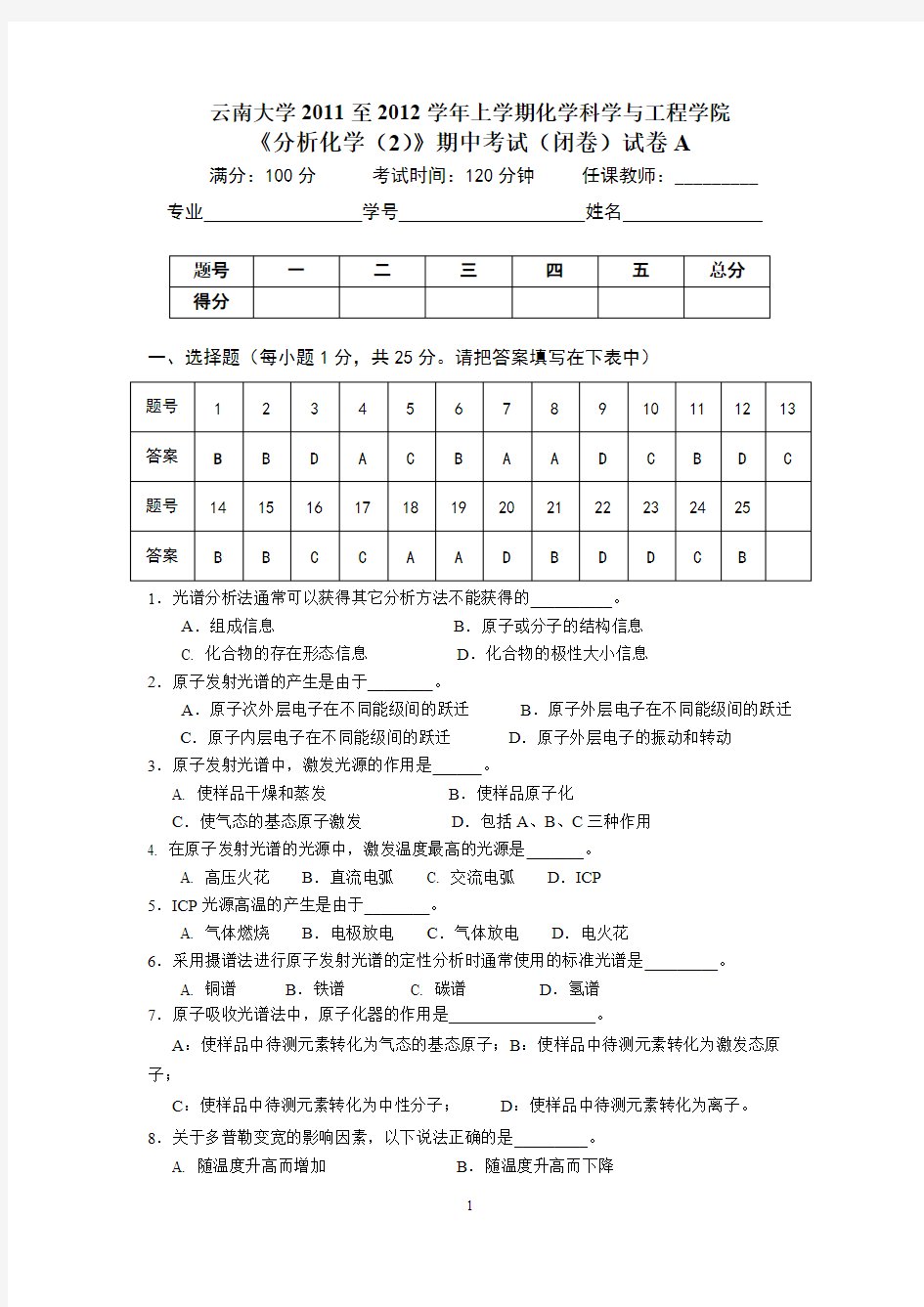
得分一、选择题(每小题1分,共25分。请把答案填写在下表中)题号
12345678910111213答案
B B D A
C B A A
D C B D C 题号
141516171819202122232425答案B B C C A A
D B D D C B 1.光谱分析法通常可以获得其它分析方法不能获得的__________。A .组成信息 B .原子或分子的结构信息C. 化合物的存在形态信息 D .化合物的极性大小信息2.原子发射光谱的产生是由于________。A .原子次外层电子在不同能级间的跃迁 B .原子外层电子在不同能级间的跃迁 C .原子内层电子在不同能级间的跃迁 D .原子外层电子的振动和转动3.原子发射光谱中,激发光源的作用是______。 A. 使样品干燥和蒸发 B .使样品原子化 C .使气态的基态原子激发 D .包括A 、B 、C 三种作用4. 在原子发射光谱的光源中,激发温度最高的光源是_______。 A. 高压火花 B .直流电弧 C. 交流电弧 D .ICP 5.ICP 光源高温的产生是由于________。
A. 气体燃烧 B .电极放电 C .气体放电 D .电火花6.采用摄谱法进行原子发射光谱的定性分析时通常使用的标准光谱是_________。 A. 铜谱 B .铁谱 C. 碳谱 D .氢谱
7.原子吸收光谱法中,原子化器的作用是
。 A :使样品中待测元素转化为气态的基态原子;B :使样品中待测元素转化为激发态原子;
C :使样品中待测元素转化为中性分子;
D :使样品中待测元素转化为离子。
8.关于多普勒变宽的影响因素,以下说法正确的是_________。
A. 随温度升高而增加 B .随温度升高而下降
,合理利用管线敷设技术。线缆敷设原则:在分线盒处,当不同电压回路交叉时,应采用金属隔板进行隔开处理;同一线槽内,强电回路须同时切断习题电源,线缆敷设完毕,要进行检查和检测处理。工作并且进行过关运行高中资料试卷技术指导。对于调试过程中高中资料试卷技术问题,作为调试人员,需要在事前掌握图纸资料、设备制造厂家出具高中资料试卷试验报告与相关技术资料,并且了解现场设备高中资料试卷布置情况与有关高中资料试卷电气系统接线等情况,然后根据规范与规程装置调试技术,要求电力保护装置做到准确灵活。对于差动保护装置高中资料试卷调试技术是指发电机一变压器组在发生内部故障时,需要进行外部电源高中资料试卷切除从而采用高中资料试卷主要保护装置。
C.随待测原子的摩尔质量增大而增大D.随压力增大而减小
9.空心阴极灯中对发射线半宽度影响最大的因素是_________。
A.阴极材料B.阳极材料C.内充气体D.灯电流
10.原子吸收光谱法中,消除物理干扰的最佳方法是________。
A.加入稀释剂B.加入保护剂C.采用标准加入法定量D.加入释放剂11.原子吸收分光光度计中常用的检测器是_________。
A.光电池 B. 光电倍增管 C. 光电管 D. 感光板
12. 在原子吸收光谱法中,对于易形成熔点较高氧化物的元素,可以选用的火焰是____ 。
A.化学计量火焰B.贫燃火焰C.电火花D.富燃火焰
13. 不能采用原子发射光谱分析的物质是______。
A.碱金属和碱土金属B.过渡金属
C.有机物和大部分的非金属元素D.稀土元素
14、在原子吸收光谱分析中,塞曼效应可用来消除______。
A:物理干扰;B:背景干扰;C:化学干扰;D:电离干扰
15. 原子吸收光谱法测定试样中的钾元素含量, 通常需加入适量的钠盐, 这里钠盐被称为__________。
A.释放剂B.消电离剂 C. 缓冲剂D.保护剂
16. 丙酮分子在220nm处产生的弱吸收带(ε< 100)是因为下列那种跃迁的结果________。
A.σ-σ* B.π-π* C.n-π* D.n-σ*
17. 分子的紫外-可见吸收光谱呈带状光谱,其原因是_________。
A.分子中价电子运动的离域性
B. 分子中振动能级的跃迁伴随着转动能级的跃迁
C.分子中价电子的跃迁伴随振动和转动能级的跃迁
D. 分子中价电子能级的相互作用
18. 在下列化合物中,能在近紫外光区产生两个吸收带的是_______。
A.丙烯醛B.丙烯 C. 1,3-丁二烯D.丁烯
19. 在一定波长处,用2.0cm吸收池测得某试液的百分透光率为60%,若改用3.0cm吸收
池时,该试液的透光率为________。
A.0.46 B.0.11 C. 0.22 D.0.9
20. 某化合物在正己烷中的最大吸收波长为329nm,在水中的最大吸收波长为308nm,则
该吸收峰的跃迁类型属于。
A.σ-σ* B.n-σ* C.π-π* D.n-π*
21. 双光束分光光度计与单光束分光光度计相比,其优点是________。
A.可以扩大波长的应用范围B.可以抵消因光源的变化而产生的误差
C. 可以抵消吸收池所带来的误差D.可以采用快速响应的检测系统
22. 某物质的摩尔吸光系数ε值很大,则表明________。
A.该物质的浓度很高B.该物质对某波长的光吸收能力很强
C. 测定该物质的准确度很高
D .测定该物质的灵敏度很高23. 下列电磁辐射的性质不属于其波的性质的是________。A .频率
B .波数
C .衍射
D .能量24. 下列化合物的紫外-可见光谱中,最大吸收波长最大的是 。 A .
B .
C .
D .25. 内标元素必须符合的条件之一是________。
A .必须是基体元素中含量最大的
B .必须与待测元素具有相近的蒸发特性
C .必须与待测元素具有相同的电离位
D .必须与待测元素具有相同的激发电位二、判断题(每小题0.5分,共5分。答案填在下表中,对的打“√”,错的打“X”)12345678910×√××√√×√×√ ( )1.待测组分能被仪器检出的最低量为仪器的灵敏度。 ( )2.根据玻耳兹曼分布定律进行计算的结果表明,原子化过程时,所有激发能级上的原子数之和相对于基态原子总数来说很少。 ( )3.在紫外光谱中,发色团指的是有颜色并在近紫外和可见区域有特征吸收的基团。 ( )4.原子吸收光谱是由气态物质中基态原子的内层电子跃迁产生的。 ( )5.极性溶剂一般使吸收带发生红移,使吸收带发生蓝移。 ( )6. 由第一激发态回到基态所产生的谱线,通常也是最灵敏线、最后线。 ( )7.自吸现象是由于激发态原子与基态原子之间的相互碰撞失去能量所造成的。( )8.AAS 和AFS 的仪器构成相当,都属原子光谱,但后者必须将光源或检测器置于与主光路垂直的位置。
(
)9.光栅的分辨率仅取决于光栅的刻线宽度。( )10. 光谱线的强度与跃迁能级的能量差、高能级上的原子总数及跃迁概率有关。
三、填空题(每个填空为1分,共26分)
1、钠的一条谱线(在真空中波长为589nm)在折射率为1.2的介质中传播时的频率为 5.09×1014Hz ,波长为 491nm ,速度为
2. 50×108m·s -1
CH 3O CH 3O CH 3O
CH 2O 不同电压回路交叉时,应采用金属隔板进行隔开处理;同一线槽内,强电回路须同时切断习题电源,线缆敷设完毕程中高中资料试卷技术问题,作为调试人员,需要在事前掌握图纸资料、设备制造厂家出具高中资料试卷试验报告护装置高中资料试卷调试技术是指发电机一变压器组在发生内部故障时,需要进行外部电源高中资料试卷切除从而
。2、一般说来,反式异构体的λmax 比顺式异构体的λmax 要 大 ,是因为反式异构体的 共轭程度 大,而顺式异构体由于邻近原子的 空间位阻 作用导致 共轭程度 减小。3、紫外-可见分光光度计中,在紫外光区测定时,常使用的光源是
D 灯(H 灯) ,单色器和比色皿材料为 石英 ;在可见光区测定时,常使用的光源是 钨灯
,单色器和比色皿材料为 玻璃 。
4、原子发射光谱的定量依据是 塞伯-罗马金公式 ,其数学表达式是;
a c
b I lg lg lg +=式中a 是与 试样的组成、蒸发 等有关的常数,b 是与 谱线自吸 有关的常数,当b=0时,表示 谱线不存在自吸 ;b 越大,说明 谱线自吸越严重 。5、电热原子化器(石墨炉原子化器)在使用时,为了防止样品与石墨管氧化,要不断通入惰性气体(Ar 气) 。电热原子化器的原子化测定过程可以分为 干燥 、 灰化(蒸发) 、 原子化 和 净化 四个阶段。6、在进行定性分析时,单色器的狭缝宽度宜 小 ;原因是 减少谱线间的重叠干扰 ;在进行定量分析时,单色器的狭缝宽度宜 大 ;原因是 提高谱线强度 。四、简答题(本大题有4小题,每小题6分,共24分)1、写出镁的基态(3 S 2)和第一激发态(3 S 1P 1)的光谱项符号,并由此判断镁的价电子从基态跃迁到第一激发态时,能产生多少条明显的吸收线。解:电子处于3 S 2时:n=3, L=0, S=0, J=0.。光谱项为:31S 0;电子处于3 S 1P 1时:n=3, L=1, S=0, J=0, 1, 2.。光谱项为:31P 1、33P 0、33P 1、33P 2。根据光谱选择定则,共振跃迁产生的光谱线为31S 0—31P 1,其他是禁止的。2、为什么要以峰值吸收代替积分吸收进行原子吸收分析?积分吸收的测定,对光源发出的谱线有何要求?为什么空心阴极灯能满足这些要求。 课件中术。高中资高中与规程因此力保护
3、简述什么叫偏离朗伯-比尔定律和引起偏离朗伯-比尔定律的原因。
4、从原理和仪器结构上比较原子吸收光谱和原子发射光谱的异同点。答:(1)
原子吸收光谱是基于气态原子外层电子由基态向激发态跃迁时对特征谱线产生吸收从而进行定量分析的方法。其仪器结构中包括一个锐线光源和一个原子化器。(2) 原子发射光谱是基于气态原子外层电子由激发态返回基态时辐射的特征谱线进行定性和定量分析的方法。其仪器结构中没有锐线光源,只有一个提供原子化和激发能的原子化器(光源)。五、计算题( 本大题共3 小题,共20分)1、用波长为213.8nm ,质量浓度为0.010mg.mL -1的锌标准溶液和空白溶液交替连续测定10次,用记录仪记录的格数如下。计算该原子吸收分光光度计测定锌元素的检出限。(本小题5分)序号12345678910记录仪格数13.513.014.814.8
14.514.014.014.814.014.2
解:求出噪声的标准偏差为s=0.597, 吸光度的平均值为14.16,代入检测限的表达式得:
m×3s/A=0.010 ×3×0.597/14.16= 0.0013mg.mL -1对全部高中资料试卷电气设备,
2、某催眠药物浓度为1.0?10-3 mol/L ,用1cm 比色皿,在270nm 处测得吸光度为0.400,在345nm 处测得吸光度为0.010。已证明此药在人体内的代谢产物浓度为1.0?10-4 mol/L ,用1cm 比色皿,在270nm 处测得吸光度为0.00,在345nm 处测得吸光度为0.460。现取用此药人的尿液10.0mL ,稀释至100mL ,同样条件下在270nm 处测得吸光度为0.325,在345nm 处,测得吸光度为0.720。试求尿样中代谢产物的浓度(设空白尿样在270nm 及345nm 处无吸收)(本小题10分)。解:因为:;232701000.4100.1400.0?=?==-C A 药ε10100.10100.03345=?==-C A 药ε; 0270==C
A 代ε343451060.4100.1460.0?=?==-C A 代ε所以:325.00270270270270=+=+=药药代药C A A A ε 720.0345345345345345=+=+=代代药药代药C C A A A εε得C 药 = 8.12?10-4 mol/L ; C 代 = 1.55?10-4 mol/L 所以尿样中代谢产物的浓度为:1.55?10-4?10=1.55?10-3 mol/L 3、采用原子吸收光谱法分析试样中的微量Si ,硅空心阴极灯发射出三条较强的谱线251.43nm 、251.61nm 、251.92nm ,初步实验时,当Si 的浓度为5.0mg/L 时,三条波长下测得的吸光度值分别为0.044、0.44和0.022,选择哪一条谱线作为分析线为宜?当仪器的倒
线色散率为D -1为2nm/mm 时,应该选用多大的狭缝宽度?在该狭缝下,单色器的光谱通带为多少?(本小题5分)解:题,合理利用管线敷设技试工作并且进行过关运行护装置调试技术,要求电
分析化学课后作业答案解析
2014年分析化学课后作业参考答案 P25: 1.指出在下列情况下,各会引起哪种误差?如果是系统误差,应该采用什么方法减免? (1) 砝码被腐蚀; (2) 天平的两臂不等长; (3) 容量瓶和移液管不配套; (4) 试剂中含有微量的被测组分; (5) 天平的零点有微小变动; (6) 读取滴定体积时最后一位数字估计不准; (7) 滴定时不慎从锥形瓶中溅出一滴溶液; (8) 标定HCl 溶液用的NaOH 标准溶液中吸收了CO 2。 答:(1)系统误差中的仪器误差。减免的方法:校准仪器或更换仪器。 (2)系统误差中的仪器误差。减免的方法:校准仪器或更换仪器。 (3)系统误差中的仪器误差。减免的方法:校准仪器或更换仪器。 (4)系统误差中的试剂误差。减免的方法:做空白实验。 (5)随机误差。减免的方法:多读几次取平均值。 (6)随机误差。减免的方法:多读几次取平均值。 (7)过失误差。 (8)系统误差中的试剂误差。减免的方法:做空白实验。 3.滴定管的读数误差为±0.02mL 。如果滴定中用去标准溶液的体积分别为2mL 和20mL 左右,读数的相对误差各是多少?从相对误差的大小说明了什么问题? 解:因滴定管的读数误差为mL 02.0±,故读数的绝对误差mL a 02.0±=E 根据%100?T E = E a r 可得 %1%100202.02±=?±= E mL mL mL r %1.0%1002002.020±=?±=E mL mL mL r 这说明,量取两溶液的绝对误差相等,但他们的相对误差并不相同。也就是说,当被测定的量较大时,测量的相对误差较小,测定的准确程度也就较高。 4.下列数据各包括了几位有效数字? (1)0.0330 (2) 10.030 (3) 0.01020 (4) 8.7×10-5 (5) pKa=4.74 (6) pH=10.00 答:(1)三位有效数字 (2)五位有效数字 (3)四位有效数字 (4) 两位有效数字 (5) 两位有效数字 (6)两位有效数字 9.标定浓度约为0.1mol ·L -1 的NaOH ,欲消耗NaOH 溶液20mL 左右,应称取基准物质H 2C 2O 4·2H 2O 多少克?其称量的相对误差能否达到0. 1%?若不能,可以用什么方法予以改善?若改用邻苯二甲酸氢钾为基准物,结果又如何? 解:根据方程2NaOH+H 2C 2O 4·H 2O==Na 2C 2O 4+3H 2O 可知, 需H 2C 2O 4·H 2O 的质量m 1为:
[精品]分析化学期中试题.doc
分析化学(一)期中考试试卷 学号班级姓名分数 四五六七总分题号 ■— .―― 评分 一、选择题(共10题20分) 1.2分 表示一组数据离散特性的最好标志是-------------------------- () (A)全距(B)偏差(C)平均偏差(D)标准差 2.2分 已知H3PO4的pKai = 2.12, pA = 7.20, p^a3 = 12.36。今有一磷酸盐溶液的pH = 4.66,则其主要存在形式是---------------------------------------- () (A) HPO/ (B) H2PO4- (C) HPO42' + H2PO4(D) H2PO4 + H3PO4 3.2分 用0.10 mol/LNaOH 溶液滴定0.10 mol/L HA(/C a=5.0 X 10'5),若终点的pH 为9.0, 则终点误差为.................................................. () (A) +0.02% (B)+().O1% (C) -0.02% (D) -0.01% 4.2分 磷以MgNH4PO4 - 6H2O形式沉淀,经过滤、洗涤后用适量HC1标准溶液溶解, 而后以NaOH标准溶液返滴定,选甲基橙为指示剂,这时磷与HC1的物质的量 比〃(P):〃 (HC1)为---------------------------------------------- ( ) (A) 1:3 (B)3:l (C) 1:1 (D) 1:2 5.2分 将PCX-以MgNH4PO4 - 6H2O形式沉淀,经过滤、洗涤后先用过量HC1标准溶液溶解,而后以NaOH标准溶液返滴定,此时应选的指示剂是?...... () (A)甲基橙(B)石蕊(C)酚酿(D)百里酚歌 6.2分 以下溶液稀释10倍时,pH改变最大的是----------------------- () (A) 0.1 mol/L NH4A C (B) 0.1 mol/L NaAc (C) 0.1 mol/L HAc (D) 0.1 mol/L HC1 7.2分
定量分析化学模拟试卷及答案
精品文档 定量分析化学模拟试卷(二) 一、填空:(共22空,每空1分,共22分) 1.在滴定分析中,若使分析结果的相对误差≤0.1%时,则滴定剂的用量最少必须为 。 2.离群(可疑)值是指 ,离群值的取舍方法有(1) (2) 。 3. 滴定的操作方式有____________、____________、___________、_____________。 4.在用EDTA 滴定水中Ca 、Mg ,测定总量时,应调节pH 为 ,有时要加入三乙醇胺,其目的是为了掩蔽 、 干扰。 5.碘量法的主要误差来源是 和 。 6.莫尔法测定Cl - 浓度时,以 为标准溶液,以 为指示剂,通过生成 色的沉淀从而指示终点的到达。 7.根据误差的性质及产生原因,误差可分为 和 。 8.某弱酸HA 的Ka=1.0×10-5,则其0.1mol/L 溶液的pH 值为_________。 9.直接用长期保存于干燥器中的硼砂(Na 2B 4O 7·10H 2O )标定盐酸溶液,将使所标定的盐酸溶液的浓度_________(填偏低或偏高)。 10.NH 4H 2PO 4水溶液的质子条件是_______________________________________。 11. 既可用于标定NaOH 溶液,又可用于标定KMnO 4溶液的基准物质为 _。 二、单项选择题(共20题,每题2分,共40分 ,正确打“V ”) 1.按有效数字运算规则,当lg K =20.43,则K =: a .2.7×1020 b .2.69×1020 c .2.692×1020 d .3×1020 2.对某试样进行平行三次测定,得 CaO 平均含量为 30.60% ,而真实含量为 30.30% ,则 30.60%-30.30% = 0.30% 为: a .相对误差 b .绝对误差 c .相对偏差 d .绝对偏差 3.下列试剂中,可用直接法配制标准溶液的是: a .K 2Cr 2O 7 b .NaOH c .H 2SO 4 d .KMnO 4 4.某酸碱指示剂的K HIn =1.0?10-5 ,则指示剂的理论变色范围为: a .4~6 b .4~5 c .5~6 d .3~7 5.用0.1mol/L 的NaOH 滴定0.1mol/L 的H 2C 2O 4(K a1=5.9?10-2,K a2=6.4?10-5),两级离解出的H +: a .分别被准确滴定 b .同时被准确滴定 c .均不能被准确滴定 d .只有第一级离解出H +能被准确滴定 6.指出下列条件适于佛尔哈德法的是: a .pH6.5~10 b .以K 2CrO 4为指示剂 c .滴定酸为0.1~1 mol ?L -1 d .以荧光黄为指示剂 7.配位滴定法以EDTA 滴定金属离子时,终点的颜色是: a .游离指示剂的颜色 b .指示剂配合物的颜色 c .EDTA 配合物的颜色 d .EDTA 配合物与指示剂配合物的混合色 8.用佛尔哈德法测定I -含量时,没有加入硝基苯,其测定结果会: a .偏高 B .偏低 c .无影响 d .不能确定 9.有一K 2Cr 2O 7标准溶液,已知其浓度为0.01683 mol ?L -1,求T Fe/ K 2Cr 2O 7为多少g ·mL -1: a 、0.05640 b 、0.008063 c 、0.005640 d 、0.080 10.EDTA 与金属离子生成螯合物时,其螯合比一般为: a . 1:1 b .1:2 c .1:4 d .1:6 11.配位滴定中,指示剂的封闭现象是由什么引起的: a .指示剂与金属离子生成的络合物不稳定 b .被测溶液的酸度过高 c .指示剂与金属离子生成的络合物稳定性大于MY 的稳定性 d .指示剂与金属离子生成的络合物稳定性小于MY 的稳定性 12.配位滴定中,αY(H)=1表示: a .Y 与H +没有发生副反应 b .Y 与H +之间的副反应相当严重 c .Y 的副反应较小 d .[Y']=[H +] 13.用铈量法测铁时,滴定至50%时的电位是: a .1.44 V b .1.06 V c .0.68 V d .0.86 V (已知 1.44V ?'=4+/3+Ce 0.68V ?'=3+/2+Fe ) 14.下列滴定法中,不用另外加指示剂的是: a .重铬酸钾法 b .甲醛法 c .碘量法 d .高锰酸钾法 15.用K 2Cr 2O 7法测定F e 2+时,为了增大突跃范围、提高测定的准确度,应在 试液中加入: a .H 2SO 4+H 3PO 4 b .H 2SO 4+HNO 3 c .H 2SO 4+HCl d .H 2SO 4+HAc 16.碘量法测定铜时,近终点时要加入KSCN 或NH 4SCN ,其作用是: 院系: 专业班级: 姓名: 学号: 装 订 线
分析化学习题答案(人卫版)
第二章 误差和分析数据处理 1、 指出下列各种误差是系统误差还是偶然误差?如果是系统误差,请区别方法误差、仪器 和试剂误差或操作误差,并给出它们的减免方法。 答:①砝码受腐蚀: 系统误差(仪器误差);更换砝码。 ②天平的两臂不等长: 系统误差(仪器误差);校正仪器。 ③容量瓶与移液管未经校准: 系统误差(仪器误差);校正仪器。 ④在重量分析中,试样的非被测组分被共沉淀: 系统误差(方法误差);修正方法,严格沉淀条件。 ⑤试剂含被测组分: 系统误差(试剂误差);做空白实验。 ⑥试样在称量过程中吸潮: 系统误差;严格按操作规程操作;控制环境湿度。 ⑦化学计量点不在指示剂的变色范围内: 系统误差(方法误差);另选指示剂。 ⑧读取滴定管读数时,最后一位数字估计不准: 偶然误差;严格按操作规程操作,增加测定次数。 ⑨在分光光度法测定中,波长指示器所示波长与实际波长不符: 系统误差(仪器误差);校正仪器。 ⑩在HPLC 测定中,待测组分峰与相邻杂质峰部分重叠 系统误差(方法误差);改进分析方法 11、两人测定同一标准试样,各得一组数据的偏差如下: ① 求两组数据的平均偏差和标准偏差; ② 为什么两组数据计算出的平均偏差相等,而标准偏差不等; ③ 哪组数据的精密度高? 解:①n d d d d d 321n ++++= 0.241=d 0.242=d
1 2 i -∑= n d s 0.281=s 0.312=s ②标准偏差能突出大偏差。 ③第一组数据精密度高。 13、测定碳的相对原子质量所得数据:12.0080、12.0095、12.0099、12.0101、12.0102、12.0106、12.0111、12.0113、12.0118及12.0120。求算:①平均值;②标准偏差;③平均值的标准偏差;④平均值在99%置信水平的置信限。 解:①12.0104i =∑= n x x ②0.00121)(2 i =--∑= n x x s ③0.00038== n s s ④0.0012 0.000383.25 25.3t 92-2 0.01±=?±==±±==时,,查表置信限=f n s t n s t x u 15、解:(本题不作要求) ,存在显著性差异。 得查表8,05.08,05.021R 2121 306.2 228 24649.34 64 60008 .04602 .04620.00008.00008.0%08.0 4602.0%02.46 4620.0%20.46t t t f t S S S S S x x >=-=-+==+?-= ========== 16、在用氯丁二烯氯化生产二氯丁二烯时,产品中总有少量的三氯丁二烯杂质存在。分析表明,杂质的平均含量为1.60%。改变反应条件进行试生产,取样测定,共取6次,测定杂质含量分别为:1.46%、1.62%、1.37%、1.71%、1.52%及1.40%。问改变反应条件后,产品中杂质百分含量与改变前相比,有明显差别吗?(α=0.05时) 解:
分析化学期中考试考试题答案
分析化学期中考试考试题答案 一、 填空题每填空1分,共32分) 1. 根据测量原理分类,分析方法有(化学分析)和(仪器分析)。 2. 定量分析过程通常包括(取样);(试样的分解);(待测组分测定);(结果计 算)。 3. 用沉淀法测定纯NaCl 中氯的质量分数,得到下列结果:0.5982,0.6000,0.6046, 0.5986,0.6024。则平均结果为(0.6009 );平均结果的绝对误差为(-5.7x10-3 );相对误差为(-0.94% );中位数为(0.6006 );平均偏差为(2.1x10-3 );相对平均偏差为(0.35% )。 4. 按照有效数字的运算规则,下列计算式的结果各应包括几位有效数字:(1) 213.64+4.402+0.3244 (五 )位; (2)0.1000 x (25.00-1.52)x 246.47/(1.000x1000)(四)位;(3)pH=0.03求H+浓度(两 )位。 5. 在分析过程中,下列情况各造成何种(系统、随机)误差。(1)称量过程中天平零点略有变动( 随机误差 );(2)分析用试剂中含有微量待测组分(系统误差 ); 6. 标定HCl 溶液的浓度时,可用Na 2CO 3或硼砂(Na 2B 4O 7 10H 2O )为基准物质,若Na 2CO 3吸水,则测定结果(偏高 ):若硼砂结晶水部分失水,则测定结果(偏低 );(以上两项填无影响、偏高、偏低)。若两者均保存妥当,不存在上述问题,则选(硼砂 )作为基准物质更好,原因为(HCL 与两者均按1:2计量比进行反应,硼砂摩尔质量大,称量时相对误差小 )。 7. 从质量保证和质量控制的角度出发,为了使分析数据能够准确地反映实际情况。要求分析数据具有(代表性)、(准确性)、(精密性)、(可比性)和(完整性)。这些反映了分析结果的(可靠性 )。 8. 浓度为c (mol/L )H 2C 2O 4溶液的电荷平衡方程:([H+]=[OH -]+[ HC 2O 4-]+2[C 2O 42-]) 9. 根据酸碱质子理论,OH -的共轭酸是(H2O ),HAc 的共轭酸是(H2Ac+)。 10.某溶液含有M 和N 离子,且K MY ?K NY 。lgK`MY 先随溶液pH 增加而增大,这是由于(αY (H )减小)。 然后当pH 增加时,lgK`MY 保持在某一定值(N 在此条件下不水解),这是因为(αY (N ) >αY (H ),lgK`MY 的大小由αY (N ) 决定,与αY (H )无关)。 11. 一般分析实验室对日常生产流程中的产品质量指标进行检查控制的分析方法为(例行)分析。不同企业部门对产品质量和分析结果有争议时,请权威的分析测试部门进行裁判的分析称为(仲裁)分析。 12. 在滴定中指示剂颜色的那一点成为(滴定终点)。(滴定终点)与化学计量点不一定恰好吻合, 由此造成的分析误差成为(终点误差)。 13. 试样的采集是指大批物料中采取(少量)样本作为原始试样。原始试样在经加工处理后用于分析,其分析结果被视作反映原始物料的实际情况。因此所采集试样应具有高度的(代表性)。
分析化学模拟试卷
化学分析模拟试卷(2) 班级姓名分数 一、选择题( 共12题23分) 1. 2 分(0112) 0112 用同一KMnO4标准溶液在酸性条件下分别滴定体积相等的FeSO4和H2C2O4溶液,耗用的标准溶液体积相等,对两溶液浓度关系正确表述是--------------( ) (A) c(FeSO4)= c(H2C2O4) (B) 2c(FeSO4)= c(H2C2O4) (C) c(FeSO4)=2c(H2C2O4)(D) 2n(FeSO4)= n(H2C2O4) 2. 2 分(0202) 0202 以下情况产生的误差属于系统误差的是---------------------( ) (A) 指示剂变色点与化学计量点不一致 (B) 滴定管读数最后一位估测不准 (C) 称样时砝码数值记错 (D) 称量过程中天平零点稍有变动 3. 2 分(0224) 0224 已知某溶液的pH值为11.90,其氢离子浓度的正确值为--------------( ) (A) 1×10-12 mol/L (B) 1.3×10-12 mol/L (C) 1.26×10-12 mol/L (D) 1.258×10-12 mol/L 4. 1 分(0305) 0305 下列各组组分中不属于共轭酸碱对的是--------------------------( ) (A) H2CO3和CO32-(B) NH3和NH2- (C) HCl和Cl-(D) HSO4- 和SO42- 5. 2 分(0321) 0321 在磷酸盐溶液中,HPO42-浓度最大时的pH是----------------( ) (已知H3PO4的解离常数p K a1 = 2.12, p K a2 = 7.20, p K a3 = 12.36) (A) 4.66 (B) 7.20 (C) 9.78 (D) 12.36 6. 2 分(0414) 0414 六次甲基四胺[(CH2)6N4]缓冲溶液的缓冲pH范围是----------( ) ?p K b[(CH2)6N4] = 8.85?
分析化学习题答案及详解
第二章 误差及分析数据的统计处理 思考题答案 1 正确理解准确度和精密度,误差和偏差的概念。 答:准确度表示测定结果和真实值的接近程度,用误差表示。精密度表示测定值之间相互接近的程度,用偏差表示。误差表示测定结果与真实值之间的差值。偏差表示测定结果与平均值之间的差值,用来衡量分析结果的精密度,精密度是保证准确度的先决条件,在消除系统误差的前提下,精密度高准确度就高,精密度差,则测定结果不可靠。即准确度高,精密度一定好,精密度高,准确度不一定好。 2 下列情况分别引起什么误差?如果是系统误差,应如何消除? (1)砝码被腐蚀; 答:系统误差。校正或更换准确砝码。 (2)天平两臂不等长; 答:系统误差。校正天平。 (3)容量瓶和吸管不配套; 答:系统误差。进行校正或换用配套仪器。 (4)重量分析中杂质被共沉淀; 答:系统误差。分离杂质;进行对照实验。 (5)天平称量时最后一位读数估计不准;答:随机误差。增加平行测定次数求平均值。 (6)以含量为99%的邻苯二甲酸氢钾作基准物标定碱溶液; 答:系统误差。做空白实验或提纯或换用分析试剂。 3 用标准偏差和算术平均偏差表示结果,哪一个更合理? 答:标准偏差。因为标准偏差将单次测定的偏差平方后,能将较大的偏差显著地表现出来。 4 如何减少偶然误差?如何减少系统误差? 答:增加平行测定次数,进行数据处理可以减少偶然误差。通过对照实验、空白实验、校正仪器、提纯试剂等方法可消除系统误差。 5 某铁矿石中含铁%,若甲分析结果为%,%,%,乙分析得%,%,%。试比较甲、乙两人分析结果的准确度和精密度。 答:通过误差和标准偏差计算可得出甲的准确度高,精密度好的结论。 x 1 = ++÷3 =(%) x 2 = ++ ÷3 = (%) E 1=- =(%) E 2=- = (%) %030.01 /)(1)(222 1=-∑-∑= --∑= n n x x n x x s i %045.01 /)(222=-∑-= ∑n n x x s i 6 甲、乙两人同时分析同一矿物中的含硫量。每次取样3.5 g ,分析结果分别报告为 甲:%,% 乙:%,% 哪一份报告是合理的?为什么? 答:甲的分析报告是合理的。因为题上给的有效数字是两位,回答也应该是两位。
分析化学期中考试试题
一、单项选择题。(每题2分,共40分) 1、误差是衡量 ················································································· ( ) A.精密度 B.置信度 C.准确度 D.精确度 2、分析测定中论述偶然误差正确的是 ·················································· ( ) A.大小误差出现的几率相等 B.正误差出现几率大于负误差 C.负误差出现几率大于正误差 D.正负误差出现的几率相等 3、计算x=11.25+1.3153+1.225+25.0678,答案x 应为 ······························· ( ) A.38.66 B.38.6581 C.38.86 D.38.67 4、有两组分析数据,要比较它们的精密度有无显著差异,则应用 ··············· ( ) A. t 检验 B. F 检验 C. Q 检验 D. u 检验 5、在置信度为95%时,测得Al 2O 3的平均值的置信区间为35.21±0.10,其意是( ) A.在所测定的数据中有95%的数据在此区间内 B.若再进行测定系列数据,将有95%落入此区间 C.总体平均值μ落入此区间的概率为95% D.在此区间内包括总体平均值μ的把握有95% 6、二乙三胺五乙酸(H 5L )的pKa 1~pKa 5分别为1.94,2.87,4.37,8.69,10.56。其溶液中 的Na 2H 3L 组分浓渡最大的pH 值是 ················································· ( ) A.3.62 B.5.00 C.9.62 D. 2.87 7、浓度为cmol/L 的H 2SO 4和HCOOH 混合液的质子条件是 ······················ ( ) A.[H +]=[OH -]+[HSO -4]+[SO - 24]+[HCOO -] B.[H +]=[OH -] +[SO - 24]+[HCOO -] C.[H +]=[OH -]+[HSO -4]+2[SO - 24]+[HCOO -] D.[H +]=[OH -]+[HSO -4]+2[SO - 24] 8、用NaOH 滴定H 3PO 4(pKa 1~ pKa 3分别为2.12,7.20,12.36)至第二计量点,pH 值为 ······························································································· ( ) A.10.70 B.9.78 C.8.74 D.7.78 9、在pH=10.0的氨性溶液中,已计算出αZn(NH3)=104.7,4.2)(10 =oH Zn α,5.0)(10=H y α,则 在此条件下,lgK ‘MY 为(已知lgK MY =16.5) ······································ ( ) A.8.9 B.11.8 C.14.3 D.11.3 10、铬黑T (EBT )与Ca 2+的络合物的稳定常数K ca -EBT =105.4,已知EBT 的逐级质子化常数 K H 1=1011.6,K H 2=106。 3。在pH=10.0时,EBT 作为滴定Ca 2+的指示剂,在颜色转变点的pCa t 值为 ··············································································· ( )
分析化学第六版分析化学模拟试题及答案
分析化学第六版分析化学模拟试题及答案 Newly compiled on November 23, 2020
分析化学模拟试题(一) 班级姓名分数 一、选择题 ( 共19题 38分 ) 1、下列情况中哪个不属于系统误差: ( ) A、定管未经过校正 B、所用试剂中含干扰离子 C、天平两臂不等长 D、砝码读错 2、下列溶液用酸碱滴定法能准确滴定的是 ( ) A、 mol/L HF (p K a = B、 mol/L HCN (p K a = C、 mol/L NaAc [p K a(HAc) = ] D、 mol/L NH4Cl [p K b(NH3) = ] 3、摩尔法测定Cl-含量时,要求介质在pH=~范围内,若酸度过高则会: ( ) A、AgCl沉淀不完全 B、形成Ag2O的沉淀 C、AgCl吸附Cl- D、Ag2CrO4沉淀不易生成 4、下列物质中,不能直接配制标准溶液的是:( ) A、K2Cr2O7 B、KMnO4 C、As2O3 D、H2C2O4·2H2O 5、下列各数中有效数字位数为四位的是:( ) A、w CaO=% B、[H+]= mol/L C、pH= D、420Kg 6、用mol·L-1HCl滴定mol·L-1NH3·H2O(PK b=的pH突跃范围为~,用mol·L-1HCl滴定mol·L-1的某碱 (PK b=的pH突跃范围则是: ( ) A、~ B、~ C、~ D、~ 7、某三元酸pKa1=2,pKa2=6,pKa3=12。利用NaOH标准溶液滴定至第二个化学计量点时,指示剂选用 ( ) A、甲基橙 B、甲基红 C、酚酞 D.溴甲酚绿(变色范围~) 8、以甲基橙为指示剂,用HCl标准溶液标定含CO32- 的NaOH溶液,然后用此NaOH溶液测定试样中的HAc含量,则HAc含量将会() A、偏高 B、偏低 C、无影响 D、无法判断
分析化学期中测试题
分析化学期中试卷 一、选择题 1.从精密度好就可以判断分析结果可靠的前提是() A.随机误差小 B.系统误差小 C.平均偏差小 D.相对误差小 2. 按质子理论,Na2HPO4是() A.中性物质 B.酸性物质 C.碱性物质 D.中性物质 3. 一般情况下,EDTA与金属离子形成的络合物的络合比是() A. 1:1 B. 2:1 C. 1:3 D. 1:2 4. EDTA滴定金属离子,准确滴定(Et<0.1%)的条件是() A. lgK MY≥6 B.lgK’MY>6 C. lg c M,sp K MY>6 D. lg c M,sp K’MY≥6 5.测的某种有机酸pKa值为12.35,其Ka值为() A.4.467×10-13 B.4.47×10-13 C. 4.5×10-13 D.4×10-13 6. 甲乙两人同时分析一矿物中含硫量,每次采样5.6g,分析结果的平均值分别报告为甲: 0.037% 乙:0.03702%,问正确的报告是() A. 甲乙报告均正确 B. 甲报告正确 C. 乙报告正确 D. 甲乙报告均不正确 7. 相同浓度的CO32-、P2-、C2O42-的三种碱性物质水溶液,其碱性强弱(由大到小)的顺序是()已知H2CO3:pKa1=6.38 , pKa2=10.25 ; H2P: pKa1=2.95 , pKa2=5.41 ; H2C2O4 :pKa1=1.22 , pKa2=4.19 A. CO 32->P2->C 2 O 4 2- B. P2->C 2 O 4 2->CO 3 2- C. P2->CO 32-> C 2 O 4 2- D. C 2 O 4 2->P2->CO 3 2- 8. 已知0.10mol/L一元弱酸HB溶液的pH=4.0,则0.10mol/L共轭碱NaB溶液的pH为() A. 11.0 B. 10.0 C. 9.5 D. 10.5 9. 酸碱滴定中选择指示剂的原理是() A.指示剂应在pH=7.0时变色 B.指示剂的变色范围一定要包括计量点在内 C.指示剂的变色范围全部都落在滴定的pH突跃范围之内 D.指示剂的变色范围全部或大部分落在滴定的pH突跃范围之内 10. 下列何种方法可减小分析测试中的系统误差()
分析化学期末复习模拟试卷(二)及答案
《分析化学》 期末复习模拟试卷(一) 一、单项选择题(请将答案填入下表,每题1分,共20分) 1. 在滴定分析中,对滴定反应的要求是: A .反应必须定量完成 B .反应必须有颜色变化 C .滴定剂必须与被测物1:1反应 D .滴定剂必须是基准物 2. 以下有关系统误差描述正确的是: A .系统误差具有随机性 B .系统误差在分析过程中不可避免 C .系统误差具有单向性 D .系统误差是由一些不确定的偶然因素造成的 3. 实验室两位新分析人员对同一样品进行分析,得到两组分析结果。考察两组分析结果的精密度是否存在显著性差异,应采用的检验方法是: A .t 检验 B .F 检验 C .Q 检验 D .格鲁布斯法 4. 用HCl 溶液滴定NaOH 和Na 2CO 3的混合溶液,以酚酞为指示剂,消耗HCl 溶液V 1 mL ,再以甲基橙为指示剂继续滴定,消耗HCl 溶液V 2 mL ,则V 1和V 2的关系是: A .V 1=2V 2 B .V 1=V 2 C .2V 1=V 2 D .V 1>V 2 5. 以下溶液稀释10倍,pH 值改变最小的是: A .0.1mol·L -1 NH 4Ac 溶液 B .0.1mol·L -1 NaAc C .0.1mol·L -1 HAc D .0.1mol·L -1 HCl 6. 甲基橙(pK a =3.4)的变色范围为3.1-4.0,若用0.1mol·L -1 NaOH 滴定0.1mol·L -1 HCl ,则刚看到混合色时,[In]/[HIn]的比值为: A .10.0 B .2.0 C .1.0 D .0.5 7. KMnO 4溶液的浓度为0.02000mol·L -1,则4/KMnO Fe T 的值(单位:g·mL -1,M Fe =55.85g·mol -1)为:
武汉大学分析化学实验习题解答(第二版)
武汉大学分析实验习题解答(第二版) 实验3---1 分析天平称量练习 1.称量结果应记录至几位有效数字?为什么?j 小数点后4位.因称量误差≦0.1% 2.称量时,应每次将砝码和物体放在天平盘的中央,为什么? 因为是等臂天平.放在天平盘的中央,才能保证等臂,使称量准确. 3.本实验中要求称量偏差不大于0.4m g,为什么? 因为称量一次,允许产生±0.2 mg的偏差, 用递减称量法称量一份试样时,需要连续两次称取容器+试样的质量,故允许产生±0.4 mg的偏差 实验3---2 滴定分析基本操作练习 1.配制NaOH溶液时,应选用何种天平称取试剂?为什么? 感量为0.1g的台秤.因为是粗配溶液 2.HCI和NaOH溶液能直接配制准确浓度吗?为什么? 不能.因浓HCI易挥发,浓度不确定. NaOH易吸收空气中的CO2和水分. 3.在滴定分析实验中,滴定管和移液管为何需用滴定剂和待移取的溶液润洗几次?锥形瓶是否也要用滴定剂润洗? (1)防止待移取的溶液浓度被稀释(2)不能.相当于多加了滴定剂,在滴定之前, 这部分滴定剂已和待测物质发生了反应,影响分析结果的准确度. 4.HCI和NaOH溶液定量反应完全后,生成NaCI和水,为什么用HCI滴定NaOH时,采用甲基橙指示剂,而用NaOH滴定HCI时,使用酚酞或其它合适的指示剂? 因为用HCI→NaOH 指示剂:甲基橙黄→橙 突跃范围PH=4..3-9.7 PH=4.4 4.0 摇动锥形瓶中的NaOH时, CO2影响大(PH≥5时),用甲基橙可有效消除CO2的影响.用酚酞指示剂,会多消耗NaOH,产生较大误差. 用NaOH →HCI, CO2影响小(滴定管液面与空气接触少), 指示剂:酚酞由无色→红色,易观察;而甲基橙,由红色→黄色,难观察. 实验4---1.食用白醋中醋酸含量的测定 1.与其他基准物质比较,邻苯二甲酸氢钾有什么优点? 邻苯二甲酸氢钾易制得纯品,在空气中不吸水,易保存,摩尔质量大,与NaOH 反应的计量比为1:1 2.称取NaOH及邻苯二甲酸氢钾各用什么天平?为什么? 称取NaOH用台秤.因为是粗配NaOH,且称样量较大. 称取邻苯二甲酸氢钾用分析天平.因为需要准确称量, 且称样量小. 3.已标定的NaOH溶液在保存中吸收了二氧化碳,用它来测定HCI的浓度,若以酚酞为指示剂对测定结果有何影响?改用甲基橙,又如何? 测定C HCI,用酚酞指示剂,偏高(多消耗NaOH)
【免费下载】分析化学2期中试卷 答案
云南大学2011至2012学年上学期化学科学与工程学院 《分析化学(2)》期中考试(闭卷)试卷A 满分:100分 考试时间:120分钟 任课教师:_________专业 学号 姓名 题号 一二三四五总分 得分一、选择题(每小题1分,共25分。请把答案填写在下表中)题号 12345678910111213答案 B B D A C B A A D C B D C 题号 141516171819202122232425答案B B C C A A D B D D C B 1.光谱分析法通常可以获得其它分析方法不能获得的__________。A .组成信息 B .原子或分子的结构信息C. 化合物的存在形态信息 D .化合物的极性大小信息2.原子发射光谱的产生是由于________。A .原子次外层电子在不同能级间的跃迁 B .原子外层电子在不同能级间的跃迁 C .原子内层电子在不同能级间的跃迁 D .原子外层电子的振动和转动3.原子发射光谱中,激发光源的作用是______。 A. 使样品干燥和蒸发 B .使样品原子化 C .使气态的基态原子激发 D .包括A 、B 、C 三种作用4. 在原子发射光谱的光源中,激发温度最高的光源是_______。 A. 高压火花 B .直流电弧 C. 交流电弧 D .ICP 5.ICP 光源高温的产生是由于________。 A. 气体燃烧 B .电极放电 C .气体放电 D .电火花6.采用摄谱法进行原子发射光谱的定性分析时通常使用的标准光谱是_________。 A. 铜谱 B .铁谱 C. 碳谱 D .氢谱 7.原子吸收光谱法中,原子化器的作用是 。 A :使样品中待测元素转化为气态的基态原子;B :使样品中待测元素转化为激发态原子; C :使样品中待测元素转化为中性分子; D :使样品中待测元素转化为离子。 8.关于多普勒变宽的影响因素,以下说法正确的是_________。 A. 随温度升高而增加 B .随温度升高而下降 ,合理利用管线敷设技术。线缆敷设原则:在分线盒处,当不同电压回路交叉时,应采用金属隔板进行隔开处理;同一线槽内,强电回路须同时切断习题电源,线缆敷设完毕,要进行检查和检测处理。工作并且进行过关运行高中资料试卷技术指导。对于调试过程中高中资料试卷技术问题,作为调试人员,需要在事前掌握图纸资料、设备制造厂家出具高中资料试卷试验报告与相关技术资料,并且了解现场设备高中资料试卷布置情况与有关高中资料试卷电气系统接线等情况,然后根据规范与规程装置调试技术,要求电力保护装置做到准确灵活。对于差动保护装置高中资料试卷调试技术是指发电机一变压器组在发生内部故障时,需要进行外部电源高中资料试卷切除从而采用高中资料试卷主要保护装置。
兰叶青 无机及分析化学课后习题答案(所有章节)
第二章 习题解答 2-10解:(1)×;(2)×;(3)√;(4)×;(5)×;(6)×; (7)×;(8)×;(9);(10)×;(11)× 2-11解:(1)敞开体系;(2)孤立体系;(3)敞开体系; 2-12解:(1) Q =100kJ W=-500 kJ △U = Q + W=-400 kJ (2)Q =-100kJ W=500 kJ △U = Q + W=400 k 2-13解:因为此过程为可逆相变过程,所以 Q p =△H= 40.6kJ ·mol -1 W=-p 外△V ≈-n R T =-8.314×373.15=-3.10 kJ ·mol -1 △U = Q + W= 40.6+(-3.10)=37.5 kJ ·mol -1 2-14解:(1) r m B f m B f m 2f m f m f m 231 B) 3CO g Fe,s 3CO,g Fe O ,s 3393.51203(110.52)(822.2)26.77kJ mol H H H H H H -?=ν?=??-?+?=?-?-?---=-?∑((,)+2()()() ()+ΘΘ ΘΘ ΘΘ (2) r m B f m B f m 2f m 2f m f m 21 B) CO g H ,g CO,g H O,g 393.510(110.52)(241.82)41.17kJ mol H H H H H H -?=ν?=??-?+?=-----=-?∑((,)+()()() ()+ΘΘ ΘΘ ΘΘ (3) r m B f m B f m 2f m f m 2f m 31 B) 6H O l NO,g 5O ,g 4NH ,g 6285.834(90.25)504(46.11)1169.54kJ mol H H H H H H -?=ν?=??-?+?=?-?-?-?-=-?∑((,)+4()()() ()+ΘΘ ΘΘ ΘΘ 2-15解:乙醇的Θm f H ?反应r m H ?Θ 为: (4) 2C (s ,石墨)+3H 2(g )+1/2O 2(g )= C 2H 5OH (l ),所以: 反应(4)=反应(2)×2+反应(3)×3-反应(1) r m r m r m r m -1 (4)2(2)3(3)(1) 2(393.5)3(571.6)(1366.7)1135.1kJ mol H H H H ?=?+?-?=?-+?---=-?ΘΘΘΘ 对反应2C (s ,石墨)+ 2H 2(g )+ H 2O (l )= C 2H 5OH (l )
《分析化学》期末考试试卷及答案(C)
《分析化学》考试试卷 1.以下说法错误的是:( ) (A) 摩尔吸光系数κ随浓度增大而增大(B) 吸光度A随浓度增大而增大 (C) 透射比T随浓度增大而减小(D) 透射比T随比色皿加厚而减小 2.某NaOH和Na2CO3混合液,用HCl溶液滴定,以酚酞为指示剂,耗去HCl V1(mL), 继以甲基橙为指示剂继续滴定,又耗去HCl V2(mL),则V1与V2的关系是:( ) (A) V1 = V2(B) V1 = 2V2(C) 2V2 = V2(D) V1> V2 3.当两电对的电子转移数均为1时,为使反应完全度达到99.9%,两电对的条件电位至少相差:( ) (A) 0.09V(B) 0.18V(C) 0.27V(D) 0.36V 4.已知二甲酚橙(XO)金属指示剂在pH<6.0时为黄色,pH>6.3时为红色,Zn2+-XO配合物为红色,滴定Zn2+的最高酸度为pH=4.0,最低酸度为pH=7.0,问用EDTA滴定Zn2+时,应控制的酸度围是()。 (A)pH=4.0~6.0 (B)pH<7.0 (C)pH=4.0~7.0 (D)pH>4.0 5.符合比尔定律的有色溶液,浓度为c时,透射比为T0,浓度增大一倍时,透射比的对数为:( ) (A) T0/ 2(B) 2T0(C) (lg T0)/2(D) 2lg T0 6.配制含锰0.1000mg/mL的KMnO4溶液100.0mL,需取0.01800mol/L KMnO4溶液(在酸性溶液中作氧化剂)的体积为:[M KMnO4=158.03,M Mn=54.94] ( ) (A) 14.15mL(B) 8.09mL(C) 10.11mL(D) 6.07mL 7.用重量法测定磷肥中P2O5的含量时,称量形式是(NH4)3PO4?12H2O,化学因数F的正确表达式是:( ) (A)P2O5 / 2(NH4)3PO4?12H2O (B) P2O5 / (NH4)3PO4?12H2O (C)2(NH4)3PO4?12H2O / P2O5(D)2P2O5 / (NH4)3PO4?12H2O
分析化学期中考试试题
一、单项选择题。(每题2分,共40分) 1误差是衡量 .............................................................. ( ) A. 精密度 B.置信度 C.准确度 D.精确度 2、........................................... 分析测定中论述偶然误差正确的是( ) A. 大小误差出现的几率相等 B.正误差出现几率大于负误差 C.负误差出现几率大于正误差 D.正负误差出现的几率相等 3、计算x=11.25+1.3153+1.225+25.0678,答案x 应为....................... ( ) A.38.66 B.38.6581 C.38.86 D.38.67 4、有两组分析数据,要比较它们的精密度有无显著差异,则应用 ......... ( ) A. t检验 B. F检验 C. Q检验 D. u检验 5、在置信度为95%时,测得Al 2O3的平均值的置信区间为35.21 ± 0.10,其意是( ) A. 在所测定的数据中有95%的数据在此区间内 B. 若再进行测定系列数据,将有95%落入此区间 C. 总体平均值卩落入此区间的概率为95% D. 在此区间内包括总体平均值□的把握有95% 6、二乙三胺五乙酸(H5L)的pKa1~pKa5分别为1.94, 2.87, 4.37, 8.69, 10.56。其溶液中 的Na2H3L组分浓渡最大的pH值是....................................... ( ) A.3.62 B.5.00 C.9.62 D. 2.87 7、浓度为cmol/L的H2SO4和HCOOH混合液的质子条件是 .................... ( ) - 2 - A. [H +]=[OH ]+[HSO 4 ]+[SO 4 ]+[HCOO ] B. [H +]=[OH ] +[SO 4 ]+[HCOO ] —2 - C. [H+]=[OH ]+[HSO 4 ]+2[SO 4 ]+[HCOO ] + - 2 D. [H ]=[OH ]+[HSO 4 ]+2[SO 4 ] 8、用NaOH 滴定H3PO4 (pKa1~ pKa3 分别为2.12, 7.20, 12.36)至第二计量点,pH 值为 ..................................................................... ( ) A.10.70 B.9.78 C.8.74 D.7.78 9、在pH=10.0 的氨性溶液中,已计算出Zn(NH3) =104.7, zn(oH) 卩2" , y(H) 卩0", 则在此条件下,lgK MY为(已知IgK MY =16.5) ............................... ( ) A.8.9 B.11.8 C.14.3 D.11.3 10、铬黑T (EBT )与Ca2+的络合物的稳定常数K ca-EBT=105.4,已知EBT的逐级质子化常数
分析化学模拟试题(二)
分析化学模拟试题(二) 班级姓名分数 一、选择题( 共17题34分) 1、以加热驱除水分法测定CaSO4·H2O中结晶水的含量时,称取试样0.2000g。已知天平称量误差为0.1 mg,分析结果的有效数字应取:( ) A、一位 B、两位 C、三位 D、四位 2、pKa=5.0的一元弱酸HA,用NaOH溶液滴定至一半时,溶液pH约为( ) A、1.3 B.2.5 C.5.0 D.7.5 3、用纯水把下列溶液稀释10倍时,其中pH值变化最大的是( ) A、0.1mol·L-1 HCl B、1mol·L-1 HAc +1mol·L-1 NaAc C.0.1mol·L-1 HAc D.0.1mol·L-1 HAc +0.1mol·L-1 NaAc 4、用HCl标准溶液测Na2CO3含量时,滴定产物为CO2,若c(HCl)=0.1000mol·1-1,则HCl对Na2CO3的滴定度T为( ) A、0.005300 g·ml-1 B、0.01060 g·ml-1 C、0.008400 g·ml-1 D、0.04200 g·ml-1 5、以0.10 mol·L-1NaOH滴定含0.10 mol·L-1 HCl和2.0×10-4 mol·L-1盐酸羟胺(pK a= 6.00)混合溶液,滴定HCl至化学计量点时溶液的pH是() A、5.00 B、6.00 C、5.50 D、5.20 5、在Fe3+、Al3+、Ca2+、Mg2+的混合溶液中,用EDTA测定Fe3+和Al3+。要消除Fe3+、Al3+的干扰最简便的是( ) A、沉淀分离法 B、控制酸度法 C、配位掩蔽法 D、离子交换法 6、欲用EDTA测定试液中的阴离子,宜采用( ) A、直接滴定法 B、间接滴定法 C、置换滴定法 D、返滴定法 7、已知Al3+离子浓度为2×10-2mol/L,若用2×10-2mol/LEDTA溶液滴定时,其最高允许酸度的计算公式可以用下列()式计算。已知lgK AlYI=18.04 A、lgαy(H)≤10.04 B、lgαy(H)≤8 C、lgαy(H)≥8 D、lgαy(H)≥10.04 8、在用K2Cr2O7标定Na2S2O3时,KI与K2Cr2O7反应较慢,为了使反应能进行完全,下列措施不正确的是( ) A、增加KI的量 B、溶液在暗处放置5min C、使反应在较浓溶液中进行 D、加热 9、以0.01000mol/L K2Cr2O7溶液滴定25.00ml Fe2+溶液,耗去K2Cr2O7溶液25.00ml。每毫升Fe2+溶液含铁(Fe的摩尔质量为55.85g/mol)多少毫克? ( )
