玻璃物理化学性能计算

玻璃物理化学性能计算
一、玻璃的粘度计算
...1.粘度和温度的关系
...2.玻璃组成对温度的作用
...3.粘度参考算点及在生产中的应用
...4.粘度的计
二、玻璃的机械性能和表面性质
...1.玻璃表面张力的物理与工艺意义
...2.玻璃表面张力与组成及温度的关系
...3.玻璃的表面性质
...4.玻璃的密度计算
三、玻璃的热学性质和化学稳定性
...(一)玻璃的热学性能
...(二)玻璃的化学稳定性
...(三)玻璃的光学性质
一、玻璃粘度和温度的关系
粘度是玻璃的重要性质之一。它贯穿着玻璃生产整个阶段,从熔制、澄清、均化、成型、加工、直到退火都与粘度密切相关。在成型和退火方面年度起着控制性的作用。在高速成型机的生产中,粘度必须控制在一定的范围内,而成型机的速度决定与粘度随温度的递增速度。此外玻璃的析晶和一些机械性能也与粘度有关。
所有实用硅酸盐玻璃,其粘度随温度的变化规律都属于同一类型,只是粘度随温度变化的速度以及对应某给定温度的有所不同。在10怕.秒(或者更低)至约1011怕.秒的粘度范围内,玻璃的粘度由玻璃化学成分所决定的,而在从约1011怕.秒(1015泊,或者更高)的范围内,粘度又是时间的函数。
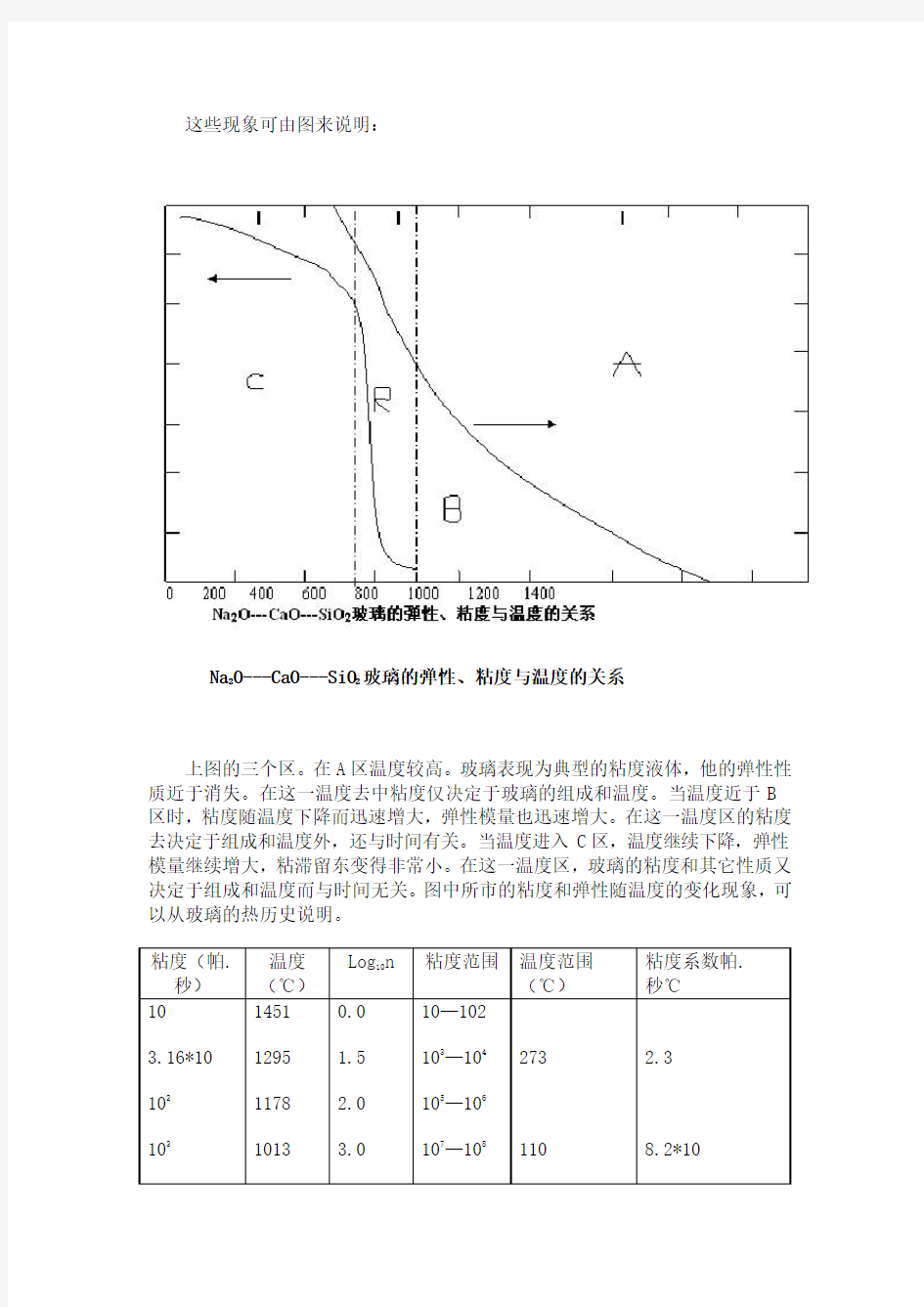
这些现象可由图来说明:
Na
2O---CaO---SiO
2
玻璃的弹性、粘度与温度的关系
上图的三个区。在A区温度较高。玻璃表现为典型的粘度液体,他的弹性性质近于消失。在这一温度去中粘度仅决定于玻璃的组成和温度。当温度近于B 区时,粘度随温度下降而迅速增大,弹性模量也迅速增大。在这一温度区的粘度去决定于组成和温度外,还与时间有关。当温度进入C区,温度继续下降,弹性模量继续增大,粘滞留东变得非常小。在这一温度区,玻璃的粘度和其它性质又决定于组成和温度而与时间无关。图中所市的粘度和弹性随温度的变化现象,可以从玻璃的热历史说明。
钠钙硅玻璃的粘度—温度数据
二、玻璃的组成对粘度的作用
玻璃成分与玻璃粘度之间存在卓复杂的关系,一般可以从硅氧比、离子的极化、键强、结构对称性以及配位数等方面来说明。现分述于如:
2.1氧硅比
当氧硅比增大(例如熔体中碱含量增大),使大型四面体群分成为小型四面体群,自由体空间随之增大,导致熔体粘度下降,
一些钠钙硅酸盐在1400℃的粘度
在玻璃中一氟化物代替氧化物时(如以CaF
2
取代CaO),由于阴离子与硅之比值增大,也有降低粘度的作用。
2.2化学键的强度
在其它条件相同的前提下,粘度随阳离子与氧的键力增大而增大。
在两元(R
2O-SiO
2
)玻璃中,当O/Si比值很高时(即R
2
O含量较高),硅氧
四面体间连接较少,已接近遇岛状结构,四面体很大程度上依靠键力R-O相联接,
因此键力量的Li+具有最高的粘度,粘度按Li
2O-Na
2
O-K
2
O顺序递减。但当O/Si
比值很低时,它们的粘度大小顺序由于此相反。
在加入配位数相同的阳离子情况下,各氧化物取代SiO
2
后年度的变化取决
于R-O键力的大小。因此n
Al2O3>n
Ga2O3
何n
SiO2
>n
GeO2
.
2.3离子的极化
离子间的相互作用极化对粘度有明显的影响。阳离子的极化力大,对于硅氧键的氧离子极化、变形大,减弱对氧键的作用大,表现在粘度下降。一般来说非惰性气体性阳离子的极化力大于惰性气体型氧离子,故前者减弱硅氧键的作用较大,具有较低的粘度。
以过渡金属氧化物取代也有粘度的作用如图所示。
0 0.23 0.50 0.75
1.00 1.25
在碱硅二元玻璃中,当O/Si比很低时,对粘度其主要作用的是硅氧四面体[SiO
4
]间的键力。极化力最大的Li+是减弱Si-O-Si键的作用最大,故粘度按
Li
2O-Na
2
O-K
2
O顺序递增。
2.4结构的对称性
在一定的条件下,结构的对称性对粘度有着重要的作用。如果结构不对称就可能在结构中存在缺陷和弱点,因此使粘度下降。
例如,硅氧键和硼氧键的键强属于同一数量级的,然而石英玻璃的粘度却比硼氧玻璃大的多,这正是由于二者结构的对称程度不同所致。又如磷氧键和硅氧键键强也属于同一数量级的,但是磷氧玻璃的粘度比石英玻璃的小的多。主要磷氧玻璃四面体中又一带双键氧、结构不对称的缘故。
∪
|
[—P==O ]
|
∩
2.5配位数
配位状态对玻璃的粘度也有重要的影响,氧化硼在这方面特别明显。在电荷相同的条件下,随氧离子配位数N的升高,增加了对硅氧集团的积聚紧密,粘度上升。
综上所述,各常见氧化物对玻璃粘度的作用,大致归纳如下:
一、SiO
2、Al
2
O
3
、ZrO2等提高粘度。
二、碱金属氧化物降低粘度。
三、碱土金属氧化物对粘度的作用较为复杂。对增加粘度顺序一般为:
Mg2+>Ca2+>Sr2+>Ba2+
其中CaO在低温时增加粘度,在高温时当含量10—12%时降低粘度,当含量10—12%时增大粘度。
四、PbO、CdO、Bi
2O
3
、SnO等降低粘度。
此外、Li
2O、ZnO、B
2
O
3
等都有增加低温年度,降低高温年度的作用。
2、玻璃粘度与成分的关系
各种常见氧化物对玻璃粘度的作用大致归纳如下:
(1)SiO
2、Al
2
O
3、
ZrO
2
等提高玻璃粘度。
(2)碱金属氧化物R
2
O降低玻璃粘度。
(3)碱土金属氧化物对玻璃粘度的作用较为复杂。一方面类似于碱金属氧化物,能使大
型的四面体群解聚,引起粘度减小;另一方面这些阳离子电价较高,离子半径又不大,故键力较碱金属离子大,有可能夺取小型四面体群的氧离子于自己的周围,使粘度增大。前一效果在高温时是主要的,而后一效果主要表现在低温。碱土金属引起粘度增加能力的排序为:
Mg2+>Ca2+>Sr2+>Ba2+其中 CaO在低温时增加粘度;在高温时,当含量小于10%—12%.时降低粘度,当含量大
于10%—12%时增加粘度。
(4)PbO、CdO、BiO、SnO
2
等降低玻璃粘度。
此外,Li
2O、ZnO、B
2
O
3
等都有增加低温粘度,降低高温粘度的作用。
3、玻璃粘度参考点
在玻璃生产上常用的粘度参考点如下:
(1)应变点:应力能在几小时内消除的温度,大致相当于粘度为 1013.6Pa.s,时的温度。
(2)转变点:相当一粘度为, 1012.4Pa.s时的温度,通常用T表示。
(3)退火点:应力能在几分钟内消除的温度,大致相当于粘度为,1012Pa.s 时的温度。
(4)变形点:相当于粘度为 ,1010—1011Pa.s时的温度范围。
(5)软化温度:它与玻璃的密度和表面张力有关,相当于粘度
为 ,106.6Pa.s时的温度,通常用 T
f
表示。
(6)操作范围:相当于成型玻璃表面的温度范围。T
上限
指准备成型操作
的温度,相当于粘度为 ,102—103Pa.s时的温度;T
下限
限相当于成型时能保持制品形状的温度,相当于粘>105Pa.s时的温度。操作范围的粘度一般为103—106Pa.s (7)熔化温度:相当于粘度为 ,10Pa.s时的温度,在此温度下玻璃能以一般要求的速度熔化。常用Tm表示。
(8)自动供料机供料的粘度:102—103Pa.s
(9)人工挑料粘度: 102.2 Pa.s。
4、玻璃粘度的计算
玻璃粘度的计算方法很多,但比较常用的方法有两种。
(1)奥霍琴法
本方法适用于含有CaO、MgO的钢钙硅系统玻璃。当Na
2
O在12%—16%,
CaO+MgO在5%—12%,Al
2O
3
在0—5%,SiO
2
在64%—80%范围时,可用下式计算。
T=Ax+By+Cz+D
式中 T——某粘度值对应的温度;
X、y、z——分别是Na
2O、CaO+MgO、Al
2
O
3
的
质量分数(%);
A、B、C、D——分别是Na
2O、CaO+MgO、Al
2
O
3
的特性常数,随粘度值而变化。
如果玻璃成分中MgO含量不等于5%,则T值必须校正。
例如,某玻璃成分为SiO
2 74%,Na
2
O 14%, CaO 7%,MgO 4%,Al
2
O
3
1%,
求粘度为103Pa.s时的温度。
查表得知n=103Pa.s时的温度为:
Tn=103=-1739*14-9.95*(7+4)+5.9*1+1381.4 =1033℃
进行校正:MgO实际含量为 4%,4%—3% =1%,查表得知,粘度为103Pa.s时,以1% MgO置换CaO,温度将提高6℃,因此
Tn=103=1033℃
+6℃=1039℃
(2)富尔切尔法
玻璃的温度与粘度的关系也可用富尔切尔方程求算,即
-A + B
Ign= —————
T - To 式中,A、B、To 可从下式中求出:
A=-1.4788 Na
2O+0.8350K
2
O+1.6030 CaO+5.4936 MgO-1.5183
Al
2O
3
+1.4550.
B=6039.7 Na
2
O-1439.6 K
2
O-3919.3 CaO+6285.3 MgO+2253.4
Al
2O
3
+5736.4
To=-25.07 Na
2
O-312.0 K
2
O+544.3 CaO+384.0 MgO+294.4 Al
2
O
3
+198.1
式中,Na
2
O、K
2
O……表示各组分相对含量,即SiO
2
的摩尔数为1时,
各组分的摩尔数与SiO
2之比(RmOn/ SiO
2
),各项数字的系数从实验结果计算得
出。实验温度范围为500—1400℃。该实验所算出的温度,其标准偏差为2.3—2.5℃。
该方法的适用范围:SiO
2=1mol; Na
2
O=0.15—0.2mol;
CaO=0.12—0.2mol; MgO=0——0.051mol;
Al
2O
3
=0.015——0.073mol;n=1012Pa.s。
二、玻璃的机械性能和表面性质
1.玻璃表面张力的物理与工艺意义
玻璃表面张力指玻璃与另一相接触的相分界面上(一般指空气),在恒温、恒容下增加一个单位表面时所做的功,单位为N/m和J/m2。硅酸盐玻璃的表面张力为(200—380)*10-3N/m。玻璃的表面张力在玻璃的澄清、均化、成型、玻璃液与耐火材料相互作用等过程中起着重要的作用。
2.玻璃表面张力与组成及温度的关系
各种氧化物对玻璃的表面张力有不同的影响,如Al
2O
3
、La
2
O
3
、CaO、
MgO、能提高表面张力。K
2O、PbO、B
2
O
3
、Sb
2
O
3
等如加入量较大,则能大大降低表
面张力。同时,Cr
2O
3
、V
2
O
3
、Mo
2
O
3
、WO
3
用量不多时也能降低表面张力。
组成氧化物对玻璃熔体与空气界面上表面张力的影响可分为三类。第"类组成氧化物对表面张力的影响关系,符合加和性法则,一般可用下式计算:
∑σ
1αm
σ= —————
∑σm
式中σ———玻璃的表面张力;
σ
1
———各种氧化物的表面张力因数(常数);
σm———氧化物的含量,以分子份数或分子百分数表示。
第Ⅱ类和第Ⅲ类组成氧化物对熔体的表面张力的关系是组成的复合函数,不符合加和性法则。由于这些组成的吸附作用,表面层的组成与蒋体内的组成是不同的。
氰化物如Na
2SiF
6
、Na
3
AlF
6
,硫酸盐如芒硝,氯化物如NaCl等都能显著
地降低玻璃的表面张力,因此,这些化合物的加入,均有利于玻璃的澄清和均化。
表面张力随着温度的升高而降低,二者几乎成直线关系,实际上可认为,当温度提高100℃时表面张力减少1%,然而在表面活性组分及一些游离的氧化物存在的情况下,表面张力能随温度升高而稍微增加。
3.玻璃的力学性能
3.1玻璃的理论强度和实际强度
一般用抗压强度、抗折强度、抗张强度和抗冲击强度等指标表示玻璃的机械强度。玻璃以其抗压强度高、硬度高而得到广泛应用,也因其抗张强度与抗折强度不高,脆性大而使其应用受到一定的限制。
玻璃的理论强度按照Orowan假设计算为11.76GPa,表面无严重缺陷的玻璃纤维,其平均强度可达686MPa。玻璃的抗张强度一般在 34.3—83.3MPa之间,而抗压强度一般在4.9——1.96GPa之间。但实际玻璃的抗折强度只有
6.86MPa,比理论强度小2—3个数量级。这是由于实际玻璃中存在有微裂纹(尤其是表面微裂纹)和不均匀区(分相等)所致。
目前常采用的提高玻璃机械强度的方法主要有退火、钢化、表面处理与涂层、微晶化、与其它材料制成复合材料等。这些方法能使玻璃的强度增加几倍甚至十几倍。
3.1.1玻璃强度与化学组成的关系。
不同化学组成的玻璃结构间的键强也不同,从而影响玻璃的机械强度。石英玻璃的强度最高。各种氧化物对玻璃抗张强度的提高作用顺序是:
CSO>B
2O
3
>BaO>Al
2
O
3
>PbO>K
2
O>Na
2
O>(MgO、FC
2
O
3
)
各组成氧化物对玻璃抗压强度提高作用的顺序是:
Al
2O
3
>(MgO、SiO
2
、ZnO)> B
2
O
3
>Fe
2
O
3
>( B
2
O
3
、Cao、PbO)
3.1.2玻璃中的缺陷。
宏观缺陷如固态夹杂物、气态夹杂物、化学不均匀等,由于其化学组成与主体玻璃不一致而造成内应力。同时,一些微观缺陷(如点缺陷、局部析晶、晶界等)常常在宏观缺陷的地方集中,而导致玻璃产生微裂纹,严重影响玻璃的强度。
3.1.3温度。
在不同的温度下玻璃的强度不同,根据对-20℃—500℃范围内的测量结果可知,强度最低值位于200℃左右。
一般认为,随着温度的升高,热起伏现象增加,使缺陷处积聚了更多的应变能,增加了破裂的几率。当温度高于200℃时,由于玻璃粘滞性流动增加,使微裂纹的裂口钝化,缓和了应力作用,从而使玻璃强度增大。
3.1.4玻璃中的应力。
玻璃中的残余应力,特别是分布不均匀的残余应力,使强度大为降低。然而,玻璃进行钢化后,表面存在压应力,内部存在张应力,而且是有规则的均匀分布,所以玻璃强度得以提高。
3.2玻璃的硬度
硬度是表示物体抵抗其他物体侵人的能力。硬度的表示方法甚多,有莫氏硬度、显微硬度、研磨硬度和刻划硬度,玻璃的莫氏硬度为5—7。玻璃的硬度决定于组成原子的半径、电荷大小和堆积密度,网络生成体离子使玻璃具有硬度,而网络外体离子则使玻璃硬度降低。各种组成对玻璃硬度提高的作用大致为:
SiO
2〉SiO
2
(MgO、ZnO、 BaO)〉Al
2
O
3
> Fe
2
O
3
> K
2
O>Na
2
O> PbO
玻璃的硬度随着温度的升高而降低。
3.3玻璃的脆性
玻璃的脆性是指当负荷超过玻璃的极限强度时立即破裂的特性。玻璃的脆性通常用它被破坏时所受到的冲击强度来表示。冲击强度的测定值与试样厚度及样品的热历史有关,淬火玻璃的冲击强度较退火玻璃大5—7倍。
3.4玻璃的弹性
在近代技术中玻璃愈来愈广泛地被用作结构材料,因此对玻璃的弹性进行研究也日益增长。高空高速飞行需要具有一定刚度的高弹性模量材料,高功率激光通过玻璃介质时所产生的结构压缩和松弛会导致密度和折射率的变化等。弹性已成为玻璃的一项重要物理性质。
玻璃的弹性主要指玻璃的弹性模量 E、剪切模量 G、泊松比μ和体积压缩模量K。它们之间有如下关系:
E
E
—— = 2
(1+μ)——=3(1-2μ)
G
K
弹性模量是表征平板玻璃应力与应变关系的物理量,是表示玻璃对变形的抵抗力。在低温和常温下玻璃基本上是遵循虎克定律的理想弹性体。在 $% 温度以下,玻璃的弹性模量可用下式表示:
σ
E = ——
∈
式中σ———应力(KN/M);
∈———相对的形变(m)。
4.玻璃的密度与密度计算
4.1玻璃的密度
玻璃的密度表示玻璃单位体积的质量,主要决定于玻璃的化学组成、温度和热历史,也与玻璃的原子堆积紧密程度、配位数有关,是表征玻璃结构的一个标志。
玻璃的密度与化学组成关系密切。玻璃组成不同密度相差很大。各种玻璃制品中,石英玻璃的密度最小,为2000kg/m3,普通钠钙硅玻璃为
2500—2600kg/m3。而含有PbO、Bi
2O
3
、Ta
2
O
5
、WO
3
的玻璃密度可达6000kg/m3。甚
至某些防辐射玻璃的密度可高达8000kg/m3。
玻璃的密度随温度升高而下降。一般工业玻璃,当温度由20℃升高1300℃时,密度下降约为6%—12%,在弹性形变范围内,密度的下降与玻璃的热膨胀系数有关。
玻璃的热历史是指玻璃从高温冷却,通过T
f —T
n
区域时的经历,包括在
该区域停留时间和冷却速度等具体情况在内。热历史影响到固体玻璃结构以及与结构有关的许多性质。其对玻璃密度影响为:
4.1.1玻璃从高温状态冷却时,淬冷玻璃的密度比退火玻璃的小。
4.1.2在一定退火温度下保温一定时间后,玻璃密度趋向平衡。
4.1.3冷却速度越快,偏离平衡密度越多,其T
g
值也越高。所以,在生产上退火质量的好坏可在密度上明显地反映出来。
在玻璃生产中常出现事故,如配方计算错误、配合料称量差错、原料化学组成波动等,这些均可引起玻璃密度的变化。因此,玻璃工厂常将测定密度作为控制玻璃生产的手段。
4.2玻璃的密度计算
根据长期时间经验和数据的积累,玻璃的密度可以通过玻璃的化学组成和比容关系进行计算:
1
V= ——=∑V
m f m
D
式中:D——密度
V
m
——各种组分的计算系数,有下列表查处。
F
m ——为玻璃中氧化物的重量百分数,表中N
siO2
=Si的原子数/O原子
量,对于相同的氧化物N
si 不同则其系数不同。例如SiO
2
玻璃Nsi=0.5,总价料
其他氧化物则氧化物Nsi<0.5。Nsi的计算方法如下:
P
Si
P
Si
Nsi= ———— = ——————
M
Si ∑S
m
f
m
60.06∑S
m f m
式中: P
Si ——玻璃中SiO
2
的氧化物的百分含量
f
m
——玻璃中氧化物的重量百分含量
S
m
——系数见下表
M
Si
——SiO
2
分子量
玻璃的比容Vm计算系数值
三、玻璃的热学性能和化学稳定性
(一) 玻璃的热学性能
玻璃的热学性能包括热膨胀系数、导热性、比热、热稳定性等。其中热膨胀系数是玻璃的一个最重要的热学性质。它对玻璃的成型、退火、钢化、玻璃与玻璃、玻璃与金属、玻璃与陶瓷的封接,以及玻璃的热稳定性等性质都有重要的意义。
玻璃的热膨胀系数是由组成原子的非简谐振动产生的。根据化学组成不同,玻璃的热膨胀系数可在5.8—150*10-7/℃范围内变化。各种氧化物对玻璃热膨胀系数影响的次序为:
Rh
2O>Cs
2
O>K
2
O>Na
2
O>Li
2
O
BaO>SrO>CaO>CdO>ZnO>MgO>BeO
从玻璃网络本身考虑,网络愈完整,热膨胀系数愈小,反之亦然。若从玻璃的熔化温度考虑坝u熔化温度愈高,则热膨胀系数愈小。
玻璃的热膨胀系数也可以采用玻璃组成化合物的热膨胀系数加和法计算。
玻璃组成对热膨胀系数#的影响主要有以下几个方面:
(1)能形成网络或积聚作用的氧化物使#降低,能引起断网的氧化物使a上升;
(2)R
2
O和RO主要起断网作用,积聚作用是次要的,而高电荷离子主要起积聚作用。
(3)在玻璃中R
2
O总量不变情况下,引入两种不同的 R+离子锄生混合碱效应,同样能使!出现极小值。
(4)中间体氧化物在有足够“游离氧”条件下,形成四面体参加网络,使a 降低。
温度对玻璃热膨胀系数的影响表现为,在Tg温度以下是一个与温度无关的常数,在Tg温度范围,淬火玻璃的热膨胀系数变化不大,而退火玻璃的热膨胀系数却激烈增加,直到软化止。
热历史对玻璃的热膨胀系数也有较大的影响。组成相同的淬火玻璃比退火玻璃的热膨胀系数大,因为淬火玻璃保持高温时的结构,存在着较大的应力,质点间距也大,相互吸引力较弱。玻璃的平均热膨胀系数与真实热膨胀系数是不同的。从0℃直到退火下限,大体上是直线变化,即a—t曲线实际上是由若干线段所组成的拆线,每一线段仅适用于一个狭窄的温度范围,而a随温度的升高而增大。
在不同的热历史条件下,玻璃的a—t曲线产生不同的变化。若要精确地考察热膨胀系数a,就必须具体地考虑玻璃的热历史。
玻璃的比热。加热单位质量玻璃升高1℃所需的热量称为比热。物质的比热决定于晶格的振动,随温度的升高而增加,当加热到软化温度以上,比热增
加的幅度更加明显。不同化学组成的玻璃比热不同,一般而言,,Li
2O、Na
2
O、B
2
O
3
、
Al
2O
3
、SiO
2
增加玻璃的比热,PbO、BaO能降低玻璃的比热。
玻璃的导热性。物质靠质点的振动把热能传递至较低温度方面的能力称
为导热性。物质的导热性用导热系数表示,其数值的大小表征玻璃单位时间内传递热能的大小,它的倒数称为热阻。物质的导热系数值是晶格和电子所引起的热传导的总和。玻璃结构无序,自由电子少,所以玻璃的导热系数小,热阻大,相对金属材料导热能力较低。玻璃的透明性又增加了辐射热的透过性,因此,高温时,玻璃的导热性随着温度的升高而增强,如加热到软化温度的玻璃的导热性几乎增加一倍。
在玻璃中引入CaO、MgO、B
2O
3
、Al
2
O
3
、Fe
2
O
3
、Na
2
O等都能提高导热性,
而引入PbO、BaO则相反。
在加热和冷却条件下,用导温系数表征玻璃温度的变化速度。
玻璃的热稳定性。玻璃经受剧烈的温度变化而不破坏的性能称为玻璃的热稳定性。热稳定性的大小用试样在保持不破坏条件下所能经受的最大温度差来表示。在受热冲击条件下,由于玻璃是热的不良导体,致使沿玻璃的厚度方向存在温度差,因而从表面到内部,不同处有着不同的膨胀量,由此产生内部不平衡应力使玻璃破裂。可见,提高玻璃热稳定性的途径,主要是降低玻璃的热膨胀系数。
玻璃的热膨胀系数愈小,其热稳定性愈好。凡是能降低玻璃热膨胀系数的组分都能提高玻璃的热稳定性。含大量碱金属氧化物的玻璃热稳定性差。在平
板玻璃中引入一定量的B
2O
3
,可以大大改善平板玻璃的热稳定性,同时也有较好
的化学稳定性。
(二)玻璃的化学稳定性
玻璃抵抗气体、水、酸、碱、盐和各种化学试剂侵蚀的能力称为化学稳定性,可分为耐水性、耐酸性、耐碱性等。玻璃的化学稳定性对玻璃的贮存、使用及加工都有着重要的意义。
1.玻璃的侵蚀机理
探讨玻璃的侵蚀机理,主要是通过侵蚀介质对玻璃的物理化学作用进行研究,常遇到的侵蚀介质主要包括水、大气及各种酸、碱、盐的水溶液,它们对玻璃的侵蚀作用,首先都是通过水对玻璃表面的作用,即玻璃表面的金属离子R与水溶液中的H+离子或H
3
O+进行离子交换的结果。目前,通过对玻璃侵蚀机理的研究分析可以把对玻璃起作用的侵蚀介质分为两类:第一类侵蚀介质只能改
变、破坏或溶解玻璃结构组成中的R
2
O、RO等网络调整体物质,如水、大气、酸、
中性盐和酸性盐的溶液。第二类侵蚀介质不仅对玻璃结构组成中的R
2
O、RO等起作用,而且也能破坏玻璃结构中的硅氧骨架的物质,如氢氧化物溶液、碳酸盐溶液、磷酸和磷酸盐类溶液、氢氟酸和氟化物溶液,以及特殊的侵蚀剂、高温金属蒸气、熔体和熔盐等。
(1)水对玻璃的侵蚀。
水对硅酸盐玻璃的侵蚀开始于水中的R+和玻璃中的H+的离子交换,而后进行水化、中和反应。其反应可用下式表示:
上述反应的实质是玻璃中的碱金属氧化物水解过程。其反应的产物硅酸钠, 的电离度要低于的电离度,因此这一反应使溶液中的离子浓度降低而促进了反应的进行。以上三个反应互为因果,循环进行,而总的速度决定于—的反应生成。
随着这一水化反应的继续,)* 原子周围原有的四个桥氧全部成为。反应产物是极性分子,它将周围的水分子极化,并定向地吸附在自己的周围,成为硅酸凝胶,在玻璃表面形成一层薄膜,它具有较强的抗水和抗酸性能,被称为保护膜层。
(2)酸对玻璃侵蚀。
玻璃具有很强的耐酸性。除氢氟酸外,一般的酸都通过水的作用侵蚀玻璃。酸的浓度大,意味着水的含量低,因此浓酸对玻璃的侵蚀作用低于稀酸。
水对硅酸盐玻璃侵蚀的产物之一是金属氢氧化物,这一产物要受到酸的中和。中和作用起着两种相反的效果。一是使玻璃和水溶液之间的离子交换反应加速进行,从而增加玻璃的失重,二是降低溶液的值,使的溶解度减小,从而减小玻璃的失重。当玻璃中的含量较高时,前一种效果是主要的;反之,当含量较高时,后一种效果是主要的。也就是说,高碱玻璃的耐酸性小于耐水性,而高硅玻璃的耐酸性大于耐水性。
(3)碱对玻璃的侵蚀。
硅酸盐玻璃一般不耐碱,碱对玻璃的侵蚀是通过’离子破坏硅氧骨架,使溶解在溶液中。所以在玻璃侵蚀过程中,不形成硅酸凝胶薄膜,而使玻璃表面层全部脱落,玻璃的侵蚀程度与侵蚀时间成直线关系。
(4)大气对玻璃的侵蚀。
大气对玻璃的侵蚀实质上是水汽等对玻璃表面侵蚀的总和。玻璃受潮湿大气的侵蚀过程,首先开始于玻璃表面的某些离子吸附了大气中的水分子,这些水分子以离子基团的形式覆盖在玻璃表面上,形成一薄层。如果玻璃化学组成中和含量少,这种薄层形成后就不再发展;如果玻璃化学组成中含碱性氧化物较多测被吸附的水膜会变成碱金属氢氧化物的溶液。释出的碱在玻璃的表面不断积累,浓度越来越高小值迅速上升,最后成为类似于碱对玻璃的侵蚀而使侵蚀加剧。
所以,水汽对玻璃侵蚀,首先是以离子交换为主的释碱过程,后来逐渐地过渡到以破坏网络为主的溶蚀过程。
2.影响玻璃化学稳定性的主要因素
(1)化学组成的影响。
a.SiO
2含量越多,即[SiO
4
]四面体互相连接越紧密,玻璃的化学稳
定性越高。碱金属氧化物含量越高,网络结构越容易被破坏,玻璃的化学稳定性就越低。
b.离子半径小,电场强度大的离子如Li
2O 取代Na
2
O,可加强网络,提
高化学稳定性,但引入量过多时,由于“积累”而促进玻璃分相,反而降低了玻璃的化学稳定性。
c.在玻璃中同时存在两种碱金属氧化物时,由于“混合碱效应”,化学稳定性出现极大值。
d.以B
2O
3
取代SiO
2
时,由于“硼氧反常现象”,在B
2
O
3
引入量为16%
左右时,化学稳定性出现极大值。
e.少量Al
2O
3
引入玻璃组成时,能形成[AlO
4
],从而提高玻璃的化学
稳定性。
一般认为,凡能增强玻璃网络结构或生成物是难溶解的氧化物,都可以提高玻璃的化学稳定性。
(2)热处理。
a.当玻璃在酸性炉气中退火时,玻璃中的部分碱金属氧化物移到表面上,被炉气中酸性气体(主要是SO
2
)所中和而形成“白霜”(主要成分为硫酸钠),通常称为硫酸化。因白霜易被除去而降低玻璃表面碱性氧化物含量,从而提高了化学稳定性。相反,在非酸性炉气中退火,将引起碱在玻璃表面上的富集,从而降低了玻璃的化学稳定性。
b.玻璃钢化过程中产生两方面作用,一是表面产生压应力,微裂纹减少,提高化学稳定性;二是碱在表面的富集降低化学稳定性。但总体来说是提高了化学稳定性。
(3)温度。
玻璃的化学稳定性随温度的升高而剧烈变化。在100℃以下,温度每升高10℃,侵蚀介质对玻璃侵蚀速度增加50—150,100℃以上时,侵蚀作用始终是剧烈的。
(4)压力。
当压力提高到2.94—908Mpa以上时,甚至较稳定的玻璃也可在短时间
内剧烈地被破坏,同时大量的SiO
2
转入溶液中。
(三)玻璃的光学性质
玻璃光学性能涉及范围很广,而且这些性能可以通过调整成分、着色、光照、热处理、光化学反应以及镀膜等物理化学方法对其进行控制和改变。
1.玻璃的折射率
玻璃的折射率可以理解为电磁波在玻璃中传播速度的降低(以真空中的光速为基准),一般用 n来表示:
玻璃物理化学性能计算
玻璃物理化学性能计算 一、玻璃的粘度计算 ...1.粘度和温度的关系 ...2.玻璃组成对温度的作用 ...3.粘度参考算点及在生产中的应用 ...4.粘度的计 二、玻璃的机械性能和表面性质 ...1.玻璃表面张力的物理与工艺意义 ...2.玻璃表面张力与组成及温度的关系 ...3.玻璃的表面性质 ...4.玻璃的密度计算 三、玻璃的热学性质和化学稳定性 ...(一)玻璃的热学性能 ...(二)玻璃的化学稳定性 ...(三)玻璃的光学性质 一、玻璃粘度和温度的关系 粘度是玻璃的重要性质之一。它贯穿着玻璃生产整个阶段,从熔制、澄清、均化、成型、加工、直到退火都与粘度密切相关。在成型和退火方面年度起着控制性的作用。在高速成型机的生产中,粘度必须控制在一定的范围内,而成型机的速度决定与粘度随温度的递增速度。此外玻璃的析晶和一些机械性能也与粘度有关。 所有实用硅酸盐玻璃,其粘度随温度的变化规律都属于同一类型,只是粘度随温度变化的速度以及对应某给定温度的有所不同。在10怕.秒(或者更低)至约1011怕.秒的粘度范围内,玻璃的粘度由玻璃化学成分所决定的,而在从约1011怕.秒(1015泊,或者更高)的范围内,粘度又是时间的函数。
这些现象可由图来说明: Na 2O---CaO---SiO 2 玻璃的弹性、粘度与温度的关系 上图的三个区。在A区温度较高。玻璃表现为典型的粘度液体,他的弹性性质近于消失。在这一温度去中粘度仅决定于玻璃的组成和温度。当温度近于B 区时,粘度随温度下降而迅速增大,弹性模量也迅速增大。在这一温度区的粘度去决定于组成和温度外,还与时间有关。当温度进入C区,温度继续下降,弹性模量继续增大,粘滞留东变得非常小。在这一温度区,玻璃的粘度和其它性质又决定于组成和温度而与时间无关。图中所市的粘度和弹性随温度的变化现象,可以从玻璃的热历史说明。
《物理化学》学习辅导习题及答案(汇编)
期末复习《物理化学》学习辅导材料之一 热力学 一、判断题: 1、在定温定压下,CO2由饱和液体转变为饱和蒸气,因温度不变, CO2的热力学能和焓也 不变。 ( ) 2、25℃时H2(g)的标准摩尔燃烧焓等于25℃时H2O(g)的标准摩尔生成焓。() 3、稳定态单质的Δf H mΘ(800K)=0 。 ( ) 4、d U=nC v,m d T公式对一定量的理想气体的任何pVT过程都适用。 ( ) 5、系统处于热力学平衡态时,其所有的宏观性质都不随时间而变。() 6、若系统的所有宏观性质均不随时间而变,则该系统一定处于平衡态。() 7、隔离系统的热力学能是守恒的。() 8、隔离系统的熵是守恒的。() 9、一定量理想气体的熵只是温度的函数。() 10、绝热过程都是定熵过程。() 11、一个系统从始态到终态,只有进行可逆过程才有熵变。() 12、系统从同一始态出发,经绝热不可逆过程到达的终态,若经绝热可逆过程,则一定达 不到此终态。() 13、热力学第二定律的克劳修斯说法是:热从低温物体传到高温物体是不可能的。() 14、系统经历一个不可逆循环过程,其熵变> 0。() 15、系统由状态1经定温、定压过程变化到状态2,非体积功W’<0,且有W G和G<0, 则此状态变化一定能发生。() 16、绝热不可逆膨胀过程中S >0,则其相反的过程即绝热不可逆压缩过程中S <0。() 17、临界温度是气体加压液化所允许的最高温度。 ( ) 18、可逆的化学反应就是可逆过程。 ( ) 19、Q和W不是体系的性质,与过程有关,所以Q + W也由过程决定。 ( ) 20、焓的定义式H = U + pV是在定压条件下推导出来的,所以只有定压过程才有焓变。( ) 21、焓的增加量?H等于该过程中体系从环境吸收的热量。 ( ) 22、一个绝热过程Q = 0,但体系的?T不一定为零。 ( ) 23、对于一定量的理想气体,温度一定,热力学能和焓也随之确定。 ( ) 24、某理想气体从始态经定温和定容两过程达终态,这两过程的Q、W、?U及?H是相等的。 ( ) 25、任何物质的熵值是不可能为负值和零的。 ( ) 26、功可以全部转化为热,但热不能全部转化为功。 ( ) 27、不可逆过程的熵变是不可求的。 ( ) 28、某一过程的热效应与温度相除,可以得到该过程的熵变。 ( ) 29、在孤立体系中,一自发过程由A→B,但体系永远回不到原来状态。 ( ) 30、绝热过程Q = 0,即,所以d S = 0。 ( )
物理化学计算题1
一、1 mol 理想气体由1013.25 kPa ,5 dm 3,609.4 K 反抗恒外压101.325 kPa 膨胀至40 dm 3 ,压力等于外压,求此过程的W 、Q 、△U 、△H 、△S 、△A 、△G 。已知C V ,m =12.5 J ·mol -1 ·K -1 ;始态熵值S 1=200 J ·K -1 。 解:K K T V p V p T 5.4874.6095 40 101111222=??== ()()()()()()()()3332111,211 1 ,21101.32510405 3.54610 3.546112.5487.5609.4 1.524112.58.314487.5609.4 2.5371.524 3.546 2.022amb V m p m W p V V Pa m J kJ U nC T T mol J mol K K kJ H nC T T mol J mol K K kJ Q U W kJ kJ ----=--=-?-=-?=-?=-=???-=-?=-=?+??-=-=?-=---=kJ ()()1111122,1111 21487.51112.58.314ln 8.314ln 14.67609.41014.67200214.67p m T p S nC ln nRln mol J mol K J mol K J K T p S S S J K J K -------? ??=-=+??-??=???? ?=?+=+?=?()()3 2211 2.53710487.5214.5609.420014.77G H T S T S J kJ ???=?--=-?-?--=?? 二、始态为T 1=300 K ,p 1=200 kPa 的某双原子理想气体1 mol ,经先绝热可逆膨胀使压力降到100 kPa ,再恒压加热到 T 2=300 K ,p 2=100 kPa 的终态,求整个过程的Q ,△U ,△H ,△S ,△G 。 J K J K S T H G K J molRln p p nRln S H U 1729762.53000762.51210;01121-=??-=?-?=??===?=?=?-- ()()()J K R mol T T nC H Q Q K K T p p T m p 15681.2463002 711.246300223,224.14.1111212=-=-=?===?=??? ? ??=--γ γ 四、甲醇(CH 3OH )在 101.325 kPa 下的沸点(正常沸点)为 64.65℃,在此条件下的摩尔蒸发焓Δvap H m =35.32kJ ·mol-1。求在上述温度压力条件下,1 kg 液态甲醇全部成为甲醇蒸气时的Q 、W 、ΔU 、ΔH ,ΔS 及ΔG 。视甲醇蒸气为理想气体。 解:根据题意可知,此蒸发过程是在相变温度及其平衡压力下进行的可逆相变化过程,若视甲醇蒸气为理想气体,且忽略液态甲醇的体积,则有kJ kJ H M m H n H Q m vap m vap p 30.1102)32.3532 1000 (=?=?= ?=?= kJ J RT g n l V g V p W 65.87)]15.27365.64(3145.832 1000 [)()]()([-=+??-=-=--= kJ kJ W Q U 65.1014)65.8730.1102(=-=+=? 1263.3)15.27365.64/(30.1102/-?=+==?K kJ K kJ T Q S r 0=?G
物理化学习题及答案
物理化学习题及答案 -CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN
物理化学期末复习 一、单项选择题 1. 涉及焓的下列说法中正确的是() (A) 单质的焓值均等于零 (B) 在等温过程中焓变为零 (C) 在绝热可逆过程中焓变为零 (D) 化学反应中系统的焓变不一定大于内能变化 2. 下列三种胶体分散系统中,热力不稳定的系统是:() A.大分子溶胶 B.胶体电解质 C.溶胶 3. 热力学第一定律ΔU=Q+W 只适用于() (A) 单纯状态变化 (B) 相变化 (C) 化学变化 (D) 封闭物系的任何变化 4. 第一类永动机不能制造成功的原因是() (A) 能量不能创造也不能消灭 (B) 实际过程中功的损失无法避免 (C) 能量传递的形式只有热和功 (D) 热不能全部转换成功 5. 如图,在绝热盛水容器中,浸入电阻丝,通电一段时间,通电后水及电阻丝的温度均略有升高,今以电阻丝为体系有() (A) W =0,Q <0,U <0 (B). W>0,Q <0,U >0 (C) W <0,Q <0,U >0
(D). W <0,Q =0,U >0 6. 对于化学平衡, 以下说法中不正确的是() (A) 化学平衡态就是化学反应的限度 (B) 化学平衡时系统的热力学性质不随时间变化 (C) 化学平衡时各物质的化学势相等 (D) 任何化学反应都有化学平衡态 7. 封闭系统内的状态变化:() A 如果系统的?S >0,则该变化过程自发 sys B 变化过程只要对环境放热,则该变化过程自发 ,变化过程是否自发无法判断 C 仅从系统的?S sys 8. 固态的NH HS放入一抽空的容器中,并达到化学平衡,其组分数、独立组分 4 数、相数及自由度分别是() A. 1,1,1,2 B. 1,1,3,0 C. 3,1,2,1 D. 3,2,2,2 9. 在定压下,NaCl晶体,蔗糖晶体,与它们的饱和混合水溶液平衡共存时,独立组分数C和条件自由度f':() A C=3,f'=1 B C=3,f'=2 C C=4,f'=2 D C=4,f'=3 10. 正常沸点时,液体蒸发为气体的过程中() (A) ΔS=0 (B) ΔG=0
物理化学计算题答案
物理化学计算题目 1、已知反应 (CH 3)2CHOH(g) == (CH 3)2CO(g) + H 2(g) 的C p ,m = 16.72 11mol K J -?-??,在 457.4 K 时的K =0.36,在298.2 K 时的?r H = 61.5 kJ ·mol -1,求500 K 时反应的标准平衡常数 1、解:?r H (T )= ?r H (298.15 K)+()B m ,298.2K B p T C ? ∑ν = 61.5×10 3 J ·mol -1+16.72 11mol K J --??(T -298.15 K) = 56.5 ×10 3 J ·mol -1+16.72 11mol K J --??×T (2分) d ln K /d T = ?r H / (RT 2 )= 2 1 113mol K J 16.72mol J 015.56RT ---??+?? = 1.445 则 K ( 500 K) = 1.53 2、反应2O 2(g) + S 2(g) == 2SO 2(g) 在298 K 至2 000 K 之间的K 与T 的关系为 : () 37852 lg 7.57/K K T θ= - 。求 (1)反应在298 ~2 000K 之间的平均反应的标准摩尔焓; (2) 1 000 K 时的K 。 2、解:(1)?r H = -2.303×8.314 11mol K J -?-??×37 852 K = -724.8 kJ ·mol -1 (3分) (2) K (1 000 K) = 3057.7100085237109.110?=??? ??- (6分) 3、几种物质298 K 的?f H (B, T )和S (B, T ) 如下: 物 质 ?f H (B, 298 K) / k J · mol -1 S (B, 298 K) / J - K -1 - mol -1 ,11 p m C J mol K --?? HCl (g ) - 92.307 186.76 29.1 H 2(g ) 0 130.6 28.82 Cl 2(g ) 223.0 33.91 求反应 H 2 (g) + Cl 2 (g) == 2 HCl (g) 的K (500K)。 3、解:?r H (298 K) = νB ∑?f H (B ,298 K)=2×(-92.307)=184.6 k J. mol -1 ?r S (298 K) =∑B νB S (B ,298 K)= 2×186.76-130.6-223=19.921 1 --??K mol J
玻璃的特性
玻璃的特性 一、玻璃的力學性質 玻璃的理論抗拉強度極限為12000Mpa,實際強度只有理論強度的1/300——1/200,一般為30——60Mpa,玻璃的抗壓強度約為700——1000Mpa。玻璃中的各種缺陷造成了應力集中或薄弱環節,試件尺寸越大缺陷存在的越多。缺陷對抗拉強度的影響非常顯著,對抗壓強度的影響較小。工藝上造成的外來雜質和波筋(化學不均勻部分)對玻璃的強度有明顯影響。在—50——+70℃範圍內玻璃的強度基本不變。 脆性是玻璃的主要缺點。玻璃的脆性指標為1300——1 500(橡膠為0.4——0.6,鋼為400——460,混凝土為4200——9350)。E越大說明脆性越大。玻璃的脆性也可以根據衝擊試驗來確定。 在實際應用中玻璃製品經常受到彎曲、拉伸和衝擊應力,較尐受到壓縮應力。玻璃的力學性質主要指標是抗拉強度和脆性指標。 二、玻璃的光學性質 光學性質是玻璃最重要的物理性質。 光線照射到玻璃表面可以產生透射,反射和吸收三種情況。光線透過玻璃稱為透射,光線被玻璃阻擋,按一定角度反射出來稱為反射,光線通過玻璃後,一部分光能量損失在
玻璃內部稱為吸收。 玻璃中光的透射隨玻璃厚度增加而減尐。玻璃中光的反射對光的波長沒有選擇性,玻璃中光的吸收對光的波長有選擇性。可以在玻璃中加入尐量著色劑,使其選擇吸收某些波長的光,但玻璃的透光性降低。還可以改變玻璃的化學組成來對可見光、紫外線、紅外線、X射線、和γ射線進行選擇吸收。 三、玻璃的熱工性質 玻璃的比熱與其化學組成有關,在室溫範圍內其比經熱的範圍為0.33——1.05×103J/(kg·K)。表7—1玻璃的導熱係數 普通玻璃的導熱係數在室溫下約為0.75W/(m·k)。玻璃的導熱係數約為銅的1/400,是導熱係數較低的材料。當發生溫度變化時,玻璃產生的熱應力很高。在溫度劇烈變化時玻璃會產生碎裂,玻璃的急熱穩定性比急冷穩定性要強一些。 四、玻璃的化學性質 玻璃具有較高的化學穩定性,它可以抵抗除氫氟酸以外所有酸類的侵濁,矽酸鹽玻璃一般不耐鹼。玻璃遭受侵蝕性介質腐蝕,也能導致變質和破壞。 大氣對玻璃侵蝕作用實質上是水氣、二氧化碳、二氧化
物理化学练习题及答案
《 物理化学 》练习题4 注意事项:1. 考前请将密封线内容(特别是姓名和班内编号)填写清楚; 2. 所有答案请直接答在试卷上; 3.考试形式:闭卷; 4. 本试卷共 三 大题,满分100分, 考试时间120分钟。 一、选择题(10题,每题2分,共20分) 1. 下述说法哪一种不正确: ( ) (A )一定量理想气体自由膨胀后,其?U = 0 (B )非理想气体经绝热自由膨胀后,其?U ≠0 (C )非理想气体经一不可逆循环,其?U = 0 (D )非理想气体自由膨胀,气体温度略有变化 2. 水在 100℃、101325Pa 下沸腾时,下列各量何者增加? (A) 系统熵 (B) 汽化焓 (C) Gibbs 函数 (D) 蒸气压 3. 不挥发的溶质溶于溶剂中形成稀溶液之后,将会引起( ) (A) 凝固点升高 (B) 沸点升高 (C) 蒸汽压升高 (D) 总是放出热量 4. 对于理想气体之间的任意一个化学反应,影响标准平衡常数K 的因素是( ) (A) 浓度 (B) 压力 (C) 温度 (D) 催化剂 5. 固体Fe ,FeO ,Fe 3O 4与气体CO ,CO 2达到平衡时其组分数C 和自由度数F 分别为( )。 (A) C = 2, F = 0 (B) C = 1, F = 0 (C) C = 3, F = 1 (D) C = 4, F = 2 6.科尔劳施从实验中总结出电解质溶液的摩尔电导率与其浓度成线性关系 m m ΛΛ∞ =-,这一规律适用于( )
(A) 弱电解质(B) 强电解质的稀溶液 (C) 无限稀溶液(D) 浓度在一定范围的溶液 7. 反应的标准平衡常数与温度T的关系为dln K /d T = ?r H m /RT2,则( ) (A) K 必随温度升高而加大(B) K 必随温度升高而减小 (C) K 必随温度升高而改变(D) 随温度升高,K 可增大、减少或不变 8. 一定体积的水,当聚成一个大水球或分散成许多水滴时,在同温度下,两种状态相比,以下性质保持不变的有( ) (A) 表面能(B) 表面张力(C) 比表面(D) 液面下的附加压力 9.某零级反应A = B+ C开始时反应物浓度为0.2 mol·dm-3,其速率常数k为1.25×10?5 mol·dm-3·s-1,则其反应完成所耗时间t为 (A) 8000 s (B) 12000 s (C) 16000 s (D) 18000 s 10.在一个绝热的刚性容器中发生一个化学反应,使系统的温度升高和压力增大,则有 (A) Q>0,W<0,?U < 0 (B) Q=0,W=0,?U = 0 (C) Q=0,W<0,?U < 0 (D) Q>0,W=0,?U > 0 二、计算题(6题,共60分) 1. 298 K,101.3 kPa下,Zn 和CuSO4溶液的置换反应在可逆电池中进行,做出电功200 kJ,放热6 kJ,求该反应的Δr U,Δr H,Δr S,Δr A,Δr G(设反应前后的体积变化可忽略不计)。(10分)
各种玻璃特性详细介绍
各种玻璃特性详细介绍玻璃的制造已有五千年的历史,一般认为最早的制造者是古代的埃及人。我国在东周时代已能制造玻璃,玻璃组成中都含有氧化铅和氧化钡,与其他国家的古代玻璃有明显的区别。我国历史上有把玻璃称为琉璃、颇黎、假水晶料器、硝子等名称。 玻璃具有一系列非常可贵的特性:透明、坚硬、良好的化学稳定性;可通过化学组成的调整,大幅度调节玻璃的物理和化学性能,以适应各种不同的使用要求;可以用吹、压、拉、铸、槽沉、离心浇注等多种成形方法,制成各种形状的空心和实心制品;可以通过焊接和粉末烧结等加工方制成形状复杂、尺寸严格的器件。而且,制造玻璃的原料丰富,价格低廉。因此,作为结构材料和功能材料,玻璃在建材、轻工、交通、医药、化工、电子、航天、原子能等领域获得了极其广泛的应用。 B270/K9 K9玻璃是用K9料制成的玻璃制品,用于光学镀膜等领域 K9料属于光学玻璃,由于它晶莹剔透,所以衍生了很多以K9料为加工对象的工厂,他们加工出来的产品,在市面上称为水晶玻璃制品。 K9的组成如下: SiO2=69.13%B2O3=10.75%BaO=3.07%Na2O=10.40%K2O=6.29%As2O3=0.36% 它的光学常数为:折射率=1.51630色散=0.00806阿贝数=64.06。 石英玻璃 石英玻璃以其优良的理化性能,被大量广泛用于半导体技术,新型电光源,彩电荧光粉生产,化工过程,超高电压收尘、远红外辐射加热设备、航空航天技术、某些武器及光学仪器的光学系统、原子能技术、浮法玻璃及元碱玻璃窖的耐火材料,特种玻璃用坩埚,仪器玻璃成型部料碗,紫外线杀菌灯,各种有色金属的生产等诸多领域。石英玻璃SiO2含量大于99.5%,热膨胀系数低,耐高温,化学稳定性好,透紫外光和红外光,熔制温度高、粘度大,成型较难。多用于半导体、电光源、光导通信、激光等技术和光学仪器中。 石英玻璃在整个波长有特别好的透光性,在红外区(特殊的红外玻璃除外),光谱透射范围比普通玻璃大。在可见光区透过率达93%。在紫外光谱区,特别是在短波,紫外光谱区透过率比其他玻璃好的多。石英玻璃他的光学性能在很大程度上取决于它的化学性能。哪怕是0.001%的杂质就明显地影响产品质量。过度金属杂质会改变波长方向移动,羟基的存在会吸收2.73μm光带。国产光学石英玻璃有三个牌号:JGS1紫外光学石英玻璃,应用波段185-2000nm,用合成石制造,Sicl4为原料,JGS2紫外光学石英玻璃,应用波段220-2500nm,用水晶做
物理化学复习题目(含答案)
物 理 化 学 总 复 习 第一章 热力学第一定律 1. 热力学第一定律U Q W ?=+只适用于:答案:D (A)单纯状态变化 (B)相变化 (C)化学变化 (D)封闭体系的任何变化 2. 1mol 单原子理想气体,在300K 时绝热压缩到500K,则其焓变H ?约为: 4157J 3. 关于热与功,下面说法中,不正确的就是:答案:B (A)功与热只出现在体系状态变化的过程中,只存在于体系与环境的界面上 (B)只有封闭体系发生的过程中,功与热才有明确的意义 (C)功与热不就是能量,而就是能量传递的两种形式,可称为被交换的能量 (D)在封闭体系中发生的过程,如果内能不变,则功与热对体系的影响必互相抵消 4. 涉及焓的下列说法中正确的就是:答案:D (A)单质的焓值均为零 (B)在等温过程中焓变为零 (C)在绝热可逆过程中焓变为零 (D)化学反应中体系的焓变不一定大于内能变化 5. 下列过程中,体系内能变化不为零的就是:答案:D (A)不可逆循环过程 (B)可逆循环过程 (C)两种理想气体的混合过程 (D)纯液体的真空蒸发过程 6. 对于理想气体,下列关系中那个就是不正确的?答案:A (A)0)T U (V =?? (B) 0)V U (T =?? (C) 0)P U (T =?? (D) 0)P H (T =??
7. 实际气体的节流膨胀过程中,哪一组的描述就是正确的?答案:A (A) Q = 0 ;H ? =0;P ?< 0 (B) Q = 0 ;H ? = 0;P ?> 0 (C) Q > 0 ;H ? =0;P ?< 0 (D) Q < 0 ;H ? = 0;P ?< 0 8. 3mol 的单原子理想气体,从初态T 1=300 K 、p 1=100kPa 反抗恒定的外压50kPa 作不可逆 膨胀至终态T 2=300 K 、p 2=50kPa,对于这一过程的Q= 3741J 、W= -3741 J 、U ?= 0 、H ?= 0 。 9. 在一个绝热的刚壁容器中,发生一个化学反应,使物系的温度从T 1升高到T 2,压力从p 1升 高到p 2,则:Q = 0 ;W = 0 :U ? = 0。 10. 当理想气体反抗一定的压力作绝热膨胀时,则:答案:D (A) 焓总就是不变 (B) 内能总就是增加 (C) 总就是增加 (D) 内能总就是减少 11. 若要通过节流膨胀达到致冷的目的,则节流操作应控制的条件就是:答案:B (A)H )P T (??=μ <0 (B)H )P T (??=μ>0 (C)H )P T (??=μ=0 (D)不必考虑μ的数值 12. 一定量的理想气体,从同一初态压力p 1可逆膨胀到压力为p 2,则等温膨胀的终态体积与绝 热膨胀的终态体积之间的关系就是:答案:A (A)前者大于后者 (B) 前者小于后者 (C) 二者没有关系 (D)二者相等 13. 1mol 单原子理想气体,从273K 及 200kPa 的初态,经pT =C(常数)的可逆途径压缩到 400kPa 的终态,则该过程的U ?= -1702J 。 14. 1mol 单原子理想气体从温度为300K 绝热压缩到500K 时,其焓变H ?为 4157J 。 15. 从定义 U H pV =-出发,推断下列关系中的不正确者:答案:C (A) p p U H ( )()p V V ??=-?? (B) p p p U T ()C ()p V V ??=-?? (C) p p p U H T ()()()T V T V ???=-??? (D) p p p U H T ()()()p V T V ???=-??? 16. 盖斯定律包含了两个重要问题,即:答案:D (A)热力学第一定律与热力学第三定律 (B)热力学第一定律与热的基本性质 (C)热力学第三定律与热的基本性质 (D)热力学第一定律与状态函数的基本特性 17. 当某化学反应的0C m .P r π?时,则该过程的)T (H m r ?随温度的升高而 答案:A (A)下降 (B)升高 (C)不变 (D) 无一定规律 18. 氢气与氧气以2:1的比例在绝热的钢瓶中反应生成水,在该过程中 答案:D
各种玻璃的物理和化学性能
Ⅰ.GG17耐高温玻璃 GG17耐高温玻璃性能完全符合ISO3583国际标准,是一种高硼硅玻璃,具有优良的物理化学性能,它的含硅量在80%以上,玻璃的内部结构稳定性极为良好,因而具有较好的机械性能和化学性能;由于它的低热膨胀系数,能更好的耐受较高的温差,并具有良好的灯焰加工性能,是制造实验室用各种加热器皿、结构复杂的玻璃仪器、化工设备和压力水表玻璃等的良好玻璃材料。 具体的物理化学性能如下: 含硅量80%以上 应变温度520℃ 退火温度560℃ 软化温度820℃ 折射率 1.47 透光率(2mm) 92% 弹性模量67KNmm-2 抗张强度40-120Nmm-2 玻璃应力光学常数 3.8×10-6mm2 /N 加工温度(104dpas) 1220℃ 线膨胀系数(20-300℃) 3.3×10-6K-1 密度(20℃) 2.23gcm-1 比热0.9Jg-1K-1 导热率 1.2Wm-1K-1 耐水性能(ISO 719) 1级 耐酸性能(ISO 195) 1级 耐碱性能(ISO 695) 2级 耐热急变玻棒法玻棒Φ6×30mm 300℃ 关于GG17玻璃的几点说明 a.GG17玻璃制造的仪器如需长期加热和加压,它的最高安全操作温度不应超过应变温度(520℃)。它在加热到退火温度时,不易变形,如放在适当支架上,且内部不受压力情况下,可以在短时间内加热到600℃,在此情况下,应使仪器缓慢冷却,藉以减少产生永久应力的程度。 b.GG17玻璃管(在25℃时)的安全工作压力可根据下式计算: P=140T/D P为安全工作压力单位为kg/cm2 T为玻璃管壁厚D为玻璃管内径单位为mm 上式公式不适用于具有平底的玻璃管 c.GG17玻璃化学组成:(%) SiO2 B2O3 Al2O3 Na2O K2O 80.5 12.8 2 4 0.4 Ⅱ.“九五”耐高温玻璃 九五料玻璃是一种低碱高硼硅玻璃,不含钙镁锌及铂元素,具有较好的物理和化学性能,用于制造各种玻璃仪器。 具体的物理化学性能如下: 含硅量79%
物理化学习题及答案
一、单选题(每题2分,共30分) 1. 在298K及101.325KPa下的1.00dm3氢气,等温可逆膨胀到 2.00 dm3,所做功的绝对值为C A、0.418 J B、0.0418 J C、70.3J D、7.11J 2. 对于孤立体系的实际过程,下列关系式不正确的是D A、W=0 B、Q=0 C、△U=0 D、△H=0 3. 一封闭系统进行可逆循环,其热温商之和D A、总是正值 B、总是负值 C、是温度的函数 D、总为零 4. 液体A和B混合成实际溶液时,当A和B之间的作用力大于相同分子之间的作用力时,该溶液对拉乌尔定律将 B A、产生正偏差 B、产生负偏差 C、不产生偏差 D、无法确定 5. 关于偏摩尔量,下面的叙述不正确的是B A、偏摩尔量是状态函数,其值与物质的量无关 B、偏摩尔量的值不能小于零 C、体系的强度性质无偏摩尔量 D、纯物质的偏摩尔量等于摩尔量 6.克拉贝龙方程dP/dT=△H m(相变)/T△Vm(相变),其应用条件是D A、只适用于纯物质的气液、气固平衡 B、只适用于服从理想气体行为的为气液、气固平衡 C、任何纯物质的相变热不随温度而变的两相平衡 D、任何纯物质两相平衡体系 7.含KNO3和NaCl的水溶液与纯水达到渗透平衡,其自由度数f为D A、1 B、2 C、3 D、4 8.分解反应A(s)=B(g)+2C(g) 该反应的平衡常数Kp与分解压力P的数值之间为 C A、Kp=P3 B、Kp>P3 C、Kp
714200222069物理化学习题集(离线选做).
浙江大学远程教育学院 《物理化学》课程作业(选做) 姓名: 孔小柯 学 号: 714200222069 年级: 14秋 学习中心: 华家池医学中心 ————————————————————————————— 第一章 热力学第一定律 一、判断题 1. 状态函数改变后,状态一定改变。 2. 不做非体积功是指系统的始态和终态的体积相同。 3. O 2(g )的标准摩尔燃烧焓等于零。 4. H 2O (l )的标准摩尔燃烧焓等于零。 5. H 2和O 2在绝热钢瓶中发生反应的△U 等于零。 二、单选题 1. 是状态函数。 A .G B .△U C .W D .Q 2. 具有广度性质。 A .T B 、U C .P D .ρ(密度) 3. 具有强度性质。 A .S B .V C .G D .η(粘度) 4. 101.325kPa 和273.15K 的水等温等压变为冰,该过程的 。 A .Q>0 B .△U =0 C .△H>0 D .△H<0 5. 理想气体向真空膨胀,其体积从V 1增大到V 2,则系统做功为 。 A .W=0 B .W>0 C .W<0 D .1 2 ln V V nRT W =
三、填空题 1.最稳定单质的标准摩尔生成焓零(填“小于”、“大于”或“等于” )。 2.完全燃烧产物的标准摩尔燃烧焓零(填“小于”、“大于”或“等于” )。 3.在充满氧气的定容绝热反应器中,石墨剧烈燃烧。若以反应器以及其中所有物质为系 统,则该过程的△H 零(填“小于”、“大于”或“等于” )。 4.称为该物质的标准摩尔燃烧焓。 5.C(石墨)的标准摩尔燃烧焓CO(g)的标准摩尔生成焓(填“小于”、“大于” 或“等于” )。 6.H2(g)的标准摩尔燃烧焓H2O(g)的标准摩尔生成焓(填“小于”、“大于” 或“等于” )。 四、简答题 1.什么是状态函数? 2.什么是等压过程? 3.什么是热力学能? 4.什么是体积功? 5.可逆过程有哪些特点? 6.什么是理想气体?
物理化学第四章化学平衡练习题及答案
第四章 化学平衡练习题 一、判断与问答题: 1.反应的吉布斯函数变就是反应产物与反应物之间的吉布斯函数的差值。 2.在恒定的温度和压力条件下,某化学反应的?r G m 就是在一定量的系统中进行1mol 的 化学反应时产物与反应物之间的吉布斯函数的差值。 3.因为m r G ?= -RT ln K ,所以m r G ?是平衡状态时的吉布斯函数变化。 4.m r G ?是反应进度的函数。 5.在等温等压条件下,?r G m > 0的反应一定不能进行。 6.?r G m 的大小表示了反应系统处于该反应进度ζ时反应的趋势。 7.任何一个化学反应都可以用m r G ?来判断其反应进行的方向。 8.在等温、等压、W’ = 0的条件下,系统总是向着吉布斯函数减小的方向进行。若某化 学反应在给定条件下?r G m < 0,则反应物将完全变成产物,反应将进行到底。 9.在等温、等压不作非体积功的条件下,反应的? r G m < 0时,若值越小,自发进行反应 的趋势也越强,反应进行得越快。 10.某化学反应的? r G m 若大于零,则K 一定小于1。 11.理想气体反应 A + B = 2C ,当p A = p B = p C 时,m r G ?的大小就决定了反应进行方向。 12.标准平衡常数的数值不仅与方程式的写法有关,而且还与标准态的选择有关。 13.在给定温度和压力下发生的PCl 5的分解反应,只须测定平衡时混合气体的密度就可 以求知平衡常数了。 14.因 K = f (T ),所以对于理想气体的化学反应;当温度一定时,其平衡组成也一定。 15.若已知某气相生成反应的平衡组成,则能求得产物的m r G ?。 16.温度T 时,若K = l ,说明这个反应在此温度,压力为100kPa 的条件下已达到平衡。 17.一个已达平衡的化学反应,只有当标准平衡常数改变时,平衡才会移动。 18.因K = ∏(a B ν),所有化学反应的平衡状态随化学反应计量系数而改变。 19.有供电能力(W f ≠ 0)的可逆电池反应体系的状态,在“G ~ξ”曲线上可存在的位置? 20.“纯是相对的,绝对纯的物质是没有”,试从反应的亲合能A 上分析这句话的道理? 21.化学反应亲合势愈大,则自发反应趋势越强,反应进行得愈快,对否? 22.标准平衡常数与标准反应自由能的关系:K RT G ln m r -=?,那么,为什么反应的 平衡态与标准态是不相同的? 23.欲使反应产物的平衡浓度最大,反应物的投料比一般为多大? 24.对于计量系数?ν = 0的理想气体化学反应,哪些因素变化不改变平衡点? 25.平衡常数 K = 1的反应,在标准态下反应,反应朝什么方向进行? 26.在空气中金属不被氧化的条件是什么? 27.反应PCl 5(g) = PCl 3(g) + Cl 2(g) 在212℃、p 容器中达到平衡,PCl 5 离解度为0.5, 反应的m r H ?= 88 kJ·mol -1,以下情况下,PCl 5的离解度如何变化: (A) 通过减小容器体积来增加压力; (B) 容器体积不变,通入N 2气来增加总压力; (B) 升高温度; (D) 加入催化剂。 28.对于复分解反应,如有沉淀、气体或水生成,则容易进行到底,试以化学平衡理论 分析其道理? 29.2HgO(s) = 2Hg(g) + O 2(g),在反应温度下及p = 101.325kPa 时,K = 4×10-3,试问 HgO(s) 的分解压力多大?当达到分解温度时,与HgO(s) 平衡的p Hg 有多大?若在标 准状态下反应,体系的总压力是多少? 30.反应CO(g) + H 2O(g) = CO 2(g) + H 2(g),在600℃、100kPa 下达到平衡(各物质的逸度 系数均为1),当压力增大到500kPa 时,各物质的逸度系数分别为:γ (CO 2) = 1.09, γ (H 2) = 1.10,γ (CO) = 1.23,γ (H 2O) = 0.77,问这时平衡点向何方移动? 31.反应CaCO 3(s) = CaO(s) + CO 2(g) 在常温常压下的分解压力并不等于零,那么古代大 理石建筑物何以能够保留至今而不倒?
物理化学作业答案文档
物理化学习题作业答案 第一章热力学第一定律 一、问答题 1. 被划定的研究对象称为系统,不属于系统但与系统密切相关的部分称为环境。 2. 状态函数是描述平衡系统宏观性质的物理量。 3. 在环境压力恒定下,系统始、终态压力相同且等于环境压力的过程。 4. 系统中物质的所有能量的总和。 5. 第一类永动机是不可能造成的。 6. 因系统的体积变化而引起的系统与环境之间交换的功。 7. 可逆过程有三个特点:(1) 系统从始态到终态,过程是以无限接近平衡状态下进行的; (2) 在可逆过程中,系统做最大功,环境做最小功;(3) 沿与过程原来途径相反方向进 行,可使系统和环境完全恢复原来状态。 8. 可以忽略分子间的作用力和分子本身体积的气体。 9. 在标准压力和指定温度下,由最稳定的单质生成一摩尔物质的焓变,称为该物质的标准摩尔生成焓。 10.不能。该情况相当于一个绝热系统中作电功,电机发热只能使室温升高。 二、判断题(正确打√,错误打×) 1. √ 2. √ 3. √ 4. × 5. × 6. × 7. × 8. √ 9. √10. √ 三、选择题(选1个答案) 1. A 2. D 3. B 4. D 5. A 6. C 7. A 8. D 9. C 10. A 四、填空题 1. 封闭 2. 封闭系统中不做非体积功的等压过程 3. 等于 4. 等于 5. 大于
6. 在标准压力和指定温度下,一摩尔物质完全燃烧的焓变 7. 小于 8. 小于 9. 强度性质 10.小于 五、计算题 1. -8.314J 2. (1)Q=0,W=0,△U=0,△H=0 (2)Q=2430J,W=-2430J,△U=0,△H=0 (3)Q=1548J,W=-1548J,△U=0,△H=0 3.Q=40.7kJ,W=-3.10kJ,△U=37.6kJ,△H=40.7kJ 4. 6 5.7kJ 5. 260.7 kJ·mol-1 第二章热力学第二定律 一、问答题 1.第二类永动机是不可能造成的。 2.由理想气体的等温可逆膨胀→绝热可逆膨胀→等温可逆压缩→绝热可逆压缩所组成的循环过程。 3.熵是系统混乱度的量度. 4.在孤立系统中的任何过程,或封闭系统中 的绝热过程: △S>0 表示自发过程 △S=0 表示可逆过程 △S<0 表示不可能发生的过程 5.在封闭系统中的等温等压非体积功 为零的过程: △G<0 表示自发过程 △G=0 表示可逆过程 △G>0 表示不可能发生的过程 6.在封闭系统中的等温等容非体积功 为零的过程:
物理化学习题集及答案2
相平衡 一、选择题: 1. 二组分体系恒温时.可能同时存在的最大相数为 ( ) (A) Φ=2 (B) Φ=3 (C) Φ=4 2. 在α、β两项中都含有A 和B 两种物质,当达相平衡时,下列哪种情况正确 ( ) A B A A A B A B (A ) (C) (D) (B )αααβαβββμμμμμμμμ==== 3. 在101325Pa 下,水、冰和水蒸气平衡的系统中,自由度为 ( ) (A) 0 (B) 1 (C) 2 4. 在密闭容器中有食盐饱和溶液,并且存在着从溶液中析出的细小食盐结晶,则系统的自由度是 ( ) (A) 0 (B) 1 (C) 2 (D) 3 5. 系统是N 2和O 2两种气体的混合物时,自由度应为 ( ) (A) 1 (B) 2 (C) 3 (D) 4 6. 在101325 Pa 下,水和水蒸气呈平衡的系统,其自由度f 为 ( ) (A) 0 (B) 1 (C) 2 (D) 3 7. NH 4Cl(s)在真空容器中分解达到平衡NH 4Cl(s) → HCl(g) + NH 3(g) ( ) (A) K =3, Φ=2, f =2 (B) K =2, Φ=2, f =1 (C) K =1, Φ=2, f =1 (D) K =4, Φ=2, f =1 8. 25 ℃及标准压力下,NaCl(s)与其水溶液平衡共存 ( ) (A) K =1, Φ=2, f =1 (B) K =2, Φ=2, f =1 (C) K =2, Φ=2, f =0 (D) K =4, Φ=2, f =1 9. 已知在318 K 时纯丙酮的的蒸气压为43.063 kPa ,今测得氯仿的摩尔分数为0.30的丙酮-氯仿二元溶液上丙酮的蒸气压为26.77 kPa ,则此溶液: ( ) (A) 为理想液体混合物 (B) 对丙酮为负偏差 (C) 对丙酮为正偏差 (D) 无法确定 10. 苯(A)与甲苯(B)形成理想混合物,当把5 mol 苯与5 mol 甲苯混合形成溶液,这时,与溶液相平衡的蒸汽中,苯(A)的摩尔分数是: ( )
大学物理化学试题及答案
物理化学 试卷一 一、选择题 ( 共15题 30分 ) 1. 下列诸过程可应用公式 dU = (Cp- nR)dT进行计算的是: ( C ) (A) 实际气体等压可逆冷却 (B) 恒容搅拌某液体以升高温度 (C) 理想气体绝热可逆膨胀 (D) 量热弹中的燃烧过程 2. 理想气体经可逆与不可逆两种绝热过程: ( B ) (A) 可以从同一始态出发达到同一终态因为绝热可逆ΔS = 0 (B) 从同一始态出发,不可能达到同一终态绝热不可逆S > 0 (C) 不能断定 (A)、(B) 中哪一种正确所以状态函数 S 不同 (D) 可以达到同一终态,视绝热膨胀还是绝热压缩而定故终态不能相同 3. 理想气体等温过程的ΔF。 ( C ) (A)>ΔG (B) <ΔG (C) =ΔG (D) 不能确定 4. 下列函数中为强度性质的是: ( C ) (A) S (B) (G/p)T (C) (U/V)T 容量性质除以容量性质为强度性质 (D) CV 5. 273 K,10p下,液态水和固态水(即冰)的化学势分别为μ(l) 和μ(s),两者的关系为:( C ) (A) μ(l) >μ(s) (B) μ(l) = μ(s) (C) μ(l) < μ(s) (D) 不能确定
6. 在恒温抽空的玻璃罩中封入两杯液面相同的糖水 (A) 和纯水 (B)。经历若干
时间后,两杯液面的高度将是(μ(纯水)>μ(糖水中水) ,水从(B) 杯向(A) 杯转移 ) ( A ) (A) A 杯高于 B 杯 (B) A 杯等于 B 杯 (C) A 杯低于 B 杯 (D) 视温度而定 7. 在通常情况下,对于二组分物系能平衡共存的最多相为: ( D ) (A) 1 (B) 2 (C) 3 (D) 4 * Φ=C+2-f=2+2-0=4 8. 硫酸与水可形成H2SO4·H2O(s)、H2SO4·2H2O(s)、H2SO4·4H2O(s)三种水合物,问在 101325 Pa 的压力下,能与硫酸水溶液及冰平衡共存的硫酸水合物最多可有多少种? ( C ) (A) 3 种 (B) 2 种 (C) 1 种 (D) 不可能有硫酸水合物与之平衡共存。 * S = 5 , R = 3 , R' = 0,C= 5 - 3 = 2 f*= 2 -Φ+ 1 = 0, 最大的Φ= 3 , 除去硫酸水溶液与冰还可有一种硫酸水含物与之共存。 9. 已知 A 和 B 可构成固溶体,在 A 中,若加入 B 可使 A 的熔点提高,则B 在此固溶体中的含量必 _______ B 在液相中的含量。 ( A ) (A) 大于 (B) 小于 (C) 等于 (D)不能确定 10. 已知反应 2NH3= N2+ 3H2在等温条件下,标准平衡常数为 0.25,那么,在此条件下,氨的合成反应 (1/2) N2+(3/2) H2= NH3 的标准平衡常数为: ( C ) (A) 4 (B) 0.5 (C) 2 K (D) 1 * $p(2) = [K $p(1)]= (0.25)= 2 11. 若 298 K 时,反应 N2O4(g) = 2NO2(g) 的 K $p= 0.1132,则: (1) 当 p (N2O4) = p (NO2) = 1 kPa 时,反应将 _____( B )_____; (2) 当 p (N2O4) = 10 kPa,p (NO2) = 1 kPa 时,反应将 ____( A )____ 。
