(完整版)高二化学选修四练习题及其参考答案(完整版).docx

《原电池》练习题
选择题
1.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A .在 AgCl 悬浊液中加入 KI 溶液充分振荡Ag+ + I- = AgI ↓
B.氢氧燃料电池的负极反应式: O2+ 2H2O + 4e- == 4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu2++2e- == Cu D.钢铁发生电化腐蚀的正极反应式:Fe - 2e- == Fe2+
2.常温时,将两种溶液等体积混合,其中溶液pH一定或可能等于7 的情况共有
①pH=2盐酸和 pH=12 NaOH溶液②pH=2醋酸和 pH=12 NaOH溶液
③pH=2盐酸和 pH=12氨水④pH=2某酸和 pH=12 NaOH溶液
⑤pH=2盐酸和 pH=12某碱溶液⑥pH=2硫酸和 pH=12 NaOH溶液
⑦pH=2盐酸和 pH=12 Ba(OH)2溶液⑧pH=2硫酸和 pH=12 Ba(OH)2溶液
A.5 种B.6种C.7种D.8种
3.下列各组离子一定能大量共存的是
A .在含大量 Fe3+的溶液中: NH4+、 Na+、Cl—、SCN—
B.在强碱溶液中: Na+、 K+、AlO 2—、CO32—
+
)=10—
13+3+2——
C.在 c(H mol/L 的溶液中: NH 4、 Al、SO4、 NO3
——
D.在 pH=1 的溶液中: K +、Fe2+、Cl、NO3
4.物质的量浓度相同的三种盐NaX、NaY 、 NaZ 溶液,其 pH 依次为 7、8、9。下列有关说法正确的是
A .HX 、 HY 、HZ 三种酸的酸性由强到弱的顺序为HZ> HY >HX
B.HX 是强酸, HY 、HZ 是弱酸,且 HY 的酸性强于 HZ
C.X -、Y -、Z-三种酸根均能水解,且水解程度Z->Y ->X -
D.三种盐溶液中X -、 Y -、Z-的浓度大小顺序为c(Z-)>c(Y - )>c(X - )
5.一定温度下,将 a mol PCl5通入一个容积不变的密闭容器中,发生反应:PCl5(g)PCl3(g)+Cl 2(g),平衡时测得混合气体的压强为 p1,此时向容器中再通入 a mol PCl5,在相同温度下再次达到平衡时,测得压强为
p2,下列判断正确的是
A .2p1>p2B.PCl5的分解率增大C.p1>p2D. Cl2的体积分数增大
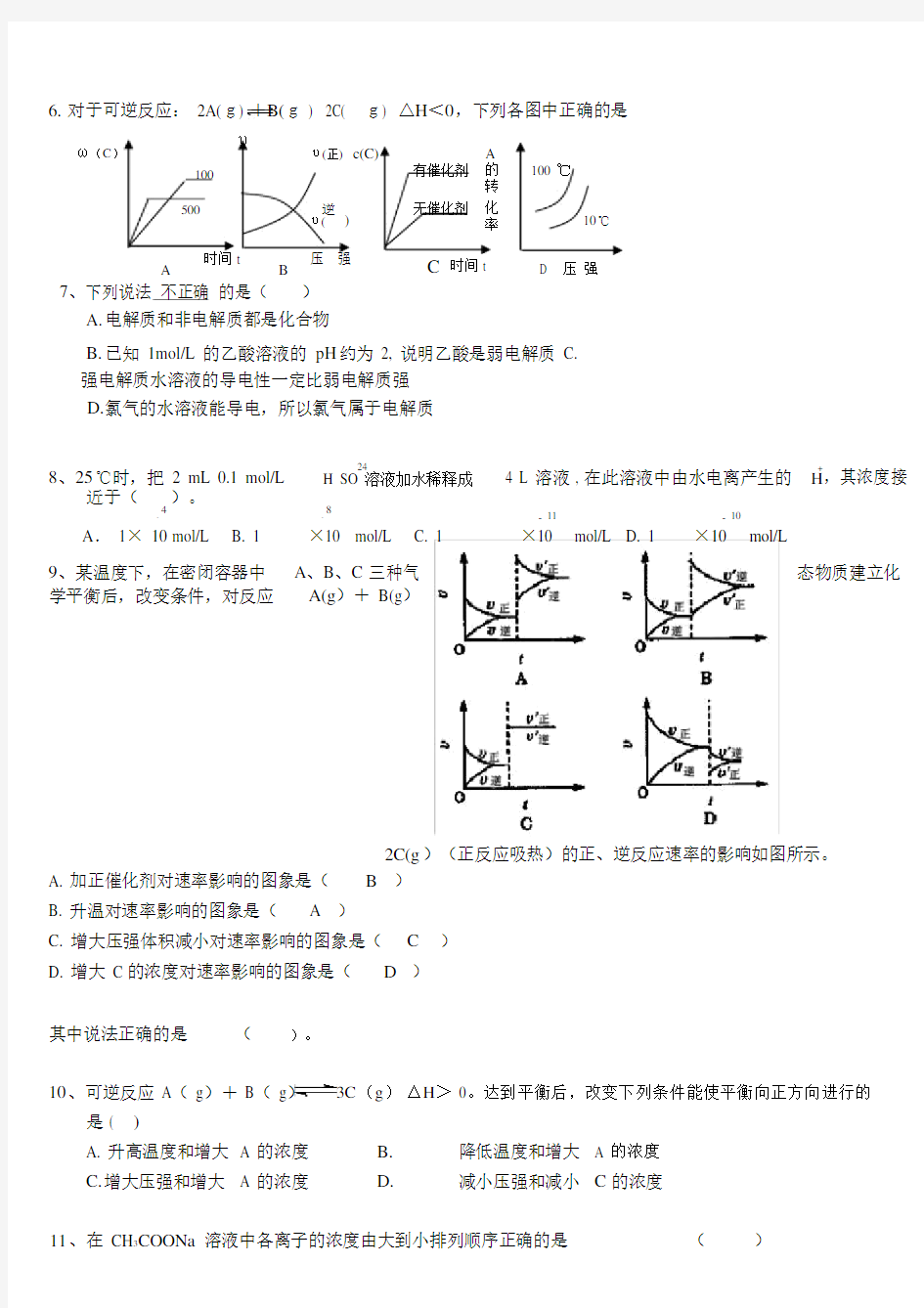
6.对于可逆反应: 2A(g) +B(g ) 2C( g) △H<0,下列各图中正确的是
ω(C)
υ
υ(正)c(C)A
100 ℃100有催化剂的
转
无催化剂
500逆
)
化
10℃
υ(率
A
时间 t
B
压强C时间 t D 压强
7、下列说法不正确的是()
A.电解质和非电解质都是化合物
B.已知 1mol/L 的乙酸溶液的 pH约为 2, 说明乙酸是弱电解质
C.
强电解质水溶液的导电性一定比弱电解质强
D.氯气的水溶液能导电,所以氯气属于电解质
8、25℃时,把 2 mL 0.1 mol/L24 4 L 溶液 , 在此溶液中由水电离产生的+,其浓度接
H SO 溶液加水稀释成H
近于()。
-
4
mol/L B. 1-
8
- 11- 10
A. 1× 10×10 mol/L C. 1×10 mol/L D. 1×10 mol/L
9、某温度下,在密闭容器中A、B、C 三种气态物质建立化学平衡后,改变条件,对反应A(g)+ B(g)
2C(g)(正反应吸热)的正、逆反应速率的影响如图所示。
A. 加正催化剂对速率影响的图象是(B)
B. 升温对速率影响的图象是(A)
C. 增大压强体积减小对速率影响的图象是(C)
D. 增大 C的浓度对速率影响的图象是(D)
其中说法正确的是()。
10、可逆反应 A( g)+ B( g)3C(g)△H> 0。达到平衡后,改变下列条件能使平衡向正方向进行的
是 ( )
A. 升高温度和增大 A 的浓度
B.降低温度和增大 A 的浓度
C.增大压强和增大 A 的浓度
D.减小压强和减小C的浓度
11、在 CH3COONa溶液中各离子的浓度由大到小排列顺序正确的是()
+ - - + ) A .c(Na ) ﹥c(CH 3COO) ﹥ c(OH) ﹥c(H +
-
+
-
C .c(Na ) ﹥c(CH COO) ﹥ c(H )
﹥ c(OH )
3
B - + - +
.c(CH 3COO) ﹥c(Na ) ﹥c(OH ) ﹥c(H )
D
+ -
-
+
.c(Na ) ﹥c(OH ) ﹥ c(CH COO) ﹥c(H )
3
12、X 、Y 、Z 三种气体,取 X 和 Y 按 1:1 的物质的量之比混合, 放入密闭容器中发生如下反应: X+2Y
2Z ,
达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为
3: 2,则 X 的转化率最接
近
(
)
A . 33%
B .40%
C . 50%
D . 65%
13.对于平衡体系: aA (g )+bB ( g )
cC(g)+dD(g);正反应放热,有下列判断,其中正确的是:
A .若温度不变,容器体积扩大一倍,此时 A 的浓度是原来的
0.48 倍,则 a+b 大于 c+d
B .若从正反应开始,平衡时, A 、 B 的转化率相等,则 A 、B 的物质的量之比为 a : b
C .若平衡体系中共有气体 M mol ,再向其中充入 bmolB ,达到平衡时气体总物质的量为 M+bmol ,则 a+b=c+d
D .若 a+b=c+d ,则当容器内温度上升时,平衡向左移动,容器中气体的压强不变。 14. 化学用语是学习化学的重要工具,下列表示物质变化的化学用语中,错误的是
4 溶液中滴人 2 4 2-
+ 2H + 2+ + 2OH -
42
A .向 KHSO Ba(OH) 溶液使 pH=7;SO + Ba
= BaSO ↓+ 2H O B .明
矾水解的离子方程式: Al
3+ +3 H 2O===Al(OH) 3 +
↓ +3H
C .Mg(HCO 3)2 溶液与盐酸溶液反应的离子方程式:
- + H +
== CO 2↑ +H 2O HCO 3 D .常温常压下, 1g 氢气充分燃烧生成液态水,放出
142.9 kJ 热量。
则表示氢气燃烧热化学方程式
2H 2( ) +O 2( )= 2 △ H =
+571.6kJ/mol
g
g 2H O(l) 15 .二元酸
2 在水中的电离情况是:
2
= + - 和 HA -
+
2-
,则下列物质的水溶液中粒子
H A
H A
H +HA
H +A
浓度之间存在的关系错误 的是
..
A .NaHA :c(Na +
-
-
+
+
-
-
)>c(HA
)>c(OH )> c(H )
B .NaHA : c(Na )= c(A 2 )+c(HA )+ c(H 2A)
2
+
)>c(A 2-
-
+
)
2
+ )= c(HA -
)+2 c(A 2-
-
)
C . Na A : c(Na
)>c(OH )> c(H D .H A : c(H )+c(OH 16.在 373K 时,把 0.5 mol N
2 O 气体通入体积为
5 L( 恒容 )的真空密闭容器中,立即出现红棕色。反应进
4
行到 2 s 时, NO 2 的浓度为 0.02 mol ·L -1。在 60 s 时,体系已达到平衡,此时容器内压强为反应前的
1.6 倍。下列说法正确的是
A .前 , 2 4 的平均反应速率为 0.01 mol · L -
1· s
-
1
B .平衡时,
2 4 的转化率为
60% 2 s N O
N O
C .平衡时,体系内含 NO 2 为 0.04 mol · L -1
D .在 2 s 时,体系内压强为反应前的
1.1 倍
第Ⅱ卷(共 64 分)
二、(本题包括 2 小题,共 20 分)
17.( 8 分)( 1)(6 分)右图分别是温度计、量筒、滴定管的一
部分,则:量筒应该是
读数为 mL mL
滴定管应该是 ,读数为 温度计应该是 ,读数是 ℃
( 2) (2 分)用已知浓度的盐酸滴定未知浓度的氢氧化 钠溶液时,
下列实验操作会引起测量结果偏高的 是
。 ①用天平称量 NaOH 固体,将小烧杯放在右盘,砝码 放在左盘,并移动游码,
使之平衡。
②滴定前滴定管尖嘴有气泡,滴定后尖嘴气泡消失
③中和滴定时,锥形瓶内有少量蒸馏水。
④酸式滴定管用蒸馏水洗后,未用标准液洗。
⑤读取滴定管终点读数时,仰视刻度线。
18.( 12 分)乙二酸俗名草酸,下面是甲、乙两个化学学习小组的同学对草酸晶体( H2C2O4·xH 2O)和草酸( H2C2O4)分别进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。
Ⅰ.甲组同学的研究课题是:探究测定草酸晶体(H2 2
O4· 2 )中x值。通过查阅资料该小组同学
C xH O
通过网络查询得,草酸易溶于水,水溶液可以用酸性 KMnO 4溶液进行滴定:
2MnO4-+5H2 2 4+2Mn2+22O
C O+6H+ 10CO ↑+ 8H
甲组的同学设计了滴定的方法测定x 值。
①称取 1.260 g 纯草酸晶体,将其酸制成100.00 mL 水溶液为待测液。
②取 25.00 mL 待测液放入锥形瓶中,再加入适的稀H2SO4时消耗;
③用浓度为 0.1000 mol/L 的 KMnO 4标准溶液进行滴定,达到终点
⑴滴定时,将 KMnO 4标准液装在右图中的
10.00 mL (填“甲”或“乙”)滴定管中。
⑵ 本实验滴定达到终点的标志可以是。
⑶通过上述数据,求得 x=。
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的 x 值会(填“偏大”、“偏小” 或“不变”,下同)。
②若滴定时所用的 KMnO 4 溶液因久置而导致浓度变小,则由此测得的x 值会。
Ⅱ.乙组同学的研究课题是:探究草酸( H2 24)受热分解的产物。通过查阅资料该小组同学通过网
C O
络查询得,草酸易溶于水,在175℃以上开始分解。他们猜想分解产物中的气体可能是CO、 CO2或它们的
..
混合物。
乙组的同学利用下图所示装置进行“猜想”的实验探究。已知: A 、C、F 中盛装澄清石灰水, B 中盛装浓 NaOH 溶液, D 中装有碱石灰, E 中装有 CuO。
气体
草酸受热
分解的实D E
验装置A B C F G
⑴证明分解产物中有 CO2的现象是;证明分解产物中有 CO 的现象是。
⑵ 讨论:小李同学继续查阅相关资料发现:草酸是二元弱酸,酸性比碳酸强,在受热分解过程中有少量
升华;草酸钙和草酸氢钙均为白色不溶物。小李通过进一步研究,对实验中CO2的检验提出质疑。试根据相关信息,指出原设计中存在的问题,并提出实验的改进措
施。。
四、(本题包括 3 小题,共20 分)
19.(6 分) (1)已知:在298K、 1.01 × 105Pa 下,由稳定的△ H(kJ ·mol -1)单质发
生反应生成 1mol 化合物的反应热叫该化合物的生成热
+ 154(△ H)。
右图为氧族元素氢化物a、b、c、d 的生成热数据示意图。试回答
下列问题:+ 81
0⑴ 写出氧族元素中含有18e -的两种氢化物的电子-20
式;。
- 242⑵请你归纳:非金属元素氢化物的稳定性与氢化物的反应
关系。
⑶硒化氢在上述条件下发生分解反应的热化学反应方程式为:a b
c
d氢化物
热△ H的
。
20.(8 分)在 537℃时,往容积可变的密闭容器中充入
2molSO 2(g )、1molO 2( g ),此时容器的体积为 200L ,
压强为
1.01×105Pa 。向容器中加入固体催化剂,并保持恒温恒压,发生反应:
2SO 2+O 2 2SO 3,达到
平衡时,平衡气体中 SO 3 的体积分数为 0.91。试回答下列问题:
(1)从理论上看,压强增大,平衡向正反应方向移动,
SO 2 的转化率增大。但工业上二氧化硫催化氧化
采用常压而不用高压,主要的原因是
。
( 2)保持上述温度和压强不变,若向容器中只充入
2molSO 3,并加入固体催化剂,则平衡时
SO 2 的体积分
数是
,此时平衡混合气体的体积是
。
( 3)温度仍保持 537℃,容器的体积保持 200L 不变。充入 amol SO 2 和 bmolO 2,并加入固体催化剂,反应
达到平衡时, SO 3 的体积分数仍为 ,体系压强为 5
= 。 0.91 1.01× 10 Pa 。若 a:b =2:1,则 a 21.( 6 分) (1)在某温度下, H 2O 的离子积常数为 1×10
-13
,则该温度下
①0.01mol/LNaOH 溶液的 pH=
。
②100mL 0.1mol/L H 2SO 4 溶液与 100mL 0.4mol/L 的 KOH 溶液混合后, pH=
。
( )①已知一溶液有
4 种离子:
X +、
Y 、 H +
、OH -
下列分析结果肯定错误的是(
)。
2
A .C Y ->C X +>C H +> C OH -
B .
C X +>C Y -> C OH ->C H + C .C H +>C Y ->C X +> C OH -
D .C OH ->C X +>C H +> C Y -
②把 0.02mol ·L -1CH 3COOH 溶液和 0.01mol ·L -1NaOH 溶液以等体积混合,则混合液中粒子浓度关系正
确的是(
)
+ B .C CH 3COOH > C
A .C CH COO < C Na
CH 3 COO
H +
3
-C CH
-1
C . = C
CH 3COO COOH D . C
CH COOH + C CH 3COO =0.01mol ·
L
2C
3
3
五、(本题包括 3 小题,共 18 分) 22.( 4 分)工业上制取 CuCl 2 的生产流程如下:
粗 CuO
浓 HCl
NaClO
CuO 沉淀 C
溶液 A
溶液 B
(含 FeO ) 加热、搅拌
过滤
溶液 D
溶液 E
CuO
CuCl 2
稍多量盐酸
充分洗涤
过滤
Cu(OH) 2
晶 体 低温蒸干 Cu(OH) 2
请结合下表数据,回答下列问题:
物 质
Fe(OH)2
Cu(OH)2 Fe(OH)3
溶度积/ 25℃
8.0×10-
× - 20 × - 38
16
2.2 10 4.0 10
完全沉淀时的 pH
≥9.6
≥ 6.4
3~ 4
范围
⑴ 向含有等浓度 Fe 2+
、 Cu 2+
、 Fe 3+
的混合溶液中滴加 NaOH 溶液,最先生成的沉淀是
。
⑵ 溶液 A 中加入 NaClO 的目的是
。
⑶ 在溶液 B 中加入 CuO 后过滤,这次过滤控制的条件是
。
⑷ 在 Cu(OH) 2 加入盐酸使 Cu(OH) 2 转变为 CuCl 2。采用多量盐酸和低温蒸干的目的 23、在一定条件下,由氢气和氧气反应生成
1mol 水蒸气放热 242.0kJ ,写出该反应的热化学方程
式:
) H
·-1
。(3 分)
H
若
2( ) 2(
= -44.0
(2 ) (2
)2(
)的
=
kJ
·
-1
,
H O g = H O l
kJ mol
,则反应 2H g +O g = 2H O l mol 那么氢气的燃烧热
H =
kJ
·mol -1 。
24、已知:(1)C (s )+ O 2(g )= CO 2(g ) H 1 = -393.5kJ/mol
(2)CO(g )+ 1/2 O 2 (g ) = CO (g ) H = -283.0kJ/mol )
2
2
求得: C (s )+1/2 O (g )= CO (g )
H =_______ kJ/mol (3 分)
2
3
25、反应 A(g)+B(g)
C(g)+D(g) 过程中的能量变化如图所示,回答下列问题。
(1) 该反应是 ___________________反应(填“吸热”“放热”);
(2) 当反应达到平衡时,升高温度, A 的转化率 ________(填“增大”“减小”“不变”) ;
(3) 在反应体系中加入催化剂,反应速率增大, E 2 的变化是 _________(填“增大”“减小”“不变”)。
2
FeO(s)+CO(g) △H<0,其平衡常数为 K
26、已知化学反应: Fe(s)+CO (g)
写出 K 的数学表达式。 K = ___________________ 。欲使平衡向逆方向进行,可采取的措施是 _____________。(4 分) A .减少 Fe 的量 B
.增加 FeO 的量
C
.移出部分 C02
D .提高反应温度
E .减小容器的容积
F .加入合适的催化剂
27、室温下, 0.01 mol/ L 的盐酸溶液的 pH 是_______, 0.01 mol/ L 的 NaOH 溶液的 pH 是 _______,
pH=3
6
的盐酸稀释 100 倍,所得溶液 pH 是_______,PH=12的 NaOH 溶液稀释 10 后 pH 是 _______。
28、指出下列溶液的酸碱性,如果能发生水解的,请写出盐水解的离子方程式:
(1)Na SO 溶液: _____性
。
2
4
(2)NH 4Cl 溶液: _____性 。 (3)AlCl 3 溶液: _____性 。 (4)Na 2SO 3 溶液: _____性 。 (5)NaHCO 3溶液: _____性
。
29、在氯化铁溶液中存在下列平衡:
FeCl 3 + H 2O
Fe(OH) 3 + HCl △H>0
(1)加热 FeCl 3 溶液,溶液颜色会不断加深, 可得到一种红褐色的透明液体, 其成份是 ____________;
(2)不断加热 FeCl 3 溶液,蒸干其水分,最终得到的固体是 _______________;
(3)在配制 FeCl 3 溶液时,为防止浑浊,应加入少量
______________。(1 分)
30、在稀氨水中存在如下平衡:
NH + H O
NH · H O
NH
+ -
+ -+
4 + OH
在下列情况下, NH ,NH
, OH ,H 的
3
2
3
2
3
4
浓度如何变化?(填“增大” “减小”“不变”)。
-
+
(1)加入少量 NH 4Cl 晶体: c(OH ) _______________ , c(NH 4 ) ____________ ;
(2)加入少量 HCl : c(NH 3)__________;
+
(3)加入少量 NaOH 晶体: c(H ) ____________ 。
31、在一定温度下,向密闭容器中加入 SO 2(g )、O 2(g ),发生反应: 2SO(g )+ O 2(g ) 2SO 3(g ),已知
SO 的起始浓度为 0.5mol/L 、O 的起始浓度为 0. 45mol/L ,经 10min 后反应达平衡时有 0.3mol/L SO
2
2
2
发生了转化。试计算:
(1)在 10min 内 O 2 的转化浓度为 _____________________________________;
(2)SO 2 的转化率为 _____________________________________;
人教版高中化学选修4第一章测试题(经典含解析)
人教版选修4第一章《化学反应与能量变化》测试题(A卷) (45分钟,100分) 一、单项选择题(每小题4分,共60分) 1.下列措施不能达到节能减排目的的是() A.利用太阳能制氢燃料B.用家用汽车代替公交车 C.利用潮汐能发电D.用节能灯代替白炽灯 2. 未来氢气将作为新能源的优点的是() ①燃烧时发生氧化反应②充分燃烧的产物不污染环境 ③氢气是一种再生能源④燃烧时放出大量热量 A. ①②③ B. ①②④ C. ①③④ D. ②③④ 3.下列变化过程,属于放热反应的是() ①液态水变成水蒸气②酸碱中和反应③浓H2SO4稀释 ④固体NaOH溶于水⑤ H2在Cl2中燃烧⑥弱酸电离 A、②③④⑤ B、②③④ C、②⑤ D、①③⑤ 4.下列对化学反应的认识错误的是() A.一定有化学键的变化B.一定会产生新的物质 C.一定有物质状态的变化D.一定伴随着能量的变化 5.25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是() A.2H2(g)+O2(g) == 2H2O(1) △H=―285.8kJ/mol B.2H2(g)+ O2(g) == 2H2O(1) △H=+571.6 kJ/mol C.2H2(g)+O2(g) == 2H2O(g) △H=―571.6 kJ/mol D.H2(g)+1/2O2(g) == H2O(1) △H=―285.8kJ/mol 6.热化学方程式C(s)+H2O(g) ==CO(g)+H2(g);△H =+131.3kJ/mol表示()A.碳和水反应吸收131.3kJ能量 B.1mol碳和1mol水反应生成一氧化碳和氢气,并吸收131.3kJ热量 C.1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ D.1个固态碳原子和1分子水蒸气反应吸热131.1kJ 7.已知25℃、101kPa条件下: 4Al (s) + 3O2 (g) == 2Al2O3 (s) △H = -2834.9 kJ·mol-1 4Al (s) +2O3 (g) ==2Al2O3 (s) △H = -3119.91 kJ·mol-1 由此得出的结论正确的是() A.等质量的O2比O3能量低,由O2变O3为吸热反应 B.等质量的O2比O3能量低,由O2变O3为放热反应
人教版高中化学选修四综合测试题及答案
高中化学学习材料 金戈铁骑整理制作 教材模块综合测试题 测试时间:120分钟试卷满分:150分 第Ⅰ卷(选择题,共64分) 一、单项选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题) 1.废弃的电子产品称为电子垃圾,其中含铅、汞等有害物质、危害严重。下列对电子垃圾处理应予提倡的是() ①将电子垃圾掩埋地下②改进生产工艺,减少有害物质使用③依法要求制造商回收废旧电子产品④将电子垃圾焚烧处理 A.①③B.②④C.②③D.①④ 2.下列实验指定使用的仪器必须预先干燥的是() ①中和热测定中所用的小烧杯②中和滴定中所用的滴定管③配制一定物质的量浓度溶液中所用的容量瓶④喷泉实验中用于收集氨气的烧瓶 A.①②B.②③C.①④D.③④ 3.在一定温度下,可逆反应2A (g)+B (g) C (g)+D (g)达到平衡的标志是() A.C的生成速率和B的消耗速率相等 B.v正(A)=2v正(B) C.2v正(A)=v逆(B) D.反应混合物中A、B、C、D的质量分数不再发生变化 4.某混合溶液中所含离子的浓度如下表,则M离可能为() 所含离子NO3-SO42-H+M 浓度/(mol·L-1) 2 1 2 1 A.Cl-B.Ba2+C.F-D.Mg2+ 5.强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)==H2O ( l ) ΔH=-57.3 kJ / mol,分别向1 L 0.5 mol / L的NaOH溶液中加入:①稀醋酸;②浓磷酸;③稀硝酸,恰好完全反应时热效应分别为ΔH1、ΔH2、ΔH3,它们的关系正确的是() A.ΔH1>ΔH2>ΔH2B.ΔH1<ΔH3<ΔH2 C.ΔH1=ΔH2=ΔH2D.ΔH1<ΔH3<ΔH2 6.下列事实中,不能用勒夏特列原理解释的是() A.对熟石灰的悬浊液加热,悬浊液中固体质量增加 B.实验室中常用排饱和食盐水的方式收集氯气 C.打开汽水瓶,有气泡从溶液中冒出 D.向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 7.下列叙述中,正确的是() ①锌跟稀硫酸反应制取氢气,加入少量CuSO4溶液能提高反应速率②镀层破损后,白铁(镀锌的铁)比
化学选修4期中考试试题(含答案)
化学选修4期中考试试题(二) 相对原子质量:H—1 C—12 O—16 N—14 一.选择题: 1.对于放热反应2H2(g)+O2(g)= 2H2O(l),下列说法正确的是A.产物H2O所具有的总能量高于反应物H2和O2所具有的总能量 B.反应物H2和O2所具有的总能量高于产物H2O所具有的总能量 C.反应物H2和O2所具有的总能量等于产物H2O所具有的总能量 D.反应物H2和O2比产物H2O稳定 2.升高温度能加快反应速率的主要原因是 A.活化分子的能量明显增加 B.降低了反应的活化能 C.增加了活化分子的百分数 D.改变了化学反应的能量变化 3.已知H2(g)+Cl2(g)= 2HCl(g)⊿H= —184.6 kJ/mol ,则反应HCl(g)=1/2 H2(g)+1/2Cl2(g)的⊿H为 A.+184.6 kJ/mol B.—92.3 kJ/mol C.—369.2 kJ/mol D.+92.3 kJ/mol 4.已知反应A+3B=2C+D在某段时间内以A的浓度变化表示的反应速率为1mol/(L ·min),则此段时间内以C的浓度变化表示的化学反应速率为 A.0.5 mol/(L ·min) B.1 mol/(L ·min) C.2 mol/(L ·min) D.3 mol/(L ·min) 5.如图,横坐标表示加水量,纵坐标表示导电能力,能表示冰醋酸(即无水醋酸)加水稀释的图是 6.体积相同、pH相同的HCl溶液和CH3COOH溶液,与NaOH溶液中和时两者消耗NaOH的物质的量 A.中和CH3COOH的多B.中和HCl的多 C.相同D.无法比较 7.一定温度下, 向aL的密闭容器中加入2molNO2(g), 发生如下反应:2NO22NO+O2,此反应达到平衡的标志是 A.单位时间内生成2nmolNO同时生成2nmolNO2 B.混合气体中NO2、NO和O2的物质的量之比为2:2:1 C.单位时间内生成2nmolNO同时生成nmolO2 D.混合气体的颜色变浅 8.下列不属于自发进行的变化是 A.红墨水加到清水使整杯水变红B.冰在室温下融化成水
(最新整理)化学选修四测试题
(完整)化学选修四测试题 编辑整理: 尊敬的读者朋友们: 这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((完整)化学选修四测试题)的内容能够给您的工作和学习带来便利。同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。 本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(完整)化学选修四测试题的全部内容。
第二章《化学反应速率与化学平衡》单元检测试题 一、选择题(本题包括16小题,每小题3分,共48分。) 1.在2A+B 3C+4D反应中,表示该反应速率最快的是 A.v(A)=0。5 mol·L-1·s-1 B.v(B)=0.3 mol·L-1·s-1 C.v(C)=0。8 mol·L-1·s-1 D.v(D)=1 mol·L-1·s-1 2.下列说法正确的是 A.增大反应物浓度,可增大单位体积内活化分子百分数,从而使有效碰撞次数增大 B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率 3.在2升的密闭容器中,发生以下反应:2A(气)+B(气) 2C气+D(气)。若最初加入的A和B都是4mol,在前10秒钟A的平均反应速度为0。12 mol·L-1·s-1,则10秒钟时,容器中B的物质的量是 A.1.6 mol B.2.8 mol C.2.4 mol D.1。2 mol 4.下列变化过程中,ΔS<0的是 A.氯化钠溶于水中 B.NH3(g)和HCl(g)反应生成NH4Cl C.干冰的升华D.CaCO3(S)分解为CaO(S)和CO2(g) 5.在一定温度不同压强(P 1<P2=下,可逆反应2X(g) 2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是
高二化学选修四 盐类的水解测试题二
高二化学选修四盐类的水解测试题二 班级姓名学号 一、选择题 1.下列关于FeCl3水解的说法错误的是 ( ) A.水解达到平衡时(不饱和),加氯化铁达饱和溶液,溶液的酸性会增强 B.浓度为5 mol/L和0.5 mol/L的两种FeCl3溶液,其他条件相同时,Fe3+的水解程度前者比后者小 C.有50℃和20℃的同浓度的两种FeCl3稀溶液,其他条件相同时,Fe3+的水解程度前者比后者小 D.为抑制Fe3+的水解,较好地保存FeCl3溶液,应加少量盐酸 2.正常人胃液的pH在0.3~1.2之间,胃酸(一般以盐酸表示)多了需要治疗。某些用以治疗胃酸过多的药物中含MgCO3、NaHCO3,也有用酒石酸钠来治疗的。这说明 ( ) A.碳酸、酒石酸都不是强酸 B.对人而言,酒石酸是营养品 C.MgCO3、NaHCO3与胃酸作用产生CO2,在服药后有喝汽水的舒服感 D.酒石酸钠水解显酸性 3.能使电离平衡H 2O H++OH-向右移动,且使溶液呈酸性的是 ( ) A.向水中加入少量硫酸氢钠固体 B.向水中加入少量硫酸铝固体 C.向水中加入少量碳酸钠固体 D.将水加热到100℃,使水的pH=6 4.有①Na2CO3溶液;②CH3COONa溶液;③NaOH溶液各25 mL,物质的量浓度均为0.1 mol/L,下列说法正确的是 ( ) A.3种溶液pH的大小顺序是③>②>① B.若将3种溶液稀释相同倍数,pH变化最大的是② C.若分别加入25 mL 0.1 mol/L盐酸后,pH最大的是① D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② 5.恒温条件下,在CH3COONa稀溶液中分别加入少量下列物质:①固体NaOH;②固体KOH; ③固体NaHSO4;④固体CH3COONa;⑤冰醋酸。其中一定可使c(CH3COO-)/c(Na+)比值增
人教版高中化学选修四《电化学》测试题
湖北黄石二中《电化学》测试题 满分:110分 时限:90分钟 高存勇 2011.11 选择题每小题只有一个正确答案 1. 如图所示的装置,通电一段时间后,测得甲池中某电极 质量增加2.16 g ,乙池中某电极上析出0.24 g 某金属,下 列说法正确的是 A.甲池是b 极上析出金属银,乙池是c 极上析出某金属 B.甲池是a 极上析出金属银,乙池是d 极上析出某金属 C.某盐溶液可能是CuSO 4溶液 D.某盐溶液可能是Mg(NO 3)2溶液 2.(2011山东)以KCl 和ZnCl 2混合液为电镀液在铁制品上镀锌,下列说法正确的是 A.未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程 B.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系 C.电镀时保持电流恒定,升高温度不改变电解反应速率 D.镀锌层破损后对铁制品失去保护作用 3.(2011新课标全国)铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni 2O 3+3H 2O= Fe(OH)2+2Ni(OH)2 。下列有关该电池的说法不正确... 的是 A. 电池的电解液为碱性溶液,正极为Ni 2O 3、负极为Fe B. 电池放电时,负极反应为Fe+2OH --2e -=Fe (OH )2 C. 电池充电过程中,阴极附近溶液的pH 降低 D. 电池充电时,阳极反应为2Ni (OH )2+2OH --2e -=Ni 2O 3+3H 2O 4.(2011全国II 卷)用石墨做电极电解CuSO 4溶液。通电一段时间后,欲使用电解液恢复到起始状态,应向溶液中加入适量的 A .CuSO 4 B .H 2O C .CuO D .CuSO 4·5H 2O 5.(2011上海)用电解法提取氯化铜废液中的铜,方案正确的是 A .用铜片连接电源正极,另一电极用铂片 B .用碳棒连接电源正极,另一电极用铜片 C .用氢氧化钠溶液吸收阴极产物 D .用带火星的木条检验阳极产物 6. (2011海南)一种充电电池放电时的电极反应为:H 2+2OH --2e -=2H 2O ;NiO(OH) +H 2O+e - =Ni(OH)2+OH - 。当为电池充电时,与外电源正极连接的电极上发生的反应是 A. H 2O 的还原 B. NiO(OH)的还原 C. H 2的氧化 D. Ni(OH) 2的氧化 7.(2011海南)根据下图,下列判断中正确的是 A.烧杯a 中的溶液pH 升高 B.烧杯b 中发生还原反应 C.烧杯a 中发生的反应为2H ++2e -=H 2 D.烧杯b 中发生的反应为2Cl --2e -=Cl 2 8.(2010浙江卷)Li-Al/FeS 电池是一种正在开发的车载电池,该电 池中正极的电极反应式为: 2Li ++FeS+2e -=Li 2S+Fe 有关该电 池的下列中,正确的是 A. Li-Al 在电池中作为负极材料,该材料中Li 的化合价为+1价 B. 该电池的电池反应式为:2Li+FeS =Li 2S+Fe C. 负极的电极反应式为Al-3e -=Al 3+ D. 充电时,阴极发生的电极反应式为:2Li s+Fe-22e Li FeS -+=+ 9.(2011安徽高考)研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间 含盐量差别进行发电,在海水中电池总反应可表示为:5MnO 2+2Ag +2NaCl=Na 2Mn 5O 10+2AgCl ,下列“水” 电池在海水中放电时的有关说法正确的是: A. 正极反应式:Ag +Cl --e -=AgCl B. 每生成1 mol Na 2Mn 5O 10转移2 mol 电子 C. Na +不断向“水”电池的负极移动 D. AgCl 是还原产物
人教版高中化学选修四高二化学期末测试题
高中化学学习材料 (精心收集**整理制作) 高二化学期末测试题 第一卷选择题(共50分) 一、选择题(本题包括15小题,每小题2分,共30分。每小题只有一个 ....选项符合题意) 1、下列叙述正确的是 A、在原电池的负极和电解池的阴极上都是发生失电子的氧化反应 B、用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 C、用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH D、镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 2、已知:①1 mol H2分子中化学键断裂时需要吸收436kJ的能量 ②1 mol Cl2分子中化学键断裂时需要吸收243kJ的能量 ③由H原子和Cl原子形成1 mol HCl分子时释放431kJ的能量 下列叙述正确的是 ( ) A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)=2HCl(g) B.氢气和氯气反应生成2 mol氯化氢气体,反应的△H=183kJ/mol C.氢气和氯气反应生成2 mol氯化氢气体,反应的△H=-183kJ/mol D.氢气和氯气反应生成1 mol氯化氢气体,反应的△H=-183kJ/mol 3、铅蓄电池放电时发生下列变化: 负极:Pb +SO42―-2e-== PbSO4↓正极:PbO2 + 4H++ SO42―+ 2e-==PbSO4↓+ 2H2O 使用该电池电解CuSO4溶液,要得到纯铜1.6g,这时铅蓄电池消耗H2SO4的物质的量为 ( ) A. 0.025mol B. 0.05mol C. 0.1mol D. 0.2mol 4、在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是 ( ) A.CH3OH(l)+3/2O2(g) CO2(g)+2H2O(l)△H=+725.8 kJ/mol B.2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l)△H=-1452 kJ/mol C.2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l)△H=-725.8 kJ/mol
(新人教版)高二化学选修4期中考试试题附答案
(新人教版)高二化学选修4期中考试试题附答案 可能用到的相对原子质量: H 1 C 12 N 14 O 16 Na 23 Al 27 S 32 Cl 一、单项选择题(本题包括9小题,每小题3分,共27分。每小题只是一个 ....选项符合题意)1、在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热 kJ,下列热化学方程式正确的是() (l)+O2(g)===CO2(g)+2H2O(l);ΔH=+ kJ/mol (l)+3O2(g)===2CO2(g)+4H2O(l);ΔH=-1452 kJ/mol (l)+3O2(g)===2CO2(g)+4H2O(l);ΔH=- kJ/mol (l)+3O2(g)===2CO2(g)+4H2O(l);ΔH=+1452 kJ/mol 2、已知反应:①101kPa时,2C(s)+O2(g)==2CO(g);ΔH=-221 kJ/mol ②稀溶液中,H+(aq)+OHˉ(aq)==H2O(l);ΔH= kJ/mol 下列结论正确的是 A.碳的燃烧热大于 kJ/mol B.①的反应热为221 kJ/mol C.稀硫酸与稀NaOH溶液反应的中和热为 kJ/mol D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出 kJ热量 3、将a g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所示。在相同的条件下,将b g(a>b)粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是() 4.在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)1/2N2(g)+CO2(g);ΔH=- kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( ) A 加催化剂同时升高温度 B 加催化剂同时增大压强 C 升高温度同时充入N2 D 降低温度同时增大压强 5、对可逆反应4NH3(g) + 5O2(g) 4NO(g) + 6H2O(g),下列叙述正确的是 A.达到化学平衡时,4v正(O2) = 5v逆(NO) B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
(完整版)高二化学选修四练习题及其参考答案(完整版)
《原电池》练习题 选择题 1.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是A.在AgCl悬浊液中加入KI溶液充分振荡Ag+ + I- = AgI↓ B.氢氧燃料电池的负极反应式:O2 + 2H2O+ 4e- == 4OH- C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu2++2e-== Cu D.钢铁发生电化腐蚀的正极反应式:Fe -2e-== Fe2+ 2.常温时,将两种溶液等体积混合,其中溶液pH一定或可能等于7的情况共有 ①pH=2盐酸和pH=12 NaOH溶液②pH=2醋酸和pH=12 NaOH溶液 ③pH=2盐酸和pH=12氨水④pH=2某酸和pH=12 NaOH溶液 ⑤pH=2盐酸和pH=12某碱溶液⑥pH=2硫酸和pH=12 NaOH溶液 ⑦pH=2盐酸和pH=12 Ba(OH) 2溶液⑧pH=2硫酸和pH=12 Ba(OH) 2 溶液 A.5种B.6种 C.7种 D.8种 3.下列各组离子一定能大量共存的是 A.在含大量Fe3+的溶液中:NH4+、Na+、Cl—、SCN— B.在强碱溶液中:Na+、K+、AlO2—、CO32— C.在c(H+)=10—13mol/L的溶液中:NH4+、Al3+、SO42—、NO3— D.在pH=1的溶液中:K+、Fe2+、Cl—、NO3— 4.物质的量浓度相同的三种盐NaX、NaY、NaZ溶液,其pH依次为7、8、9。下列有关说法正确的是A.HX、HY、HZ三种酸的酸性由强到弱的顺序为HZ>HY>HX B.HX是强酸,HY、HZ是弱酸,且HY的酸性强于HZ C.X-、Y-、Z-三种酸根均能水解,且水解程度Z->Y->X- D.三种盐溶液中X-、Y-、Z-的浓度大小顺序为c(Z-)>c(Y-)>c(X-) 5.一定温度下,将a mol PCl 5通入一个容积不变的密闭容器中,发生反应:PCl5(g) PCl3(g)+Cl2(g),平衡时测得混合气体的压强为p1,此时向容器中再通入a mol PCl5,在相同温度下再次达到平衡时,测得压强为p2,下列判断正确的是 A.2p1>p2B.PCl5的分解率增大C.p1>p2D.Cl2的体积分数增大
高二化学选修4全册综合测试题
T 2P 1 T 2P 2 T 1P 1 t 0 n (Z 2012-2013学年度第一学期期末高二化学试卷 考试时间:90分钟 考试分值:100分 参考相对原子量:H:1 Na:23 Mg:24 Al:27 Fe:56 K:39 Cu:64 Ag:108 C:12 O:16 S:32 Cl:35.5 第Ⅰ卷 选择题(共50分) 一、选择题(每小题只有一个正确选项,每题2分,共50分) 1、改变下列一个条件,通过提高活化分子的百分率来提高反应速率的是 A.加热 B.加压 C.加负催化剂 D.加大反应物浓度 2、用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是 A .加热 B .不用稀硫酸,改用98%浓硫酸 C .滴加少量CuSO 4溶液 D .不用铁片,改用铁粉 3、下列变化的熵变大于零的是 A .H 2O(l) H 2O(g) B .CO 2(g) CO 2(s) C .NaOH(aq)+HCl(aq) = NaCl(aq)+H 2O D .NH 3(g)+HCl(g)=NH 4Cl(s) 4、在一定温度下的定容密闭容器中,当下列物理量不再改变时,不能表明反应 A(s)+2B(g) C(g)+D(g)已达平衡的是 A .混合气体的压强 B .混合气体的密度 C .混合气体的相对分子质量 D .C 气体的总物质的量浓度 5、已知反应X+Y= M+N 为放热反应,,对该反应的下列说法中正确的 A 、X 的能量一定高于M B 、Y 的能量一定高于N C 、X 和Y 的总能量一定高于M 和N 的总能量 D 、因该反应为放热反应,故不必加热就可发生 6、下列事实不能用勒夏特列原理解释的是 A .将氯化铁溶液加热蒸干最终得不到氯化铁固体 B .钢铁在潮湿的空气中容易生锈 C .温度过高对合成氨不利 D .常温下,将1mLpH=3的醋酸溶液加水稀释至l00mL ,测得其pH<5 7、在一支25mL 的酸式滴定管中盛入0.1mol/L HCl 溶液,其液面恰好在5mL 刻度处。若把滴定管内溶液全部放入烧杯中,再用0.1mol/L NaOH 溶液进行中和,则所需NaOH 溶液的体积 为 A .大于20mL B .小于20mL C .等于20mL D .等于5mL 8、强酸和强碱在稀溶液中的中和热可表示为: H +(aq)+OH -(aq)=H 2O(l); △H= -57.3 kJ ·mol -1 ,又知在溶液中反应有: CH 3COOH(aq)+NaOH(aq)=CH 3COONa(aq)+H 2O(l); △H=-Q 1kJ ·mol -1 , 12-H 2SO 4(浓)+NaOH(aq)=12-Na 2SO 4 (aq)+H 2O(l) ; △H= -Q 2 kJ ·mol -1 HNO 3(aq)+KOH(aq)KNO 3(aq )+H 2O(l) ; △H= -Q 3 kJ ·mol -1 , 则Q 1、Q 2、Q 3的关系正确的是 ( ) A. Q 1 = Q 2 = Q 3 B.Q 2 > Q 1 > Q 3 C. Q 2 > Q 3 > Q 1 D. Q 2 = Q 3 > Q 1 9、为了除去MgCl 2酸性溶性中的Fe 3+,可在加热搅拌的条件下加入一种试剂,过滤后再加入适量盐酸. 这种试剂是 A.NH 3·H 2O B.NaOH C.Na 2CO 3 D.MgCO 3 10、分别放置在下图所示装置(都盛有0.1 mol ·L -1 的H 2SO 4溶液)中的四个相同的纯锌片,腐蚀最慢的 是 11、反应2X (g )+Y (g ) 2Z (g );△H<0(正反应为放热反应)。在不同温度(T 1和T 2)及压强(P 1 和P 2)下,产物Z 的物质的量[n (Z )]与反应时间(t )的关系如图所示。则下列判断正确的是 A .T 1 第一章《化学反应与能量》测试题 本试卷分第一部分(选择题)和第二部分(非选择题),满分100分,考试时间45分钟。 第一部分 选择题(共36分) 一、选择题(每小题只有..1.个.选项符合题意。每小题4分,共24分) 1.根据以下3个热化学方程式: 2H 2S(g)+3O 2(g)=2SO 2(g)+2H 2O(l) △H =Q 1 kJ/mol 2H 2S(g)+O 2(g)=2S (s)+2H 2O(l) △H =Q 2 kJ/mol 2H 2S(g)+O 2(g)=2S (s)+2H 2O(g) △H =Q 3 kJ/mol 判断Q 1、Q 2、Q 3三者关系正确的是( ) A . Q 1>Q 2>Q 3 B . Q 1>Q 3>Q 2 C . Q 3>Q 2>Q 1 D . Q 2>Q 1>Q 3 2.下列各组热化学方程式中,化学反应的△H 前者大于后者的是 ①C(s)+O 2(g)=CO 2(g);△H 1 C(s)+1/2O 2(g)=CO(g);△H 2 ②S(s)+O 2(g)=SO 2(g);△H 3 S(g)+O 2(g)=SO 2(g);△H 4 ③H 2(g)+1/2O 2(g)=H 2O(l);△H 5 2H 2(g)+O 2(g)=2H 2O(l);△H 6 ④CaCO 3(s)=CaO(s)+CO 2(g);△H 7 CaO(s)+H 2O(l)=Ca(OH)2(s);△H 8 A .① B .④ C .②③④ D .①②③ 3.已知H 2(g)+Cl 2(g)=2HCl(g) △H = ―184.6kJ ·mol -1 , 则反应HCl(g)=1/2H 2(g)+1/2Cl 2(g)的△H 为 ( ) A .+184.6kJ ·mol -1 B .―92.3kJ ·mol -1 C .+92.3kJ D . +92.3kJ ·mol -1 4.已知热化学方程式:①CO (g ) + 2 1O 2 (g )=CO 2 (g ) ΔH=-283.0kJ ·mol -1 ②H 2(g ) +2 1O 2 (g ) =H 2O (g );ΔH=-241.8 kJ ·mol -1 则下列说法正确的是 ( ) A .H 2的燃烧热为241.8kJ ·mol -1 B .由反应①、②可知右图所示的热化学方程式为 CO (g )+H 2O (g )=CO 2(g )+H 2(g ) ΔH=-41.2 kJ ·mol -1 C .H 2(g )转变成H 2O (g )的化学反应一定要释放能量 D .根据②推知反应H 2(g ) + 2 1O 2 (g ) =H 2O (l ); ΔH >-241.8 kJ ·mol -1 高中化学选修4第三章测试题 一、选择题:(本题包括16小题,共48分) 1.水是一种极弱的电解质,在室温下,平均每n个水分子中只有1个水分子发生了电离,则n的值是()A.1×10-14B.55.6×107C.107D.55.6 2.下列溶液一定是碱性的是()A.pH=8的某电解质的溶液 B.c(OH-)>1×10-7mol/L C.溶液中含有OH-D.溶液中c(OH-)>c(H+) 3.已知某温度下,四种一元弱酸的电离平衡常数为:K a(HCN)=6.2×10-10mol/L、K a(HF)=6.8×10-4 mol/L、K a(CH3COOH)=1.8×10-5mol/L、K a(HNO2)=6.4×10-6mol/L。物质的量浓度都为0.1 mol/L 的下列溶液中,pH最小的是()A.HCN B.CH3COOH C.HF D.HNO2 4.0.1 mol/L K2CO3溶液中,若使c(CO32-)更接近0.1 mol/L,可采取的措施是()A.加入少量盐酸B.加KOH固体C.加水D.加热 5.在已达到电离平衡的0.1mol/L的醋酸溶液中,欲使平衡向电离的方向移动,同时使溶液的pH 降低,应采取的措施是()A.加少量盐酸B.加热C.加少量醋酸钠晶体D.加少量水6.将足量的BaCO3粉末分别加入下列溶液中,充分溶解至溶液饱和。各溶液中Ba2+的浓度最小的为()A.10 mL 0.2 mol/LNa2CO3溶液B.40 mL水 C.50 mL 0.01 mol/L 氯化钡溶液D.100 mL 0.01 mol/L盐酸 7.下列有关滴定操作的顺序正确的是() ①检查滴定管是否漏水;②用蒸馏水洗涤玻璃仪器;③用标准溶液润洗盛装标准溶液的滴定管, 用待测液润洗盛待测液的滴定管;④装标准溶液和待测液并调整液面(记录初读数);⑤取一定体积的待测液于锥形瓶中;⑥滴定操作 A.①③②④⑤⑥B.①②③④⑤⑥C.②③①④⑤⑥D.④⑤①②③⑥ 8.要使K2S溶液中[K+]/[S2-]的比值变小,可加入的物质是()A.适量盐酸B.适量NaOH溶液C.适量KOH溶液D.适量KHS溶液 9.在Ca(OH)2(K sp=5.5×10-6)、Mg(OH)2(K sp=1.2×10-11)、AgCl(K sp=1.56×10-10)三种物质中,下列说法正确的是()A.Mg(OH)2的溶解度最小B.Ca(OH)2的溶解度最小 C.AgCl的溶解度最小D.同下Ksp越大的溶解度也越大 10.在室温下,等体积的酸和碱的溶液混合后,pH一定少于7的是()A.pH=3的HNO3跟pH=11的KOH B.pH=3的盐酸跟pH=11的氨水 C.pH=3硫酸跟pH=11的NaOH D.pH=3的醋酸跟pH=11的Ba(OH)2 欢迎来主页下载---精品文档 2017-2018学年度高二月考测试题 考试时间:90分钟考试分值:100分 参考相对原子量:H:1 Na:23 Mg:24 Al:27 Fe:56 K:39 Cu:64 Ag:108 C:12 O:16 S:32 Cl:35.5 第Ⅰ卷选择题(共60分) 一、选择题(每小题只有一个正确选项,每题3分,共60分) 1、在25℃、101 kPa下,1 g甲醇燃烧生成CO和液态水时放热22.68 kJ,下列热化学方程式2 正确的是( B ) H=+725.8 kJ/mol Δ(l);===CO(g)+2HOA.CHOH(l)O+(g)2223H=-);Δ1452 kJ/mol )+4HO (l(B.2CHOH(l)+3O(g)===2COg2322H=-Δ725.8 kJ/mol O)+4H(l);(l)+3O(g)===2CO (gOHC.2CH2232H=+1452 kJ/mol);Δ)+4HO(l(l)+3O(g)===2CO(gD.2CHOH22232、已知反应: ①101kPa时,2C(s)+O(g)==2CO(g);ΔH=-221 kJ/mol H(aq)+OHˉ(aq)==HO(l);ΔH=-57.3 kJ/mol 2下列结论正确的是(A) 2+②稀溶液中, A.碳的燃烧热大于110.5 kJ/mol B.①的反应热为221 kJ/mol C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 3.将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应: 2C(气)。若经2 s(秒)后测得C+B的浓度为0.6 mol·L,现有下2A(气)列几种说 1-(气) 法: A表示的反应平均速率为0.3 mol·L·s -1-1①用物质 B表示的反应的平均速率为0.6 mol·L·s -1-1②用物质 ③2 s时物质A的转化率为70% 2 s时物质B的浓度为0.7 mol·L -1④ 其中正确的是(B ) A.①③ B.①④ C.②③ D.③④ 4、改变下列一个条件,通过提高活化分子的百分率来提高反应速率的是( A) A.加热 B.加压 C.加负催化剂 D.加大反应物浓度 5、用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是(B) A.加热 B.不用稀硫酸,改用98%浓硫酸 C.滴加少量CuSO溶液 D.不用铁片,改用铁粉46、在一定温度下的定容密闭 容器中,当下列物理量不再改变时,不能表明反应 A(s)+2B(g) C(g)+D(g)已达平衡的是( A) A.混合气体的压强 B.混合气体的密度 C.混合气体的相对分子质量 D.C气体的总物质的量浓度 CO(g)1/2N(g)+CO(7.在密闭容器中,一定条件下,进行如下反应:NO(g)+g);22ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( B ) A 加催化剂同时升高温度 B 加催化剂同时增大压强 C 升高温度同时充入N D 降低温度同时增大压强2精品文档. 欢迎来主页下载---精品文档 2013—2014学年度第一学期学分认定考试 高二化学试题 注意事项: 1.本试卷分为第I卷(选择题)和第II卷(非选择题)两部分,考试时间100分钟,满分100 分。 2.答第Ⅰ卷前,考生务必将自己的姓名、准考证号、考试科目、试卷类型用铅笔涂写在答题 卡上。 3. 请将第I卷的答案用2B铅笔涂到答题卡,将第II卷的答案用黑色中性笔答在规定位置 处。 可能用到的相对原子质量: H-1 C-12 O-16S-32 N-14Na-23Al-27 第Ⅰ卷(选择题共54分) 一、选择题(每个小题只有一个答案,共18个题,每题3分,共54分) 1.为了保护环境,下列做法不可取的是() ①开发新能源,减少矿物燃料的燃烧②关闭所有的化工企业③提倡使用一次性发泡塑料餐具和塑料袋④开发、生产无汞电池⑤机动车安装尾气净化器 A.①②③ B.③④⑤ C.①④ D.②③2.下列说法错误的是( ) A.碱性锌锰电池是二次电池 B.铅蓄电池是二次电池 C.二次电池又叫蓄电池,它放电后可以再充电使活性物质获得再生 D.燃料电池的活性物质没有储存在电池内部 3.化学电池可以直接将化学能转化为电能,化学电池的本质是 () A .化合价的升降 B . 电子的转移?C.氧化还原反应 D .电能的储存 4. 下列物质中,属于强电解质的是( ) A. 2CO ?? B. NaOH 溶液?? C. O H NH 23 D. HCl 5.升高温度,下列数据不一定增大的是( ) A. 化学反应速率v ? B. 3KNO 的溶解度S C. 化学平衡常数K ? D. 水的离子积常数W K 6. 下列式子中,属于水解反应的是( ) A .H 2O+H 2O H3O ++O H― ? B.C O32―+H 2O H CO3―+OH ― C .N H3+H 2O NH 3·H 2O?? D .HCO 3—+ OH ― H 2O+CO32― 7.反应A (g)+3B(g)2C(g )+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( ) A .v (C)=0.04m ol·(L·s)-1 B .v (B )=0.06mol·(L·s )-1 C.v (A)=0.03mo l·(L·s)-1 D.v (D)=0.01m ol·(L·s)-1 8.下列事实中,不能用勒夏特列原理解释的是( ) A.对熟石灰的悬浊液加热,悬浊液中固体质量增加 B .实验室中常用排饱和食盐水的方式收集氯气 C.打开汽水瓶,有气泡从溶液中冒出 D.向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 9.在下列的各种叙述中,正确的是( ) A.在任何条件下,纯水的PH=7 B.在任何条件下,纯水都呈中性 C.在100℃时,纯水的PH>7 D.在100℃时,纯水中c(H+)<10-7mol /L 10.在0.1 mo l·L -1 C H3CO OH溶液中存在如下电离平衡: CH 3CO OH C H3C OO -+H + 对于该平衡,下列叙述正确的是( ) A.加入水时,平衡向逆反应方向移动 B.加入少量NaOH 固体,平衡向正反应方向移动 高中化学选修四测试题 本试卷分为第I 卷(选择题)和第II 卷(非选择题)两部分。考试用时120分钟。满分为150分。 注意事项:1.可能用到的相对原子质量:H-1 C-12 O-16 Cu-64 2.第I 、II 卷答案务必写在答题卷上。 第Ⅰ卷(共70分) 一、选择题(本题包括15小题,每小题2分,共30分。每小题只有一个选项符合题意) 1、已知反应X+Y= M+N 为放热反应,,对该反应的下列说法中正确的 ( ) A 、X 的能量一定高于M B 、Y 的能量一定高于N C 、X 和Y 的总能量一定高于M 和N 的总能量 D 、因该反应为放热反应,故不必加热就可发生 2、在pH=1的无色溶液中,下列离子能大量共存的是 ( ) A .NH 4+、Ba 2+、NO 3—、CO 32— B .Fe 2+、OH —、SO 42—、MnO 4 — C .K +、Mg 2+、NO 3-、SO 42— D .Na +、Fe 3+、Cl —、AlO 2— 3、在密闭容器里,A 与B 反应生成C ,其反应速率分别用A v 、B v 、C v 表示,已知2B v =3A v 、3C v =2B v ,则此反应可表示为 ( ) A 、2A+3B=2C B 、A+3B=2 C C 、3A+B=2C D 、A+B=C 4、下列说法正确的是 ( ) A 、可逆反应的特征是正反应速率和逆反应速率相等 B 、在其他条件不变时,使用催化剂只能改变反应速率,而不能改变化学平衡状态 C 、在其他条件不变时,升高温度可以使平衡向放热反应方向移动 D 、在其他条件不变时,增大压强一定会破坏气体反应的平衡状态 5、相同温度下等物质的量浓度的下列溶液中,pH 值最小的是 ( ) A .Cl NH 4 B .34HCO NH C .44HSO NH D .424SO )(NH 6、下列说法正确的是 ( ) A 、物质的溶解性为难溶,则该物质不溶于水 B 、不溶于水的物质溶解度为0 C 、绝对不溶解的物质是不存在的 D 、某离子被沉淀完全是指该离子在溶液中的浓度为0 7、化学电池可以直接将化学能转化为电能,化学电池的本质是 ( ) A .化合价的升降 B . 电子的转移 C .氧化还原反应 D .电能的储存 8、随着人们生活质量的不断提高,废电池必须集中处理的问题被提到议事日程,首要原因是 ( ) A 、利用电池外壳的金属材料 B 、防止电池中汞、镉和铅等重金属离子对土壤和水源的污染 C 、不使电池中渗泄的电解液腐蚀其他物品 D 、回收其中石墨电极 9、在一密闭容器中进行如下反应:2SO 2(气)+O 2(气)2SO 3(气),已知反应过程中某一时刻SO 2、O 2、SO 3的浓度分别为0.2mol/L 、0.1mol/L 、0.2mol/L ,当反应达平衡时,可能存在的数据是 ( ) A .SO 2为0.4mol/L 、O 2为0.2mol/L B .SO 2为0.25mol/L C .SO 2、SO 3均为0.15mol/L D .SO 3为0.4mol/L 10、下列对化学平衡移动的分析中,不正确... 的是 ( ) ①已达平衡的反应C (s )+H 2O (g ) CO (g )+H 2(g ),当增加反应物物质的量时,平衡一定向正反应方向移动 ②已达平衡的反应N 2(g )+3H 2(g ) 2NH 3(g ),当增大N 2的浓度时,平衡向正反应方向移动,N 2的转化率一定升高 ③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动 ④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动 A .①④ B .①②③ C .②③④ D .①②③④ 11、可以充分说明反应P (g )+Q (g ) R (g )+S (g )在恒温下已达到平衡的是 ( ) A .反应容器内的压强不随时间改变 B .反应容器内P 、Q 、R 、S 四者浓度之比为1:1:1:1 C .P 的生成速率和S 的生成速率相等 D .反应容器内的气体总物质的量不随时间变化 12、设C +CO 22CO -Q 1(吸热反应)反应速率为 υ1,N 2+3H 22NH 3+Q 2(放热反应)反应速率为 υ2,对于上述反应,当温 度升高时,υ1和υ2的变化情况为 ( ) A 、 同时增大 B 、同时减小 C 、增大,减小 D 、减小,增大 13、在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明化学平衡移动的是 ( ) A.反应混合物的浓度 B. 反应体系的压强 C.正、逆反应的速率 D. 反应物的转化率 14、可以将反应Zn+Br 2 = ZnBr 2设计成蓄电池,下列4个电极反应 ①Br 2 + 2e - = 2Br - ②2Br - - 2e - = Br 2 ③Zn – 2e - = Zn 2+ ④Zn 2+ + 2e - = Zn高二化学选修四第一章测试题(精选.)
(完整版)高中化学选修4第三章测试题
高二化学选修4测试题及答案
高中化学选修四期末测试题
(完整版)高中化学选修四测试题
