标准溶液配制记录表
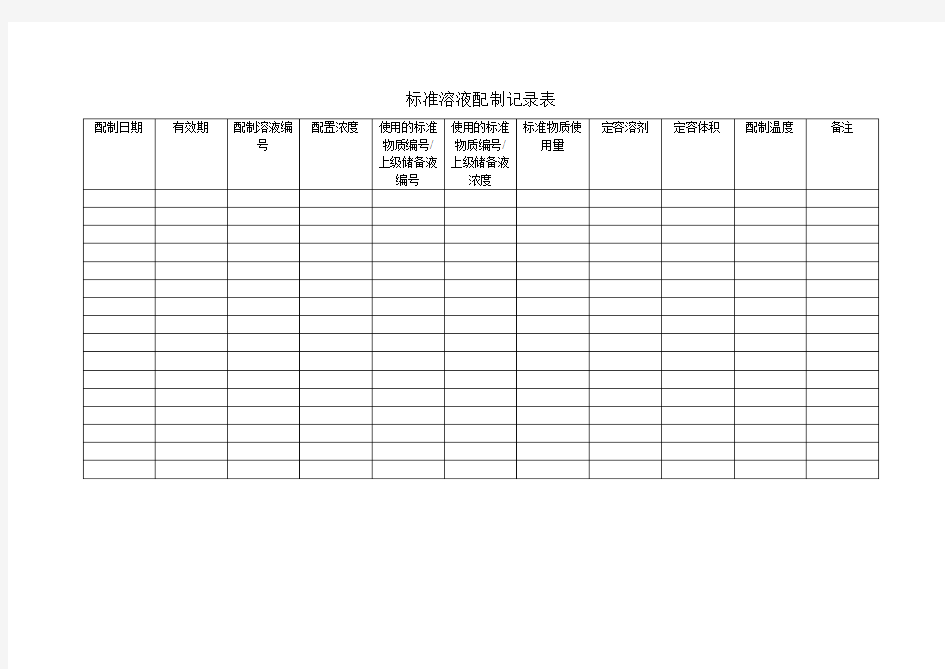
标准溶液配制记录表
标准溶液‘配制’及‘标定’原始记录
标准溶液‘配制’及‘标定’原始记录 配制人:标定:复标:审核:
标准物质配制(标定)记录 编号: CHEC/QBG-075 名称:、配制方法: 使用天平型号编号室温℃、湿度%RH 配制:取定溶mL 标定:取份: ⑴⑵⑶⑷ 用溶液滴定,滴定消耗量(mL)V1= 、V2= 、V3= 、V4= 、V0= 。 标准溶液浓度计算公式:C= 计算结果():C1= C2= C3= C4= C = 相对偏差(%):S1= S2= S3= S4= 备注: 。 配制人:复核人: 配制日期:年月日有效期年月日
标准溶液配制记录 编号: CHEC/QBG-147 标准溶液名称:规格: 配制方法: 仪器名称: 溯源标准: 温度:℃、湿度:%RH 标准溶液拟配浓度: 配制或稀释过程: 配制日期:年月日有效期:年月日配制人:复核人:
0.1mol/L盐酸标准滴定溶液的标定 编号:JL/LJ-001-01 一、标定方法:GB/T5009.1-2003 二、使用仪器:AEL-200电子天平(仪器编号:JYB001)马弗炉(仪器编号: JYC009) 三、操作 1、量取9ml盐酸,加适量水并稀释至1000ml。混匀,待标定。 2、标定:精密称取约0.15g在270~300℃干燥至恒量的基准无水碳酸 钠,加50ml水使之溶解,加10滴溴甲酚绿-甲基红混合指示液,用本溶 液滴定至溶液由绿色转变为紫红色,煮沸2min,冷却至室温,继续滴定 至溶液由绿色变为暗紫色。 四、记录和结果 1、计算公式:c(HCl)=m/[(V1-V2)×0.0530] 0.0530……与1.00ml盐酸标准滴定溶液[c(HCl)=1mol/L]相当的基 准无水碳酸钠的质量,g 配制人:复核人: 配制日期:复核日期:
各种缓冲液配制方法
不同缓冲液的缓冲范围 pH缓冲液 六十一秒的常用缓冲溶液的配制&缓冲溶液原理(2007年6月16日更新)(一)甘氨酸-盐酸缓冲液(0.05 mol/L) 甘氨酸分子量=75.07。 0.2 mol/L甘氨酸溶液含15.01 g/L。 (二)邻苯二甲酸-盐酸缓冲液(0.05 mol/L) 邻苯二甲酸氢钾分子量=204.23。0.2 mol/L邻苯二甲酸氢钾溶液含40.85 g/L。(三)磷酸氢二钠-柠檬酸缓冲液 Na2HPO4分子量=141.98;0.2 mol/L溶液为28.40 g/L。 Na2HPO4·2H2O分子量=178.05;0.2 mol/L溶液为35.61 g/L。 Na2HPO4·12H2O分子量=358.22;0.2 mol/L溶液为71.64 g/L。
C6H8O7·H2O分子量=210.14;0.1 mol/L溶液为21.01 g/L。 ①使用时可以每升中加入1克酚,若最后pH值有变化,再用少量50%氢氧化钠溶液或浓盐酸调节,冰箱保存。 柠檬酸钠:Na3C6H5O7·2H2O分子量=294.12 ;0.1 mol/L溶液为29.41 g/L。 (六)醋酸-醋酸钠缓冲液(0.2 mol/L) NaAc·3H2O分子量=136.09;0.2 mol/L溶液为27.22 g/L。冰乙酸11.8 mL稀释至1 L(需标定)。 (七)磷酸二氢钾-氢氧化钠缓冲液(0.05 mol/L) X 毫升0.2 mol/L KH2PO4+Y毫升0.2 mol/L NaOH 加水稀释至20毫升。
(八)磷酸盐缓冲液磷酸氢二钠-磷酸二氢钠缓冲液(0.2 mol/L) Na2HPO4·2H2O分子量=178.05;0.2 mol/L溶液为35.61 g/L。 Na2HPO4·12H2O分子量=358.22;0.2 mol/L溶液为71.64 g/L。 NaH2PO4·H2O分子量=138.01;0.2 mol/L溶液为27.6 g/L。 NaH2PO4·2H2O分子量=156.03;0.2 mol/L溶液为31.21 g/L。 (九)巴比妥纳-盐酸缓冲液 巴比妥钠分子量=206.18;0.04 mol/L溶液为8.25 g/L。 (十)Tris-HCl缓冲液(0.05 mol/L) 50毫升0.1mol/L三羟甲基氨基甲烷(Tris)溶液与X毫升0.1mol/L盐酸混匀并稀释至100
《缓冲溶液的配制与性质》
实验一 缓冲溶液的配制和性质、溶液pH 值测定 【实验目的】 1. 学习缓冲溶液及常用等渗磷酸盐缓冲溶液的配制方法。 2. 加深对缓冲溶液性质的理解。 3. 强化吸量管的使用方法。 4. 学习使用pHS-2C 型酸度计。 5. 培养环境保护意识。 【预习作业】 1. 一般性溶液与缓冲溶液有什么不同? 2. 缓冲溶液的性质有哪些? 3. 如何衡量缓冲溶液的缓冲能力大小?缓冲溶液的缓冲能力与什么因素有关? 4. 实验是如何设计以验证缓冲溶液所具有的性质及缓冲容量的影响因素的,设计时有哪些注意事项? 5. 该如何检测缓冲溶液的pH 值是否发生改变?是否均需要用pH 计? 6. 本实验属定量测定还是定性测定或半定量测定? 【实验原理】 普通溶液不具备抗酸、抗碱、抗稀释作用。 缓冲溶液通常是由足够浓度的弱酸及其共轭碱、弱碱及其共轭酸或多元酸的酸式盐及其次级盐组成的,具有抵抗外加的少量强酸或强碱、或适当稀释而保持溶液pH 值基本不变的作用。 本实验通过将普通溶液和配制成的缓冲溶液对加入酸、碱或适当稀释前后pH 数值的变化来探讨缓冲溶液的性质。 根据缓冲溶液中共轭酸碱对所存在的质子转移平衡: HB ? B - +H 3O + 缓冲溶液pH 值的计算公式为: 缓冲比lg a p ] 共轭酸[] 共轭碱[lg a p [HB]][B lg p pH -+=+=+=K K K a 式中p K a 为共轭酸解离常数的负对数。此式表明:缓冲溶液的pH 值主要取决于弱酸的p K a 值,其次决定于其缓冲比。 需注意的是,由上述公式算得的pH 值是近似的,准确的计算应该用活度而不应该用浓度。要配制准确pH 值的缓冲溶液,可参考有关手册和参考书上的配方,它们的pH 值是由精确的实验方法确定的。 缓冲容量(β)是衡量缓冲能力大小的尺度。缓冲容量(β)的大小与缓冲溶液总浓度、
标准溶液配制
溶液配制 标准溶液的配置与标定 一、1N、0.5N、0.1N硫酸标准溶液 1、配制 1N硫酸标准溶液 量取98%的浓硫酸280ml,慢慢倒入装有10L水瓶中,摇匀待标 0.5N硫酸标准溶液 量取98%的浓硫酸140ml,慢慢倒入装有10L水瓶中,摇匀待标 0.1N硫酸标准溶液 量取98%的浓硫酸28ml,慢慢倒入装有10L水瓶中,摇匀待标 2、标定 1)标定方法 1N硫酸标准溶液 吸取25ml1N碳酸钠基准液于250ml三角烧瓶中,加入2D0.05%甲基橙指示剂,用配制好的硫酸标准溶液滴定至橙色,煮沸5min,冷却后继续滴定至橙色为终点。 0.5N硫酸标准溶液 吸取10ml1N碳酸钠基准液于250ml三角烧瓶中,加入2D0.05%甲基橙指示剂,用配制好的硫酸标准溶液滴定至橙色,煮沸5min,冷却后继续滴定至橙色为终点。 0.1N硫酸标准溶液 吸取25ml1N碳酸钠基准液于250ml三角烧瓶中,加入2D0.05%
甲基橙指示剂,用配制好的硫酸标准溶液滴定至橙色,煮沸5min,冷却后继续滴定至橙色为终点。 2)计算 N=N1*V1/V 式中:V1-碳酸钠基准液用量 ml N1-碳酸钠基准液当量浓度 V-消耗硫酸标准溶液的用量 ml 二、10%、25% 10%硫酸溶液 量取98%的浓硫酸600ml,慢慢倒入装有10L水瓶中,摇匀待标25%硫酸溶液 量取98%的浓硫酸1600ml,慢慢倒入装有10L水瓶中,摇匀待标 2、标定 1)标定方法 10%硫酸溶液 吸取配制好的10%的硫酸溶液5ml于250ml三角烧瓶中,加入3D 甲基红指示剂,用1N的氢氧化钠标准溶液滴定,滴至由红色变为橙色即为终点。(消耗的氢氧化钠标准溶液应在10.85ml以上,方可达到10%浓度) 25%硫酸溶液 吸取配制好的25%的硫酸溶液5ml于250ml三角烧瓶中,加入3D 甲基红指示剂,用1N的氢氧化钠标准溶液滴定,滴至由红色变为橙
常见缓冲溶液配制方法
常见缓冲溶液配制方法 乙醇-醋酸铵缓冲液(pH3.7):取5mol/L醋酸溶液15.0ml,加乙醇60ml和水20ml,用10mol/L氢氧化铵溶液调节pH值至3.7,用水稀释至1000ml。 三羟甲基氨基甲烷缓冲液(pH8.0):取三羟甲基氨基甲烷12.14g,加水800ml,搅拌溶解,并稀释至1000ml,用6mol/L盐酸溶液调节pH值至8.0。 三羟甲基氨基甲烷缓冲液(pH8.1):?取氯化钙0.294g,加0.2mol/L三羟甲基氨基甲烷溶液40ml使溶解,用1mol/L盐酸溶液调节pH值至8.1,加水稀释至100ml。 三羟甲基氨基甲烷缓冲液(pH9.0):?取三羟甲基氨基甲烷6.06g,加盐酸赖氨酸3.65g,氯化钠5.8g,乙二胺四醋酸二钠0.37g,再加水溶解使成1000ml,调节pH值至9.0。 乌洛托品缓冲液:取乌洛托品75g,加水溶解后,加浓氨溶液4.2ml,再用水稀释至250ml。 巴比妥缓冲液(pH7.4):取巴比妥钠4.42g,加水使溶解并稀释至400ml,用2mol/L盐酸溶液调节pH值至7.4,滤过。 巴比妥缓冲液(pH8.6):取巴比妥5.52g与巴比妥钠30.9g,加水使溶解成2000ml。 巴比妥-氯化钠缓冲液(pH7.8):取巴比妥钠5.05g,加氯化钠3.7g及水适量使溶解,另取明胶0.5g加水适量,加热溶解后并入上述溶液中。然后用0.2mol/L盐酸溶液调节pH值至7.8,再用水稀释至500ml。 甲酸钠缓冲液(pH3.3):取2mol/L甲酸溶液25ml,加酚酞指示液1滴,用2mol/L氢氧化钠溶液中和,再加入2mol/L甲酸溶液75ml,用水稀释至200ml,调节pH值至3.25~3.30。 邻苯二甲酸盐缓冲液(pH5.6):?取邻苯二甲酸氢钾10g,加水900ml,搅拌使溶解,用氢氧化钠试液(必要时用稀盐酸)调节pH值至5.6,加水稀释至1000ml,混匀。 枸橼酸盐缓冲液:取枸橼酸4.2g,加1mol/L的20%乙醇制氢氧化钠溶液40ml使溶解,再用20%乙醇稀释至100ml。 枸橼酸盐缓冲液(pH6.2):取2.1%枸橼酸水溶液,用50%氢氧化钠溶液调节pH值至6.2。 枸橼酸-磷酸氢二钠缓冲液(pH4.0):甲液:取枸橼酸21g或无水枸橼酸19.2g,加水使溶解成1000ml,置冰箱内保存。乙液:取磷酸氢二钠71.63g,加水使溶解成1000ml。?取上述甲液61.45ml与乙液38.55ml混合,摇匀。 氨-氯化铵缓冲液(pH8.0):取氯化铵1.07g,加水使溶解成100ml,再加稀氨溶液(1→30)调节pH值至8.0。 氨-氯化铵缓冲液(pH10.0):取氯化铵5.4g,加水20ml溶解后,加浓氯溶液35ml,再加水稀释至100ml。 硼砂-氯化钙缓冲液(pH8.0):取硼砂0.572g与氯化钙2.94g,加水约800ml溶解后,用1mol/L盐酸溶液约2.5ml调节pH值至8.0,加水稀释至1000ml。 硼砂-碳酸钠缓冲液(pH10.8~11.2):取无水碳酸钠5.30g,加水使溶解成1000ml;另取硼砂1.91g,加水使溶解成100ml。临用前取碳酸钠溶液973ml与硼砂溶液27ml,混匀。 硼酸-氯化钾缓冲液(pH9.0):取硼酸3.09g,加0.1mol/L氯化钾溶液500ml使溶解,再加0.1mol/L氢氧化钠溶液210ml。 醋酸盐缓冲液(pH3.5):取醋酸铵25g,加水25ml溶解后,加7mol/L盐酸溶液38ml,用2mol/L盐酸溶液或5mol/L氨溶液准确调节pH值至3.5(电位法指示),用水稀释至100ml,即得。 醋酸-锂盐缓冲液(pH3.0):取冰醋酸50ml,加水800ml混合后,用氢氧化锂调节pH值至3.0,再加水稀释至1000ml。
环境监测原始记录表
环境监测原始记录表 环境保护监测中心站 2012年
目录 1. 地表水采样原始记录表19.离子选择电极原始记录表 2. 大气采样原始记录表20.分光光度法分析原始记录表 3. 降水采样原始记录表21.原子吸收分光光度法分析原始记录表 4. 降尘采样原始记录表22.气相色谱分析原始记录表 5. 土壤采样原始记录表23.离子色谱分析原始记录表 6. 底质(底泥、沉积物)采样原始记录表24.细菌总数测定原始记录表 7. 污染源废水采样原始记录表25.粪大肠菌群测定原始记录表 8. 固定污染源排气中气态污染物采样原始记录表26.区域环境噪声监测原始记录表 9. 固定污染源排气中颗粒物采样原始记录表27.城市交通噪声监测原始记录表 10.烟气烟色监测现场记录表28.污染源噪声监测原始记录表 11.pH值分析原始记录表29.机动车排气路检原始记录表 12.电导率分析原始记录表30.一般试剂配制原始记录表 13.色度分析原始记录表(铂钴比色法)31.校准曲线配制原始记录表 14.色度分析原始记录表(稀释倍数法)32.标准溶液配制与标定原始记录表 15.重量分析原始记录表33.样品交接记录表 16.容量法分析原始记录表34.样品分析任务表 17.五日生化需氧量分析原始记录表35.样品前处理原始记录表 18.一氧化碳分析原始记录表36.大气采样器流量校准原始记录表
xx 省环境监测原始记录表( 1 ) 地表水采样原始记录表 采样目的: 方法依据:GB12998-91 采样日期: 年 月 日 枯 丰 平 pH 计型号及编号: DO 仪型号及编号: 电导仪型号及编号: 采样: 送样: 接样: .第 页 共 页
常用缓冲溶液的配制方法
常用缓冲溶液的配制方法 磷酸氢二钠–柠檬酸缓冲液 24Na 2HPO 4·2H 2O 分子量 = 178.05,0.2 mol/L 溶液含35.01克/ 升。 C 4H 2O 7·H 2O 分子量 = 210.14,0.1 mol/L 溶液为21.01克/升。 pH 4.0 20mL :Na2HPO4 0.219g + C4H2O7·H2O 0.258g 柠檬酸–柠檬酸钠缓冲液(0.1 mol/L ) 6872柠檬酸钠Na 3 C 6H 5O 7·2H 2O :分子量294.12,0.1 mol/L 溶液为29.41克/毫升。 pH 4.0 20mL : C4H2O7·H2O 0.275g + Na3 C6H5O7·2H2O 0.203g
乙酸–乙酸钠缓冲液(0.2 mol/L ) Na 2Ac·3H 2O 分子量 = 136.09,0.2 mol/L 溶液为27.22克/升。 pH 4.0 20mL :NaAc 0.098g + HAc 0.282mL 甘氨酸–氢氧化钠缓冲液(0.05M ) 甘氨酸分子量=75.07; 0.2M 溶液含15.01克/升。 pH 10.0 20mL :甘氨酸0.075g + NaOH 0.013g 碳酸钠-碳酸氢钠缓冲液(0.1M ) 2+2+ 无水Na 2CO 2分子量=105.99;0.1M 溶液为10.60克/升。 Na 2CO 2·10H 2O 分子量=286.2;0.1M 溶液为28.62克/升。 Na 2HCO 3分子量=84.0;0.1M 溶液为8.40克/升。 pH 10.0 20mL :无水碳酸钠 0.127g +碳酸氢钠0.067g
标准溶液的配制
标准溶液的配制 二氧化硅标准贮存溶液:称取0.5000g预先在100℃灼烧2h并冷至室温的二氧化硅(99.99%)置于铂坩埚中,加5g无水碳酸钠,盖上坩埚盖并稍留缝隙,置于1000℃高温炉中熔融5-10min,取出,冷却。置于盛有300ml 沸水聚四氟乙烯烧杯中,低温加热浸出熔块至溶液清亮,用热水洗出坩埚及盖,冷却运载室温。移入500ml容量瓶中,用水稀释至刻度,摇匀,贮于塑料瓶中,此溶液1ml含1mg二氧化硅。 二氧化硅标准溶液:移取50.00ml二氧化硅标准贮存溶液,置于500ml 容量瓶中,用水稀释至刻度,摇匀,贮于塑料瓶中。此溶液1ml含1μg二氧化硅。 三氧化二铁标准贮存溶液:称取1.0000g预先在110℃烘2小时的三氧化二铁(99.99%),置于烧杯中,用少许水湿润,加入40ml盐酸(1+1),低温加热溶解至溶液清亮,冷至室温,移入1000ml容量瓶中,用水稀释至刻度,摇匀。此溶液1ml含1mg三氧化二铁。 三氧化二铁标准溶液:移取50.00ml三氧化二铁标准贮存溶液,置于500ml容量瓶中用水稀释至刻度,摇匀。此溶液1ml含100μg三氧化二铁。 氧化铝标准溶液:称取0.5293g金属铝(99.99%)于聚四氟乙烯烧杯中,加20ml水、10~15ml氢氧化钾溶液(40%),低温溶解,以盐酸(1+1)中和至沉淀出现,并过量20ml,加热煮沸1~2min至溶液清亮,冷却,移入1000ml容量瓶中,以水稀释至刻度,摇匀,此溶液1ml含1mg氧化铝。 二氧化钛标准贮存溶液:称取0.1000g预先在1000℃灼烧1小时的二氧化钛(光谱纯),置于铂坩埚中,加入5~8g焦硫酸钾熔融,熔融物用200ml 硫酸(1+9)加热溶解,溶液冷至室外温后,移入1000ml容量瓶中,用硫酸(5+95)稀释至刻度摇匀。此溶液1ml含100μg二氧化钛。 二氧化钛标准溶液:称取50.00ml二氧化钛标准贮存溶液,置于500ml 容量瓶中,用水稀释至刻度,摇匀。此溶液1ml含10μg二氧化钛。 氧化钙标准溶液:称取0.8923g预先在110℃烘1小时的碳酸钙(基准试剂)置于400ml烧杯中,加少量水盖上表面皿,沿杯嘴慢慢加入盐酸(1+1),加热溶解并煮沸冷至室温,移入1000ml容量瓶中用水稀释至刻度摇匀。此溶液1ml含0.5mg氧化钙。当取样量为1.7848g时溶液含氧化钙1mg/ml。
常用缓冲溶液的配制和PH计校正溶液配置方法
常用缓冲溶液的配制方法 1.甘氨酸–盐酸缓冲液(0.05mol/L) 2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L) 邻苯二甲酸氢钾分子量= 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液 24 Na2HPO4·2H2O分子量= 178.05,0.2 mol/L溶液含35.01克/升。 C4H2O7·H2O分子量= 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液 ① 使用时可以每升中加入1克克酚,若最后pH 值有变化,再用少量50% 氢氧化钠溶 液或浓盐酸调节,冰箱保存。 5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L ) 6872柠檬酸钠Na 3 C 6H 5O 7·2H 2O :分子量294.12,0.1 mol/L 溶液为29.41克/毫升。 6.乙酸–乙酸钠缓冲液(0.2 mol/L ) Na 2Ac·3H 2O 分子量 = 136.09,0.2 mol/L 溶液为27.22克/升。 7.磷酸盐缓冲液
242Na 2HPO 4·12H 2O 分子量 = 358.22,0.2 mol/L 溶液为 71.64克/升。 Na 2HPO 4·2H 2O 分子量 = 156.03,0.2 mol/L 溶液为31.21克/升。 (2)磷酸氢二钠–磷酸二氢钾缓冲液(1/15 mol/L ) 242KH 2PO 4分子量 = 136.09,1/15M 溶液为9.078克/升。 8.磷酸二氢钾–氢氧化钠缓冲液(0.05M ) 9.巴比妥钠-盐酸缓冲液(18℃)
标准滴定溶液配制及标定原始记录 (2)
氢氧化钠标准滴定溶液配制及标定原始记录 依据标准GB/T601-2002 有效期:2个月 基准试剂名称:邻苯二甲酸氢钾 基准试剂摩尔质量(M ):204.22g/mol 仪 器、设 备 编 号 电热恒温干燥箱: 分析天平: 称量瓶: 100 mL 容量瓶: 10mL 刻度吸管: 1000 mL 容量瓶: 150 mL 三角瓶: 滴定管: 配 制 试剂称量(g ): 溶液体积(mL ): 溶液温度(℃): 配制日期: 操作类别 操作项目 标 定 操作序号 1 2 3 4 操作日期 溶液温度(℃) 基准试剂质量 m ﹙g ﹚ 滴定末数 V 1﹙mL ﹚ 空白修正 V 2﹙mL ﹚ 温度修正系数F ﹙ml/L ﹚ 溶液体积V ﹙mL ﹚ 溶液浓度C ﹙mol/L ﹚ 平均值﹙mol/L ﹚ 计算式: V=﹙V 1-V 2﹚×﹙1± 1000F ﹚ C=M ×V 1000×m =0.20422V m 备注:?每次滴定必须从“0”开始; ?温度修正系数F 值参见GB/T601-2002 附录A ; ?复校指标准滴定溶液超过有效期后再使用时进行的标定; ?计算时保留五位有效数字,平均值报出结果并保留四位有效数字。 配制人: 标定人:
硫酸标准滴定溶液配制及标定原始记 依据标准GB/T601-2002 有效期:3个月 基准试剂名称:无水碳酸钠 基准试剂摩尔质量(M ):52.994 g/mol 仪 器、设 备 编 号 实验电阻炉: 分析天平: 乳钵: 称量瓶: 50 ml 量筒: 1000 mL 容量瓶: 150 mL 三角瓶: 50mL 酸式滴定管: 配 制 试剂称量(g ): 溶液体积(mL ): 溶液温度(℃): 配制日期: 操作类别 操作项目 标 定 操作序号 1 2 3 4 操作日期 溶液温度(℃) 基准试剂质量 m ﹙g ﹚ 滴定末数 V 1﹙mL ﹚ 空白修正 V 2﹙mL ﹚ 温度修正系数F ﹙ml/L ﹚ 溶液体积V ﹙mL ﹚ 溶液浓度C ﹙mol/L ﹚ 平均值﹙mol/L ﹚ 计算式: V=﹙V 1-V 2﹚×﹙1± 1000F ﹚ C=M ×V 1000×m =0.052994V m 备注:?每次滴定必须从“0”开始; ?温度修正系数F 值参见GB/T601-2002 附录A ; ?复校指标准滴定溶液超过有效期后再使用时进行的标定; ?计算时保留五位有效数字,平均值报出结果并保留四位有效数字。 配制人: 标定人:
标准溶液配制作业指导书-1
标准溶液的配制作业指导书 1.目的: 规范标准溶液配制活动、保证标准溶液(标准物质)准确、可靠,量值溯源稳定。 2.适用范围: 适用于技术中心检验测试用标准溶液(标准物质)的制备、标定、验证、有效期限的规定和标识等活动。 3.职责: 3.1配制人员:记录配制、稀释过程和数据;加贴标签; 3.2审核(复核)人员:检查配制过程符合性,计算有效性和结果准确性。 4.工作过程及要求 4.1基本要求 4.1.1方法选择:按照检验、测试、分析标准(方法)规定执行或按照国家标准(如GB/T601、GB/T602等)规定执行。 4.1.2制备标准溶液用水,应符合GB/T6682-92中二级水的规定,特殊项目、微量测定用元素标准溶液配制用水应符合GB/T6682-92中一级水的规定。 4.1.3配制标准溶液所用试剂的纯度应为基准剂试、高纯试剂、光谱纯试剂。 4.1.4所用分析天平的砝码需定期校正,滴定管、容量瓶及移液管使用已校正的。 4.1.5标定标准溶液所用的基准试剂应为容量分析工作基准试剂。 4.1.6制备标准溶液的浓度系指20℃时的浓度,在标定和使用时,如温度有差异,应按附表1进行补正。 4.1.7“标定”或比“较较”标准溶液浓度时,平行试验不得少于4次,平行测定结果的极差(即最大值和最小值之差)与平均值之比不得大于0.1%,结果取平均值。浓度值取四位有效数字。 4.1.8对规定用“标定”和“比较”两种方法测定浓度时不得略去其中任何一种,且两种方法测得的浓度值之差不得大于0.2%,以标定结果为准。 4.1.9制备的标准溶液浓度与规定浓度相对误差不得大于5%。 4.1.10配制浓度等于或低于0.02mol/L的标准溶液时,应现用现配。 4.1.11碘量法反应时,溶液的温度不能过高,一般在15-20℃之间进行。 4.1.12标准贮备液有效期为两个月。滴定分析用标准溶液在常温(15-25℃)下,保存时间一般不超过2个月。 4.1.13微量测定用工作液应用标准溶液逐级冲稀成所需工作液,每次吸取体积不得小于5ml。4.1.14微量测定所用标准溶液在常温(15-25℃)下保存期一般为2个月,有效期内出现混浊、沉淀或颜色有变化时,应重新制备。 4.2 配制方法 4.2.1滴定分析(容量分析)用标准溶液的制备按照检验、测试、分析标准(方法)规定执行或按GB/T601-2002执行 4.2.1.1直接配制法 用分子量求出欲配制的浓度质量。 在分析天平上准确称取一定量已干燥的基准物放入洁净的烧杯中溶于水,转入已校正的容量瓶中用水稀释至刻度,摇匀。 根据物质的重量,溶液的体积计算出其准确浓度。 配制标准溶液校核登记。
常见缓冲液配制大全
常见缓冲液配制大全 缓冲液 乙醇-醋酸铵缓冲液(pH3.7) 取5mol/L醋酸溶液15.0ml,加乙醇60ml和水20ml,用10mol/L氢氧化铵溶液调节pH值至3.7,用水稀释至1000ml,即得。 三羟甲基氨基甲烷缓冲液(pH8.0) 取三羟甲基氨基甲烷12.14g,加水800ml,搅拌溶解,并稀释至1000ml,用6mol/L盐酸溶液调节pH值至8.0,即得。 三羟甲基氨基甲烷缓冲液(pH8.1) 取氯化钙0.294g,加0.2mol/L三羟甲基氨基甲烷溶液40ml使溶解,用1mol/L盐酸溶液调节pH值至8.1,加水稀释至100ml,即得。 三羟甲基氨基甲烷缓冲液(pH9.0) 取三羟甲基氨基甲烷6.06g,加盐酸赖氨酸 3.65g、氯化钠5.8g、乙二胺四醋酸二钠0.37g,再加水溶解使成1000ml,调节pH值至9.0,即得。 乌洛托品缓冲液 取乌洛托品75g,加水溶解后,加浓氨溶液4.2ml,再用水稀释至250ml,即得。 巴比妥缓冲液(pH7.4) 取巴比妥钠4.42g,加水使溶解并稀释至400ml,用 2mol/L盐酸溶液调节pH值至7.4,滤过,即得。 巴比妥缓冲液(pH8.6) 取巴比妥5.52g与巴比妥钠30.9g,加水使溶解成 2000ml,即得。 巴比妥-氯化钠缓冲液(pH7.8) 取巴比妥钠5.05g,加氯化钠3.7g及水适量使溶解,另取明胶0.5g加水适量,加热溶解后并入上述溶液中。然后用0.2mol/L 盐酸溶液调节pH值至7.8,再用水稀释至500ml,即得。 甲酸钠缓冲液(pH3.3) 取2mol/L甲酸溶液25ml,加酚酞指示液1滴,用2mol/L 氢氧化钠溶液中和,再加入2mol/L甲酸溶液75ml,用水稀释至200ml,调节pH 值至3.25~3.30,即得。 邻苯二甲酸盐缓冲液(pH5.6) 取邻苯二甲酸氢钾10g,加水900ml,搅拌使溶解,用氢氧化钠试液(必要时用稀盐酸)调节pH值至5.6,加水稀释至1000ml,混匀,即得。 枸橼酸盐缓冲液 取枸橼酸4.2g,加1mol/L的20%乙醇制氢氧化钠溶液40ml使溶解,再用20%乙醇稀释至100ml,即得。
常用缓冲溶液配制
1、选择合适的缓冲对:原则是所选缓冲对弱酸的pKa尽量接近于所需pH,并尽量在缓冲对的 缓冲范围内(pH= pKa±1)。二是所选缓冲对不能与溶液中主物质发生作用。 2、缓冲溶液的总浓度要适当,一般0.1-0.5 mol·L-1之间 3、计算所需缓冲对的量,为方便计算和配制,常用相同浓度的共轭酸、碱溶液,分别取不同体 积混合即可 4、校正,实际pH值与计算pH值常有出入,用pH计或精密pH纸校正。 表1. 常用pH缓冲溶液的配制和pH值 Preparation and pH Values of Common pH Buffer Solutions
表2. pH标准缓冲溶液Standard pH Buffer Solutions
表3. 标准缓冲液pH值与温度对照表
表4。常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L) 2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L) 24 Na2HPO4-2H2O分子量= 178.05,0.2 mol/L溶液含35.01克/升。 C4H2O7·H2O分子量= 210.14,0.1 mol/L溶液为21.01克/升。
溶液或浓盐酸调节,冰箱保存。 6872柠檬酸钠Na 3 C 6H 5O 7·2H 2O :分子量294.12,0.1 mol/L 溶液为29.41克/毫升。 22
7.磷酸盐缓冲液 242 Na2HPO4·2H2O分子量= 358.22,0.2 mol/L溶液为71.64克/升。 Na2HPO4·2H2O分子量= 156.03,0.2 mol/L溶液为31.21克/升。 242 KH2PO4分子量= 136.09,1/15M溶液为9.078克/升。 8.磷酸二氢钾–氢氧化钠缓冲液(0.05M) X毫升0.2M K2PO4 + Y毫升0.2N NaOH加水稀释至29毫升
磷酸盐缓冲溶液的配制
磷酸盐缓冲液 磷酸氢二钠-磷酸二氢钠缓冲液(0.2M) pH 0.2M Na2HPO4/ml 0.2M NaH2PO4/ml 5.8 8.0 92.0 5.9 10.0 90 .0 6.0 12.3 87.7 6.1 15.0 85.0 6.2 18.5 81.5 6.3 22.5 77.5 6.4 26.5 73.5 6.5 31.5 68.5 6.6 3 7.5 62.5 6.7 43.5 56.5 6.8 49.5 50. 5 6.9 55.0 45.0 7.0 61.0 39.0 7.1 67.0 33.0 7.2 72.0 28.0 7.3 77.0 23.0
7.4 81.0 19.0 7.5 84.0 16.0 7.6 87.0 13.0 7.7 89.5 10.5 7.8 91.5 8.5 7.9 93.0 7.0 8.0 94.7 5.3 Na2HPO4?2H2O分子量=178.05 0.2M溶液含35.61g/L Na2HPO4?12 H2O分子量=358.22 0.2M溶液含71.64g/L NaH2PO4?H2O分子量=138.01 0.2M溶液含27.6g/L NaH2PO4?2H2O分子量=156.03 0.2M溶液含31.21g/L 磷酸盐缓冲液 取磷酸二氢钠38.0g,与磷酸氢二钠5.04g,加水使成1000ml,即得。 磷酸盐缓冲液(pH2.0) 甲液:取磷酸16.6ml,加水至1000ml,摇匀。乙液:取磷酸氢二钠71.63g,加水使溶解成1000ml。取上述甲液72.5ml与乙液27.5ml混合,摇匀,即得。 磷酸盐缓冲液(pH2.5) 取磷酸二氢钾100g,加水800ml,用盐酸调节pH至2.5,用水稀释至1000ml。磷酸盐缓冲液(pH5.0) 取0.2mol/L磷酸二氢钠溶液一定量,用氢氧化钠试液调节pH值至5.0,即得。磷酸盐缓冲液(pH5.8) 取磷酸二氢钾8.34g与磷酸氢二钾0.87g,加水使溶解成1000ml,即得。 磷酸盐缓冲液(pH6.5) 取磷酸二氢钾0.68g,加0.1mol/L氢氧化钠溶液15.2ml,用水稀释至100ml,即得。 磷酸盐缓冲液(pH6.6)
常用缓冲溶液的配制
常用缓冲溶液的配制方法1 ?甘氨酸-盐酸缓冲液(0.05mol/L ) 2.邻苯二甲酸-盐酸缓冲液(0.05 mol/L ) 24 Na2HPO4 ? 2H2O 分子量=178.05, 0.2 mol/L 溶液含35.01 克/升。 C4H2O7 ? H2O 分子量=210.14, 0.1 mol/L 溶液为21.01 克/升。
4 ①溶 液或浓盐酸调节,冰箱保存。 687 2 柠檬酸钠Na3 C6H5O7 ? 2H2O:分子量294.12, 0.1 mol/L溶液为29.41克/毫升。 6. Na2Ac H2O 分子量=136.09, 0.2 mol/L 溶液为27.22 克/升。
7 ?磷酸盐缓冲液 (1 2 4 2 Na2HPO4 12H2O 分子量=358.22 , 0.2 mol/L 溶液为71.64 克/升。 Na2HPO4 2H2O 分子量=156.03, 0.2 mol/L 溶液为31.21 克/升。(2)磷酸氢二钠-磷酸二氢钾缓冲液(1/15 mol/L ) Na2HPO4 2H2O 分子量=178.05, 1/15M 溶液为11.876 克/升。 KH 2PO4 分子量=136.09, 1/15M 溶液为9.078 克/升。 &磷酸二氢钾-氢氧化钠缓冲液(0.05M) 2 4
9. 10. Tris -盐酸缓冲液(0.05M , 25C) 50毫升0.1M三羟甲基氨基甲烷(Tris)溶液与X毫升0.1N盐酸混匀后,加水稀释至100 毫升。 C H0CH2 NH2 分子量=121.14; 0.1M溶液为12.114克/升。Tris溶液可从空气中吸收二氧化碳,使用时注意将瓶盖严。 11 硼砂Na2B4O7H2O,分子量=381.43;0.05M溶液(=0.2M硼酸根)含19.07克/升。硼酸H2BO3,分子量 =61.84,0.2M溶液为12.37克/升。 硼砂易失去结晶水,必须在带塞的瓶中保存。
标准溶液配制和标定
1、氢氧化钠标准滴定溶液 1.1配制 称取110 g氢氧化钠,溶于100 ml无二氧化碳的水中,摇匀,注人聚乙烯容器中,密闭放置至溶液清亮。按表1的规定,用塑料管量取上层清液,用无二氧化碳的水稀释至1 000MI,摇匀。 表1 1.2 标定 按表2 的规定称取于105℃--110℃电烘箱中干燥至恒重的工作基准试剂邻苯二甲酸氢钾,加无二氧化碳的水溶解,加2滴酚酞指示液(10 g/L),用配制好的氢氧化钠溶液滴定至溶液呈粉红色,并保持30 s。同时做空白试验。 表2 氢氧化钠标准滴定溶液的浓度〔c(NaOH)],数值以摩尔每升(mol/ L)表示,按式(1)计算: m×1000 c(NaOH)= ------------- (V1-V2)M 式中: m—邻苯二甲酸氢钾的质量的准确数值,单位为克(9);
V1 —氢氧化钠溶液的体积的数值,单位为毫升(mL); V2 一空白试验氢氧化钠溶液的体积的数值,单位为毫升(mL); M一邻苯二甲酸氢钾的摩尔质量的数值,单位为克每摩尔(g/mol)【M(KHC8H4O4)= 204.22 】 2、硫酸标准滴定溶液 2.1配制 按表3的规定量取硫酸,缓缓注人1 000 mL水中,冷却,摇匀。 表3 2.2标定 按表4的规定称取于270℃—300℃高温炉中灼烧至恒重的工作基准试剂无水碳酸钠,溶于50m l.水中,加5甲基红—亚甲基蓝指示剂(或滴澳甲酚绿一甲基红指示液),用配制好的硫酸溶液滴定至溶液由绿色变为紫色(绿色变为暗红色),煮沸2 min,冷却后继续滴定至溶液再呈紫色(暗红色)。同时做空白试验。 表4 硫酸标准滴定溶液的浓度[c(1/2H2SO4)],数值以摩尔每升(mol/L)表示m×1000 c(1/2H2SO4)= ------------- (V1-V2)M
氢氧化钠标准滴定溶液记录表
氢氧化钠标准滴定溶液配制及标定原始记录 依据标准GB/T601-2002 有效期:1个月 基准试剂名称:邻苯二甲酸氢钾 基准试剂摩尔质量(M ):204.22g/mol 仪 器、设 备 编 号 容量瓶: 称量瓶: 滴定管: 刻度吸管: 三角瓶: 配 制 试剂称量(g ): 溶液体积(mL ): 溶液温度(℃): 配制日期: 操作类别 操作项目 标 定 复 标 复 校 操作序号 1 2 3 4 5 6 操作日期 溶液温度(℃) 基准试剂质量 m ﹙g ﹚ 滴定末数 V 1﹙mL ﹚ 空白修正 V 2﹙mL ﹚ 温度修正系数F ﹙ml/L ﹚ 溶液体积V ﹙mL ﹚ 溶液浓度C ﹙mol/L ﹚ 平均值﹙mol/L ﹚ 操作类别 操作项目 复 校 复 校 复 校 操作序号 7 8 9 10 11 12 操作日期 溶液温度(℃) 基准试剂质量 m ﹙g ﹚ 滴定末数 V 1﹙mL ﹚ 空白修正 V 2﹙mL ﹚ 温度修正系数F ﹙ml/L ﹚ 溶液体积V ﹙mL ﹚ 溶液浓度C ﹙mol/L ﹚ 平均值﹙mol/L ﹚ 计算式: V=﹙V 1-V 2﹚×﹙1± 1000F ﹚ C=M ×V 1000×m =0.20422V m 备注: 配制人: 标定: 复标: 复校:
盐酸标准滴定溶液配制及标定原始记录 依据标准: 有效期:3个月 基准试剂名称:无水碳酸钠 基准试剂摩尔质量(M ):52.994 g/mol 仪 器、设 备 编 号 容量瓶:1000 mL 酸式滴定管:50mL 烧杯: 量筒:50 ml 三角瓶:150 mL 、250mL 移液管: 配 制 试剂称量(g ): 溶液体积(mL ): 溶液温度(℃): 配制日期: 操作类别 操作项目 标 定 复 标 复 校 操作序号 1 2 3 4 5 6 操作日期 溶液温度(℃) 基准试剂质量 m ﹙g ﹚ 滴定末数 V 1﹙mL ﹚ 空白修正 V 2﹙mL ﹚ 温度修正系数F ﹙ml/L ﹚ 溶液体积V ﹙mL ﹚ 溶液浓度C ﹙mol/L ﹚ 平均值﹙mol/L ﹚ 操作类别 操作项目 复 校 复 校 复 校 操作序号 7 8 9 10 11 12 操作日期 溶液温度(℃) 基准试剂质量 m ﹙g ﹚ 滴定末数 V 1﹙mL ﹚ 空白修正 V 2﹙mL ﹚ 温度修正系数F ﹙ml/L ﹚ 溶液体积V ﹙mL ﹚ 溶液浓度C ﹙mol/L ﹚ 平均值﹙mol/L ﹚ 计算式: V=﹙V 1-V 2﹚×﹙1± 1000F ﹚ C=M ×V 1000×m =0.052994V m 备注: 配制人: 标定: 复标: 复校:
常用缓冲溶液的配制
常用pH缓冲溶液的配制和pH值Preparation and pH Values of Common pH Buffer Solutions
缓冲溶液的配制 三羟甲基氨基甲烷缓冲液(pH8.0)取三羟甲基氨基甲烷12.14g,加水800ml,搅拌溶解,并稀释至1000ml,用6mol/L盐酸溶液调节pH值至8.0,即得。 三羟甲基氨基甲烷缓冲液(pH8.1)取氯化钙0.294g,加0.2mol/L三羟甲基氨基甲烷溶液40ml使溶解,用1mol/L盐酸溶液调节pH值至8.1,加水稀释至100ml,即得。 三羟甲基氨基甲烷缓冲液(pH9.0)取三羟甲基氨基甲烷6.06g,加盐酸赖氨酸3.65g、氯化钠5.8g、乙二胺四醋酸二钠0.37g,再加水溶解使成1000ml,调节pH值至9.0,即得。 乌洛托品缓冲液取乌洛托品75g,加水溶解后,加浓氨溶液4.2ml,再用水稀释至250ml,即得。 巴比妥缓冲液(pH7.4)取巴比妥钠4.42g,加水使溶解并稀释至400ml,用2mol/L盐酸溶液调节pH 值至7.4,滤过,即得。 巴比妥缓冲液(pH8.6)取巴比妥5.52g与巴比妥钠30.9g,加水使溶解成2000ml,即得。 巴比妥-氯化钠缓冲液(pH7.8)取巴比妥钠5.05g,加氯化钠3.7g及水适量使溶解,另取明胶0.5g加水适量,加热溶解后并入上述溶液中。然后用0.2mol/L盐酸溶液调节pH 磷酸盐缓冲液(pH2.5)取磷酸二氢钾100g,加水800ml,用盐酸调节pH至2.5,用水稀释至1000ml.磷酸盐缓冲液(pH5.0)取0.2mol/L磷酸二氢钠溶液一定量,用氢氧化钠试液调节pH值至5.0,即得。 磷酸盐缓冲液(pH5.8)取磷酸二氢钾8.34g与磷酸氢二钾0.87g,加水使溶解成1000 ml,即得。 磷酸盐缓冲液(pH6.5)取磷酸二氢钾0.68g,加0.1mol/L氢氧化钠溶液15.2ml,用水稀释至100ml,即得。 磷酸盐缓冲液(pH6.6)取磷酸二氢钠1.74g、磷酸氢二钠2.7g与氯化钠1.7g,加水使溶解成400ml,即得。 磷酸盐缓冲液(含胰酶)(pH6.8)取磷酸二氢钾6.8g,加水500ml使溶解,用0.1mol/L氢氧化钠溶液调节pH值至6.8;另取胰酶10g,加水适量使溶解,将两液混合后,加水稀释至1000ml,即得。 磷酸盐缓冲液(pH6.8)取0.2mol/L磷酸二氢钾溶液250ml,加0.2mol/L氢氧化钠溶液118ml,用水稀释至1000ml,摇匀,即得。 磷酸盐缓冲液(pH7.0)取磷酸二氢钾0.68g,加0.1mol/L氢氧化钠溶液29.1ml,用水稀释至100ml,即得。 磷酸盐缓冲液(pH7.2)取0.2mol/L磷酸二氢钾溶液50ml与0.2mol/L氢氧化钠溶液35ml,加新沸过的冷水稀释至200ml,摇匀,即得。 磷酸盐缓冲液(pH7.3)取磷酸氢二钠1.9734g与磷酸二氢钾0.2245g,加水使溶解成1000ml,调节pH
常用缓冲溶液配制方法
常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L) 2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L) 24 Na2HPO4·2H2O分子量= 178.05,0.2 mol/L溶液含35.01克/升。 C4H2O7·H2O分子量= 210.14,0.1 mol/L溶液为21.01克/升。
液或浓盐酸调节,冰箱保存。 6872 柠檬酸钠Na3 C6H5O7·2H2O:分子量294.12 ,0.1 mol/L溶液为29.41克/毫升。
7.磷酸盐缓冲液 242Na 2HPO 4·12H 2O 分子量 = 358.14,0.2 mol/L 溶液为71.628克/升。 NaH 2PO 4·2H 2O 分子量 = 156.01,0.2 mol/L 溶液为31.202克/升。 磷酸盐是生物化学研究中使用最广泛的一种缓冲剂,由于它们是二级解离,有二个pKa 值,所以用它们配制的缓冲液,pH 范围最宽:NaH 2PO 4: pKa1=2.12,pKa2=7.21; Na 2HPO 4:pKa1=7.21,pKa2=12.32 配酸性缓冲液:用NaH 2PO 4,pH =1~4, 配中性缓冲液:用混合的两种磷酸盐,pH =6~8, 配碱性缓冲液:用Na 2HPO 4,pH =10~12。 用钾盐比钠盐好,因为低温时钠盐难溶,钾盐易溶,但若配制SDS-聚丙烯酰胺凝胶电泳的缓冲液时,只能用磷酸钠而不能用磷酸钾,因为SDS(十二烷基硫酸钠)会与钾盐生成难溶的十二烷基硫酸钾。 磷酸盐缓冲液的优点为:①容易配制成各种浓度的缓冲液;②适用的pH 范围宽;③pH 受温度的影响小;④缓冲液稀释后pH 变化小,如稀释10倍后pH 的变化小于0.1。 其缺点为:①易与常见的钙Ca2+离子、镁Mg2+离子以及重金属离子缔合生成沉淀;②会抑制某些生物化学过程,如对某些酶的催化作用会产生某种程度的抑制作用。
实验一:缓冲溶液的配制实验
实验一:缓冲溶液的配制实验
项目1:缓冲溶液的配制及pH 测定 一、实验目的 1.学会标准缓冲溶液的配制方法,并验证其性质。 2. 练习吸量管的使用方法。 二、实验原理 缓冲原理:缓冲溶液具有抵抗外来少量酸、碱或稀释的干扰,而保持其本身pH 基本不变的能力。缓冲溶液由共轭酸碱对组成,其中共轭酸是抗碱成分,共轭碱是抗酸成分,缓冲溶液的pH 计算公: 配制一定pH 的缓冲溶液的原则:选择合适的缓冲系,使缓冲系共轭酸的pKa 尽可能与所配缓冲溶液的pH 相等或接近,以保证缓冲系在总浓度一定时,具有较大的缓冲能力;配制缓冲溶液要有适当的总浓度,一般情况下,缓冲溶液的总浓度宜选在0.05~0.2mo1/L之间。 缓冲溶液pH除了主要决定于pKa(pKb)外,还与盐和酸(或碱)的浓度比值有关,若配制缓冲溶液所用的盐和酸(或碱)的原始浓度相同均为c,酸(或碱)的体积为Va(Vb),盐的体积为Vs,总体积为V,混合后酸(或碱)的浓度 为,盐的浓度为,则 所以缓冲溶液pH可写为 配制缓冲溶液时,只需按照计算值量取盐和酸(或碱)的体积,混合后即可得到一定pH的缓冲溶液。 缓冲容量是衡量缓冲溶液的缓冲能力大小的尺度。为了获得最大的缓冲容
量,应控制,盐和酸(或碱)的浓度大的,缓冲容量亦大。 三、仪器和药品 仪器:烧杯,量筒,吸量管,试管等。 试剂:pH=4的HCl溶液、pH=10的NaOH溶液、0.10mol/L 的HAc、NaAc、NaOH、HCl 、Na2HPO4、NaH2PO4溶液、精密pH 试纸,广泛pH 试纸。 四、实验步骤 1. 缓冲溶液配制 甲、乙、丙三种缓冲溶液的组成如下表。如配制三种缓冲溶液各10mL,计算所需各组分的体积,并填入表中。 按照表1中用量,用10mL量筒(或吸量管)配制甲、乙、丙三种缓冲溶液于已经编号的3支试管中,用广泛pH试纸测定所配制的缓冲溶液的pH,填入表中,试比较实验值与计算值是否相符。 表1 缓冲溶液理论配制与实验测定 pH=pKa-lgn a/n b 4=4.75-lg0.1x/0.1(10-x) 0.75=lgx/(10-x)
