水环境化学

水环境化学
Page 1 of 14
第十二章 水环境中的溶解与沉淀
教学一般要求 掌握:难溶氢氧化物溶解性与pH的关系。难溶硫化物、难溶碳酸盐的溶解性与pH及CT的关系。 初步掌握:开放体系与封闭体系中碳酸钙的溶解平衡,水稳定性的概念与调整。 了解:Fe(OH)2与FeCO3溶解平衡图。Fe(OH)2与FeCO3的分级沉淀和稳定性区域图的认识。 初步了解:Fe(OH)2与FeCO3稳定区域图的绘制。FeS、Fe(OH)2与FeCO3的分级沉淀。
第一节 天然水中各类固体的溶解平衡 一、常见固体的溶解性
(一) 天然水中溶解沉淀平衡的复杂性
溶解―沉淀平衡是固一液两相间的平衡,反应发生在两相的界面上。天然水是个组成复杂的体系, 增加了溶解―沉淀平衡的复杂性。难溶电解质的溶解规律可以用溶度积原理描述,天然水中的溶解 平衡有以下特点: 1,反应的滞后性。即平衡状态不是迅速达到,往往要滞后一段时间。因此,在天然水中常常会 发现沉淀物的过饱和状态。例如大洋表层水中的CaCO3一般都有一定的过饱和程度。升高温度,有结 晶核及生物作用,均可加速反应的进行。 2,最先生成的沉淀不一定是最稳定的形态,而是反应速度快的形态。这种形态经过一定时间的作 用,可以转化为更稳定的形态。例如,硅酸盐在沉淀析出时首先析出的是蛋白石,而不是更稳定的 石英。 3,吸附沉淀作用和共沉淀作用的存在,这使沉淀反应生成的固相组成复杂,使远未达到溶度积的成 分也可沉淀析出。 天然水在地球化学循环过程中不断侵蚀陆地,使其风化产物转入水体,最后进入海洋。其中80%左 右是悬浮物质,20%左右是溶解物质。在条件变化时,溶解的物质可以发生沉淀,悬浮物质也可溶 解。地面水中的主要离子成份就是径流在汇集过程中对岩石、土壤淋溶而形成的。这些成分主要来 自沉积岩。下面就天然水中较常见的沉淀物作简单介绍。
(二)硝酸盐、氯化物和硫酸盐
在常见化合物中,硝酸盐几乎全部是易溶的,氯化物和硫酸盐绝大多数也是易溶的。较常见的难溶 化合物有氯化银、氯化铅、硫酸铅、硫酸钡等。它们的溶度积常数见表12-1。另外,硫酸钙在水中 的溶解度也比较小(1.9g/L)。铅虽然是比较常见的污染重金属,但它在海水中,大部分被转移到
http://210.30.64.60/etc/jpk/huaxue/kejian/dishierz.htm
2010-03-11
水环境化学
Page 2 of 14
沉淀中,使毒性大大降低。
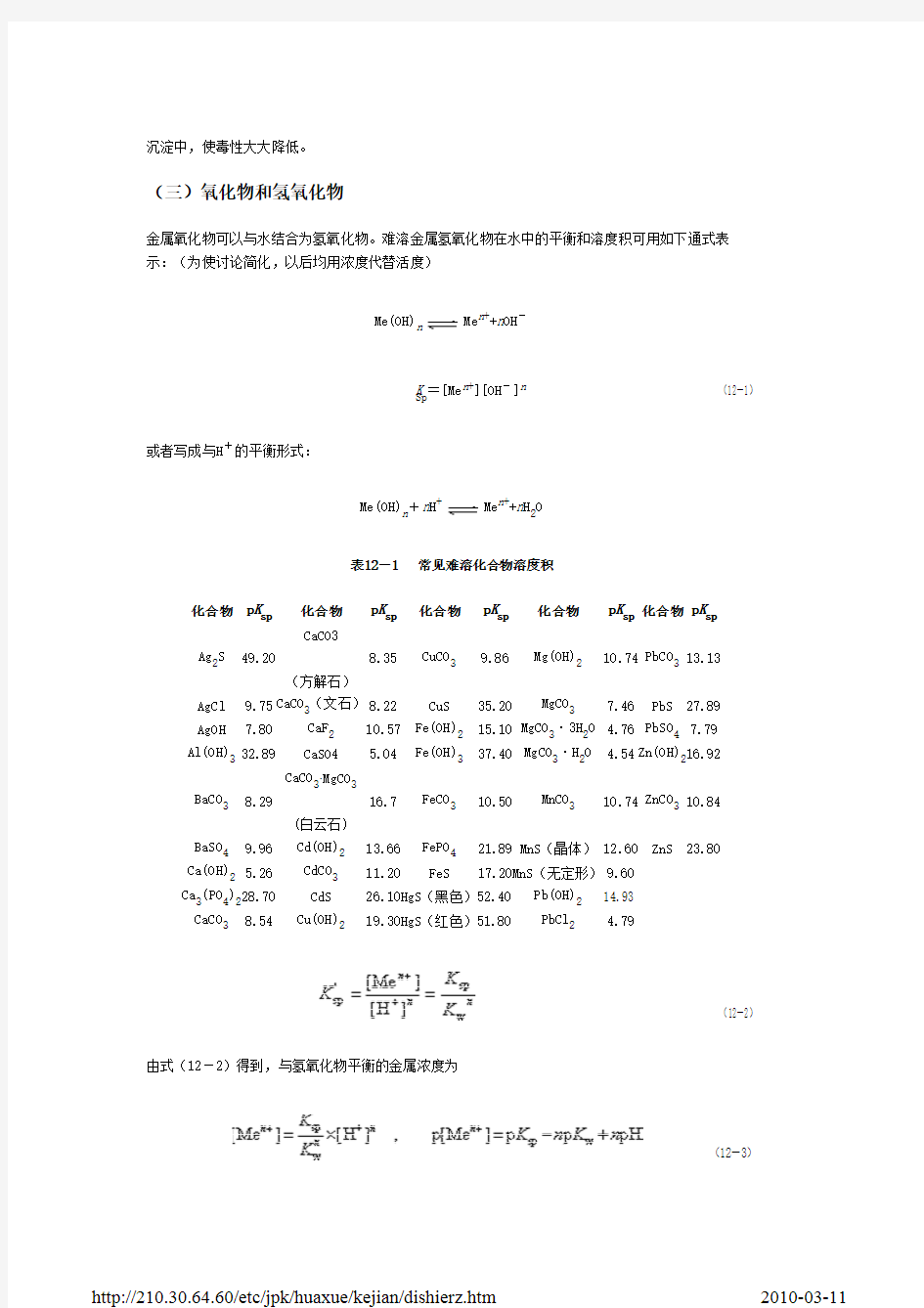
(三)氧化物和氢氧化物
金属氧化物可以与水结合为氢氧化物。难溶金属氢氧化物在水中的平衡和溶度积可用如下通式表 示:(为使讨论简化,以后均用浓度代替活度)
Me(OH)n
Men++nOH-
KSp=[Men+][OH-]n (12-1)
或者写成与H+的平衡形式:
Me(OH)n+nH+
Men++nH2O
表12-1 常见难溶化合物溶度积 化合物 pKsp Ag2S AgCl AgOH 49.20 (方解石) 9.75 CaCO3(文石) 8.22 7.80 CaF2 CaSO4 CaCO3MgCO3 BaCO3 BaSO4 8.29 (白云石) 9.96 Cd(OH)2 CdCO3 CdS Cu(OH)2 13.66 11.20 FePO4 FeS 21.89 MnS(晶体) 12.60 ZnS 23.80 17.20MnS(无定形) 9.60 Pb(OH)2 PbCl2 14.93 4.79 Ca(OH)2 5.26 Ca3(PO4)228.70 CaCO3 8.54 16.7 FeCO3 10.50 MnCO3 10.74 ZnCO3 10.84 10.57 5.04 CuS Fe(OH)2 Fe(OH)3 35.20 MgCO3 7.46 PbS 27.89 15.10 MgCO33H2O 4.76 PbSO4 7.79 37.40 MgCO3H2O 4.54 Zn(OH)216.92 化合物 CaCO3 8.35 CuCO3 9.86 Mg(OH)2 10.74 PbCO3 13.13 pKsp 化合物 pKsp 化合物 pKsp 化合物 pKsp
Al(OH)3 32.89
26.10HgS(黑色)52.40 19.30HgS(红色)51.80
(12-2)
由式(12-2)得到,与氢氧化物平衡的金属浓度为
(12-3)
http://210.30.64.60/etc/jpk/huaxue/kejian/dishierz.htm
2010-03-11
水环境化学
Page 3 of 14
图12-1 难溶金属氢氧化s物的溶解度 图12-2 氢氧化亚铁溶解区域图 式(12-3)表明达到溶解平衡时,水中[Men+]浓度的负对数与pH值呈直线关系。这种关系可用pC- pH图来表示,例如图12-1。从图中可以看出,金属离子的价数相同,所得直线的斜率也相同。 图12—1绘制时没有考虑溶液中可能还有金属的羟基络合物生成。如果有金属羟基络合物生成,则不 是直线关系,而是如图12-2的曲线关系。在溶液中亚铁有三种离子(Fe2+、FeOH+ 和Fe(OH)3-)与 氢氧化亚铁平衡。此图的绘制方法将在后面介绍。
(四)硫化物和碳酸盐
1.硫化物 金属硫化物大部分是难溶的,溶度积很小。FeS、MnS及CdS在盐酸中可以溶解,放出 H2S。CuS、PbS及HgS在盐酸中难溶解,只在具有氧化性的强酸(例如硝酸)中溶解。 下面以2价金属硫化物为例,介绍硫化物的溶解平衡:
MeS
Me2++S2- ,[Me2+][S2-]=Ksp
常见金属硫化物的溶度积见表12-1。 硫化氢在水中的电离很微弱,在水中分二级电离,电离平衡常数分别为:
Ka,1=6.3×10-8 pKa,1=7.2 ; Ka,2=8.9×10-15 pKa,2=14.0
下面以硫化亚铁在水中的溶解性为例,讨论pH值对难溶硫化物溶解度的影响:
FeS
Fe2++S2- [S2-][ Fe2+]=Ksp=10-17.2
[S2-]=CT,S(Ⅱ)×f2 (12-4)
http://210.30.64.60/etc/jpk/huaxue/kejian/dishierz.htm
2010-03-11
水环境化学
Page 4 of 14
式中CT,S(Ⅱ)为硫化物各形态的总量,f2为S2-的分布系数
(12-5)
式中Ka1,Ka2为H2S的一级二级电离平衡常数。如果假定硫化物总量CT,S(Ⅱ)=1.00×10-5mol/L
则
(12-6)
lg[Fe2+]=9.0+lg([H+]2+10-7.2[H+]+10-21.2) (12—7) 作lg[Fe2+]―pH图,可得图12-3。图中的曲线可近似看作由两条直线组成:左面的直线相当于式 (12—7)中括号内保留[H+]2项,其余两项忽略的情形。右面的直线则是保留10-7.2[H+]项,忽略 [H+]和10-21.2两项的情形。
图12-3 硫化亚铁溶解度与pH的关系
(不考虑生成FeOH+ 和Fe(OH)3-时 )
如果考虑到水中还有FeOH+ 和Fe(OH)3-生成,图形就比较复杂,这将在下面碳酸亚铁的平衡中介 绍。
2.碳酸盐 几乎所有的天然水中都含有碳酸盐。能与碳酸根离子生成难溶沉淀物的金属很多,常见 难溶碳酸盐及其溶度积常数列于表12-1。
http://210.30.64.60/etc/jpk/huaxue/kejian/dishierz.htm
2010-03-11
水环境化学
Page 5 of 14
与硫化物类似,碳酸盐在水中的溶解度与pH有密切关系。现以FeCO3为例,说明pH的影响。此处先只 考虑与Fe2 +的平衡,暂时忽略生成FeOH+及Fe(OH)3-对平衡的影响:
FeCO3
Fe2++CO32-
[Fe2+][CO32-]=
=10-10. 7
(12-8)
式中f2为 CO32- 的分布系数,CTCO2为碳酸总量,将f2与碳酸的电离常数及pH的关系代入式(12— 8),并假定CTCO2=1.00×10-3mol/L,则有:
(12-9)
(12-10)
依据式12-10,可以绘出lg[Fe2+]-pH图,例如图12-4中之Fe2+线。水中碳酸总量CTCO2不同,曲线 的具体位置会上下移动。浓度在此线之上,就会发生碳酸亚铁的沉淀;浓度在此线之下,就发生碳 酸亚铁的溶解。图中还示出了CaCO3、ZnCO3的溶解曲线,曲线的形态与碳酸亚铁相同,因为方程的 形式完全一样,只是溶度积常数值不同。曲线表明pH升高,发生碳酸盐沉淀的金属浓度降低。三条 曲线在高pH区段都变成了水平直线,这是因为此时碳酸根离子的浓度已经都等于CT,CO2。FeCO3和 ZnCO3的曲线有一段用的是虚线,表示曲线的实际走向与此有所不同。因为此时铁和锌都有羟基络离 子生成,实际上曲线走向发生了变化。有羟基络离子生成的碳酸亚铁的溶解度曲线将在分级沉淀中 讨论。
二、天然水中碳酸钙的溶解和沉淀
碳酸钙的溶解和沉淀是在天然水中不断自然发生的过程,在天然水中有重要的作用。了解这个平衡 规律,可以帮助我们理解水环境中的许多变化。
参与碳酸钙溶解平衡的,除了水中的Ca2+及CO32-外,还有游离CO2、HCO3-及H+,均会间接影响平 衡。对于开放体系,水中的溶解CO2,既与空气中的CO2有溶解-逸出平衡。又参与水中CaCO3的溶解 -沉淀平衡,这形成了包括气-液-固三相的平衡体系。对于封闭体系,不存在与气相的气体交 换,只需考虑固-液平衡。两种平衡情况的规律不同,现分别加以讨论。
http://210.30.64.60/etc/jpk/huaxue/kejian/dishierz.htm
2010-03-11
水环境化学
Page 6 of 14
(一)封闭体系的碳酸钙溶解平衡
封闭体系的特点是碳酸总量不变,在给定了CT,CO2值以后就与绘制FeCO3(未考虑存在铁的羟基离 子)的平衡图一样可以绘出CaCO3的平衡图,只是常数不同,这里不再赘述,只列出有关方程:
Ca2++CO32-
CaCO3
[Ca2+][ CO32-]=Ksp(CaCO3)=10- 8.35
(12-11)
将有关常数代入,整理可得:
(12-11’)
CT,CO2一定时,[Ca2+]与pH的关系如图12-4的Ca2+曲线。CTCO2值的不同,可引起曲线上下移动。从
式12-11’可以看出,如果pH一定,则[Ca2+]与CTCO2的浓度成反比关系—碳酸总量越高,与其平衡 的Ca2+含量就越低。体系在短时间发生的过程可近似用封闭体系中的过程来处理,因为CO2来不及逸 出或溶解。
图12-4 封闭体系碳酸盐的溶解平衡
http://210.30.64.60/etc/jpk/huaxue/kejian/dishierz.htm
2010-03-11
水环境化学
Page 7 of 14
(二)开放体系中的碳酸钙溶解平衡
开放体系中CTCO2不是恒量,由于与气相有CO2交
换, CTCO2在不断变化。开放体系要考虑的是气-液—固三相的平衡关系。
气—液两相间的CO2平衡用亨利定律来描述。PCO2=KHCH2CO3*
或
(12-12)
又 CH2CO3*=f0CTCO2 (12-13)
空气中CO2分压一定时,在一定温度下,达到气-液溶解平衡后,水中游离二氧化碳的浓度也一定。 对于达到平衡的开放体系,在变化过程中水中游离二氧化碳的浓度不变,这就是开放体系中碳酸钙 溶解平衡的特征。 将式(12-12)及(12-13)代入式(12-11)
(12-14)
式中
将上式代入(12-14),整理得到:
(12-15)
此式表明,Ca2+浓度的负对数值,与pH成直线关系:pH升高,“lg[Ca2+]”成直线下降,[Ca2+]的平 衡浓度降低。其他难溶金属碳酸盐与pH也有类似的直线关系,如图12-5所示。
(三)水的稳定性
在环境工程与给水排水工程中,水的稳定性是指水中碳酸钙的溶解和沉积性。如果水体中CaCO3没达
http://210.30.64.60/etc/jpk/huaxue/kejian/dishierz.htm
2010-03-11
水环境化学
Page 8 of 14
饱和,CaCO3会在水中溶解,此时称水具有侵蚀性。在侵蚀性强的水中混凝土构件也会受到缓慢的侵 蚀。如果水体中CaCO3过饱和,则称为水具有沉积性,会发生CaCO3的沉积。对于养殖水体,一般都 希望具有稳定性或者有一定的沉积性。池塘养鱼中定期使用生石灰清塘,或不定期往水中施用石灰 水,可以提高水的pH,维持CaCO3的饱和或适度过饱和状态,对稳定水质有利。在水中浮游生物含量 较大时,光合作用使水的pH升高,可达到碳酸钙过饱和,会有碳酸钙析出。我们在用黑白瓶方法测 定养鱼池初级生产力时,就经常发现白瓶玻璃外壁上有碳酸钙的沉积。但是,如果水的沉积性过 强、碳酸钙过饱和程度太高,则可能对水中生物产生危害。在室外河蟹土池育苗时,我们曾观察到 由于海水pH升高,碳酸钙大大过饱和,结果在河蟹蚤状幼体附肢上发生碳酸钙结晶,将附肢包裹, 宛如打上了“石膏”。这种现象发生,会引起蚤状幼体大批死亡。 1.水的稳定性指数 水的稳定性用水的实际pH值与水的平衡pH值(pHs)之差来描述,称为水的稳定 性指数S
S =pH-pHS S =0,水是稳定的;S<0,表明实际pH偏低,CaCO3不饱和,会发生CaCO3溶解,水具有侵蚀性;
S>0,表明实际pH偏高,CaCO3过饱和,会发生CaCO3的沉积,水具有沉积性。
pHS由水的碳酸盐碱度和Ca2+含量决定,根据这两个参数即可计算pHS值:
pHS = pKa2-pKsp-lg[Ca2+]-lg(A+[H+]-Kw/[H+])+lg(1+2Ka2/[H+]) (12-16)
将各常数及[H+]=10-pH代入上式得到:
pHs=10.38-8.35-lg[Ca2+]-lg(A+10-pHs-10-14+pHs)+lg(1+2×10-10.38+pHs) (12-16,)
此方程的等号两边都具有变量pHS,且有的含在对数符号内,难以精确求解。我们可以采用近似计算 方法 逐次逼近的迭代计算方法来求解。具体做法为:先将给出的条件[Ca2+](假定0.003mol/L) 及碱度A(假定0.002mol/L)的值代入方程,先假定一个pH值代入方程等号右边的pHS中,求出第一 次近似值pHS1;再将此式代入式12-16的右边,求出第二次近似值pHS2。如此循环迭代,计算所得的 值可收敛为一个几乎不变的数值(此处为pHs=7.25),即为所求方程的近似解。一般迭代3~5次即 可得出一个相当精确的pHS值。 [1]
http://210.30.64.60/etc/jpk/huaxue/kejian/dishierz.htm
2010-03-11
水环境化学
Page 9 of 14
图12-5 开放体系碳酸盐溶解度与pH的关系 (不考虑有羟基络合物生成时) 2.水稳定性的调整 在给水工程上,当水具有较强的侵蚀性或沉积性时,要对水进行稳定性调整。 实际是将pH调整到接近CaCO3的平衡状态。调整使用的药剂类型不同,调整方法也有所差异。
(1)加入或排出CO2气体 这种操作既不改变水中Ca2+含量,又不改变水的碱度。在调整过程中pHs 值不发生变化。所以,只要将水的实测pH调到pHs值即可。如果需要计算药剂用量,可以根据碱度和 调整前、后的pH值,利用下式计算调整前后的碳酸总量:
(12-22)
式中A为碱度,f1 、f2分别为碳酸HCO3-和CO32-的分布系数。调整前后碳酸总量之差,即为需用CO2 的量。负值为需排出的量,正值为需加入的量。
(2)加入非碳酸及无钙酸碱 这种操作不改变水中Ca2+含量和碳酸总量CTCO2 ,但在调整过程中碱 度不断发生变化。因此,pHS也随着调整的进行而不断变化。调整的目标pH就不能是最初计算出来的 pHS,而是另一个值pHS’ 。pHS’可根据CTCO2在调整前后不变化的特点来计算: a,根据调整前的pH,计算f1及f2,再根据调整前碱度A,用式12-22计算CT,CO2
b,根据Ca2+含量,计算与其平衡的CO32-含量
[CO32-] = Ksp / [Ca2+]
此即调整后水中应有的[CO32-]量,再根据CTCO2及[CO32-]求出f2
进而求出f2所对应的pH值,即为pHs’。调整时,将水的pH调整到pHs’值即满足了稳定性要求。 c, 计算调整后的碱度A’ :根据pHs’及CTCO2,利用式12-22可以计算碱度A’:
A = A’- A
http://210.30.64.60/etc/jpk/huaxue/kejian/dishierz.htm
2010-03-11
水环境化学
Page 10 of 14
A即为所需加入药剂的剂量。负值是加酸量;正值是加碱量。
(3)加入Na2CO3或Ca(OH)2调整:前者会使水的碱度增加,后者使水的碱度和Ca2+都增加。调整过程 中pHS不断变化。计算比较复杂,此处从略。
(四)钙含量与碱度、pH关系的讨论
一些内陆干旱地区碱度大的湖泊,水中总硬度、尤其钙含量都比较低,而pH却比较高。我们却又在 水总硬度的变化中提到呼吸作用可以使水pH下降、碱度硬度上升;光合作用则使水pH上升、碱度硬 度下降。这两现象初看起来好像是矛盾的。现在来分别加以讨论。
1.关于湖泊碱度大、钙含量低、pH高的现象 上面提到的干旱地区湖泊的现象是长期变化的结果, 基本表现为开放体系的特征,可以用开放体系的碳酸平衡来加以解释。在本章前面得到了关系式1215:
(12-15)
对开放体系,式中KH’PCO2 可以视为常数。开放体系如果达到平衡,钙含量是随着pH的升高而降低 的。在第四章第二节我们曾推导得到,开放体系的二氧化碳平衡系统总碱度
(4-23’)
从图4-6可知碱度随pH的升高而迅速上升 [2] 。或者反过来说,碱度较大的水体,其平衡pH值较 高。将式12-15和式4-23’ 综合起来分析,对开放体系的平衡,碱度升高,与其平衡的pH就上升、 钙含量就降低。所以,当湖水因某种原因积累了碱度以后,由于长期与大气的交换,水体的pH就会 升高,钙含量也就降低。即使往这种水体中补充钙,也会因为生成碳酸钙沉淀而除去。由于碳酸镁 的溶度积比碳酸钙大很多(大约是12倍),水中可以积累较多的镁离子。 2.关于光合作用和呼吸作用引起的碱度硬度变化 这一般是指短时间内的变化,水体还来不及建立 与大气的平衡,可以不考虑与大气的交换过程。光合作用和呼吸作用引起水中CO2的消耗和补充,就 改变了体系的碳酸总量,因此不具备前面讲到的封闭体系碳酸总量不变的特征。这时实际是下述平 衡的移动在引起碱度硬度的变化:
CaCO3 +H2O+CO2
Ca
2+
+2HCO3-
http://210.30.64.60/etc/jpk/huaxue/kejian/dishierz.htm
2010-03-11
水环境化学
Page 11 of 14
CaCO3MgCO3 +2H2O+2CO2
Ca
2+
+Mg2++4HCO3-
光合作用使平衡向左移动,呼吸作用使平衡向右移动,因而碱度硬度随之变化,pH也相应升高降 低。这在前面有关章节已经讲过,此处不再赘述。
第二节 碳酸盐和氢氧化物共存时的分级沉淀
碳酸根离子和氢氧根离子是在天然水中一般都存在的。当重金属离子进入天然水体后,能否生成碳 酸盐沉淀或氢氧化物沉淀?哪一种沉淀先生成?研究这个问题可以采用模拟实验的方法,也可以采 用已有的溶度积常数绘图来分析。下面我们以亚铁离子为例,介绍图解分析的方法。 1. 氢氧化亚铁溶解区域 前面提到在图12-1中,氢氧化亚铁pC-pH图是一条直线。这时考虑亚铁 离子在水中只有一种存在形态(Fe2+),实际上Fe(OH)2是与Fe++、FeOH+及Fe(OH)3- 3种形态平衡 pC-pH图是一条曲线(12—2)。下面介绍有关平衡反应式和图12—2的绘制:
1)Fe(OH)2(s)
Fe
2++2OH-
[Fe2+][OH-]2=K1=10-14.5 (12-23)
2)Fe(OH)2(s)
FeOH++OH-
[FeOH+][OH-]=K2=10-9.4 (12-24)
3)Fe(OH)2(s)+ OH-
Fe(OH)3-
(12-25)
在溶液中,上述3个平衡同时建立,同时满足。由于Fe(OH)2(s)的溶解而产生的水中亚铁离子是 Fe2+、FeOH+及Fe(OH)33种形态的总和,设为CT,Fe(Ⅱ)
CT,Fe(Ⅱ)= [Fe2+]+[FeOH+]+[Fe(OH)3-] (12-26)
将前三式代入上式:
http://210.30.64.60/etc/jpk/huaxue/kejian/dishierz.htm
2010-03-11
水环境化学
Page 12 of 14
(12-2 7)
lgCT,Fe(Ⅱ) = lg(1013.5-2pH+104.6-pH+1019.1+pH) (12-28)
方程(12—28)绘出的lgC-pH图如图12-2中的粗线条曲线。曲线以上部分是Fe(OH)2的稳定区域。 图中的三条细直线,是分别只考虑Fe2+或FeOH+或Fe(OH)3-一种形式时的平衡关系式。图中曲线表 明:FeOH+和Fe(OH)3-形态增加了Fe(OH)2的溶解度。PH>11.85后,pH的增加使Fe(OH)2的溶解度反 而增大。
2. 碳酸亚铁溶解区域 FeCO3也与水中Fe2+、FeOH+及Fe(OH)3-分别有平衡关系,其方程及平衡常 数为:
4)FeCO3(s)
Fe2++CO32-
[Fe2+][ CO32-]=Ksp=10-10.7 (12-29)
5)FeCO3(s)+OH-
FeOH++ CO32-
(12-30)
6)FeCO3(s) +3OH-
Fe(OH)3-+CO32-
(12-31)
同样有
http://210.30.64.60/etc/jpk/huaxue/kejian/dishierz.htm
2010-03-11
水环境化学
Page 13 of 14
(12-32)
设体系中CTCO2=1×10-3mol/L = 10-3.0 mol / L
已知
代入上式,整理可得
lgCTFe(Ⅱ)=lg (10-10.7+10-19.6+pH+10-43.3+3pH) -3.0 +16.76+lg(10-2pH+10-6.38-pH+10-16.76) (12 -33)
此式可以绘出图12-6中的粗线条曲线。图中细线条曲线是与FeCO3平衡的Fe2+、FeOH+及Fe(OH)3-的 浓度随pH变化曲线。 将两个图合并,绘成一个图,得图12-7。图中的垂直虚线是Fe(OH)2、FeCO3的分界线。在此线上, 两种沉淀同时等量发生。图中两条曲线和一条垂线共把图象从左至右分成A、B、C、D四个区。A区是 FeCO3沉淀区,只能发生FeCO3沉淀。B、C为FeCO3及Fe(OH)2可以同时沉淀区,当水的pH和亚铁含量在 这个区域内时,FeCO3及Fe(OH)2沉淀都可发生。但是在B区由于与FeCO3平衡的亚铁浓度更低,所以 更稳定,FeCO3优先生成。当体系的碳酸总量几乎反应完全后,Fe(OH)2才能稳定存在。在C区,情况 正好与B区相反,是Fe(OH)2比FeCO3更稳定。D为Fe(OH)2沉淀区。从FeCO3与Fe(OH)2的稳定性区分, 则A、B是FeCO3的稳定区,C、D是Fe(OH)2的稳定区。
图12-6 FeCO3溶解区域图图12-7 Fe(OH)2 、FeCO3分级沉淀区
http://210.30.64.60/etc/jpk/huaxue/kejian/dishierz.htm
2010-03-11
水环境化学
Page 14 of 14
需要说明的是,我们在绘图时忽略了电解质对活度系数的影响(认为活度系数为1)。对于淡水这么 处理可以。对于海水或含盐量比较高的水质体系,则应该考虑离子强度对离子活度的影响。
[1] 注:利用Microsoft Excel软件进行迭代计算十分方便。在Excel工作表的A2单元格中输入函数 式: “=10.38 - 8.35 - LOG10 (0.003) - LOG10 (0.002+10^($Al)-10^ (-14+$Al)) + LOG10 (1+2*10^(-10.38+$Al)” 在Al单元格输入初次设定的pH值,比如11,用鼠标指向A2单元格的右下角,按住鼠标左键将鼠标向 下拉,则鼠标每向下移动一个单元格,就进行了一次迭代计算。收敛得快的,在3~5个单元格以 后,数值事实不变化了。逐次逼近迭代计算有一定条件,否则可能不收敛,详见有关近似计算书 籍。 [2] 这种关系从数学上也可以证明,将AT对[H+]求导后,A的一阶导数dA/d[H+] 为负值,A是[H+]的 减少函数,即[H+]越低(pH越高),AT越大。
http://210.30.64.60/etc/jpk/huaxue/kejian/dishierz.htm
2010-03-11
水环境化学名词解释
名词解释 总硬度Ht:在一般天然水中,主要是Ca2+和Mg2+,其它离子含量很少,通常以水中Ca2+和Mg2+的总含量称为水的总硬度Ht 碳酸盐硬度(Hc):由于水中含有Ca(HCO3)2和Mg(HCO3)2而形成的硬度,经煮沸后可把硬度去掉,这种硬度称为碳酸盐硬度,亦称暂时硬度。 非碳酸盐硬度(Hn):由于水中含有CaSO4(CaCl2)和MgSO4(MgCl2 )等盐类物质而形成的硬度,经煮沸后也不能去除,这种硬度称为非碳酸盐硬度,亦称永久硬度。 当量粒子:对于还原性物质,一个当量粒子是指与1个氢原子具有相同的还原能力的粒子 毫克当量:对于还原性物质,与1mg(1mmol)氢的还原能力相等的物质叫做1毫克当量。含水率定义:树脂含水率一般以每克湿树脂(在水中充分膨胀)所含水分的百分比表示(约50%),并且相应地反映了树脂网架中的孔隙率 溶胀性定义:树脂体积变化的现象称为溶胀 全交换容量:一定量树脂所具有的活性基团或可交换离子的总数量。 工作交换容量:在给定工作条件下实际可利用的交换能力。 完交换容量:完全交换容量也称最大容量、理论容量,是干燥恒重的单位质量H型或Cl 型树脂中可交换离子(离子基团)的总数量。 固定床:离子交换树脂(或磺化煤)装填在离子交换器内。在操作过程中,树脂不往外输送,所以称之为固定床 复床指阳、阴离子交换器串联使用,达到水的除盐的目的。 半透膜:只允许溶质或溶剂透过的膜称为半透膜。 半透膜属于选择透过性膜。 选择透过性膜:如生物膜、细胞膜,扩散方式包括自由扩散、协助扩散、主动运输。 渗析 如果用膜把一个容器分隔成两部分,在膜的一侧放入溶液,在膜的另一侧放入纯水,则把小分子溶质透过膜向纯水侧的迁移过程称为渗析(溶质透过膜的现象)。 渗透 如果仅纯水侧的纯水透过膜向溶液侧迁移,而溶质不透过,这一过程称为渗透(溶剂透过膜的现象)。 水面的综合散热系数:在单位时间内、水面温度变化1oC时,水体通过单位表面散失的热量变化量,单位:W/(m2?oC) 湿空气:干空气和水蒸气所组成的混合空气。 饱和空气:当空气在某一定温度下,吸湿能力达到最大值时,空气中的水蒸气处于饱和状态,称为饱和空气。水蒸气的分压称为饱和蒸汽压力。 绝对湿度:每m3湿空气中所含水蒸气的质量称为空气的绝对湿度。 相对湿度:空气的绝对湿度和同温度下饱和空气的绝对湿度之比,成为湿空气的相对湿度。相对湿度是表示空气接近饱和的程度。相对湿度小的空气吸收水分能力强。 湿空气的密度:每m3湿空气中所含干空气的质量和水蒸气的质量之和。 湿空气的焓(i):表示1kg干空气和含湿量x公斤水蒸气的含热量之和。
水环境化学复习题
水环境化学复习题 7. 腐殖质分为哪些种类,通过哪些途径对水质产生影响? 8. 简述生物富集的概念和影响因素,并说明生物富集的生态环境意义。9. 说明辛醇/水分配系数的概念和作用。 10. 亨利常数的表达方式有哪些?怎样计算亨利常数?11. 葡萄糖的氧化反应式为:C6H12O6 + 6O2 =6CO2 + H2O 计算100 mg/L的葡萄糖完全氧化的理论耗氧量。 12. 某废水的BOD5为250 mg/L,其最终BOD为380 mg/L,试求其降解速率常数。 13 .某河段流量为Q = 2 160 000 m3/d, 流速为46 km/d,T=13.5℃,耗氧系数k1=1.14 d-1,复氧系数k2=1.85d-1,起始断面排污口排放的废水量为8×104 m3/d,废水含BOD5为500 mg/L, DO为0,上游河水BOD5为0,DO为8.95 mg/L。求排污口下游10 km处河水的BOD5和氧亏值以及极限溶解氧出现的距离。 14 .某芳烃类有机污染物的分子量为192,在水中的溶解度为0.05 mg/L,试估算其辛醇/水分配系数(kow)及在鱼体中的生物富集系数(logBCF)。 15 .某种鱼对水中的持久性污染物X的吸收速率常数ka为14.5h-1,鱼体消除X的速率常数ke为2.5×10-3h-1;若X在鱼体中的起始浓度为0,在水中的浓度保持不变,且实验期间鱼体体重保持不变。计算X在鱼体内的富集系数及其浓度达到稳态浓度95%时所需要的时间。
16 .已知二氯乙烷(CH2ClCH2Cl)在25℃时的饱和蒸汽压为82 mmHg,在水中的溶解度为8700 mg/L,计算在该温度下四氯化碳从6.5 cm厚水层中挥发的半衰期。十、水中的重金属 1. 天然水体中的重金属大约有几种存在形态? 2. 影响水中重金属存在形态的因素有哪些? 3. 影响水中重金属毒性的因素有哪些?它们都如何影响重金属的毒性? 4. 何谓金属元素在水环境中的迁移?有哪些迁移基本类型? 5. 元素在地表环境中迁移的特点有哪些? 6. 影响元素在地表环境中迁移的因素是什么? 7. 有哪些因素可以影响沉积物中的重金属向上覆水中释放? 8. 沉积物中的金属有哪些存在形态?9. 如何评价沉积物中重金属的生物有效性?十一、配位解离平衡 1、决定络合物稳定性的因素在哪几方面? 2、水环境中常见无机配位体和有机配位体有哪些? 3、水环境中的金属离子与配位体络合的一般规律如何? 4、Cl-对金属离子的络合作用有何特点? 5、OH-对金属离子的络合作用有何特点? 6、腐植质对对重金属离子迁移转化有何影响? 7、举例说明EDTA在水产养殖上的应用?十二、溶解与沉淀 1.天然水体中的溶解和沉淀平衡的复杂性表现在哪里? 2.难溶金属氢氧化物的溶解度与pH的关系如何? 3.解释图12—2中的3条直线与一条曲线各表示什么意思? 4.如何绘制氢氧化亚铁与碳酸亚铁溶解度与pH的关系图?
养殖水环境化学习题
各章复习思考题及综合性模拟题 参考答案 第一章 一、名词解释 1、水质:水及其中杂质所共同表现出来的特征。 2、水质系:水和其中杂质所组成的一切复杂体系。 二、问答题(答题要点) 1、为什么说天然水是包含各种杂质的溶液或浊液? 答:天然水中溶解了多种盐类、气体和有机物,而且还含有泥沙、粘土颗粒、浮游生物、有机碎片等悬浮物质,所以说天然水是包括各种杂质的溶液和浊液。 2、水生生物与水、水质有何密切关系?(可问老师) 答:主要从水生生物生长、繁殖等与水、水质的关系及养殖生产的产量、质量与水、水质的关系这两个方面另以阐述。 第二章 一、名词解释 1、硬度:单位水体中所含二价和二价以金属离子的总量为水的硬度。 2、暂时硬度:水中的钙、镁的碳酸氢盐在煮沸后即分解成碳酸盐沉淀析出,故相应的硬度又称暂时硬度。 3、永久硬度:钙、镁的硫酸盐、氯化物等,用一般的煮沸方法不能把它们从水中除去,所以又称永久硬度。 4、电导率:在相距1cm用惰性金属制成的平行电极间,电解质溶液有1cm2面上所具有的电导,称为电导率。P32 5、离子活度:离子的有效浓度。P30 6、水的透明度:把透明度板沉入水中,至恰好看不见板面上的白色,此时水的深度即为水的透明度。 7、温跃层:温度随深度增加而迅速降低的水层。 8、水温的正分层:指夏季的上层温度高,下层温度低的分层情况。 9、水温的逆分层:指冬季的上层温度低,下层温度高的分层情况。 10、水温的全同温:指春秋季的上下层温度几乎相同的情况。 二、问答题(答题要点) 1、水的硬度如何分类? 答:单位水体中所含Ca2+、Mg2+的总量称为水的总硬度,按照造成硬度的阳离子的不同,硬度又可分为钙硬度和镁硬度。考虑阴离子组成,硬度可分为碳酸盐硬度(其中钙、镁的碳酸氢盐标定的硬度又称暂时硬度)和非碳酸盐硬度(又称永久硬度)。 2、硬度的常用单位有哪三种?这些单位之间如何相互换算? 答:常用单位有:mmol(1/2 Ca2+,1/2 Mg2+)·L-1;德国度(0H G)和mg(CaCO3)·L-1三种。 换算关系:1 mmol(1/2 Ca2+,1/2 Mg2+)·L-1=2.804 0H G=50.05 mg(CaCO3)·L-1。 3、鱼池水硬度变化与水生生物的呼吸作用和光合作用有何关系? 答:光合作用和呼吸作用会引起鱼池水硬度变化:光合作用使硬度减小,呼吸作用使硬度增大。 4、盐度小于24.9的海水,密度最大时的温度比冰点高,在冰下可以保持高于冰点温度的水层;在盐度为24.9的海水中密度最大时的温度与冰点相同:(24.9‰、-1.350C),纯水在3.980C时密度最大。 5、何谓硫酸盐的还原作用?发生硫酸盐还原作用的条件是什么?P56 答:在缺氧环境中,各种硫酸盐还原菌可把SO42-还原成硫化物,这一过程称为硫酸盐的还原作用的,其发生的条件是:(1)缺乏溶氧;(2)有丰富的有机物;(3)SO42-的含量(4)有微生物的参与。 6、硫元素在水体中有哪些转化作用? 答:硫元素在水体中的转化作用有:氧化作用、还原作用、化学沉淀或吸附沉淀和同化作用及蛋白质分解作用。 7、硫化氢在总硫化物中占的比例与哪些因素有关?为什么pH值降低的毒性增强?P56 答:H2S在总硫化物中占的比例主要与水温、pH值等有关,在硫化物的三种存在形式中,H2S毒性最强,pH下降,硫化氢在总硫化物中占的比例增加,毒性也随之增强。 8、养殖生产中可采取哪些措施防止硫化氢的生成及其毒害作用?P57 答:主要措施有:(1)促进水体垂直流转混合,打破其分层停滞状态,避免底泥、底层水发展为厌气状态。(2)尽可能保持底质、底层水层中性、微碱性(pH值8左右),极力避免底质、底层水呈酸性。(3)施用铁剂,提高底质、底层水中铁含量。(4)避免大量SO42-进入养殖水体。 9、为什么Fe2+、Fe3+、石灰水、黄泥水均可降低水中硫化物的毒性?P57 答:Fe2+、Fe3+可使硫化物转化为硫和硫化亚铁沉淀,黄泥含铁离子也具有此作用,而石灰水会增大水的pH值,降低硫化氢
水环境化学
水环境化学
Page 1 of 14
第十二章 水环境中的溶解与沉淀
教学一般要求 掌握:难溶氢氧化物溶解性与pH的关系。难溶硫化物、难溶碳酸盐的溶解性与pH及CT的关系。 初步掌握:开放体系与封闭体系中碳酸钙的溶解平衡,水稳定性的概念与调整。 了解:Fe(OH)2与FeCO3溶解平衡图。Fe(OH)2与FeCO3的分级沉淀和稳定性区域图的认识。 初步了解:Fe(OH)2与FeCO3稳定区域图的绘制。FeS、Fe(OH)2与FeCO3的分级沉淀。
第一节 天然水中各类固体的溶解平衡 一、常见固体的溶解性
(一) 天然水中溶解沉淀平衡的复杂性
溶解―沉淀平衡是固一液两相间的平衡,反应发生在两相的界面上。天然水是个组成复杂的体系, 增加了溶解―沉淀平衡的复杂性。难溶电解质的溶解规律可以用溶度积原理描述,天然水中的溶解 平衡有以下特点: 1,反应的滞后性。即平衡状态不是迅速达到,往往要滞后一段时间。因此,在天然水中常常会 发现沉淀物的过饱和状态。例如大洋表层水中的CaCO3一般都有一定的过饱和程度。升高温度,有结 晶核及生物作用,均可加速反应的进行。 2,最先生成的沉淀不一定是最稳定的形态,而是反应速度快的形态。这种形态经过一定时间的作 用,可以转化为更稳定的形态。例如,硅酸盐在沉淀析出时首先析出的是蛋白石,而不是更稳定的 石英。 3,吸附沉淀作用和共沉淀作用的存在,这使沉淀反应生成的固相组成复杂,使远未达到溶度积的成 分也可沉淀析出。 天然水在地球化学循环过程中不断侵蚀陆地,使其风化产物转入水体,最后进入海洋。其中80%左 右是悬浮物质,20%左右是溶解物质。在条件变化时,溶解的物质可以发生沉淀,悬浮物质也可溶 解。地面水中的主要离子成份就是径流在汇集过程中对岩石、土壤淋溶而形成的。这些成分主要来 自沉积岩。下面就天然水中较常见的沉淀物作简单介绍。
(二)硝酸盐、氯化物和硫酸盐
在常见化合物中,硝酸盐几乎全部是易溶的,氯化物和硫酸盐绝大多数也是易溶的。较常见的难溶 化合物有氯化银、氯化铅、硫酸铅、硫酸钡等。它们的溶度积常数见表12-1。另外,硫酸钙在水中 的溶解度也比较小(1.9g/L)。铅虽然是比较常见的污染重金属,但它在海水中,大部分被转移到
http://210.30.64.60/etc/jpk/huaxue/kejian/dishierz.htm
2010-03-11
水环境化学作业(1)
水环境化学作业(1) 一、填空题 1.天然水中的[总碱度]= +2 + [OH-] —。 2.水环境中胶体颗粒物的吸附作用有、和 3.影响胶体微粒聚沉的因素有_________、___________、_________、水体pH及流动状况,带相反电荷颗粒间的相互作用。 4.适用于水体颗粒物对污染物吸附的等温式有_______________、 _________________和_______________三种方程。其中 _______________可求饱和吸附量。 5.某一氧化还原体系的标准电极电位为0.771,其pE o为______。 6、腐殖质中不溶于NaOH的部分称为__________,可溶于NaOH的部分称为__________,既溶于碱又溶于酸的部分称为_________。 7、天然水的PE随水中溶解氧的减少而,因而表层水呈 环境。 二、简答题 1. 向某一含有碳酸的水体加入重碳酸盐,问:①总酸度、②总碱度、 ③无机酸度、④酚酞碱度、⑤CO2酸度,是增加还、减少还是不变。 2. 什么是表面吸附作用、离子交换吸附作用和专属吸附作用?并说明水合氧化物对金属离子的专属吸附和非专属吸附的区别。 3. 请说明水体中胶体的凝聚和絮凝之间的区别。 三、计算题 1.含镉废水通入H2S达到饱和并调整pH为8.0,计算水中剩余镉离子浓度。 [Ksp(CdS=7.9×10-27)]
2.用Langmuir方程描述悬浮物对溶质的吸附作用,假设溶液平衡浓度为 3.00×10-3mol/L,溶液中每克悬浮物固体吸附溶质0.50×10-3mol/L,当平衡浓度降至 1.00×10-3mol/L时, 每克吸附剂吸附溶质0.25×10-3mol/L,问每克吸附剂可以吸附溶质的限量是多少? 3. 若有水A,pH为7.5,其碱度为6.38 mmol/L,水B的pH为9.0, 碱度为0.80 mmol/L,若以等体积混合,问混合后的pH值是多少? 4. 在一个pH为6.5,碱度为1.6 mmol/L的水体中,若加入碳酸钠使其碱化,问需要加多少mmol/L的碳酸钠才能使水体pH值上升至8.0。若用NaOH强碱进行碱化,又需要多少碱?
水环境化学
第三章水环境化学 水是世界上分布最广的资源之一,也是人类与生物体赖以生存和发展必不可少的物质,但世界上可供人类利用的水资源很少,仅占地球水资源的0.64%。 水环境化学:是研究化学物质在天然水体中的存在形态、反应机制、迁移转化、归趋的规律与化学行为及其对生态环境的影响。它是环境化学的重要组成部分,这些研究将为水污染控制和水资源的保护提供科学的依据。 第一节 水的分布、基本特征及污染物存在形态 一、水的特征与分布 天然水中一般含有可溶性物质和悬浮物质(包括悬浮物、颗粒物、水生生物 等)。可溶性物质的组成十分复杂,主要是岩石在风化过程中,经水溶解迁移 的地壳矿物质。天然水中常见的八大离子占天然水中离子总量的95%-99%. 总含盐量:TDS=[Ca2+ + Mg2+ + K+ + Na+ ] + [Cl- + SO42- + HCO3- + NO3-] (2)水中的金属离子 水中金属离子的表示式常写成Mn+,其水合离子的分子式一般写作M(H2O)xn+。金属离子在水中可以以多种形态存在,一般为Fe(OH)2+,Fe2(OH)24+和Fe3+等形态存在。水溶液中金属离子的表示式常写成Mn+,预示着是简单的水合金属阳离子M(H2O)xn+。它可通过化学反应达到最稳定的状态,酸-碱、沉淀、配合及氧化-还原等反应是它们在水中达到最稳定状态的过程。各种形态的浓度可以通过平衡常数加以计算,见书P148页。 (3)气体在水中的溶解性 气体溶解在水中,对于生物种类的生存是非常重要的。一般来说大气中的气体分子与溶液中同种气体分子存在一种平衡,浓度关系服从Henny定律。 X(g)X(aq) (4)水生生物 水生生物可直接影响许多物质的浓度,其作用有代谢、摄取、存储和释放等。 自养生物:利用太阳能量和化学能量,把简单、无生命的无机一无机元素引进至复杂的生命分子中组成生命体,如藻类。 异养生物:利用自养生物产生的有机物作为能源及合成自身生命的原始物质。 藻类生成和分解是水体中进行光合作用(P)和呼吸作用(R)的一典型过程,可
《水环境化学》重点习题及参考答案
《水环境化学》重点习题及参考答案 1请推导出封闭和开放体系碳酸平衡中[H2CO3 ]、[HCO 3-]和[CO 32-]的表达式,并讨论这两个体系之间的区别。 解: (1) 封闭体系(溶解性C02与大气没有交换)中存在下列平衡 C02 + H20 -―- H2CO3* pK o=1.46 - + H2CO3* -―HCO3 + H pK i=6.35 - 2- + HCO3 -―C03 + H pK2=10.33 其中K i=[HCO3-][H+] / [H2CO3*] ,K2=[CO32-][H j / [HCO 3-] 用a、a和a分别表示三种碳酸化合态在总量中所占比例,得下面表达式 a= [H 2CO3*]/{[H 2CO3*] + [HCO 3] + [CO 32 ]} - - 2- a= [HCO3]/{[H 2CO3*] + [HCO 3] + [CO3 ]} a= [CO32 ]/{[H 2CO3*] + [HCO 3] + [CO32]} 把K i、K2的表达式代入以上三式,得 + +2-1 a= (1 + K i/[H ] + K1K2/[H ]2) 1 + + -1 a= (1 + [H ]/ K1 + K2/ [H ]) + 2 + -1 a= (1 + [H ] / K1K2 + [H ]/ K2) 设C T = [H 2CO3*] + [HCO 3-] + [CO 32-],则有 + + 2 -1 [H 2CO3*] = C T(1 + K1/[H ] + K1K2/[H ]) - + + -1 [HCO3] = C T(1 + [H ]/ K1 + K2/ [H ] ) 1 2- + 2 + -1 [CO3 ] = C T(1 + [H ] / K1K2 + [H ]/ K2) (2) 开放体系中CO2在气相和液相之间平衡,各种碳酸盐化合态的平衡浓度可 表示为P CO2和pH的函数。 依亨利定律:[CO2(aq)]= K H P CO2 溶液中,碳酸化合态相应为: C T = [CO2]/ a= K H P CO2/ a - + [HCO3]= ( a/ a )K H P CO2= (K 1/[H ])K H P CO2
《水环境化学》重点习题及参考答案
《水环境化学》重点习题及参考答案1.请推导出封闭和开放体系碳酸平稳中[H2CO3*]、[HCO3-]和[CO32 -]的表达式,并讨论这两个体系之间的区别。 解: (1)封闭体系(溶解性CO2与大气没有交换)中存在下列平稳 CO2 + H2O H2CO3* pK0=1.46 H2CO3* HCO3- + H+ pK1=6.35 HCO3- CO32- + H+ pK2=10.33 其中K1=[HCO3-][H+] / [H2CO3*] ,K2=[CO32-][H+] / [HCO3-] 用α0、α1和α2分别表示三种碳酸化合态在总量中所占比例,得下面表达式 α0= [H2CO3*]/{[H2CO3*] + [HCO3-] + [CO32-]} α1= [HCO3-]/{[H2CO3*] + [HCO3-] + [CO32-]} α2= [CO32- ]/{[H2CO3*] + [HCO3-] + [CO32-]} 把K1、K2的表达式代入以上三式,得 α0= (1 + K1/[H+] + K1K2/[H+]2)-1 α1= (1 + [H+]/ K1 + K2/ [H+] )-1 α2= (1 + [H+]2/ K1K2 + [H+]/ K2)-1 设CT = [H2CO3*] + [HCO3-] + [CO32-],则有 [H2CO3*] = CT(1 + K1/[H+] + K1K2/[H+]2)-1 [HCO3-] = CT(1 + [H+]/ K1 + K2/ [H+] )-1 [CO32- ] = CT(1 + [H+]2/ K1K2 + [H+]/ K2)-1 (2)开放体系中CO2在气相和液相之间平稳,各种碳酸盐化合态的平稳浓度可表示为PCO2和pH的函数。 依亨利定律:[CO2(aq)]=KH·PCO2 溶液中,碳酸化合态相应为: CT = [CO2]/ α0= KH·PCO2/ α0 [HCO3-]= (α1/ α0 )KH·PCO2= (K1/[H+])KH·PCO2 [CO32-]= (α2/ α0 ) KH·PCO2= (K1K2/[H+]2)KH·PCO2
环境化学戴课后习题参考答案
第一章绪论 2、根据环境化学的任务、内容和特点以及发展动向,你认为怎样才能学好环境化学这门课 环境化学是一门研究有害化学物质在环境介质中的存在、化学特征、行为和效应及其控制的化学原理和方法的科学。环境化学以化学物质在环境中出现而引起环境问题为研究对象,以解决环境问题为目标的一门新型科学。其内容主要涉及:有害物质在环境介质中存在的浓度水平和形态,潜在有害物质的来源,他们在个别环境介质中和不同介质间的环境化学行为;有害物质对环境和生态系统以及人体健康产生效用的机制和风险性;有害物质已造成影响的缓解和消除以及防止产生危害的方法和途径。环境化学的特点是要从微观的原子、分子水平上来研究宏观的环境现象与变化的化学机制及其防治途径,其核心是研究化学污染物在环境中的化学转化和效应。目前,国界上较为重视元素(尤其是碳、氮、硫和磷)的生物地球化学循环及其相互偶合的研究;重视化学品安全评价、臭氧层破坏、气候变暖等全球变化问题。当前我国优先考虑的环境问题中与环境化学密切相关的是:以有机物污染为主的水质污染、以大气颗粒物和二氧化硫为主的城市空气污染;工业有毒有害废物和城市垃圾对水题和土壤的污染。 3、环境污染物有哪些类别主要的化学污染物有哪些 按环境要素可分为:大气污染物、水体污染物和工业污染物。 按污染物的形态可分为:气态污染物、液态污染物和固体污染物; 按污染物的性质可分为:化学污染物、物理污染物和生物污染物。 主要化学污染物有: 1.元素:如铅、镉、准金属等。 2.无机物:氧化物、一氧化碳、卤化氢、卤素化合物等 3.有机化合物及烃类:烷烃、不饱和脂肪烃、芳香烃、PAH等; 4.金属有机和准金属有机化合物:如,四乙基铅、二苯基铬、二甲基胂酸等; 5.含氧有机化合物:如环氧乙烷、醚、醛、有机酸、酐、酚等; 6.含氮有机化合物:胺、睛、硝基苯、三硝基甲苯、亚硝胺等; 7.有机卤化物:四氯化碳、多氯联苯、氯代二恶瑛; 8.有机硫化物:硫醇、二甲砜、硫酸二甲酯等; 9.有机磷化合物:磷酸酯化合物、有机磷农药、有机磷军用毒气等。 第二章:大气环境化学 4.影响大气中污染物迁移的主要因素是什么 主要有:(1)空气的机械运动如风和大气湍流的影响; (2)天气和地理地势的影响;(3)污染源本身的特性。 7.大气中有哪些重要自由基其来源如何 大气中主要自由基有:HO、HO2、R、RO2 HO的来源:①O3的光解:O3+hr O+O2 O+H2O 2HO ②HNO2的光解:HNO2 +hr HO +NO ③H2O2的光解:H2O2+hr 2HO HO2的来源:①主要来自醛特别是甲醛的光解 H2CO +hr H + HCO HO2 + M H + O2 + M HCO + O2 +M HO2 + CO + M CH3O + NO ②亚硝酸酯的光解:CH3ONO +hr CH3O + O2HO2 + H2CO ③H2O2的光解:H2O2+hr 2HO HO + H2O2HO2 + H2O R的来源:RH + O R + HO RH + HO R + H2O CH3的来源:CH3CHO的光解 CH3CHO +hr C H3 + CHO CH3COCH3的光解 CH3COCH3 +hr CH3 + CH3CO CH3O的来源:甲基亚硝酸酯的光解 CH3ONO +hr CH3O + NO
(完整版)第三章水环境化学答案
第三章 水环境化学 1、 请推导出封闭和开放体系碳酸平衡中[H 2CO 3*]、[HCO 3-]和[CO 32-]的表达式,并讨论 这两个体系之间的区别。 解: 开放体系,考虑到CO 2在气液相之间的平衡,[H 2CO 3*] 不变 根据亨利定律: [CO 2(aq)] = K H Pco 2 lg[H 2CO 3*] ≈ lg[CO 2(aq)] = lg K H + lg Pco 2 = - 4.9 lg[HCO 3-] = lg K 1 + lg [H 2CO 3*] + pH = -11.3 + pH lg[CO 32-] = lgK 1 + lgK 2 + lg[H 2CO 3*] + 2pH = -21.6 + 2pH *][][][*][]][[32133231CO H H K HCO CO H HCO H K +--+== *][] [][*] [] [][32221233223221CO H H K K CO CO H CO H K K +--+?== ?][][][233*32- -++=CO HCO CO H C T 是常数。 的总和为各种碳酸化合态浓度假设,T C T C HCO ??????-=31αT C CO ??????-=232αT C CO H ??? ???*=320α12 2122)][][1(-+ ++=K H K K H α1211)][][1(-++++=H K K H α122110)][][1(-++++=H K K H K α*][][][*][]][[32133 231 CO H H K HCO CO H HCO H K +-- +==*][][][*][][][32221233223221CO H H K K CO CO H CO H K K +--+?==?] [][][][2 1233* 32+--H K K CO HCO C CO H T 和含有的表示式,,为变量表示以:,][],[*],[21023332得到,,代入把αααT C CO HCO CO H --
水环境化学
水环境化学 1、水中八大离子:K +、Na +、Ca 2+、Mg 2+、HCO 3-、NO 3-、Cl -和SO 42-为常见八种离子 2、溶解气体与Henry 定律:溶解于水中的气体与大气中的气体存在平衡关系,气体的大气分压P G 与气体的溶解度的比表现为常数关系,称为Henry 定律,该常数称为Henry 定律常数K H 。 [G(aq)] = K H PG K H -气体在一定温度下的亨利定理常数 (mol/L.Pa) PG - 各种气体的分压 (Pa) 3、水体中可能存在的碳酸组分 CO 2、CO 32-、HCO 3-、H 2CO 3 ( H 2CO 3*) 4、天然水中的碱度和酸度:碱度:水中能与强酸发生中和作用的全部物质,即能够接受质子H+的物质总量;酸度:凡在水中离解或水解后生成可与强碱(OH -)反应的物质(包括强酸、弱酸和强酸弱碱盐)总量;即水中能与强碱发生中和作用的物质总量。 5、天然水中的总碱度=HCO3-+2CO32-+ OH- —H+ 6、水体中颗粒物的类别(1)矿物微粒和粘土矿物(铝或镁的硅酸盐 )(2)金属水合氧化物(铝、铁、锰、硅等金属 )(3)腐殖质 (4)水体悬浮沉积物 (5)其他(藻类、细菌、病毒等) 影响水体中颗粒物吸附作用的因素有:颗粒物浓度、温度、PH 。 7、水环境中胶体颗粒物的吸附作用有 表面吸附 、化学吸附、离子交换吸附 和 专属吸附。 8、天然水的PE 随水中溶解氧的减少而 降低 ,因而表层水呈 氧化性 环境。 9、吸附等温线:在一定温度,处于平衡状态时被吸附的物质和该物质在溶液中的浓度的关系曲线称为吸附等温线;水环境中常见的吸附等温线主要有L -型、F -型和H -型。 10、无机物在水中的迁移转化过程:分配作用、挥发作用、水解作用、光解作用、生物富集、生物降解作用。 11、PE:pE 越小,电子活度越高,提供电子的倾向越强,水体呈还原性。pE 越大,电子活度越低,接受电子的倾向越强,水体呈氧化性 。 pe 影响因素:1)天然水的pE 随水中溶解氧的减少而降低;2)天然水的pE 随其pH 减少而增大。 12、什么是电子活度pE ,以及pE 和pH 的区别。 答:定义电极上电子有效浓度为电子活度,记作E ,其负对数记作pE 。电子活度越大或pE 越小,电子供出电子的倾向越大。在电化学研究中,通常用电极电位表示电极供出或接受电子的倾向,当给出电子活度E 和电子活度的负对数pE 明确的热力学意义之后,就可以
水环境化学复习题一
资料收集于网络,如有侵权请联系网站删除 自净系数:是大气复氧动力学系数k2与有机物好氧条件下的耗氧衰减动力学系数k1之比,即f=k2/k1。自净系数与水体自净能力有关,其它因素确定后,f 越大,自净能力越强。 剪切流扩散(离散、弥散):由于断面流速和浓度分布不均匀带来的物质输送作用,使浓度由不均匀向均匀趋势变化的现象称为弥散作用。 温跃层:许多湖泊水体在一年的特定时期温度是分层的,垂向的温度梯度有效地阻碍了水体的混合,在每层中是完全混合的,而在这两层之间由于密度的差异而阻止了它们的完全混合,形成一个过渡层,称温跃层。 非点源污染:污染源没有确定的位置、并具有时空不确定性等。 水环境背景值:在相对没有受到人为污染影响条件下水体的水质指标的量值。水环境容量:水环境容量是指在一定环境目标下,某一水域所能承担的外加的某种污染物的最大允许负荷量。 有机污染物的降解:有机污染物在微生物的生物化学作用下分解和转化为无机物质,从而使水体中有机污染浓度降低,称为有机污染物的降解。 水中氮有机物耗氧过程:在有氧条件下,含氮有机物生化降解过程可分为两个阶段,首先是碳化阶段(CBOD氧化分解),然后硝化阶段(NBOD氧化分解),后者一般较前者滞后10天左右。 河流氧垂曲线氧垂曲线:污水排入水体后水体中的DO随流经距离的变化曲线先下降后上升呈悬索状下垂,故称氧垂曲线。 水质迁移转化基本方程:水质迁移转化基本方程是由水流连续性原理、能量守恒原理、物质转化与平衡原理针对微元水体建立的微分方程式,它是建立水质模型最基本的方程。 何谓点源污染和面源污染?两种污染源各有何特点? 点源污染是具有确定位置的排污口和污染物排放地点的污染源引起的污染。 非点源污染是没有集中的排污口,污染物来源的位置高度分散的非点污染源造成的污染。点源污染空间范围小,各类污染物、污水量和浓度相对稳定,较便于治理。非点源污染的特点是:随机性、广泛性、时空延滞性、机理复杂性、不确定性、隐蔽性、难监测、难治理性等。 水体污染与水文循环有何联系?试从水文循环的各个环节上给以说明。 在水文循环中,水与各种各样的物质接触,使那些物质混入或溶入其中,并经历着不断的物理、化学、生物等变化过程。因此,自然界的水体中存在着种类繁多的可能使水体污染的不同物质,称之为污染物。当某些物质超过一定限度,危害人类生存和破坏生态平衡,影响水的用途时,称该水体受到了污染。水体的污染可以发生在水文循环的各个环节上,在降水形成中,若空气中NO、SO溶入过22只供学习与交流. 资料收集于网络,如有侵权请联系网站删除 2--使pH值低于SO5.6,NO,则导致酸雨,即降水受到了污染;沿河多降水中的34流有大量的工厂废水和城镇生活污水排入,可能形成局部或整条河流的污染;挟带过多的氮、磷等植物营养素的农田径流进入湖泊和水库,长期富集时,可能出现富营养化污染;地面污水大量渗入地下,可能使地下水污染。 从性质上说水体的自净可分为哪三个方面?各自有何特点?各举例说明。 水体自净是水体中的污染物随水体的运动不停地发生变化,自然地减少、消失或
水环境化学期末知识点总结
1 反映天然水含盐量参数:离子总量矿化度(淡水)盐度氯度(海水) 2 淡水中的八种离子:Ca+ Mg2+ Na- K+ Cl-HCO3-CO32-SO42- 海水中多出的几种是Br- F- B- Sr- 3 盐度与氯度的关系:S‰=1.80655Cl‰ 4 条件密度A与标准密度B的关系:A=(B-1)*1000 g/cm3 5 阴阳离子含量比例将水分为四型 6 冰点↓与盐度↑的关系呈直线;蒸汽压↓与盐度↑的关系也呈直线; 渗透压↑与盐度↑的关系也呈直线 7 光合作用速率(A) 呼吸作用速率(B) A>B 营养生成层A
成因:海水通过潮汐、环流、垂直流及风浪的长期不断混合作用 水体体积大、各种变化因素很难改变各成分的关系 意义:总含盐量可有测某一主要成分而间接求出 物理性质与海水某一主要成分之间也存在定量关系 对于养殖生产也有重要意义 特例:海水中碳酸氢根及碱度的恒定性比较差因为其本身含量少 Ca/Cl的比值随水深度的增加而增大 河口区海水常量成分与大洋水一致 13 影响气体溶解度的因素:气体本身的性质、温度、含盐量、气体分压力 14 影响气体溶解度速率的因素:气体的不饱和程度、水的单位体积表面积、扰动情况 15 养殖水体中的氧气来源:空气溶解、光合作用(主要)、补水 16 水中的氧气消耗:鱼虾等养殖生物的呼吸、水中微型生物耗氧(主要)(水呼吸)、底质耗氧、逸出 17 溶氧日变化中最高值与最低值之差称为日较差 日较差较大时,水体产氧与耗氧相对较多,说明水中的浮游植物较多,浮游动物和有机物质的量适中,也就是饵料生物较为丰富,有利于鱼类的生长,在溶氧最低值不影响养殖鱼类生长的前提下,日较差越大越好。 18 溶氧的意义:溶氧量低会影响鱼虾的摄饵量及饵料系数 溶氧量低也会增加养殖鱼虾的发病率 溶氧量低将导致胚胎发育异常 溶氧量低会增加毒物的毒性 溶氧量过高(过饱和)将会引起气泡病(增加含盐量以治疗) 19 溶氧的调控:降低水体的耗氧速率及数量(清淤沉淀有机物等) 加强增氧作用、提高水中的溶氧浓度(加入活性沸石)
水环境化学试题
水环境化学A卷参考答案及评分标准2008-2009学年第一学期 一、填空(25 分,每个填空1分) 1、天然淡水中含有的主要阳离子有钙、镁、钠、钾。 2、某水中的优势阴离子为SO42- , 优势阳离子为Ca2+, 不含CO32-或HCO3-离子, 该类型水用符号表示为S Ca IV 3、按照阿列金分类法,海水一般就是III 型水,淡水一般就是II 型水。 4、海水盐度为24、7‰ 时,最大密度时的温度等于冰点温度。 5、天然水的盐度增大会使蒸汽压下降,渗透压增大。 6、在陆地水水质调查中,K+与Na+含量的测定方法就是计算阴离子量与Ca2+、Mg2+总量之差。 7、海水总碱度可简化为ALK = C HCO3-+ C1/2CO32- + C H2BO3-。 8、水中氧气的来源主要就是水生植物光合作用,水中氧气的消耗主要就是水中微型生物耗氧 (水呼吸)。 9、贫营养型湖泊,夏季形成温跃层,上层水温高、氧气溶解度低,下层水温低、氧气溶解度高。 10、淡水中,pH =8、3 时,HCO3-最多; pH >10、4时, CO32-占优势。随着海水氯度与温度 增大,二氧化碳系统各分量与pH的关系曲线向左移动。 11、水的溶氧升高,硫化氢的毒性减小;pH升高,硫化氢的毒性减小。 12、水中加入1mol/L的碳酸钠后,水体的碳酸总量增大 1 mol/L,碱度增大 2 mol/L。 13、若米氏常数K M平均为 1 umol/L , 则有效磷浓度应不低于3umol/L 的范围。 14、一般情况下,若天然水或养殖用水中的氧化还原电位为0、4V 左右时,可认为该水 体处于良好的氧化状态。 三、名词解释( 10分,每题2分) 1、天然水体的Eh 值:在一个氧化-还原系统中,由于电子得失,产生的可被测量的电位,称为氧 化还原电位。反映水的氧化还原状况,了解水质的状态,并可作为水体氧化还原能力的度量。 2、活性磷化合物:能与酸性钼酸盐反应的,包括磷酸盐,部分溶解状态的有机磷,吸附在悬浮物 表面的磷酸盐以及一部分在酸性中可以溶解的颗粒态无机磷等。 3、泛池:集约化养殖由于放养密度大、投饵与施肥量较多,加之浮游生物的突然大量死亡,可 分解耗氧导致水体的严重缺氧,鱼类浮头,甚至窒息死亡的现象。 4、暂时硬度:指碳酸盐硬度,水加热煮沸后形成碳酸钙沉淀而除去。 5、BOD:生化需氧量,在 规定条件下,水体中有机物在微生物作用下进行生物氧化时所消耗的溶解氧的数量。 四、问答题(34分) 1、含铁丰富的地下水注入鱼池后水质如何变化?(5分) 答案要点:含大量铁的地下水大量注入鱼池,会使水质状况发生一系列变化。首先就是Fe2+被氧化成Fe(OH)3,水变混浊,pH值降低:4Fe2++O2+10H2O 4Fe(OH)3+8H+生成的Fe(OH)3絮凝时会将水中的藻类及悬浮物一并混凝、下沉, 使水又逐渐变清。过些天浮游植物又繁生,水又渐渐变浑,pH又回升。(3分)大量Fe2+氧化需要消耗水中的溶氧,水中生成的大量Fe(OH)3微粒会堵塞鱼鳃,聚沉藻类。(2分) 2、为什么可以用电导仪来测海水的盐度?(5分) 答案要点:根据海水组成的恒定性原理,海水的总含盐量或盐度就是可变的,但常量成分浓度之间的比值几乎保持恒定。(3分)由于海水的主要成分的比例恒定,因此电导率与 与盐度有很精确的关系,所以可以用电导仪来测海水的盐度。(2分) 3、溶氧丰富的水中,投饵后,食物残渣与粪便中的氮就是通过哪些作用在水中逐步转变成硝态 氮?(7分)
水环境化学
1.水温的垂直分布有明显的季节特点 1)冬季的逆分层期 2)春季的全同温期 3)夏季的正分层期(停滞期) 4)秋季的全同温期 2.硬度硬度是指水中的二价及多价金属离子含量的总和。 3.水硬度单位的换算关系 1mmol/L=2.804O H C=50.05mg/(CaCO3) 4.天然水硬度的分类 德国度(O H C) 极软水0~4 软水4~8 中等软水8~16 硬水16~30 极硬水30以上 5.养殖用水碱度的适宜量以1~3mmol/L较好。除天然浓度较低者外,为了保护淡水生物, 以CaCO3表示的碱度应不小于20mg/L。 四大家鱼养殖用水的碱度的危险指标值是10mmol/L。 6.海水主要离子组成的恒定性 海水中的主要成分的含量比例几乎是恒定的,只是盐分含量总值不同。 原因:大洋海水通过潮汐、环流、垂直流及风浪长期不断的混合作用,是主要成分混合均匀,且因水体体积大,分钟欧诺个变化因素都很难明显改变各组分的比例关系。 7.影响气体在水中溶解度的因素 1)温度:一般温度升高气体在水中的溶解度降低。 2)含盐量:当温度、压力一定时,水含盐量增加,会使气体在水中的溶解度降低。 3)气体分压力:在温度与含盐量一定时,气体在水中的溶解度随气体的分压增加而增加。 8.影响气体溶解速率的因素 1)气体的不饱和程度 2)水的单位体积表面积 3)扰动状况 9.日较差:溶解日变化中,最高值与最低值之差称为昼夜变化幅度,简称“日较差”。日 较差的大小可反映水体产氧与耗氧的相对强度. 10.必需元素是直接参与生物的营养、其功能不能被别的元素替代、生物生命活动不可缺 少的元素。 11.藻类对营养盐的吸收特点通常把天然水中的溶性氮、磷、硅的无机化合物称为水生 植物营养盐。 12.天然水中氮的来源和转化 1)氮化作用含氮有机物在微生物作用下分解释放氨态氮的过程。 2)同化作用水生植物通过吸收利用天然水中的NH+4(NH3)、NO-2、NO-3等合成自身的物质。 3)硝化作用在通气良好的天然水中,经硝化细菌的作用,氨可进一步被氧化为NO3。 4)脱氮作用脱氮作用是在微生物的作用下,硝酸盐或亚硝酸盐被还原为一氧化二氮(N2O)或氮气(N2)的过程。
水环境化学试卷答案
新疆农业大学试卷答案 新疆农业大学2012—2013学年度第二学期期末考试 课程名称:水环境化学 学生姓名:杨志敏学号: 113836233 专业:水文与水资源工程班级:水文112班课程性质: 1、选择题(共10分,每小题2分。) 1.A 2.D 3.B 4.B 5.A 2、填空题(共25分,每一个空1分。) 1.可溶性物质、悬浮物质 2.DO、BOD、COD、TOC、TOD 3.大气中氧的溶解、光合作用、水体补给 4.大小、形状、荷电状态 5.有机胶体、无机胶体、有机-无机胶体复合体 6.迁移 7.浮游生物、真核生物、原核生物 8.专一性、诱导性
9.氧化还原作用、甲基化作用 10.现场实验模拟、实验室实验模拟 三、名词解释(共15分,每小题3分。) 1.水质指标:指的是水样中除水分子外所含杂质的种类和数量。 2.腐殖质:腐殖质是已死的生物体在土壤中经微生物分解而形成的有机物质,黑褐色,含有植物生长发育所需要的一些元素,能改善土壤,增加肥力。 3.标化分配系数:有机碳为基础表示的分配系数成为标化分配系数。 4.水体自净:是指水体受到污染后,内部发生一系列物理,化学,生物等方面的作用,使污染物浓度逐渐降低,经过一段时间后恢复到污染前的状态。 5.光化学平衡:由光化学反应参与的可逆反应所达到的平衡。 四、简答题(共30分,每小题6分。) 1.(1)物理指标(2)化学指标: 非专一性指标 无机物指标 非专一性有机物指标 溶解性气体(3)生物指标(4)放射性指标 2.氧在水中的溶解度指的是水体和大气处于平衡时氧的最大溶解量,它的数值与温度、压力、水中的溶质量等因素有关。水中溶解氧量则一般是指非平衡状态下的水中溶解氧的浓度,它的数值与水体曝气作用、光合作用、呼吸作用及有机污
水环境化学部分-本科-答案2008
昆明理工大学环境工程专业2008级环境化学习题 (水环境化学部分) 一、选择题 1、海水中Hg2+主要以_______的形式存在。 a) Hg(OH)2 , HgCl2 b) HgCl2 , HgCl3- c) HgCl42- d) HgCl3- , HgCl42- 2、若水体的pE值高,有利于下列_______ 组在水体中迁移。 a) Fe、Mn b) Cr、Fe c) Cr、Mn d) Cr、V 3、当前最简单,也较流行的是将金属划分为溶解态和颗粒态,溶解态是能通过______μm孔径 滤膜的部分。 a) 0.54 b) 0.22 c) 0.45 d) 0.50 4、河水中阴、阳离子的含量顺序为______。 a) Na+ > Mg2+ > Ca2+,HCO3- > SO42- > Cl- b) Ca2+ > Na+ > Mg2+,HCO3- > SO42- > Cl- c) Na+ > Ca2+ > Mg2+,Cl- > HCO3- > SO42- d) Na+ > Mg2+ > Ca2+,Cl- > SO42-> HCO3- 5、某一水体的BOD20为100 mg/L,其BOD5约为__________。 a)40 b) 50 c) 35 d) 70 6、下列各种形态的汞化物,毒性最大的是______。 a) Hg(CH3)2 b) HgO c) Hg d) Hg2Cl2 7、有机物的辛醇-水分配系数常用________表示。 a)K oc b) K ow c) K om d) K d 8、一般情况下,当水体DO______时,鱼类会死亡。 a) >8.0mg/L b) <4.0 mg/L c) >0 d) >4.0 mg/L 9、表面活性剂含有很强的,容易使不溶于水的物质分散于水体,而长期随水流迁移。 A 疏水基团B亲水基团 C 吸附作用 D渗透作用
