(完整word)高中阶段常见酸碱盐溶解性表
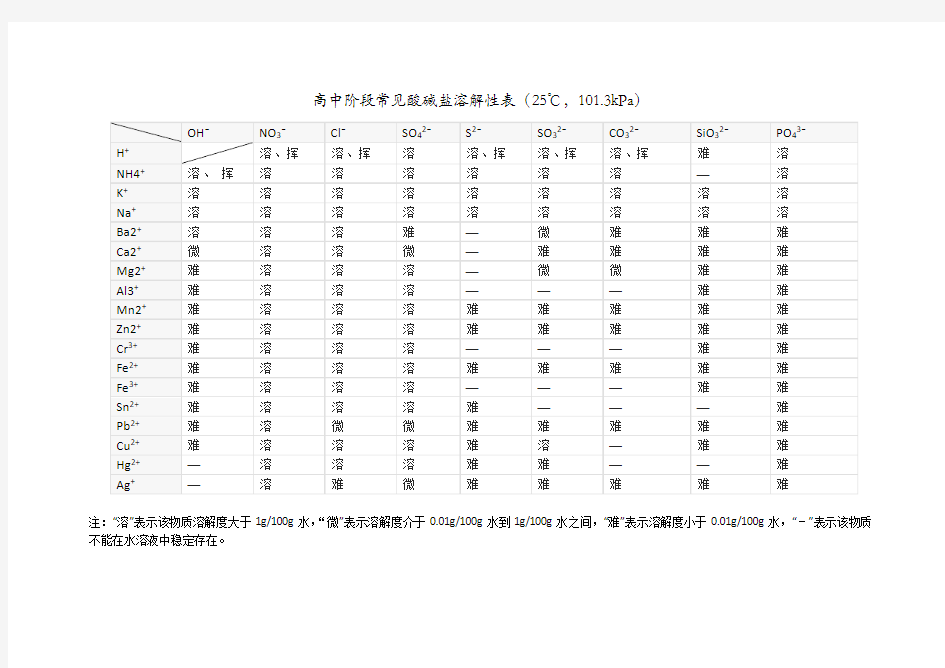
高中阶段常见酸碱盐溶解性表(25℃,101.3kPa)
注:“溶”表示该物质溶解度大于1g/100g水,“微”表示溶解度介于0.01g/100g水到1g/100g水之间,“难”表示溶解度小于0.01g/100g水,“-”表示该物质不能在水溶液中稳定存在。
初三化学酸碱盐知识点[最全整理版]
应用广泛的酸、碱、盐 § 7.1溶液的酸碱性一、酸性溶液和碱性溶液 1.实验:检验溶液的酸碱性 实验试样白醋 酸果 汁稀盐 酸 纯碱溶 液 肥皂 水 石灰 水 氨水 食盐 水 蔗糖 水 滴加紫色 石蕊试液 变红变红变红变蓝变蓝变蓝变蓝紫色紫色滴加无色 酚酞试液 无色无色无色变红变红变红变红无色无色结论酸性酸性酸性碱性碱性碱性碱性中性中性 结论: (1)凡是能使紫色石蕊试液变红的溶液都是酸性 ..溶液,并且该溶液不能使无色酚酞试液变色; (2)凡是能使紫色石蕊试液变蓝的溶液都是碱性 ..溶液,并且该溶液能使无色酚酞试液变红;(3)不能使紫色石蕊试液变色,也不能使无色酚酞试液变色的溶液,我们称为中性溶液。(4)如紫色石蕊试液及无色酚酞等能检验溶液酸碱性的试液,称为酸碱指示剂。 注意:①我们有时候还用蓝色或红色石蕊试纸来检验溶液的酸碱性; ②酸性溶液能使蓝色石蕊试纸变红,碱性溶液能使红色石蕊试纸变蓝; ③只有可溶性的酸性、碱性物质才能使指示剂变色,变色的是指示剂,而不是该物质。2.日常生活中常见的酸性物质与碱性物质 (1)酸性物质:山楂、柠檬、柑橘、西红柿等; (2)碱性物质:茶叶碱、烟碱等。
3.区分酸溶液和酸性溶液、碱溶液和碱性溶液 注意:酸溶液是指酸的水溶液,酸性溶液是指能使紫色石蕊试液变红的溶液,因此酸溶液一定是酸性溶液,而酸性溶液不一定是酸溶液;同样,碱性溶液不一定是碱溶液,碱溶液一定是碱性溶液。 例如:硫酸铜、氯化铵的水溶液显酸性,而不是酸;纯碱、肥皂的水溶液显碱性,但不是碱。4.补充知识:酸、碱、盐的概念 (1)酸:电离时生成的阳离子全部 ..是氢离子的化合物。如:HCl、HNO3、H2SO4、H2CO3等。 HCl==H++Cl-;H2SO4==2H++SO42-; (2)碱:电离时生成的阴离子全部 ..是氢氧根离子的化合物。如:NaOH、Ca(OH)2等。 NaOH==Na++OH-;Ca(OH)2==Ca2++2OH-; (3)盐:电离时生成金属离子(或铵根离子)和酸根离子的化合物。如:NaCl、NH4NO3等。 NaCl==Na++Cl-;NH4NO3==NH4++NO3-; 二、溶液的酸碱性的强弱 1.酸碱度:用来表示溶液的酸性或碱性的强弱程度。 2.pH试纸用来定量的测定溶液的酸碱度。 pH值 1 2 3 4 5 6 7 8 9 10 11 12 13 14 | 酸性增强中性碱性增强 溶液的pH值与酸碱性关系: pH=7,溶液呈中性;pH<7,溶液呈酸性,且pH越小,酸性越强;pH>7,溶液呈碱性,且 pH越大,碱性越强。 3.pH试纸的使用方法:
初中化学溶解性表
1.2Mg+O2点燃或Δ2MgO 化学反应现象:剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟应用:白色信号弹
2.2Hg+O2点燃或Δ2HgO 化学反应现象:银白液体、生成红色固体 应用:拉瓦锡实验 3.4Al+3O2Δ2Al2O3 化学反应现象:银白金属变为白色固体 4.3Fe+2O2点燃Fe3O4 化学反应现象:剧烈燃烧、火星四射、生成黑色固体、放出大量热 5.C+O2点燃CO2 化学反应现象:剧烈燃烧、白光、放热、使石灰水变浑浊 6.S+O2点燃SO2 化学反应现象:剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰 7.2H2+O2点燃2H2O 化学反应现象:淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水) 应用:高能燃料 8.4P+5O2点燃2P2O5 化学反应现象:剧烈燃烧、大量白烟、放热、生成白色固体 应用:证明空气中氧气含量 9.CH4+2O2点燃2H2O+CO2 化学反应现象:蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)应用:甲烷和天然气的燃烧 10.2KClO3 MnO2Δ 2KCl +3O2↑ 化学反应现象:生成使带火星的木条复燃的气体 应用:实验室制备氧气 11.2KMnO4Δ K2MnO4+MnO2+O2↑ 化学反应现象:紫色变为黑色、生成使带火星木条复燃的气体 应用:实验室制备氧气 12.2HgOΔ2Hg+O2↑ 化学反应现象:红色变为银白、生成使带火星木条复燃的气体 应用:拉瓦锡实验 13.2H2O通电2H2↑+O2↑ 化学反应现象:水通电分解为氢气和氧气 应用:电解水 14.Cu2(OH)2CO3Δ2CuO+H2O+CO2↑ 化学反应现象:绿色变黑色、试管壁有液体、使石灰水变浑浊气体 应用:铜绿加热 15.NH4HCO3ΔNH3↑+ H2O +CO2↑ 化学反应现象:白色固体消失、管壁有液体、使石灰水变浑浊气体 应用:碳酸氢铵长期暴露空气中会消失 16.Zn+H2SO4=ZnSO4+H2↑ 化学反应现象:有大量气泡产生、锌粒逐渐溶解 应用:实验室制备氢气 17.Fe+H2SO4=FeSO4+H2↑ 化学反应现象:有大量气泡产生、金属颗粒逐渐溶解 18.Mg+H2SO4 =MgSO4+H2↑ 化学反应现象:有大量气泡产生、金属颗粒逐渐溶解 19.2Al+3H2SO4=Al2(SO4)3+3H2↑ 化学反应现象:有大量气泡产生、金属颗粒逐渐溶解 20.Fe2O3+3H2Δ 2Fe+3H2O 化学反应现象:红色逐渐变为银白色、试管壁有液体
初中化学中溶解度的计算
初中化学中溶解度的计算 一定温度下,一定量的溶剂中所溶解物质的质量是一定的,反之,任意量的饱和溶液里溶质质量与溶剂质量或溶质质量与溶液的质量比是一定的,如果把一定温度下溶剂的量规定为100g,此时所溶解溶质形成饱和溶液时的质量称为溶解度。由此可得以下关系: 溶解度————100g溶剂————100+溶解度 (溶质质量) (溶剂质量) (饱和溶液质量) 可得出以下正比例关系: 式中W溶质、W溶剂、W饱和溶液分别表示饱和溶液中溶质、溶剂和溶液的质量,S表示某温度时该溶质的溶解度。 在以上的比例式中,100是常量,其它3个量中只要知道其中2个量就可求出另外一个量。由此,不仅明确了溶解度的解题的基本思路就是比例关系,从而避免质量混淆的现象,而且也使学生明确溶解度计算的一题多种解法,并从中找出最佳解法。 一、已知一定温度下某物质饱和溶液里的溶质和溶剂的质量,求溶解度 例1 在一定温度下,ng某物质恰好溶于一定量的水中形成mg饱和溶液,求该物质在此温度下的溶解度。解;由题意可知,W溶液=W溶质+W溶剂,因此mg该物质的饱和溶液中含水的质量为:(m-n)g,此题可代入分式(1): 设某温度下该物质的溶解度为Sg 也可代入分式(2) 二、已知一定温度下某物质的溶解度,求此温度下一定量的饱和溶液中含溶质和溶剂的质量 例2 已知在20℃时KNO3的溶解度为31.6g。现要在20℃时配制20gKNO3饱和溶液,需KNO3和H2O各几克? 解:设配制20℃20g硝酸钾饱和溶液需硝酸钾的质量为xg。 此题若代入公式(1),列式为: 若代入公式(2),列式为:
需水的质量为20-4.8=15.2g 答:配制20℃时20gKNO3的饱和溶液需KNO34.8g和水15.2g。 三、已知一定温度下某物质的溶解度,求一定量溶质配制成饱和溶液时,所需溶剂的质量 例3 已知氯化钠在20℃的溶解度是36g,在20℃时要把40g氯化钠配制成饱和溶液,需要水多少克?解:从题意可知,在20℃时36g氯化钠溶于l00g水中恰好配制成氯化钠的饱和溶液。 设20℃时40g氯化钠配制成氯化钠饱和溶液需要水为xg 答:在20℃时,40g氯化钠配制成饱和溶液需要水111g。 四、计算不饱和溶液恒温变成饱和溶溶需要蒸发溶剂或加入溶质的质量 例4 已知硝酸钾在20℃的溶解度为31.6g,现有150g20%的硝酸钾溶液,欲想使其恰好饱和,应加入几克硝酸钾或蒸发几克水? 解:先计算150g20%的KNO3溶液里含KNO3的量为150×20%=30g,含水为150-30=120g,则欲使之饱和,所要加进溶质或蒸发溶剂后的量之比与饱和溶液中溶质和溶剂之比相等进行列式。 设要使20℃150克20%KNO3溶液变为饱和溶液需加入x克KNO3或蒸发yg水,依题意列式: 答:要使20℃150g20%的KNO3溶液变为饱和溶液需加入KNO37.92g,或蒸发25.1g水。 五、计算温度升高时变成饱和溶液需加入溶质或蒸发溶剂的质量 例5 将20℃时263.2g硝酸钾饱和溶液温度升至60℃需加入几克硝酸钾或蒸发几克水才能变为饱和溶液?(20℃硝酸钾溶解度为31.6g,60℃为110g) 设将20℃时263.2gKNO3饱和溶液升至60℃时需加入xgKNO3或蒸发yg水后才能变成饱和溶液。 先计算20℃此饱和溶液中含溶质和溶剂的量,设含溶质为ag
初中化学酸碱盐溶解性表以及口诀新的
初中化学酸碱盐溶解性表以及口诀-(新的)
————————————————————————————————作者:————————————————————————————————日期:
课题1之---常见酸碱盐的溶解性(导学案)课型:新授课主备:邓爵华审核:化学组 一、学习目标: 1、强化酸碱盐化学式的读写。 2、加深对酸碱盐间发生复分解反应的条件、实质的理解。 3、初步认识盐的分类方法。 4、重点掌握常见酸碱盐的溶解性及其应用。 二、难点: 从酸碱盐的溶解性去理解酸碱盐间发生复分解反应的实质。 三、教学过程: 1、知识回顾: 指出下列物质中那个是酸?那些是碱?那些是盐? 1.H2O 2. NaCl 3. KNO3 4. KMnO4 5.CaCO3 6. H2SO4 7. H2O2 8. NaHCO3 9.Cu(OH)210. NaNO2 11. Ca(OH)212. N2 13.MnO2 14. H2 15. NH4Cl 属于酸的有(填序号,下同):; 属于碱的有:; 属于盐的有:。 因为酸的构成特点是:H+ + 酸根离子 碱的构成特点是:金属离子(或NH4+) + OH- 盐的构成特点是:金属离子(或NH4+) + 酸根离子 2、根据酸碱盐的构成特点,自学课本114页的常见酸碱盐的溶解性表, ①、强化酸碱盐化学式的读写(写出化学式): 酸:硫酸碳酸盐酸; 碱:氢氧化钠氢氧化钙; 盐:氯化钠硫酸铜; 碳酸钠硝酸钙。 ②、盐的种类较多,为更好的识别、掌握它们,就要给它们分门别类, 化繁为简: 盐的分类常按所含或的类型来分类; ③、归纳酸碱盐的溶解性,并熟记,以便更好应用: 酸:酸全溶碱:氢氧铵钠钾钡溶 盐:铵钠钾盐硝酸盐(全溶);氯化盐不溶 硫酸盐不溶;碳酸盐溶
初中化学酸碱盐溶解性表以及口诀 (新的)
课题1之---常见酸碱盐的溶解性(导学案)课型:新授课主备:邓爵华审核:化学组 一、学习目标: 1、强化酸碱盐化学式的读写。 2、加深对酸碱盐间发生复分解反应的条件、实质的理解。 3、初步认识盐的分类方法。 4、重点掌握常见酸碱盐的溶解性及其应用。 二、难点: 从酸碱盐的溶解性去理解酸碱盐间发生复分解反应的实质。 三、教学过程: 1、知识回顾: 指出下列物质中那个是酸?那些是碱?那些是盐? 1.H2O 2. NaCl 3. KNO3 4. KMnO4 5.CaCO3 6. H2SO4 7. H2O2 8. NaHCO3 9.Cu(OH)210. NaNO2 11. Ca(OH)212. N2 13.MnO2 14. H2 15. NH4Cl 属于酸的有(填序号,下同):; 属于碱的有:; 属于盐的有:。 因为酸的构成特点是:H+ + 酸根离子 碱的构成特点是:金属离子(或NH4+) + OH- 盐的构成特点是:金属离子(或NH4+) + 酸根离子 2、根据酸碱盐的构成特点,自学课本114页的常见酸碱盐的溶解性表, ①、强化酸碱盐化学式的读写(写出化学式): 酸:硫酸碳酸盐酸; 碱:氢氧化钠氢氧化钙; 盐:氯化钠硫酸铜; 碳酸钠硝酸钙。 ②、盐的种类较多,为更好的识别、掌握它们,就要给它们分门别类, 化繁为简: 盐的分类常按所含或的类型来分类; ③、归纳酸碱盐的溶解性,并熟记,以便更好应用: 酸:酸全溶碱:氢氧铵钠钾钡溶 盐:铵钠钾盐硝酸盐(全溶);氯化盐不溶 硫酸盐不溶;碳酸盐溶
3、学以致用 应用一:判断常见的酸碱盐的溶解性 考点:某碱或盐加入水中能否形成溶液 强化练习 1、下列物质加入水中能形成溶液的是() A、Cu(OH)2 B、CaCO3 C、BaSO4 D、(NH4)2CO3 2、下列各组物质全部能溶于水的是: A 、H2SO4CuSO4NaOH AgNO3 B 、CuCl2Na2SO4Mg(OH)2 FeCl2 C 、KOH AgCl KNO3Na2CO3 D 、Al(OH)3ZnSO4Ca(NO3)2(NH4)2SO4 应用二:判断酸碱盐之间的复分解反应可 否发生(即是否满足复分解反应的条件)复分解反应发生的条件: 生成物中:①有水生成②有气体生成③有沉淀生成三者之一 复分解反应发生的条件即体现出复分解反应的实质,即 反应物的离子相互结合反应形成:水或气体或沉淀的过程。 形成水的离子对:H+ + OH-→ H2O 形成水和气体的离子对: H+ + CO32- (HCO3- ) →H2O+CO2↑ NH4++ OH-→ H2O + NH3↑ 形成沉淀的离子对(重点): 与OH-不能共存即形成不溶性碱的金属离子(常考的):Cu2+、Fe3+、Mg2+、Al3+ 与CO32-不能共存即形成不溶性碳酸盐的金属离子Ba2+、Ca2+ Cl-:Ag+ + Cl- → AgCl ↓ (不溶于水,也不溶于酸) SO42- : SO42-+ Ba2+→ BaSO4↓(不溶于水,也不溶于酸) 注意:Fe(OH)3↓ Cu(OH)2↓ ,其余的沉淀 红褐色蓝色都为白色
酸碱盐可溶性表及口诀
酸碱盐可溶性表及口诀 溶解性表: 口诀酸碱盐溶解性表 说明:此为20℃时的情况。"溶"表示那种物质可溶于水,"不"表示不溶于水,"微"表示微溶于水,"挥"表示具有挥发性,"---"表示那种物
质不存在或遇到水就分解了。 口诀一: 钾,钠,铵盐,硝酸盐,都能溶解水中间. 盐酸盐不溶银亚汞,硫酸盐不溶钡和铅,微溶有钙银. 碳酸盐多不溶,溶者只有钾钠铵,碳酸氢溶镁微溶. 钾,钠,铵,钡碱都溶氢氧化钙是微溶 挥发者有氢氧铵,硝酸、氯化、碳酸氢 口诀二: 钾钠铵硝酸盐溶水快,①硫酸盐除去钡铅钙。②氯化物不溶氯化银,硝酸盐溶液都透明。③口诀中未有皆下沉。④注: ①钾钠铵盐都溶于水; ②硫酸盐中只有硫酸钡、硫酸铅、硫酸钙不溶; ③硝酸盐都溶于水; ④口诀中没有涉及的盐类都不溶于水; 口诀三: 钾、钠、铵盐、硝酸盐; (钾盐、钠盐、铵盐、硝酸盐均可溶于水) 氯化物除银、亚汞; (氯化物除氯化银、氯化亚汞外均可溶于水) 硫酸盐除钡和铅; (硫酸盐除硫酸钡、硫酸铅外均可溶于水) 碳酸、磷酸盐,只溶钾、钠、铵。 说明:以上四句歌谣概括了8类相加在水中溶解与不溶的情况。 口诀四: 钾钠铵硝皆可溶、盐酸盐不溶银亚汞; 硫酸盐不溶钡和铅、碳磷酸盐多不溶。 多数酸溶碱少溶、只有钾钠铵钡溶。 口诀五: 钾、钠、硝酸溶, (钾盐、钠盐和硝酸盐都溶于水。) 盐酸除银(亚)汞, (盐酸盐里除氯化银和氯化亚汞外都溶。) 再说硫酸盐,不容有钡、铅, (硫酸盐中不溶的是硫酸钡和硫酸铅。) 其余几类盐,(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物) 只溶钾、钠、铵, (只有相应的钾盐、钠盐和铵盐可溶) 最后说碱类,钾、钠、铵和钡。(氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶) 另有几种微溶物,可单独记住。 口诀六: 钾钠铵盐硝酸盐,完全溶解不困难。
(完整)初中化学溶解性表
1.2Mg+O2点燃或Δ2MgO 化学反应现象:剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟 应用:白色信号弹 2.2Hg+O2点燃或Δ2HgO 化学反应现象:银白液体、生成红色固体 应用:拉瓦锡实验 3.4Al+3OΔ2Al2O3 化学反应现象:银白金属变为白色固体 4.3Fe+2O2点燃Fe3O4 化学反应现象:剧烈燃烧、火星四射、生成黑色固体、放出大量热 5.C+O2点燃CO2 化学反应现象:剧烈燃烧、白光、放热、使石灰水变浑浊 6.S+O2点燃SO2 化学反应现象:剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰 7.2H2+O2点燃2H2O 化学反应现象:淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水) 应用:高能燃料 8.4P+5O2点燃2P2O5 化学反应现象:剧烈燃烧、大量白烟、放热、生成白色固体 应用:证明空气中氧气含量 9.CH4+2O2点燃2H2O+CO2 化学反应现象:蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)应用:甲烷和天然气的燃烧 10.2KClO3 MnO2Δ 2KCl +3O2↑ 化学反应现象:生成使带火星的木条复燃的气体 应用:实验室制备氧气 11.2KMnO4Δ K2MnO4+MnO2+O2↑ 化学反应现象:紫色变为黑色、生成使带火星木条复燃的气体 应用:实验室制备氧气 12.2HgOΔ2Hg+O2↑ 化学反应现象:红色变为银白、生成使带火星木条复燃的气体 应用:拉瓦锡实验 13.2H2O通电2H2↑+O2↑ 化学反应现象:水通电分解为氢气和氧气 应用:电解水 14.Cu2(OH)2CO3Δ2CuO+H2O+CO2↑ 化学反应现象:绿色变黑色、试管壁有液体、使石灰水变浑浊气体 应用:铜绿加热 15.NH4HCO3ΔNH3↑+ H2O +CO2↑ 化学反应现象:白色固体消失、管壁有液体、使石灰水变浑浊气体 应用:碳酸氢铵长期暴露空气中会消失 16.Zn+H2SO4=ZnSO4+H2↑ 化学反应现象:有大量气泡产生、锌粒逐渐溶解 应用:实验室制备氢气 17.Fe+H2SO4=FeSO4+H2↑ 化学反应现象:有大量气泡产生、金属颗粒逐渐溶解
初中化学溶解度教案设计
溶解度重要知识点
溶解度曲线相关练习 1. 甲、乙两物质的溶解度曲线如图所示,下列说确的是( ) A .甲和乙的饱和溶液,从t 1℃升温到t 2℃,仍是饱和溶液 B .t 1℃时,甲和乙的溶解度相等 C .t 1℃时,甲和乙各30g 分别加入80g 水中,均能恰好完全溶解 D .t 2℃时,在100g 水中放入60g 甲,形成不饱和溶液 2. 右图是a 、b 两种固体物质的溶解度曲线。从图中可获得的信息是( ) A. 固体物质的溶解度均随温度升高而增大 B .t ℃,相同质量的a 、b 溶解时放出热量相同 C .升高温度,可使a 或b 的饱和溶液变为不饱和溶液 D .将相同质量的a 、b 分别加入100g 水中,所得溶液质量分数相同 3.右图是甲、乙两种固体物质的溶解度曲线,下列说确的是( ) A .甲的溶解度大于乙的溶解度 B .乙的不饱和溶液降温可变成饱和溶液 C .20o C 时,甲、乙两种物质的溶解度相等 D .50o C 时,甲的饱和溶液中溶质的质量分数为40% 4. 右图是a 、b 两种固体物质(不含结晶水)的溶解度曲线。下列说确的是( ) A .b 的溶解度大于a 的溶解度 B .t 1℃时,将a 、b 两种物质的饱和溶液分别恒温蒸发等质量的 水,析出晶体的质量一定相等 C .将t 2℃时的b 的不饱和溶液降温至t 1℃,一定能得到b 的饱 和溶 液 D .t 2℃时,a 溶液的溶质质量分数一定小于b 溶液的溶质质量分数 5.右图是a 、b 两种固体物质的溶解度曲线,下列说法中正确的是 A .a 的溶解度大于b 的溶解度 B .在20℃时,a 、b 的溶液中溶质的质量分数相同 C .a 、b 的溶解度都随温度升高而增大 D .a 、b 都属于易溶物质 6.t 2℃时往盛有100g 水的烧杯中先后加入a g M 和a g N (两种物质溶解时互不影响,且溶质仍是M 、N ),充分搅拌。将混合物的温度降低到t 1℃,下列说确的是( ) A.t 2℃时,得到M 的饱和溶液 B.t 2℃时,得到N 的不饱和溶液 C .温度降低到t 1℃时,M 、N 的溶质质量分数相等,得到M 、N 的不饱和溶液 D.温度降低到t 1℃时,M 、N 的溶解度相等,得到M 、N 的饱和溶液 7.右图是a 、b 、c 三种固体物质的溶解度曲线,下列叙述正确的是( ) 50- 40- 30- 20- 10- 甲 乙 温度/ t 1 t 2 溶 解度/g
部分酸、碱和盐的溶解性表总结
部分酸、碱和盐的溶解性表
说明 此为20℃时的情况。 “AgNO3”表示那种物质可溶于水,“AgCl”表示不溶于水,“MgCO3”表示微溶于水,“KOH”表示挥发性,“-----”表示那种物质不存在或遇到水就分解了。 常见沉淀 白色:BaSO4、BaCO3、CaCO3、AgCl、Mg(OH)2、Fe(OH)2、Al(OH)3、ZnCO3、MnCO3、Zn(OH)2; 蓝色:Cu(OH)2、CuCO3; 浅黄色:AgBr、Ag2CO3;
红褐色:Fe(OH)3固体的颜色 1、红色固体:铜,氧化铁 2、绿色固体:碱式碳酸铜 3、蓝色固体:氢氧化铜,硫酸铜晶体 4、紫黑色固体:高锰酸钾 5、淡黄色固体:硫磺 6、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭) 7、红褐色固体:氢氧化铁 液体的颜色 8、无色液体:水,双氧水 9、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液 10、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液11、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液 12、紫红色溶液:高锰酸钾溶液 13、紫色溶液:石蕊溶液 气体的颜色 14、红棕色气体:二氧化氮 15、黄绿色气体:氯气 16、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气体。 特殊不溶解:氯化银、硫酸钡既不溶于水,也不溶于稀硝酸。
常见物质的颜色 1、红色物体:铜,氧化铁 2、绿色固体:碱式碳酸铜(Cu?(OH)?CO?) 3、蓝色固体:氢氧化铜,硫酸铜固体 4、紫黑色固体:高锰酸钾 5、淡黄色固体:硫磺(S) 6、无色固体:冰,干冰,金刚石 7、银白色固体:银,铁,镁,铝,汞等金属 8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁(炭黑,活性炭) 9、红褐色固体:氢氧化铁 10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁 11、无色液体:水,双氧水 12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液 13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液 14、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液
初中化学溶解度曲线
一.选择题溶解度曲线训练 1.右图是甲、乙两种物质的溶解度曲线,下列说法正确的是 A.甲的溶解度受温度影响比乙小 B.15℃时甲、乙的溶解度相等 C.30℃时乙的溶解度为30g D.升高温度可使接近饱和 .. ....的甲溶液变为饱和 2.如图是A、B两种物质的溶解度曲线。在t1℃时往两个盛有100克水的烧杯中分别加入a克A物质和b克B物质,充分搅 拌后都加热到t2℃。下列说法正确的是( ) A.t1℃时,AB两物质的溶解度相等。两杯溶液均是不饱和溶液B.t1℃时,AB两物质的溶解度相等,A溶液为饱和溶液,B溶 液为不饱和溶液 C.t2℃时,A的溶解度比B的溶解度大,两杯溶液均是不饱和 溶液 D.t 2℃时,A的溶解度比B的溶解度大,A溶液为不饱和溶液,B 溶液为饱和溶液 3.右图为A、B两种不带结晶水的固体物质溶解度曲线,下列说 法不正确的是 A.30℃时,A物质的溶解度为20g B.20℃时,A和B的溶解度相同 C.10℃时,等质量的A和B饱和溶液中,B的溶剂最少 D.等质量的A、B的饱和溶液从30℃降到20℃时,B析出的晶体 最多 4.根据下列几种物质溶解度曲线图,得到的结论正确的是 A.硝酸钾中混有少量氯化钠,采用蒸发结晶进行提纯 B.氢氧化钙饱和溶液降低温度后有晶体析出 C.80℃时,氯化钾与硫酸镁的溶解度相等 D.所有物质的溶解度均随温度的升高而增大或随温度的降低而减小
A B C 0 t 1 20 t 2 温度/℃ g 40 溶解度 5.下列关于溶液的说法中,不正确的是 A .溶液中各部分性质相同,是一种高级混合物 B .氢氧化钠溶液能导电,是因为溶液中含有自由移动的离子 C .接近饱和的硝酸钾溶液,通过蒸发溶剂或加溶质的方法都可以达到饱和状态 D .20℃,氯化钠的溶解度为36g ,则20℃时100g 氯化钠饱和溶液中含有氯化钠36g 6.右图是甲、乙、丙三种物质的溶解度曲线.下列说法正确的是 A .在t 1℃时,三种物质的溶解度由大到水的顺序是甲>乙>丙 B .在t 2℃时,甲、乙两物质的溶解度相等 C .甲、乙、丙三种物质的饱和溶液升温都会转化为不饱和溶液 D .当乙的饱和溶液中混有少量丙时,可采用降温结晶的方法析出丙 7.(10海南)右图是甲、乙两种固体物质的溶解度曲线。据此判断 下列说法不正确的是: A.t 2℃时,甲、乙的溶解度相等 B. t 3℃时,将60g 乙加入100g 水中可得l60g 溶液 C .乙的溶解度受温度影响很小 D .t l ℃时,乙的溶解度大于甲的溶解度 二.分析题 1. 20℃时,碳酸氢钠的溶解度为9.7g ,其含义是在20℃ 时___________________;工业上用氨碱法制纯碱时,向 饱和氨盐水中不断通入CO2,同时生成碳酸氢钠和氯化铵,但却只有碳酸氢钠结晶析出,原因是________________________。 100g 水中溶解9.7g 碳酸氢钠即可达到饱和 相同温度下,氯化铵的溶解度比碳酸氢钠大 2. 右图为A 、B 、C 三种物质的溶解度曲线,据图回答: ⑴ t 20C 时,A 、B 、C 三种物质的溶解度由大到小顺序是 。 ⑵ 将t 20C 时三种物质等质量的饱和溶液分别降温到00C 时,析出溶质 最多的是 ,无溶质析出的是 。 ⑶ 20℃时,将30g A 物质放入50g 水中,充分搅拌,所得溶液的质量是 g 。 3.右图是甲、乙两种固体物质的溶解度曲线。请回答:甲物质在45℃时的溶解度为_______;甲、乙两物质的溶解度相等时的温度是____℃;要 使甲的不饱和溶液变为饱和溶液应_____________(填“升 高”、“降低”)温度;常压下,CO2在水中的溶解度随温度的 变化应类似于____(填“甲”、“乙”)曲线。
初中化学溶解性表
1、化合物 注:表中“↑”表示挥发性,“↓”表示不溶于水“,微”表示微溶于水,“_”表示物质不存在或遇到水就会分解了,其余的全 是易溶于水。 )
1.2Mg+O 2 点燃或Δ2MgO 化学反应现象:剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟应用:白色信号弹 2.2Hg+O 2 点燃或Δ2HgO 化学反应现象:银白液体、生成红色固体应用:拉瓦锡实验 3.4Al+3O 2Δ2Al 2O3 化学反应现象:银白金属变为白色固体 4. 3Fe+2O 2点燃Fe3O4 化学反应现象:剧烈燃烧、火星四射、生成黑色固体、放出大量热 5. C+O 2 点燃CO 2 化学反应现象:剧烈燃烧、白光、放热、使石灰水变浑浊 6. S+O 2 点燃SO 2 化学反应现象:剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰 7. 2H2+O2 点燃2H 2O 化学反应现象:淡蓝火焰、放热、生成使无水CuSO 4 变蓝的液体(水)应用:高能燃料 8. 4P+5O 2 点燃2P2O5 化学反应现象:剧烈燃烧、大量白烟、放热、生成白色固体应用:证明空气中氧气含量 9.CH 4+2O 2点燃2H2O+CO 2 化学反应现象:蓝色火焰、放热、生成使石灰水变浑浊气体和使无水 CuSO 4 变蓝的液体(水) 应用:甲烷和天然气的燃烧 10.2KClO 3 MnO 2 Δ2KCl +3O 2↑ 化学反应现象:生成使带火星的木条复燃的气体应用:实验室制备氧气 11.2KMnO 4Δ K2MnO 4+MnO 2+O 2 ↑ 化学反应现象:紫色变为黑色、生成使带火星木条复燃的气体应用:实验室制
酸碱盐的溶解性口诀大全
酸碱盐的溶解性口诀大全 溶解性用来判断复分解反应能否发生,如果生成物中有难溶性的物质而反应物中没有,那么反应就可以发生 钾钠硝酸溶,铵盐也相同。氯除银亚汞,硫酸除钡铅。 磷酸碳酸盐,钾钠氨才溶。钾钠钡氨钙,溶碱有五种。 解释: 就是钾盐、钠盐、硝酸盐、铵盐都是可溶的 盐酸盐除了氯化银和氯化亚汞都是可溶的 硫酸盐除硫酸钡和硫酸铅都可溶 磷酸盐和碳酸盐除了含有钾、钠、铵根离子外都是不溶的 氢氧化钾、氢氧化钠、氢氧化钡、氨水、氢氧化钙这五种碱溶于水 钾钠铵盐皆可溶 硝酸盐入水影无踪 氯化物不溶氯化银 硫酸盐不溶硫酸钡 碳酸盐只溶钾钠铵 可溶碱有四位钾钠和钙钡 钾钠铵盐均可溶 硝酸盐遇水无影踪 盐酸盐不溶AgCl 硫酸盐不溶BaSO4 碳酸盐只溶钾钠铵 带K+.NH4+.Na+离子菂盐都溶于水. 带NO3+根离子菂盐都溶于水. 带Cl-离子菂盐中只有AgCl不溶. 带SO42-离子菂盐中只有BaSO4.CaSO4.Ag2SO4不溶. 带CO32-离子菂盐中只有K2CO3.Na2CO3.(NH4)2CO3溶于水. 例子BaCl2+Na2SO4===BaSO4↓+2NaCl(复分解反映条件为反应物都可溶.而生成物中一定要有气体或水.或沉淀) 所以记溶解表最主要是明白什么和什么可以反映.什么和什么不能反映.而且除杂多数要把杂质以沉淀或者气体菂方式滤出或排出.. 背诵口诀 1.钾钠铵盐都可溶,氯化物不溶氯化银 硫酸盐钙银微溶钡不溶 硝酸盐遇水影无踪 碳酸盐除钾钠铵都不溶 氢氧化钙是微溶 钾钠钡钙碱可溶 红褐铁,蓝絮铜 其它沉淀白色呈 注:1.初中用够了,红褐铁,代表铁盐沉淀为红褐色【fe(oh)2氢氧化亚铁除外】,蓝絮铜代表,铜盐为蓝色絮状沉淀。2.氯化银【不溶酸】,碳酸钙,碳酸钡,硫酸钡【不溶酸】,氢氧化铝,氢氧化镁,为白色沉淀。氢氧化铁(红褐色)氢氧
初中化学中常见物质的溶解性情况
初中化学中常见物质的溶解性情况 单质 1、【金属单质 ....】:所有金属几乎难溶于水(但一些金属由于很活泼,在常温下能够和水发生反应:例如K、Ca、Na等)。 2、【非金属单质 .....】:①(固态)C、S、P等难溶于水; ②(气态) N2、H2 等难溶于水,O2 不易溶于水。 化合物 1、【酸的溶解性 .....】 【大部分酸及酸性氧化物(非金属氧化物)能溶于水,(酸性氧化物+水→酸)大部分碱性氧化物(金属氧化物)不溶于水,能溶的有:氧化钡、氧化钾、氧化钙、氧化钠(碱性氧化物+水→碱)】。 2、【碱的溶解性 .....】 ▲溶于水的碱有:氢氧化钡、氢氧化钾、氢氧化钠和氨水。▲其他的碱大部分不溶于水:难溶性碱中Fe(OH)3是红褐色沉淀,Cu(OH)2是蓝色沉淀,其他难溶性碱为白色(包括Fe(OH)2)。 ▲其中AgOH 为白色固体,属于碱,常温下AgOH极不稳
定,易分解为棕褐色难溶于水的氧化银固体.低温下可制得氢氧化银在水中的白色沉淀,Ca(OH)2为微溶于水的白色固体。 3、【盐的溶解性 .....】 ★含有钾、钠、硝酸根、铵根的物质都溶于水; ★含Cl- 的化合物只有AgCl不溶于水,其他都溶于水;★含SO42-的化合物只有BaSO4不溶于水,Ag2SO4、CaSO4微溶于水, 其他都溶于水; ★含CO32-的物质只有K2CO3、Na2CO3、(NH4)2CO3溶于水,其他绝大部分不溶于水,一些微溶于水或者遇到水发生水解。注意:【沉淀物中AgCl和BaSO4不溶于稀硝酸,其他沉淀物能溶于酸。如:Mg(OH)2、CaCO3、BaCO3、Ag2 CO3等】 4、【氧化物的溶解性 .......】 ▲金属氧化物一般都不溶解,例如:CuO, Fe2O3, Fe3O4 ,MgO, Al2O3 ,MnO2等, 其中CaO能与水反应。 ▲非金属氧化物:①难溶于水,例如:CO、NO等。 ②可溶于水,例如:CO2(其中CO2 溶于水后又能与水反应)。 ③易溶于水:例如:SO2、NO2等。 5、【其他 ......】 ..物质的溶解性 ▲①难溶于水:CH4 ;②易溶于水: HCl、NH3 (其中NH3溶于水后又能与水反应)、葡萄糖、蔗糖等。
部分酸、碱和盐的溶解性表总结
部分酸、碱和盐的溶解性表 (20o C)
说明 此为20℃时的情况。 “AgNO 3 ”表示那种物质可溶于水,“AgCl”表示不溶于水,“MgCO3”表示微溶于水,“KOH”表示挥发性,“-----”表示那种物质不存在或遇到水就分解了。 常见沉淀 白色:BaSO4、BaCO3、CaCO3、AgCl、Mg(OH)2、Fe(OH)2、Al(OH)3、ZnCO3、MnCO3、Zn(OH)2; 蓝色:Cu(OH)2、CuCO3; 浅黄色:AgBr、Ag2CO3; 红褐色:Fe(OH)3 固体的颜色 1、红色固体:铜,氧化铁 2、绿色固体:碱式碳酸铜 3、蓝色固体:氢氧化铜,硫酸铜晶体 4、紫黑色固体:高锰酸钾 5、淡黄色固体:硫磺 6、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭) 7、红褐色固体:氢氧化铁 液体的颜色 8、无色液体:水,双氧水 9、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液 10、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液11、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液 12、紫红色溶液:高锰酸钾溶液 13、紫色溶液:石蕊溶液 气体的颜色 14、红棕色气体:二氧化氮 15、黄绿色气体:氯气 16、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气体。 特殊不溶解:氯化银、硫酸钡既不溶于水,也不溶于稀硝酸。
常见物质的颜色 1、红色物体:铜,氧化铁 2、绿色固体:碱式碳酸铜(Cu?(OH)?CO?) 3、蓝色固体:氢氧化铜,硫酸铜固体 4、紫黑色固体:高锰酸钾 5、淡黄色固体:硫磺(S) 6、无色固体:冰,干冰,金刚石 7、银白色固体:银,铁,镁,铝,汞等金属 8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁(炭黑,活性炭) 9、红褐色固体:氢氧化铁 10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁 11、无色液体:水,双氧水 12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液 13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液 14、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液 15、紫红色溶液:高锰酸钾溶液 16、紫色溶液:石蕊溶液 17、红棕色气体:二氧化氮 18、黄绿色气体:氯气 19、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气体
最标准酸碱盐的溶解性表
酸碱盐的溶解性表 OH(-1)NO3(-1)Cl(-1) SO4(-2)CO3(-2) PO4(-3) H(+1)溶、挥溶、挥溶溶、挥溶 K(+1)溶溶溶溶溶溶 Na(+1)溶溶溶溶溶溶 NH4(+1)溶、挥溶溶溶溶溶 Ba(+2)溶溶溶不不不 Ca(+2)微溶溶微不不 Mg(+2)不溶溶溶微不 Al(+3)不溶溶溶--- 不 Zn(+2)不溶溶溶不不 Fe(+2)不溶溶溶不不 Fe(+3)不溶溶溶不不 Cu(+2)不溶溶溶--- 不 Ag(+1)--- 溶不微不不说明:此为20℃时的情况。“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“---”表示那种物质不存在或遇到水就分解了 背诵口诀 1.钾钠铵盐都可溶,氯化物不溶氯化银 硫酸盐钙银微溶钡不溶 硝酸盐遇水影无踪 碳酸盐除钾钠铵都不溶 钾钠钡钙碱可溶 红褐铁,蓝絮铜 其它沉淀白色呈 注:1.初中用够了,红褐铁,代表铁盐沉淀为红褐色【fe(oh)2氢氧化亚铁除外】,蓝絮铜代表,铜盐为蓝色絮状沉淀。2.氯化银【不溶酸】,碳酸钙,碳酸钡,硫酸钡【不溶酸】,氢氧化铝,氢氧化镁,为白色沉淀。氢氧化铁(红褐色)氢氧化铜(蓝色) 说明【】内为前一物质的特点 2.钾钠铵盐全都溶 碳酸除镁是微溶 其他全都不能溶 AgCl、BaSO4酸也不溶 磷酸盐,更不溶
一、氧气的性质: (1)单质与氧气的反应:(化合反应) 1. 镁在空气中燃烧:2Mg + O2 点燃 2MgO 2. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O4 3. 铜在空气中受热:2Cu + O2 加热 2CuO 4. 铝在空气中燃烧:4Al + 3O2 点燃 2Al2O3 5. 氢气中空气中燃烧:2H2 + O2 点燃 2H2O 6. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O2 点燃 2P2O5 7. 硫粉在空气中燃烧: S + O2 点燃 SO2 8. 碳在氧气中充分燃烧:C + O2 点燃 CO2 9. 碳在氧气中不充分燃烧:2C + O2 点燃 2CO (2)化合物与氧气的反应: 10. 一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO2 11. 甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O 12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O (3)氧气的来源: 13.玻义耳研究空气的成分实验 2HgO 加热 Hg+ O2 ↑ 14.加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 + O2↑(实验室 制氧气原理1) 15.过氧化氢在二氧化锰作催化剂条件下分解反应: H2O2 MnO22H2O+ O2 ↑(实验室制氧气原理2) 二、自然界中的水: 16.水在直流电的作用下分解(研究水的组成实验):2H2O 通电 2H2↑+ O2 ↑ 17.生石灰溶于水:CaO + H2O == Ca(OH)2 18.二氧化碳可溶于水: H2O + CO2==H2CO3 三、质量守恒定律: 19.镁在空气中燃烧:2Mg + O2 点燃 2MgO 20.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu 21.氢气还原氧化铜:H2 + CuO 加热 Cu + H2O 22. 镁还原氧化铜:Mg + CuO 加热 Cu + MgO 四、碳和碳的氧化物: (1)碳的化学性质 23. 碳在氧气中充分燃烧:C + O2 点燃 CO2 24.木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑ 25.焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe + 3CO2↑ (2)煤炉中发生的三个反应:(几个化合反应) 26.煤炉的底层:C + O2 点燃 CO2 27.煤炉的中层:CO2 + C 高温 2CO 28.煤炉的上部蓝色火焰的产生:2CO + O2 点燃 2CO2 (3)二氧化碳的制法与性质: 29.大理石与稀盐酸反应(实验室制二氧化碳): CaCO3 + 2HCl == CaCl2 + H2O + CO2↑ 30.碳酸不稳定而分解:H2CO3 == H2O + CO2↑ 31.二氧化碳可溶于水: H2O + CO2== H2CO3 32.高温煅烧石灰石(工业制二氧化碳):CaCO3 高温 CaO + CO2↑33.石灰水与二氧化碳反应(鉴别二氧化碳): Ca(OH)2 + CO2 === CaCO3 ↓+ H2O
部分酸、碱和盐的溶解性表(20℃)_加记忆口诀
溶解性用来判断复分解反应能否发生,如果生成物中有难溶性的物质而反应物中没有,那么反应就可以发生 : 钾纳铵盐均可溶, 硝盐入水影无踪, 碱溶钾钠钡和铵, 氯物不溶银、亚汞, 硫酸铅钡不溶水, 碳酸只溶钾钠铵. 就是钾盐、钠盐、硝酸盐、铵盐都是可溶的;盐酸盐除了氯化银和氯化亚汞是可溶的; 硫酸盐除硫酸钡和硫酸铅都可溶;碳酸盐除了含有钾、钠、铵根离子外都是不溶的; 氢氧化钾、氢氧化钠、氢氧化钡、氨水、氢氧化钙这五种碱溶于水常见的难溶物质中: BaSO4 ; AgCl; CaCO3 ; BaCO3 ; Ag2SO4 ; Mg(OH)2 ;AI(OH)3是白色的, Cu(OH)2是蓝色的,Fe(OH)3是红褐色的,其中只有BaSO4和AgCl不溶于稀硝酸。
钾钠硝酸溶,铵盐也相同。氯除银亚汞,硫酸除钡铅。磷酸碳酸盐,钾钠氨才溶。钾钠钡氨钙,溶碱有五种。解释: 钾钠铵盐皆可溶硝酸盐入水影无踪氯化物不溶氯化银硫酸盐不溶硫酸钡碳酸盐只溶钾钠铵 可溶碱有四位钾钠和钙钡 钾钠铵盐均可溶硝酸盐遇水无影踪盐酸盐不溶AgCl 硫酸盐不溶BaSO4 碳酸盐只溶钾钠铵 带K+.NH4+.Na+离子菂盐都溶于水. 带NO3+根离子菂盐都溶于水. 带Cl-离子菂盐中只有AgCl不溶. 带SO42-离子菂盐中只有BaSO4.CaSO4.Ag2SO4不溶. 带CO32-离子菂盐中只有K2CO3.Na2CO3.(NH4)2CO3溶于水. 例子BaCl2+Na2SO4===BaSO4↓+2NaCl(复分解反映条件为反应物都可溶.而生成物中一定要有气体或水.或沉淀) 所以记溶解表最主要是明白什么和什么可以反映.什么和什么不能反映.而且除杂多数要把杂质以沉淀或者气体菂方式滤出或排出.. 背诵口诀 1.钾钠铵盐都可溶,氯化物不溶氯化银硫酸盐钙银微溶钡不溶硝酸盐遇水影无踪碳酸盐除钾钠铵都不溶氢氧化钙是微溶钾钠钡钙碱可溶红褐铁,蓝絮铜其它沉淀白色呈 注:1.初中用够了,红褐铁,代表铁盐沉淀为红褐色【fe(oh)2氢氧化亚铁除外】,蓝絮铜代表,铜盐为蓝色絮状沉淀。 2.氯化银【不溶酸】,碳酸钙,碳酸钡,硫酸钡【不溶酸】,氢氧化铝,氢氧化镁,为白色沉淀。氢氧化铁(红褐色)氢氧
初中化学溶解性表[参照材料]
1、化合物 阴离子阳离子 OH- 氢氧根 NO3- 硝酸根 Cl- 氯离子 SO42- 硫酸根 CO32- 碳酸根 分 类 O2- 氧离子 H+H2O HNO3、↑HCl、↑H2SO4 H2CO3、↑→ 酸H2O 氢离子水硝酸盐酸硫酸碳酸水 NH4+NH4·H2O↑NH4NO3 NH4Cl (NH4)2SO4 (NH4)2CO3↓ 盐_ 铵根离子氨水硝酸铵氯化铵硫酸铵碳酸铵_K+KOH KNO3KCl K2SO4K2CO3K2O 钾离子氢氧化钾硝酸钾氯化钾硫酸钾碳酸钾氧化钾Na+ NaOH NaNO3NaCl Na2SO4Na2CO3Na2O 钠离子氢氧化钠硝酸钠氯化钠硫酸钠碳酸钠氧化钠Ba2+ Ba(OH)2Ba(NO3)2BaCl2BaSO4↓BaCO3↓BaO 钡离子氢氧化钡硝酸钡氯化钡硫酸钡碳酸钡氧化钡Ca2+ Ca(OH)2Ca(NO3)2CaCl2CaSO4微CaCO3↓CaO 钙离子氢氧化钙硝酸钙氯化钙硫酸钙碳酸钙氧化钙Mg2+ Mg(OH)2↓Mg(NO3)2MgCl2 MgSO4MgCO3微MgO 镁离子氢氧化镁硝酸镁氯化镁硫酸镁碳酸镁氧化镁Mn2+ Mn(OH)2↓Mn(NO3)2MnCl2MnSO4MnCO3↓MnO 锰离子氢氧化锰硝酸锰氯化锰硫酸锰碳酸锰氧化锰Zn2+Zn(OH)2↓Zn(NO3)2ZnCl2ZnSO4ZnCO3↓ZnO 锌离子氢氧化锌硝酸锌氯化锌硫酸锌碳酸锌氧化锌Al3+ Al(OH)3↓Al(NO3)3AlCl3Al2(SO4)3 _Al2O3铝离子氢氧化铝硝酸铝氯化铝硫酸铝_氧化铝Cu2+Cu(OH)2↓Cu (NO3)2CuCl2 CuSO4CuCO3↓CuO 铜离子氢氧化铜硝酸铜氯化铜硫酸铜碳酸铜氧化铜Fe2+ Fe(OH)2↓Fe(NO3)2FeCl2FeSO4FeCO3↓FeO 亚铁离子氢氧化亚铁硝酸亚铁氯化亚铁硫酸亚铁碳酸亚铁氧化亚铁Fe3+ Fe(OH)3↓Fe(NO3)3 FeCl3Fe2(SO4)3 _Fe2O3铁离子氢氧化铁硝酸铁氯化铁硫酸铁_氧化铁Ag+ _AgNO3AgCl ↓Ag2SO4微Ag2CO3↓Ag2O 银离子_硝酸银氯化银硫酸银碳酸银氧化银分类碱→盐氧化物(注:表中“↑”表示挥发性,“↓”表示不溶于水,“微”表示微溶于水,“_”表示物质不存在或遇到水就会分解了,其余的全是易溶于水。) 2 、单质金属单 质 K Ca Na Mg Al Zn Fe Sn 钾钙钠镁铝锌铁锡 Pb Cu Hg Ag Pt Au Mn Ni 铅铜汞银铂金锰镍非金属 单质 H2O2N2F2Cl2Br2I2O3 氢气氧气氮气氟气氯气溴碘臭氧 P S C Si B
