(冶金行业)第二章冶金熔体的相平衡图
第二章冶金熔体的相平衡图
2.1 三元系相图基础知识
2.1.1 相律及二元系相图回顾
一、相律
?描述平衡体系中独立组元数、相数和自由度数之间的关系
f = c –Φ + 2
?对于常压下的冶金熔体体系,可以忽略气相的影响
f = c –Φ + 1
?独立组元数c
与体系中物质种类数N、独立化学反应数R 和限制条件数S 的关系:c = N – R – S
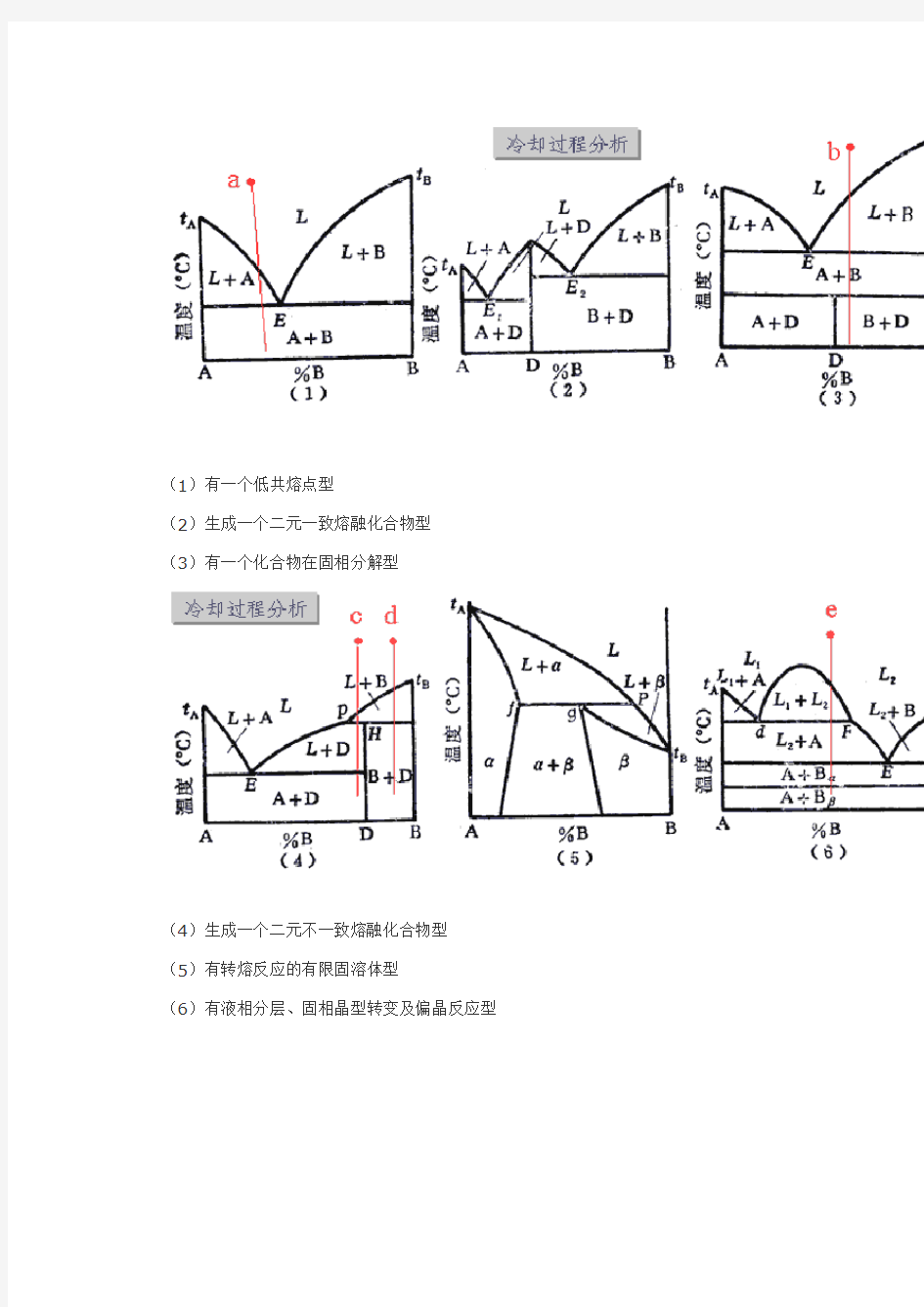
二、二元系相图的基本类型(1/3)
(1)有一个低共熔点型
(2)生成一个二元一致熔融化合物型
(3)有一个化合物在固相分解型
(4)生成一个二元不一致熔融化合物型
(5)有转熔反应的有限固溶体型
(6)有液相分层、固相晶型转变及偏晶反应型
(7)形成连续固溶体型
(8)有最高点的连续固溶体型(9)有低共熔点的有限固溶体型
三、熔体冷却过程分析
2.1.2 三元系的组成表示法
?对于三元熔体体系:
f = c –Φ + 1 = 4 –Φ
?三元凝聚体系的自由度数最多为3,即体系的平衡状态决定于温度和两个组元的浓度。
?要完整地表示三元系的状态,必须采用三维空间图形。
?在这种立体图中,底面上的两个坐标表示体系的组成,垂直于底面的坐标表示温度。
一、浓度三角形
→等腰直角三角形表示法
→等边三角形表示法
1、等腰直角三角形表示法
?用纵轴表示组元A的浓度,
横轴表示组元B的浓度,
两轴均分为100等分。
?组元C的含量
→计算法:C% = 100 – A% – B%
→图解法:
过M点作斜边的平行线交AC、BC边于m2、m1;
线段Am2或Bm1的长度表示组元C的含量。?→优点:可以用普通直角坐标纸作图
→缺点:坐标原点所表示组元的含量的读取欠方便
2、等边三角形表示法
?性质:
→吉布斯浓度三角形
→罗策布浓度三角形
?→优点:可以直接从图上读出三个组元的百分含量
→缺点:必须用等边三角形坐标纸
3、双线法确定体系的组成
二、浓度三角形的性质
1、等含量规则
→在浓度三角形△ABC中平行于三角形某一边的任一直线上,其所有体系点中对应顶点组元的浓度相等。如图:
→KK'线上诸物系点中组元C的含量均为c%
2、等比例规则
→由浓度三角形中任一顶点向对边引一射线,则射线上所有各点含三角形其余二顶点所表示的组元的数量比例均相等。如图:
→b1/c1 = b2/c2 = b3/c3 = … = 常数
3、背向规则
→在浓度三角形△ABC中,假定当物系点P冷却至初晶温度(即物系点到达液相面)时首先自液相中析出固相A,则当体系继续冷却时,剩余液相的组成将沿AP的延长线AL、朝着背向A的方向变化。
4、直线规则
→两个原始体系M,N完全混合为一个新体系P时,P的组成点必定在MN连线上,且必介于M、N二点之间。
→反之,当一个体系P分解成为两个不同组成的体系M、N时,则M、N、P三点也必然处于一条直线上,且M、N两体系的组成点分居于P组成点的两侧。
5、杠杆规则
→当两个体系M、N 混合成为一个新体系P 时,组成点P与组成点M、N 的距离与体系M、N 的数量成反比。即:
→杠杆规则同样适用于一个体系P分解为两个新体系M、N的情形。
6、重心原理
→三个原始体系M、N、Q完全混合为一个新体系P时,P点必定在以M、N、Q为顶点的三角形之内,且处于M、N、Q 三重物组成的(物理)重心。(通常不是几何重心!)
重心位置的确定:
→计算法:质量守恒原理
→作图法:两次应用杠杆规则。
利用重心原理确定物系P的化学组成
→假定M、N和Q的质量分别为2kg、3kg和5kg,则新物系P的质量WP为:WP = 2 + 3 + 5 = 10 kg
→P点在浓度三角形中的位置可以两次运用杠杆规则来确定。假定先由M与N 构成一中间物系S,则S的重质量WS为:
WS = 2 + 3 = 5 kg
→根据直线规则及杠杆规则,S点必在MN线段上,其具体位置则由如下关系确定:
NS/SM = WM / WN = 2/3
→再由S与Q构成物系P,其质量WP为:
WP = WS + WQ = 5 + 5 = 10 kg
→而且P点必在SQ连线上,且满足以下数量关系:
SP/PQ = WQ / WS = 5/5
→当总体系(重心)P的重量和组成已知,由体系P分解出的三个体系M1、M2、M3的组成也已知时,则可以应用杠杆规则求出M1、M2、M3三个体系的重量:
7、交叉位规则
→新体系点P在起始混合物MNQ三角形之外,在一条边的外侧。
WP + WQ = WS
WM + WN = WS
WP + WQ = WM + WN
WP = (WM + WN) – WQ
→为了获得P组成的混合物,需从M和N的混合物中取出Q组成;
→反之,P组成必须加入Q组成,才能分解为M和N组成。
8、共轭位规则
→P点在三角形MNQ之外,且位于三角形顶点的外侧,即Q点位于三角形MNP 之内。
WQ = WM + WN + WP
WP = WQ -(WM + WN)
→为了获得P组成的混合物,需从Q组成取出M和N组成;
→当P分解时,需要加入M和N,才能得到Q组成。
2.1.3 三元系相图的表示法
?立体相图
?平面投影图
?等温截面图
一、立体相图
——简单三元低共熔体系
→用三方棱柱体表示——以浓度三角形为底面,以垂直于浓度三角形平面的纵坐标表示温度。
→体系的特点—— A、B、C在液态时完全互溶,而在固态时完全不互溶、形成机械混合物,三个组元只形成一个低共熔体。
1、液相面
→三个液相面或初晶面—— ae1ee3a、be1ee2b 和ce2ee3c
→三元立体状态图中的液相面是由二元系中的液相线发展而来的
如:ae1ee3a液相面源于A组分在A?B二元中的液相线ae1和在A-C二元中
的液相线ae3。
→液相面本质上是一个饱和曲面
如:任何富A的三元熔体冷却到ae1ee3a液相面上的温度时,即开始对A饱
和,析出A的晶体,L→A。
→液相面代表了一种两相平衡状态
液相面上体系的自由度为f = 3 - 2 + 1 = 2。
→在三个液相面上部的空间是熔体的单相区,在此空间区域内体系的自由度为
f = 3 - 1 + 1 = 3。
2、界线
→界线——三个液相面彼此相交得到的三条空间曲线e1e、e2e及e3e
→界线上的液相同时被两种晶相所饱和,本质上是一条饱和曲线
如:界线e1e上任一点的液相对组分A和B同时饱和,冷却时同时析出晶体A 和B:L→A + B
界线e1e又被称作组分A和B的低共熔线。
→界线代表了体系的三相平衡状态
在界线上体系的自由度为f = 3 - 3 + 1 = 1
→界线e2e是组分B和C的低共熔线:L→B + C
界线e3e为组分C和A的低共熔线:L→C + A
3、无变点
→e点是三条界线(或三个液相面)的交点,称为三元无变点或三元零变点。→在e点,体系处于四相平衡状态,即一个液相与三个固相平衡共存,体系的自由度为f = 3 - 4 + 1 = 0
→e点的液相同时对A、B、C三个组分饱和
冷却时将同时析出A、B、C三种晶体,L→A + B + C
e点亦被称作该体系的三元低共熔点。
三元系相图中自由度数和相数
f = c –Φ + 1 = 4 –Φ
4、空间区域
→单相区:在三个液相面上部的空间;f = 3 - 1 + 1 = 3。
→固相区:在固相面(通过三元低共熔点e、平行于浓度三角形底面的平面)以下的空间区域; f = 3。
→结晶空间(或结晶区):在液相面与固相面之间的区域,为液相与固相平衡
共存的空间。
结晶空间
在简单三元低共熔体系内,液相面和固相面之间所围的空间是由六个不同的结晶空间所构成,而不是一个整体。
(1)一次结晶空间
→三个一次结晶空间是液相与一个晶相两相共存的空间区域,分别是:L+A,L+B、L+C。
→每个一次结晶空间由五块曲面围成。
(2)二次结晶空间
→三个二次结晶空间
是液相与两个晶相三相
平衡共存的空间区域,
分别是:L+A+B,
L+B+C、L+C+A。
→每个二次结晶空间
由四个面围成。
→二次结晶空间实质
上是一系列不同等温面
上的结线三角形由上而
下叠合而成;温度愈低,
三角形愈大。
二、平面投影图
(三元相图,三元熔度图)
→等温截面立体相图中平行于浓度三角形底边、与立体相图的液相面相截的平面。
→空间等温线等温截面与立体相图的液相面相截所得的截线;
→等温线空间等温线在浓度三角形中的投影;
或:熔化温度相等的组成点的联线。
→体系中所有组元及其化合物都有自己的初晶面;
或:组元及其化合物数目之和等于初晶面的数目
(固相已分解,或仅在熔体中才存在的物质除外)。
→在浓度三角形中一致熔融化合物的组成点都落在自己为初晶面之内;
不一致熔融化合物的组成点都落在自己的初晶面之外。
→在浓度三角形中,等温线密集部分表示立体相图中液相面陡度较大,即温度变化较大;
等温线稀疏部分表示液相面较平坦,即温度随组成的变化较和缓。
三、等温截面图
→等温截面图在某一定温度下的等温平面与立体相图相截,所得截面在浓度三角形上的投影。
→用途反映了体系在指定温度下所处的相态以及组成改变时体系相态的变化。
→液相区由等温线及浓度三角形的边围成的区域
→二相区扇形区域
→三相区三角形区域
等温截面图(1/4)
等温截面图(2/4)
等温截面图(3/4)
等温截面图(4/4)
从平面投影图绘制等温截面图
步骤:
→将平面投影图中给定温度以外的等温线、温度高于给定温度的部分界线(fe1)去掉→将界线与给定温度下的等温线的交点(f)与该界线对应二组元的组成点相连接,形成结线三角形(BfC)
→去掉余下的界线(Ef,Ee2,Ee3)
→在液–固两相区画出一系列结线
→标出各相区的平衡物相
→用“边界规则”检查所绘制的等温截面图
2.1.4 三元系相图的基本类型
2.1.4.1 简单低共熔型三元系相图
1、简单低共熔型三元系的特点
?三个组分各自从液相分别析晶
?不形成固溶体
?不生成化合物
?无液相无分层现象
2、熔体M的冷却过程
(1)用文字描述
?在t2温度以上,体系中只有一个液相,液相组成点与原始体系组成点重合。?当温度降至t2时,体系点到达组分B的液相面,进一步冷却则会析出B晶体,L E→B。
?据等比例规则(或背向规则),液相组成必定沿着BM连线延长线、向着离开B点的方向变化。
?当体系的温度继续降低时,液相中继续析出B晶体,运用杠杆规则可以确定液相点的位置以及析出的B晶体的相对量。
?例如,当体系温度降低至t3时,液相组成到达a点;根据杠杆规则,析出的B晶体的量与原始熔体的质量存在如下关系。
?当液相点到达E2E界线上的g点时,体系中将发生二元低共熔反应,L →B + C。
?体系进一步冷却时,液相组成必沿着二元低共熔线E2E向三元低共熔点E的方向变化;固相点将离开B点沿着BC连线移动。
?可以利用杠杆规则确定液相点和固相点的位置以及析出的B、C混合晶体的相对量。
?例如,液相组成到达b点时,根据直线规则,固相组成位于k点;而析出的B、C混合晶体的量可由杠杆规则确定:
?当体系冷却到低共熔温度T E时,液相点到达低共熔点(E点)。体系中将发生三元低共熔反应:L E→ B + C + A,体系进入四相平衡状态,f = 0 →体系温度保持不变→液相点则保持在E点不变。
?固相点则到达q点。根据直线规则,E、M、q三点必在同一条等温的直线上。?在此等温析晶过程中,固相点离开q点向浓度三角形内部移动。按照直线规则,固相点必定沿着直线qME向M点推进。
?可以根据杠杆规则确定此等温析晶过程中固相点的位置以及析出的B、C、A 混合晶体的质量。
?例如,当固相组成到达n点时,根据杠杆规则,析出的B、C、A混合晶体的质量为:
?随着E点的等温析晶过程的进行,体系中液相的数量不断减少,直至液相完全消失→此时固相点与原始熔体组成点M重合,结晶过程结束,体系重新获得一个自由度,系统温度又可继续下降。
?最后得到的结晶产物为晶相A、B和C。
(2)用冷却曲线表示
