新版gmp现场检查指导原则vs新版iso13485对比

原创:新版GMP现场检查指导原则vs新版ISO 13485
对比(连载五-完)
2016-05-26张稳博
2014年12月29日,国家食品药品监督管理总局发布了新版医疗器械生产质量管理规
范(2014年第64号,以下简称“新版GMP”),其具体实施时间因产品类型和企业开办情
况而各异。另外,2016年3月1日,ISO官网发布了ISO 13485:2016,其具体实施时间有
待确定。
大部分的医疗器械企业不但满足于在本国上市产品,而且想走出国门。为了帮助企业更
好地建立医疗器械质量管理体系,同时符合新版GMP和新版ISO 13485的要求,提高医疗器
械质量管理效率,博济医药为您整理了新版GMP及其现场检查指导原则(以下简称“检查原则”),与新版ISO 13485的对比,并稍作浅析,供您参考。
注:由于受版面限制,本文未对比美国的QSR 820、指南QSIT,后续会陆续出连载,请
密切关注博济医药。
由于内容篇幅过长,故分为多个连载,若需要全文,请联系博济医药。
一、详细条款对比
以ISO 13485:2016为主导。差异内容标注为不同颜色的加粗字体。
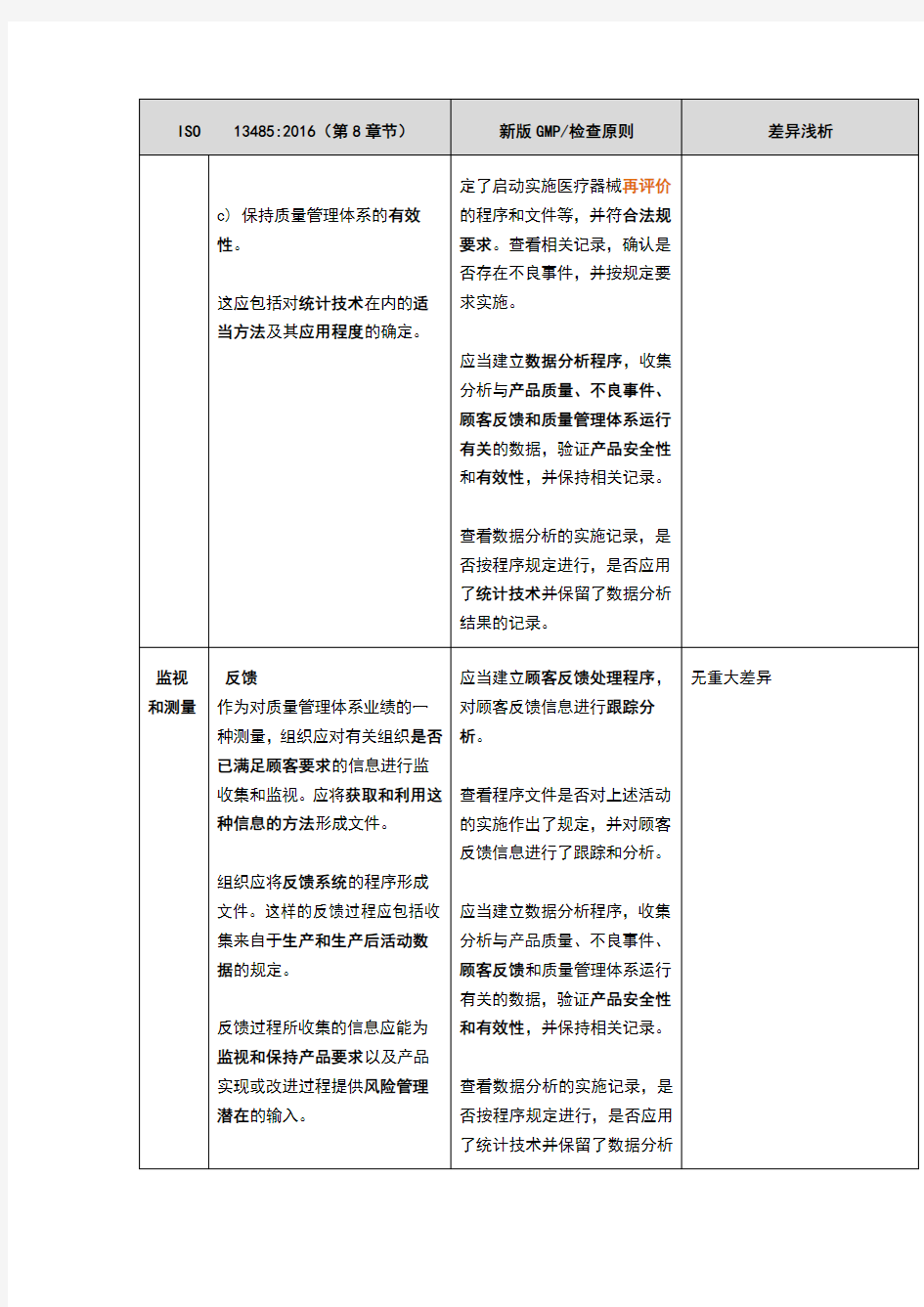
ISO 13485:2016(第8章节)新版GMP/检查原则差异浅析
8测量、分析和改进
总则组织应策划并实施以下方面所
需的监视、测量、分析和改进过
程:
a) 证实产品的符合性;
b) 确保质量管理体系的符合
性;
*应当按照有关法规要求建立
医疗器械不良事件监测制度,
开展不良事件监测和再评价工
作,保持相关记录。
查看企业建立的不良事件的监
测制度,是否规定了可疑不良
事件管理人员的职责、报告原
则、上报程序、上报时限,制
检查原则更加细化了监测制度
的具体要求。
ISO 13485:2016(第8章节)新版GMP/检查原则差异浅析
c) 保持质量管理体系的有效性。
这应包括对统计技术在内的适当方法及其应用程度的确定。定了启动实施医疗器械再评价的程序和文件等,并符合法规要求。查看相关记录,确认是否存在不良事件,并按规定要求实施。
应当建立数据分析程序,收集分析与产品质量、不良事件、顾客反馈和质量管理体系运行有关的数据,验证产品安全性和有效性,并保持相关记录。
查看数据分析的实施记录,是否按程序规定进行,是否应用了统计技术并保留了数据分析结果的记录。
监视和测量
反馈
作为对质量管理体系业绩的一
种测量,组织应对有关组织是否
已满足顾客要求的信息进行监
收集和监视。应将获取和利用这
种信息的方法形成文件。
组织应将反馈系统的程序形成
文件。这样的反馈过程应包括收
集来自于生产和生产后活动数
据的规定。
反馈过程所收集的信息应能为
监视和保持产品要求以及产品
实现或改进过程提供风险管理
潜在的输入。
应当建立顾客反馈处理程序,
对顾客反馈信息进行跟踪分
析。
查看程序文件是否对上述活动
的实施作出了规定,并对顾客
反馈信息进行了跟踪和分析。
应当建立数据分析程序,收集
分析与产品质量、不良事件、
顾客反馈和质量管理体系运行
有关的数据,验证产品安全性
和有效性,并保持相关记录。
查看数据分析的实施记录,是
否按程序规定进行,是否应用
了统计技术并保留了数据分析
无重大差异
ISO 13485:2016(第8章节)新版GMP/检查原则差异浅析
如果适用法规要求组织获得来
自生产后活动的特定经验,此经
验的评审应构成反馈过程的一
部分。
结果的记录。
投诉处理
组织应将依据适用的法规要求及时处理投诉的程序形成文件。
这些程序应至少包含以下要求和职责:
a) 接收和记录信息;
b) 评价信息以确定反馈是否构成投诉;
c) 调查投诉;
d) 确定将信息报告给适当的监管机构的需求;
e) 处理与投诉相关产品;
f) 确定开展纠正或纠正措施的需求。
如果投诉未经调查,应将其理由形成文件。任何因投诉处理过程所产生的纠正或纠正措施应形成文件。
如果调查确定投诉是组织外的活动所致,相关信息应在组织和应当指定相关部门负责接收、
调查、评价和处理顾客投诉,
并保持相关记录。
查看有关职责权限的文件,确
定是否对上述活动作出规定。
应当建立纠正措施程序,确定
产生问题的原因,采取有效措
施,防止相关问题再次发生。
13485更加细化投诉处理程序
的具体要求和职责。
ISO 13485:2016(第8章节)新版GMP/检查原则差异浅析相关外部方之间交换。
投诉处理记录应予保持(见。
报告监管机构
如果适用的法规要求将符合规定的不良事件报告准则的投诉进行告示或发布忠告性通知,组织应通知适当的监管机构的程序形成文件。
报告监管机构的记录应予保持(见。*对存在安全隐患的医疗器械,
应当按照有关法规要求采取召
回等措施,并按规定向有关部
门报告。
应当建立产品信息告知程序,
及时将产品变动、使用等补充
信息通知使用单位、相关企业
或消费者。
无重大差异
内部审核
组织应按策划的时间间隔进行内部审核,以确定质量管理体系是否:
a) 符合策划和文件化的安排、本标准的要求以及组织所建立的质量管理体系的要求和适用的法规要求;
b) 得到有效实施与保持。
组织应将程序形成文件,以表述策划、实施审核以及报告审核结果的职责和要求。
考虑拟受审区域和过程的状态和重要性以及以往审核的结果,应对审核方案进行策划。应规定和记录审核的准则、范围、间隔应当建立质量管理体系内部审
核程序,规定审核的准则、范
围、频次、参加人员、方法、
记录要求、纠正预防措施有效
性的评定等内容,以确保质量
管理体系符合本规范的要求。
查看内部审核程序是否包括了
上述内容。查看内审资料,实
施内审的人员是否经过培训,
内审的记录是否符合要求,针
对内审发现的问题是否采取了
纠正措施,是否有效。
13485明确了审核员的选择和
审核的实施应确保审核过程的
客观性和公正性;审核员不应审
核自己的工作。
ISO 13485:2016(第8章节)新版GMP/检查原则差异浅析策划的文件化的安排和文件化
的程序,在产品实现过程的适当阶段进行。
应保持符合接收准则的证据。授权放行产品的人员身份应予以记录(见。适当时,记录应识别用于开展测量活动的测试设备。
只有在已策划的文件化的安排已圆满完成时,才能放行产品和交付服务。
对于植入性医疗器械,组织应记录检验和试验人员的身份。查看产品检验规程是否涵盖强
制性标准以及经注册或者备案
的产品技术要求的性能指标;
确认检验记录是否能够证实产
品符合要求;查看是否根据检
验规程及检验结果出具相应的
检验报告或证书。
需要常规控制的进货检验、过
程检验和成品检验项目原则上
不得进行委托检验。对于检验
条件和设备要求较高,确需委
托检验的项目,可委托具有资
质的机构进行检验,以证明产
品符合强制性标准和经注册或
者备案的产品技术要求。
*每批(台)产品均应当有批检
验记录,并满足可追溯要求。
检验记录应当包括进货检验、
过程检验和成品检验的检验记
录、检验报告或证书等。
《GMP植入性医疗器械现场检
查指导原则》:
*应当具有相应的质量检验机
构或专职检验人员。
查看组织机构图、部门职责要
求、岗位人员任命等文件确认
是否符合要求。
产品的检验规程;
2)检查原则更加细
化了产品的检验要求;
3)虽然13485未在此
章节强调每批(台)产品均
应当有批检验记录,并满足
可追溯要求,但在前文第“
生产和服务提供的控制”有
提及;
4)植入性医疗器械
的相关要求,需参考《GMP
植入性医疗器械现场检查
指导原则》。
ISO 13485:2016(第8章节)新版GMP/检查原则差异浅析
不合格品控制
总则
组织应确保不符合产品要求的
产品得到识别和控制,以防止其
非预期的使用或交付。组织应将
规定不合格品控制以及规定不
合格品识别、文件证明、隔离、
评价和处置不合格品相关职责
和权限的程序形成文件。
不合格的评价应包括决定采取
调查的需求和通知对此不合格
负责的任何外部方。
应保持不合格的性质以及随后
采取任何措施的记录,包括评
价、任何调查和决定理由的记录
(见。
应当建立不合格品控制程序,
规定不合格品控制的部门和人
员的职责与权限。
*应当对不合格品进行标识、记
录、隔离、评审,根据评审结
果,应当对不合格品采取相应
的处置措施。
现场查看不合格品的标识、隔
离是否符合程序文件的规定,
抽查不合格品处理记录,是否
按文件的规定进行评审。
无重大差异
交付前不合格产品的响应措施
组织应按以下一个或多个方式
处理不合格品:
a) 采取措施消除已发现的不合
格;
b) 采取措施防止其原预期使用
或应用;
c) 授权让步使用、放行或接受
不合格品。
组织应确保不合格品仅在已提
供其合理性、获得批准并且满足
适用的法规要求情况下,才能实
*应当规定产品放行程序、条件
和放行批准要求。
查看产品放行程序,是否明确
了放行的条件和放行批准的要
求。应当规定有权放行产品人
员及其职责权限,并应当保持
批准的记录。
放行的产品应当附有合格证
明。
13485更加细化交付前不合格
产品的响应措施。
ISO 13485:2016(第8章节)新版GMP/检查原则差异浅析
返工
基于返工对产品潜在的不利影响的考虑,组织应依据文件化的程序实施返工。这些(返工)程序应经历和原程序相同的评审和批准。
返工结束后,产品应经过验证以确保其符合适用的接收准则和法规要求。
应保持返工的记录 (见。不合格品可以返工的,企业应
当编制返工控制文件。返工控
制文件应当包括作业指导书、
重新检验和重新验证等内容。
查看返工控制文件,是否对可
以返工的不合格品作出规定;
抽查返工活动记录,确认是否
符合返工控制文件的要求。
不能返工的,应当建立相关处
置制度。
检查原则明确了不能返工的,应
当建立相关处置制度。
数据分析组织应将确定、收集和分析适当
的数据,以证实质量管理体系的
适宜性和有效性的程序形成文
件。程序应包含统计技术及其应
用范围和程度在内的适当方法
的确定。
数据分析应包括由监视测量所
产生的数据和其他相关来源的
数据,至少包括以下方面的输
入:
a) 反馈;
b) 与产品要求的符合性;
c) 过程和产品的特性及趋势,
包括采取预防措施的机会;
d) 供方;
应当建立数据分析程序,收集
分析与产品质量、不良事件、
顾客反馈和质量管理体系运行
有关的数据,验证产品安全性
和有效性,并保持相关记录。
查看数据分析的实施记录,是
否按程序规定进行,是否应用
了统计技术并保留了数据分析
结果的记录。
13485更加细化了数据分析的
具体输入内容。
ISO 13485:2016(第8章节)新版GMP/检查原则差异浅析
e) 审核;
f) 适当时,服务报告。
如果数据分析显示质量管理体
系不适宜,不充分或不有效,组
织应按的要求将此分析作为改
进的输入。
数据分析结果的记录应予保持
(见。
改进总则
组织应利用质量方针、质量目
标、审核结果、上市后监督、数
据分析、纠正和预防措施以及管
理评审来识别和实施任何必要
的更改,以确保和保持质量管理
体系的持续适宜性、充分性和有
效性以及医疗器械的安全和性
能。*管理者代表应当负责建立、实
施并保持质量管理体系,报告
质量管理体系的运行情况和改
进需求,提高员工满足法规、
规章和顾客要求的意识。
查看是否对上述职责作出明确
规定。查看管理者代表报告质
量管理体系运行情况和改进的
相关记录。
*应当定期开展管理评审,对质
量管理体系进行评价和审核,
以确保其持续的适宜性、充分
性和有效性。
查看管理评审文件和记录,应
包括管理评审计划、管理评审
报告以及相关改进措施,管理
评审报告中是否包括了对法规
符合性的评价。是否在规定时
间内进行了管理评审,是否提
无重大差异。13485稍细化了识
别和实施任何必要的更改的利
用方式。
ISO 13485:2016(第8章节)新版GMP/检查原则差异浅析
出了改进措施并落实具体职责
和要求,是否按计划实施。
纠正措施
组织应采取措施,以消除不合格的原因,防止不合格的再发生。应及时采取任何必要的纠正措施。纠正措施应与所遇到不合格的影响程度相适应。
组织应编制形成文件的程序,以规定以下方面的要求:
a) 评审不合格(包括顾客投诉);
b) 确定不合格的原因;
c) 评价确保不合格不再发生的措施的需求;
d) 策划并对所需的措施形成文件,实施措施,适当时,包括更新文件;
e) 验证纠正措施未对满足适用的法规要求的能力或医疗器械的安全和性能带来不利影响;
f) 评审所采取的纠正措施的有效性。
任何调查和采取措施的记录应予保持(见。应当建立纠正措施程序,确定
产生问题的原因,采取有效措
施,防止相关问题再次发生。
应当建立质量管理体系内部审
核程序,规定审核的准则、范
围、频次、参加人员、方法、
记录要求、纠正预防措施有效
性的评定等内容,以确保质量
管理体系符合本规范的要求。
查看内部审核程序是否包括了
上述内容。查看内审资料,实
施内审的人员是否经过培训,
内审的记录是否符合要求,针
对内审发现的问题是否采取了
纠正措施,是否有效。
无重大差异,13485稍微细化了
对纠正措施的要求。
ISO 13485:2016(第8章节)新版GMP/检查原则差异浅析
预防措施
组织应确定措施,以消除潜在不合格的原因,防止不合格发生。预防措施应与潜在问题的影响程度相适应。
组织应形成文件的程序,以描述以下要求:
a) 确定潜在不合格及其原因;
b) 评价防止不合格发生的措施的需求;
c) 策划并对所需的措施形成文件,实施措施,适当时,包括更新文件;
d) 验证预防措施未对满足适用的法规要求的能力或医疗器械的安全和性能带来不利影响;
e) 适当时,评审所采取的预防措施的有效性。
任何调查和采取的措施的记录应予保持(见。应当建立预防措施程序,确定
潜在问题的原因,采取有效措
施,防止问题发生。
应当建立质量管理体系内部审
核程序,规定审核的准则、范
围、频次、参加人员、方法、
记录要求、纠正预防措施有效
性的评定等内容,以确保质量
管理体系符合本规范的要求。
查看内部审核程序是否包括了
上述内容。查看内审资料,实
施内审的人员是否经过培训,
内审的记录是否符合要求,针
对内审发现的问题是否采取了
纠正措施,是否有效。
无重大差异,13485稍微细化了
对预防措施的要求。
综上全文,新版ISO 13485与新版GMP及其现场检查指导原则,本质上并无重大差异,仅在细节条款存在部分差异,或者两者的条款互补。只要医疗器械企业仔细斟酌这些差异,相信能更高效率地完善自身质量管理体系。
如果您有医疗器械注册、体系或临床方面的问题,博济医药可为您提供专业的服务,以帮助您的产品及早进入国内外市场,面向全球。
以上内容仅供参考,一切以官方发布信息为准。
参考:ISO 13485: 2016,新版GMP及其现场检查指导原则原创:博济医药-张稳博
体外诊断试剂现场检查指导原则
附件4 医疗器械生产质量管理规范体外诊断试剂现场检查
指导原则 章条款内容节 应当建立与医疗器械生产相适应的管理机构,具备组织机构图。 1.1.1 是否包括企业的组织机构图,查看提供的质量手册,是否明确 各部门的相互 关系。 应当明确各部门的职责和权限,明确质量管理职能。 程序文件或相关文件,查看企业的质量手册,是否对各部门的职责权限作出规定; *1.1.2质量管理部门应当能独立行使职能, 查看质量管理部门 的文件,是否明确规定对 机产品质量的相关事宜负有决策的权利。构生产管理 部门和质量管理部门负责人不得互相兼任。和1.1.3查看公司的任职文件或授权文件并对照相关生产、检验等履行职责的记录, 核实人是否与授权一致。员 1.2.1企业负责人应当是医疗器械产品质量的主要责任人。
企业负责人应当组织制定质量方针和质量目标。 1.2.2查看质量方针和质量目标的制定程序、批准人员。 企业负责人应当确保质量管理体系有效运行所需的人力资源、基础设 施和工作环 1.2.3 境。 —53——
章 条款内容节 企业负责人应当组织实施管理评审,定期对质量管理体系运行情
况进行评估,并 1.2.4持续改进。查看管理评审文件和记录,核实企业负责人是否组织实施管理评审。*1.2.5企业负责人应当确保企业按照法律、法规和规章的要求组织生产。企业负责人应当确定一名管理者代表。 1.3.1 查看管理者代表的任命文件。管理者代表应当负责建立、实施并保持质量管理体系,报告质量管理体系的运行情况和改进需求,提高员工满足法规、规章和顾客要求的意识。*1.3.2查看是否对上述职责作出明确规定。查看管理者代表报告质量管理体系运行情况和改进的相关记录技术、生产、质量管理部门负责人应当熟悉医疗器械法律法规,具有质量管理的实践经验,应当有能力对生产管理和质量管理中实际问题作出正确判断和处理。 1.4.1 查看相关部门负责人的任职资格要求,是否对专业知识、工作技能、工作经历作出规定;查看考核评价记录,现场询问,确定是否符合要求。应当配备与生产产品相适应的专业技术人员、管理人员和操作人员。 1.5.1 查看相关人员的资格要求。应当具有相应的质量检验机构或专职检验人员。*1.5.2 查看组织机构图、部门职责要求、岗位人员任命等文件确认是否符合要求。*1.6.1从事影响产品质量工作的人员,应当经
生产现场检查指导原则
附件2 仿制药质量和疗效一致性评价 生产现场检查指导原则 为贯彻落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2016〕8号),进一步规范仿制药质量和疗效一致性评价(以下简称一致性评价)申请的生产现场检查要求,保证药品检查质量,制定本指导原则。 一、目的 一致性评价生产现场检查是对申报品种的生产条件和能力及其动态生产过程进行检查,确认相关生产和质量控制活动与申报的处方、生产工艺、生产条件、质量标准的一致性,以及药品生产是否符合《药品生产质量管理规范》要求。 二、组织 (一)国家食品药品监督管理总局负责全国一致性评价现场检查的统筹和监督管理。 (二)国家食品药品监督管理总局食品药品审核查验中心(以下简称核查中心)负责指导全国一致性评价现场检查工作,负责组织对境内用同一条生产线生产上市并在欧盟、美国或日本获准上市的药品和地产化的原研药品进行检查;对进口仿制药品的境外生产现场进行抽查。 (三)省级食品药品监督管理部门负责组织对所受理的国内一致性评价药品的生产现场检查。 三、程序 —1 —
(一)国内仿制药品 1.申请人提交《仿制药质量和疗效一致性评价申请表》时,同时提交生产现场检查申请,应包括《生产现场检查申请表》(附1-1)a、《现场主文件》(清单见附1-2) c、《生产现场检查准备情况》(附1-3)g,涉及多个生产场地的,应予详细说明。 2.申请人应在现场检查期间安排申报品种的动态生产。 3.省级食品药品监督管理部门原则上应在接收/受理申报资料后30日内组织生产现场检查。 应对《生产现场检查申请表》、现场检查准备情况的内容进行审核,并参考现场主文件基于品种的工艺和风险制定检查方案。与申请人沟通检查品种的现场生产安排情况,申请人应在现场检查期间安排申报品种的动态生产,应当至少对每个申报品种(规格)的一个批次的动态生产情况进行现场检查。检查准备工作完成后,应发出现场检查通知明确检查员、检查时间等信息,并要求申请人安排动态生产。 4.检查组一般由2—3名检查员组成,原则上至少包含1名药品GMP检查员。检查组按照检查方案开展检查,并完成生产现场检查报告(附2)h。检查组现场对连续生产的三批产品进行抽样,应包含现场检查动态生产批次的产品,现场封签(封签样式详见附3)j,填写《生产现场检查抽样记录单》(附4)l、《生产现场检查抽样检验通知书》(附5)o。由申请人将所抽样品及申报资料送一致性评价办公室指定的药品检验机构进行复核检验。 5.省级食品药品监督管理部门对《生产现场检查报告》进行审核。 6.涉及改变处方工艺的,应参照《药品注册管理办法》的有关要求,提出补充申请,按照《仿制药质量和疗效一致性评价工作程序》执行。 (二)进口仿制药品 1.申请人提交生产现场检查申请时,应填写《生产现场检查申请表》(附1-1)及—2 —
药品经营质量管理规范现场检查指导原则(含答案)
《药品经营质量管理规范现场检查指导原则》考试题姓名:考试时间:成绩: 一、填空:(40空,每空2分,共80分) 1、企业应当( )参与质量管理,各部门、岗位人员应当正确理解并履行职责,承担相应的质量责任。 2、企业应当依据有关法律法规及本规范的要求建立()。 3、企业制定的质量方针文件应当明确企业总的()和(),并贯彻到药品经营活动的全过程。 4、企业应当在质量管理体系关键要素发生重大变化时,组织开展()。 5、企业()的职责不得由其他部门及人员履行。 6、质量管理部门应当负责对()和()的合法性、购进药品的合法性以及供货单位()、购货单位()的合资格进行审核,并根据审核内容的变化进行动态管理。 7、()应当负责指导设定计算机系统质量控制功能,负责计算机系统()的审核和质量管理基础数据的建立及更新。 8、质量管理部门应当组织()、()相关设施设备。 9、质量管理部门应当组织对被委托运输的承运方()和()的审查。 10、企业应当对各岗位人员进行与其职责和工作内容相关的()和()。 11、书面记录及凭证应当及时填写,并做到()、不得()、不得()。 12、冷库应当配备()、()、()、()、()的设备。 13、企业采购药品时应当向供货单位索取()。 14、冷藏、冷冻药品到货时,应当对其运输方式及运输过程的()、() 等质量控制状况进行重点检查并记录,不符合温度要求的应当()。 15、冷藏、冷冻药品应当在()内待验。 16、企业按照验收规定,对每次到货药品进行( )。 17、储存药品相对湿度为()。 18、药品按批号堆码,不同批号的药品不得()。
19、药品和()、()与其他药品分开存放。 20、运输药品过程中,运载工具应当保持()。 21、企业应当制定冷藏、冷冻药品运输(),对运输途中可能发生的设备 故障、异常天气影响、交通拥堵等突发事件,能够采取相应的应对措施。 22、委托运输记录应当至少保存()。 23、企业应加强对退货的管理,保证退货环节药品的质量和安全,防止混入()。 二、多项选择题:(每题5分,共20分) 1、企业质量管理体系应当与其经营范围和规模相适应,包括:() A、组织机构 B、人员 C、设施设备 D、质量管理体系文件 E、计算机系统 2、企业根据相关验证管理制度,形成验证控制文件,包括() A、验证方案 B、验证报告 C、验证评价 D、偏差处理 E、预防措施 3、发现不得入库的情况有() A、药品包装出现破损、污染、封口不牢、衬垫不实、封条损坏等问题 B、包装内有异常响动或者液体渗漏; C、标签脱落、字迹模糊不清或者标识内容与实务不符; D、药品已超过有效期; E、其他异常情况的药品。 4、《药品经营质量管理规范现场检查指导原则》中检查项目共258条,其 中严重缺陷项目为()项: A、药品经营企业应当依法经营; B、药品经营企业应当坚持诚实守信,禁止任何虚假、欺骗行为; C、企业制定质量管理体系文件应当符合企业实际,文件包括质量管理制定、部门及岗位职责、操作规程、档案、报告、记录和凭证等; D、企业计算机系统应应当符合《规范》要求及企业管理实际需要的应用软件和相关数据库;
药品生产现场检查风险评定指导原则2014
药品生产现场检查风险评定指导原则 药品监督管理部门对在企业现场检查中发现的缺陷应根据本指导原则进行分类,附件列举了部分缺陷事例及其分类情况,旨在规范药品检查行为,指导药品检查机构(人员)对发现的缺陷进行科学评定。 本指导原则适用于药品监督管理部门组织的药品GMP认证检查、跟踪检查等检查工作;在药品飞行检查中,涉及药品GMP执行情况的,也可参照本指导原则进行检查和判定。 一、缺陷的分类 缺陷分为“严重缺陷”、“主要缺陷”和“一般缺陷”,其风险等级依次降低。(具体举例见附件1~3) (一)严重缺陷 严重缺陷是指与药品GMP要求有严重偏离,产品可能对使用者造成危害的缺陷。属于下列情形之一的为严重缺陷: 1.对使用者造成危害或存在健康风险; 2.与药品GMP要求有严重偏离,给产品质量带来严重风险; 3.有文件、数据、记录等不真实的欺骗行为;4.存在多项关联主要缺陷,经综合分析表明质量管理体系中某一系统不能有效运行。 (二)主要缺陷 主要缺陷是指与药品GMP要求有较大偏离的缺陷。属于下列情形之一的为主要缺陷:1.与药品GMP要求有较大偏离,给产品质量带来较大风险; 2.不能按要求放行产品,或质量受权人不能有效履行其放行职责; 3.存在多项关联一般缺陷,经综合分析表明质量管理体系中某一系统不完善。 (三)一般缺陷 一般缺陷是指偏离药品GMP要求,但尚未达到严重缺陷和主要缺陷程度的缺陷。 二、产品风险分类 企业所生产的药品,依据风险高低分为高风险产品和一般风险产品。 (一)高风险产品以下产品属高风险产品:1.治疗窗窄的药品; 2.高活性、高毒性、高致敏性药品(包括微量交叉污染即能引发健康风险的药品,如青霉素类、细胞毒性、性激素类药品); 3.无菌药品; 4.生物制品(含血液制品); 5.生产工艺较难控制的产品(是指参数控制的微小偏差即可造成产品不均一或不符合质量标准的产品,如:脂质体、微球、某些长效或缓释、控释产品等)。 (二)一般风险产品 指高风险产品以外的其他产品。 三、风险评定原则 对现场检查所发现的缺陷,应根据其缺陷严重程度以及产品风险分类,综合判定其风险高低。风险评定应遵循以下原则: (一)所评定的风险与缺陷的性质和出现次数有关。(二)所评定的风险与产品风险类别有关。(三)所评定的风险与企业的整改情况有关。当企业重复出现前次检查发现的缺陷,表明企业没有整改,或没有采取适当的预防措施防止此类缺陷再次发生,风险等级可根据具体情况上升一级。 四、检查结果判定 检查结果判定按照《关于印发药品生产质量管理规范认证管理办法的通知》(国食药监安〔2011〕365号)第24条有关规定处理。 附件:1.严重缺陷(举例) 2.主要缺陷(举例) 3.一般缺陷(举例)
新版gmp现场检查指导原则vs新版iso13485对比
原创:新版GMP现场检查指导原则vs新版ISO 13485 对比(连载五-完) 2016-05-26张稳博 2014年12月29日,国家食品药品监督管理总局发布了新版医疗器械生产质量管理规 范(2014年第64号,以下简称“新版GMP”),其具体实施时间因产品类型和企业开办情 况而各异。另外,2016年3月1日,ISO官网发布了ISO 13485:2016,其具体实施时间有 待确定。 大部分的医疗器械企业不但满足于在本国上市产品,而且想走出国门。为了帮助企业更 好地建立医疗器械质量管理体系,同时符合新版GMP和新版ISO 13485的要求,提高医疗器 械质量管理效率,博济医药为您整理了新版GMP及其现场检查指导原则(以下简称“检查原则”),与新版ISO 13485的对比,并稍作浅析,供您参考。 注:由于受版面限制,本文未对比美国的QSR 820、指南QSIT,后续会陆续出连载,请 密切关注博济医药。 由于内容篇幅过长,故分为多个连载,若需要全文,请联系博济医药。 一、详细条款对比 以ISO 13485:2016为主导。差异内容标注为不同颜色的加粗字体。 ISO 13485:2016(第8章节)新版GMP/检查原则差异浅析 8测量、分析和改进 总则组织应策划并实施以下方面所 需的监视、测量、分析和改进过 程: a) 证实产品的符合性; b) 确保质量管理体系的符合 性; *应当按照有关法规要求建立 医疗器械不良事件监测制度, 开展不良事件监测和再评价工 作,保持相关记录。 查看企业建立的不良事件的监 测制度,是否规定了可疑不良 事件管理人员的职责、报告原 则、上报程序、上报时限,制 检查原则更加细化了监测制度 的具体要求。
医疗器械GMP规范现场检查指导原则考试试卷(含答案)
医疗器械生产质量管理规范现场检查指导原则考核 部门:___________姓名:___________分数:_________ 一、填空(3分/题,75分) 1、应当明确各部门的职责和权限,明确质量管理职能。 2、企业负责人应当是医疗器械产品质量的主要责任人。 3、企业负责人应当组织实施管理评审,定期对质量管理体系运行情况进行评估,并持续改进。 4、管理者代表应当负责建立、实施并保持质量管理体系,报告质量管理体系的运行情况和改进需求,提高员工满足法规、规章和顾客要求的意识。 5、技术、质量、管理部门负责人应当熟悉医疗器械法律法规,具有质量管理的实践经验,应当有能力对生产管理和质量管理中实际问题作出正确判断和处理。 6、应当具有相应的质量检验机构或专职检验人员。 7、厂房与设施应当根据所生产产品的特性、工艺流程及相应的洁净级别要求进行合理设计、布局和使用。 8、厂房应当有适当的照明、温度、湿度和通风控制条件。 9、仓储区应当能够满足原材料、包装材料、中间体、成品等贮存条件和要求。 10、仓储区应当按照待验、合格、不合格、退货或召回等进行有序、分区存放各类材料和产品,便于检查和监控。
11、应当配备与产品生产规模、品种、检验要求相适应的检验场所和设施。 12、应当配备与产品检验要求相适应的检验仪器和设备,主要检验仪器和设备应当具有明确的操作规程 13、应当建立健全质量管理体系文件,包括质量方针和质量目标、质量手册、程序文件、技术文件和记录,以及法规要求的其他文件。14、技术文件应当包括产品技术要求及相关标准、生产工艺规程、作业指导书、检验和试验操作规程、安装和服务操作规程等相关文件。15、分发和使用的文件应当为适宜的文本,已撤销或作废的文件应当进行标识,防止误用。 16、记录不得随意涂改或销毁,更改记录应当签注姓名和日期,并使原有信息仍清晰可辨,必要时,应当说明更改的理由。 17、记录的保存期限至少相当于生产企业所规定的医疗器械的寿命期,但从放行产品的日期起不少于2年,或符合相关法规要求,并可追溯。 18、设计和开发输入应当包括预期用途规定的功能、性能和安全要求、法规要求风险管理措施和其他要求。 19、必要时,应当对设计和开发更改进行评审、验证和确认,并在实施前得到批准。 20、应当建立供应商审核制度,对供应商进行审核评价,必要时,应当进行现场审核。 21、应当与主要原材料供应商签订质量保证协议,明确双方所承担的
GMP现场检查指导原则
G M P现场检查指导原则 Document number:PBGCG-0857-BTDO-0089-PTT1998
药品生产现场检查风险评定指导原则 药品监督管理部门对在企业现场检查中发现的缺陷应根据本指导原则进行分类,附件列举了部分缺陷事例及其分类情况,旨在规范药品检查行为,指导药品检查机构(人员)对发现的缺陷进行科学评定。 本指导原则适用于药品监督管理部门组织的药品GMP认证检查、跟踪检查等检查工作;在药品飞行检查中,涉及药品GMP执行情况的,也可参照本指导原则进行检查和判定。 一、缺陷的分类 缺陷分为“严重缺陷”、“主要缺陷”和“一般缺陷”,其风险等级依次降低。(具体举例见附件1~3) (一)严重缺陷 严重缺陷是指与药品GMP要求有严重偏离,产品可能对使用者造成危害的缺陷。属于下列情形之一的为严重缺陷: 1.对使用者造成危害或存在健康风险; 2.与药品GMP要求有严重偏离,给产品质量带来严重风险; 3.有文件、数据、记录等不真实的欺骗行为; 4.存在多项关联主要缺陷,经综合分析表明质量管理体系中某一系统不能有效运行。
(二)主要缺陷 主要缺陷是指与药品GMP要求有较大偏离的缺陷。属于下列情形之一的为主要缺陷: 1.与药品GMP要求有较大偏离,给产品质量带来较大风险; 2.不能按要求放行产品,或质量受权人不能有效履行其放行职责; 3.存在多项关联一般缺陷,经综合分析表明质量管理体系中某一系统不完善。 (三)一般缺陷 一般缺陷是指偏离药品GMP要求,但尚未达到严重缺陷和主要缺陷程度的缺陷。 二、产品风险分类 企业所生产的药品,依据风险高低分为高风险产品和一般风险产品。 (一)高风险产品 以下产品属高风险产品: 1.治疗窗窄的药品; 2.高活性、高毒性、高致敏性药品(包括微量交叉污染即能引发健康风险的药品,如青霉素类、细胞毒性、性激素类药品); 3.无菌药品; 4.生物制品(含血液制品);
药品经营质量管理规范现场检查指导原则
药品经营质量管理规范现场检查指导原则
说明 一、为规范《药品经营质量管理规范》检查工作,确保检查工作质量,根据《药品经营质量管理规范》,制定《药品经营质量管理规范现场检查指导原则》。 二、应当按照本指导原则中包含的检查项目和所对应的附录检查内容,对药品经营企业实施《药品经营质量管 理规范》情况进行全面检查。 三、按照本指导原则进行检查过程中,有关检查项目应当同时对照所对应的附录检查内容进行检查。如果附录 检查内容检查中存在任何不符合要求的情形,所对应的检查项目应当判定为不符合要求。 四、本指导原则批发企业检查项目共258 项,其中严重缺陷项目(** )6 项,主要缺陷项目(*)107 项,一般 缺陷项目145 项。 本指导原则零售企业检查项目共180 项,其中严重缺陷项目(** )4 项,主要缺陷项(* )58 项,一般缺陷项118 项。 五、药品零售连锁企业总部及配送中心按照药品批发企业检查项目检查,药品零售连锁企业门店按照药品零售 企业检查项目检查。
六、结果判定: 检查项目 结果判定 严重缺陷项目主要缺陷项目一般缺陷项目 0 0 ≤20% 通过检查 0 0 20%~ 30% 限期整改后复核检查 0 <10% <20% ≥ 1 0 ≥10% 不通过检查 0 <10% ≥20% 0 0 ≥30% 注:缺陷项目比例数=对应的缺陷项目中不符合项目数/(对应缺陷项目总数- 对应缺陷检查项目合理缺项数)×100%。
第一部分药品批发企业(258 项检查内容省略) 第二部分药品零售企业 一、《药品经营质量管理规范》部分 序号条款号检查项目 1 **00401 药品经营企业应当依法经营。 总则 2 **00402 药品经营企业应当坚持诚实守信,禁止任何虚假、欺骗行为。 3 12301 企业应当按照有关法律法规及本规范的要求制定质量管理文件,开展质量管理活动,确保药品质量。 4 **12401 企业应当具有与其经营范围和规模相适应的经营条件,包括组织机构、人员、设施设备、质量管理文件,并按照规定设置计算机系统。 企业负责人是药品质量的主要责任人,负责企业日常管理,负责提供必要的条件,保证 5 *12501 质量管理部门和质量管理人员有效履行职责,确保企业按照《规范》要求经营药品。 质 6 *12601 企业应当设置质量管理部门或者配备质量管理人员。 量 7 12602 管质量管理部门或者质量管理人员负责督促相关部门和岗位人员执行药品管理的法律法规及《规范》要求。 理 8 12603 质量管理部门或者质量管理人员负责组织制订质量管理文件,并指导、监督文件的执行。
医疗器械现场检查指导原则
医疗器械现场检查指导原则 附件医疗器械通用名称命名指导原则本指导原则依据《医疗器械通用名称命名规则》制定,是制定医疗器械通用名称和编制各专业领域命名指导原则的基本要求。 本指导原则是对备案人、注册申请人、审查人员及各专业领域命名指导原则编写人员的指导性文件,不包括注册审批所涉及的行政事项,不作为法规强制执行。若有满足相关法规要求的其他方法,也可采用,并应提供充分的研究资料和验证资料。本指导原则是在现行法规和标准体系以及当前认知水平下制定的,应在遵循相关法规的前提下使用。随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将进行适时的调整。 一、适用范围本指导原则是制定医疗器械通用名称的基本技术要求,同时用于指导各专业领域的命名指导原则编制。对于各专业领域存在的特殊情形,由各专业领域命名指导原则进行具体说明。 本原则不适用于按照医疗器械管理的体外诊断试剂。 二、通用名称组成结构及要求(一)医疗器械通用名称由一个核心词和一般不超过三个特征词组成。 (二)核心词是对具有相同或者相似的技术原理、结构组成或者预期目的的医疗器械的概括表述。 (三)特征词是对医疗器械使用部位、结构特点、技术特点或者材料组成等特定属性的描述。 (四)各领域根据专业领域特性和产品特点分别确定核心词和特征词选取原则。 (五)对现有认知和技术具有重大影响的其他特定属性,视情况需要可增加特征词数量。
(六)一般情况下,描述产品使用形式、提供形式等属性的特征词应放首位,其他类型的特征词应按其对核心词的修饰性从广义到狭义的顺序排列。 (七)由两种及以上医疗器械组合而成,以实现某一临床预期用途的器械组合产品,由各领域根据产品实际情况进行命名,原则上其通用名称应体现组合形式和主要临床预期用途。按医疗器械管理的药械组合产品,根据其专业领域要求,其通用名称宜体现药械组合特性。 三、命名指导原则编制指南(一)基于现有技术发展情况,以技术为主线,从医疗器械的功能和临床使用的角度,按不同专业领域分别编制命名指导原则。按照专科服从通用、分领域服从总领域、全面覆盖、避免重复的原则,做好各领域内的统一、领域间的协调衔接。 (二)在各专业领域体系框架下,按照第二条第二款要求确定核心词概念范畴,确定需要在通用名称中体现产品特点的特征词,按照第二条第六款要求进行排序,形成固定的共有结构,编制医疗器械产品通用名称的核心词和特征词的可选术语。 (三)各专业领域命名指导原则主要内容为:该领域适用范围、核心词及特征词制定原则、通用名称确定原则、命名术语表、利用术语表确定通用名称的方法、参考资料等。 (四)通用名称中未能包含的其他特征可考虑在产品型号、规格、标识、说明书等制造商信息中加以体现,如确有其他特征需在通用名称中体现,或有未能包含的产品,可对命名指导原则进行调整或增补。 四、命名术语表编制(一)命名术语表包含序号、产品类别、术语类型、术语名称和术语描述五项内容。
GSP认证现场检查指导原则(最新完整版)
药品经营质量管理规范现场检查指导原则 lenary sessi on, e ach session of the Central Committee of national instit utions and personnel problems have bee n arranged, you can conce ntrate on national deve lopme nt and reforms. Previous plenary session is often branded wit h a ce ntral leadi ng collective, often by l ooki ng at the thir d plenum of the initiative t o found the curre nt ce ntral leader shi p coll ective gover na nce chara cteristics. From the analysis of the process of economic reform in China, ple nary se ssion, 12 sessi on, 14, 16 ple nary session have programmatic meani ng, respectivel y, marking t he four stage s of Chi na's economi c reform, and that the start-up pha se of reform, reform, construction phase a nd perfecting t he Socialist market economy framework stage of socialist market economy. Previous plenary session topi cs propose d to the t hird plenary sessi on of "taking class struggle as t he key link," shifted to sociali st moder nizati on; 12 session marked the cha nge from rural to ur ban, establi she d with public owner shi p as the F oundation of a pla nned commodity e conomy; 13 session at a time w hen bot h the ol d and the new system cha nge, gover nance and rectify the economic order; 14 ... Fair and efficient and aut horitative Socialist judi cial system, safeguard the pe ople's interests. Legal authority to uphol d the Constituti on, deepeni ng the reform of admini strative law enfor cement, e nsure that the rig ht to exercise judicial power i ndepe nde ntly and impartially accor ding to law t he pr ose cuti on, perfecting t he runni ng mechanism of judi cial power, improve t he system of judicia l prote ction of huma n rights. Ple nary session, Affairs the right to a dhere t o the system, a nd let
药品生产现场检查风险评定指导原则
药品生产现场检查风险评定指导原则 各省、自治区、直辖市食品药品监督管理局,新疆生产建设兵团食品药品监督管理局: 为进一步强化药品生产监督管理,规范和指导《药品生产质量管理规范》现场检查工作,统一检查和评定标准。总局组织制定了《药品生产现场检查风险评定指导原则》,现予印发,请遵照执行。 国家食品药品监督管理总局 2014年5月13日 药品生产现场检查风险评定指导原则 药品监督管理部门对在企业现场检查中发现的缺陷应根据本指导原则进行分类,附件列举了部分缺陷事例及其分类情况,旨在规范药品检查行为,指导药品检查机构(人员)对发现的缺陷进行科学评定。 本指导原则适用于药品监督管理部门组织的药品GMP认证检查、跟踪检查等检查工作;在药品飞行检查中,涉及药品GMP执行情况的,也可参照本指导原则进行检查和判定。 一、缺陷的分类 缺陷分为“严重缺陷”、“主要缺陷”和“一般缺陷”,其风险等级依次降低。(具体举例见附件1~3) (一)严重缺陷 严重缺陷是指与药品GMP要求有严重偏离,产品可能对使用者造成危害的缺陷。属于下列情形之一的为严重缺陷: 1.对使用者造成危害或存在健康风险; 2.与药品GMP要求有严重偏离,给产品质量带来严重风险; 3.有文件、数据、记录等不真实的欺骗行为; 4.存在多项关联主要缺陷,经综合分析表明质量管理体系中某一系统不能有效运行。 (二)主要缺陷 主要缺陷是指与药品GMP要求有较大偏离的缺陷。属于下列情形之一的为主要缺陷:1.与药品GMP要求有较大偏离,给产品质量带来较大风险; 2.不能按要求放行产品,或质量受权人不能有效履行其放行职责; 3.存在多项关联一般缺陷,经综合分析表明质量管理体系中某一系统不完善。 (三)一般缺陷 一般缺陷是指偏离药品GMP要求,但尚未达到严重缺陷和主要缺陷程度的缺陷。 二、产品风险分类企业所生产的药品,依据风险高低分为高风险产品和一般风险产品。 (一)高风险产品以下产品属高风险产品:
体外诊断GMP审查要点
体外诊断GMP审查要点 导读:近日,利用周末时间,花了好几个小时,整理了医疗器械体外诊断的审核要点,如果大家觉有用,请转发分享出去哦,本次整理主要参照《医疗器械生产质量管理规范体外诊断试剂现场检查指导原则》,摘取部份课件内容,又融合以往曝光的飞检内容,对《规范》全部章节进行了梳理,希望能帮助到大家! 检查依据: 《药品医疗器械飞行检查办法》(2015年总局令第14号) 《医疗器械生产质量管理规范》(2014年第64号) 《医疗器械生产质量管理规范附录体外诊断试剂》(2015年第103号) 《医疗器械生产质量管理规范体外诊断试剂现场检查指导原则》食药监械监〔2015〕218号 相关标准 YY0287-2017《医疗器械质量管理体系用于法规的要求》 略…… 检查范围: 医疗器械生产企业在医疗器械设计开发、生产、销售和售后服务等过程中应当遵守以上法规的要求。 责任主体: 企业应当依照以上规范的要求,结合产品特点,建立健全与所生产医疗器械相适应的质量管理体系,并保证其有效运行。 风险意识: 企业应当将风险管理贯穿与设计开发,生产,销售和售后服务等全过程,所采取的措施应当与产品存在的风险相适应。 简点说明: 如何检查,查什么?怎么查?基于风险,根据产品特性、生产工艺、生产规模,围绕产品生产需要实施检查。 医疗器械生产质量管理规范GMP 是体外试剂生产管理和质量控制的基本要求,旨在最大限度地降低试剂生产过程中,污染、交叉污染以及混淆、差错等风险,确保持续稳定地生产出符合预期用途和注册要求的产品,其宗旨是为保障医疗器械安全、有效,规范医疗器械生产质量管理 第一节:机构和人员
飞检案例: 1、企业负责人未对企业质量体系运行情况进行评估 2、企业未提供文件发放实施前培训记录 3、进入洁净区的工作人员未进行微生物知识培训,也无相关培训计划 4、洁净间直接接触物料和产品的人员未进行健康体验 5、进入洁净区需戴一次性无菌手套,但未在人员进出洁净区管理规程中明确戴手套的相关要求等 关键点: 人是生产质量管理过程中最主要的,尤其是基本的操作人员 组织机构控制;人员职责明确;培训是必要的基本保障:三项是检查必查项目 1、企业负责人: (1)组织制定质量方针和质量目标 (2)组织实施管理评审,定期对质量管理体系运行情况进行评估,并持续改进。 (3)确保企业按照法律、法规和规章的要求组织生产 (4)确保质量管理体系有效运行所需的人力资源、基础设施和工作环境。 (5)应当确定一名管理者代表 3、管理者代表: (1)应当负责建立(质量管理体系所需的过程形成文件)、实施并保持质量管理体系(2)报告质量管理体系的运行情况(向最高管理者和监督单位)和改进需求 (3)提高员工满足法规、规章和顾客要求的意识 4、其他负责人: (1)技术、生产、质量管理部门负责人应当熟悉医疗器械法律法规 (2)具有质量管理的实践经验(学历背景、工作经历) (3)应当有能力对生产管理和质量管理中实际问题作出正确判断和处理 (4)体外诊断试剂生产、技术和质量管理人员应当具有医学、检验学、生物学、免疫学或药学等 2、职责权限 (1)生产管理部门和质量管理部门负责人不得相互兼任 (2)确保生产和质量管理完整性、合理性 (3)部门职责和权限清晰,职能明确完整,不交叉,不重叠,补缺位,不空位 (4)任命书或授权文件应与实际权限一致 注意在组织机构图基础上,需要进一步明确产品实现过程中各环节的管理程序,出现各种问题时,如何进行协调管理,并最终实现有效控制 5、人员档案 (1)从事影响产品质量工作的人员,应当定期进行培训(如卫生、微生物学、洁净作业、安全防护等) (2)建立人员健康档案,每年至少体检一次,患有传染性和感染性疾病的人员不得从事直接接触产品的工作
GMP现场检查缺陷项目改正方案撰写指导原则
GMP检查缺陷项目改正方案撰写指导原则为进一步提高药品生产企业实施药品生产质量管理规范(简称“GMP”)的水平,指导企业采取有效措施对现场检查发现的缺陷进行整改,规范企业改正方案的撰写,根据《浙江省药品生产质量管理规范认证管理实施办法》,特制订本指导原则。 1.改正方案的基本要求 1.1.企业应在现场结束后10个工作日内,将改正方案上报浙江省药品认证中心,同时抄报企业所在地市局。 1.2.改正方案应由正文和附件两部分组成。正文部分至少应包括:缺陷的描述、产生缺陷的原因分析、相关的风险分析评估、(拟)采取的整改措施及完成时间。正文部分可以是文字描述,也可以采用表格的形式进行说明。附件部分应是对正文部分进一步解释说明的证明性材料。 1.3.改正方案应内容完整、表达清楚,文字通顺、用语准确,充分如实反映企业的整改情况,并加盖企业公章。 2.改正方案撰写的具体技术要求 2.1.正文部分 2.1.1.缺陷的描述 2.1.1.1.企业需改正的缺陷不仅仅是检查报告中缺陷条款的内容,还应包括现场检查报告其他部分涉及的缺陷内容,如综合评定、需要说明的问题中涉及的缺陷等。 2.1.1.2.应对检查报告中涉及的每项缺陷进行详细的文字表达,包括发生的时间、地点、具体情节及相关人员等。 例:企业关于7901项缺陷的描述:仓库员工(xxx)在2009年8月11日接受一批XX胶囊(批号:20090101)的退货时,未严格按文件执行企业退货和收回程序,退货产品接受处理记录内容不全,退货来源、数量均未记录。
2.1.2.原因分析 2.1.2.1.应对涉及的缺陷逐条进行原因分析。原因分析不应停留在引发缺陷的表面现象,应找到缺陷发生的根本原因。 2.1.2.2.对发生的缺陷至少应从以下方面进行分析: 涉及软件的,应分析是否制订了相应的文件;相应的文件的内容是否完善、合理;相应的文件是否已经过了培训;员工是否按照相应的文件进行了操作;质量管理部门是否进行了有效的监督。 涉及硬件的,应主要从设计选型、施工安装、日常维护等因素进行原因分析,并审阅支持该硬件的文件系统。 涉及人员的,应分析是否配备了足够的人员;相关人员的能力是否胜任该岗位的需要;相关人员是否受到了应有培训;培训的内容是否已被掌握。 2.1.2.3.根据原因分析的结果进而确定该缺陷是由于系统原因造成还是偶然发生的个例。 例:检查组缺陷描述:口服固体车间部分计量器具(温湿度计、压差计等)计量合格证上无编号,不能追溯;原辅料仓库相邻房间温湿度计的相对湿度差15%以上。 企业原因分析:现场检查时发现口服固体车间部分温湿度计、压差计计量合格证上无编号,主要是质量管理人员管理不到位造成。负责计量器具的为新招聘人员,由于培训不到位,平时工作疏忽,未对该车间的计量器具进行校验登记,主管也未对此项工作及时监督检查,造成该缺陷。该缺陷产生为系统原因,涉及培训、员工对该岗位工作的胜任程度和质量管理部门的有效监督。 原辅料仓库相邻房间温湿度计的相对湿度差15%以上,该仓库温湿度计均经过校验,并在有效期内。经了解,可能是由于仓库人员在某次搬运时碰到温湿度计,掉落损坏,未及时发现。质量部门将仓库所有的温度计都进行了检查,其余均正常。该缺陷为偶然发生个例。 2.1.3.风险评估
无菌GMP下放配套指南:药品生产现场检查风险评定指导原则
药品生产现场检查风险评定指导原则 药品监督管理部门对在企业现场检查中发现的缺陷应根据本指导原则进行分类,附件列举了部分缺陷事例及其分类情况,旨在规范药品检查行为,指导药品检查机构(人员)对发现的缺陷进行科学评定。 本指导原则适用于药品监督管理部门组织的药品GMP认证检查、跟踪检查等检查工作;在药品飞行检查中,涉及药品GMP执行情况的,也可参照本指导原则进行检查和判定。 一、缺陷的分类 缺陷分为“严重缺陷”、“主要缺陷”和“一般缺陷”,其风险等级依次降低。(具体举例见附件1~3) (一)严重缺陷 严重缺陷是指与药品GMP要求有严重偏离,产品可能对使用者造成危害的缺陷。属于下列情形之一的为严重缺陷: 1.对使用者造成危害或存在健康风险; 2.与药品GMP要求有严重偏离,给产品质量带来严重风险; 3.有文件、数据、记录等不真实的欺骗行为; 4.存在多项关联主要缺陷,经综合分析表明质量管理体系中某一系统不能有效运行。 (二)主要缺陷 主要缺陷是指与药品GMP要求有较大偏离的缺陷。属于下列情形之一的为主要缺陷:
1.与药品GMP要求有较大偏离,给产品质量带来较大风险; 2.不能按要求放行产品,或质量受权人不能有效履行其放行职责; 3.存在多项关联一般缺陷,经综合分析表明质量管理体系中某一系统不完善。 (三)一般缺陷 一般缺陷是指偏离药品GMP要求,但尚未达到严重缺陷和主要缺陷程度的缺陷。 二、产品风险分类 企业所生产的药品,依据风险高低分为高风险产品和一般风险产品。 (一)高风险产品 以下产品属高风险产品: 1.治疗窗窄的药品; 2.高活性、高毒性、高致敏性药品(包括微量交叉污染即能引发健康风险的药品,如青霉素类、细胞毒性、性激素类药品); 3.无菌药品; 4.生物制品(含血液制品); 5.生产工艺较难控制的产品(是指参数控制的微小偏差即可造成产品不均一或不符合质量标准的产品,如:脂质体、微球、某些长效或缓释、控释产品等)。
食品药品监管总局关于印发药品生产现场检查风险评定指导原则的通知
食品药品监管总局关于印发药品生产现场检查风险评定指 导原则的通知 食药监药化监〔2014〕53号 各省、自治区、直辖市食品药品监督管理局,新疆生产建设兵团食品药品监督管理局:为进一步强化药品生产监督管理,规范和指导《药品生产质量管理规范》现场检查工作,统一检查和评定标准。总局组织制定了《药品生产现场检查风险评定指导原则》,现予印发,请遵照执行。 国家食品药品监督管理总局 2014年5月13日 药品生产现场检查风险评定指导原则 药品监督管理部门对在企业现场检查中发现的缺陷应根据本指导原则进行分类,附件列举了部分缺陷事例及其分类情况,旨在规范药品检查行为,指导药品检查机构(人员)对发现的缺陷进行科学评定。
本指导原则适用于药品监督管理部门组织的药品GMP认证检查、跟踪检查等检查工作;在药品飞行检查中,涉及药品GMP执行情况的,也可参照本指导原则进行检查和判定。 一、缺陷的分类 缺陷分为“严重缺陷”、“主要缺陷”和“一般缺陷”,其风险等级依次降低。(具体举例见附件1~3) (一)严重缺陷 严重缺陷是指与药品GMP要求有严重偏离,产品可能对使用者造成危害的缺陷。属于下列情形之一的为严重缺陷: 1.对使用者造成危害或存在健康风险; 2.与药品GMP要求有严重偏离,给产品质量带来严重风险; 3.有文件、数据、记录等不真实的欺骗行为; 4.存在多项关联主要缺陷,经综合分析表明质量管理体系中某一系统不能有效运行。 (二)主要缺陷 主要缺陷是指与药品GMP要求有较大偏离的缺陷。属于下列情形之一的为主要缺陷:1.与药品GMP要求有较大偏离,给产品质量带来较大风险; 2.不能按要求放行产品,或质量受权人不能有效履行其放行职责;
药品生产现场检查风险评定指导原则
药品生产现场检查风险 评定指导原则 Company number:【0089WT-8898YT-W8CCB-BUUT-202108】
药品生产现场检查风险评定指导原则各省、自治区、直辖市食品药品监督管理局,新疆生产建设兵团食品药品监督管理局:为进一步强化药品生产监督管理,规范和指导《药品生产质量管理规范》现场检查工作,统一检查和评定标准。总局组织制定了《药品生产现场检查风险评定指导原则》,现予印发,请遵照执行。 国家食品药品监督管理总局 2014年5月13日药品生产现场检查风险评定指导原则 药品监督管理部门对在企业现场检查中发现的缺陷应根据本指导原则进行分类,附件列举了部分缺陷事例及其分类情况,旨在规范药品检查行为,指导药品检查机构(人员)对发现的缺陷进行科学评定。 本指导原则适用于药品监督管理部门组织的药品GMP认证检查、跟踪检查等检查工作;在药品飞行检查中,涉及药品GMP执行情况的,也可参照本指导原则进行检查和判定。 一、缺陷的分类 缺陷分为“严重缺陷”、“主要缺陷”和“一般缺陷”,其风险等级依次降低。(具体举例见附件1~3) (一)严重缺陷 严重缺陷是指与药品GMP要求有严重偏离,产品可能对使用者造成危害的缺陷。属于下列情形之一的为严重缺陷: 1.对使用者造成危害或存在健康风险;
2.与药品GMP要求有严重偏离,给产品质量带来严重风险; 3.有文件、数据、记录等不真实的欺骗行为; 4.存在多项关联主要缺陷,经综合分析表明质量管理体系中某一系统不能有效运行。 (二)主要缺陷 主要缺陷是指与药品GMP要求有较大偏离的缺陷。属于下列情形之一的为主要缺陷: 1.与药品GMP要求有较大偏离,给产品质量带来较大风险; 2.不能按要求放行产品,或质量受权人不能有效履行其放行职责; 3.存在多项关联一般缺陷,经综合分析表明质量管理体系中某一系统不完善。 (三)一般缺陷 一般缺陷是指偏离药品GMP要求,但尚未达到严重缺陷和主要缺陷程度的缺陷。 二、产品风险分类企业所生产的药品,依据风险高低分为高风险产品和一般风险产品。 (一)高风险产品以下产品属高风险产品: 1.治疗窗窄的药品; 2.高活性、高毒性、高致敏性药品(包括微量交叉污染即能引发健康风险的药品,如青霉素类、细胞毒性、性激素类药品); 3.无菌药品; 4.生物制品(含血液制品); 5.生产工艺较难控制的产品(是指参数控制的微小偏差即可造成产品不均一或不符合质量标准的产品,如:脂质体、微球、某些长效或缓释、控释产品等)。
