知识总结物质间的相互转化

物质间的相互转化
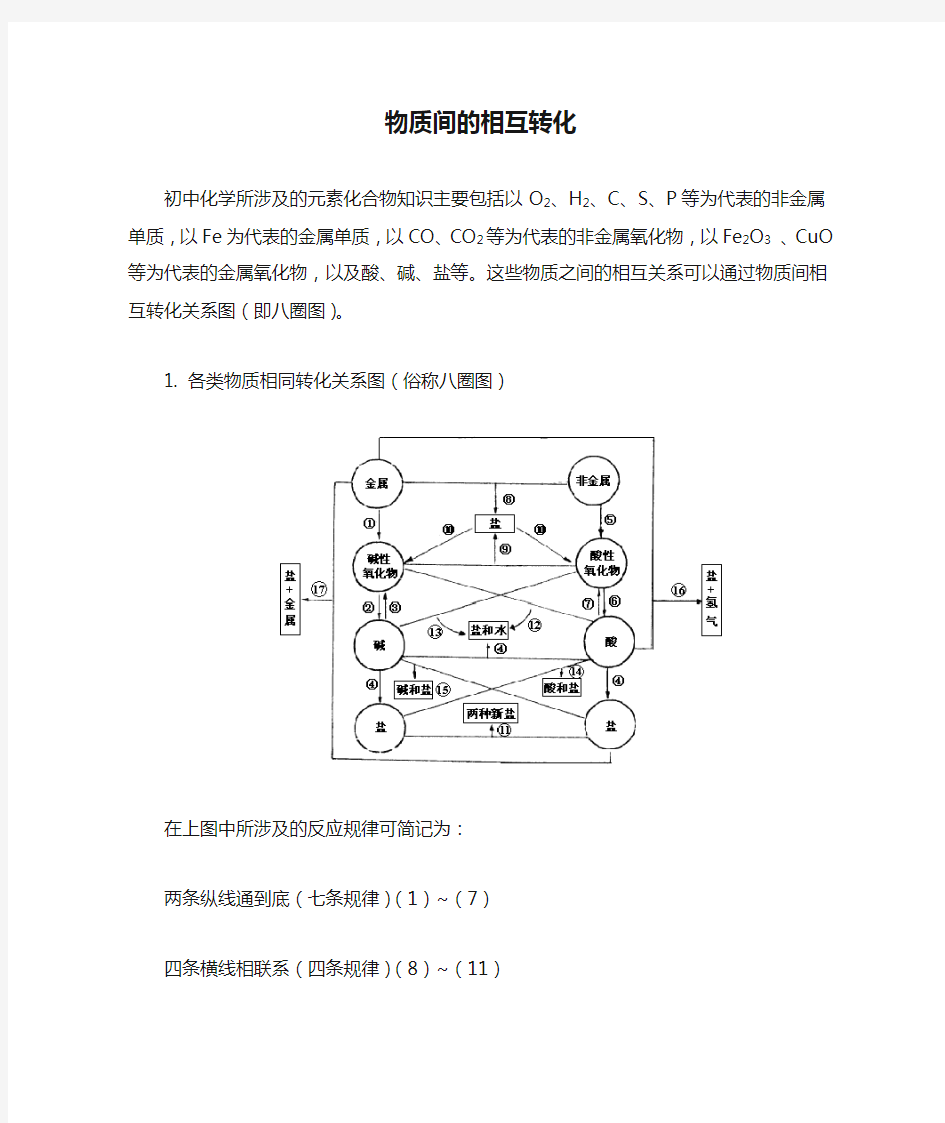
初中化学所涉及的元素化合物知识主要包括以O 2、H 2、C 、S 、P 等为代表的非金属单质,以Fe 为代表的金属单质,以CO 、CO 2等为代表的非金属氧化物,以Fe 2O 3 、CuO 等为代表的金属氧化物,以及酸、碱、盐等。这些物质之间的相互关系可以通过物质间相互转化关系图(即八圈图)。
1. 各类物质相同转化关系图(俗称八圈图)
在上图中所涉及的反应规律可简记为:
两条纵线通到底(七条规律)(1)~(7)
四条横线相联系(四条规律)(8)~(11)
六条交叉成网络(六条规律)(12)~(17)
17条规律须牢记
反应规律
示例
纵向:
(1)金属+???→??/2点燃O 金属氧化物(碱性氧化物) O Na O Na 2224=+ CuO O Cu 222?+
(2)碱性氧化物(可溶)+水→碱(可溶)
NaOH O H O Na 222=+
(3)碱(难溶)???→??高温/碱氧(难溶) + 水
?
==2)(OH Cu O H CuO 2+
(4)酸+碱→盐+水 O H PO Na PO H NaOH 2434333+=+
O H CuSO SO H OH Cu 244222)(+=+
(5)非金属+??
→?点燃2O 非金属氧化物(酸性氧化物) 22CO O C 点燃+ 522254O P O P 点燃+ (6)酸性氧化物(易溶)+水→酸(易溶)
3222CO H O H CO =+ 4325223PO H O H O P =+
(7)酸(易挥发 / 难溶)→酸氧+水(易挥发 / 难溶)
↑+=2232CO O H CO H 2232SiO O H SiO H +?
从纵向来看,金属→碱性氧化物→碱→盐,其中金属元素相同。 非金属→酸性氧化物→酸(含氧酸)→盐,其中非金属元素相同。 横向:
(8)金属+非金属→(无氧酸)盐
NaCl Cl Na 222点燃+
(9)碱氧+酸氧→(含氧酸)盐
32CaSiO SiO CaO 高温+
(10)含氧酸盐→碱氧+酸氧
↑+23CO CaO CaCO 高温
(11)盐+盐→两种新盐
↓+=+AgCl NaNO AgNO NaCl 33
交叉:
(12)酸+碱氧→盐+水
O H CuSO CuO SO H 2442+=+
(13)碱+酸氧→盐+水
O H CO Na CO NaOH 23222+=+
(14)酸+盐→新酸+新盐
32423242CO H SO Na CO Na SO H +=+
↑+=2232CO O H CO H
(15)碱+盐→新碱+新盐
↓+=+2424)(2OH Cu SO Na CuSO NaOH
(16)金属+酸→盐+↑2H
↑+=+2442)(H ZnSO SO H Zn 稀
(17)金属+盐→新盐+新金属
44ZnSO Cu CuSO Zn +=+
以上十七条规律的应用:
(1)可知某物质的性质。
(2)可知某物质的制法。如:(4)、(8)、(9)、(11)~(17)为盐的十种制法。
(3)已知各类物质间的相互关系。
说明:
<1> 以上各规律为各物质间相互转化的一般规律,具体到某些物质有些规律要具体分析,未必均适用。
例如:制取2ZnCl 的方法与制取4CuSO 的方法各有几种?(思考)
答:制取2ZnCl :
① ↑+=+222H ZnCl HCl Zn
② O H ZnCl HCl ZnO 222+=+
③ O H ZnCl HCl OH Zn 22222)(+=+
④ ↑++=+22232CO O H ZnCl HCl ZnCO
⑤ 22ZnCl Cl Zn 点燃+
⑥ ↓+=+4224BaSO ZnCl BaCl ZnSO
⑦ Cu ZnCl CuCl Zn +=+22
因2ZnCl 为无氧酸盐,故规律(9)、(13)不适用。
因2)(OH Zn 为难溶碱,故规律(15)不适用。
∴ 只有如上7种制法。
制取4CuSO :
① O H CuSO SO H CuO 2442+=+
② O H CuSO SO H OH Cu 244222)(+=+
③ ↑++=+224423CO O H CuSO SO H CuCO
因Cu 为H 后金属,2)(OH Cu 为难溶碱、CuO 不能直接与SO 3反应生成CuSO 4,Ag 2SO 4为微溶物,不符合与CuCl 2发生复分解反应的条件,也不能与Cu 发生置换反应等原因,∴ CuSO 4只有上述三种制取方法(初中范围内,方法③也不常见)
<2> 此外,在物质的制取中还有一些常见的规律,如:
对于盐+酸→新盐+新酸,有如下规律:
① 强酸→弱酸
如:↑++=+22232CO O H CaCl HCl CaCO
② 稳定的(不易分解的)酸→不稳定的(另分解的)酸。
如:↑++=+22232CO O H CaCl HCl CaCO
③ 高沸点(不易挥发的)酸→低沸点(易挥发的)酸。 如:↑+?+HCl SO Na NaCl SO H 2)
(2)(4242固浓
④ 可溶性酸→难溶性酸。 如:↓+=+323222SiO H NaCl HCl SiO Na
<3> 从反应规律与反应类型的关系来看。
属于化合反应的有:规律(1)、(2)、(5)、(6)、(8)、(9)。
属于分解反应的有:规律(3)、(7)、(10)。
属于置换反应的有:规律(16)、(17)。
属于复分解反应的有:规律(4)、(11)、(12)、(14)、(15)。
规律(13)不属于任何一种基本反应类型。
初中阶段不属于任何一种基本反应类型的反应包括:
O H CO O CH 222422++点燃
O H CO O OH H C 222
52323++点燃
2CO Cu CuO CO +?+ 酸氧+碱→盐+水
2. 金属活动顺序表及其使用范围:
(1)金属活动顺序:很活泼Na Ca K 较活泼Fe Zn Al Mg )(H Pb Sn 钝化不活泼Au
Pt Ag Hg Cu
(2)在金属活动性顺序里,位于氢以前的较活泼金属,能与盐酸或稀硫酸发生置换反应,置换出酸中的氢,氢后的金属则不能。较活泼的金属能将不活泼金属从它的盐溶液里置换出来。
(3)很活泼的金属与某些盐溶液反应时,先与水反应生成碱,然后碱再与盐溶液发生复分解反应,无金属生成。
2、 酸、碱、盐的溶解性规律
(1)酸:无机化合物中,除硅酸(32SiO H )不溶于水,大多数常见的酸易溶于水。
(2)碱:一水合氨(O H NH 23?)、2)(OH Ba KOH NaOH 、、易溶;2)(OH Ca 微溶;其余碱不溶于水。
(3)盐:铵盐、钾盐、钠盐、硝酸盐易溶;盐酸盐中22Cl Hg AgCl 、(氯化亚汞)不溶,其余溶;硫酸盐中44PbSO BaSO 、不溶,4CaSO 、42SO Ag 微溶,其
余都溶;碳酸盐中,+++
Na K NH 、、4溶,+2Mg 微溶,其余不溶;磷酸盐、硫化
物中除+++Na K NH 、、4溶外,其余不溶。
(4)酸中342HNO SO H HCl 、、为强酸,43PO H 为中强酸,、、3232CO H SiO H COOH CH S H 32、为弱酸。
(5)可溶性碱除O H NH 23?(弱碱)外均为强碱,不溶性碱为弱碱。了解酸、碱、盐的溶解性的应用之一是判断某些复分解反应能否发生。
4. 复分解反应的发生条件
(1)复分解反应需在溶液里才能发生,在固态时无自由移动的离子时不发生反应。还要看生成物是否满足下列条件之一:
① 产生沉淀 ② 放出气体 ③ 生成难电离的水
(2)复分解反应常发生在下列几条反应规律中:
① 酸+碱→盐+水(有强酸或强碱,至少一种物质可溶,若碱不溶于水但能溶于酸)
② 酸+碱性氧化物→盐+水(碱氧可不溶于水,但要溶于酸,酸为强酸) ③ 酸+盐→新酸+新盐(盐可不溶于水,但要溶于酸,酸为强酸) ④ 碱+盐→新碱+新盐(反应物的碱和盐均要溶于水)
⑤ 盐+盐→两种新盐(反应物均要溶于水)
