硅化学方程式

硅及其化合物
碳、硅及其化合物的化学方程式和离子方程式
碳硅及其化合物的化学方程式和离子方程式 碳及其化合物的化学方程式和离子方程式 一、碳 1、碳在少量的氧气中燃烧:2C+O22CO 2、碳在足量的氧气中燃烧:C+O2CO2 3、碳和硫蒸气高温反应:C+2S CS2 4、碳和氧化铁在高温下反应:2Fe2O3+3C2Fe+3CO2↑ 5、碳粉与氧化铜共热:2CuO+C2Cu+CO2↑ 6、碳和水蒸气高温反应:C+H2O CO+H2 7、碳和二氧化碳在高温下反应:C+CO22CO 8、碳与浓硫酸共热:C+2H2SO4CO2↑+2SO2↑+2H2O 9、碳与浓硝酸共热:C+4HNO3CO2↑+4NO2↑+2H2O 10、碳与稀硝酸共热:3C+4HNO33CO2↑+4NO ↑+2H2O 11、工业上制备粗硅:SiO2+2C Si+2CO↑ 12、工业上制备金刚砂:SiO2+3C SiC+2CO↑ 13、工业上制备碳化钙:CaO+3C CaC2+CO↑ 二、一氧化碳 1、一氧化碳在氧气中燃烧:2CO+O22CO2 2、一氧化碳气体和氧化铁在高温下反应:Fe2O3+3CO2Fe+3CO2 3、一氧化碳通过灼热的氧化铜:CuO+CO Cu+CO2 4、一氧化碳和水蒸气反应:CO+H2O CO2+H2 三、二氧化碳 1、镁在二氧化碳中燃烧:2Mg+CO22MgO+C 2、碳和二氧化碳在高温下反应:C+CO22CO
3、氧化钠与二氧化碳反应:Na2O+CO2Na2CO3 4、氧化钙与二氧化碳反应:CaO+CO2CaCO3 5、过氧化钠与二氧化碳反应:2Na2O2+2CO22Na2CO3+O2↑ 6、二氧化碳和水反应:CO 2+H2O H2CO3 7、向氢氧化钠溶液中通入少量的二氧化碳:2NaOH+CO2Na2CO3+H2O 2OH-+CO2CO32-+H2O 8、向氢氧化钠溶液中通入过量的二氧化碳:NaOH+CO2NaHCO3 OH-+CO2HCO3- 9、工业上生产碳铵:NH3+CO2+H2O NH4HCO3 10、向澄清石灰水中通入二氧化碳:Ca(OH)2+CO2CaCO3↓+H2O Ca2++2OH-+CO2CaCO3↓+H2O 11、碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO3 CO32-+CO2+H2O2HCO3- 12、向饱和的碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO3 2Na++CO32-+CO2+H2O2NaHCO3↓13、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO3 2AlO2-+CO2+3H2O2Al(OH)3↓+CO32-14、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3↓+NaHCO3 AlO2-+CO2+2H2O Al(OH)3↓+HCO3-15、向硅酸钠通入中通入少量的二氧化碳:Na2SiO3+CO2+H2O H2SiO3↓+Na2CO3 SiO32-+CO2+H2O CO32-+H2SiO3↓ 16、向硅酸钠通入中通入过量的二氧化碳:Na2SiO3+2CO2+2H2O H2SiO3↓+2NaHCO3 SiO32-+2CO2+2H2O2HCO3-+H2SiO3↓
碳、硅及其化合物的化学方程式
碳及其化合物的化学方程式1、碳在少量的氧气中燃烧: 2、碳在足量的氧气中燃烧: 3、碳和水蒸气反应: 4、碳和氧化铁反应: 5、碳粉与氧化铜共热: 6、工业上制备粗硅: 7、碳和二氧化碳反应: 8、碳与浓硫酸共热: 9、碳与浓硝酸共热: 10、碳与稀硝酸共热: 11、一氧化碳在氧气中燃烧: 12、一氧化碳气体和氧化铁反应: 13、一氧化碳通过灼热的氧化铜: 14、一氧化碳和水蒸气反应: 15、镁在二氧化碳中燃烧: 16、碳和二氧化碳在高温下反应: 17、氧化钠与二氧化碳反应: 18、氧化钙与二氧化碳反应: 19、过氧化钠与二氧化碳反应: 20、二氧化碳和水反应: 21、向氢氧化钠溶液中通入少量的二氧化碳:
22、向氢氧化钠溶液中通入过量的二氧化碳: 23、向澄清石灰水中通入二氧化碳: 24、碳酸钠溶液中通入二氧化碳气体: 25、向偏铝酸钠溶液通入少量二氧化碳气体: 26、向偏铝酸钠溶液通入足量二氧化碳气体: 27、向硅酸钠通入中通入少量的二氧化碳: 28、向硅酸钠通入中通入过量的二氧化碳: 29、向碳酸钙的悬浊液通入二氧化碳气体: 30、向苯酚钠溶液中通入二氧化碳气体: 31、向次氯酸钠溶液中通入二氧化碳气体: 32、向次氯酸钙溶液中通入二氧化碳: 33、碳酸钙溶于稀盐酸: 34、碳酸钙溶于醋酸: 35、碳酸钙与二氧化硅反应: 36、高温分解碳酸钙: 37、向碳酸钙的悬浊液通入二氧化碳气体: 38、碳酸氢钙与盐酸反应: 39、向碳酸氢钙溶液中加入少量氢氧化钠溶液: 40、向碳酸氢钙溶液中加入足量氢氧化钠溶液: 41、向碳酸氢钙溶液中加入石灰水: 42、碳酸氢钙溶液与碳酸钠溶液反应:
高一化学方程式——硅
4、硅及其化合物的转化关系 ①Si +O 2 △ SiO 2 ②SiO 2+2C 高温 Si +2CO ↑(制取粗硅) ※③SiO 2+4HF = SiF 4↑+2H 2O (刻蚀玻璃) ⑩ ④Si +4HF = SiF 4↑+2H 2↑ ⑤SiO 2+CaO 高温 CaSiO 3 ※⑥SiO 2+2NaOH = Na 2SiO 3+H 2O (SiO2是酸性氧化物) SiO 2+CaCO 3 高温 CaSiO 3+CO 2↑ SiO 2+2OH -= SiO 32-+H 2O (装NaOH 的试剂瓶不可以用玻璃塞 ) SiO 2+Na 2CO 3 高温 Na 2SiO 3+CO 2↑ (Na 2SiO 3是粘合剂) ※ ⑦Na 2SiO 3+2HCl = H 2SiO 3↓+2NaCl SiO 32-+2H += H 2SiO 3↓(白色胶状沉淀)( 硅胶可以用作干燥剂) ※⑦Na 2SiO 3+H 2O +CO 2=H 2SiO 3↓+Na 2CO 3或Na 2SiO 3+2H 2O +2CO 2=H 2SiO 3↓+2NaHCO 3 SiO 32-+H 2O +CO 2=H 2SiO 3↓+CO 32-或SiO 32-+2H 2O +2CO 2=H 2SiO 3↓+2HCO 3- (强酸制弱酸,SiO 2不能和H 2O 反应制硅酸) ⑧H 2SiO 3+2NaOH = Na 2SiO 3+2H 2O ⑨H 2SiO 3 △ H 2O +SiO 2 H 2SiO 3+2OH -= SiO 32-+2H 2O ※⑩Si+NaOH +H 2O=Na 2SiO 3+H 2↑ 5、氯及其化合物的转化关系 ①2Fe +3Cl 2 点燃 2FeCl 3 (棕黄色的烟) ②Cu +Cl 2 点燃 CuCl 2 (棕黄色的烟) ③2FeCl 3+Cu = 2FeCl 2+CuCl 2 2Fe 3++Cu = 2Fe 2++Cu 2+ ④H 2+Cl 2 2HCl (苍白色火焰,光照时发生爆炸) ※ ⑤MnO 2+4HCl(浓) △ MnCl 2+Cl 2↑+2H 2O MnO 2+4H ++2Cl - △ Mn 2++Cl 2↑+2H 2O ※⑥Cl 2+H 2O = HCl +HClO (次氯酸是弱酸) ※⑦2HClO 2HCl +O 2↑ Cl 2+H 2O = H ++Cl -+HClO 2HClO 2H ++2Cl -+O 2↑ ※ ⑧Cl 2+2NaOH = NaCl +NaClO +H 2O ※ ⑨2Cl 2+2Ca(OH)2 = CaCl 2+Ca(ClO)2+2H 2O 工业制漂白粉用石灰乳 Cl 2+2OH -= Cl -+ClO -+H 2O ※⑩Ca(ClO)2+H 2O +CO 2 = CaCO 3↓+2HClO 或Ca(ClO)2+2HCl = CaCl 2+2HClO Ca 2++2ClO -+H 2O +CO 2= CaCO 3↓+2HClO 或ClO -+H += HClO 漂白粉的漂白原理 向漂白粉溶液中通入过量的CO 2:Ca(ClO)2+2H 2O +2CO 2 = Ca(HCO 3)2+2HClO ClO -+H 2O +CO 2 = HCO 3-+HClO Na 2SiO 3 SiF 4 Si SiO 2 H 2SiO 3 CaSiO 3 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ CuCl 2 HClO HCl Cl 2 FeCl 3 NaClO Ca(ClO)2 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ 点燃 或光照 光照 光照
硅和氯的化学方程式(完整版)
点燃 非金属及其化合物的方程式集锦 3Cl2+2P2PCl3(小液滴) 点燃一、硅及其化合物的相互转化 PCl3+Cl2PCl5(固体小颗粒) 1、二氧化硅与氢氟酸反应:SiO2+4HF=SiF4↑+2H2O3.氯气与水反应:Cl2+H2O=HCl+HClO 二氧化硅与氢氧化钠溶液反应:SiO2+2NaOH=Na2SiO3+H2O 离子方程式:Cl2+H2O=H++Cl-+HClO 离子方程式:SiO2+2OH-=SiO32-+H2O 4.HClO光照下分解:2HClO光照2HCl+O 2↑高温5.制漂白液(或氯气尾气处理):Cl2+2NaOH=NaCl+NaClO+H2O 二氧化硅与氧化钙高温反应:SiO2+CaOCaSiO3 工业制玻璃原理:SiO2+Na2CO3高温Na2SiO3+CO 2↑ 离子方程式:Cl2+2OH-=Cl-+ClO-+H2O 6.制漂白粉(或漂粉精):2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O SiO2+CaCO3高温CaSiO3+CO2↑7.漂白粉的使用原理:Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO 2、硅酸钠溶液中通入二氧化碳:Na2SiO3+H2O+CO2=Na2CO3+H2SiO3↓离子方程式:Ca2++2ClO-+H2O+CO2=CaCO+2HClO 离子方程式:SiO32-+H2O+CO2=CO32-+H2SiO3↓ 漂白粉长期置露在空气中失效:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,硅酸钠与盐酸反应:Na2SiO3+2HCl=2NaCl+H2SiO3↓2HClO光照2HCl+O2↑离子方程式:SiO32-+2H+=H2SiO3↓8.实验室制氯气:4HCl(浓)+MnO2△MnCl2+Cl2↑+2H2O 硅酸受热分解:H2SiO3△SiO2+H2O 离子方程式:4H++2Cl-+MnO2△Mn2++Cl2↑+2H2O 3、粗硅的制取:SiO2+2C高温Si+2CO↑粗硅的提纯:Si+2Cl2△SiCl4 9.氯气与还原性物质反应 SiCl4+2H2△Si+4HCl a.Cl2+2NaBr=2NaCl+Br2离子方程式:Cl2+2Br-=2Cl-+Br2 4、硅单质与O2 、F2、HF、NaOH溶液:Si+2F2=SiF4Si+4HF=SiF4+2H2↑b.Cl2+2KI=2KCl+I2离子方程式:Cl2+2I -=2Cl-+I 2 点燃 Si+2NaOH+H2O=Na2SiO3+2H2↑Si+O2SiO2 c.Br2+2KI=2KBr+I2离子方程式:Br2+2I -=2Br-+I2 二、氯及其化合物的相互转化 d.Cl2+H2S=S↓+2HCl 1、氯气与金属反应:2Na+Cl2 点燃 2NaCl(黄色火焰,产生白烟) 2++Cl2=2Fe3++Cl- e.FeCl2+Cl2=2FeCl3离子方程式:Fe 点燃 Cu+Cl2CuCl2(产生棕黄色烟) f.2H2O+SO2+Cl2=2HCl+H2SO4 点燃 2Fe+3Cl22FeCl3(产生棕黄色烟) 离子方程式:2H2O+SO2+Cl2=4H++2Cl-+SO42- 点燃 专业资料整理
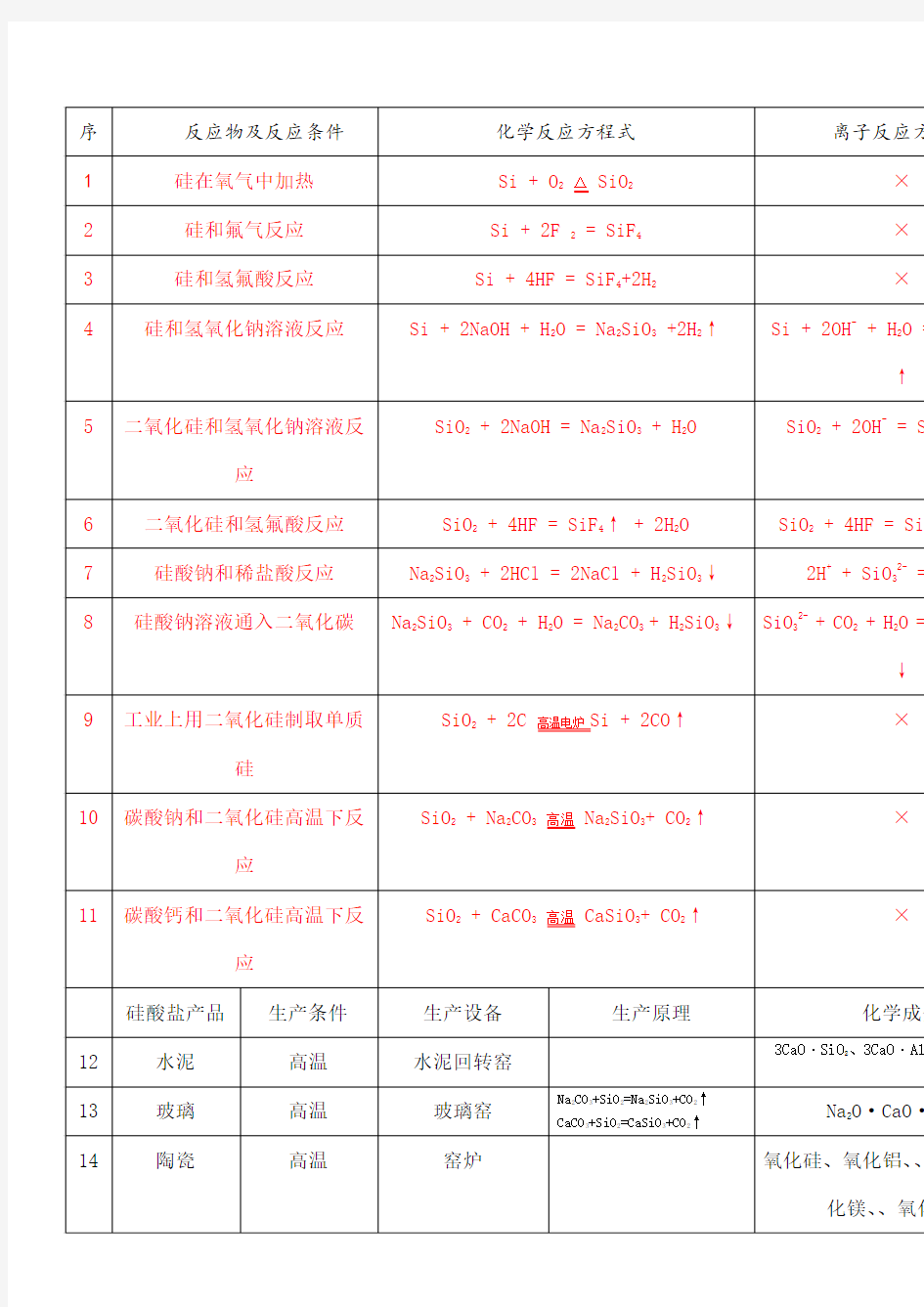
硅化学方程式
序反应物及反应条件化学反应方程式 1硅在氧气中加热 Si + O 2△ SiO 2 2硅和氟气反应 Si + 2F 2 = SiF 4 3硅和氢氟酸反应 Si + 4HF = SiF 4+2H 2 4硅和氢氧化钠溶液反应 Si + 2NaOH + H 2O = Na 2SiO3 +2H 2↑ 5二氧化硅和氢氧化钠溶液反应 SiO2 + 2NaOH = Na 2SiO3 + H 2O 6二氧化硅和氢氟酸反应 SiO 2 + 4HF = SiF 4↑ + 2H 2O 7硅酸钠和稀盐酸反应 Na2SiO 3 + 2HCl = 2NaCl + H2SiO 3↓ 8硅酸钠溶液通入二氧化碳 Na2SiO3 + CO 2 + H 2O = Na 2CO3 + H 2SiO 3↓ SiO2 + 2C 高温电炉 Si + 2CO ↑ 9工业上用二氧化硅制取单质硅 SiO2 + Na 2CO3高温 Na2SiO3+ CO 2↑10碳酸钠和二氧化硅高温下反应 SiO2 + CaCO3高温 CaSiO3+ CO 2↑ 11碳酸钙和二氧化硅高温下反应 离子反应方程式 × × × Si + 2OH - + H 2O = SiO 32- +2H 2↑ -2- SiO 2 + 2OH = SiO 3+ H 2O SiO 2 + 4HF = SiF 4↑ + 2H 2O +2- 2H + SiO 3=H 2SiO3 ↓ SiO32- + CO 2 + H 2O = CO 32- + H 2SiO3↓ × × ×
硅酸盐产品生产条件生产设备生产原理化学成分 12水泥高温水泥回转窑 3CaO·SiO 2、 3CaO· Al 2 O3、 2CaO· SiO 2 13玻璃高温玻璃窑Na2CO 3+SiO 2=Na 2SiO 3+CO2↑ Na2O·CaO·6SiO 2 CaCO3+SiO 2=CaSiO3+CO2↑ 14陶瓷高温窑炉氧化硅、氧化铝、氧化钾、氧化钠、氧 化钙、氧化镁、氧化铁、氧化钛等 15俗名硅石石英水晶玛瑙刚玉 SiO2SiO2SiO 2SiO2Al 2 3 16主要化学成分O 合金生铁钢熟铁合金钢青铜黄铜白铜铝合金主要成分Fe 、 C Fe 、C Fe、 C Fe 、 C Cu 、 Sn Cu 、 Zn Cu 、 Ni、 Zn Al
硅化学方程式
反应物及反应条件化学反应方程式离子反应方程式 序 1 硅在氧气中加热Si + O2△ SiO2× 2硅和氟气反应Si + 2F 2 = SiF4× 3硅和氢氟酸反应Si + 4HF = SiF4+2H2× 4硅和氢氧化钠溶液反应Si + 2NaOH + H2O = Na2SiO3 +2H2↑Si + 2OH- + H2O = SiO32- +2H2↑ 5二氧化硅和氢氧化钠溶液反应SiO2 + 2NaOH = Na2SiO3 + H2O SiO2 + 2OH- = SiO32- + H2O 6二氧化硅和氢氟酸反应SiO2 + 4HF = SiF4↑ + 2H2O SiO2 + 4HF = SiF4↑ + 2H2O 7硅酸钠和稀盐酸反应Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓2H+ + SiO32- =H2SiO3↓ 8硅酸钠溶液通入二氧化碳Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓SiO32- + CO2 + H2O = CO32-+ H2SiO3↓9工业上用二氧化硅制取单质硅SiO2 + 2C 高温电炉Si + 2CO↑× 10碳酸钠和二氧化硅高温下反应SiO2 + Na2CO3高温 Na2SiO3+ CO2↑× 11碳酸钙和二氧化硅高温下反应SiO2 + CaCO3高温 CaSiO3+ CO2↑×硅酸盐产品生产条件生产设备生产原理化学成分 12水泥高温水泥回转窑3CaO·Si O2、3CaO·Al2O3、2CaO·Si O2 Na2O·CaO·6SiO2 13玻璃高温玻璃窑Na2CO3+SiO2=Na2SiO3+CO2↑ CaCO3+SiO2=CaSiO3+CO2↑ 14陶瓷高温窑炉氧化硅、氧化铝、、氧化钠、、氧化 镁、、氧化钛等 15俗名硅石石英水晶玛瑙刚玉 16主要化学成分SiO2SiO2SiO2SiO2Al2O3
碳和硅化学方程式总结
碳和硅化学方程式总结 1、一氧化碳与氧气2CO+O2=CO2(点燃) 2、一氧化碳与氧化铁3CO+Fe2O3=2Fe+3CO2↑ 3、二氧化碳与水CO2+H2o=H2CO3(这个都不会,服了) 4、二氧化碳与过氧化钠2Na2O2+2CO2=2Na2CO3+O2↑ 5、二氧化碳与少量的氢氧化钠CO2+NaOH=NaHCO3 6、二氧化碳与足量的石灰水Ca(OH)2+CO2=CaCO3↓+H2o 7、二氧化碳与少量的石灰水Ca(OH)2+2CO2=Ca(HCO3)2 8、二氧化碳与饱和的碳酸钠溶液Na2CO3+H2o+CO2=2NaHCO3 9、二氧化碳与碳酸钙和水CO2+CaCO3+H2o=Ca(HCO3)2 10、二氧化碳与碳CO2+C=2CO(高温) 氧族化学方程式总结 1、二氧化硫与水反应SO2+H2o=H2SO3 2、二氧化硫通入足量石灰水中SO2+Ca(OH)2=CaSO3+H2o 3、二氧化硫与足量氢氧化钠溶液SO2+2NaOH=Na2SO3+H2o 4、二氧化硫通入饱和碳酸氢钠溶液SO2+NaHCO3=NaHSO3+CO2 5、二氧化硫催化氧化2SO2+O2=2SO3(加热,催化剂) 6、二氧化硫通入氯水Cl2+SO2+2H2o=H2SO4+2HCl 7、浓硫酸与铜反应Cu+2H2SO4=CuSO4+SO2↑+2H2o 8、浓硫酸与炭反应C+2H2SO4=CO2↑+2SO2↑+2H2o 高二化学氮族化学方程式总结 1、氮气和氢气N2+3H2=2NH3(高温高压催化剂) 2、氮气和氧气N2+O2=2NO(放电) 3、氨的催化氧化4NH3+5O2=4NO+6H2O 4、氨气和氯化氢NH3+HCl=NH4Cl 5、氨气和水NH3+H2O=NH3·H2O(可逆) 6、氯化铁和氨水FeCl3+3NH3·H2O=Fe(OH)3(↓)+3NH4Cl(不太肯定是不是会发生氧化还原) 7、氯化铝和氨水AlCl3+3NH3·H2O=Al(OH)3(↓)+3NH4Cl 8、实验室制氨气Ca(OH)2 +2NH4Cl=CaCl2+2NH3(↑)+H2O 9、一氧化氮和氧气2NO+O2=2NO2 10、氯化铵受热分解NH4Cl=NH3↑+HCl↑ 11、碳酸氢铵受热分解NH4HCO3===NH3↑+CO2↑+H2O 12、浓硝酸长久放置4HNO3=4NO2↑+O2↑+H2o(光照或加热) 13、铜和浓硝酸:Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2o 14、铜和稀硝酸:3Cu+8HNO3=3Cu(NO3)3+2NO↑+4H2o 15、锌和浓硝酸:Zn+4HNO3=Zn(NO3)2+2NO2↑+2H2o 16、碳和浓硝酸:C+4HNO3=CO2↑+4NO2↑+2H2o 17、浓硝酸受热分解4HNO3=4NO2↑+O2↑+H2o(光照或加热) 高二化学第一章化学方程式总结 1、氮气与氢气的反应:N2+3H2 2NH3 2、氮气与氧气的反应:N2+O2 2NO 3、一氧化氮与氧气的反应:2NO+O2 =2NO2 4、磷与氧气的反应:4P+5O2 2P2O5
高一化学方程式——硅
4、硅及其化合物的转化关系 探 ⑧ CI 2+ 2NaOH = NaCI + NaCIO + H 20 ※-⑨2CI 2 + 2Ca (OH )2 = CaCI 2 + Ca (CI0)2 + 2HQ 工业制漂白粉用石灰乳 CI 2 + 20H —= CI — + CIO — + H 20 ※⑩Ca (CI0)2 + H 2O + CO 2 = CaC03 J+ 2HCI0 或 Ca (CI0)2+ 2HCI = CaCI 2 + 2HCI0 Ca 2+ + 2CI0 — + H 2O + C02= CaC03 J+ 2HCI0 或 CIO — + H + = HCIO 漂白粉的漂白原理 向漂白粉溶液中通入过量的 C02: Ca (CI0)2+ 2H 2O + 2CO 2 = Ca (HCO 3)2 + 2HCI0 ① Si + 02 Si02 ④ ■① 高温 ②Si02 + 2C Si + 2C0 t (制取粗硅) Si02 9 SiF 4 A ③ Si ⑩② ⑥ ⑦ 一 Na 2SiO 3 H 2SQ 3 ⑧ ⑤一:CaSiO 3 ※③Si02 + 4HF = SiF 4f + 2H 2O (刻蚀玻璃) ④Si + 4HF = SiF 4f+ 2H 2 t 高温 ⑤ Si02+ CaO CaSiO 3 ※⑥ Si02+ 2NaOH = Na 2SiO 3+ H 2O (Si02 是酸性氧化物) S 丿 Si02 + 20H _= SiO 32_ + H 2O (装NaOH 的试剂瓶不可以用玻璃塞 ) i02+ CaC03^^ CaSiO 3 + CO 21 高温 < Si02+ Na 2CO 3^= Na 2SiO 3+ CO 21 (Na 2SiO 3 是粘合剂) 探 ⑦Na 2SiO 3+ 2HCI = H 2SQ 3 J+ 2NaCI - SiO 32 + 2H = H 2SQ 3 J (白色胶状沉淀)(硅胶可以用作干燥剂) ※⑦ Na?SiO 3+H 2O +CO 2=H 2SiO 3 J+Na 2CO 3或 Na 2SiO 3+2H 2O +2C6=H 2SiO 3 J+2NaHCQ SiO 32_ + H 2O + CO 2=H 2SiO 3 J+ CO 32「或 SiO 32_ + 2H 2O + 2CO 2=H 2SiO 3 J + 2HCO 3_ (强酸制弱酸,Si02不能和H 20反应制硅酸) ⑧ H 2SiO 3+ 2NaOH = Na 2SiO 3+ 2H 2O △ ⑨ H 2SQ 3 H 2O + Si02 ※⑩ Si+NaOH + H 2O=Na 2SiO 3+H 2t -Ca (CIO ) 2 ⑨ H 2SiO 3+ 20H - = SiO 32_+ 2H 2O 5、氯及其化合物的转化关系 HCI 十 CI 2 ⑧「NaCIO ④ ① 2Fe + 3CI 2 点里2FeCl 3(棕黄色的烟) 点燃 CuCI 2 (棕黄色的烟) ③ HCIO -⑩ ⑥ ② C u + CI 2 ③ 2FeCI 3 + Cu = 2FeCI 2+ CuCI 2 2Fe 3+ + Cu = 2FeT + Cu 2+ 点燃 ④ H 2+ CI 2或光照2HCI (苍白色火焰,光照时发生爆炸) { CuCl 2 FeCb ⑤ Mn O 2+ 4HCI (浓)—Mn CI 2+ CI 21+ 2H 2O MnO 2 + 4H + 2CI = Mn 2 + CI 2 t+ 2H 2O 光昭 ※⑥CI 2+ H 20 = HCI + HCIO (次氯酸是弱酸) ※⑦2HCI0; 2HCI + O 2 t — 光昭 + — CI 2+ H 20 = H + CI + HCIO 2HCI0 壬 2H + 2CI + O 2 t
碳、硅及其化合物的化学方程式和离子方程式
碳硅及其化合物的化学方程式和离子方程式 碳及其化合物的化学方程式和离子方程式 氧化碳 △ 氧化碳通过灼热的氧化铜: CuO + CO Cu + CQ 高蛊 氧化碳和水蒸气反应: CO+ H 2O CQ + H 2 .氧化碳 点燃 镁在二氧化碳中燃烧: 2Mg + CQ 2MgO + C 、碳 1、 碳在少量的氧气中燃烧: 占愣! J b I'S .A W K. 2C + O 2 2CO 2、 碳在足量的氧气中燃烧: 占機 * u i^nw. C + O 2 CC 2 碳和硫蒸气高温反应: C + 2S ' CS 高温 碳和氧化铁在高温下反应: 2Fe s O 3+ 3C ' 2Fe + 3CQ f △ 碳粉与氧化铜共热: 2CuO + C 2Cu + CO 2 f 碳和水蒸气高温反应: C + H 2O ' CO + H 2 高温 碳和二氧化碳在高温下反应: C + CC 2 ' 2CO 8、 碳与浓硫酸共热: △ C + 2H 2SQ CQ f + 2SC 2 f + 2H 2O 碳与浓硝酸共热: △ C + 4HNO 3 CQ f + 4NO 2 f + 2H 2O 10、碳与稀硝酸共热: △ 3C + 4HNO 3 3CQ f + 4NO f + 2H 2O 11、工业上制备粗硅: SiQ + 2C Si+ 2CO f 12、工业上制备金刚砂: SiQ + 3C SiC + 2CO f 13、工业上制备碳化钙: CaO + 3C ' CaC 2+ CO f 2、 碳和二氧化碳在高温下反应: 高温 C + CO 2 2CO 1、 氧化碳在氧气中燃烧: 占弊 2CO + O 2 2CO 2 2、 氧化碳气体和氧化铁在高温下反应: 高温 Fe 2O 3+ 3CO ■ 2Fe + 3CQ 1、
硅的化学方程式
一分耕耘 一分收获 璇仔化学 1 4.1硅的化学方程式 1、写出硅与氢氟酸反应的化学方程式:Si +4HF===SiF 4↑+2H 2↑。 2、写出硅与氟气反应的化学方程式:Si +2F 2===SiF 4 3、写出硅与氢氧化钠溶液反应的化学方程式: Si+2NaOH+H 2O===Na 2SiO 3+2H 2↑ 4、写出硅与氯气反应的化学方程式Si +2Cl 2=====加热SiCl 4 5、写出硅与氧气反应的化学方程式: Si+O 2=====加热SiO 2 6、写出硅与碳单质反应的化学方程式: Si+C=====加热SiC 7、用碳还原二氧化硅制备粗硅,反应的化学方程式是 SiO 2+2C=====高温电炉 Si(粗)+2CO ↑ 8、粗硅提纯的化学方程式是: Si(粗)+2Cl 2=====加热SiCl 4 、 SiCl 4+2H 2=====高温Si(纯)+4HCl 9、写出二氧化硅和氢氟酸反应的化学方程式:SiO 2+4HF===SiF 4↑+2H 2O 10、写出二氧化硅与氢氧化钠反应的化学方程式:SiO 2+2NaOH==Na 2SiO 3+H 2O 11、写出二氧化硅与氧化钙反应的化学方程式:SiO 2+CaO=====高温CaSiO 3 12、写出二氧化硅制玻璃的反应方程式: SiO 2+Na 2CO 3=====高温Na 2SiO 3+CO 2↑ 、 SiO 2+CaCO 3=====高温 CaSiO 3+CO 2↑ 13、Na 2SiO 3溶液与盐酸反应其化学方程式为:Na 2SiO 3+2HCl===H 2SiO 3↓+2NaCl 其离子方程式是:SiO 32-+2H +===H 2SiO 3↓ 14、将CO 2通入Na 2SiO 3溶液中化学方程式为:Na 2SiO 3+CO 2+H 2O===H 2SiO 3↓+Na 2CO 3 其离子方程式是:SiO 32-+2H 2O+CO 2===H 2SiO 3↓+CO 32- 15、写出硅酸与氢氧化钠溶液反应的化学方程式:H 2SiO 3+2NaOH==Na 2SiO 3+2H 2O 16、写出硅酸受热分解的化学方程式:H 2SiO 3=====加热 SiO 2+H 2O
非金属方程式(二)氮、硅化学方程式
碳、硅及其化合物方程式 1.碳在氧气中燃烧化学方程式: 氧气不足: 氧气充足: 2.碳与SiO 2、CO 2、Fe 2O 3、H 2O 等氧化反应化学方程式: 2C+ SiO 2 2CO ↑+ Si C+CO 22CO 3C+Fe 2O 33CO ↑+2Fe C+H 2O(g) CO+H 2 注:高温下,以C 为还原剂还原氧化物一般生成CO 3.碳被浓硫酸、浓硝酸氧化化学方程式:. C+2H 2SO 4(浓)CO 2↑+2SO 2↑+2H 2O C+4HNO 3(浓)CO 2↑+4NO 2↑+2H 2O 4. 常温下,Si 化学性质不活泼,只能与F 2、氢氟酸、强碱(如NaOH)反应,写出化学方程式: Si +2F 2 =SiF 4 Si +2NaOH +H 2O =Na 2SiO 3+2H 2↑ Si +4HF =SiF 4↑+2H 2↑ 5.加热条件下,Si 与O 2、Cl 2反应化学方程式:Si +O 2 SiO 2 Si +2Cl 2 SiCl 4 6.高温条件下Si 与C 反应方程式:Si +C SiC(金刚砂) 7.高纯硅的制备化学方程式: ①制粗硅:SiO 2+2C Si+2CO↑ ②提纯(与Cl 2反应): 粗Si 中含碳,造成SiCl 4中含CCl 4等杂质,通过分馏得纯SiCl 4 ③还原(用H 2还原): 8.CO 2分别与H 2O 、NaOH 溶液、CaO 反应化学方程式: CO 2+H 2O H 2CO 3 CO 2+2NaOH=Na 2CO 3+H 2O CO 2+CaO=CaCO 3 9. SiO 2与H 2O 不反应,与NaOH 溶液、CaO 反应化学方程式: SiO 2+2NaOH=Na 2SiO 3+H 2O (装碱性溶液试剂瓶不能用玻璃塞,要用橡胶塞) 离子方程式:SiO 2+2OH -= SiO 32-+H 2O SiO 2+CaO CaSiO 3 10. SiO 2与氢氟酸反应方程式: SiO 2+4HF=SiF 4↑+2H 2O (刻蚀玻璃、装氢氟酸不能用玻璃瓶,一般用铅制容器或塑料瓶) 11. 制硅酸(水玻璃中加入盐酸或通入二氧化碳)化学方程式: Na 2SiO 3+2HCl=H 2SiO 3↓+2NaCl Na 2SiO 3+CO 2+H 2O=H 2SiO 3↓+Na 2CO 3 12.硅酸受热分解化学方程式:H 2SiO 3 SiO 2+H 2O 13. 制普通玻璃化学方程式(两个): Na 2CO 3+SiO 2Na 2SiO 3+CO 2↑ CaCO 3+SiO 2CaSiO 3+CO 2↑ 氮及其化合物方程式 1.氮气和氧气反应化学方程式: === 高温 === 高温 === 高温 === 高温
硅和氯的化学方程式(完整版)
硅和氯的化学方程式 (完整版) -CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN
非金属及其化合物的方程式集锦 一、硅及其化合物的相互转化 1、二氧化硅与氢氟酸反应:SiO2+ 4HF=SiF4↑+2 H2O 二氧化硅与氢氧化钠溶液反应:SiO2+ 2NaOH=Na2SiO3+ H2O 离子方程式:SiO2+ 2 OH-= SiO32-+H2O 二氧化硅与氧化钙高温反应:SiO2+ CaO高温CaSiO3 工业制玻璃原理: SiO2 + Na2CO3高温Na2SiO3+ CO2↑ SiO2 + CaCO3高温CaSiO3+ CO2↑ 2、硅酸钠溶液中通入二氧化碳:Na2SiO3+H2O+CO2= Na2CO3+ H2SiO3↓ 离子方程式:SiO32-+H2O+CO2= CO32-+ H2SiO3 ↓ 硅酸钠与盐酸反应:Na2SiO3 +2HCl = 2NaCl + H2SiO3 ↓ 离子方程式:SiO32-+2H+ = H2SiO3 ↓ 硅酸受热分解:H2SiO3△ SiO2+ H2O 3、粗硅的制取:SiO2 + 2C 高温 S i + 2CO↑ 粗硅的提纯:Si+2Cl2 △SiCl4 SiCl4+2H2 △Si+4HCl 4、硅单质与O2 、F2、HF、NaOH溶液:Si + 2F2 = SiF4 Si + 4HF = SiF4 + 2H2↑ Si + 2NaOH + H2O = Na2SiO3 +2H2↑ Si +O2 点燃SiO2 二、氯及其化合物的相互转化 1、氯气与金属反应:2Na + Cl2 点燃2NaCl(黄色火焰,产生白烟) Cu + Cl2 点燃CuCl2(产生棕黄色烟) 2Fe + 3Cl2 点燃2FeCl3(产生棕黄色烟) 2.氯气与非金属单质反应:H2+ Cl2 点燃2HCl(安静燃烧,苍白色火焰,瓶口 有白雾产生,并且产生有刺激性气味的气体) H2+ Cl2 光照2HCl(发生爆炸,瓶口有白雾产生) 3Cl2+2P点燃2PCl3(小液滴) PCl3+Cl2点燃 PCl5(固体小颗粒) 3.氯气与水反应:Cl2 + H2O = HCl + HClO 离子方程式:Cl2 + H2O = H++Cl-+HClO 4.HClO光照下分解:2HClO光照2HCl+O2↑ 5.制漂白液(或氯气尾气处理):Cl2 + 2NaOH = NaCl + NaClO + H2O 离子方程式:Cl2 + 2OH- = Cl- + ClO- + H2O 6.制漂白粉(或漂粉精):2Cl2 + 2Ca(OH)2 = CaCl 2+ Ca(ClO)2 +2 H2O 7.漂白粉的使用原理:Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO 离子方程式: Ca2++2ClO-+H2O+CO2=CaCO+ 2HClO 漂白粉长期置露在空气中失效:Ca(ClO)2 + CO2 + H2O = CaCO3↓+ 2HClO , 2HClO光照2HCl + O2↑ 8.实验室制氯气:4HCl(浓)+MnO2△ MnCl2+Cl2↑+2H2O 离子方程式:4H++2Cl-+MnO2△ Mn2++Cl2↑+2H2O 9. 氯气与还原性物质反应 a. Cl2+2NaBr=2NaCl+Br2 离子方程式:Cl2+2Br-=2Cl-+Br2 2
硅的化学方程式
一分耕耘一分收获璇仔化学 4.1 硅的化学方程式 1、写出硅与氢氟酸反应的化学方程式:Si+ 4HF===SiF 4↑+ 2H 2↑。 2、写出硅与氟气反应的化学方程式:Si+ 2F2===SiF4 3、写出硅与氢氧化钠溶液反应的化学方程式:Si+2NaOH+H 2O===Na 2SiO3 +2H 2↑ 4、写出硅与氯气反应的化学方程式 加热 Si+ 2Cl 2=====SiCl 4 5、写出硅与氧气反应的化学方程式: 加热 Si+O 2=====SiO2 6、写出硅与碳单质反应的化学方程式: 加热 Si+C=====SiC 高温 7、用碳还原二氧化硅制备粗硅,反应的化学方程式是SiO 2+ 2C=====电炉Si(粗 )+ 2CO ↑ 8、粗硅提纯的化学方程式是: 加热高温 Si(粗 )+ 2Cl 2=====SiCl 4、SiCl 4+ 2H 2=====Si(纯 )+ 4HCl 9、写出二氧化硅和氢氟酸反应的化学方程式:SiO2+4HF===SiF 4↑ +2H 2 O 10、写出二氧化硅与氢氧化钠反应的化学方程式:SiO2+2NaOH==Na 2 SiO3+H 2O 11、写出二氧化硅与氧化钙反应的化学方程式: 高温 SiO2+CaO===== CaSiO 3 12、写出二氧化硅制玻璃的反应方程式: 高温高温 SiO2 +Na 2CO 3=====Na 2SiO3+CO 2↑、SiO 2+CaCO 3=====CaSiO 3+CO 2↑ 13、Na2SiO3溶液与盐酸反应其化学方程式为:Na 2SiO 3+ 2HCl===H 2SiO3↓+ 2NaCl 其离子方程式是: SiO 32-+ 2H + ===H 2SiO3↓ 14、将 CO2通入 Na2SiO 3溶液中化学方程式为:Na2SiO3+ CO 2+ H 2O===H 2SiO 3↓+ Na2CO 3其离子方程式是: SiO 32-+ 2H 2 O+CO 2===H 2SiO3↓ +CO32- 15、写出硅酸与氢氧化钠溶液反应的化学方程式:H 2SiO 3+2NaOH==Na 2SiO 3+2H 2O 16、写出硅酸受热分解的化学方程式: 加热 H 2SiO3=====SiO 2+H 2O 1
硅的化学方程式[精.选]
一分耕耘 一分收获 璇仔化学 word. 4.1硅的化学方程式 1、写出硅与氢氟酸反应的化学方程式:Si +4HF===SiF 4↑+2H 2↑。 2、写出硅与氟气反应的化学方程式:Si +2F 2===SiF 4 3、写出硅与氢氧化钠溶液反应的化学方程式: Si+2NaOH+H 2O===Na 2SiO 3+2H 2↑ 4、写出硅与氯气反应的化学方程式Si +2Cl 2=====加热SiCl 4 5、写出硅与氧气反应的化学方程式: Si+O 2=====加热SiO 2 6、写出硅与碳单质反应的化学方程式: Si+C=====加热SiC 7、用碳还原二氧化硅制备粗硅,反应的化学方程式是 SiO 2+2C=====高温电炉 Si(粗)+2CO ↑ 8、粗硅提纯的化学方程式是: Si(粗)+2Cl 2=====加热SiCl 4 、 SiCl 4+2H 2=====高温Si(纯)+4HCl 9、写出二氧化硅和氢氟酸反应的化学方程式:SiO 2+4HF===SiF 4↑+2H 2O 10、写出二氧化硅与氢氧化钠反应的化学方程式:SiO 2+2NaOH==Na 2SiO 3+H 2O 11、写出二氧化硅与氧化钙反应的化学方程式:SiO 2+CaO=====高温CaSiO 3 12、写出二氧化硅制玻璃的反应方程式: SiO 2+Na 2CO 3=====高温Na 2SiO 3+CO 2↑ 、 SiO 2+CaCO 3=====高温 CaSiO 3+CO 2↑ 13、Na 2SiO 3溶液与盐酸反应其化学方程式为:Na 2SiO 3+2HCl===H 2SiO 3↓+2NaCl 其离子方程式是:SiO 32-+2H +===H 2SiO 3↓ 14、将CO 2通入Na 2SiO 3溶液中化学方程式为:Na 2SiO 3+CO 2+H 2O===H 2SiO 3↓+Na 2CO 3 其离子方程式是:SiO 32-+2H 2O+CO 2===H 2SiO 3↓+CO 32- 15、写出硅酸与氢氧化钠溶液反应的化学方程式:H 2SiO 3+2NaOH==Na 2SiO 3+2H 2O 16、写出硅酸受热分解的化学方程式:H 2SiO 3=====加热SiO 2+H 2O 最新文件 仅供参考 已改成word 文本 。 方便更改
硅化学方程式
硅及其化合物 序 反应物及反应条件化学反应方程式离子反应方程式 1 硅在氧气中加热Si + O 2△ SiO 2 × 2 硅和氟气反应Si + 2F 2 = SiF 4 × 3 硅和氢氟酸反应Si + 4HF = SiF 4+2H 2 × 4 硅和氢氧化钠溶液反应Si + 2NaOH + H 2O = Na 2 SiO 3 +2H 2 ↑Si + 2OH-+ H 2 O = SiO 3 2-+2H 2 ↑ 5 二氧化硅和氢氧化钠溶 液反应SiO 2 + 2NaOH = Na 2 SiO 3 + H 2 O SiO 2 + 2OH- = SiO 3 2- + H 2 O 6 二氧化硅和氢氟酸反应SiO 2 + 4HF = SiF 4 ↑ + 2H 2 O SiO 2 + 4HF = SiF 4 ↑ + 2H 2 O 7 硅酸钠和稀盐酸反应Na 2SiO 3 + 2HCl = 2NaCl + H 2 SiO 3 ↓ 2H+ + SiO 3 2- =H 2 SiO 3 ↓ 8 硅酸钠溶液通入二氧化 碳Na 2 SiO 3 + CO 2 + H 2 O = Na 2 CO 3 + H 2 SiO 3 ↓ SiO 3 2- + CO 2 + H 2 O = CO 3 2-+ H 2 SiO 3 ↓ 9 工业上用二氧化硅制取 单质硅SiO 2 + 2C 高温电炉Si + 2CO↑× 10 碳酸钠和二氧化硅高温 下反应SiO 2 + Na 2 CO 3高温 Na 2 SiO 3 + CO 2 ↑× 11 碳酸钙和二氧化硅高温 下反应SiO 2 + CaCO 3高温 CaSiO 3 + CO 2 ↑× 硅酸盐产 品 生产条件生产设备生产原理化学成分 12 水泥高温水泥回转窑3CaO·SiO2、3CaO·Al2O3、 2CaO·SiO2 13 玻璃高温玻璃窑Na2CO3+SiO2=Na2SiO3+CO2↑ CaCO3+SiO2=CaSiO3+CO2↑Na 2 O·CaO·6SiO 2 14 陶瓷高温窑炉氧化硅、氧化铝、、氧化钠、、 氧化镁、、氧化钛等 15 俗名硅石石英水晶玛瑙刚玉 16 主要化学 成分SiO 2 SiO 2 SiO 2 SiO 2 Al 2 O 3 合金生铁钢熟铁合金钢青铜黄铜白铜铝合金主要成分Fe、C Fe、C Fe、C Fe、C Cu、Sn Cu、Zn Cu、Ni、Zn Al 合金的特 点 良好的物理、化学和机械性能;硬度大、熔点低
硅和硅的化合物方程式
硅和硅的化合物 1、硅和氢氧化钠溶液反应的化学方程式: Si + 2NaOH + H2O = Na2SiO3 + 2H2↑ 2、硅和氢氧化钠溶液反应的离子方程式: Si +2OH—+ H2O= SiO32—+ 2H2↑ 3、硅和氢氟酸反应的化学方程式: Si + 4HF= SiF4↑ + 2H2↑ 4、保存氢氧化钠溶液的试剂瓶不用玻璃瓶的原因: SiO2 + 2NaOH = Na2SiO3 + H2O 5、用氢氟酸刻蚀玻璃的原理: SiO2 + 4HF= SiF4↑+ 2H2O 6、制玻璃的反应原理: SiO2 + Na2CO3 = Na2SiO3 + CO2↑(高温条件自己写) SiO2 +CaCO3 = CaSiO3 + CO2↑(高温条件自己写) 7、制粗硅的反应原理: 2C + SiO2 = Si + 2 CO↑(高温条件自己写) 8、制硅酸的反应方程式:(写三个反应) Na2SiO3 + 2HCl= 2NaCl + H2SiO3(胶体) Na2SiO3 + CO2(少)+H2O = Na2CO3 + H2SiO3(胶体) Na2SiO3 + 2CO2(多)+2H2O = 2NaHCO3 + H2SiO3(胶体) 9、二氧化硅和氧化钙反应: SiO2 + CaO = CaSiO3 (高温条件自己写) 10、二氧化硅在自然界的存在形态有结晶型和无定形,统称为硅石。说出二氧化硅的一种用途制光导纤维。 11、陶瓷的原料黏土,制玻璃的原料是石灰石、纯碱和石英,制水泥的原料以黏土和石灰石为主要原料,在加入适量的石膏12、说出硅的两点用途:计算机芯片和硅太阳能电池 硅酸的主要用途制硅胶干燥剂硅酸钠的主要用途木材防火剂
硅及其化合物知识总结
硅及其化合物知识总结 1.硅单质(Si) (1)存在:硅是一种亲氧元素,在自然界中以化合态存在,在地壳中的含量仅次于氧。(2)物理性质:晶体硅是灰黑色固体,硬度大,熔、沸点高,具有金属光泽。 (3)化学性质:常温下能与F 2、HF 、NaOH 反应;加热时能与H 2化合生成不稳定的氢化物SiH 4,还能与Cl 2、O 2化合分别生成SiCl 4、SiO 2。涉及的化学方程式如下: 2:Si +O 2=====△ SiO 2 2:Si +2F 2===SiF 4 2:Si +2Cl 2=====△SiCl 4 ②与氢氟酸反应:Si +4HF===SiF 4↑+2H 2↑。 ③与NaOH 溶液反应:Si +2NaOH +H 2O===Na 2SiO 3+2H 2↑(4)用途:①良好的半导体材料;②太阳能电池;③计算机芯片。(5)高纯硅的制备 ①SiO 2+2C=====高温 Si(粗)+2CO ↑(1800~2000℃)②③ 2.二氧化硅(SiO 2)(1)存在与形态 SiO 2的存在形态有结晶形和无定形两大类。 自然界中的二氧化硅,存在于沙子、水晶、玛瑙,石英等中。(2)结构 SiO 2是由Si 原子和O 原子按个数比1∶2直接构成的立体网状结构的晶体。(3) 二氧化硅与二氧化碳都是酸性氧化物,二者的性质与用途比较 性质与用途二氧化硅二氧化碳物理性质硬度大,熔、沸点高,不溶于水 熔、沸点低,可溶于水化学性质 与水反应不反应 CO 2+H 2O H 2CO 3 与酸反应(只与HF 反应)氢氟酸用于刻蚀玻璃:SiO 2+4HF===SiF 4↑+2H 2O 不反应 与碱反应(如NaOH)SiO 2+2NaOH===Na 2SiO 3+H 2O(盛碱液的试剂瓶不能用玻璃塞) CO 2+2NaOH===Na 2CO 3+H 2O 或CO 2+NaOH===NaHCO 3与盐反应(如Na 2CO 3)SiO 2+Na 2CO 3=====高温 Na 2SiO 3+CO 2↑CO 2+Na 2CO 3+H 2O===2NaHCO 3与碱性氧化物反应与CaO 反应:SiO 2+CaO=====高温 CaSiO 3 与Na 2O 反应:CO 2+Na 2O===Na 2CO 3与碳反应 2C +SiO 2=====高温 Si +2CO ↑C +CO 2=====高温 2CO 主要用途 制光学仪器、石英玻璃;水晶和玛瑙可制作饰品;常用来制造通讯材料——光导纤维;以SiO 2为主要成分的沙子是基本的建筑材料 化工原料、灭火剂;干冰用作制冷剂,人工降雨
