含铬废水的处理方法

含铬废水的处理方法
(焦翠华山东师范大学济南 250358)
摘要:简述了含铬废水的来源、性质及其危害,对含铅废水处理的工艺方法包括吸附法、苹取法及液膜法等物理方法。药剂还原法和沉淀法、铁屑铁粉及铁氧体处理等化学方法和生物法进行了比较分析,考察了上述方法的优缺点,介绍了含铬废水的处理研究新动向并对其应用前景作出了展望。并对它们的原理、工艺流程、优缺点等进行了详细评述。
关键词:含铬废水;处理方法
1 含铬废水的来源、性质及危害
铬及其化台物在工业上应用广泛,冶金、化工、矿物工程、电镀、制铬、颜料、制药、轻工纺织、铬盐及铬化物的生产等一系列行业,都会产生大量的含铬废水。铬的化合物以二价(如CrO)、三价(如Cr2O3)和六价(如CrO3)的形式存在,但以三价和六价的化合物最为常见。其毒性则以六价铬最强,约为三价铬的一百倍,三价铬次之,而二价铬和铬本身毒性很小或无毒性。铬化物可以通过消化道、呼吸道、皮肤和粘膜侵人人体,主要积聚在肝、肾、内分泌系统和肺部。毒理作用是影响体内物质氧化、还原和水解过程,与核酸、核蛋白结合影响组织中的磷含量。铬化合物具有致癌作用。水中的铬可在鱼的骨骼中积累,此时Cr3+比Cr6+的毒性还大。浓度为3.0 mg/ L即对淡水鱼有致死作用;浓度为0.01mg/L,便可使一些水生生物致死,使水体的自净作用受到抑制[1]。若用含铬的污水灌溉农田,铬便在植物体内积聚,土壤中有机质的消化作用受到抑制,造成农业减产。因此,各国对排放的废水、渔业水域水质、农田灌溉水质、地面水以及饮用水的铬含量,均有严格规定。我国已把六价铬规定为实施总量控制的指标之一,并规定工业排放的废水中六价铬最高浓度为0.5 mg/L,总铬的最高浓度为1.5 mg/L,且不得用稀释法代替必要的处理;生活饮用水中铬含量不得超过0.05mg/L[2]。
2 化学法
2.1 药剂还原沉淀法
还原沉淀法是目前应用较为广泛的含铬废水处理方法。基本原理是在酸性条件下向废水中加入还原剂,将Cr6+还原成Cr3+,然后再加入石灰或氢氧化钠,使其在碱性条件下生成氢氧化铬沉淀,从而去除铬离子。可作为还原剂的有:SO2、FeSO4、Na2SO3、NaHSO3、Fe等。还原沉淀法具有一次性投资小、运行费用低、处理效果好、操作管理简便的优点,因而得到广泛应用,但在采用此方法时,还原剂的选择是至关重要的一个问题[3]。
2.1.1 NaHSO3还原法
(1)基本原理: 在酸性条件下,向含铬废水投加还原剂NaHSO3,使水中Cr6+还原为Cr3+,调整废水pH 至碱性,使Cr3+生成难溶的Cr(0H)3而除去。化学反应为:
2H2Cr2O7 + 6NaHSO3 + 3H2SO4→ 2Cr2(SO4)3 + 3Na2SO4 + 8H20
Cr2(SO4)3 + 6NaOH →2Cr(OH)3↓ + 3Na2S04
(2)技术条件
①Cr6+的还原
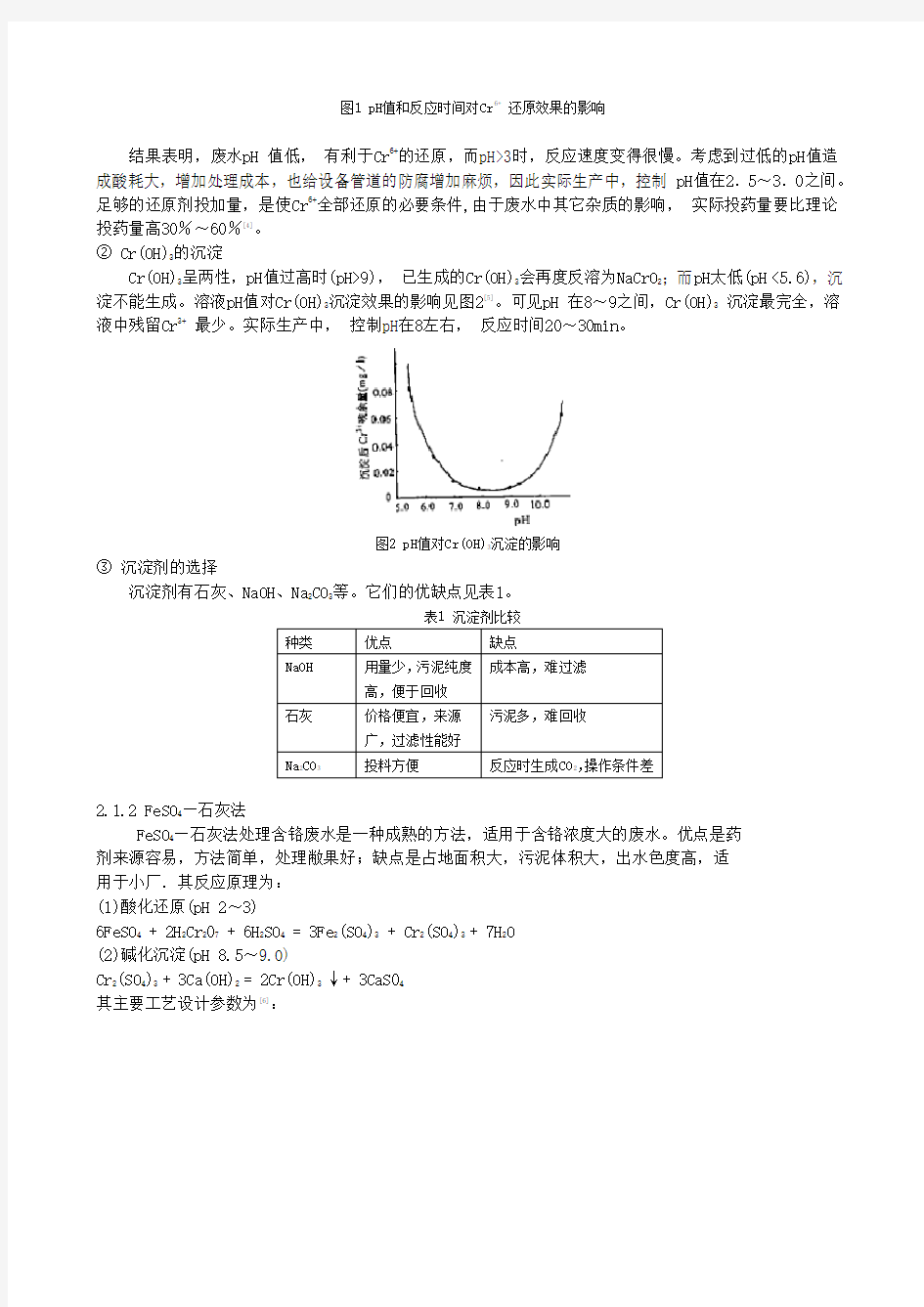
Cr6+的还原率取决于反应时间,废水pH值,还原剂投加量等因素。废水pH值和反应时间对Cr6+还原效果的影响见图1[4]。
图1 pH值和反应时间对Cr6+还原效果的影响
结果表明,废水pH 值低,有利于Cr6+的还原,而pH>3时,反应速度变得很慢。考虑到过低的pH值造成酸耗大,增加处理成本,也给设备管道的防腐增加麻烦,因此实际生产中,控制pH值在2.5~3.0之间。足够的还原剂投加量,是使Cr6+全部还原的必要条件,由于废水中其它杂质的影响,实际投药量要比理论投药量高30%~60%[4]。
② Cr(OH)3的沉淀
Cr(OH)3呈两性,pH值过高时(pH>9),已生成的Cr(OH)3会再度反溶为NaCrO2;而pH太低(pH <5.6),沉淀不能生成。溶液pH值对Cr(OH)3沉淀效果的影响见图2[5]。可见pH 在8~9之间,Cr(OH)3沉淀最完全,溶液中残留Cr3+最少。实际生产中,控制pH在8左右,反应时间20~30min。
图2 pH值对Cr(OH)3沉淀的影响
③沉淀剂的选择
沉淀剂有石灰、NaOH、Na2CO3等。它们的优缺点见表1。
表1 沉淀剂比较
2.1.2 FeSO4—石灰法
FeSO4—石灰法处理含铬废水是一种成熟的方法,适用于含铬浓度大的废水。优点是药
剂来源容易,方法简单,处理敝果好;缺点是占地面积大,污泥体积大,出水色度高,适
用于小厂.其反应原理为:
(1)酸化还原(pH 2~3)
6FeSO4 + 2H2Cr207 + 6H2SO4 = 3Fe2(SO4)3 + Cr2(SO4)3 + 7H2O
(2)碱化沉淀(pH 8.5~9.O)
Cr2(SO4)3 + 3Ca(OH)2 = 2Cr(OH)3 ↓+ 3CaS04
其主要工艺设计参数为[6]:
a.废水含六价铬5O~100 mg/L;
b.还原剂用量Cr6+:FeSO4·7H2O=1:25~1:30;
c.反应时问不小于30 min。
2.1.3 SO2还原法
二氧化硫还原法设备简单、效果较好,处理后六价铬含量可达到0.l mg/L 。但二氧化硫是有害气体,对操作人员有影响,处理池需用通风没备,另外对设备腐蚀性较大,不能直接回收铬酸。烟道气中的二氧化硫处理含铬(VI)废水,充分利用资源,以废治废,节约了处理成本,但也同样存在以上的问题。其反应原理为:
3SO2 + Cr2O72- + 2H+ = Cr3+ + 3SO42- + H20 Cr3+ + 30H- = Cr(OH)3↓
工艺流程图如图3所示:
图3 SO2还原法工艺流程图
2.2 铁氧体法
铁氧体法实际上是硫酸亚铁法的发展,向含铬废水中投加废铁粉或硫酸亚铁时,Cr6+可被还原成Cr3+。再加热、加碱、通过空气搅拌,便成为铁氧体的组成部分,Cr3+转化成类似尖晶石结构的铁氧体晶体而沉淀。铁氧体是指具有铁离子、氧离子及其他金属离子所组成的氧化物。其具体反应为:
Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H20
Fe2+ + Fe3+ + Cr3+ + O2 = Fe3+[Fe2+ Cr x3+ Fe2+1-x]O4
铁氧体法不仅具有还原法的一般优点,还有其特点,即铬污泥可制作磁体和半导体,这样不但使铬得以回收利用,又减少了二次污染的发生,出水水质好,能达到排放标准[7]。但是,铁氧体法也有试剂投量大,能耗较高,不能单独回收有用金属,处理成本较高的缺点[8]。
2.3 铁屑铁粉处理法
铁屑铁粉由于原料易得,价格便宜,处理含铬(VI)等重金属废水效果较好,但该法要消耗较多的酸(电镀厂可用车间生产的废酸),同时污泥量较大,铁屑处理含铬废水有多种作用:(1)还原作用,由于铁屑中含有杂质,它们与铁的电位不同,铁作为阳极溶解,给出电子成为二价铁离子,电子转移到阴极被Cr2O72-和H+接受成为Cr3+和H2,阴极生成的二价铁离子叉将Cr2O72-还原;(2)置换作用,废水中电位比铁正的金属离子与金属铁屑粉末发生置换作用;(3)凝聚作用,反应生成的氢氧化铁本身就是一种凝聚剂,有利于最后氢氧化铬等的沉降;(4)中和作用,由于反应中要消耗太量的酸,随着反应进行PH值不断升高,使Fe呈氢氧化铁析出;(5)吸附作用,经X射线微量分析,在铁粉表面可见到吸附的金属,因此认为铁粉具有吸附作用。
2.4 钡盐法
利用溶解积原理,向含铬废水中投加溶度积比铬酸钡大的钡盐或钡的易溶化合物,使铬酸根与钡离子形成溶度积很小的铬酸钡沉淀而将铬酸根除去。废水中残余Ba2+再通过石膏过滤,形成硫酸钡沉淀,再利用微孔过滤器分离沉淀物[9]。反应式是:
BaCO3 + H2Cr04→ BaCrO4↓+ CO2 + H2O
Ba2+ +CaSO4→ BaSO4↓ + Ca2+
钡盐法优点是工艺简单,效果好,处理后的水可用于电镀车间水洗工序,还可回收铬酸,复生BaCO3;其缺点是过滤用的微孔塑料管加工比较复杂,容易阻塞,清洗不便,处理工艺流程较为复杂。
2.5 电解还原法
电解还原法是铁阳极在直流电作用下,不断溶解产生亚铁离子,在酸性条件下,将Cr6+还原为Cr3+。主要反应为[10]:
阳极反应:
Fe - 2e-→ Fe2+ (1)
Cr2072- + 6Fe2+ + 14H+ → 2Cr3+ + 6Fe3+ + 7H20 (2)
CrO42- + 3Fe2+ + 8H+→ Cr3+ + 3Fe3+ + 4H20 (3)
阴极反应:
2H+ + 2e-→ H2↑(4)
由于废水中的氢离子不断减少,因此pH值将不断上升,Cr3+在pH值为7~10.5之间时同氢氧根离子结合成Cr(OH)3沉淀,从而抑制了pH 值上升,并使废水中的铬元素分离出来。Fe2+ 除了还原作用外,也有使Cr(OH)3凝聚和吸附的作用,提高了固液分离速率。
废水pH值、极板间距、投加食盐量、反应温度与时间、极板间电压等,都是影响该法处理效果的重要因素,在工程中必须予以考虑。反应以普通钢板做阴阳极,板间距越小,处理废水所耗电能越少。在废水中投加食盐可以增加电导率,减少电耗。但当采用小极距(20mm以下),处理低浓度废水时(含铬50 mg/L 以下),可以不加食盐。
用电解法处理含铬废水,优点是效果稳定可靠,操作管理简单,设备占地面积小,废水中的重金属离子也能通过电解有所降低。缺点是耗电量较大,消耗钢板,运行费用较高,沉渣综合利用等问题有待进一步解决。
3 物理化学法
3.1 膜分离法
膜分离法以选择性透过膜为分离介质,当膜两侧存在某种推动力(如压力差、浓度差、电位差等)时,原料侧组分选择性透过膜,以达到分离、除去有害组分的目的。目前,工业上应用的较为成熟的工艺为电渗析、反渗透、超滤、液膜。别的方法如膜生物反应器、微滤等尚处于基础理论研究阶段,尚未进行工业应用。
电渗析法是在直流电场作用下,以电位差为推动力,利用离子交换膜的选择透过性,从而使废水得到净化。反渗透法是在一定的外加压力下,通过溶剂的扩散,从而实现分离。超滤法也是在静压差推动下进行溶质分离的膜过程。液膜包括无载体液膜、有载体液膜、含浸型液膜等。液膜分散于电镀废水时,流动载体在膜外相界面有选择地络合重金属离子,然后在液膜内扩散,在膜内界面上解络,重金属离子进人膜内相得到富集,流动载体返回膜外相界面,如此过程不断进行,废水得到净化。
膜分离法的优点:能量转化率高,装置简单,操作容易,易控制、分离效率高。但投资大,运行费用高,薄膜的寿命短。主要用于回收附加值高的物质,如金等。
3.2 离子交换法
离子交换法是借助于离子交换剂上的离子和水中的离子进行交换反应除去水中有害离子。目前在水处理中广泛使用的是离子交换树脂。对含铬废水先调pH值,沉淀一部分Cr3+后再行处理。将废水通过H型阳离子交换树脂层,使废水中的阳离子交换成H+而变成相应的酸,然后再通过OH型阴离子交换成OH-,与留下的H+结合生成水。吸附饱和后的离子交换树脂,用NaOH进行再生。
其反应为:
用阴离子交换树脂去除Cr2072-或Cr042-:
2ROH + Cr042-→ R2Cr04 + 2OH-, 2ROH + Cr2072- → R2Cr207 + 2OH-.
树脂失效后,用NaOH将树脂再生:
R2Cr207 + 4NaOH → ROH + 2Na2Cr04 + H2O.
阴树脂的洗脱液再经一级H型阳离子交换进行脱钠,即得铬酸:
4ROH + 2Na2Cr04 → RNa + H2Cr2O7 + H2O.
离子交换法的优点是处理效果好,废水可回用,并可回收铬酸。尤其适用于处理污染物浓度低、水量小、出水要求高的废水。缺点是工艺较为复杂,且使用的树脂不同,工艺也不同;一次投资较大,占地面积大,运行费用高,材料成本高,因此对于水量很大的工业废水,该法在经济上不适用。
3.3 吸附法
吸附剂由于其巨大的比表面积和表面能,能够吸附并固定住废水中的金属离子。吸附剂具有较强的对
水量及水质变化的抗冲击能力,且吸附后可以再生,不易造成二次污染,来源广泛,价格便宜,因此具有较好的经济性。根据水质及污染物的具体情况,恰当合理的选择吸附剂,可以取得很好的净化效果。国内也有人采用吸附剂淀粉渣铁处理含铬废水,通过实验证明它具有良好的吸附性能
