2019-2020学年江苏省南通市如皋市九年级(上)期末化学试卷

汇百教育汇集千万智慧,成就百强人生2019-2020学年江苏省南通市如皋市
九年级(上)期末化学试卷
选用的相对原子质量:Fe—56;N—14;S—32;C—12;O—16;H—1;Na—23一、选择题
1.“如皋如歌,长来长寿”。为了使如皋天更蓝、水更清、景更美,下列做法应禁止的是()
A.增高烟囱排放废气B.分类回收垃圾C.工业废水达标排放D.洒水车喷水降尘
2.下列有关物质的分类说法正确的是()
A.钢属于纯净物B.纯碱属于碱C.干冰属于氧化物D.氯酸钾属于酸3.如图是有关实验室制取氢气的部分实验操作,其中错误的是()
A.连接仪器B.加入锌粒C.倾倒稀硫酸D.收集氢气
4.下列说法正确的是()
A.大多数金属元素在自然界中以单质形式存在
B.水中Ca2+、Mg2+增多会导致水体富营养化
C.洗涤剂洗油污是利用洗涤剂能溶解植物油形成溶液的原理
D.物体的热胀冷缩现象常常是由于构成物质的粒子间间隙发生改变
5.下列有关物质的性质与用途具有对应关系的是()
A.浓盐酸具有挥发性,可用于除铁锈
B.浓硫酸具有吸水性,可用作气体干燥剂
C.石墨具有良好的导电性,可用作铅笔芯
D.稀有气体化学性质稳定,可制多种用途的电光源
6.KNO3、NaNO3、NaCl三种物质的溶解度曲线如图所示,
下列说法正确的是()
A.NaNO3的溶解度大于KNO3的溶解度
B.将KNO3饱和溶液升温,溶液中KNO3的质量分数不变
C.40℃时,将60g NaNO3加入50g水中,可得到110g溶液
D.从NaCl溶液中获取NaCl晶体时,一般采用降温结晶的方法
汇百教育
汇集千万智慧,成就百强人生
500℃~600℃
7.向盛有硝酸锌和硝酸银混合液的烧杯中加入一定量的铁粉,反应停止后过滤,向滤渣中加入稀盐酸,有气泡产生。下列说法正确的是()
A.金属的活动性:Fe>Zn>Ag
B.滤液中一定含有硝酸亚铁,一定没有硝酸银和硝酸锌
C.滤渣中一定含有银和铁,一定没有锌
D.反应后滤液的质量大于反应前溶液的质量
8.下列物质提纯所用的实验方法正确的是()
选项物质(括号内为杂质)实验方法
A H2(HCl)通过足量的氢氧化钠溶液
B MgO(Mg)加入足量的稀盐酸
C H2O2(H2O)加入二氧化锰
D NaCl溶液(Na2CO3)加入适量的稀硫酸
9.下列实验方案,能达到相应实验目的的是()
A B C D A.图1:检验二氧化碳是否集满
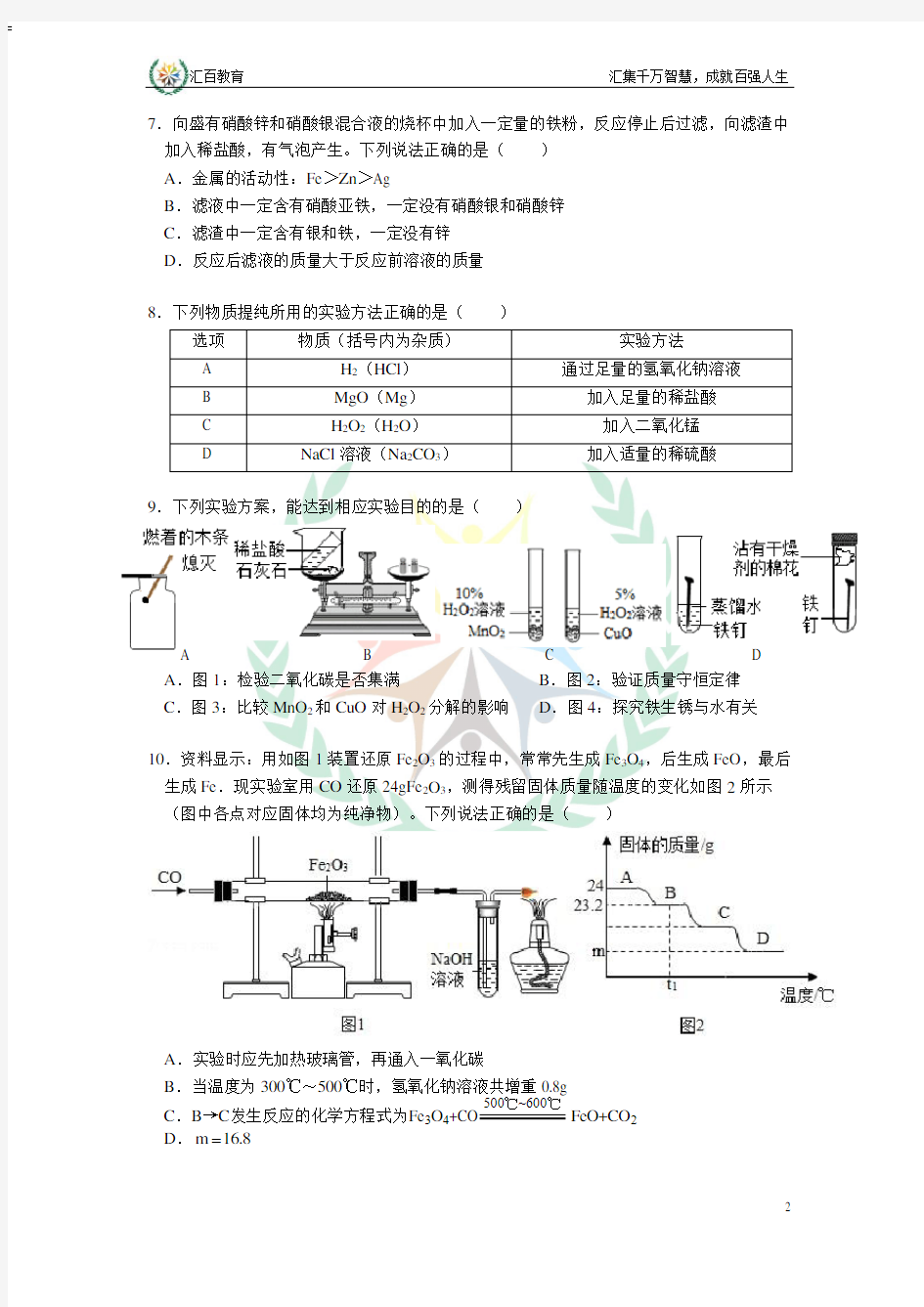
B.图2:验证质量守恒定律C.图3:比较MnO2和CuO对H2O2分解的影响D.图4:探究铁生锈与水有关10.资料显示:用如图1装置还原Fe2O3的过程中,常常先生成Fe3O4,后生成FeO,最后生成Fe.现实验室用CO还原24gFe2O3,测得残留固体质量随温度的变化如图2所示(图中各点对应固体均为纯净物)。下列说法正确的是()
A.实验时应先加热玻璃管,再通入一氧化碳
B.当温度为300℃~500℃时,氢氧化钠溶液共增重0.8g
C.B→C发生反应的化学方程式为Fe3O4+CO FeO+CO2
D.m16.8
二、非选择题
11.了解物质的组成和结构,有利于理解和认识化学问题。
(1)如图1是元素周期表中第三周期部分元素原子的结构示意图如图。 第三周期
11 Na
12 Mg
13 Al
……
18 Ar
子为________(填离子符号)。
②镁原子的最外层电子数(x )为________,氯化镁的化学式为________。
③分析图1可知:Na 、Mg 、Al 、Ar 等元素均位于第三周期的原因是_______________。 (2)在催化剂作用下,二氧化碳能高效转化为甲醇(CH 3OH ),相关反应如图2所 示,其中“
”、“
”和“”表示不同的原子。
①保持乙化学性质的最小粒子是________(填粒子名称)。
②写出图2所示反应的化学方程式:________________________________。
12.工业上利用生产钛白的副产品硫酸亚铁制备还原铁粉的流程如图:
(1)写出“转化”过程中所发生的复分解反应的化学方程式______________________。 (2)实验室常用________
操作进行“沉淀分离”;溶液中的溶质用作化肥时不可与碱性
物质混合使用的原因是________________________。
(3)“洗涤”干净的标志:取最后一次洗涤液,先加入一定量稀盐酸,再滴加______ (写化学式)溶液,无白色沉淀生成。
(4)“干燥”过程中有少量的FeCO 3转化为FeOOH ,FeOOH 中铁元素的化合价是 ________,FeCO 3和FeOOH 在空气中“焙烧”转化为Fe 2O 3,Fe 2O 3在高温条件下与C 反应生成还原铁粉,该反应利用了碳的________性。
(5)制得的还原铁粉中还含有Fe 2C ,Fe 2C 中铁元素与碳元素的质量比为________(用最简整数比表示)。
C a CO3
H2CO3Ⅰ
Ⅲ
CO2C6H12O6
Ⅱ
13.“氧循环”、“水循环”和“碳循环”是自然界中的三大循环。
甲乙丙
(1)氧气是参与“氧循环”的重要物质。
①图甲为空气成分示意图,物质A的化学式为________。
②利用图乙装置测定空气中氧气含量并结合传感器技术,测得实验过程中容器内气体压强、温度的变化趋势如图丙所示。请结合实验原理,解释BC段气体压强变化的原因:________________________________。
(2)“水”被称为生命之源。
①自然界中的水含有较多杂质,净化时加入一定量的活性炭,是利用其________性除去色素和异味。
②图丁为电解水装置,a管连接的是电源的________(填“正”或“负”)极。
丁戊
(3)“碳循环”主要通过二氧化碳来实现,如图戊是某同学整理的含碳物质间转化图。
①自然界中消耗二氧化碳的途径主要有绿色植物的光合作用(转化Ⅱ)和海水的吸收(转化Ⅰ),同样是二氧化碳与水反应,产物却完全不同,原因是________________。
②实验室常用转化Ⅲ检验CO2气体,写出该转化的化学方程式:__________________。
14.市售“自热米饭”带有发热包,遇水后可迅速升温,保温时间达3小时,兴趣小组对某品牌“自热米饭”中的发热包进行实验探究。
【提出问题】发热包中含有哪些物质?
【查阅资料】
(1)发热包由生石灰、铁粉、镁粉、铝粉、炭粉、氯化钠中的若干种组成。
(2)氢氧化镁和氢氧化铝均为不溶于水的白色固体,后者可溶于NaOH溶液。
【实验探究】
(1)甲同学取出发热包内灰黑色的固体粉末,用磁铁靠近,发现有黑色物质被磁铁吸引,证明粉末中含有________;用磁铁将该黑色物质全部吸出,所得制余粉末(样品A)供其他同学进行后续探究。
(2)乙同学取少量样品A,加水溶解、静置后,滴入酚酞试液,试液变为________色,说明原粉末中含生石灰。
(3)丙同学取少量样品A,按如图1所示流程进行实验。
①滤渣的成分为________。
②丙同学实验后发现“样品A中含有铝粉,不含镁粉”,则“碱化”时,他观察到的实验现象是________________________________________。
③“酸溶”时,铝粉与盐酸反应的化学方程式为________________________________。(4)丁同学取少量样品A,加入足量的水溶解,过滤;向所得滤液中滴入5g质量分数为14.6%的稀盐酸(溶液恰好呈中性),再加入足量硝酸银溶液,产生白色沉淀,经过滤、洗涤、干燥等操作后得到3g白色固体X。
①X的化学式为________。
②丁同学认为样品A中一定含有NaCl,其理由为________________________。
【拓展延伸】
(1)发热包所提供的热量主要来自于生石灰与水的反应。利用图2所示的装置进行实验时,锥形瓶内温度迅速升高,但烧杯中未观察到气泡,可能的原因是_______________。(2)“自热米饭”能保温较长时间,是因为发热包内的铁粉锈蚀时能持续提供热量。铁锈蚀时首先通过化合反应生成氧化亚铁,请写出该反应的化学方程式_______________。
15.工业上采用离子交换膜电解槽电解饱和食盐水,可得到高浓度的烧碱溶液(含NaOH 35%~48%),兴趣小组欲确定某化工厂生产的NaOH溶液是否达到高浓度标准,进行了如下操作,请你参与计算:
(1)用质量分数为98%浓硫酸配制200g质量分数为9.8%的稀硫酸,所需玻璃仪器有烧杯、玻璃棒、胶头滴管和________,所需浓硫酸质量为________。
(2)采集该化工厂电解槽中的NaOH溶液20g,向其中滴加质量分数为9.8%的稀硫酸,恰好完全反应时所加稀硫酸的质量为100g。判断电解槽中NaOH溶液是否达到高浓度标准________。
