仪器分析习题及答案.docx

仪器分析习题及答案
一、光学分析法引论习题及答案
1.对下列的物理量单位进行换算:
(1)150pm X 射线的波数(cm-1 );
(2)670.7nm Li 线的频率(Hz);
(3)3300cm-1 波数的波长(P m);
2.计算下列电磁辐射的频率(Hz)、波数(cm-1)及光量子的能量(用电子伏eV、尔格erg 及千卡/摩尔表示):
(1)波长为589.0nm的钠D线;
(2)在12.6H m的红外吸收峰。
3.将波长443nm的光通过折射率为1.329的甲醉溶液时,试计算:
(1)在甲醇溶液中的传播速度;
(2)频率;
(3)能量(J);
(4)周期(s)o
4.辐射通过空气(n= 1.00027)与某玻璃(n= 1.7000)界面时,其反射损失的能量大约有多少?
5.何谓光的二象性?何谓电磁波谱?
6.请按照能量递增和波长递增的顺序,分别排列下列电磁辐射区:红外线,无线电波,可见光,紫外光,X射线,微波。
7.光谱法的仪器通常由哪儿部分组成?它们的作用是什么?
1.答:(1) 6.67x1 hem";(2) 4.47xlO n MHz .⑶ 3.03m。
2容.⑴5.090x1/MHz , 1.698x1"cm" , 2.10eV, 3.37x10-12erg, 4&5千卡/摩尔
p)2.379xlO7MHz , 793.7cm-1 , 0.0984eV, 1.58 xlO-13erg, 2.27^卡/摩尔
3答:(j 2.256 xlO^-s"1. Q) 6.77xlO n MHz .(3)4.48xlO-19J .
(4)1.48xl0-15s o
4.答:6.7%
5.答:光的二彖性:光同时具有波动和粒了两种属性的性质。
电磁波谱:将各种电磁辐射按照波长或频率的大小顺序排列起来的图表。
6.答:能量递增顺序:无线电波、微波、红外线、可见光、紫外光、X射线。
波长递增顺序:X射线、紫外光、可见光、红外线、微波、无线电波。
二、紫外-可见分光光度法习题及答案
1.(CH3)3 N分子能发生n —跃迁,X 为227nm(£为900)。试问:若在酸屮测量时,该吸收峰会怎样变化?为什么?
2.
某化合物的nux为305nm,而吟为307nm。试问:引起该吸收的是n-开*还是n-n*跃迁?
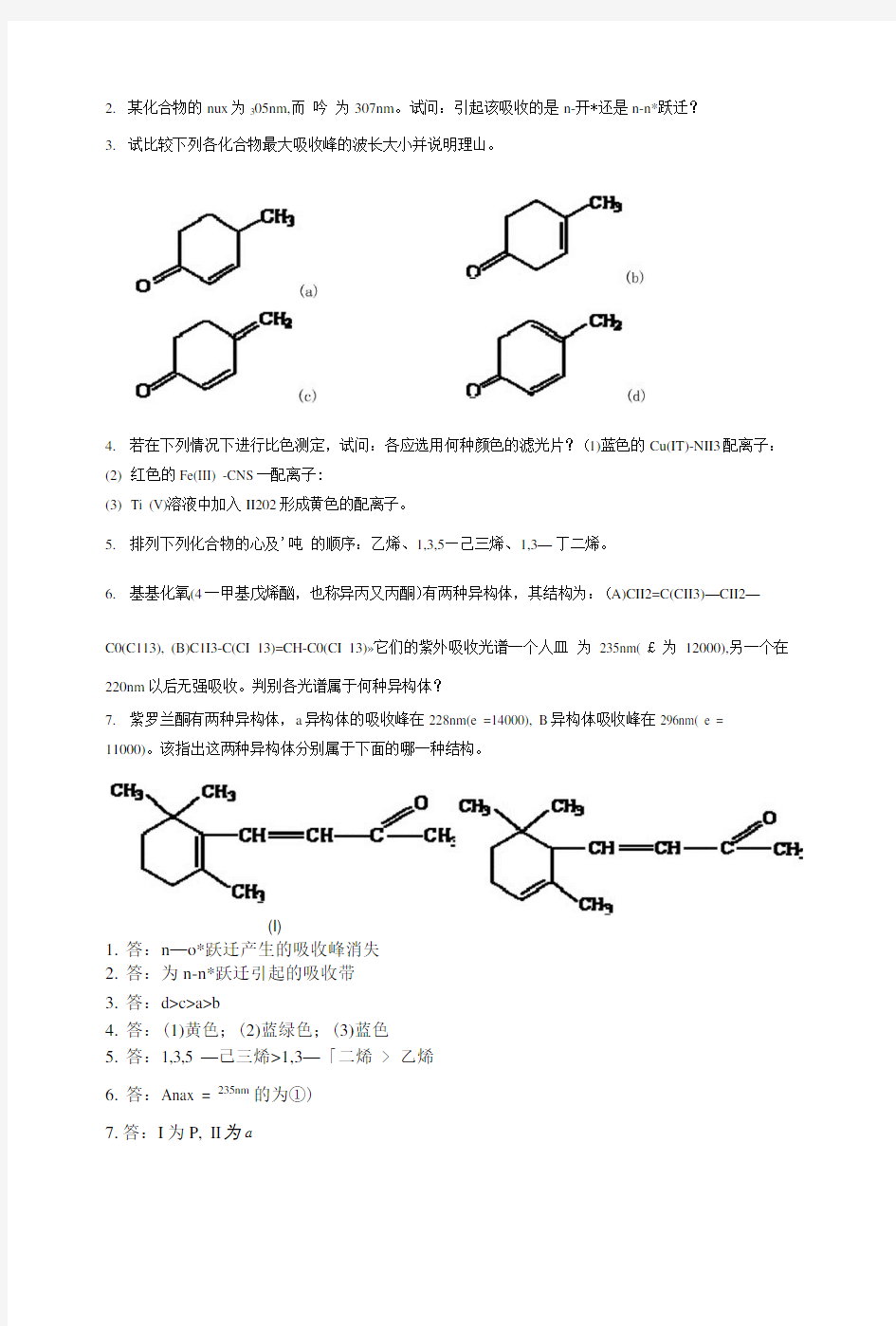
3.试比较下列各化合物最大吸收峰的波长大小并说明理山。
4.若在下列情况下进行比色测定,试问:各应选用何种颜色的滤光片?(1)蓝色的Cu(IT)-NII3配离子:
(2)红色的Fe(III) -CNS一配离子:
(3)Ti (V)溶液中加入II202形成黄色的配离子。
5.排列下列化合物的心及'吨的顺序:乙烯、1,3,5—己三烯、1,3—丁二烯。
6.基基化氧(4一甲基戊烯酗,也称异丙又丙酮)有两种异构体,其结构为:(A)CII2=C(CII3)—CII2—
C0(C113), (B)C1I3-C(CI 13)=CH-C0(CI 13)?它们的紫外吸收光谱一个人皿为235nm( £ 为12000),另一个在220nm以后无强吸收。判别各光谱属于何种异构体?
7.紫罗兰酮有两种异构体,a异构体的吸收峰在228nm(e =14000), B异构体吸收峰在296nm( e = 11000)。该指出这两种异构体分别属于下面的哪一种结构。
1.答:n—o*跃迁产生的吸收峰消失
2.答:为n-n*跃迁引起的吸收带
3.答:d>c>a>b
4.答:(1)黄色;(2)蓝绿色;(3)蓝色
5.答:1,3,5 —己三烯>1,3—「二烯 > 乙烯
6.答:Anax = 235nm的为①)
7.答:I为P, II为a
(I)
三、红外光谱法习题及答案
1.在红外光谱分析中,用KBr?制作为试样池,这是因为()
A KBr晶体在4000?400cm-1范围内不会散射红外光
B KBr在4000?400 cnrl范用内有良好的红外光吸收特性
C KBr在4000?400 cnrl范围内无红外光吸收
D在4000?400 cm-1范围内,KBr对红外无反射
2.一种能作为色散型红外光谱仪色散元件的材料为()
A玻璃
B石英
C卤化物晶体
D有机玻璃
3.并不是所有的分子振动形式其相应的红外谱带都能被观察到,这是因为()
A分子既有振动运动,又有转动运动,太复杂
B分子中有些振动能最是简并的
C因为分子中有C、II、0以外的原子存在
D分子某些振动能最相互抵消了
1.在下列不同溶剂中,测定竣酸的红外光谱时,C=O伸缩振动频率出现最高者为()
A气体
B正构烷坯
C乙健
D乙醇
5.水分子有几个红外谱带,波数最高的谱带对应于何种振动?()
A 2个,不对称伸缩
B 4个,弯曲
C 3个,不对称伸缩
D 2个,对称伸缩
6.在以下三种分子式中C=C双键的红外吸收哪一种最强? (1) C1I3- C1I = C1I2 (2) C1I3- Cll = CH - CI13 (顺式)(3) CI13- CU = C11 - C113 (反式)()
A (1)最强
B (2)最强
C (3)最强
D强度相同
7.以下四种气体不吸收红外光的是()
A 1120
B C02
C IIC1
D N2
8.某化合物的相对分子质量Mr-72,红外光谱指出,该化合物含锲基,则该化合物可能的分子式为()
A分子外层电子、振动、转动能级的跃迁
B原子外层电子、振动、转动能级的跃迁
C分子振动-转动能级的跃迁
D分子外层电子的能级跃迁
9.试比较同一周期内下列情况的仲缩振动(不考虑费米共振与生成氢键)产生的红外吸收峰,频率最小的是()
A C-II
B N-II
C 0-11
D F-II
10.下列关于分子振动的红外活性的叙述屮正确的是()
A凡极性分子的各种振动都是红外活性的,非极性分子的各种振动都不是红外活性的
B极性键的仲缩和变形振动都是红外活性的
C分子的偶极矩在振动时周期地变化,即为红外活性振动
D分子的偶极矩的大小在振动时周期地变化,必为红外活性振动,反之则不是
11.两个能最间距为DE的能级,热平衡时较髙能级和较低能级的布局数之比山Boltzmann分布描述:较
高能级布局数/较低能级布局数=e -DE /kT 式中k为Boltzmann常数(1. 38x 10-23m2XkgX s-2 XK-2)o 拉曼线的强度正比于跃迁起始态的分子数。如果各种因素相同,试计算在300K时,CC11在218 cm-1和459 cm-1处的反Stokes线和Stokes线的强度之比0Plank常数h为6. 63x10-34 m2XkgXsT。
12.25° C下大多数分子处于基态(v = 0) o (a)利用Boltzmann公式计算IIC1分子激发态与基态分子布局数之比:N(v = 1) / N(v = 0)及N (v = 2) / N(v = 0)。HC1 分子的基频为2885 cm-l0 (b)利用(a)的结果计算v = 1至v = 2以及v = 2至v = 3跃迁时相对于v = 0至v = 1跃迁的强度。
13?环己酮在5. 86 nun处的红外峰最强,并且在此波长下其吸光度与浓度呈线性关系。(a)选择什么溶剂有利于在该波长下对环己酮进行定最?⑹浓度为2.0 mg /ml环己酮在该溶剂中的溶液其吸光度为0.40,液池厚度为0. 025 nuno如果噪声为0. 001个吸光度单位,则该条件下环己酮的检测限是多少?
1.C
2. D
3. B
4.A
5.C
6. A
7. D
8. B
9. A 10. C
五、分了发光分析法习题及答案
1?试从原理和仪器两个方面比较分子荧光磷光和化学发光的异同点。
2.何为荧光(磷光)的激发光谱和发射光谱?如何绘制?它们有何异同点?
3.有机化合物的荧光与其结构有何关系?
4.解释下列术语:
(1)荧光最子产率:(2)荧光猝灭:(3)系间跨越;(4)振动弛豫:(5)靈原子效应。
5.写出荧光强度的数学表达式,说明式屮各物理最的意义。影响荧光强度的因索是什么?
6.试解释荧光分析法比紫外一可见分光光度法灵敏度高的原因。
7.F列各组化合物或不同条件中,预期哪一种荧光产率高?为什么?
偶氮苯
(2)pH=3及pII=10时的苯胺
⑷pII-3及pII=10时的苯胺
8.提髙磷光测定灵敏度的方法有哪些?
9.化学发光分析法有哪些特点?能发生化学发光的化学反应必须具备哪些主要条件?
10.若一种化合物能发射荧光和磷光,则该化合物吸收光谱、荧光发射光谱、磷光发射光谱最大波长的顺序如何?为什么?
11.核黄素的吸收光谱(实线)和荧光光谱(虚线)如图14. 18所示。进行荧光分析时,选择的激发波氏和发射波长各为多少?
二氮杂菲
X/nm
图14 IE 水中核黄素的吸收光语和荧光丸诸
12?根据蔡和菲的光谱图(14.19, 20),设计一分析方法测定混合物中的蔡和菲。
100 200
300
400 500
600
O
O 9
o o
O o o O 8 7 6
O O 5 O O
O 3
O O 2
200 300 400 500 600
A/nm
图14.19 奈(在EPA中,77K灼吸收光谱(A)荧充发射充借(F〉和磷光发射光语@)
200 300 400 500 600
X/ppm
图14.20 菲(在EPA中,77° K)的吸收光谱
(A)荧丸发尤尤诸(F)和礴尤发射尤诺
(P)
六、原子发射光谱法习题及答案
1.氐子发射光谱是怎样产生的?为什么各种元索的原子都有其特征的谱线?
2.光谱仪的意义是什么?为何写出Mg285. 2nm共振线的光谱线跃迁表达式?
3.试比较原了发射光谱屮几种常用激发光源的工作原理、特性及适用范围。
4.简述ICP光源的工作瓯理及其优点?
5.光谱仪的主要部件可分为几个部分?各部件的作用如何?
6.棱镜摄谱仪和光栅摄谱仪的性能各用那些指标表示?各性能指标的童义是什么?
7.比较摄谱仪及光电直读光谱仪的异同点?
8.分析下列试样时应选用何种激发光源?
(1)矿石的定性、半定最分析:
(2)合金中铜的定量分析(O.x?x%):
(3)钢中镭的定量分析(0. Ox?0. x%):
⑷头发中各元素的定最分析:
⑸水质调查中Cr、Mn> Cu、Fe、Zn、Pb的定最分析。
9.影响原了发射光谱的谱线强度的因索是什么?产生谱线自吸及自蚀的原因是什么?
10.解释下列名词:
(1)激发电位和电离电位;
⑵ 共振线、原子线、离子线、灵敢线、最后线:
⑶等离子线、激发光源屮的三大平衡。
11.什么是感光板的乳剂特性曲线?其直线部分的关系式如何表示?何谓反衬度、惰延最、雾翳黑度?在分析上有何意义?
12.光谱定最分析为何经常采用内标法?其基本公式及各项的物理意义是什么?
13.选择内标元素及内标线的原则是什么?说明理山。
14.何谓基体效应?为何消除或降低其对光谱分析的影响?
15.计算Cu327. 4nm和Na589. 6nm谱线的激发电位(eV表示)
16.下标中列出I〉b的某些分析线及激发电位,若测定水中痕最Pb应选用那条谱线?当某试样中Pb含杲谓0.1%左右时,是否仍选用此谱线,说明理山。
17.当一级光谱波长为500. Onm时,其入射角为60(),反射角(衍射角)为-40(),此光栅的刻痕数为多少
条/mm?
18.有一块光栅的宽度为5.00mm, nun的刻痕数为720条,那么该光栅第一级光谱分辨率是多少?对波数为1000cm-l的红外线,光栅能分辨的最靠近的两条谱线的波长差为多少?
19.用曲心入=(折射率对波长的变化率)的60()熔融石英棱镜和刻有1200条饰的
光栅來色散Li的400. 20nm及400. 30nm两条谱线。试计算
(1)分辨率;
⑵棱镜和光栅的大小。
20.在原子发射光谱图中,未知元素的谱线X x位于两条铁谱线X 1=486. 37nm和X 2=487.12nm之间。在波长测量仪(也称比长仪)上测得入1和入2之间距离为14. 2mm (经放大),入1和入x之间距离为12. 3mm, 试算入x为多少?
21.用原子发射光谱法测定Zr含量屮的Ti,选用的分析线对为Ti331. 9nm/Zr332. 7nm.测定含Ti=0. 0045% 的标样时,强度比为0. 126:测定含Ti=0. 070%的标样时,强度比为1.29;测定某试样时,强度比为0. 598, 求试样屮Ti%o
22.用原子发射光谱法测定锡合金屮铅的含量,以基体锡作为内标元索,分析线对为Pb283. 3,/Sn276. lnm, 毎个样品平行摄谱三次,测得黑度平均值列于下表,求未知试样屮铅的百分含量(作图法)
23?用标准加入法测定硅酸岩矿中I;e的质量分数,I 17.446 条/mm 18.360(); 2.8nm 19.(1)46xl°3;(2) 3.1cm 和 3.8mm 20.487.02 21.0.028% 22. 0.461% 23 1.12xll]T% 六、原了吸收光谱法习题及答案 1.原子吸收光谱和原子荧光光谱是如何产生的?比较两种分析方法的特点。 2.解释下列名词:(1)谱线轮廓;(2)积分吸收:(3)峰值吸收:(4)锐线光源:(5)光谱通带。 3.表征谱线轮廓的物理最是哪些?引起谱线变宽的主要因索有哪些? I.原子吸收光谱法定量分析的基本关系式是什么?原子吸收的测量为什么要用锐线光源? 5.原子吸收光谱法最常用的锐线光源是什么?其结构、工作原理及最主要的工作条件是什么? 6.空心阴极灯的阴极内壁应衬上什么材料?其作用是什么?灯内充有的低压惰性气体的作用是什么? 7.试比较火焰瓯予化系统及石墨炉原子化器的构适、工作流程及特点,并分析石墨炉原子化法的检测限比 原子化法高的原因。 8.火焰氐子化法的燃气、助燃气比例及火焰高度对被测元索有何影响?试举例说明。 9.原子吸收分光光度计的光源为什么要进行调制?有几种调制的方式? 10?分析下列元索时,应选用何种类型的火焰?并说明其理山:(1)人发中的硒:(2)矿石屮的钻:⑶ 油漆屮的铅。 II.原了吸收光谱法屮的菲光i普干扰有哪些?如何消除这些干扰? 12.原子吸收光谱法中的背景干扰是如何产生的?如何加以校正? 13.说明用筑灯法校正背景干扰的原理,该法尚存在什么问题? 14.在测定血清屮钾时,先用水将试样稀释40倍,再加入钠盐至0. Bmg./mL,试解释此操作的理山,并说明 标准溶液丿垃如何配制? 15.产生原子荧光的跃迁有几种方式?试说明为什么原子荧光的检测限一般比原子吸收低? 16.与测定下列物质,应选用哪一种原子光谱法,并说明理由: (1)血清中的Zn 和Cd (?Zn2mg/mL, CdO. 003ug/mL): ⑵鱼肉中的Hg (?xug/g数量级); (3)水中的As (?0. x ug/mL): (4)矿石Ld、Ce、Pr、Nd、Sin (0. OOx?0.x%) (5)废水中Fe、Mn、Al、Ni、Co、Cr (x ug/mL?x mg/mL)。 17.镁的共振线285.21nm是跃迁产生的,试计算在2430K时,激发态和基态的原子数之比。 用原子吸收光谱法测定试样中的T1,使用丙烷一氧气火焰,其温度为2800K,分析线为377.6側,它是 111 6P1电子跃迁至7S1产生的。试问火焰屮T1原子的激发态和基态数之比是多少? 19.原子吸收分光光度计的单色器倒色散率为1.6nm/mm,欲测定Si251.61nm线的吸收值,为了消除多重线 Si251. -13nm和Si251. 92的干扰,应釆取什么措施? 20.测定血浆中Li的浓度,将两份均为0. 430niL血浆分别加入到5. OOmL水屮,然后向第二份溶液加入20. 0 UL 0. 0130mol./L的LiCl标准溶液。在原子吸收分光光度计上测得读数分别为0. 230和0. 680,求此血浆中Li 得浓度(以Li g/mLLi表示) 21.用原子吸收光谱测定水样屮Co得浓度。分别吸取水样10. OmL于50inL容昴瓶中,然后向各容最瓶屮加入不同体积的6. 00 ug/mL 3标准溶液,并稀释至刻度,在同样条件下测定吸光度,山下表数据用作图法求得水样屮Co的浓度。 22.用双标准加入法原子吸收光谱测定二乙基二硫代氨基甲酸盐萃取物屮的铁,得到如下的数据,求试液屮铁的浓度。 17.答:5.2x10』 1&答:4.1X10-7 2().答:7.08 u g/mL 21.答:10.9 u g/mL 22.答:3.57 u g/mL 七、X射线荧光光谱法习题及答案 1.X射线荧光光谱是如何产生的? 2.X射线荧光光谱分析的基木原理。 3.X射线荧光光谱仪佶哪两种基木类型? 4.X射线荧光光谱议分光系统是什么? 5.简述两种类型X射线光谱仪的主要部件及工作原理 2.答:X射线荧光光谱分析的基木原理:当试样受到x射线,高能粒子束,紫外光等照射时,山于高能粒 子或光子与试样原子碰撞,将原子内层电子逐出形成空穴,使原子处于激发态,这种激发态离子寿命很短, 当外层电子向内层空穴跃迁时,多余的能最即以x射线的形式放出,并在教外层产生新的空穴和产生新的 x射线发射,这样便产生一系列的特征x射线。 j HI显何胭) 般色陋:多元霸对分強色散番応筋覇帖醮元畑 飆讎-起) X翕姒光光斛 b色购值长色粘ti色?ill储T) 厲色储 3.??: 4.答:X射线荧光光谱议分光系统是山入射狭缝,分光晶体,晶体旋转机构,样品室和真空系统组成。其作用是将试样受激发产生的二次x射线(荧光x射线)经入射狭缝准直后,投射到分光晶体上。晶体旋转机构使分光晶体转动,连续改变?角,使各元素不同波K的X射线按布拉楼定律分别发生衍射而分开,经色散产生荧光光谱 八、电子能谱法习题及答案 1?简述电子能谱原理。 2.电了能谱的主要应用有哪些? 3?为什么说电了能谱是表面灵敏的分析技术 九、核磁共振波谱法习题及答案 1 .试述产生核磁共振的条件是什么? 2—个白旋量了数为5/2的核在磁场屮有多少种能态?各种能态的磁量了数取值为多少? 3.指出下列原子核中,哪些核无白旋角动量? ':F 訂> 繆 9 ,,,,,,, , 4. 解释下列术语:核进动频率、饱和、弛豫、纵向弛豫、横向弛豫。 5. 什么是化学位移?它是如何产生的?影响化学位移的因素有哪些?为什么乙烯质了的化 学位移比乙炊质子大? 6. 简述H 旋一白旋裂分的原理。 7?何谓一级图谱? 一级图谱的白旋偶合裂分有哪些规律? 8?什么是化学全同和磁全同?试举例说明。 9. 脉冲傅里叶变换核磁共振波谱仪在原理上与连续波核磁波谱仪有什么不同?它有哪些优 点? 10」3C-NMR 谱比较1H-NMR 谱有什么优点? 11. 射频辐射的频率固定时,要使共振发生,氟核和氢核哪一个将需要更大的外磁场?为什 么? 12. 试计算在1.9406T 的磁场中,1H 、13C 、19F 、31P 的共振频率。 13. 试计算在25oC 时,处在2.4T 磁场中13C 高低能态核数目的比例。 14. 使用60.0MHz NMR 仪时,TMS 的吸收与化合物屮某质了Z 间的频率差为180Hz o 如果 使用40.0MHz 的NMR 仪,它们Z 间的频率茅将是多少? 15. 按照一级图谱的偶合裂分规律,预测下列化合物的NMR 图(包括化学位移大约值、裂分 峰数及强度比、各组峰的相对积分面积) (DC2H5OC2H5; (2)CH3COCH2CH3; (3)CH3CH2CHO ;(心CH3CH2COOH ; (5)(CH3)2CHC1; (6)C6H5CH2OH ; (7)C1CH2CH2CH2CI ; (8)CH3CHBrCHBrCH3; 5 3 1 1 3 5 用=—,一,一,——,——,—— 2. 答:6 种, 2 2 2 2 2 2 11. 答:氟核大, 12. 答:82.6MHz. 20.XMHZ 、77.7MHz 、33.4MHz ' 丿=0.9999959 N (+I /2) 120Hz 十、电分析化学引论习题及答案 1?化学电池山哪几部分组成?如何表达电池的图示式?电池的图示式有那些规定? 2. 电池的阳极和阴极,正极和负极是怎样定义的?阳极就是正极,阴极就是负极的说法对吗?为什么? 3. 电池中"盐桥"的作用是什么?盐桥中的电解质溶液应有什么要求? 1. 电极电位及电池电动势的表示式如何表示?应注意什么问题?何谓式最电位?如何表示 5. 电极有几种类型?各种类型电极的电极电位如何表示? 3.答: 13. 答: 因为氛核的核磁炉小 6.何谓指示电极、工作电极、参比电极和辅助电极? 7.何?谓电极的极化?产生电极极化的原因有哪些?极化过电位如何表示? &写出下列电池的半电池反应和电池反应,计算电动势。这些电池是原电池还是电解池?极性为何?(设T为259,活度系数均为1) ?c 严,c?+ = ~°-41V ^Pb 2+, Pb =_0126V (2) Pt, H2(20265Pa) | HC1 (0. lOOmol - L-l) II HC104(0. lOOmol ? L -l) | C12(50663Pa), Pt (3) Bi | BiO+ (&0 X10-2mol - L-l) , 11+ (1. 00X 10~2mol -L-l) II 1-(0. lOOmol - L-l), Agl (饱 和)I Ag 酗:磕5皿32匚喷 J0.799V,耳陶=8.3x0” 9. 己知下列半电池反应及其标准电极电位: Sb+3N++3e = ^=-0.5 IV Sbll3 计算下列半电池反应Sb+31120+3e = Sbll3+30U-l 在25°C 时的值 10. 电池:Hg | Hg2C12, Cl-(饱和)II Mn+ | M 在25°C 时的电动势为0. 100V ;当Mn+的浓度稀释为原来的 1/50时,电池的电动势为0.050Vo 试求电池右边半电池反应的电子转移数(n 值)。 11. 下列电池的电动势为0. 693V (25°C) Pt, 112(101325Pa) | 11A (0. 200mol - L-l) , NaA (0. 300 mol - L-l) II SCE 12. 下列电池的电动势为一0?138V (289oK) Hg | llg(N03)2 (1.0X10-3mol ?L-1) , KI (1. 00X 10-2mol ?L-1) II SCE 试计算:Hg?*的配合稳定常数K 。 13. 己知卜列半电池反应及其标准电极电位: Sn 2++2^ = Sn SnQ ;? + 2e = Sn + 4Cl- 试计算:弘"+ 4CP _ SnCl ;-的配合稳定常数K 1-1.下列电池的电动势为0.411V (25°C) Pb | PbC12 (饱和),Cl- (0.020inol ? L-l) II SCE Pb = _0126V ,倨CE = 0.2444V 己知Pb .Fb ,不考虑离子强度的影响。请计算PbC12的KSP 。 15. 有一电池:Zn | Zn2+ (O.OlOOmol ? L-l) II Ag+ (0. 300mol ? L-l) | Ag 计算该电池298oK 时的电动势为多少?当电池反应达到平衡外线路无电子流通过时,Ag+浓度为多少? Zn = -°-762V ,吩 A g = 0 799V 己知: 咗H 严V"盒十139V @SCE = 0.2444V 不考虑离子强度的影响,请计算HA 的离解常数Kao -0.136V -0.19V 已知: 8. (1) E=0.429V,是原电池 (2) E= 1.448V,是原电池 (3) E=-0.261V,是电解池 9. -1.34V 10. n=2 11. Ka=3.9X10-8 12. K=6.5X1029 13. K=67 14. K=1.7X 10-5 15. E=1.59V,浓度=1.55X10-27mol ? L-l 十一、电位分析与离了选择性电极习题及答案 1. 电位分析法的理论基础是什么?它可以分成哪两类分析方法?它们各有何特点? 2. 以氟离子选择件电极为例,画出离子选择电极的基木结构图,并指出各部分的名称。 3. 何谓扩散电位和道南电位(相间电位)?笃出离子选择电极膜电位和电极电位的能斯特方程式。 1.试述pH 玻璃电极的响应机理。解释pll 的操作性实用定义。 况何谓1SE 的不对称电位?在使用pll 玻璃电极时,如何减少不对称电位对pH 测量的影响? 6. 气緻电极在结构上与一般的ISE 有何不同?其原理如何? 7. 何谓1SE 的电位选择系数?它在电位分析屮有何朿要意义?写出有干扰离子存在下的能斯特方程的扩充 式。 &何谓总离子强度调节缓冲剂?它的作用是什么? 9.电位滴定的终点确定有哪几种方法? 10汁算25°C 时下列电池的电动势,并标明电极的正负: 己知卩盂ci ,Ag=°?222V , §%CE =0.244V 11.硫化银膜电极以银丝为内参比电极,0. Olmol/L 硝酸银为内参比溶液,讣算该电极在 12?测定以下电池:pH 玻璃电极 pll=5. 00的溶液|SCE ,得到电动势为0. 2018V ;而测定另一未知酸度 的溶液 时,电动势为0.2366V 。电极的实际响应斜率为5&0mV/pH 。计算未知液得pH 。 13?冠能屮性载体膜钾电极和饱和林汞电极(以醋酸锂为盐桥)组成测最电池为: K —SCE 删蜀容液|SCE 当测最溶液分别为ORMOmolCiKCl 溶液和O.OlOCImol LbfaCl 溶液时,测得电动势为-88?8讷和 Ag , AgCl O.lOOmol-LT^aCl 1.00 xlO -3mol-^NaF 单晶膜 O.lOOmol- LKF SCE l.OOxlO^mo-r 1 s 2- 碱性溶液屮的电极电位 已知: = 0.799V, K SP (A€2S) = 2X 10-49 2 | 2 | 14用固定干扰法测选择电极对的电位选择系数。在浓麼为l.OxlO^mol-L-1的一 F+/ / mol-L 1 LOxlL l.OxlO-3 1.0X1 旷 4 l.OxlO -5 l.OxlO"6 e (VS SCE ) / /mV 30.0 2.0 -26.0 -45. 0 17. 0 Rpot — 2.0xl0-3 15. C1_ 选择电极的cr ,当它用于测定pH 为6. 0且含有°- 01mo1 ? L 卜:2“5溶液中的5.0xl0-4 mol-L-1的CT 时,估计方法的相对谋差有多大? 16. 用F ■选择电极测定水样中的F~。取25?00mL 水样,加入25. OOmLTlSAB 溶液,测得电位值为0. 1372V (Vs SCE ):再加入1.00X10-3mol-L -1的厂标准溶液i.oOmL,测得电位值为0. 1170V,电位的响应 斜率为58.0mV./pF o iT 算水样屮的F ■浓度(需:考虑稀释效应) 17. 为了测定Cu (TT ) -EDTA^CUY2)络和物的稳定常数稳,组装了下列电池: Cu |cuY A (1 ? 00 X1 旷4 mol 匸1),丫卜(1.00x10-2mol .L-1)||SHE 测得该电池的电动势为0. 277V,请计算络和物的K 稳。 1&准确移取50. OOmL 含NH :的试液,经碱化后(若体积不变)用气做氨电极测得其电位为-80?1讷。若 加l.OOxlO^mol-L-1的NH :标准溶液0 50mL ,测得电位值为-96.1讷。然后再此溶液中再加入离子 强度调节剂 50. OOmL.测得其电位值为-7& 3诃。计算试液中的NH :浓度为多少(以^/mL 表示)。 19?用亂离子选择电极测定CN-和广混合液中CbT 。该电极适用的[川范围为ll-12o 现移取试液 100. OmL, 在pll 为12时测得电位值为-251. 8mV.然后用固体试剂调节试液至pll=4 (此时,CN 完全以 IICN 形式存在):测得电位值为-235. o mLo 若向凶=1的该试液中再l-00mL9.00 X 1 0-4mol ? L _1 _ K 1^ = i 2 广标准溶液,测得电位值为-291加。己知该电极的响应斜率为5&°mv/pCN , CN-,r 。请 计算混合试液中CN_的浓度。 10. 答:0.081V 58. 2mV, 若电极的响应斜率为58. OinV/pK 时, 系列不同Cf+ K 浓度的溶液屮?测得如下数据。请用作图法求 pot 11.答:-0.522V 12.答:5.6 13.答:E=0.429V,是原电池292x10-3 14.答:0.21 15.答:20% 16.答:3.14x10-5mol.I/】 17.答:76x1018 18答.0.206 |ig/mL 19答:l.^xlO^mol -L-1 十二、电解和库仑分析法习题及 1.有下列五种电化学分析法: A.电位分析法 B.伏安分析法 C.电导分析法 D.电解分析法 E.库仑分析法 (1)以测量沉积于电极表面的沉积物质量为基础的是() (2)以测量电解过程屮被测物质在电极上发生电化学反应所消耗的电量为基础的是() (3)要求电流效率100%的是() 2.以下有关电解的叙述哪些是正确的? A.借外部电源的作用来实现化学反应向着非自发方向进行的过程; B.借外部电源的作用来实现化学反应向着白发方向进行的过稈; C.在电解时,加直流电压于电解池的两个电极上; D.在电解时,加交流电压于电解池的两个电极上; 3 .在电重量分析法屮作为沉淀剂的是: A.电压 B.电流 C.电量 D.电能 E.电动势 4以下哪个是错误的? A.在阴极上还原的不一定是阳离子; B.在阳极上氧化的不一定水阴离了; C.析出电位是相对一个电极而言; D.分解电压是对整个电解池而言; E.析出电位值越负越容易被还原; 5.在分解电压屮没有考虑的因素是: A.理论分解电压 B.极化产生的超电压 C.电解冋路的降 D.液体接界电位 E.膜电位 6以下哪个因素与超电位无关? A?电极面积B.电流密度 C.温度D.析出物温度 E.电解质纟R成 7与电解方程式的表达式无关的是 A .电极电位B.超电位C.电解池内阻D.通过电解池的电流E.液接电位 8在控制电位电解法的装置屮,不包括以下哪个? A.电压表 B.电位计 C.电流表 D.可变电阻 E.甘汞电极 9右图为欲分离A和B两种离了的i-E Illi线,如果要使金属离了A还原而B不还原,则阴极电位E必须控制在 A. avEvb B. b< E C. E >b D. E >a E. E 10若在溶液屮含有下列浓度的离了,以Pt为电极进行电解,首先在阴极上析出的是: A.0.01(=0.799); B.2(=0.337); C. 1 (=-0.128); D.0」(=-0.763); E.0.2 (=-0.1.18); 11在0.5溶液屮,电解0.100溶液,使Z开始电的理解分压(单位:V )为(已知:=0.337V; = 1.23V) A. 0.307 B. 0.913 C. 0.922 D. 1.527 E. 1.536 12.以0.500A电流通入某溶液0.25,如果电流效率为100%,要阴极上析出锌的质量(单位:g) 为: A. 8.47X 10 B? 2.54X10C? 5.08X10D? 0.152 E? 0.304 13.用两支钳电极组成一电解池,电解池的内阻为0.50,钳电极的面积均为150,将两支钳电极分别插入200 1.00和1溶液进行电解,如果通入的电解电流为1.50A,开沉积时,需要的外加电压(单位:V)为: A. 0.89 B? 1.64 C. 2.08 D. 2.49 E? 3.17 14:电解浓度不0.01和1离子的硫酸盐溶液([H =1]),外加电压控制在下列哪个范围内,才能完全析出,而留在溶液屮(已知:=0.337V, =+0.45, =1.23V)? A. 0.55?0.785V B. 0.68?1.02V C. 1.02?1.26 D. 1.02?1.36V E. 1.02?1.54V 十三、伏安法和极谱法习题及答案 1.伏安和极谱分析时一种特殊情况下的电解形式,其特殊表观在哪些方面? 2.极谱分析法采用的滴汞电极具有哪些特点?在极谱分析法屮为什么常用三电极系统? 3.简单金属离子和金属配合物离子的极谱波方程式有何不同?为何利用配合物离子的极谱波方程求配合物的n. p. K? 4.何谓半波电位?它有何性质和用途? 5.何谓极谱扩散电流方程式(也称尤考维奇方程式)?式屮各符号的意义及单位是什么? 6.影响极谱扩散电流的因素是什么?极谱干扰电流有哪些?如何消除? 7.极谱的底液包括哪些物质?英作用是什么? &直流极谱法有哪些局限性?应从哪些方面來克服这些局限性? 9.试比较单扌:|描极谱法及循环伏安法的原理、特点和应用等方面的异同点。 10.试述脉冲极谱法的基木原理,为什么示差脉冲极谱法的灵做度较高? 11.极谱催化波有哪些类型?各类催化波产生的过程有何不同?
