江苏省兴化一中2020届高三化学12月月考试题

江苏省兴化一中2020届高三化学12月月考试题
第Ⅰ卷(选择题共40分)
可能用到的相对原子质量:
单项选择题:本题包括10 小题,每小题2分,共20分。每小题只有一个选项符合题意。1.下列有关环境问题的做法错误的是
A.生活污水使用明矾杀菌消毒 B.向燃煤中加入适量石灰石“固硫”
C.推广使用可降解塑料防止白色污染 D.提倡公交出行可减少氮氧化物排放
2.下列有关化学用语表示正确的是
A. 甲酸乙酯的结构简式:CH3OOCCH3
B. Al3+的结构示意图:
C. 次氯酸钠的电子式:
D. 中子数比质子数多1的磷原子:
3.下列物质的性质与应用对应关系正确的是
A.氨气易液化,而且液氨气化时吸收大量的热,可用作制冷剂
B. Na2CO3溶液显碱性,可用于除锅垢中的硫酸钙
C. FCl3溶液显酸性,可用于蚀刻印刷电路板
D.Al2O3具有两性,可用作耐高温材料
4.设N A为阿伏加德罗常数的值。下列说法正确的是
A.0.1 mol丙烯酸中含有的双键数目为0.1 N A
B.常温常压下,4.6 g NO2和N2O4的混合气体中分子总数为0.3 N A
C.标准状况下,2.24LCCl4中含有的共价键数目为0.4N A
D.7.8 g Na2O2和Na2S的固体混合物中含有的离子总数为0.3 N A
5.常温下,下列各组离子在指定溶液中能大量共存的是
A.0.1 mol·L?1的FeCl2溶液中:H+、Al3+、SO42—、ClO?
B.无色透明的溶液中:Al3+、Fe3+、NO3—、SCN—
C.与Al反应能放H2的溶液中:Cu2+、NH4+、CO32-、Cl?
D.c(OH?)/c(H+)=1×1014的溶液中:K+、Na+、I?、SiO32—
6.下列有关物质性质的叙述不正确的是
A.常温下,铝遇浓硝酸发生钝化
B.钠在空气中燃烧生成白色的Na20粉末
C.二氧化硫可以使品红溶液褪色
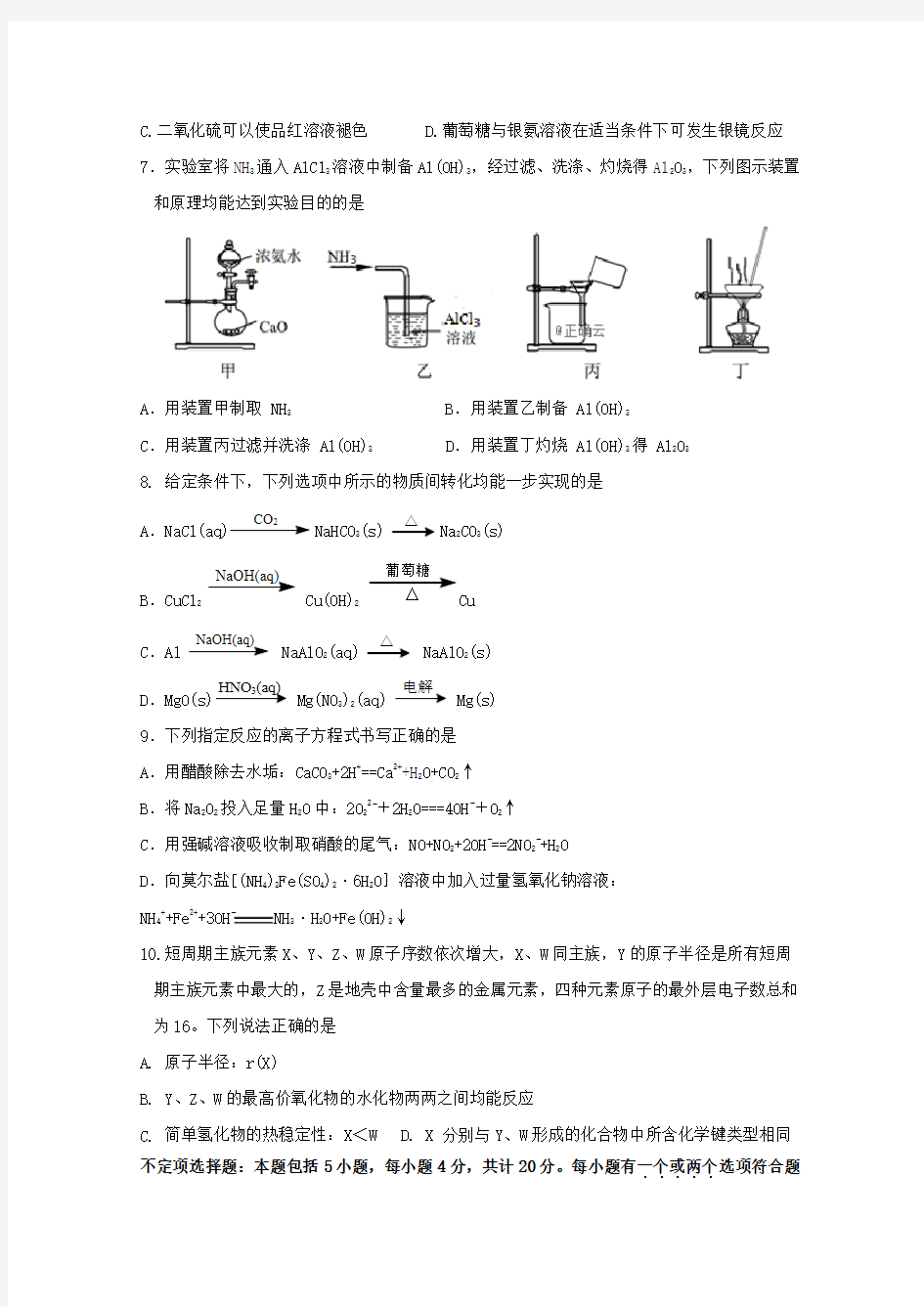
D.葡萄糖与银氨溶液在适当条件下可发生银镜反应7.实验室将NH3通入AlCl3溶液中制备Al(OH)3,经过滤、洗涤、灼烧得Al2O3,下列图示装置和原理均能达到实验目的的是
A.用装置甲制取 NH3 B.用装置乙制备 Al(OH)3
C.用装置丙过滤并洗涤 Al(OH)3 D.用装置丁灼烧 Al(OH)3得 Al2O3
8. 给定条件下,下列选项中所示的物质间转化均能一步实现的是
A.NaCl(aq)CO2
NaHCO3(s)
△
Na2CO3(s)
B.CuCl2 NaOH(aq)
2
葡萄糖
△Cu
C.Al NaOH(aq)
NaAlO2(aq)
△
NaAlO2(s)
D.MgO(s)HNO3(aq)
Mg(NO3)2(aq)
电解
Mg(s)
9.下列指定反应的离子方程式书写正确的是
A.用醋酸除去水垢:CaCO3+2H+==Ca2++H2O+CO2↑
B.将Na2O2投入足量H2O中:2O22?+2H2O===4OH?+O2↑
C.用强碱溶液吸收制取硝酸的尾气:NO+NO2+2OH?==2NO2?+H2O
D.向莫尔盐[(NH4)2Fe(SO4)2·6H2O]溶液中加入过量氢氧化钠溶液:
NH4++Fe2++3OH?NH3·H2O+Fe(OH)2↓
10.短周期主族元素X、Y、Z、W原子序数依次增大,X、W同主族,Y的原子半径是所有短周期主族元素中最大的,Z是地壳中含量最多的金属元素,四种元素原子的最外层电子数总和为16。下列说法正确的是
A. 原子半径:r(X) B. Y、Z、W的最高价氧化物的水化物两两之间均能反应 C. 简单氢化物的热稳定性:X<W D. X 分别与Y、W形成的化合物中所含化学键类型相同 不定项选择题:本题包括5小题,每小题4分,共计20分。每小题有一个或两个 .....选项符合题 意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。 11.一种合成某药物中间体Z 的方法如下。下列说法正确的是 A .1mol X 最多能消耗溴水中的2 mol Br 2 B .Y 可以发生消去反应 C .Z 中所有碳原子可以在同一平面 D .用FeCl 3溶液可以检验Z 中是否混有X 12.下列说法正确的是 A .298 K 时,2H 2S(g)+SO 2(g)===3S(s)+2H 2O(l) 能自发进行,则其ΔH <0 B .铜的化学性质比铁稳定,在铁闸上安装铜块可减慢铁闸的腐蚀速率 C .铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 D .常温下,pH 均为5的盐酸与氯化铵溶液中,水的电离程度相同 13.根据下列实验操作和现象所得到的结论正确的是 选项 实验操作和现象 结论 A 向硅酸钠溶液中滴加盐酸,有白色胶状沉淀生成 非金属性:C1>Si B 某溶液中加入硝酸酸化的Ba(NO 3)2溶液,无现象,再滴加AgNO 3溶液,有白色沉淀生成 溶液中一定含有Cl - C 淀粉溶液在硫酸存在下加热一段时间后,再与新制的 Cu(OH)2悬浊液混合,加热煮沸,无红色沉淀生成 淀粉没有水解 D 向FeCl 2溶液中加入足量Na 2O 2粉末,出现红褐色沉淀和 无色气体 FeCl 2溶液部分变质 14.常温下,下列有关叙述正确的是 A .向0.1 mol·L ?1 Na 2CO 3溶液中通入适量CO 2气体后:c (Na +)=2[c ( 3HCO -)+c (23CO -)+c (H 2CO 3)] B .常温下,pH=6的NaHSO 3溶液中:c (23SO -)?c (H 2SO 3)=9.9×10?7 mol·L ?1 C .等物质的量浓度、等体积的Na 2CO 3和NaHCO 3混合: 323(HCO ) (H CO )c c ->233(CO ) (HCO )c c -- D .0.1 mol·L ?1 Na 2C 2O 4溶液与0.1 mol·L ?1 HCl 溶液等体积混合(H 2C 2O 4为二元弱酸): 2c( 2 24 C O- )+c(24 HC O- )+c(OH?)=c(Na+)+c(H+) 15.一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g)COCl2(g),其中容器Ⅰ中5 min时到达平衡。 容器 编 号 温度/℃ 起始物质的量/mol 平衡物质的量/mol CO Cl2 COCl2 COCl2 Ⅰ500 1.0 1.0 0 0.8 Ⅱ500 1.0 a 0 0.5 Ⅲ600 0.5 0.5 0.5 0.7 下列说法中正确的是 A.容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1 B.该反应正反应为放热反应 C.容器Ⅱ中起始时Cl2的物质的量为0.55 mol D.若起始时向容器Ⅰ加入CO 0.8 mol、Cl2 0.8 mol,达到平衡时CO转化率大于80% 第Ⅱ卷(非选择题共80分) 16.(12分)某化学兴趣小组以菱铁矿(主要成分为FeCO3,含有SiO2、Al2O3等少量杂质)为原料制备氯化铁晶体(FeCl3·6H2O)的实验过程如下: ⑴酸溶及后续过程中均需保持酸过量,其目的除了提高铁元素的浸出率之外,还有▲ 。 ⑵操作Ⅰ名称是▲。 ⑶滴加H2O2溶液氧化时,发生主要反应的离子方程式为▲。 ⑷在氧化过程中,如何检验铁元素全部以Fe3+形式存在:▲。 ⑸加入过量NaOH溶液的目的是▲。 17. (15分)化台物J是一种重要的有机中间体,可以由苯合成: (1) B中含氧官能团名称为__________、___________。 (2) D E的反应类型为_____________。 (3) C的分子式为C10H12O2,经取代反应得到D;写出C的结构简式_________。 (4)写出同时满足下列条件的J的一种同分异构体的结构简式______________。 ①属于芳香族化合物;②不能与金属钠反应;③有3种不同化学环境的氢原子。 (5)已知: (R表示烃基,R1、R2表示氢或烃基)。 请写出以为原料制备的合成路线图。 (无机试剂任用,合成路线流程图示例见本题题干)。 18.(12分)KMnO4是一种用途广泛的氧化剂,可由软锰矿(主要成分为MnO2)通过下列方法制备: ①软锰矿与过量KOH、KC1O3固体熔融生成K2MnO4;②溶解、过滤后将滤液酸化,使K2MnO4完全转变为MnO2和KMnO4;③滤去MnO2,将滤液进行处理可获得深紫色的KMnO4产品。 (1)写出第②步中发生反应的离子方程式▲。 (2)第③步中从滤液中获得KMnO4晶体的方法是▲、▲、过滤、洗涤、干燥。(3)取上述制得的KMnO4产品2.0000g,溶于水配成250mL溶液,取出25.00mL于碘量瓶中, 加入稀硫酸和足量碘化钾并放于暗处5min左右,然后加入适量水和数滴淀粉溶液作指示剂,用0.2500mol/L标准Na2S2O3溶液进行滴定(发生反应I2+2S2O32-=2I-+S4O62-,杂质不参加反应),滴定至终点消耗Na2S2O3溶液20.00mL。 ①滴定终点的现象是▲。 ②计算KMnO4产品的纯度。(写出计算过程) 19.(13分)工业上以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料 制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下: ⑴过滤Ⅰ所得滤渣Ⅰ的主要成分为▲ (填化学式)。 ⑵“氧化”过程中除了发生MnO2与SO2的反应外,还发生另一氧化还原反应,写出该反应的离子方程式:▲ 。 ⑶“浸锰”反应中往往有副产物MnS2O6生成, 温度对“浸锰”反应的影响如右图所示, 为减 少 MnS2O6 的生成,“浸锰”的适宜温度是 ▲ 。 ⑷向过滤Ⅱ所得的滤液中加入NH4HCO3 溶 液时温度控制在30-35℃,温度不宜太高 的原因是。 ⑸加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有CO2气体生成,写出反应的离子方程式: ▲ 。 ⑹生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是▲ 。 20.(14 分)采用科学技术减少氮氧化物、SO2等物质的排放,可促进社会主义生态文明建设。 (1)采用“联合脱硫脱氮技术”处理烟气(含CO2、SO2、NO)可获得含CaCO3、CaSO4.Ca(NO3)2的副产品,工业流程如题20图一l所示。 ①反应釜I采用“气一液逆流”接触吸收法(如题20图-2),其优点是。 ②反应釜Il中CaSO3转化为CaSO4的化学反应方程式为。(2)用稀硝酸吸收NO x,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:____________________________________。 (3)利用脱氮菌可净化低浓度NO废气。当废气在塔内停留时间均为90s的情况下,测得不同条件下NO的脱氮率如图I、Ⅱ所示。 ① 由图I知,当废气中的NO含量增加时,宜选用______法提高脱氮的效率。 ② 图Ⅱ中,循环吸收液加入Fe2+、Mn2+,提高了脱氮的效率,其可能原因为________。 (4)研究表明:NaClO/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。图Ⅲ所示为复合吸收剂组成一定时,温度对脱硫脱硝的影响。 ①温度高于60℃后,NO去除率下降的原因为__________。 ②写出废气中的SO2与NaC1O2反应的离子方程式:____________。 21.(14 分)研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。 (1)CO2和H2可直接合成甲醇,向一密闭容器中充入CO2和H2,发生反应: CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH ①保持温度、体积一定,能说明上述反应达到平衡状态的是。 A.容器内压强不变 B.3v正(CH3OH)= v正(H2) C.容器内气体的密度不变 D.CO2与H2O的物质的量之比保持不变 ②测得不同温度时CH3OH的物质的量随时间的变化如图1所示,则ΔH 0(填“>”或“<”)。 (2)工业生产中需对空气中的CO进行监测。 ①PdCl2溶液可以检验空气中少量的CO。当空气中含CO时,溶液中会产生黑色的Pd沉淀。若反应中有0.02 mol电子转移,则生成Pd沉淀的质量为。 ②使用电化学一氧化碳气体传感器定量检测空气中CO含量,其模型如图2所示。这种传感器利用了原电池原理,则该电池的负极反应式为。 (3)某催化剂可将CO2和CH4转化成乙酸。催化剂的催化效率和乙酸的生成速率随温度的变化关系如图3所示。乙酸的生成速率主要取决于温度影响的范围是。 (4)常温下,将一定量的CO2通入石灰乳中充分反应,达平衡后,溶液的pH为11,则 c(2 CO )= 。(已知:K sp[Ca(OH)2]=5.6×10?6,K sp(CaCO3) =2.8×10?9)3 (5)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。图4是通过光电转化原理以廉价原料制备新产品的示意图。催化剂a、b之间连接导线上电子流动方向是(填 “a→b”或“b→a”)。 兴化市第一中学2020秋学期期中后月考化学学科答案 高三化学参考答案及评分建议 评分建议: (1)化学用语、中文书写错误或不规范不给分; (2)非选择题相关文字表述有明显科学性错误不给分,回答不到位扣分,与参考答案不一致但合理的给分; (3)化学方程式误写为离子方程式,或者离子方程式误写为化学方程式,均不给分; (4)方程式中化学式错误或漏写不给分,方程式所有化学式正确但配平错误不给分,反应条件不写扣1分,关键符号错误扣1分。 一、单项选择题(本题包括10小题,每小题2分,共20分) 1.A 2.D 3.A 4.D 5.D 6.B 7.A 8.C 9.C 10.B 二、不定项选择题(本题包括5小题,每小题4分,共20分) 11.CD 12.A 13.B 14.BC 15.BC 16. (12分) ⑴抑制Fe3+水解(2分)⑵过滤(2分) ⑶H2O2+2Fe2++2H+=2Fe3++2H2O(2分) ⑷取少许氧化后的溶液于试管中,向试管中滴加1-2滴酸性高锰酸钾溶液,紫色不褪去,说明铁元素全部以Fe3+形式存在(3分) ⑸将Al3+转化为AlO2—,分离Fe3+与Al3+(3分) 17. (15分) (1). 羰基、羧基 (2). 还原反应 (3). (4). (以上每空2分) (5). (5分) 18.( 12分) (1)3MnO42-+4H+=MnO2↓+2MnO4-+2H2O (2分) (2)蒸发浓缩、降温结晶(2分) (3)当加入最后一滴标准Na2S2O3溶液时,溶液由蓝色变为无色,且半分钟内不变色。(2分)79%(6分) 19.(13分) (1)SiO2 (2)2Fe2++MnO2+4H+2Fe3++Mn2++2H2O (3)90℃ (4)防止NH4HCO3受热分解,提高原料的利用率 (5)Mn2++2HCO3—=MnCO3↓+CO2↑+H2O (每空2分) ⑹取1-2mL最后一次的洗涤于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白 色沉淀产生,则表明洗涤干净(此空3分) (2)HNO 2?2e?+H2O3H++NO3?(3)①好氧硝化;②Fe2+、Mn2+对该反应有催化作用;(4)①温度升高H2O2分解速率加快;② 2H2O+ClO2-+2SO2=Cl-+2SO42-+4H+(每空2分) 21.(14 分) (1)①AD(2 分)②<(2 分) (2)①1.06 g(2 分)②CO+4OH ??2e ? = CO32? +2H2O(2 分) (3)300℃~400℃(2 分) (4)5×10 ?10mol·L ?1(2 分) (5)a→b(2 分) 安徽省六安市商业干校2012-2013学年高一化学12月月考试题(无 答案) 满分100分 一. 选择题(每小题只有一个选项符合题意,每题3分) 1.下列状态的物质,既能导电又属于电解质的是 ( ) A.MgCl2晶体 B.NaCl溶液 C.液态HCl D.熔融的KOH 2.在无色强酸性溶液中,下列各组离子能够大量共存的是…………..…...…. .( ) A.Cl -、Na+、NO3-、Ca2+; B.NH4+、HCO3-、Cl-、K+; C.K+、Cu2+、Cl-、SO42-; D.NO3-、NH4+、I-、Cl- 3.物理量是量度物理属性或描述物体运动状态及其变化过程的量。下列名词中,哪个名词不属于物理量 A.长度 B.质量C.摩尔 D.时间 4.分类是生活、学习和科学研究中常用的一种方法。下列物质的分类正确的是A.碳酸钠、碳酸钾、碳酸钙、碳酸氢钙都属于可溶性的碳酸盐 B.盐酸、硫酸、硝酸、醋酸都属于含氧酸 C.氢氧化钠、氢氧化钡、氢氧化钾、NH3·H2O都属于一元碱 D.H2、N2、O2、Cl2都属于非金属单质 5.下列说法中正确的是 ( ) A.氨水能够导电,故氨水是电解质 B.硫酸钡难溶于水,但硫酸钡属于强电解质 C.二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质 D.硫酸钠在水中的电离方程式可表示为Na2SO4===2Na++S6++4O2- 6.下列变化一定需要加入还原剂才能实现的 ( ) A.HCO→CO2 B. HCl Cl2 C.FeCl3 FeCl2 D.Mn2+ MnO4- 7.溶液、胶体和浊液这三种分散系的最本质的区别是 A.是否能透过滤纸 B.是否为均一、稳定、透明的外观 C.是否会产生丁达尔效应 D.分散质粒子直径的大小 8.下列物质中,不属于电解质的是 A. NaOH B. H2SO4 C. 蔗糖 D. NaCl 9. 下列各组物质,按化合物、单质、混合物顺序排列的是 A. 烧碱、液态氧、碘酒 B. 生石灰、白磷、熟石灰 C. 干冰、铁、氯化氢 D. 空气、氮气、胆矾 10 在无色透明的酸性溶液中能大量共存的离子组是() A. K+、Cu2+、NO3-、SO42- B. Na+、Ba2+、Cl-、SO42- C. Na+、CO32-、Cl-、NO3- D. Mg2+、K+、Ba2+、Cl- 11.向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中轻缓地加入一块绿豆大小的金属钠,可能观察到的现象符合下图中的( ) 4.下列溶液中,Na+物质的量浓度最大的是 A.1mL 0.5mol·L-1的NaNO3溶液B.100mL 0.01 mol·L-1的N aCl溶液 C.10mL 0.1mol·L-1的NaOH溶液D.100mL 0.1mol·L-1的Na2 SO4溶液 12.量取100mL碘的饱和水溶液,倒入分液漏斗中,然后再注入4mL四氯化碳,用力振荡后静置,实验现象为 A.液体分层,上层为四氯化碳层,黄色 B.液体分层,上层为水层,紫色 C.液体分层,下层为四氯化碳层,紫色 监利县外国语学校2018年秋七年级12月月考 语文试卷 (本卷共23小题;考试时间:120分钟;满分120分命题人:邓俊龙) 友情提示:所有答案必须填写到答题卡相应的位置上。 第一部分积累与运用(28分) 1、下列词语中加点的字注音全都正确的一项是()(2分) A、骸.骨(hái)峰峦.(luán)瘦骨嶙.峋(lín ) B、纳罕.(hǎn)瞬.间(sùn )头晕目眩.(xuàn ) C、辜.负(gū)迸.溅(bèng )仙露琼浆.(jiǎng ) D、伶仃.(dīng)伫.立(zhù)忍俊不禁.(jìn) 2、选出字形有误 ..的一项是()(2分) A、庸碌隐秘茁壮怡然自得 B、凝成迂回训诫心惊肉跳 C、糟蹋骚扰卑微峰围蝶阵 D、宽恕纹理收敛盘虬卧龙 3、下列各句中的加点词语运用不恰当 ...的一项是()(2分) A、一小时后,他终于苦心孤诣 ....地完成了作业。 B、2017年4月20日,四川雅安发生地震后,各级领导翻.来复去 ...地讨论灾区群众的安置和灾后重建。 C、我的心在瘦骨嶙峋 ....的胸腔里咚咚直跳。 D、36岁的邓肯依旧很刻苦的进行练习,无论是投篮还是对抗,他都一丝不苟 ....的对待。 4、下列句子中没有 ..语病的一项是()(2分) A、《我的老师》这篇课文的作者是魏巍写的。 B、山村里,满山遍野到处都是果树。 C、我们讨论了并且听了老红军的报告。 D、每个学生都应该养成上课认真听讲的好习惯。 5、下面对课文的理解错误 ..的一项是()(2分) A、《在山的那边》中“山”与“海”是两个相对的形象,是富有象征意义的。这首诗抒写了童年的向往和困惑,成年的感悟和信念,启示人们要实现远大的理想,必须百折不挠、坚持奋斗。 B、《走一步,再走一步》是过来人的经验之谈,在人生道路上,艰难险阻并不可怕,大困难可以化整为零、化难为易,走一步、再走一步,最终定能战胜一切困难。 C、《蝉》通过写作者对蝉态度的改变,揭示蝉在夏天尽情歌唱的原因是“十七年埋在泥中,出来就活一个夏天”,从而提示我们,不管生命短暂还是长久,都应该积极面对,好好生活。 D、《虽有嘉肴》选自《礼记·学记》。《礼记》是道家经典著作之一,是“五经”之一,相传为西汉戴圣编撰。《学记》是我国最早的一部关于教育、教学活动的论著。 6、名著阅读(2分) 《繁星》《春水》是冰心在印度诗人泰戈尔《》的影响下写成的,用她自己的话说,是将一些“”收集在一个集子里. 7、名句默写(8分) (1)绿树村边合, 。(孟浩然<<过故人庄>>) (2) ,随风直到夜郎西。(李白《闻王昌龄左迁龙标遥有此寄》) 2019年秋季期高三12月月考 文科数学试题 一、选择题:本大题共12小题,每小题5分,共60分. 1.已知集合{ }{ } 2 |20,|3,0x A x x x B y y x =--<==≤,则=B A A .)2,1(- B .)1,2(- C .]1,1(- D .(0,1] 2.若i y i i x 1 )2(- =+(),x y ∈R ,则y x += A .1-B .1 C .3 D .3- 3.在等差数列{}n a 中,37101a a a +-=-,11421a a -=,则=7a A .7B .10C .20D .30 4. 已知变量x 与变量y 之间具有相关关系,并测得如下一组数据 则变量x 与y 之间的线性回归方程可能为( ) A .0.7 2.3y x =- B .0.710.3y x =-+ C .10.30.7y x =-+ D .10.30.7y x =- 5. 已知数列{}n a 满足:11,0n a a =>,() 22* 11n n a a n N +-=∈,那么使5n a <成立的n 的最大值为 ( ) A .4 B .5 C .24 D .25 6. 已知函数()()()2sin 0f x x ω?ω=+>的部分图象如图所示,则函数()f x 的一个单调递增区 间是( ) A .75,1212ππ??- ??? B .7,1212ππ??-- ??? C .,36ππ??- ??? D .1117,1212ππ?? ??? 7. 若01m <<,则( ) A .()()11m m log m log m +>- B .(10)m log m +> C. ()2 11m m ->+ D .()()1 132 11m m ->- 8. 已知一个棱长为2的正方体,被一个平面截后所得几何体的三视图如图所示,则该截面的面积为( ) A . 92 B .4 C. 3 D 9. 若函数()32 4f x x x ax =+--在区间()1,1-内恰有一个极值点,则实数a 的取值范围为( ) A .()1,5 B .[)1,5 C. (]1,5 D .()(),15,-∞?+∞ 10.已知,,,A B C D 是同一球面上的四个点,其中ABC ?是正三角形,AD ⊥平面ABC ,26AD AB ==,则该球的体积为( ) A . B .48π C. 24π D .16π 2019届高三化学12月月考试题 (I) 本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。 注意事项: 1.答题前,考生务必将自己的准考证号、姓名填写在答题卡上,考生要认真核对答题卡上粘贴的条形码的准考证号、姓名与本人准考证号、姓名是否一致。 2.第Ⅰ卷每小题选出答案后用2B铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。第Ⅱ卷用黑色墨水签字笔在答题卡上规定的答题区域内书写作答,超出答题区域书写的答案无效。在试题卷上作答,答案无效。 3.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。 4.保持卡面清洁,不要折叠、弄破、弄皱,不准使用涂改液、修正带、刮纸刀。 5.考试结束后,监考员将试题卷、答题卡一并收回。 可能用到的相对原子质量: H:1 C:12 N:14 O:16 Na:23 Al:27 S:32 Cl:35.5 K:39 Cr:52 Mn:55 Fe:56 Cu:64 Zn:65 第Ⅰ卷(选择题共126分) 本卷共21小题,每小题6分,共126分。 一、选择题:本题共13小题,每小题6分,在每小题给出的四个选项中,只有一项是符合题目要求的。 7. 化学与生产、生活密切相关,下列有关说法中正确的是() A. 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱 B. 铝及其合金广泛应用,是因为铝的性质稳定,不易被腐蚀 C. 塑料的老化是因为其主要成分在空气中发生了缓慢的加成反应 D. 硅太阳能电池利用的是原电池原理 8. 设N A为阿伏加德罗常数的值,下列说法正确的是() A. 1 molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为N A B. 46g分子式为C2H6O的有机物中含有的C-H键的数目为6N A C. 室温时,1.0LpH=13的Ba(OH)2溶液中含有OH的数目为0.1N A D. Fe与水蒸汽反应生成22.4L氢气,转移电子数为2N A 9. Y、Z、M为原子序数依次增大的短周期主族元素。已知,Z的原子最外层只有一个电子;Y 与M同主族,且可形成MY2、MY3两种分子。下列叙述正确的是() A. 简单气态氢化物的稳定性:M>Y B. 铁与M的单质化合生成三价铁化合物 C. 电解Z的氯化物溶液制备Z的单质 D. Z、Y的化合物中阴阳离子数比为1:2 淮南二中2016年高二第一学期第二次月考文科数学试卷 一、选择题(本题共12道小题,每题3分共36分) 1、条件:12p x +>,条件:2 q x ≥,则p 是q 的( ) A .充分非必要条件 B .必要不充分条件 C .充要条件 D .既不充分也不必要的条件 2、下面有三个游戏规则,袋子中分别装有球,从袋中无放回地取球,问其中不公平的游戏是( ) A.游戏1和游戏3 B.游戏1 C.游戏2 D.游戏3 游戏1 游戏2 游戏3 3个黑球和1个白球 1个黑球和1个白球 2个黑球和2个白球 取1个球,再取1个球 取1个球 取1个球,再取1个球 取出的两个球同色→甲胜 取出的球是黑球→甲胜 取出的两个球同色→甲胜 取出的两个球不同色→乙胜 取出的球是白球→乙胜 取出的两个球不同色→乙胜 3、如图程序框图输出的结果为( ) (A ) 511 (B )513 (C )49 (D )6 13 4、总体由编号为01,02,…,19,20的20个个体组成,利用下面的随机数表选取6个个体,选取方法是从随机数表第1行的第5列和第6列数字开始由左到右依次选取两个数字,则选出来的第5个个体的编号为( ) A .11 B .02 C . 05 D .04 7816 6572 0802 6314 0702 4369 1128 0598 3204 9234 4935 8200 3623 4869 6938 7481 5、给出以下四个命题:①若0ab ≤,则0a ≤或0b ≥;②若b a >则22 am bm >;③在△ABC 中,若 B A sin sin =,则A=B;④在一元二次方程2 0ax bx c ++=中,若240b ac -<,则方程有实数根.其 中原命题.逆命题.否命题.逆否命题全都是真命题的有( )个 A.4 B.3 C.2 D.1 6、将参加夏令营的600名学生编号为:001,002,…,600.采用系统抽样方法抽取一个容量为50的样本,且随机抽得的号码为004,这600名学生分住在三个营区.从001到300在第Ⅰ营区,从301到495在第Ⅱ营区,从496到600在第Ⅲ营区.三个营区被抽中的人数依次为( ) A . 24,17,9 B .25,16,9 C . 25,17,8 D . 26,16,8 7 、给出以下三个命题:①将一枚硬币抛掷两次,记事件A:两次都出现正面,事件B:两次都出现反面,则事件A 与事件B 是对立事件;②在命题①中,事件A 与事件B 是互斥事件;③在10件产品中有3件是次品,从中任取3件,记事件A:所取3件中最多有2件是次品,事件B:所取3件中至少有2件是次品,则事件A 与事件B 是互斥事件.其中真命题的个数是( ) A .0 B.1 C. 2 D. 3 8、如图是依据某城市年龄在20岁到45岁的居民上网情况调查而绘制的频率分布直方图,现已知年龄在[30,35),[35,40),[40,45]的上网人数呈递减的等差数列分布,则网民年龄在[35,40)的频率为( ) A .0.04 B .0.06 C .0.2 D .0.3 9、给出以下三幅统计图及四个命题:( ) ①从折线统计图能看出世界人口的变化情况 ②2050年非洲人口大约将达到15亿 ③2050年亚洲人口比其他各洲人口的总和还要多 ④从1957年到2050年各洲中北美洲人口增长速度最慢 A .①② B .①③ C .①④ D .②④ 10、某车间加工零件的数量x 与加工时间y 的统计如下表: 辽宁省本溪市高级中学2016-2017学年高一化学12月月考试题 可能用到的相对原子质量:Ag--108 Na--23 Fe--56 Al--27 Cl--35.5 Cu--64 第Ⅰ卷(选择题 42分) 一?选择题(本大题共 14小题每小题3分,计42分) 1.用N A表示阿伏加德罗常数的值,下列说法正确的是( ) A.标准状况下,22.4L水中含有N A个水分子 B.常温常压下,28g CO中所含的原子数目为2N A C.如果11.2LN2中含有n个分子,则阿伏加德罗常数一定为2n D.1L 1mo1/L的NaHSO4溶液中,HSO4-离子的数目为N A 2.下列实验操作中正确的是() A.蒸馏操作时,应向蒸馏液体中加入几块沸石,以防止暴沸 B.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 C.分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出 D.萃取操作时,可以选用CCl4或酒精作为萃取剂从溴水中萃取溴 3.下列物质的用途错误的是() A.硅是制造太阳能电池的常用材料 B.硅是制取水泥的原料 C.水玻璃可用作木材防火剂 D.二氧化硅是制造光导纤维的材料 4.下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是() A.NaHSO4和Ba(OH)2 B.AlCl3和NaOH C.NaAlO2和H2SO4 D.Na2CO3和H2SO4 5.有Al、CuO、Fe2O3组成的混合物共10.0g,放入250mL某浓度的硫酸溶液中,混合物完全溶解,当再加入125mL 2.00mol/L的NaOH溶液时,得到沉淀物质的量最多.上述硫酸溶液的浓度为()A.0.500 mol/L B.1.00 mol/L C.2.00 mol/L D.3.00 mol/L 6.常温下,下列三个反应均能发生:X2+2W2+═2X﹣+2W3+;Z2+2X﹣═2Z﹣+X2;2W3++2Y﹣═2W2++Y2.则在相同条件下,下列三个反应:①Y2+2X﹣═2Y﹣+X2;②Z2+2Y﹣═2Z﹣+Y2;③2W3++2Z﹣═2W2++Z2也能发生的是() A.只有①B.只有②C.①和②D.②和③ 7.把铁片放入下列溶液中,铁片溶解,溶液质量增加,但没有气体放出的是() 上学期数学12月月考试卷 一、单选题 1. 下列说法正确的是() A . 4的平方根是±2 B . 8的立方根是±2 C . D . 2. 点A(﹣2,3)关于x轴的对称点A′的坐标为() A . (2,﹣3) B . (﹣2,3) C . (﹣2,-3) D . (2,3) 3. 在实数1.732,,,,中,无理数有() A . 1个 B . 2个 C . 3个 D . 4个 4. 若y= 是正比例函数,则m的值为 A . 1 B . -1 C . 1或-1 D . 或- 5. 如图,正方形ABCD的边长为4,点A的坐标为,AB平行于x轴,则点C的坐标为 A . B . C . D . 6. 如图,在直角坐标系中,点A、B的坐标分别为(1,4)和(3,0),点C是y轴上的一个动点,且A、B、C三点不在同一条直线上,当△ABC的周长最小时,点C的坐标是() A . (0,0) B . (0,1) C . (0,2) D . (0,3) 7. 若函数y = ,则当函数值y = 8时,自变量x的值是 A . B . 4 C . 或4 D . 4或 8. 如图,已知等腰△ABC中,AB=AC,∠BAC=120°,AD⊥BC于点D,点P是BA延长线上一点,点O是线段AD上一点,OP=OC,下面的结论:①∠APO+∠DCO=30°;②△OPC是等边三角形;③AC=AO+AP;④S△ABC=S四边形AOCP,其中正确的个数是() A . 1 B . 2 C . 3 D . 4 二、填空题 9. 的立方根是________. 10. 在函数中,自变量x的取值范围是________ 11. 据国家旅游局统计,2017年端午小长假全国各大景点共接待游客约为82600000人次,数据82600000用科学记数法表示为________ 12. 已知点P在第二象限,且到x轴的距离为5,到y轴的距离为3,则点P的坐标为________. 哈六中高三学年12月知识检测 化学试题 本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分,考试用时90分钟。第Ⅰ卷选择题(每小题只有一个选项符合题意,每题2分) 1、化学与人类生产生活、社会可持续发展密切相关,下列说法不正确的是() A.我们熟悉的塑料、合成橡胶和合成纤维这三大合成材料,都主要是以石油、煤和天然气为原料生产的 B.“春蚕到死丝方尽,蜡炬成灰泪始干”其中的“丝”和“泪”化学成分都是蛋白质C.天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源 D.干电池即使不用,放置过久也可能漏液失效,其原因是电解质溶液NH4Cl显酸性和外壳锌反应 2、下列应用不涉及物质氧化性或还原性的是() A.用葡萄糖制镜或保温瓶胆B.用ClO2杀菌、消毒 C.用Na2SiO3溶液制备木材防火剂D.用浸泡过高锰酸钾溶液的硅藻土保鲜水果 3、阿伏加德罗常数的值为N A。下列说法不正确的是( ) A. 1LPH=3的盐酸与1L PH=3的CH3COOH溶液中,水电离出的H+数目均为10-3N A B. 0.1mol乙烯与乙醇的混合物完全燃烧所消耗的氧分子数为0.3 N A C.标准状况下,2.24LN2和O2的混合气体中分子数为0.1N A D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数等于0.2mol 4、SO2通入不同溶液中实验现象,所得结论不正确的是( ) 实验现象结论 A含HCl、BaCl2的FeCl3溶液产生白色沉淀SO2有还原性 B H2S溶液产生黄色沉淀SO2有氧化性 C酸性KMnO4溶液紫色溶液褪色SO2有漂白性 D Na2SiO3溶液产生胶状沉淀酸性:H2SO3>H2SiO3 5、正确表示下列反应离子方程式是() A.浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑ B.钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+ 江苏省扬州中学2020-2021学年高二上学期12月月 考数学试题 学校_________ 班级__________ 姓名__________ 学号__________ 一、单选题 1. 下列命题为真命题的是( ) A.,使B.,有 C.,有D.,有 2. 已知双曲线的离心率为,则实数的值为() C.D. A.B. 3. 平行六面体中,,, ,则对角线的长为() A.B.12 C.D.13 4. 已知双曲线右支上一点到右焦点的距离为,则该点到左准线的距离为() A.B.C.D. 5. 若直线过抛物线的焦点,与抛物线相交于两点,且,则线段的中点到轴的距离为() A.B.C.D. 6. 北京天坛的圜丘坛为古代祭天的场所,分上、中、下三层,上层中心有一块圆形石板(称为天心石),环绕天心石砌9块扇面形石板构成第一环,向外每环依次增加9块,下一层的第一环比上一层的最后一环多9块,向外每环依次也增加9块,已知每层环数相同,且下层比中层多729块,则三层共有扇面形石 板(不含天心石)() A.3699块B.3474块C.3402块D.3339块 7. 数列是等比数列,公比为,且.则“”是 “”的() A.充分不必要条件B.必要不充分条件 C.充要条件D.既不充分又不必要条件 8. 关于的不等式恰有2个整数解,则实数的取值范围是() A.B. C.D. 二、多选题 9. 已知数列,则前六项适合的通项公式为() A. B. D. C. 10. 已知命题不存在过点的直线与椭圆相切.则命题是真命题的一个充分不必要条件是() A.B.C.D. 11. 下列条件中,使点与三点一定共面的是() A.B. C.D. 12. 以下命题正确的是() A.直线l的方向向量为,直线m的方向向量,则 B.直线l的方向向量,平面的法向量,则 C.两个不同平面,的法向量分别为,,则 D.平面经过三点,,,向量是平面的法向量,则 三、填空题 13. 以为一个焦点,渐近线是的双曲线方程是_____________ 14. 已知正实数满足,则的最大值为_________ 15. 已知正方体中,是的中点,直线与平面所成角的正弦值为_____________ 四、双空题 16. 数列满足:其中为数列的前项 和,则_______,若不等式对恒成立,则实数的最小值为_____. 五、解答题 高中化学学习材料 (精心收集**整理制作) 东莞市常平中学高一年级12月月考化学试题 本试卷满分为100分。考试时间60分钟。2010-12-23 第一部分选择题(共54分) 一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意) 1、铝合金在日常生活、建筑装潢、航空航天和汽车制造等方面均有着广泛的用途。下列关于铝合金 具有广泛用途的分析不正确的是 A.铝元素在地壳中的含量高,储量丰富B.铝容易形成致密的氧化膜,抗腐蚀性能好C.铝化学性质稳定,常温下不与任何酸碱反应D.铝的冶炼技术基本成熟,可以大量生产2.硅被誉为无机非金属材料的主角,下列物品用到硅单质的是 A.陶瓷餐具B.石英钟表C.计算机芯片D.光导纤维 3.下列变化过程属于物理变化的是 A.活性炭使红墨水褪色B.雷雨天氮气与氧气化合 C.氨气溶于水D.酸雨侵蚀建筑物 4.下列情况会对人体健康造成较大危害的是 A.用小苏打(NaHCO3)发酵面团制作馒头B.用食醋清洗热水瓶胆内壁附着的水垢 C.用Al(OH)3治疗胃酸过多D.用SO2加工食品使食品增白 5.黑火药是由硫黄粉、硝酸钾和木炭按一定比例混合而成的,爆炸时的反应是:S+2KNO3+3C =K2S+N2+3CO2,该反应的还原剂是() A.C B.S C.KNO3D.S和KNO3 6.汽车排放尾气中含有氮的氧化物而污染大气,产生氮的氧化物的主要原因是A.燃烧含氮化合物燃料引起的B.燃烧含铅化合物引起的 C.由于燃烧不充分引起的D.在气缸中氮气被氧化生成的 7.铁和铁合金是生活中常见的材料,下列说法正确的是 A.铁与盐酸反应,铁合金不与盐酸反应B.一定条件下,铁粉可与水蒸气反应 C.不锈钢是铁合金,只含金属元素D.纯铁的硬度和熔点均高于铁合金 8.氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于区域3的是 A.4Fe(0H)2+O2+2H2O 4Fe(OH)3 B.2NaHCO3Na2CO3+H2 O+CO2↑ C.4NH3+5O24NO+6H2O D.Zn+H SO4ZnSO4+H2↑ 9、类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是( ) 已知类推 A 将Fe加入CuSO4溶液中将Na加入到CuSO4溶液中 双鸭山市第一中学2016-2017学年度高三上学期 数学(文)第二次月考考试题 (时间120分钟,150分) 一.选择题.(每题5分,共12道,共计60分) 1.已知集合{} 2log 2<=x x A ,{} R x y y B x ∈+==,23,则A B = ( ) A .(1,4) B .(2,4) C .(1,2) D .),1(+∞ 2.在复平面内,复数i i z += 1(i 是虚数单位)对应的点位于( ) A.第一象限 B. 第二象限 C. 第三象限 D. 第四象限 3. 将函数)6 2sin(π + =x y 的图象向右平移 6 π 个单位,再纵坐标不变,横坐标变为原来的2倍,所得新图象的函数解析式是( ) A.x y 4sin = B.x y sin = C.)6 4sin(π - =x y D. )6 sin(π - =x y 4.已知()f x 是定义在R 上的奇函数,当0x >时,2()log f x x =,则(8)f -值为( ) A.3- B. 13 C.1 3 - D.3 5.下表提供了某厂节能降耗技术改造后在生产A 产品过程中记录的产量x (吨)与相应的 生产能耗y (吨)的几组对应数据,根据下表提供的数据,求出y 关于x 的线性回归方程 为0.70.35y x ∧ =+,则下列结论错误的是 ( ) x 3 4 5 6 y 2.5 t 4 4.5 A .线性回归直线一定过点(4.5,3.5) B .产品的生产能耗与产量呈正相关 C .t 的取值是 3.15 D .A 产品每多生产1吨,则相应的生产能耗约增加0.7吨 6.已知{} n a 为等比数列,472a a +=,568a a =-,则110a a +=( ) A.7 B. 5 C. -7 D.-5 河南省郑州智林学校2015届高三12月月考化学试题 一.选择题(共20题,每题3分共60分,每题只有一个选项正确) 1.用下列实验装置进行相应实验,能达到实验目的的是 A.用图1所示装置从Fe(OH)3胶体中过滤出Fe(OH)3胶粒 B.用图2所示装置蒸发掉CuCl2溶液中部分水制得CuCl2·2H20晶体 C.用图3所示装置从CH3OH与C2H5OH的混合物中分离出乙醇 D.用图4所示装置从C2H5OH与C2H5OOCCH3的混合物中分离出乙酸乙酯 2.下列关于甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是 A.甲装置:可用证明硫的非金属性比硅强 B.乙装置:橡皮管的作用是能使水顺利流下 C.丙装置:用图示的方法能检查此装置的气密性 D.丁装置:可在瓶中先装入某种液体收集NO气体 3.下列说法正确的是() A.SO2和NO2都是酸性氧化物,都能与水反应生成酸 B.Na20和Na202组成元素相同,与CO2反应产物也完全相同 C.Al203和Na20按物质的量比1:1投人水中可得到澄清溶液 D.金属铝排在金属活动性顺序表中氢元素的前面,铝与强酸反应一定放出氢气4.下列说法正确的是() A.将NaH溶于水,得到的水溶液能导电说明NaH是离子化合物 B.Fe(OH)3胶体和Fe(OH)3沉淀的化学性质不相同 C.乙醇分子中含羟基,可与金属钠反应生成氢气 D.Mn02具有较强氧化性,可作为H202分解反应的氧化剂 5 .下列实验“操作和现象”与“结论”都正确的是 6.下列有关说法体现了化学与生产、生活、社会的密切关系。其中不正确的是() A.绚丽缤纷的烟花中添加了含钾、钠、钙、铜等金属元素的化合物 B.为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰 C.停车场安装催化光反应设施,可使汽车尾气中的CO和NO X反应生成无毒气体 D.氮化硅陶瓷、氧化铝陶瓷、光导纤维等属于新型无机非金属材料 7.下列说法不正确的是() A.非金属气态氧化物都不是电解质 B SO2、NO2、C02都会导致酸雨的形成 C.氮的氧化物都属于大气污染物 D. Si、S的氧化物均属于酸性氧化物 8.某溶液中含有的溶质是FeBr2、Fel2,若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,溶液变为红色,则下列叙述正确的是() ①原溶液中的Br一一定被氧化②通入氯气之后原溶液中的Fe2+一定有部分或全部被氧化③不能确定通入氯气后的溶液中是否存在Fe2+④若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgN03溶液,只产生白色沉淀,说明原溶液中的I一、Fe2+、Br 一均被完全氧化 ( ) A.①②③ B.②③④ C.①③④ D.①②③④ 9.酸雨的主要成分是H2SO4,以下是形成途径之一:①NO2+SO2=NO+S03,②2NO+02=2NO2,③S03+H2O=H2S04,以下叙述错误的是 ( ) A.NO2由反应生成 B.总反应可表示为 C.还可能发生的反应有 D.还可能发生的反应有 10.在1 L HNO3和H2S04的混合溶液中,两种酸的物质的量浓度之和为O.6 mol/l,向该溶液中加入足量铜粉,加热,充分反应,当HNO3与H2S04的物质的量比为x:y 时所得溶液中Cu2+物质的量浓度最大,则x:y为() A.2:3 B.3:8 C.1:4 D.11 11.下列表述正确的是() A.水溶液中NaHCO3的电离方程式:NaHCO3=== Na++H++CO32- B.HCO3-水解的离子方程式:HCO3-+H2O CO32-+H3O+ C.BaSO4的溶解平衡表达式:BaSO4(s)Ba2+(aq)+SO42-(aq) D.氯气与水反应的化学平衡常数: 12.已知:25 ℃,K sp =3.2×10-11,则此温度下M(OH)2饱和溶液的pH 等于() A.10 B.10+lg2 C.10+2×lg2 D.10-2×lg2 13.下列有关水电离情况的说法正确的是 A.25℃,pH=12的烧碱溶液与纯碱溶液,水的电离程度相同 B.其它条件不变,稀释醋酸钠溶液,水的电离程度增大 C.其它条件不变,稀释氢氧化钠溶液,水的电离程度减小 D.其它条件不变,温度升高,水的电离程度增大,Kw增大 14.下图所示的实验,能达到实验目的的是() 辽宁省凤城一中2017-2018学年高二数学12月月考试题 理 1抛物线2 y ax =的准线方程是1y =-,则的值为 ( ) A. B. 14 C. D.12 2 .已知命题00:,sin p x x ?∈=R x ,y∈R,若x+y≠2017,则x≠1000或y≠1017”,则下列结论正确的是( ) A .命题p q ∨是假命题 B .命题p q ∧是真命题 C .命题()()p q ?∨?是真命题 D .命题()()p q ?∧?是真命题 3、若1>a ,则1 1-+ a a 的最小值是( ) A .2 B . C .3 D. 1 2 -a a 4.如图,空间四边形OABC 中,,,OA a OB b OC c ===.点 在上,且2OM MA =,点为BC 的中点,则MN 等( ) A. 121232a b c -+ B.211322a b c -++ C.111222a b c +- D.221332 a b c +- 5、已知点12F F ,为椭圆22 1925 x y +=的两个焦点,过的直线交椭圆于 A B ,两点,且8AB =,则22AF BF +=( ) A .20 B .18 C .12 D .10 6、若直线l 被圆x 2 +y 2 =4所截得的弦长为32,则l 与曲线1y 3 x 22 =+的公共点个数为 A.1个 B.2个 C.1个或2个 D.1个或0个 7、设n S 是数列 {}n a ()n N + ∈的前项和,2n ≥时点1(,2)n n a a -在直线21y x =+上,且 {}n a 的首项是二次函数2 23y x x =-+的最小值,则9S 的值为( ) A . B . C . D . 8、已知方程1322 2 2=--+n m y n m x 表示双曲线,且该双曲线两焦点间的距离为4, 则n 的取值范围是 A.(-1,3) B.(-1,) C.(0,3) D.(0,) 9、设等比数列{}n a 的公比为,其前项之积为,并且满足条件:11a >,201620171a a >, 通渭县榜罗中学九年级语文第二次月考试卷 学号:姓名:成绩: 一、古诗词名句填写(共8分) 1、过尽千帆皆不是,。(温庭钧《望江南》) 2、今夜偏知春气暖,。(刘方平《月夜》) 3、力尽不知热,。(白居易《观刈麦》) 4、《渔家傲·秋思》中表现将士壮志难酬、怀念故乡之情的词句是_____ ___,_ _________。 5、由王维《使至寒上》中的名句“大漠孤烟直,长河落日圆”,可以使人联想到范仲淹《渔家傲》中同是写边塞景象的词句:__________,______________________。 6、《武陵春》中与“问君能有几多愁,恰似一江春水向东流”有异曲同工之妙的句子是 ,。 7、《江城子密州出猎》中表达作者报效国家,抵御入侵者,建功立业的决心的诗句是, ,。 8、一个国家都要不断学习,学别国的的科学技术、先进理念,来提升自己。《诗经》中早就有“他山之石,”之说。 二、语言基础和语文实践活动(共23 分) 9、将下面的句子抄写在方格中,要求:正确、规范、美观。(2分) 清水出芙蓉,天然去雕饰。 10、根据提示,将对应的汉字按顺序写在下面的横线上。( 3 分) (1)再接再lì()——指公鸡相斗,每次交锋以前先磨一下嘴。比喻继续努力,再加一把劲。 (2)指桑骂huái()——指着桑树骂槐树。比喻表面上骂这个人,实际上是骂那个人。(3)邯dān ()学步——比喻模仿人不到家,反把原来自己会的东西忘了。(4)囊 yíng ()映雪——表示彼此互相欺骗。 (5)心无旁wù()——形容心思集中,专心致志。 (6)东施效 pín()——比喻盲目模仿,效果很坏。 11、下列加点字注音完全正确的一项是()(2分) A. 静谧.(mì) 峰峦.(nuán) 骸.(hái)骨锲而不舍.(qiè) B. 收敛.liǎn)菡萏.(dàn)叱咤chà)毛骨悚.然(sǒng) C. 门楣.(méi) 糍粑.(bā)蝉蜕.(tuì)吹毛求疵.(cī) D. 砭骨(biān)鲑.鱼(guì)倜傥.(tǎng)销声匿.迹(nì) 12、下列句中标点符号使用正确的一句是()( 2分) A.人的一生,总是在不停地尝试,尝试拥有,尝试放弃;人的一生,又始终在不断地追求,追求自由,追求幸福。 2019届高三数学上学期12月月考试题理 本试卷分第1 卷(选择题)和第 2 卷(非选择题)两部分,满分150 分.考试时间120 分钟. 一、选择题:本大题共12 小题,每小题5 分,共60 分,在每小题给出的四个选项中,只有一项是符合题目要求的. 3.向量 a (m,1) , b1, m,则“m1”是“a/ /b ”的( ) A.充分不必要条件 B.必要不充分条件 C.充要条件 D.非充分又非必要条件 8.设随机变量N (2, 2 ) ,若P(a) 0.3 ,则P( 4 a) 等于( ) A.0.4 B.0.5 C.0.6 D.0.7 10. 我国古代有着辉煌的数学研究成果.《周髀算经》、《九章算术》、《海岛算经》、《孙子算经》、…、《辑古算经》等 部专著,有着十分丰富多彩的内容,是了解我国古代数学的重要文献.这部专著中有部产生于魏晋南北朝时期.某中学拟从这部名著中选择部作为“数学文化”校本课程学习内容,则所选部专著中至少有一部是魏晋南北朝时期专著的概率为() 第2 卷(非选择题) 本卷包括必考题和选考题两部分,第13 题--第21 题为必考题,每个试题考生都必须回答. 第 22 题-第 23 题为选考题,考生根据要求做答. 二、填空题:本大题共4 小题,每小题 5 分,共 20 分. 15.《聊斋志异》中有这样一首诗:“挑水砍柴不堪苦,请归但求穿墙术. 得诀自诩无所阻,额上 坟起终不悟.” 在这里,我们称形如以下形式的等式具有“穿墙术”: 三、解答题:解答应写出文字说明,证明过程或演算步骤. 18.随着经济模式的改变,微商和电商已成为当今城乡一种新型的购销平台.已知经销某种商品的电商在任何一个销售季度内,每售出1 吨该商品可获利润0.5 万元,未售出的商品,每1 吨亏损 0.3 万元.根据往年的销售经验,得到一个销售季度内市场需求量的频率分布直方图如图所示.已知电商为下一个销售季度筹备了 130 吨该商品.现以x(单位:吨,)表示下一个销售季度的市场需求量,T (单位:万元)表示该电商下一个销售季度内经销该商品获得的利润. 2020届高三化学12月月考试题 可能用到有相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5 K-39 Ca-40 Mn-55 Fe-56 Cu-64 Ba-137 一、选择题 7.化学与日常生活密切相关,下列说法正确的是() A. 氨气易液化,液氨常用作制冷剂 B. 二氧化硫是一种常见的漂白剂,常用于加工食品使食品增白 C. 燃料电池是一种高效、环境友好的发电装置,其能量转化率可达100% D. 常温下,铁与浓硫酸不反应,常用铁质容器盛放浓硫酸 8.下列说法不正确的是() A. 无机物与有机物之间不可能存在同分异构现象 B. 乙烯能使溴水、酸性KMnO4溶液褪色,其反应原理不相同 C. 福尔马林能使蛋白质发生变性,可用浸制动物标本 D. 分子式为C4H10O的有机物与金属Na反应的同分异构体有4种 9.下列事实能用勒夏特列原理解释的是() A. 工业上N2与H2合成NH3,往往需要使用催化剂 B. 向1.50mol/L的硝酸铵溶液中加入少量氨水至中性,水的电离程度减小 C. 密闭容器中2molCO与1molH2O(g)充分反应达平衡后,增大压强CO的反应速率加快 D.SO2与O2催化氧化成SO3是一个放热过程,450℃左右的温度比室温更有利于SO3生成 10.下列实验操作规范且能达到目的是() ZX;Y、M同主族,可形成MY2、MY3两种分子;Y、G的单质或两元素之间形成的化合物可作水消毒剂。下列叙述正确的是() A. 元素M的氧化物对应的水化物酸性比G的氧化物对应的水化物酸性弱 B. 化合物Z2M、MY2中化学键的类型相同 C. ZX与水的反应属于氧化还原反应 新津县二中2019-2020学年上学期高二数学12月月考试题含解析 班级__________ 姓名__________ 分数__________ 一、选择题 1. 已知△ABC 的周长为20,且顶点B (0,﹣4),C (0,4),则顶点A 的轨迹方程是( ) A .(x ≠0) B .(x ≠0) C .(x ≠0) D .(x ≠0) 2. 已知实数a ,b ,c 满足不等式0<a <b <c <1,且M=2a ,N=5﹣b ,P=()c ,则M 、N 、P 的大小关系为( ) A .M >N >P B .P <M <N C .N >P >M 3. 已知双曲线kx 2﹣y 2=1(k >0)的一条渐近线与直线2x+y ﹣3=0垂直,则双曲线的离心率是( ) A . B . C .4 D . 4. 直线l 将圆x 2+y 2﹣2x+4y=0平分,且在两坐标轴上的截距相等,则直线l 的方程是( ) A .x ﹣y+1=0,2x ﹣y=0 B .x ﹣y ﹣1=0,x ﹣2y=0 C .x+y+1=0,2x+y=0 D .x ﹣y+1=0,x+2y=0 5. 设函数()()() 21ln 31f x g x ax x ==-+,,若对任意1[0)x ∈+∞,,都存在2x ∈R ,使得()()12f x f x =,则实数的最大值为( ) A . 94 B . C.9 2 D .4 6. 已知向量与的夹角为60°,||=2,||=6,则2﹣在方向上的投影为( ) A .1 B .2 C .3 D .4 7. 如果集合 ,A B ,同时满足{}{}{}{}1,2,3,41,1,1A B B A B =≠≠,A =,就称有 序集对 (),A B 为“ 好集对”. 这里有序集对(),A B 是指当A B ≠时,(),A B 和(),B A 是不同的 集对, 那么 “好集对” 一共有( )个 A .个 B .个 C .个 D .个 【人教版】高一化学12月月考试卷 可能用到的相对原子质量:H-1 C-12 O-16 Al-27 Cl-35.5 Fe-56 Cu-64 选择题(共50分) 一、单项选择题 (本题包括15小题,每题2分,共30分) 1. 化学在资源利用、环境保护等与社会可持续发展密切相关的领域发挥着积极作用。下列做法与社会可持续发展理念相违背的是 A. 回收利用废旧金属 B. 加强植树造林,增大绿化面积 C. 大力开发不可再生资源 D. 改进汽车尾气净化技术 2. 下列有关化学用语表示正确的是 A. 中子数为10的氧原子:O B.电离方程式NH 3·H 2O =NH 4++ OH -C. Mg 2+的结构示意图: D. 电离方程式:Ca(OH)2=Ca 2+ +(OH)3. 除去镁粉中少量的铝粉,最适宜的试剂是 A. 氨水 B. AgNO 3溶液 C. NaOH 溶液 D. 盐酸4. 硅是带来人类文明的重要元素之一。下列物质中主要成分是硅酸盐的是 A. 陶瓷 B. 金刚石 C. 光导纤维 D. 大理石 5. 下列各种冶炼方法中,可制得相应金属的为 A. 高温分解碳酸钙 B. 电解熔融氯化镁 C. 氧化铝和焦炭混合加热 D. 电解饱和食盐水 6. 下列关于SO 2的说法中,不正确的是 A. SO 2能使品红溶液褪色,是因为SO 2具有漂白性B. SO 2在空气中极易被氧化为SO 3 C. SO 2通入Na 2SO 3、NaHCO 3 溶液中均能发生反应 D. SO 2是形成酸雨的大气污染物之一,主要是化石燃料的燃烧和工厂排放的废气 7. 下列变化中,必须加入氧化剂才能发生的是 A. SO 2→S B. Cl 2→HClO C. Fe 2+→Fe 3+ D. HCO 3-→CO 3 2-8.下列反应中,水只作还原剂的是 A .2H 2O ══电解2H 2↑+ O 2↑ B .2Na+ 2H 2O=2NaOH + H 2↑ C .2F 2+ 2H 2O = 4HF + O 2 D .Na 2O + H 2O = 2NaOH 9. 下列有关Na 2CO 3和NaHCO 3的性质说法正确的是 A. 右图所示装置可证明稳定性:Na 2CO 3>NaHCO 3 B. 用澄清石灰水可鉴别Na 2CO 3溶液和NaHCO 3溶液 C. 溶解度:Na 2CO 3>NaHCO 3 D. 等质量的Na 2CO 3和NaHCO 3分别与过量盐酸反应,放CO 2质量相同 10. 设N A 为阿伏加徳罗常数的值,下列说法正确的是 A. 常温常压下,16gO 3含氧原子数为N A B. 7.1gCl 2与足量NaOH 反应转移的电子数为0.2N A C. 足量的Fe 与1mol 氯气充分反应,转移的电子数为0.3N A安徽省六安市-高一化学12月月考试题(无答案)
2017年人教版七年级语文12月月考测试题及答案
高三数学12月月考试题 文 新人教版新版
高三化学12月月考试题 (I)
高二数学12月月考试题 文1
高一化学12月月考试题13
上学期数学12月月考试卷真题
黑龙江省xx市第六中学201X届高三化学12月月考试题
江苏省扬州中学2020-2021学年高二上学期12月月考数学试题
【重点推荐】人教版高中化学必修一高一年级12月月考化学试题
高三数学12月月考试题 文8
河南省郑州智林学校2015届高三12月月考化学试题
高二数学12月月考试题理(1)
人教版语文(12月)月考试题
高三数学上学期12月月考试题理
2020届高三化学12月月考试题
新津县二中2019-2020学年上学期高二数学12月月考试题含解析
【人教版】高一化学上学期12月月考试卷(有答案)
