疟原虫形态图谱

原虫形态
期间日疟原虫恶性疟原虫三日疟原虫
环状体胞质淡蓝色,环状,约为
红细胞直径的1/3;核1
个偶有2个;红细胞内
通常寄生1个原虫
环纤细,约为红细胞走
私的1/5,核1-2个,红细
胞内常寄生2个或多个
原虫,虫体位于红细胞
边缘.
与间日疟原虫相似
大滋养
体
核1个,胞质有伪足伸
出,空泡明显,形状不规
则;疟色素棕黄色,细小
杆状分散于胞质内
一般不出现在外周血,
集中于内脏毛细血管,
体小,圆形胞质深蓝,疟
色素黑褐色,块状.
核黄素1个,胞质深蓝,
圆形或带状,疟色素棕
褐色,颗粒状
成熟裂
殖体
虫体充满红细胞,裂殖
子12-24个通常16个,
排列不规则,疟色素集
中成堆
外周血不易见.
裂殖子8-36个,排列不
规则,疟色素集中成一
团
裂殖子较大,6-12个,多
为8个,排列为菊花状,
疟色素集中在中央.
雌配子
体
虫体圆形,胞质深蓝色,
核小,致密,深红色,偏向
一侧,疟色素分散
新月形,两端尖,胞质深
蓝色,核致密深红色位
于中央,疟色素黑褐色
分布核周围
与间日疟相似,虫体较
小
雄配子
体
虫体圆形,胞质蓝,略带
红色,核大疏松,淡红色,
位于中央,疟色素分散
腊肠形,两端印圆,胞质
蓝而略带红色,核疏松
淡红色,位于中央,疟色
素黄棕色分布核周围
与间日疟相似,虫体较
小
被寄生
的红细
胞变化
除环状体外,其余各期
均胀大,色变淡,并有鲜
红色细小数多的薛色
点
正常或略缩小,可有几
颗粗大,紫红色茂氏点
正常或略缩小,颜色无
改变,偶见淡紫色纤细
的西氏点
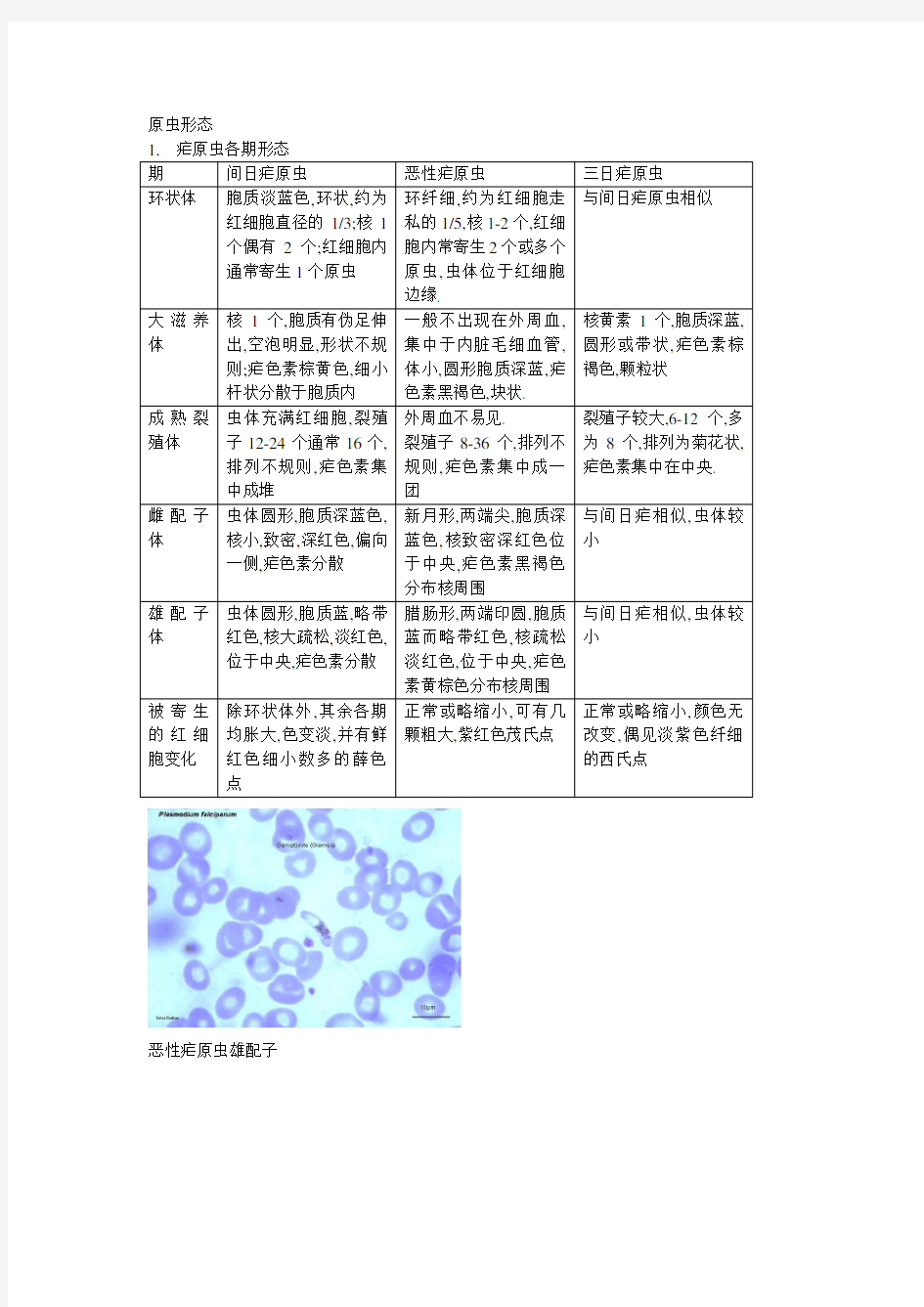
恶性疟原虫雄配子
恶性疟原虫滋养体
间日疟裂殖体和孢子体
间日疟滋养体
卵圆疟滋养体
三日疟裂殖体和配子体
三日疟滋养体
人体疟原虫红内期形态
人体疟原虫红内期形态 涂制于玻片上的红内期疟原虫,经吉氏染色后核呈红色,胞质呈蓝色,疟色素呈黄褐色或深褐色,不着色部分为空泡。 一、薄血膜中疟原虫形态 薄血膜涂制均匀时疟原虫着色良好,结构清晰,便于观察形态和鉴别虫种。薄血膜上各期红内期疟原虫的形态见表1。 表1 薄血膜4种疟原虫形态(吉氏染剂染色) 间日疟原虫恶性疟原虫三日疟原虫卵形疟原虫 被寄生红细胞大小 形状 颜色 斑点 胀大 褪色 薛氏点,红色,细 小数多 正常 正常或稍紫 茂氏点,红色, 粗大数少 正常或缩小 正常 齐氏点淡红色, 微细 正常或稍胀大 卵圆形或边缘呈伞矢状 褪色 薛氏点,粗大数多 早期滋养体(环状体) 大小 核 胞质 色素 较大,约占红细胞 直径的1/3 1个 较薄 无 较小,约占 红细胞直径的1/6 1或2个 纤细 无 中等 1个 较粗厚 偶见细小褐色颗粒 中等 1个 较粗厚 无 大滋养体大小 核 胞质 色素 较大 1个 阿米巴样,常含空泡 黄褐色,细小,杆状, 散在分布 较小 1或2个 圆形,空泡不显著 黄褐色,细小,结成 团块后,呈黑褐色 较小 1个 带状,空泡不显著 深褐色,粗大,沿边 缘分布 较小 1个 圆形,空泡不显著 棕黄色,较粗大 未成熟裂殖体大小 核 胞质 色素 较大 2个以上 圆形或不规则,空泡 消失 黄褐色,分布不匀 较小 2个以上 圆形,空泡消失 黑褐色团块状 较小 2个以上 圆形,空泡消失 深褐色,分布不匀 较小 2个以上 圆形或卵圆形,空泡 消失 棕黄色,分布不匀 成熟裂殖体 大小 裂殖子 色素 大于正常红细胞 12~24个,常为16~18 个,排列不规则,较大 黄褐色,常聚集一侧 小于正常红细胞 8~32个,常为8~18 个,排列不规则,较小 黑褐色团块 小于正常红细胞 6~12个,常为8个, 常排列如菊花状, 较大 深褐色,常聚集中央 小于正常红细胞 6~12个,常为8个, 排列不规则,较大 棕黄色,聚集中央或一 侧
疟原虫形态图谱
原虫形态 期间日疟原虫恶性疟原虫三日疟原虫 环状体胞质淡蓝色,环状,约为 红细胞直径的1/3;核1 个偶有2个;红细胞内 通常寄生1个原虫 环纤细,约为红细胞走 私的1/5,核1-2个,红细 胞内常寄生2个或多个 原虫,虫体位于红细胞 边缘. 与间日疟原虫相似 大滋养 体 核1个,胞质有伪足伸 出,空泡明显,形状不规 则;疟色素棕黄色,细小 杆状分散于胞质内 一般不出现在外周血, 集中于内脏毛细血管, 体小,圆形胞质深蓝,疟 色素黑褐色,块状. 核黄素1个,胞质深蓝, 圆形或带状,疟色素棕 褐色,颗粒状 成熟裂 殖体 虫体充满红细胞,裂殖 子12-24个通常16个, 排列不规则,疟色素集 中成堆 外周血不易见. 裂殖子8-36个,排列不 规则,疟色素集中成一 团 裂殖子较大,6-12个,多 为8个,排列为菊花状, 疟色素集中在中央. 雌配子 体 虫体圆形,胞质深蓝色, 核小,致密,深红色,偏向 一侧,疟色素分散 新月形,两端尖,胞质深 蓝色,核致密深红色位 于中央,疟色素黑褐色 分布核周围 与间日疟相似,虫体较 小 雄配子 体 虫体圆形,胞质蓝,略带 红色,核大疏松,淡红色, 位于中央,疟色素分散 腊肠形,两端印圆,胞质 蓝而略带红色,核疏松 淡红色,位于中央,疟色 素黄棕色分布核周围 与间日疟相似,虫体较 小 被寄生 的红细 胞变化 除环状体外,其余各期 均胀大,色变淡,并有鲜 红色细小数多的薛色 点 正常或略缩小,可有几 颗粗大,紫红色茂氏点 正常或略缩小,颜色无 改变,偶见淡紫色纤细 的西氏点 恶性疟原虫雄配子
恶性疟原虫滋养体 间日疟裂殖体和孢子体 间日疟滋养体 卵圆疟滋养体 三日疟裂殖体和配子体 三日疟滋养体
蛋白质组学技术与药物作用新靶点研究进展
蛋白质组学技术与药物作用新靶点研究进展 [关键词]:蛋白质组学,新药发现,药物作用靶点,研究进展 药物开发是一个漫长的过程,包括以下步骤:样品制备、新化学实体的发现、靶的探测与验证、先导物选择、小分子筛选和优化以及临床前、临床试验研究等。其中药物作用靶点的探测与验证是新药发现阶段中的重点和难点,成为制约新药开发速度的瓶颈。基因组学研究表明,人体中全部药靶蛋白为1万~2万种,而在过去100年中发现的靶点,仅约有500种。因此,自1994年Wilkins等提出蛋白质组(pro- teome)和蛋白质组学(proteormcs)概念后,就迅速引起广大研究者和制药公司的兴趣和投资。近几年来,蛋白质组学技术和研究思路都有了令人鼓舞的进展,新技术的出现和发展,如多维色质联用(multidimensional liquid chromatography and tan- dem mass spectrometry, MudLC-MS/MS)、表面增强激光解吸离子化-蛋白质芯片系统(surface enhanced laser desorption ion- ization-proteinchip, SELDI-ProteinChip)、同位素亲和标签(iso- tope-coded affinity tags, ICAT)、胶上差示电泳(differential in- gel electrophoresis, DIGE)等技术,弥补了普通双向电泳上样量和检测极限的局限,自动化、特异性和重复性都得到了加强。 蛋白质组学是研究疾病发生过程中蛋白质变化、生化代谢途径改变和鉴定的有力工具。在药物开发中的作用主要表现在疾病检测、药物靶点发现、药物代谢转化、药物不良反应研究等方面。通过比较正常体与病变体、给药前后蛋白质谱的变化,蛋白质组学技术可提供疾病发生、药物作用和药物不良反应的分子机制信息。通过蛋白质组学鉴定的特异生物标记可作为排查药物的功效、抗性和优选。因此,蛋白质组学在药物研究开发中的各个方面得到了细化,如化学蛋白质组学(chemical proteomics),拓扑蛋白质组学(topological proteomics),临床蛋白质组学(clinical proteomics),毒性蛋白质组学(toxicoproteomics)和药物蛋白质组学(phamiaco- proteormcs),这些“亚蛋白质组学”技术的发展,与基因组学结合,将对药物靶标验正和药物开发引起重大变革。笔者就蛋白质组学及相关技术在药物作用靶 点的探测和验证方面的应用作一概述。 1药靶的探测 与药物作用相关的靶或蛋白质主要有3类:①疾病相关(特异性)蛋白质;②生物标记分子;③信号传导分子。蛋白质组学探测药物作用相关靶点的基本策略是蛋白质 组的比较,即健康与病变组织、细胞或体液(如血清、脊髓液、尿液和气管呼出物等)的蛋白质表达谱差异和表达量变化。蛋白质组学已成功用于肿瘤、糖尿病、艾滋病、关节炎等多种疾病相关蛋白或标记蛋白的检测,成为疾病诊断、监测、治疗的有力工具。例如丹麦人类基因组研究中心Julio Celis实验室从膀胱鳞片状细胞癌(SCC)患者的尿液中分离鉴定了一个生物标记—牛皮癣素(psoriasin),免疫组织化学分析表明该蛋白质在正常人的泌尿系统中不存在,因而成为临床检测膀胱鳞片状细胞癌的标记蛋白。 给药前后蛋白质组比较,是比较蛋白质组学的另一个重要内容,是探测新靶蛋白,深入了解药物作用机制,评价药物不良反应,更合理地设计药物的一个新途径。Chen等利用这个方法,找到了抗MCF-7人乳腺癌药物阿霉素的一个作用靶—Hsp27。 类似的方法也用于探测信号传导途径中 的药物作用靶。信号级联放大系统中信号的传递一般与蛋白质磷酸化/去磷酸化密切 相关。通过合适的预分离技术,如亚细胞蛋白质组制备或用免疫色谱分离磷酸化的亚 蛋白质组,得到与信号传导途径相关的蛋白质组以及在细胞中的定位信息,然后通过双向电泳技术分析蛋白质修饰和表达变化。利用这个方法,Stancato等在人原淋巴细胞
疟原虫形态
形态 发育期 疟原虫在红细胞内生长、发育、繁殖,形态变化很大。一般分为三个主要发育期。 (1)滋养体(trophozoite):为疟原虫在红细胞内摄食和生长、发育的阶段。按发育先后,滋养体有早、晚期之分。早期滋养体胞核小,胞质少,中间有空泡,虫体多呈环状,故又称之为环状体(ring form)。以后虫体长大,胞核亦增大,胞质增多,有时伸出伪足,胞质中开始出现疟色素(malarial pigment)。间日疟原虫和卵形疟原虫寄生的红细胞可以变大、变形,颜色变浅,常有明显的红色薛氏点(Schuffner’s dots);被恶性疟原虫寄生的红细胞有粗大的紫褐色茂氏点(Maurer’s dots);被三日疟原虫寄生的红细胞可有齐氏点(Ziemann’s dots)。此时称为晚期滋养体,亦称大滋养体。 (2)裂殖体(schizont):晚期滋养体发育成熟,核开始分裂后即称为裂殖体。核经反复分裂,最后胞质随之分裂,每一个核都被部分胞质包裹,成为裂殖子(merozoite),早期的裂殖体称为未成熟裂殖体,晚期含有一定数量的裂殖子且疟色素已经集中成团的裂殖体称为成熟裂殖体。 (3)配子体(gametocyte):疟原虫经过数次裂体增殖后,部分裂殖子侵入红细胞中发育长大,核增大而不再分裂,胞质增多而无伪足,最后发育成为圆形、卵圆形或新月形的个体,称为配子体;配子体有雌、雄(或大小)之分:雌(大)配子体虫体较大,胞质致密,疟色素多而粗大,核致密而偏于虫体一侧或居中;雄(小)配子体虫体较小,胞质稀薄,疟色素少而细小,核质疏松、较大、位于虫体中央。 超微结构 (1)裂殖子:红细胞 显微镜下的疟原虫 内期裂殖子呈卵圆形,有表膜复合膜(pellicular complex)包绕。大小随虫种略有不同,平均长1.5µm,平均直径1µm。 表膜(pellicle)由一质膜和两层紧贴的内膜组成。质膜厚约7.5µm,内膜厚约15µm,有膜孔。紧靠内膜的下面是一排起于顶端极环(polar ring)并向后部放散的表膜下微管(subpellicular microtubule)。内膜和表膜下微管可能起细胞骨架作用,使裂殖子有硬度。游离的裂殖子的外膜有一厚约20µm表被(surface coat)覆盖。此表被是电子致密、坚实的纤丝,在性质上似是蛋白质,可能在对宿主免疫反应的应答中起作用。在裂殖子侧面表膜有一胞口(cytostome),红细胞内期各期原虫通过胞口摄取宿主细胞浆。 裂殖子顶端是一截头的圆锥形突起称为顶突(apical prominence),有三个极环。在此区可见两个电子致密的棒状体(rhoptry)和数个微线体(micronemes)。棒状体和微线体可能在裂殖子侵入宿主细胞时起作用。裂殖子后部可见一线粒体。内质网很少,但胞浆内有丰富的核糖体。高尔基氏复合体不明显。裂殖子的核大而圆,位于虫体后半部,沿核膜可见核孔,未见有核仁。 (2)子孢子:子孢子形状细长,长约11µm,直径为1.0µm,常弯曲呈C形或S形,前端稍细,顶端较平,后端钝圆,体表光滑。子孢子内的细胞器基本上与裂殖子相似。表膜由一外膜、双层内膜和一层表膜下微管组成。膜下微管自极环向后延伸至核或稍越过核而终止。虫体的微弱运动可能是膜下微管的伸缩引起的。子孢子的前端顶部有一向内凹入的顶杯(anterior cup)即顶突,在顶突的周围有3~4个极环。细胞核一个,长形。有一对电子致密的棒状体,可能开口于顶环。在核的前方或后方,有数量很多的微线体,呈圆形、卵圆形或长形。[1]
寄生虫讲稿(经典编辑)
寄生虫 1、单宿主寄生虫(也称为土源性寄生虫),如蛔虫、钩虫等。 多宿主寄生虫(也称生物源性寄生虫),如绦虫、吸虫等。 2、专一宿主寄生虫。例如马的尖尾线虫只寄生于马属动物,鸡球虫只感染鸡等。既能寄生于动物,也能寄生于人的寄生虫——人兽共患寄生虫,如日本血吸虫、弓形虫、旋毛虫等。 3、如猪带绦虫(成虫)寄生于人的小肠内,所以人是猪带绦虫的终末宿主;猫是弓形虫的终未宿主。 4、猪是猪带绦虫的中间宿主;猪、羊等动物是弓形虫的中间宿主。 8、补充宿主(第二中间宿主):双腔吸虫在发育过程中依次需要在蜗牛和蚂蚁体内发育,其补充宿主就是蚂蚁。 9、贮藏宿主(转续宿主) 宿主体内有寄生虫虫卵或幼虫存在,虽不发育繁殖,但保持着对易感动物的感染力,这种宿主称为贮藏宿主或转续宿主。如鸡异刺线虫的虫卵被蚯蚓吞食后在蚯蚓体内不发育但保持感染性,鸡吞食含有异刺线虫的蚯蚓可感染异刺线虫,蚯蚓是鸡异刺线虫的贮藏宿主。 10、保虫宿主 某些惯常寄生于某种宿主的寄生虫,有时也可寄生于其他一些宿主,但寄生不普遍多量,无明显危害,通常把这种不惯常被寄生的宿主称为保虫宿主。如耕
牛是日本血吸虫的保虫宿主。这种宿主在流行病学上起一定作用。 11、带虫宿主(带虫者) 宿主被寄生虫感染后,处于隐性感染状态,临床上不表现症状,体内仍存留有一定数量的虫体,并对同种寄生虫再感染具有一定的免疫力,这种宿主即为带虫宿主。 12、传播媒介 通常是指在脊椎动物宿主间传播寄生虫病的一类动物,多指吸血的节肢动物。例如,蚊子在人之间传播疟原虫,蜱在牛之间传播梨形虫等。 13、寄生虫生活史 寄生虫生长、发育和繁殖的一个完整循环过程,称为寄生虫的生活史或发育史。 不需中间宿主的发育史,又称为直接发育型;需要中间宿主的发育史,又称为间接发育型。 二、简答 1、寄生虫的分类 寄生虫分类的最基本单位是种。种、属、科、目、纲、门、界。 2、寄生虫对宿主的危害(寄生虫的致病作用): 1)掠夺宿主营养 消化道寄生虫(如蛔虫、绦虫)多数以宿主体内的消化或半消化的食物营养为食;
疟原虫镜检技术培训手册-1
目录 第一章疟原虫生活史 一、概述 二、人体内发育 三、蚊体内的发育 第二章疟原虫镜下形态 一、薄血膜中疟原虫形态 二、厚血膜中疟原虫形态 第三章显微镜使用及维护 一、显微镜的构造 二、显微镜使用 三、使用注意事项 四、显微镜的维护保养 第四章血片制作与染色 一、血片制作 二、血膜的染色 第五章疟原虫镜检技术 一、血液 二、血液中各种正常细胞形态 三、薄血膜镜检 四、厚血膜镜检 五、杂质与疟原虫的鉴别 六、疟原虫计数 附录:疟原虫图谱
第一章疟原虫生活史 一、概述 疟原虫是疟疾的病原体。疟原虫为单细胞真核生物,属原生动物亚界顶端复合物门、孢子纲、真球虫目、疟原虫科、疟原虫属。人体疟原虫有4种:间日疟原虫(Plasmodium vivax)、恶性疟原虫(P.falciparum)、三日疟原虫(P.malariae)和卵形疟原虫(P.ovale),依次引起间日疟、恶性疟、三日疟和卵形疟。在我国间日疟较常见,恶性疟次之,但对人体危害较间日疟严重,三日疟偶尔发现,卵形疟已无病例报告。4种人体疟原虫的生物学特征见表1-1。 疟原虫的发育和繁殖,必须通过脊椎动物与昆虫媒介两个宿主,人体疟原虫的宿主是人和按蚊。疟原虫在人体分别寄生于肝实质细胞和血液中的红细胞内,在蚊体内则寄生于蚊胃,最后积聚于唾腺。4种人体疟原虫的生活史基本相同,包括在人体内的红细胞外期和红细胞内期以及在蚊体内的配子生殖和孢子增殖两个阶段。 二、人体内发育 疟原虫在人体内的发育分成肝细胞内的发育和红细胞内的发育两个阶段。(一)红细胞外期 按蚊吸人血时,按蚊唾腺中的子孢子随唾液进入人体的末梢血液中,在30分钟内,随血流进入肝脏,在肝实质细胞内发育,进行裂体增殖,此时期称红细胞外期(简称红外期)或肝细胞期(简称肝期),此时期的疟原虫称肝期裂殖体。成熟肝期裂殖体直径为45~60 m,内含数以万计的肝期裂殖子。肝期裂殖体成熟致使肝细胞破裂,肝期裂殖子释入血液。不同种疟原虫的此期所需时间不同,从6~12天不等。 间日疟原虫的红外期裂体增殖较为复杂。目前认为间日疟原虫的子孢子在遗传学上具有两种不同的类型,即速发型子孢子和迟发型子孢子。速发型子孢子侵入肝细胞后,遂开始红外期裂体增殖,释放出肝期裂殖子侵入红细胞,经裂体增殖引起临床发作。迟发型子孢子侵入肝细胞后暂不继续发育,处于休眠状态(休眠体),经过一段休眠期后,再发育成为成熟的红外期裂殖体,释放出肝期裂殖子侵入红细胞引起复发。恶性疟原虫和三日疟原虫无迟发型子孢子,因而恶性疟和三日疟也无复发现象 (二)红细胞内期
2020届河北省衡水密卷新高考原创冲刺模拟试卷(十五)生物
2020届河北省衡水密卷新高考原创冲刺模拟试卷(十五) 生物 ★祝考试顺利★ 注意事项: 1、考试范围:高考范围。 2、试题卷启封下发后,如果试题卷有缺页、漏印、重印、损坏或者个别字句印刷模糊不清等情况,应当立马报告监考老师,否则一切后果自负。 3、答题卡启封下发后,如果发现答题卡上出现字迹模糊、行列歪斜或缺印等现象,应当马上报告监考老师,否则一切后果自负。 4、答题前,请先将自己的姓名、准考证号用0.5毫米黑色签字笔填写在试题卷和答题卡上的相应位置,并将准考证号条形码粘贴在答题卡上的指定位置。用2B铅笔将答题卡上试卷类型A后的方框涂黑。 5、选择题的作答:每个小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。写在试题卷、草稿纸和答题卡上的非选择题答题区域的答案一律无效。 6、主观题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域的答案一律无效。如需改动,先划掉原来的答案,然后再写上新答案;不准使用铅笔和涂改液。不按以上要求作答无效。 7、保持答题卡卡面清洁,不折叠,不破损,不得使用涂改液、胶带纸、修正带等。 8、考试结束后,请将本试题卷、答题卡、草稿纸一并依序排列上交。 第Ⅰ卷 一、选择题(本大题共30小题,每小题2分,共60分。在每小题给出的四个选项中,只有一项是符合题目要求的) 1.有关物质和细胞的说法正确的是() A. 细胞器是细胞代谢的主要场所 B. 含磷的细胞器不包括中心体和核糖 体 C. 青霉菌含有两种核酸,发菜含有一种核酸 D. 健那绿染液是作用于活细胞的染料 2.下列有关生物实验中实验材料、试剂的使用及实验现象描述正确的是() A. 用溴麝香草酚蓝水溶液检测酒精时,颜色变化为由蓝变绿再变黄 B. 制备细胞膜前,向猪血细胞中加适量蒸馏水稀释制成细胞稀释液 C. 用健那绿给黑藻细胞染色观察蓝绿色的线粒体 D. 用苏丹Ⅲ给花生子叶切片染色,用显微镜可以观察到橘黄色的脂肪颗粒 3.下图甲、乙依次为蛋白质、核酸的单体结构示意图。下列叙述错误的是()
疟原虫图谱
约占寄生红细胞的1/3,很少见到一个红细胞寄生2个环状体和一个环状体有2个核。 恶性疟环状体: 环纤细,约为RBC直径的1/6,RBC不胀大 核1个,但2个常见,红细胞常含2个以上原虫
虫体不规则,较大;阿米巴样空泡明显;疟色素细小,黄褐色。 恶性疟大滋养体: 虫体较小,蓝色,圆形,坚实,体积小。 较细的黑褐色颗粒,常集成块。
间日疟成熟裂殖体: 红细胞:胀大,褪色,可见薛氏小点。大小:个体较大。 胞浆和核:裂殖子12~24个,通常为16~18个,排列不规则,核红色,胞浆浅蓝色。疟色素:黄褐色,常集于疟原虫的一边。 恶性疟成熟裂殖体: 红细胞:大小正常,颜色较深,可见茂氏小点。大小:虫体较小。裂殖子8~32个,通常8~18个,排列不规则;疟色素集中成团块状;虫体占红细胞体积的2/3至3/4
间日疟原虫雌配子体: 形状大小:圆形或椭圆形,较大。胞浆:深蓝色。核:一个,较小,深红色,常偏于一边,核周可见明显不染色带。疟色素:黄褐色,均匀散在,数目较多。 间日疟原虫雄配子体: 形状大小:圆形,虫体较大。胞浆:浅蓝色。核:一个,较大,疏松,位于中央,浅红色,周围有明显不着色带。疟色素:黄褐色,散在分布。
恶性疟雌配子体: 形状:新月形,两端稍尖。胞浆:深蓝色。核:一个,较小,致密,深红色,位于中央,核周可见透明不染色带。疟色素:黑褐色,密布于核的周围。 恶性疟雄配子体: 形状:腊肠形,两端钝圆。胞浆:浅蓝色或淡紫红色。核:一个,较大,疏松,位于中央,浅红色,核周可见不染色带。疟色素:黑褐色,松散分布于核周围。
1.红细胞通常胀大; 2.薛氏点明显; 3.成熟环状体粗大; 4.滋养体有阿米巴样伪足; 5.可见不同发育期的原虫 恶性疟鉴定要点: 1.环状体钎细, 红细胞不涨大; 2.一个红细胞内可有几个环状体; 3.环状体内可有2个核; 4.环状体可贴在红细胞边缘; 5.血片中没有其他发育期滋养体 6.配子体呈新月形或腊肠形; 7.可出现茂氏点
基因诊断方法
第二十一章基因诊断与基因治疗 基因诊断与基因治疗能够在比较短的时间从理论设想变为现实,主要是由于分子生物学的理论及技术方法,特别是重组DNA技术的迅速发展,使人们可以在实验室构建各种载体、克隆及分析目标基因。所以对疾病能够深入至分子水平的研究,并已取得了重大的进展。因此在20世纪70年代末诞生了基因诊断(gene diagnosis);随后于1990年美国实施了第一个基因治疗(gene therapy)的临床试验方案。可见,基因诊断和基因治疗是现代分子生物学的理论和技术与医学相结合的范例。 第一节基因诊断 一.基因诊断的含义 传统对疾病的诊断主要是以疾病的表型改变为依据,如患者的症状、血尿各项指标的变化,或物理检查的异常结果,然而表型的改变在许多情况下不是特异的,而且是在疾病发生的一定时间后才出现,因此常不能及时作出明确的诊断。现知各种表型的改变是由基因异常造成的,也就是说基因的改变是引起疾病的根本原因。基因诊断是指采用分子生物学的技术方法来分析受检者的某一特定基因的结构(DNA水平)或功能(RNA水平)是否异常,以此来对相应的疾病进行诊断。基因诊断有时也称为分子诊断或DNA诊断(DNA diagnosis)。基因诊断是病因的诊断,既特异又灵敏,可以揭示尚未出现症状时与疾病相关的基因状态,从而可以对表型正常的携带者及某种疾病的易感者作出诊断和预测,特别对确定有遗传疾病家族史的个体或产前的胎儿是否携带致病基因的检测具有指导意义。 二.基因诊断的原理及方法 (一)基因诊断的原理 疾病的发生不仅与基因结构的变异有关,而且与其表达功能异常有关。基因诊断的基本原理就是检测相关基因的结构及其表达功能特别是RNA产物是否正常。由于DNA的突变、缺失、插入、倒位和基因融合等均可造成相关基因结构变异,因此,可以直接检测上述的变化或利用连锁方法进行分析,这就是DNA诊断。 对表达产物mRNA质和量变化的分析为RNA诊断(RNA diagnosis)。 (二)基因诊断的方法
疟原虫形态
疟原虫形态 四种疟原虫在红细胞内的各期形态不尽相同,是诊断、鉴别各种疟原虫的依据。瑞氏染色或姬氏染色后疟原虫的细胞质呈蓝色,细胞核呈红色,疟色素呈棕褐色。现将薄血片染色后的间日疟原虫各个时期形态(滋养体、裂殖体、配子体)介绍如下: 1.滋养体(trophozoite):是疟原虫在红细胞内摄取营养和发育的阶段。当裂殖子侵入红细胞后,虫体胞质较少,中间出现大空泡,胞质呈环状,细胞核位于虫体一侧,颇似戒指的宝石。因此,早期滋养体又称为环状体(ring form)。环状体继续发育,长大。间日疟原虫和卵形疟原虫约经8~10小时,恶性疟原虫约经10小时,三日疟原虫约经24小时,虫体增大,伸出伪足,为运动细胞器,同时胞质中出现少量疟色素(malarialpigment);随着虫体继续发育,疟色素增多,伪足活动增加,出现多种形态,虫体有1或2~3个空泡。受染的红细胞胀大可达1倍,颜色变淡,并出现能染成淡红色的小点,称薛氏小点(Schhffner,s dots)。恶性疟原虫的早期滋养体在外周血液中经十几小时的发育,逐渐隐匿于各种器官组织的毛细血管中,继续发育成滋养体。 四种人体疟原虫滋养体形态比较(薄片,吉氏液染色) 间日疟原虫恶性疟原虫三日疟原虫卵形疟原虫 小 滋
养体较大,约为红细胞直 径的1/3,环粗大, 核1或2个;红细 胞的多虫感染不多 见 约为红细胞直径的 1/6,环纤细,核1~2 个,有些贴于红细胞边 缘;红细胞的多虫感染 比较常见 约为红细胞直径的 1/3,环教粗,核1个; 红细胞的多虫感染很 少见 似三日疟原虫 大滋 养体较大,阿米巴样,空 泡明显;核较大,疟 色素细小,黄褐色, 短杆状 通常在外周血中看不 到;中等大小,很少呈 阿米巴样。早期疟色素 细小,金黄色,晚期结 成块状,黑褐色 常称带状而非阿米巴 样,空泡小,疟色素较 粗大,深褐色,常沿虫 体边缘分布 常呈圆形或不整圆 形,疟色素粗大,暗 褐色返回标题 2.裂殖体(schizont):约经40小时,间日疟原虫晚期滋养体发育成熟,虫 体变圆,胞质内空泡消失,核开始分裂,称未成熟裂殖体(immature schizont)。之后核继续分裂,胞质随之分裂,疟色素渐趋集中。最后,分裂的每一小部分胞质包绕一个胞核,形成裂殖子。这时含有裂殖子的虫体称为成熟裂殖体。间日疟原虫的成熟裂殖体常充满于被寄生的红细胞,最后形成12~24个裂殖子。裂殖子长约1.5um,宽约1um。在红细胞受染后48小时左右,形成成熟裂殖体。
镰刀细胞性贫血
案例二镰刀细胞性贫血 血红蛋白 血红蛋白是高等生物体内负责运载氧的一种蛋白质。分子结构:每一血红蛋白分子由一分子的珠蛋白和四分子亚铁血红素组成,珠蛋白约占96%,血红素占4%。有多种类型:血红蛋白A(HbA),α2β2,占成人血红蛋白的98%;血红蛋白A2(HbA2),α2δ2,占成人血红蛋白的2%;血红蛋白F(HbF),α2γ2,仅存在于胎儿血中;血红蛋白H(HbH),β4,四个相同β链组成的四聚体血红蛋白;血红蛋白C(HbC),β链中Lys被Glu取代的血红蛋白;血红蛋白S(HbS),镰刀状细胞红蛋白;血红蛋白O2(HbO2,HHbO2),氧合血红蛋白;血红蛋白CO(HbCO) 发病机制 镰刀形红细胞病(即镰形细胞病,又称镰形红细胞贫血),是一种常染色体隐性遗传性血液病,即一种常见的严重血红蛋白病,其特征为红细胞中出现结构和功能异常的Hb ,这些异常Hb分子的聚合导致月牙状或镰形红细胞的形成,这种镰形细胞极易黏附于血管内皮,从而阻碍正常血流及氧在重要器官和组织中的释放。存在于红细胞中的Hb 为一种载氧蛋白,由4条珠蛋白多肽链构成(2条α样链和2条样β链)。镰形细胞病病人在染色体llp15.4上基因编码的β链形成中遗传有一个位点突变,这一位点突变使得每一条β链的6位上亲水性氨基酸谷胺酰胺被疏水性氨基酸缬氨酸取代,结果导致β分子异常结构(Hbs)。临床表现为慢性贫血、易感染、多器官系统损伤及寿命缩短。 检测诊断 1.基因诊断 2.血红蛋白电泳筛查为主。全自动琼脂凝胶电泳系统通过与正常人的血红蛋白图谱
进行比较,可发现异常血红蛋白区带如:HbH,HbE,HbBart’s,HbS,HbD 和HbC等异常血红蛋白。 3.网织红细胞计数器(1)外周血血红蛋白为50~100g/L,危象时进一步降低。网织红细 胞计数常在10%以上。红细胞大小不均,多染性、嗜碱性点彩细胞增多可见有核红细胞、靶形红细胞异形红细胞、Howell-Jolly小体。镰状红细胞并不多见,若发现则有助于诊断通常采用“镰变试验”检查有无镰状细胞。红细胞渗透脆性显著降低白细胞和血小板计数一般正常。(2.)骨髓象示红系显著增生,但在再生障碍危象时增生低下,在巨幼细胞危象时有巨幼细胞变(3).血清胆红素轻~中度增高,溶血危象时显著增高。本病的溶血虽以血管外溶血为主,但也存在着血管内溶血。(4.)血浆结合珠蛋白降低,血浆游离血红蛋白可能增高。(5)红细胞半衰期测定显示红细胞生存时间明显缩短至5~15天[正常为(28±5)天] (6.)血红蛋白电泳显示HbS占80%以上HbF增多至2%~15%,HbA2正常,而HbA缺如。 治疗 目前对镰形细胞病最常用的治疗手段均为针对症状的和支持性疗法,包括静脉内水合作用、镇痛药(非甾体抗炎药和吗啡)、氧疗、tV_,N预防和输血。虽然这些疗法能够用于镰形细胞病的对症治疗,但是急需一种安全有效的预防疗法。羟基脲是目前镰形细胞病预防疗法的主要药物,它通过促进胎儿血红蛋白(I-lbF)的产生而抑制mS的形成,而I-IbF是一种不参与聚合的Hb分子,它的增加可抑制细胞内麟的聚合及镰形细胞的形成,且与镰形细胞病病人发病率呈反相关。因此HbF是通过稀释I-IbS 有效浓度而发挥作用,从而减少溶血和缺血性疼痛。然而羟基脲仅对6o%的病人有效,同时它会产生毒副作用,如骨髓抑制和进行性器官衰竭。因此需要寻找更有效、毒性更低的治疗药物。 问题 1血红蛋白α链β链的空间结构有何特点?维持血红蛋白四级空间结构的力量包括那些化学键? 人体内的血红蛋白由四个亚基构成,分别为两个α亚基和两个β亚基,在与人体环境相似的电解质溶液中血红蛋白的四个亚基可以自动组装成α2β2的形态。血红蛋白的每个亚基由一条肽链和一个血红素分子构成,肽链在生理条件下会盘绕折叠成球形,把血红素分子抱在里面,这条肽链盘绕成的球形结构又被称为珠蛋白。血红素分子是一个具有卟啉结构的小分子,在卟啉分子中心,由卟啉中四个吡咯环上的氮原子与一个亚铁离子配位结合,珠蛋白肽链中第8位的一个组氨酸残基中的吲哚侧链上的氮原子从卟啉分子平面的上方与亚铁离子配位结合,当血红蛋白不与氧结合的时候,有一个水分子从卟啉环下方与亚铁离子配位结合,而当血红蛋白载氧的时候,就由氧分子顶替水的位置。 氢键、离子键。 2.镰刀细胞性贫血的分子基础是什么?用什么方法可以诊断? 点突变(point mutation)发生於β-多肽链基因(HBB 基因)上的第六个密码子(condon),GAG突变成GTG。结果令到β-多肽链(β-珠球蛋白)上的第六个氨基酸被置换,由谷氨酸(glutamic acid) 置换成缬氨酸(valine),形成正常的β-多肽链。 3为什么患者的红细胞会变成镰刀状/ 谷氨酸是一个亲水氨基酸,氨基酸位点位于血红蛋白分子外部,易与水结合。但是缬氨酸是一个疏水氨基酸,这样的氨基酸分子暴露在血红蛋白分子外部是不利的。由于这样
