化工原理知识点总结复习重点(完美版).doc

第一章、流体流动
一、流体静力学
二、流体动力学
三、流体流动现象
四、流动阻力、复杂管路、流量计
一、流体静力学:
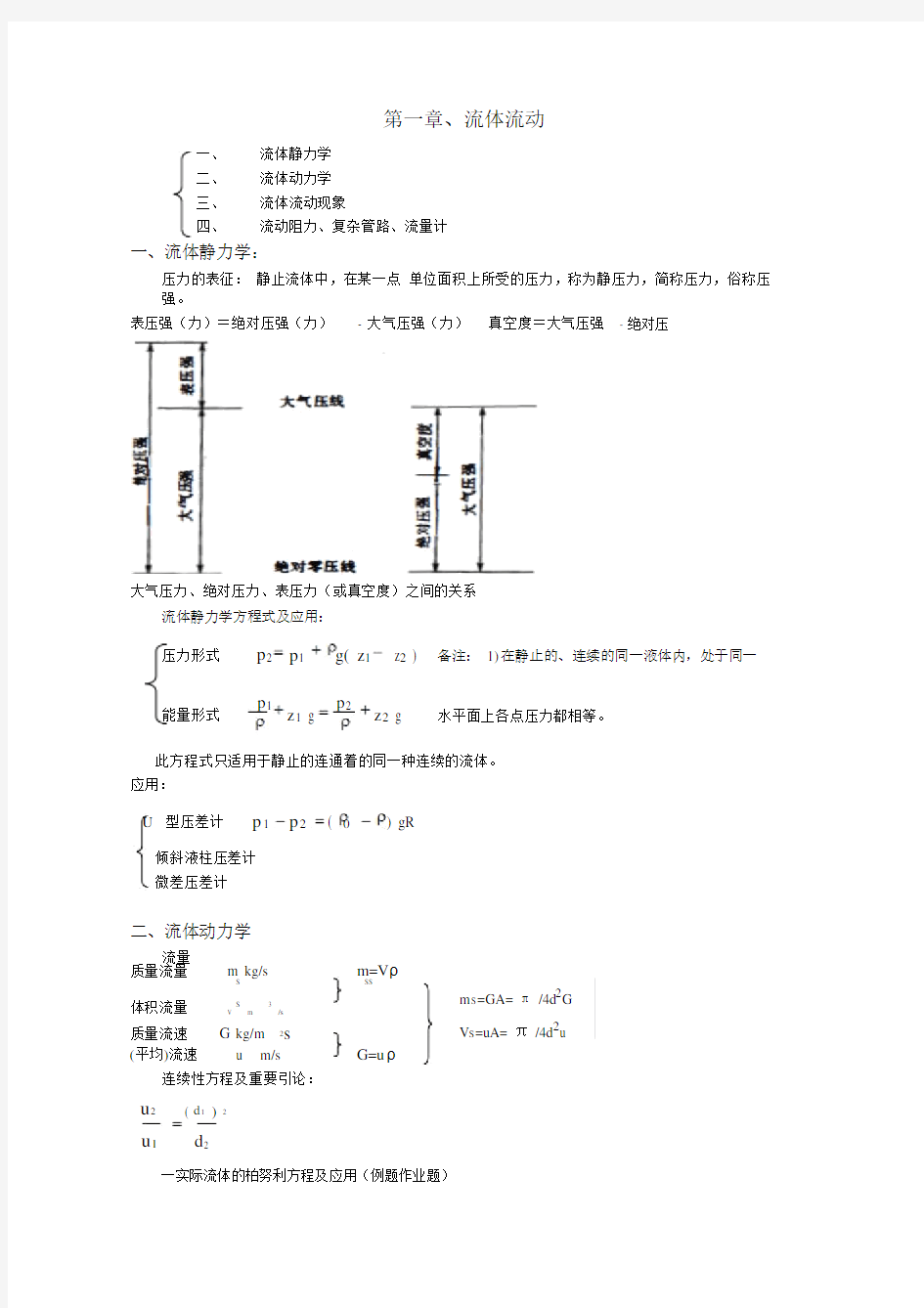
压力的表征:静止流体中,在某一点单位面积上所受的压力,称为静压力,简称压力,俗称压强。
表压强(力)=绝对压强(力)- 大气压强(力)真空度=大气压强- 绝对压
大气压力、绝对压力、表压力(或真空度)之间的关系
流体静力学方程式及应用:
压力形式p2 p1 g( z1 z2 ) 备注: 1) 在静止的、连续的同一液体内,处于同一
能量形式p1
z1 g
p2
z2 g 水平面上各点压力都相等。
此方程式只适用于静止的连通着的同一种连续的流体。应用:
U型压差计p1p2( 0) gR
倾斜液柱压差计
微差压差计
二、流体动力学
流量
m kg/s m=Vρ
质量流量
S SS
体积流量S 3 m S=GA= π /4d2G
V m /s
V S=uA= π /4d2u 质量流速G kg/m 2s
(平均)流速u m/s G=uρ
连续性方程及重要引论:
u2( d1) 2
u1d2
一实际流体的柏努利方程及应用(例题作业题)
以单位质量流体为基准:
1 2 p1 1 2 p2
J/kg z1 g 2 u1 W e z2 g 2 u2 W f
以单位重量流体为基准:
1 2 p1 1 2 p2
J/N=m z1 2g u1 g H e z2 2g u2 g h f
输送机械的有效功率:N e m s W e
输送机械的轴功率:N N e
(运算效率进行简单数学变换)
应用解题要点:
1、作图与确定衡算范围: 指明流体流动方向,定出上、下游界面;
2、截面的选取:两截面均应与流动方向垂直;
3、基准水平面的选取:任意选取,必须与地面平行,用于确定流体位能的大小;
4、两截面上的压力:单位一致、表示方法一致;
5、单位必须一致:有关物理量的单位必须一致相匹配。
三、流体流动现象:
流体流动类型及雷诺准数:
( 1)层流区Re<2000
(2)过渡区2000< Re<4000
( 3)湍流区Re>4000
本质区别:(质点运动及能量损失区别)层流与端流的区分不仅在于各有不同的Re 值,更重要的是两种流型的质点运动方式有本质区别。
流体在管内作层流流动时,其质点沿管轴作有规则的平行运动,各质点互不碰撞,互不混合流体在管内作湍流流动时,其质点作不规则的杂乱运动并相互碰撞,产生大大小小的旋涡。
由于质点碰撞而产生的附加阻力较自黏性所产生的阻力大得多,所以碰撞将使流体前进阻力急剧
加大。
管截面速度大小分布:
无论是层流或揣流,在管道任意截面上,流体质点的速度均沿管径而变化,管壁处速度为零,离开管壁以后速度渐增,到管中心处速度最大。
层流: 1、呈抛物线分布;2、管中心最大速度为平均速度的2倍。
湍流: 1、层流内层; 2、过渡区或缓冲区;3、湍流主体
湍流时管壁处的速度也等于零,靠近管壁的流体仍作层流流动,这-作层流流动的流体薄层称为
层流内层或层流底层。自层流内层往管中心推移,速度逐渐增大,出现了既非层流流动亦非
完全端流流动的区域,这区域称为缓冲层或过渡层,再往中心才是揣流主体。层流内层的厚度随
Re 值的增加而减小。
层流时的速度分布
u 1 u
max 2
湍流时的速度分布u 0.8u max
四、流动阻力、复杂管路、流量计:
计算管道阻力的通式:(伯努利方程损失能)
范宁公式的几种形式:圆直管道h f
l u 2 d 2
非圆直管道p f W f l u 2 d 2
运算时,关键是找出值,一般题目会告诉,仅用于期末考试,考研需扩充非圆管当量直径:
当量直径: d e d e=4r H(4倍水力半径)
水力半径: r H= A Π
(流体在通道里的流通截面积 A 与润湿周边长Π之比)
流量计概述:(节流原理)
孔板流量计是利用流体流经孔板前后产生的压力差来实现流量测量。
孔板流量计的特点:恒截面、变压差,为差压式流量计。
文丘里流量计的能量损失远小于孔板流量计。
转子流量计的特点:恒压差、恒环隙流速而变流通面积,属截面式流量计。
复杂管路:(了解)
并联管路各支路的能量损失相等,主管的流量必等于各支管流量之和。
第二章、流体输送机械
一、离心泵的结构和工作原理
二、特性参数与特性曲线
三、气蚀现象与安装高度
四、工作点及流量调节
转化离心泵:电动机流体(动能)
一、离心泵的结构和工作原理:
离心泵的主要部件:
叶轮
泵壳液体的汇集与能量的转换泵
轴
密封填料密封机械密封(高级)静压能
离心泵的的启动流程:
吸液(管泵,无自吸能力)转能
排放
叶轮其作用为将原动机的能量直接传给液体,以提高液体的静压能与动能(主要为静压能)。
泵壳具有汇集液体和能量转化双重功能。
轴封装置其作用是防止泵壳内高压液体沿轴漏出或外界空气吸入泵的低压区。常用的轴封
装置有填料密封和机械密封两种。
气缚现象:离心泵启动前泵壳和吸入管路中没有充满液体,则泵壳内存有空气,而空气的密
度又远小于液体的密度,故产生的离心力很小,因而叶轮中心处所形成的低压不足以将贮槽内液
体吸入泵内,此时虽启动离心泵,也不能输送液体,此种现象称为气缚现象,表明离心泵无自吸
能力。因此,离心泵在启动前必须灌泵。
汽蚀现象:汽蚀现象是指当泵入口处压
力等于或小于同温度下液体的饱和蒸汽压
时,液体发生汽化,气泡在高压作用下,迅
速凝聚或破裂产生压力极大、频率极高的冲
击,泵体强烈振动并发出噪音,液体流量、
压头(出口压力)及效率明显下降。这种现
象称为离心泵的汽蚀。
二、特性参数与特性曲线:
流量 Q:离心泵在单位时间内排送到管路系
统的液体体积。
压头(扬程) H:离心泵对单位重量(1N)的
液体所提供的有效能量。
效率:总效率=v m h
轴功率 N:泵轴所需的功率N Ne
-Q 曲线对应的最高效率点为设计点,对
应的 Q、H、N值称为最佳工况参数,铭牌所
标出的参数就是此点的性能参数。(会使用
IS 水泵特性曲线表,书P117)
三、气蚀现象与安装高度:
气蚀现象的危害:
①离心泵的性能下降,泵的流量、压头和效率均降低。若生成大量的气泡,则可能出现气缚现象,且使离心泵停止工作。
②产生噪声和振动,影响离心泵的正常运行和工作环境。
③泵壳和叶轮的材料遭受损坏,降低了泵的使用寿命。
解决方案:为避免发生气蚀,就应设法使叶片入口附近的压强高于输送温度下的液体饱和蒸气压。
通常,根据泵的抗气蚀性能,合理地确定泵的安装高度,是防止发生气蚀现象的有效措施。
离心泵的汽蚀余量:
为防止气蚀现象发生,在离心泵人口处液体的静压头( p 1/p g)与动压头(
2
u 1 /2 g )之和必
须大于操作温度下液体的饱和蒸气压头( p v/p g)某一数值,此数值即为离心泵的气蚀余量。
p1 u1 2 p v
NPSH H S H g抗气蚀性能好NPSH
2g g
g
必须汽蚀余量: (NPSH)r
离心泵的允许吸上真空度:
离心泵的允许安装高度H g(低于此高度0.5-1m ):
关离心泵先关阀门,后关电机,开离心泵先关出口阀,再启动电机。
四、工作点及流量调节:
管路特性与离心泵的工作点:
由两截面的伯努利方程所得
全程化简。
联解既得工作点。
离心泵的流量调节:
1、改变阀门的开度(改变管路特性曲线);
2、改变泵的转速(改变泵的特性曲线);减小叶轮直径也可以改变泵的特性曲线,但一般不
用。
3、泵串联(压头大)或并联(流速大)
往复泵的流量调节:
1、旁路调节;
2、改变活塞冲程和往复次数。
第三章、非均相物系的分离(密度不同)
一、重力沉降
二、离心沉降
三、过滤
一、重力沉降:
沉降过程:
先加速(短),后匀速(长)沉降过程。
流型及沉降速度计算:(参考作业及例题)
层流区(滞流区)或斯托克斯定律区:(-4 t )( K<2.62 )
10 过渡区或艾伦定律区:(1 3 5 湍流区或牛顿定律区:(10 计算方法: 1、试差法: 即先假设沉降属于某一流型(譬如层流区),则可直接选用与该流型相应的沉降速度公式计算u t ,然后按u t 检验 Re t值是否在原设的流型范围内。如果与原设一致,则求得的u t 有效。否则,按算 出的 Re t值另选流型,并改用相应的公式求u t。 2、摩擦数群法:书 p149 3、K值法:书p150 沉降设备: 为满足除尘要求,气体在降尘室内的停留时间至少等于颗粒的沉降时间,所以: 单层降尘室生产能力: V s blu t (与高度 H 无关,注意判断选择填空题) 多层降尘室: V s ( n 1)blu t ( n+1为隔板数, n 层水平隔板,能力为单层的( n+1)倍) 二、离心沉降: 2 离心加速度: (惯性离心力场强度) u T ;重力加速度 :g R 4d( s ) u T 2 4d( s ) g 离心沉降速度 u r : 3 R ;重力沉降速度 u T : 3 离心分离因数 C K : 2 K C u r U T (离心沉降速度与重力沉降速度的比值,表征离心沉降是重力沉降的多少倍) u T g R 离心沉降设备: 旋风分离器: 利用惯性离心力的作用从气流中分离出尘粒的设备 性能指标: 1、临界粒径d c:理论上在旋风分离器中能被完全分离下来的最小颗粒直径; 2、分离效率:总效率η0;分效率ηp(粒级效率); 3、分割粒径d50: d50是粒级效率恰为50%的颗粒直径; 4、压力降△p:气体经过旋风分离器时,由于进气管和排气管及主体器壁所引起的摩擦阻力, 流动时的局部阻力以及气体旋转运动所产生的动能损失等,造成气体的压力降。 (标准旋风) 标准旋风 N e=5,=8.0 。 三、过滤: 过滤方式: 1、饼层过滤:饼层过滤时,悬浮液置于过滤介质的一侧,固体物沉积于介质表面而形成滤饼层。 过滤介质中微细孔道的直径可能大于悬浮液中部分颗位的直径,因而,过滤之初会有一些细 小颗粒穿过介质而使滤液浑浊,但是颗粒会在孔道中迅速地发生“架桥”现象(见图),使 小子孔道直径的细小颗粒也能被截拦,故当滤饼开始形成,滤液即变清,此后过滤才能有效 地进行。可见,在饼层过滤中,真正发挥截拦颗粒作用的主要是滤饼层而不是过滤介质。饼层过滤适用于处理固体含量较高的悬浮液。 深床过滤:在深床过滤中,固体颗粒并不形成滤饼,而是沉积于较厚的粒状过滤介质床层内部。 悬浮液中的颗粒尺寸小于床层孔道直径,当颗粒随流体在床层内的曲折孔道中流过时,便附在过滤介质上。这种过滤适用于生产能力大而悬浮液中颗粒小、含量甚微的场合。自来水厂饮水的净化及从合成纤维纺丝液中除去极细固体物质等均采用这种过滤方法。 助滤剂的使用及注意: 为了减少可压缩滤饼的流动阻力,有时将某种质地坚硬而能形成疏松饼层的另一种固体颗粒混入 悬浮液或预涂于过滤介质上,以形成疏松饼层,使滤液得以畅流。这种预混或预涂的粒状物质称 为助滤剂。 对助滤剂的基本要求如下: ①应是能形成多孔饼层的刚性颗粒,使滤饼有良好的渗透性、较高的空隙率及较低的流动阻力; ②应具有化学稳定性,不与悬浮液发生化学反应,也不溶于液相中。 应予注意,-般以获得清净滤液为目的时,采用助滤剂才是适宜的。 恒压过滤方程式:(理解,书 P175) 对于一定的悬浊液,若、 r '、及皆可视为常数,令 k 1 , k——表征过滤物料特性r ' 的常数,;恒压过滤时,压力差△p不变, k、 A、s都是常数再令 过滤常数的测定:书P179, 包括压缩因子 板框压力机: 过滤时,悬浮液在指定的压强下经滤浆通道自滤框角端的暗孔进入框内,滤液分别穿过两侧 滤布,再经邻板板面流至滤液出口排走,固体则被截留于框内,如图所示,待滤饼充满滤框后, 即停止过滤。 若滤饼需要洗涤,可将洗水压人洗水通道,经洗涤板角端的暗孔进入板面与滤布之间。 第四章传热 一、热传导、对流传热 二、总传热 三、换热器及强化传热途径 一、热传导、对流传热: 传热基本方式: 1、热传导(宏观无位移):若物体各部分之间不发生相对位移,仅借分子、原子和自由电子等微 观粒子的热运动而引起的热量传递称为热传导(又称导热)。热传导的条件是系统两部分之间存 在温度差,此时热量将从高温部分传向低温部分,或从高温物体传向与它接触的低温物体,直至 整个物体的各部分温度相等为止。 2、热对流(宏观有位移):流体各部分之间发生相对位移所引起的热传递过程称为热对流(简称 对流)。热对流仅发生在流体中。在流体中产生对流的原因有二:一是因流体中各处的温度不 同而引起密度的差别,使轻者上浮,重者下沉,流体质点产生相对位移,这种对流称为自然对流;二是因泵(风机)或搅拌等外力所致的质点强制运动,这种对流称为强制对流。 3、热辐射(不需要介质):因热的原因而产生的电磁波在空间的传递,称为热辐射。所有物体(包 括固体、液体和气体)都能将热能以电磁波形式发射出去,而不需要任何介质,也就是说它可以 在真空中传播。 4、对流传热:流体流过固体壁面(流体温度与壁面温度不同)时的传热过程称为对流传热。 1 )流体无相变的对流传热流体在传热过程中不发生相变化,依据流体流动原因不同,可 分为两种情况。 ①强制对流传热,流体因外力作用而引起的流动; ②自然对流传热,仅因温度差而产生流体内部密度差引起的流体对..流动。 2)流体有相变的对流传热流体在传热过程中发生相变化,它分为两种情况。 ①蒸气冷凝,气体在传热过程中全部或部分冷凝为液体;②液体 沸腾,液体在传热过程中沸腾汽化,部分液体转变为气体 对流传热的温度分布情况 对流传热是集热对流和热传导于一体的综合现象。对流传热的热阻主要集中在层流内层,因此,减薄层流内层的厚度是强化对流传热的主要途径。 传热过程中热、冷流体(接触)热交换方式:(书 p211 ) 1、直接接触式换热和混合式换热器; 2、蓄热式换热和蓄热器; 3、典型的间壁式换热器:(列管换热器,区分壳程、管程、单/ 多壳程、单 / 多管程) 特定的管壳式换热器传热面积: S=n dL S ——传热面积; n——管数; d——管径, m;L——管长, m。 传热速率和热通量: 传热速率Q(又称热流量)指单位时间内通过传热面积的热量; 传热推动力(温度差)t。 传热速率 =;Q=R ——整个传热面的热阻, C / W 传热热阻R 热通量 q(又称传热速度)指单位面机的传热速率。 d Q ;q= t 2 。 q= ; R ’——单位传热面积的热阻,m . C / W d S R' 热传导基本规律: 傅里叶定律:傅立叶定律为热传导的基本定律,表示通过等温表面的导热速率与温度梯度及传热面积成正比,即: 通过平壁的稳态热传导: 1、单层平壁的热传导: Q .S. t S(t t 2 ) t 1 t 2 t Q t t b 1 b R q b R' b S S b——平壁厚度, m; △ t ——温度差,导热推动力,。 C ; R b 。 ——导热热阻, C /W;S R' b 2 。 W。 ——导热热阻,m . C / 2、多层平壁的热传导: 在稳态导热时,通过各层的导热速率必相等,即Q=Q1=Q2=Q3 ; 热通量也相等:q=q1=q2=q3 (三层) ( n 层) 通过圆筒壁的热传导: 1、单层圆筒壁的热传导: Q .S m.t S m2 r m L r m r 2 r1 2 L( t 1t2 ) b ln r 2/ r 1 r2 ln r1 2、多层圆筒壁的热传导: Q1=Q2=Q3=Q n(注意判断选择填空) q1>q2>q3>q n (n 层) 保温层的临界直径: 通常,热损失随保温层厚度的增加而减少。但是在小直径圆管外包扎性能不良的保温材料, 随保泪层厚度增加,可能反而使热损失增大。 (散热区、保温区,d0大于 B点保温才有意义) 二、总传热:(参考习题及例题) 热量衡算: 总传热速率方程: Q=KS t m t m t 2 t 1 (△t2需大于△t1) t 2 ln t 1 1 总传热系数 K、总热阻 K 总热阻 =热阻之和 三、换热器及强化传热途径: 间壁式换热器的类型:(掌握原理书p277) 管式换热器: 1、蛇管式换热器(沉浸式蛇管换热器、喷淋式蛇管换热器) 2、套管式换热器 3、管壳式换热器(固定管板式换热器、U形管换热器) 板式换热器: 1、夹套式换热器 2、板式换热器 3、螺旋板式换热器( I 、II 、III形)、 翅片式换热器: 1、翅片管式换热器 2、版翅片式换热器 热管换热器 间壁式换热器强化传热途径: 1、增大平均温度差△ t m 2、增大传热面积 S 1)翅化面; 2)异形表面; 3)多孔物质结构; 4)采用小直径传热管。 3、增大总传热系数 K 1)提高流体的流速; 2)增强流体的扰动; 3)在流体中加固体颗粒; 4)采用短管换热器; 5) 防止垢层形成和及时清除垢层。 第五章、蒸发(不挥发溶质) 一、概述及蒸发器 二、溶液沸点升高与温度差损失 三、多效蒸发及流程 一、概述及蒸发器: 单效蒸发与多效蒸发:单效蒸发与多效蒸发在操作中一般用冷凝方法将二次燕汽不断地移 出,否则蒸汽与沸腾溶液趋于平衡,使蒸发过程无法进行。若将二次蒸汽直接冷凝,而不利 用其冷凝热的操作称为单效蒸发。若将二次蒸汽引到下一蒸发器作为加热蒸汽,以利用其冷凝热,这种串联蒸发操作称为多效燕发。 常见蒸发器类型及原理(书P302) 循环形(非膜式)蒸发器: 1、中央循环管式(或标准式)蒸发器 2、悬筐式蒸发器 3、外热式蒸发器 4、强制循环蒸发器 (单程型)膜式蒸发器: 1、升膜蒸发器 2、降膜蒸发器 3、升 - 降膜蒸发器 4、刮板搅拌薄膜蒸发器 直接加热蒸发器 二、溶液沸点升高与温度差损失: 溶液的沸点: 溶液中含有不挥发的溶质,在相同条件下,其蒸气压比纯水的低,所以溶液的沸点就比纯水 的要高,两者之差称为因溶液蒸气压下降而引起的沸点升高。 例如,常压下20%(质量百分数)NaOH水溶液的沸点为108.5 ℃,而水的沸点为100℃,此时溶液沸点升高 8.5 度。 由于有沸点升高现象,使同条件下蒸发溶液时的有效温度差下降8.5 ℃,正好与溶液沸点升高值相等,故沸点升高又称为温度差损失。 温度差损失:(书P310) 温度差损失不仅仅是因为溶液中含有了不挥发性溶质引起的,蒸发器内的操作压力高于冷凝嚣以克服二次蒸汽从蒸发器流到冷凝器的阻力损失、蒸发器的操作需维持一定的液面等因素都会 造成温度差损失。 ’ 1、因溶液蒸气压下降而引起的温度差损失△ 2、因加热管内液柱静压力而引起的温度差损失△’’ 3、由于管路流动阻力而引起的温度差损失△’’’ 三、多效蒸发及流程 : (书 P322,搞清楚前后黏度、压强、温度) P1>P2>P3 T1>T2 >T3 溶液的沸点必纯溶剂的高,冷凝液的沸点高于二次蒸汽。 第六章蒸馏(液体混合物挥发度不同) 一、平衡关系 二、精馏原理及流程 三、精馏过程计算 一:平衡关系: 用饱和蒸气压和相平衡常数表示的气液平衡关系: 由拉乌尔定律得出, p- 溶液上方组分平衡分压,Pa。 p’ -在溶液温度下纯组分的饱和蒸气压,Pa。x- 溶液中组分的摩尔数。下标 A表示易挥发组分, B表 示难挥发组分。 Xb=(1-Xa) 泡点方程式 x A p p B0 p A0 p B0 露点方程式 y A p A p A0 x A p A0 p p B0 道尔顿分压定律得出。p p p p A0 p B0 挥发度v A p A 对于理想溶液 p 0 x A x A v A p A。VB同理表示 x A 相对挥发度:易挥发组分的挥发度与难挥发组分的挥发度之比 v A p A / x A v B p B / x B 相图:( t-x-y 图)( x-y 图) x 3、相平衡方程式:y 1 (1)x 4、简单蒸馏流程特点:简单蒸馏是将原料液一次加入蒸馏釜中,在恒压下加热使之部分汽化,产生的蒸气进入冷凝器中冷凝,随着过程的进行,釜液中易挥发组分含量不断降低,当釜液 组成达到规定值时,即停止蒸馏操作,釜液一次排出。 二、精馏原理及流程: 原理:液体混合物经多次部分汽化和冷凝后,便可得到几乎完全的分离。 流程:原料液经预热器加热到指定温度后.送入精馏塔的进料板,在进料板上与自塔上部下降的 回流液体汇合后,逐板溢流,最后流人塔底再沸器中。在每层板上,回流液体与上升蒸气互相接 触,进行传热传质过程。操作时,连续地从再沸器取出部分液体作为地底产品(釜残掖),部分 液体汽化,产生上升蒸气,依次通过各层塔板。塔顶蒸气进人冷凝器中被全部冷凝,并将部分冷 凝液用泵送回塔顶作为回流液体,其余部分经冷却器后被送出作为塔顶产品(馏出液)。 通常,将原料液进入的那层板称为加料板,加料板以上的塔段称为精馏段加料板以下的塔段(包括加料板)称为提馏段。 三、精馏过程计算: 总物料衡算F=D+W 易挥发组分衡算Fx F=Dy+Wx 塔顶易挥发组分的回收率塔釜难挥发组分的回收率D Dx D 100% Fx F W W (1 x W ) 100% F (1 x F ) 回流比: R L D 最小回流比R min x D y q R=(1.1~2.0) R min y q x q 操作线远离平衡线,N T 设备费 R L V V ,冷凝器、再沸器热负荷操作费进料热状况的影响及q线方程 q I I V V I I F L CP t r将1kmol原料变成饱和蒸汽所需热量 r1kmol原料的汽化潜热 并由此得到L,=L+qF及V'= V+( q-1) F 进料热状况对q 值及 q 线的影响: q 线方程 y q x F 必过点 e ( x , x ) x q 1 q 1 F F 操作线方程: 精馏段操作线方程: 总物料衡算 V =L +D 易挥发组分衡算 Vy n+1=Lx n +Dx D 操作线方程 y n 1 R x n 1 x D 必过点 a ( x D , x D ) R 1 R 1 提馏段操作线方程: 总物料衡算 L ‘ =V ’ +W 易挥发组分衡算 L , , , , +Wx x m =V y m+1 操作线方程 y m ' 1 L ' ' x m ' W x W 必过点 C ( x W , x W ) V V ' 或 , L ' ' W y m 1 L ' W x m L ' W x W 平衡线方程: y x 1 ( 1)x -------- 图形关系(记住)。 q=1, 斜率为 ,图像为 特殊 泡点 xq x F 进料 露点 q=0, 斜率为 0,图像为 1 、逐板计算法 理论版层数计算: 2 、图解法 逐板计算法: y 1 X D 平衡关系 X 1 操作关系 y 2 平衡关系 X 2 计算到 X X (饱和液体进料状况, 其他为 X ) n F q 说明第 n 层是加料板( n-1 层)。提馏段:同理 x , m x ( m-1 层)。 w 全塔效率与单板效率 E = N T 100% E mV y n y n 1 或 E mL x n 1 x n N P y n * y n 1 x n 1 x n * 塔板上气液两相的非理想流动 1. 返混现象 液沫夹带 塔板上部分液体产生与液体主体流动方向相反的流动为液沫夹带(又称雾沫夹带) 。 即液滴被上升的气体夹带到上一层塔板上。 气泡夹带 塔板上部分气体产生与气体主体方向相反的流动为气泡夹带。 即气泡被下降的液体 卷入下一层塔板上。 2. 气体和液体的不均匀分布 气体沿塔板的不均匀分布 由于液面落差 的存在,气体通过塔板时阻力大小不等,导致塔板 上气量分布不均。 液体沿塔板的不均匀分布 由于液体横向流过塔板时路径长短不一,使塔板的物质传递量减少。 不正确操作 液泛 在操作过程中,塔板上液体下降受阻并逐渐在塔板上积累,这种现象称为液泛(也称淹 塔)。根据引起液泛的原因不同,可以分为: ( 1)降液管液泛 液体流量过大降液管内液体不能及时排出或气体流量过大使降液管液面升高, 均会引起降液管液泛。 ( 2)夹带液泛气速过大导致液沫夹带量过大,板上液层增厚并各板液层相连造成液泛。 严重漏液 当气体通过筛孔的速度较小或气体分布不均匀时, 从孔道流下的液体量占液体流量 的 10%以上称为严重漏液。 第七章 吸 收(溶解度差异 ) 一、概述及平衡关系 二、传质理论 三、吸收塔计算 一、概述及平衡关系: 1、吸收依据: 混合物各组分在某种溶剂中溶解度差异 1 )分离混合气体以回收所需的组分; 高考化学工艺流程题答题规律大总结! 一、考点分析 无机化工题实际上是考查考生运用化学反应原理及相关知识来解决工业生产中实际问题的能力。解此类型题目的基本步骤是: ①从题干中获取有用信息,了解生产的产品 ②分析流程中的每一步骤,从几个方面了解流程:A.反应物是什么;B.发生了什么反应;C.该反应造成了什么后果,对制造产品有什么作用。抓住一个关键点:一切反应或操作都是为获得产品而服务。 ③从问题中获取信息,帮助解题。 了解流程后着手答题。对反应条件的分析可从以下几个方面着手: 对反应速率有何影响?对平衡转化率有何影响?对综合生产效益有何影响?如原料成本,原料来源是否广泛、是否可再生,能源成本,对设备的要求,环境保护(从绿色化学方面作答)。 二、工业流程题中常用的关键词 原材料:矿样(明矾石、孔雀石、蛇纹石、大理石、锂辉石、黄铜矿、锰矿、高岭土,烧渣),合金(含铁废铜),药片(补血剂),海水(污水) 灼烧(煅烧):原料的预处理,不易转化的物质转化为容易提取的物质:如海带中提取碘 酸:溶解、去氧化物(膜)、调节pH促进水解(沉淀) 碱:去油污,去铝片氧化膜,溶解铝、二氧化硅,调节pH促进水解(沉淀) 氧化剂:氧化某物质,转化为易于被除去(沉淀)的离子氧化物:调节pH促进水解(沉淀) 控制pH值:促进某离子水解,使其沉淀,利于过滤分离 煮沸:促进水解,聚沉后利于过滤分离;除去溶解在溶液中的气体,如氧气趁热过滤:减少结晶损失;提高纯度 三、工业流程常见的操作 (一)原料的预处理 ①粉碎、研磨:减小固体的颗粒度,增大固体与液体或气体间的接触面积,加快反应速率。(研磨适用于有机物的提取,如苹果中维生素C的测定等) ②水浸:与水接触反应或溶解。 ③酸浸:通常用酸溶,如用硫酸、盐酸、浓硫酸等,与酸接触反应或溶解,使可溶性金属离 子进入溶液,不溶物通过过滤除去。近年来,在高考题出现了“浸出”操作。在化工生产题中,矿物原料“浸出”的任务是选择适当的溶剂,使矿物原料中的有用组分或有害杂质选择性地溶解,使其转入溶液中,达到有用组分与有害杂质或与脉石组分相分离的目的。 ④灼烧:除去可燃性杂质或使原料初步转化,如从海带中提取碘时的灼烧就是为了除去可燃性杂质,将有机碘转化为碘盐。 化工流程题特点及常见考点( 重点班 ) 化学组杨锐钦 一、化工流程题特点 1. 工业生产流程题主要框架: 原料→I 预处理→II 分离提纯→III 核心反应→产品 抓箭头:①主线主产品;②支线副产品;③回头循环品。 2.试题本质:想办法从混合物中制取纯净物。 3.核心考点:物质的分离操作、除杂试剂的选择、生产条件的控制、产品分离提纯。 (1 )据流程图或题目提供的反应物和部分生成物书写方程式;(2)滤液滤渣的成分;(3) 调 PH值的范围及试剂的选择;( 4)核心反应条件的控制和原因;( 5)选择化学除杂试剂及 原因;( 6)绿色化学评价;(7)实验操作和仪器;( 8)相关计算 4.读题: ( 1)先粗读:明确原料、明确杂质、明确目标产品。先不必把每个环节的原理都搞清 楚。 (2)针对问题再精读:分析细节,根据问题去研究某一步或某一种物质。 (3)第三,要看清所问问题,不能答非所问,并注意语言表达的规范 性。二、常见考点 (一)、样品的预处理 1.矿样的预处理方法: (1)原料预处理 ①粉碎目的:增大接触面积,加快反应速率;或使反应更完全。 ②煅烧目的: (A) 除去有机物杂质或者碳的杂质 ; 或 (B) 使一些具有还原性的物质被空气中氧 气氧化、分解(思考样品成分中是否有具有还原性的物质,且看在整个流程中是否需要被氧 化);或(C) 改变矿样的结构,使其在后面的酸溶(或碱溶或水溶)中更易溶解。③溶解:有酸 溶、碱溶、水溶;又叫酸浸、碱浸、水浸。 酸浸目的:与酸反应,使可溶性金属离子进入溶液,不溶物通过过滤除去。 碱浸目的:与碱反应,使可溶性金属离子进入溶液,不溶物通过过滤除去。 水浸目的:使可溶性金属离子进入溶液,不溶物通过过滤除去。 【注】浸出:固体加水(酸)溶解得到离子。 浸出率:转入浸出液中的溶质量与物料原含溶质总量的比值。 提高浸出率的措施通常有粉碎、搅拌、升温、增大酸(或碱)浓度。 2. 植物样品预处理: (1)灼烧:如海带中碘的提取、茶叶中铁含量的测定,灼烧成灰之后,再用水浸, 为了加快其溶解速率可以加热、不断搅拌。 (2)研磨成汁:提取植物样品中的有机物所用方法(如波菜中草酸含量的测定),研磨成 汁之后,如该有机物可溶于水,研磨之后,可用水浸取;如该有机物不溶于水,就用有机 溶剂来萃取。 (二)、控制反应条件 1.调节 pH 值目的:控制溶液酸碱性使某些金属离子形成氢氧化物沉淀。 调节 PH值除杂:(常考除 Fe2+、Fe3+)(1)除 Fe2+要将其氧化成Fe3+,氧化剂可选择H2O2、 Cl 2、HNO3、 NaClO 或氯水,到底选择谁,要据具体的题景来选择;(2)调PH值所加试剂: 一般是含被提纯物质中的金属阳离子对应的 a. 金属、 b. 金属氧化物、 c. 金属氢氧化物、 d. + 金属碳酸盐(总之,这些物质要能与H 反应,又难溶于水,这样可即使过量而又不会引入新 2+3+ 的杂质离子)。例如:若要除去Cu 溶液中混有的Fe,可加入CuO、 Cu(OH)2、Cu2(OH)2CO3 ++ 等物质来调节溶液的pH 值。有时候也可能加NaOH或氨水来调PH值(要求Na 、 NH4不会在 后续的程序中难以分离),要据题意具体分析(3) PH 值的调节范围:根据离子完全沉淀或 开始沉淀的PH值数据来选择,应该是题目中原始数据的组合。 例如:已知下列物质开始沉淀和沉淀完全时的pH 第一章流体与输送机械 1、基本研究方法:实验研究法、数学模型法 2、牛顿粘性定理: 应用条件: 3、阻力平方区:管内阻力与流速平方成正比的流动区域; 原因:流体质点与粗糙管壁上凸出的地方直接接触碰撞产生的惯性阻力在压倒地位。 4、流动边界层:紧贴壁面非常薄的一区域,该薄层内流体速度梯度非常大。 流动边界层分离的弊端:增加流动阻力。 优点:增加湍动程度。 5、流体黏性是造成管内流动机械能损失的原因。 6、压差计: 文丘里 孔板 转子 7、离心泵工作原理: 离心泵工作时,液体在离心力的作用下从叶轮中心被抛向外缘并获得能 量,使叶轮外缘的液体静压强提高。液体离开叶轮进入泵壳后,部分动能转变成为静压能。当液体从叶轮中心被抛向外缘时,在中心处形成低压区,在外界与泵吸入口的压差作用下,致使液体被吸进叶轮中心。 8、汽蚀现象:离心泵安装过高,泵进口处的压力降低至同温度下液体的饱和蒸汽压,使液体气化,产生气泡。气泡随液体进入高压区后立即凝结消失,形成真空导致巨大的水力冲击,对泵造成损害。 9、气缚现象:离心泵启动时,若泵内存在空气,由于空气密度大大低于输送流体的密度,经离心力的作用产生的真空度小,没有足够的压差使液体进入泵内,从而吸不上液体。 10、泵壳作用:收集液体和能量转化(将流体部分动能转化为静压能) 11、离心泵在设计流量下工作效率最高,是因为:此时水力损失小。 12、大型泵的效率通常高于小型泵是由于:容积效率大。 13、叶轮后弯的优缺点 优点:叶片后弯使液体势能提高大于动能提高,动能在蜗壳中转化为势能的损失小,泵的效率高。 缺点:产生同样的理论压头所需泵的体积大。 14、正位移泵(往复泵)的特点:a流量与管路状况、流体温度、黏度无关; b 压头仅取决于管路特性。(耐压强度) c 不能在关死点运转。 d 很好的自吸 化工原理(上)各章主要知识点 绪论「 三个传递:动量传递、热量传递和质量传递 三大守恒定律:质量守恒定律——物料衡算;能量守恒定律——能量衡算;动量守恒定律——动量衡算 第一节流体静止的基本方程 、密度 1. 气体密度: m pM V RT 2. 液体均相混合物密度: 1 a 1 a 2 a n -(m —混合液体的密度, a —各组分质量分数, n — 各组 分密度) m 1 2 n 3. 气体混合物密度: m 1 1 2 2 n n ( m —混合气体的密度, —各组分体积分数) 4. 压力或温度改变时, 密度随之改变很小的流体成为不可压缩流体 (液体);若有显著的改变则称为可压缩流体 (气体)。 、.压力表示方法 1、常见压力单位及其换算关系: 1atm 101300 Pa 101.3kPa 0.1013MPa 10.33mH 2O 760mmHg 2 、压力的两种基准表示:绝压(以绝对真空为基准) 、表压(真空度)(以当地大气压为基准,由压力表或真空表测岀) 表压=绝压一当地大气厂 真空度=当地大气 三、流体静力学方程 1、静止流体内部任一点的压力,称为该点的经压力,其特点为: (1) 从各方向作用于某点上的静压力相等; (2) 静压力的方向垂直于任一通过该点的作用平面; (3) 在重力场中,同一水平面面上各点的静压力相等,高度不同的水平面的经压力岁位置的高低而变化。 2 、流体静力学方程(适用于重力场中静止的、连续的不可压缩流体) P 1 g (z 1 Z 2) d (Z 1 Z 2) g z p (容器内盛液体,上部与大气相通, p/ g —静压头,"头"一液位高度,z p —位压头 或位头) 上式表明:静止流体内部某一水平面上的压力与其位置及流体密度有关,所在位置与低则压力愈大。 四、流体静力学方程的应用 1 、 U 形管压差计 指示液要与被测流体不互溶,且其密度比被测流体的大。 测量液体:P 1 p 2 ( 0 )gR g (z 2乙) 测量气体:p 1 p 2 0gR 2、双液体U 形管压差计 p 1 p 2 ( 2 第二节流体流动的基本方程 一、基本概念 3 1 1 、体积流量(流量 V s ):流体单位时间内流过管路任意流量截面(管路横截面)的体积。单位为 m s 2 、质量流量( m s ):单位时间内流过任意流通截面积的质量。单位为 kg s 1 m s V s P 2 P 1 g p g 1 )gR 高考化学大题专题(四) 工艺流程 一、【考点分析】无机化工题实际上是考查考生运用化学反应原理及相关知识来解决工业生产中实际问题的能力。解此类型题目的基本步骤是:①从题干中获取有用信息,了解生产的产品②分析流程中的每一步骤,从几个方面了解流程:A .反应物是什么B .发生了什么反应C .该反应造成了什么后果,对制造产品有什么作用。抓住一个关键点:一切反应或操作都是为获得产品而服务。③从问题中获取信息,帮助解题。 了解流程后着手答题。对反应条件的分析可从以下几个方面着手: 对反应速率有何影响?对平衡转化率有何影响?对综合生产效益有何影响?如原料成本,原料来源是否广泛、是否可再生,能源成本,对设备的要求,环境保护(从绿色化学方面作答)。 二、【工业流程题中常用的关键词】 原材料:矿样(明矾石、孔雀石、蛇纹石、大理石、锂辉石、黄铜矿、锰矿、高岭土,烧渣),合金(含铁废铜),药片(补血剂),海水(污水) 灼烧(煅烧):原料的预处理,不易转化的物质转化为容易提取的物质:如海带中提取碘 酸:溶解、去氧化物(膜)、调节pH 促进水解(沉淀) 碱:去油污,去铝片氧化膜,溶解铝、二氧化硅,调节pH 促进水解(沉淀) 氧化剂:氧化某物质,转化为易于被除去(沉淀)的离子 氧化物:调节pH 促进水解(沉淀) 控制pH 值:促进某离子水解,使其沉淀,利于过滤分离 煮沸:促进水解,聚沉后利于过滤分离;除去溶解在溶液中的气体,如氧气 趁热过滤:减少结晶损失;提高纯度 三、【工业流程常见的操作】 (一)原料的预处理 ①溶解:通常用酸溶。如用硫酸、盐酸、浓硫酸等 ②灼烧:如从海带中提取碘 ③煅烧:如煅烧高岭土改变结构,使一些物质能溶解。并使一些杂质高温下氧化、分解 ④研磨:适用于有机物的提取如苹果中维生素C 的测定等。 (二)控制反应条件的方法 ①控制溶液的酸碱性使其某些金属离子形成氢氧化物沉淀——pH 值的控制。 +++调节pH 所需的物质一般应满足两点:能与H 反应,使溶液pH 值增大不引入新杂质。若要除去Cu 2溶液中混有的Fe 3, 可加入CuO 、Cu(OH)2、Cu 2(OH)2CO 3等物质来调节溶液的pH 值 ②蒸发、反应时的气体氛围 ③加热的目的:加快反应速率或促进平衡向某个方向移动 ④降温反应的目的:防止某物质在高温时会溶解或为使化学平衡向着题目要求的方向移动 ⑤趁热过滤:防止某物质降温时会析出 ⑥冰水洗涤:洗去晶体表面的杂质离子,并减少晶体在洗涤过程中的溶解损耗 (三)物质的分离和提纯的方法 ①结晶——固体物质从溶液中析出的过程(蒸发溶剂、冷却热饱和溶液、浓缩蒸发) 重结晶是利用固体物质均能溶于水,且在水中溶解度差异较大的一种除杂质方法。 ②过滤——固、液分离 ③蒸馏——液、液分离 ④分液——互不相溶的液体间的分离 ⑤萃取——用一种溶剂将溶质从另一种溶剂中提取出来。 ⑥升华——将可直接气化的固体分离出来。 一、流体力学及其输送 1.单元操作:物理化学变化的单个操作过程,如过滤、蒸馏、萃取。 2.四个基本概念:物料衡算、能量衡算、平衡关系、过程速率。 3.牛顿粘性定律:F=±τA=±μAdu/dy,(F:剪应力;A:面积;μ:粘度;du/dy:速度梯度)。 4.两种流动形态:层流和湍流。流动形态的判据雷诺数Re=duρ/μ;层流—2000—过渡—4000—湍流。当流体层流时,其平均速度是最大流速的1/2。 5.连续性方程:A1u1=A2u2;伯努力方程:gz+p/ρ+1/2u2=C。 6.流体阻力=沿程阻力+局部阻力;范宁公式:沿程压降:Δpf=λlρu2/2d,沿程阻力:Hf=Δpf/ρg=λl u2/2dg(λ:摩擦系数);层流时λ=64/Re,湍流时λ=F(Re,ε/d),(ε:管壁粗糙度);局部阻力hf=ξu2/2g,(ξ:局部阻力系数,情况不同计算方法不同) 7.流量计:变压头流量计(测速管、孔板流量计、文丘里流量计);变截面流量计。孔板流量计的特点;结构简单,制造容易,安装方便,得到广泛的使用。其不足之处在于局部阻力较大,孔口边缘容易被流体腐蚀或磨损,因此要定期进行校正,同时流量较小时难以测定。 转子流量计的特点——恒压差、变截面。 8.离心泵主要参数:流量、压头、效率(容积效率?v:考虑流量泄漏所造成的能量损失;水力效率?H:考虑流动阻力所造成的能量损失;机械效率?m:考虑轴承、密 封填料和轮盘的摩擦损失。)、轴功率;工作点(提供与所需水头一致);安装高度(气蚀现象,气蚀余量);泵的型号(泵口直径和扬程);气体输送机械:通风机、鼓风机、压缩机、真空泵。 9. 常温下水的密度1000kg/m3,标准状态下空气密度1.29 kg/m3 1atm =101325Pa=101.3kPa=0.1013MPa=10.33mH2O=760mmHg (1)被测流体的压力 > 大气压 表压 = 绝压-大气压 (2)被测流体的压力 < 大气压 真空度 = 大气压-绝压= -表压 10. 管路总阻力损失的计算 11. 离心泵的构件: 叶轮、泵壳(蜗壳形)和 轴封装置 离心泵的叶轮闭式效率最高,适用于输送洁净的液体。半闭式和开式效率较低,常用于输送浆料或悬浮液。 气缚现象:贮槽内的液体没有吸入泵内。汽蚀现象:泵的安装位置太高,叶轮中各处压强高于被输送液体的饱和蒸汽压。原因(①安装高度太高②被输送流体的温度太高,液体蒸汽压过高;③吸入管路阻力或压头损失太高)各种泵:耐腐蚀泵:输送酸、碱及浓氨水等腐蚀性液体 12. 往复泵的流量调节 ? (1)正位移泵 ? 流量只与泵的几何尺寸和转速有关,与管路特性无关,压头与流量无关,受管路的承压能力所限制,这种特性称为正位移性,这种泵称为正位移泵。 222'2e 2e 2u d l l u d l l u d l h h h f f f ??? ? ??++=???? ??+=??? ??+=+=∑∑∑∑∑∑ζλλζλ 化工原理(上)各章主要知识点 三大守恒定律:质量守恒定律——物料衡算;能量守恒定律——能量衡算;动量守恒定律——动量衡算 第一节 流体静止的基本方程 一、密度 1. 气体密度:RT pM V m = = ρ 2. 液体均相混合物密度: n m a a a ρρρρn 22111+++=Λ (m ρ—混合液体的密度,a —各组分质量分数,n ρ—各组 分密度) 3. 气体混合物密度:n n m ρ?ρ?ρ?ρ+++=Λ2211(m ρ—混合气体的密度,?—各组分体积分数) 4. 压力或温度改变时,密度随之改变很小的流体成为不可压缩流体(液体);若有显著的改变则称为可压缩流体(气体)。 二、.压力表示方法 1、常见压力单位及其换算关系: mmHg O mH MPa kPa Pa atm 76033.101013.03.10110130012===== 2、压力的两种基准表示:绝压(以绝对真空为基准)、表压(真空度)(以当地大气压为基准,由压力表或真空表测出) 表压 = 绝压—当地大气压 真空度 = 当地大气压—绝压 三、流体静力学方程 1、静止流体内部任一点的压力,称为该点的经压力,其特点为: (1)从各方向作用于某点上的静压力相等; (2)静压力的方向垂直于任一通过该点的作用平面; (3)在重力场中,同一水平面面上各点的静压力相等,高度不同的水平面的经压力岁位置的高低而变化。 2、流体静力学方程(适用于重力场中静止的、连续的不可压缩流体) )(2112z z g p p -+=ρ )(2121z z g p g p -+=ρρ p z g p =ρ(容器内盛液体,上部与大气相通,g p ρ/—静压头,“头”—液位高度,p z —位压头 或位头) 上式表明:静止流体内部某一水平面上的压力与其位置及流体密度有关,所在位置与低则压力愈大。 四、流体静力学方程的应用 1、U 形管压差计 指示液要与被测流体不互溶,且其密度比被测流体的大。 测量液体:)()(12021z z g gR p p -+-=-ρρρ 测量气体: gR p p 021ρ=- 2、双液体U 形管压差计 gR p p )(1221ρρ-=- 第二节 流体流动的基本方程 一、基本概念 1、体积流量(流量s V ):流体单位时间内流过管路任意流量截面(管路横截面)的体积。单位为13 -?s m 2、质量流量(s m ):单位时间内流过任意流通截面积的质量。单位为1 -?s kg s s V m ρ= 化学工艺流程答题规律总结 第Ⅰ部分 一、【考点分析】 无机化工题实际上是考查考生运用化学反应原理及相关知识来解决工业生产中实际问题的能力。解此类型题目的基本步骤是: ①从题干中获取有用信息,了解生产的产品 ②分析流程中的每一步骤,从几个方面了解流程:A.反应物是什么;B.发生了什么反应;C.该反应造成了什么后果,对制造产品有什么作用。抓住一个关键点:一切反应或操作都是为获得产品而服务。 ③从问题中获取信息,帮助解题。 了解流程后着手答题。对反应条件的分析可从以下几个方面着手: 对反应速率有何影响?对平衡转化率有何影响?对综合生产效益有何影响?如原料成本,原料来源是否广泛、是否可再生,能源成本,对设备的要求,环境保护(从绿色化学方面作答)。 二、【工业流程题中常用的关键词】 原材料:矿样(明矾石、孔雀石、蛇纹石、大理石、锂辉石、黄铜矿、锰矿、高岭土,烧渣),合金(含铁废铜),药片(补血剂),海水(污水) 灼烧(煅烧):原料的预处理,不易转化的物质转化为容易提取的物质:如海带中提取碘 酸:溶解、去氧化物(膜)、调节pH促进水解(沉淀) 碱:去油污,去铝片氧化膜,溶解铝、二氧化硅,调节pH促进水解(沉淀) 氧化剂:氧化某物质,转化为易于被除去(沉淀)的离子氧化物:调节pH促进水解(沉淀) 控制pH值:促进某离子水解,使其沉淀,利于过滤分离 煮沸:促进水解,聚沉后利于过滤分离;除去溶解在溶液中的气体,如氧气趁热过滤:减少结晶损失;提高纯度 三、【工业流程常见的操作】 (一)原料的预处理 ①粉碎、研磨:减小固体的颗粒度,增大固体与液体或气体间的接触面积,加快反应速率。(研磨适用于有机物的提取,如苹果中维生素C的测定等) ②水浸:与水接触反应或溶解。 ③酸浸:通常用酸溶,如用硫酸、盐酸、浓硫酸等,与酸接触反应或溶解,使可溶性金属离子进入溶液,不溶物通过过滤除去。近年来,在高考题出现了“浸出”操作。在化工生产题中,矿物原料“浸出”的任务是选择适当的溶剂,使矿物原料中的有用组分或有害杂质选择性地溶解,使其转入溶液中,达到有 第一章 流体流动与输送机械 1. 流体静力学基本方程:gh p p ρ+=02 2. 双液位U 型压差计的指示: )21(21ρρ-=-Rg p p ) 3. 伯努力方程:ρ ρ222212112121p u g z p u g z ++=++ 4. 实际流体机械能衡算方程:f W p u g z p u g z ∑+++=++ ρρ222212112121+ 5. 雷诺数:μρ du =Re 6. 范宁公式:ρρμλf p d lu u d l Wf ?==??=2 2322 7. 哈根-泊谡叶方程:2 32d lu p f μ=? 8. 局部阻力计算:流道突然扩大:2211?? ? ??-=A A ξ流产突然缩小:??? ??-=2115.0A A ξ 第二章 非均相物系分离 1. 恒压过滤方程:t KA V V V e 222=+ 令A V q /=,A Ve q e /=则此方程为:kt q q q e =+22 第三章 传热 1. 傅立叶定律:n t dA dQ ??λ-=,dx dt A Q λ-= 2. 热导率与温度的线性关系:)1(0t αλλ+= 3. 单层壁的定态热导率:b t t A Q 21-=λ,或m A b t Q λ?= 4. 单层圆筒壁的定态热传导方程: )ln 1(21 221r r t t l Q λπ-=或m A b t t Q λ21-= 5. 单层圆筒壁内的温度分布方程:C r l Q t +- =ln 2λπ(由公式4推导) 6. 三层圆筒壁定态热传导方程:3 4123212141ln 1ln 1ln 1(2r r r r r r t t l Q λλλπ++-= 7. 牛顿冷却定律:)(t t A Q w -=α,)(T T A Q w -=α 8. 努塞尔数λαl Nu =普朗克数λμCp =Pr 格拉晓夫数22 3μ ρβtl g Gr ?= 9. 流体在圆形管内做强制对流: 10000Re >,1600Pr 6.0<<,50/>d l k Nu Pr Re 023.08.0=,或k Cp du d ??? ? ????? ??=λμμρλα8.0023.0,其中当加热时,k=0.4,冷却时k=0.3 10. 热平衡方程:)()]([1222211t t c q T T c r q Q p m s p m -=-+= 无相变时:)()(12222111t t c q T T c q Q p m p m -=-=,若为饱和蒸气冷凝:)(12221t t c q r q Q p m m -== 11. 总传热系数:2 1211111d d d d b K m ?+?+=αλα 12. 考虑热阻的总传热系数方程: 212121211111d d R R d d d d b K s s m ?++?+?+=αλα 13. 总传热速率方程:t KA Q ?= 14. 两流体在换热器中逆流不发生相变的计算方程:???? ??-=--2 2111112211ln p m p m p m c q c q c q KA t T t T 15. 两流体在换热器中并流不发生相变的计算方程:???? ??+=--2 2111122111ln p m p m p m c q c q c q KA t T t T 16. 两流体在换热器中以饱和蒸气加热冷流体的计算方程:2 221ln p m c q KA t T t T =-- 第四章 蒸发 1. 蒸发水量的计算:110)(Lx x W F Fx =-= 2. 水的蒸发量:)1(1 0x x F W -= 3. 完成时的溶液浓度:W F F x -= 0 4. 单位蒸气消耗量:r r D W '=,此时原料液由预热器加热至沸点后进料,且不计热损失,r 为加热时的蒸气汽化潜热r ’为二次蒸气的汽化潜热 第一章 流体流动 一、压强 1、单位之间的换算关系: 221101.3310330/10.33760atm kPa kgf m mH O mmHg ==== 2、压力的表示 (1)绝压:以绝对真空为基准的压力实际数值称为绝对压强(简称绝压),是流体的真实压强。 (2)表压:从压力表上测得的压力,反映表内压力比表外大气压高出的值。 表压=绝压-大气压 (3)真空度:从真空表上测得的压力,反映表内压力比表外大气压低多少 真空度=大气压-绝压 3、流体静力学方程式 0p p gh ρ=+ 二、牛顿粘性定律 F du A dy τμ= = τ为剪应力; du dy 为速度梯度;μ为流体的粘度; 粘度是流体的运动属性,单位为Pa ·s ;物理单位制单位为g/(cm·s),称为P (泊),其百分之一为厘泊cp 111Pa s P cP ==g 液体的粘度随温度升高而减小,气体粘度随温度升高而增大。 三、连续性方程 若无质量积累,通过截面1的质量流量与通过截面2的质量流量相等。 111222u A u A ρρ= 对不可压缩流体 1122u A u A = 即体积流量为常数。 四、柏努利方程式 单位质量流体的柏努利方程式: 22u p g z We hf ρ???++=-∑ 22u p gz E ρ ++=称为流体的机械能 单位重量流体的能量衡算方程: Hf He g p g u z -=?+?+?ρ22 z :位压头(位头);22u g :动压头(速度头) ;p g ρ:静压头(压力头) 有效功率:Ne WeWs = 轴功率:Ne N η = 五、流动类型 雷诺数:Re du ρ μ = Re 是一无因次的纯数,反映了流体流动中惯性力与粘性力的对比关系。 (1)层流: Re 2000≤:层流(滞流) ,流体质点间不发生互混,流体成层的向前流动。圆管内层流时的速度分布方程: 2 max 2(1)r r u u R =- 层流时速度分布侧型为抛物线型 (2)湍流 Re 4000≥:湍流(紊流) ,流体质点间发生互混,特点为存在横向脉动。 即,由几个物理量组成的这种数称为准数。 六、流动阻力 1、直管阻力——范宁公式 2 2 f l u h d λ= f f f p h H g g ρ?== (1)层流时的磨擦系数:64 Re λ=,层流时阻力损失与速度的一次方成正比,层流区又称为阻力一次方区。 (2)湍流时的摩擦系数 ①(Re,)f d ελ=(莫狄图虚线以下):给定Re ,λ随d ε增大而增大;给定d ε ,λ 随Re 增大而减小。(2f p u λ?∝,虽然u 增大时, Re 增大, λ减小,但总的f p ?是增大的) ②()f d ελ=(莫狄图虚线以上),λ仅与d ε 有关,2f p u ?∝,这一区域称为阻力 平方区或完全湍流区。 2、局部阻力 (1)阻力系数法 工艺流程题解题技巧 一、除杂、分离、提纯类工艺流程题 本质就是对混合物的除杂、分离、提纯。①首先,找出要得到的主要物质是什么,混有哪些杂质;②然后,认真分析当加入某一试剂后,能与什么物质发生反应,生成了什么产物;③最后,思考要用什么样的方法才能将杂质除去。这样才能每一步所加试剂或操作的目的。 二、物质制备类工艺流程题这样的题目一般①先是确定要制备什么物质,从题干或问题中获取有用信息,了解产品的性质(具有某些特殊性质的产物,要采取必要的措施来避免在生产过程中产生其它杂质,比如:产品受热易分解,可能要低温烘干、减压烘干、减压蒸发等);②分析流程中的每一步骤,从几个方面了解流程:反应物是什么?反应方程式是什么?该反应造成了什么后果?对制造产品有什么作用?③从问题中获取信息,帮助解题。标准化问题要标准化回答。 题目中的信息往往是制备该物质的关键所在。产物如果具有某些特殊性质,则要采取必要的措施来避免在生产过程中产生其它杂质。如: ⑴如果在制备过程中出现一些受热易分解的物质或产物,则要注意对温度的控制。 ⑵如果产物是一种会水解的盐,且水解产物中有挥发性的酸产生时,则要加相对应的酸来防止水解。如:制备FeCb、AICI3、MgC2、Cu(NO)2等物质时,要蒸干其溶液得到固体溶质时,都要加相应的酸或在酸性气流中干燥来防止它水解,否则得到的产物分别是F Q Q、AI2Q、MgOCuQ而像Al2(SO)3、NaAIQ、NaCO 等盐溶液,虽然也发生水解,但产物中AI(QH)3、HSQ、NaHCQ、NaOH都不是挥发性物质, 在蒸发时, 抑制了盐的水解, 最后得到的还是溶质本身。 ⑶如果产物是一种强的氧化剂或强的还原剂,则要防止它们发生氧化还原的物质,如:含Fe2+、SQ2-等离子的物质,则要防止与氧化性强的物质接触。 ⑷如果产物是一种易吸收空气中的CQ或水(潮解或发生反应)而变质的物 质(如NaOH固体等物质),则要注意防止在制备过程中对CO或水的除去,也要防止空气中的CO或水进入装置中。 化学工艺流程答题规律详细总结 作者:日期: 化学工艺流程答题规律总结 第I部分 一、【考点分析】 无机化工题实际上是考查考生运用化学反应原理及相关知识来解决工业生产中实际问题的能力。解此 类型题目的基本步骤是: ①从题干中获取有用信息,了解生产的产品 ②分析流程中的每一步骤,从几个方面了解流程:A ?反应物是什么;E.发生了什么反应;C.该反应造 成了什么后果,对制造产品有什么作用。抓住一个关键点:一切反应或操作都是为获得产品而服务。 ③从问题中获取信息,帮助解题。 了解流程后着手答题。对反应条件的分析可从以下几个方面着手: 对反应速率有何影响?对平衡转化率有何影响?对综合生产效益有何影响?如原料成本,原料来源是 否广泛、是否可再生,能源成本,对设备的要求,环境保护(从绿色化学方面作答)。 二、【工业流程题中常用的关键词】 原材料:矿样(明矶石、孔雀石、蛇纹石、大理石、锂辉石、黄铜矿、锰矿、高岭土,烧渣),合金(含铁废铜),药片(补血剂),海水(污水) 灼烧(煅烧):原料的预处理,不易转化的物质转化为容易提取的物质:如海带中提取碘 酸:溶解、去氧化物(膜)、调节pH促进水解(沉淀) 碱:去油污,去铝片氧化膜,溶解铝、二氧化硅,调节p H促进水解(沉淀) 氧化剂:氧化某物质,转化为易于被除去(沉淀)的离子氧化物:调节p H促进水解(沉淀) 控制p H值:促进某离子水解,使其沉淀,利于过滤分离 煮沸:促进水解,聚沉后利于过滤分离;除去溶解在溶液中的气体,如氧气趁热过滤:减少结晶损失;提高纯度 三、【工业流程常见的操作】 (一)原料的预处理 ①粉碎、研磨:减小固体的颗粒 △ 初三化学培优专题提高(十七) ——工艺流程题 1.下图是氧化沉淀法生产复印用高档Fe 3O 4粉的工艺流程简图,根据要求回答问题。 (1)铁的另两种常见氧化物的化学式是 、 。 (2)加水溶解过程中,在实验室里通常要使用的玻璃仪器有烧杯和 ,操作A 的名称 是 。 (3 )副产品P 是 ,由溶液N 获得该副产品的操作顺序是b → → →d 。 a .过滤 b .加热浓缩 c .冷却结晶 d .晶体加热至完全失去结晶水 (4)通空气时的化学方程式是4Fe (OH )2 + 2H 2O + O 2 === 4 Fe (OH )3,由沉淀M 获得Fe 3O 4的过程中发生的反应为Fe (OH )2 + 2Fe (OH )3 === Fe 3O 4 + 4H 2O ,控制“一定量空气 ”的目的是 ,沉淀M 中Fe (OH )2 和Fe (OH )3的最佳质量比为 。 (相对分子质量:Fe (OH )2 —90,Fe (OH )3—107) 2.(11分)我市濒江临海,有较长的海岸线,海洋资源十分丰富。 ⑴海水晒盐可获得粗盐,在实验室中粗盐经过溶解、 、 可制得精盐。 ⑵晒盐后得到的卤水中含有MgCl 2、KCl 和MgSO 4等物质,右图是它们的溶解度曲线示意图。 ①设t 1℃时MgCl 2、KCl 和MgSO 4三种物质的溶解度分别为a 、b 、c ,则它们的大小关系为 。 ②将卤水加热到t 2℃以上,根据溶解度曲线,首先析出的晶体是 。 ⑶目前世界上60%的镁是从海水中提取的。其主要步骤如下: ①提取Mg 的过程中,试剂A 可以选用_________,试剂B 选用_________,由无水MgCl 2制取Mg 的反应类型为 。 ②分离出Mg(OH)2后的NaCl 溶液中还含有CaCl 2、Na 2SO 4等杂质,为了获得NaCl 溶液,在分离后的溶液中依次加入过量的BaCl 2溶液、Na 2CO 3溶液,过滤,再向滤液中加入适量盐酸。实验中加入过量BaCl 2溶液是为了除去 ;加入过量Na 2CO 3溶液的目的是 。 ⑷目前海水淡化普遍采用“多级闪急蒸馏法”,证明蒸馏得到的水为淡水的方法是 。海底矿产资源“可燃冰”,其主要成分是水合甲烷晶体(CH 4·n H 2O ),若水合甲烷晶体中CH 4的质量分数为10%,则水合甲烷晶体的化学式为 。 t 1 t 2 温度/℃ 溶解度/g 化工流程题答题套路归纳 (1)增大原料浸出率(离子在溶液中的含量多少)的措施:搅拌、升高温度、延长浸出时间、增大气体的流速(浓度、压强),增大气液或固液接触面积。 (2)加热的目的:加快反应速率或促进平衡向某个方向(一般是有利于生成物生成的方向)移动。 (3)温度不高于××℃的原因:适当加快反应速率,但温度过高会造成(如浓硝酸)挥发、(如H2O2、NH4HCO3)分解、(如Na2SO3)氧化或促进(如AlCl3)水解等,影响产品的生成。 (4)从滤液中提取一般晶体(溶解度随温度升高而增大的晶体,如KNO3)的方法:蒸发浓缩(至有晶膜出现)、冷却结晶、过滤、洗涤(冰水洗、热水洗、乙醇洗)、干燥。 (5)从滤液中提取溶解度受温度影响较小或随温度升高而减小的晶体(如NaCl中混有少量KNO3)的方法:蒸发浓缩、趁热过滤(如果温度下降,杂质也会以晶体的形式析出来)、洗涤、干燥。 (6)溶液配制、灼烧、蒸发、过滤用到的仪器。 配制溶液:容量瓶、烧杯、玻璃棒、胶头滴管、量筒(天平) 灼烧:坩埚、泥三角、三脚架、酒精灯(坩埚钳、干燥器) 蒸发:蒸发皿、玻璃棒、三脚架、酒精灯 过滤:漏斗、玻璃棒、烧杯(铁架台、铁圈) (7)控制某反应的pH值使某些金属离子以氢氧化物的形式沉淀:调节pH所用试剂为主要元素对应的氧化物、碳酸盐、碱,以避免引入新的杂质;pH分离时的范围确定、范围过小的后果(导致某离子沉淀不完全)或过大的后果(导致主要离子开始沉淀)。 例如:已知下列物质开始沉淀和沉淀完全时的pH如下表所示 (8)减压蒸馏(减压蒸发)的原因:减小压强,使液体沸点降低,防止(如H2O2、浓硝酸、NH4HCO3)受热分解、挥发。 (9)检验溶液中离子是否沉淀完全的方法:将溶液静置一段时间后,向上层清液中滴入沉淀剂,若无沉淀生成,则离子沉淀完全。 (10) 检验沉淀是否洗涤干净的方法:取少量最后一次的洗涤液于试管中,向其中滴入某试剂,若……,则沉淀洗涤干净。 (11) 洗涤的目的:①除掉附着在沉淀表面的可溶性杂质。②提高可溶性物质的产率 (12) 洗涤沉淀:沿玻璃棒往漏斗中加蒸馏水至液面浸没沉淀,待水自然流下后,重复操作2~3次。 (13)冰水洗涤的目的:洗去晶体表面的杂质离子并降低被洗涤物质的溶解度,减少其在洗涤过程中的溶解损耗。 (14)乙醇洗涤的目的:降低被洗涤物质的溶解度,减少其在洗涤过程中的溶解损耗,得到较干燥的产物。 (15)蒸发、反应时的气体氛围:抑制某离子的水解,如加热蒸发AlCl3溶液时为获得AlCl3需在HCl气流中进行。 (16)事先煮沸溶液的原因:除去溶解在溶液中的气体(如氧气)防止某物质被氧化。 2020高考化学化工流程试题知识点总结 知识归纳 无机化工流程题的特点: 规律:主线主产品、分支副产品、回头为循环。 核心考点:物质的分离操作、除杂试剂的选择、生产条件的控制。 1. 流程的呈现主要有以物质转化为主线,以操作过程为主线,甚至有时候会以设备为主线。 2. 这类题常围绕以下几个知识点进行设问: ⑴反应速率与平衡理论的运用 反应物颗粒大小:反应速率、原料的利用率等 温度:反应速率、物质的稳定性、物质的结晶等 ⑵氧化还原反应的判断、化学方程式或离子方程式的书写; ⑶利用控制pH分离除杂; ⑷化学反应的能量变化; ⑸实验基本操作:除杂、分离、检验、洗涤、干燥等; ⑹流程中的物质转化和循环,资源的回收和利用; ⑺环境保护与绿色化学评价。 一、原料处理的方法和作用 对原料进行预处理的常用方法及其作用: 1. 粉碎、研磨:减小固体的颗粒度,增大固体与液体或气体间的接触面积,加快反应速率。 2. 水浸:与水接触反应或溶解。 3. 酸浸:通常用酸溶,如用硫酸、盐酸、浓硫酸等,与酸接触反应或溶解,使可溶性金属离子进入溶液,不溶物通过过滤除去。近年来,在高考题出现了“浸出”操作。在化工生产题中,矿物原料“浸出”的任务是选择适当的溶剂,使矿物原料中的有用组分或有害杂质选择性地溶解,使其转入溶液中,达到有用组分与有害杂质或与脉石组分相分离的目的。 4. 浸出率:固体溶解后,离子在溶液中含量的多少(更多转化)。 5. 灼烧:除去可燃性杂质或使原料初步转化,如从海带中提取碘时的灼烧就是为了除去可燃性杂质,将有机碘转化为碘盐。 6. 灼烧、焙烧、煅烧:改变结构和组成,使一些物质能溶解;并使一些杂质在高温下氧化、分解,如煅烧高岭土和石灰石。 二、掌握核心化学反应 1. 元素及其化合物知识:化工生产将原料转变成产品的过程,也是物质经历相互转化的过程。理解物质之间的转化关系,就要用到元素及其化合物的相关知识。一般围绕铁、铜、铝、镁、氯、硫、磷、硅等元素的单质或化合物的工业制备来进行命题,需要掌握这些元素及其化合物的知识 2. 还要掌握有关化工生产的知识,熟悉的有纯碱工业、氨工业、硅单质的制备、氯碱工业、海水中提取镁、海水中提取溴等; 3. 化学反应原理:化工生产中把原料转变成产品的过程就是化学反应的过程,从化学反应原理的角度选择原料、控制条件和选择设备等,是化工生产的基本思路。化学反应原理的相关知识包括质量守恒定律、化学反应速率、化学平衡、电化学、化学热力学等,做到能综合运用这些知识分析化工生产中化学反应的情况。 ①调节溶液的pH值:使某些离子转变为沉淀而达到分离的目的,抑制某些离子的水解,防止某些离子的氧化等。在题目中常以表格形式给出信息。 例如:已知下列物质开始沉淀和沉淀完全时的pH如下表所示 若要除去Mn2+溶液中含有的Fe2+,应该怎样做? 提示:先用氧化剂把Fe2+氧化为Fe3+,再调溶液的pH到3.7。 工艺流程题解题技巧专题 一、【考点分析】无机化工题实际上是考查考生运用化学反应原理及相关知识来解决工业生产中实际问题的能力。解此类型题目的基本步骤是:①从题干中获取有用信息,了解生产的产品②分析流程中的每一步骤,从几个方面了解流程:A.反应物是什么B.发生了什么反应C.该反应造成了什么后果,对制造产品有什么作用。抓住一个关键点:一切反应或操作都是为获得产品而服务。③从问题中获取信息,帮助解题。 了解流程后着手答题。对反应条件的分析可从以下几个方面着手: 对反应速率有何影响?对平衡转化率有何影响?对综合生产效益有何影响?如原料成本,原料来源是否广泛、是否可再生,能源成本,对设备的要求,环境保护(从绿色化学方面作答)。 二、【工业流程题中常用的关键词】 原材料:矿样(明矾石、孔雀石、蛇纹石、大理石、锂辉石、黄铜矿、锰矿、高岭土,烧渣),合金(含铁废铜),药片(补血剂),海水(污水) 灼烧(煅烧):原料的预处理,不易转化的物质转化为容易提取的物质:如海带中提取碘 酸:溶解、去氧化物(膜)、调节pH促进水解(沉淀) 碱:去油污,去铝片氧化膜,溶解铝、二氧化硅,调节pH促进水解(沉淀) 氧化剂:氧化某物质,转化为易于被除去(沉淀)的离子 氧化物:调节pH促进水解(沉淀) 控制pH值:促进某离子水解,使其沉淀,利于过滤分离 煮沸:促进水解,聚沉后利于过滤分离;除去溶解在溶液中的气体,如氧气 趁热过滤:减少结晶损失;提高纯度 三、【工业流程常见的操作】 (一)原料的预处理 ①溶解:通常用酸溶。如用硫酸、盐酸、浓硫酸等 ②灼烧:如从海带中提取碘 ③煅烧:如煅烧高岭土改变结构,使一些物质能溶解。并使一些杂质高温下氧化、分解 ④研磨:适用于有机物的提取如苹果中维生素C的测定等。 (二)控制反应条件的方法 ①控制溶液的酸碱性使其某些金属离子形成氢氧化物沉淀——pH值的控制。 调节pH所需的物质一般应满足两点:能与H+反应,使溶液pH值增大不引入新杂质。若要除去Cu2+溶液中混有的Fe3+,可加入CuO、Cu(OH)2、Cu2(OH)2CO3等物质来调节溶液的pH值 ②蒸发、反应时的气体氛围 ③加热的目的:加快反应速率或促进平衡向某个方向移动 ④降温反应的目的:防止某物质在高温时会溶解或为使化学平衡向着题目要求的方向移动 ⑤趁热过滤:防止某物质降温时会析出 ⑥冰水洗涤:洗去晶体表面的杂质离子,并减少晶体在洗涤过程中的溶解损耗 (三)物质的分离和提纯的方法 ①结晶——固体物质从溶液中析出的过程(蒸发溶剂、冷却热饱和溶液、浓缩蒸发) 重结晶是利用固体物质均能溶于水,且在水中溶解度差异较大的一种除杂质方法。 ②过滤——固、液分离 ③蒸馏——液、液分离 ④分液——互不相溶的液体间的分离 ⑤萃取——用一种溶剂将溶质从另一种溶剂中提取出来。 化工流程题 考点一:结晶与过滤 结晶法和过滤的常见方法: ①蒸发结晶:例:NaCl溶液,加热蒸发浓缩至有大量固体析出,停止加热,利用余热将固体蒸干。 ②蒸发浓缩、冷却结晶、过滤、洗涤、烘干(干燥) ③蒸发浓缩结晶、趁热过滤、(冷却结晶)、洗涤、烘干(干燥) 即时训练1: 从Na2Cr2O7和Na2SO4的混合溶液中提取Na2Cr2O7晶体的操作:先将混合溶液蒸发浓缩,趁热过滤。 趁热过滤的目的是: 有利于Na2SO4结晶析出,又能防止Na2Cr2O7·2H2O结晶析出而损失 NaClO2(亚氯酸 钠)饱和溶液在 温度低于38℃时 析出晶体是 NaClO2·H2O, 在温度高于38℃ 时析出晶体是 NaClO2。 ①②③洗涤④干燥。 考点二 洗涤:关键是洗涤试剂的选择——用什么洗 【例3】(4)产品PbSO4还需用Pb(NO3)2溶液多次洗涤,目的是除去 产品洗涤的目的:把其它可溶性盐类除去 产品洗涤的方法: 1、易溶与水的固体:冰水、乙醇、饱和溶液洗涤; 2、难溶于水的固体:用水洗涤。 答题规范表述: 过滤后继续向漏斗中加溶剂(冰水、乙醇、水)至没过沉淀,待溶剂流下之后,重复操作2~3次。 用有机溶剂洗涤的优点: 1、减少目标物的溶解损耗(一般用75%的乙醇) 2、增加有机杂质的溶解量 3、由于有机溶剂易挥发,能使晶体快速干燥 考点三:循环利用 考查方式:1、找出流程中可以循环利用的物质; 2、物质多次循环后有何不利影响? 3、为何要循环利用? 分析归纳 1.如何找流程中可以循环利用的物质 (1)在流程中加入的物质,在后续步骤中会生产的可以循环利用(滤液、滤渣); (2)养成在流程上写出每一步的物质的习惯; (3)可逆反应往往有可以循环利用的物质; (4)析出晶体过滤后的母液中。 2、物质多次循环后的不利影响一般有哪些? 离子浓度增大,会产生沉淀或析出晶体 总结 1、结晶与过滤要结合溶解度和实验目的分析 2、洗涤和干燥要注意“温度”的影响 3、循环利用需要对整个流程全面、深刻理解。 面对新的信息要不要慌,耐心审题,读懂化工流程,学会找到新信息与熟悉知识之间的联系,根据题目要求规范答题。 课后巩固 2 (4)BaCl2滤液经____________、___________、过滤、洗涤,再经真空干燥后得到BaCl2·2H2O。 (5)为体现该工艺绿色化学的思想,该工艺中能循环利用的物质是:高考化学工艺流程题答题规律大总结
化工流程题特点及常见考点.doc
化工原理终极总结
化工原理主要知识点
(完整版)最新高考化学工艺流程大题技巧总结
化工原理知识点总结
化工原理(上)主要知识点
高中化学化学工艺流程答题规律详细总结(1)
《化工原理》公式总结
(完整版)化工原理基本知识点
化工流程题知识点总结
化学工艺流程答题规律详细总结
初三化学工艺流程题
(word完整版)化工流程题答题套路归纳,推荐文档
2020高考化学化工流程试题知识点总结
(完整word版)高考化学工艺流程题目解题方法指导
化工流程题解题技巧总结
