钢铁中镍含量的测定
基础化学实验I准备实验卡
煤中磷的测定方法
煤中磷的测定方法 实 习 报 告 师傅:辛宇 实习人:黄泽龙 2011年2月
煤中磷的测定方法实习报告 一、煤中磷测定的意义 煤中磷是有害元素之一,在炼焦时煤中磷进入焦炭,炼铁时磷又从焦炭进入生铁,当其含量超过0.05%时就会使钢铁产生冷脆性,因此,磷含量是煤质的重要指标之一。 二、基本原理 煤中的磷主要以无机磷存在,如磷灰石[3Ca3(PO4)2CaF2],也有微量的有机磷。由于无机磷的沸点很高,(一般为1700℃以上),所以在煤灰化过程中磷不会挥发损失,而含量甚微的有机磷,虽然挥发,但对结果影响不大。国际标准和我国现行标准都采用还原磷钼酸分光光度法,其优点是,灵敏度高,结果可靠,实验简便快速,干扰元素易于分离和消除,它试用于微量磷的分析。 磷钼蓝的反应机理 在酸性溶液中正磷酸与钼酸作用生成磷钼酸,然后抗坏血酸还原成蓝色的磷钼酸络合物。其反应及磷钼蓝的组成,至今尚无统一的意见,其中的一种观点认为: H3PO4+12H2MoO4→H3[P(Mo3O10)4]+12H2O H3[P(Mo3O10)4]+4C6H8O6→(2Mo24MoO3)2H3PO4+4C6H6O6+4H2O 当磷含量较低时,其蓝色强度与磷含量成正比。 三、方法提要 将煤样灰化后用氢氟酸—硫酸分解,脱除二氧化硅,然后加入钼酸铵和抗坏血酸,生成磷钼蓝后,用分光光度计测定吸光度。 四、实验步骤 1、试样处理 煤样灰化:按GB/T212中规定的慢速灰化煤样,然后研细到全部通过0.1mm的筛子。 灰的酸解:准确称取0.05-1g(准确至0.0002g)于聚四氟乙烯(或铂)坩埚中,加硫酸2mL,氢氟酸5mL,放在电热板上缓慢加热蒸发(温度约
土壤质量镍的测定
GB/T 17139—1997 土壤质量镍的测定火焰原子吸收分光光度法 1适用范围 1.1本细则规定淝定七壤中镍的火焰原广吸收分光光度法。 1.2本细则的检出限(按称取:0.5g试样消解定容至50 ml计算) 为5 mg/kg。 1.3干扰 1.3.1使用23 2.0-nm线作为吸收线,存在波长距离很近的镍三线, 应选用较窄的光谱通带予以克服。 1.3.2使用23 2.0nm线处于紫外区,盐类颗粒物、分子化合物产生的 光散射和分子吸收比较严重,会影响测定,使用背景校正可以克 服这类干扰,如浓度允许亦可用将试液稀释的方法来减少背景干 扰。 2原理 采用盐酸-硝酸-氢氟酸-高氯酸全分解的方法,彻底破坏土壤的矿物晶格,使试样中的待测元素全部进入试液。然后,将土壤消解液喷入空气-乙炔火焰屮。在火焰的高温下,镍化合物离解为基态原子,基态原子蒸气对镍空心阴极灯发时的特征谱线232 .0 nm产生选择性吸收。在选择的最佳测定条件下,测定镍的吸光度。 3试剂 本标准所使用的试剂除另有说明外,均使用符合国家标准的分析纯试剂和去离子水或等同纯度的水。 3.1盐酸(HC1),p=02g/ml,优级纯。 3.2硝酸(HN03), g/ml,优级纯。 3.3硝酸溶液, 用3.2配制。 3.4硝酸溶液,体积分数为0.2%:用3.?配制。 3.5氢酸(HF),丨。二 1.49 g/rnl。 3.6高氣酸(HC10:), 0-1.69 g/ml,优级纯。 3.7镍标准储备液,1.000mg/ml:称取光谱纯镍粉1.0000 g (精确 至0.0002g)于的60ml烧杯中,加硝酸溶液(3.3)20ml,温热,待完全溶解后,全量转移至1000ml容量瓶中,用水稀释至标线,摇匀。 3.8镍标准使液,5Omg/L:移取镍标准储备液(3.7) l0.0ml于200ml 容量瓶中,用硝酸溶液(3.4)稀释至标线,摇匀。
钢铁中锰含量的测定 (2)
实验报告 钢铁中锰含量的测定——银盐氧化光度法 班级:应111-1 姓名:王海花 学号:201169503147 指导老师:王老师
一.实验目的: 1.通过实验,了解钢铁中锰的存在形式,测定意义。 2.了解测定钢铁中锰含量的测定方法。 3.掌握钢铁中锰含量的测定原理。 4.熟练掌握分光光度计的使用,进一步训练移液管、容量瓶的正确使用。 5.掌握用比色法测定钢材中锰含量的方法 二.实验原理: 1.锰在钢铁中主要以MnC、MnS、FeMnSi或固溶体状态存在。生铁中一般 含锰0.5%~6%,普通碳素钢中锰含量较低,含锰0.8%~14%的为 高锰钢,含锰12%~20%的铁合金称为镜铁,含锰60%~80%的铁合 金称为锰铁。 2.锰溶于稀酸中,生成锰(Ⅱ)。锰化物也很活泼,容易溶解和氧化。在 化学反应中,由于条件的不同,金属锰可部分或全部失去外层价电子, 而表现出不同的价态,分析上主要有锰(Ⅱ)、锰(Ⅲ)、锰(Ⅳ)、锰(Ⅶ), 少数情况下亦有锰(Ⅵ),这就为测定锰提供了有利条件。 3.常用测定方法:一般碳素钢,低合金钢,生铁试样常以HNO 3 (1+3)或 硫磷混酸溶解。难溶的高合金钢以王水溶解,加HClO 4或H 2 SO 4 冒烟溶 解。溶解试样的酸主要依靠H 2SO 4 ,HCl,HNO 3 ,因H 2 SO 4 -HCl可使MnS 分解。HNO 3分解碳化物(Mn 3 C)生成CO 2 逸出,加磷酸可使Fe3+配合成 无色而消除Fe3+的干扰。同时因为磷酸的存在,防止了MnO 2 沉淀的生 成和HMnO 4 的分解。 4.主要反应方程式: 3MnS+12HNO 3=3Mn(NO 3 ) 2 +6HNO 3 +3SO 2 +6H 2 O 3Mn 3C+28HNO 3 =29Mn(NO 3 ) 2 +3CO 2 +10NO+14H 2 O MnS+H 2 SO 4 =MnSO4+H 2 S 2AgNO 3 +(NH 4 ) 2 S 2 O 8 =Ag 2 S 2 O 8 +2NH 4 NO 3 Ag 2 S 2 O 8 +2H 2 O=Ag 2 O 2 +2H 2 SO 4 5Ag 2O 2 +2 Mn(NO 3 ) 2 +6HNO 3 =2HMnO 4 +10AgNO 3 +2H 2 O 三.实验仪器及试剂: 1.实验仪器:721型分光光度计,分析天平,容量瓶(50mL),移液管(1ml, 2ml,3ml),滴管,洗耳球,电炉 2.实验试剂:硝酸溶液(1:3),王水(1浓硝酸+3浓盐酸)硫磷混酸(700ml 水中加入150ml磷酸及硫酸150ml,摇匀),0.5%硝酸银溶液,20%过 硫酸铵溶液,5%EDTA,锰标准溶液(0.1mg/ml) 四.实验步骤: 1.溶样:钢样0.2630g于50ml烧杯,加5mlH 2 O,15ml王水溶解,(可稍热) 2mlHClO 4 加热至冒白烟2min冷却,加硫磷混酸10ml加热至冒白烟,除尽Cl-冷却,定量转移至50ml容量瓶定容,摇匀,备用。 2.显色:移取试样溶液5ml4份于4个小烧杯,加H 2 O5ml,硫磷混酸5ml 依次加入锰标准溶液0.00ml,1.00ml,2.00ml,3.00ml,AgNO 3 2ml, (NH 3) 2 S 2 O 8 5.0ml,煮沸20-40s放置1min,冷水冷却转移定容至50ml容 量瓶。 3.测定A:在530nm的波长下,测定溶液的吸光度,比色皿b=1cm,以水为 参比溶液。
金属功能材料镍含量的测定
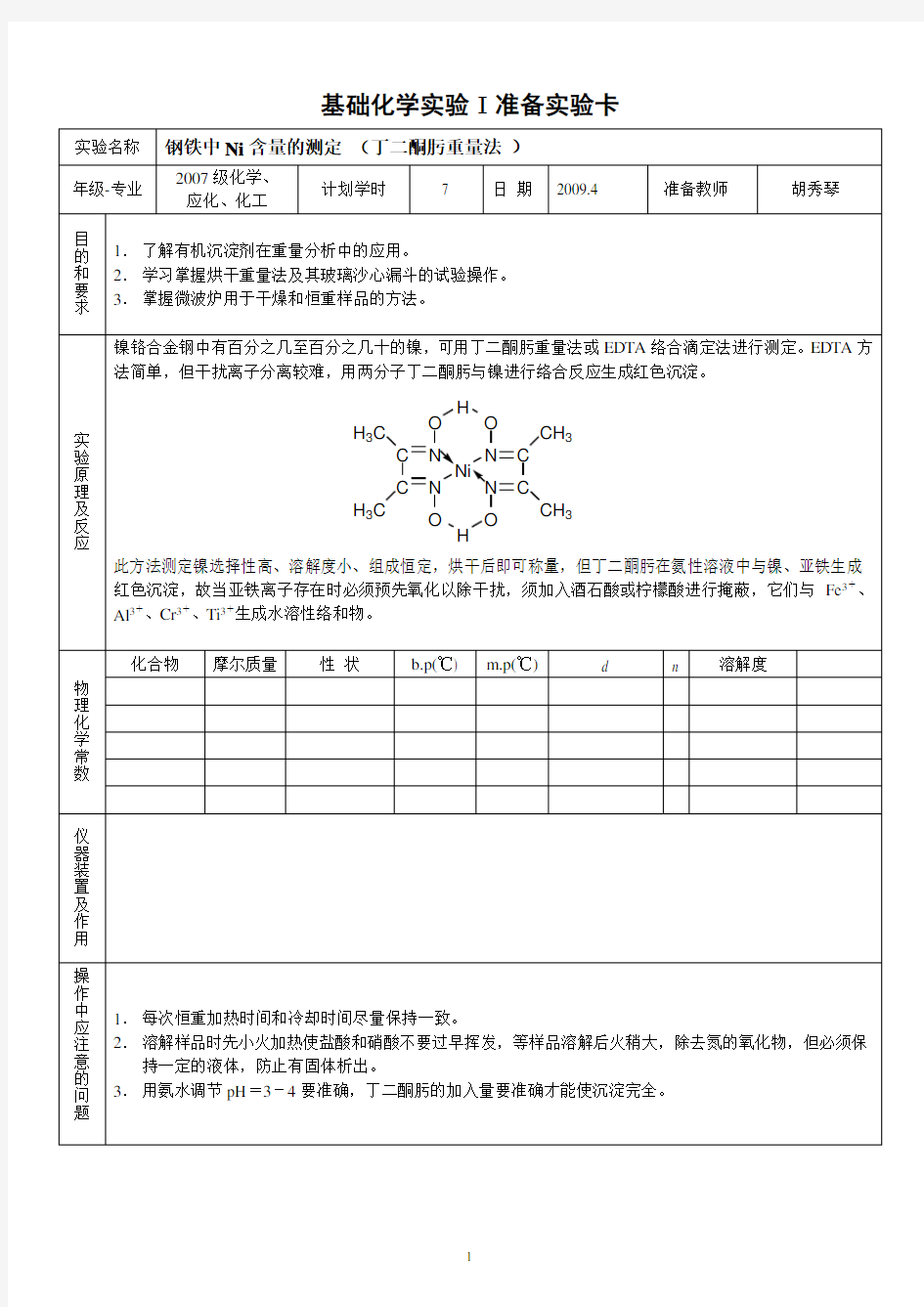
!"#$%$&’($)’$$* 金属功能材料—镍含量的测定— 丁二酮肟光度法 +范围 本推荐方法用丁二酮肟光度法测定金属功能材料中镍的含量。 本方法适用于金属功能材料中质量分数为!"!#$!%$的镍含量的测定。 ’原理 试样以酸溶解,高氯酸冒烟氧化铬至六价,以酒石酸钠掩蔽铁,在强碱性介质中,以过硫酸铵为氧化剂,镍与丁二酮肟生成红色配合物,在分光光度计上于波长&#!’(处测量吸光度,计算出镍的质量分数。 显色液中锰量大于)"&(*,铜量大于!"%(*,钴量大于!")(*干扰测定。*试剂 分析中,除另有说明外,仅使用分析纯的试剂和蒸馏水或与其 纯度相当的水。 *,+乙醇 *,’盐酸,!约) ")+*/(,、)-)*,*硝酸,!约) ".!*/(,、)-)、%-#*,)高氯酸,!约) "/0*/(,*,-酒石酸钠溶液,#!!* /,*,&氢氧化钠溶液,)!!* /,*,%丁二酮肟乙醇溶液,)!*/,? 01#?C S M
!"#过硫酸铵溶液,!"# /$!"$镍标准溶液 !"$"%镍储备液,%""! #/&$称取"’%"""#纯镍(质量分数大于( (’()*),精确至"’"""%# 。置于+)"&$烧杯中,加+"&$硝酸(+,-),加热溶解,冷却至室温后,移入%"""&$容量瓶中, 用水稀释至刻度,混匀。此溶液%&$含%""! #镍。!"$"&镍标准溶液,%"’"! #/&$移取%"’""&$镍储备液(%""! #/&$)于%""&$容量瓶中,用水稀释至刻度,混匀。此溶液%&$含%"’"! #镍。’操作步骤 ’"%称样 称取"’%"""’)"#试样,精确至"’"""%# 。含镍量为"’"-*""’%"*时称"’)"#;大于"’%"*""’)"*时称"’+"#;大于"’)"*"+’""*时称"’%"# 。’"&空白试验 随同试料做空白试验。 ’"!试料分解将试料置于%)"&$锥形瓶中,加)"%"&$硝酸(%,%)或适宜比例的盐酸硝酸混合酸,加热至试料完全溶解。加-")&$高氯酸,加热蒸发至冒高氯酸白烟,稍冷,加少量水使盐类溶解,冷却后移入%""&$容量瓶中(含镍量为"’"-*""’%"*时,移入)"&$容量瓶中),用水稀释至刻度,混匀。如有沉淀,干过滤除去。’"’显色分取%"’""&$(镍含量为%’""*"+’""*时,移取)’""&$)试液两份,分别置于)"&$容量瓶中。 显色液:加%"&$酒石酸钠溶液(-""#/$),%"&$氢氧化钠溶液(%""#/$),+&$丁二酮肟乙醇溶液(%"# /$),)&$过硫酸铵溶?..-?C S M
钢铁中磷的测定磷钼蓝吸光光度法
钢铁中磷的测定——磷钼蓝吸光光度法 实 验 报 告 班级:应121-2 姓名:曲红玲 学号:201269503222 同组人:王双孙艺 指导老师:王美兰老师
一、实验目的 1、了解钢铁中磷的测定意义。 2、掌握钢铁中磷的测定方法。 3、掌握溶液的定量转移配制,称量等基本操作。 二、实验原理 1、磷的测定是钢铁分析的一个必测指标。磷是典型的非金属元素,它在钢铁及合 金中主要以固熔体的磷化铁(Fe 2P、Fe 3 P)形式存在,还有少量的磷酸盐等夹杂物, 其来源一般从矿石带入。磷是钢铁的有害元素,它使钢铁发生冷脆,降低冲击韧性和影响锻接,一般钢材P控制不大于0.06%,高级的合金钢在0.03%以下,在某些特殊钢中,为提高其耐磨性而只允许达0.10%左右,因此,钢铁及合金中磷的测定是一项必不可少的项目。 2、工厂实用分析方法有:滴定法,分光光度法。 分光光度法有钒钼黄和钼蓝法两类。钒钼黄是磷酸与钒酸、钼酸作用形成磷钒钼黄杂多酸直接测定。钼蓝法是将磷钼杂多酸还原成钼蓝后进行测定,所用还原剂有氯化亚锡、抗坏血酸、硫酸联胺和亚硫酸盐等。 3、分析方法 4、本实验采用磷钼蓝吸光光度法
试样用王水溶解,高氯酸冒烟以氧化磷,加钼酸铵使磷转化为磷钼配合离子。用氟化物掩蔽铁离子,以氯化亚锡还原成钼蓝.分光光度法测定。主要反应:3Fe3P+41HNO3→9Fe(NO3)3+3H3PO4+14NO↑+16H2O Fe3P+13HNO3→3Fe(NO3)3+3H3PO3+4NO↑+5H2O 4H3PO3+HClO4→4H3PO4+HCl H3PO4+12H2MoO4→H3(P(MoO10)4)+12 H2O H3(P(MoO10)4)+8H++4Sn2+→(2Mo2.4MoO3)2.H3PO4+4Sn4++4H2 生成的磷钼蓝络合物的蓝色深浅与磷的含量成正比,据此可比色测定磷的含量。 三、仪器与试剂 1、实验仪器 721分光光度计,分析天平,移液管(10ml,5ml,2ml,1ml),吸耳球,烧杯(100ml 5个,400ml 1个,500ml 1个),50ml容量瓶4个,100ml容量瓶2个,玻璃棒,电炉,量筒(10ml 4个,50ml 1个),秒表,滤纸,洗瓶。 2、实验试剂 王水(盐酸:硝酸=3:1) 高氯酸(浓) 亚硫酸钠溶液(10%) 钼酸铵溶液(5%) 6%的H2SO4溶液:量取466mL蒸馏水至500 mL烧杯中,再量取28 mL浓硫酸缓慢加入水中,用玻璃棒引流并搅拌, 6.氟化钠-氯化亚锡溶液:称取2.4g氟化钠溶解于100 mL水中,必要时加热,加入0.2g氯化亚锡,搅拌溶解,当天使用。 7.磷标准溶液(0.01mg/mL):取10 mL0.1mg/mL磷标准溶液该溶液放入100 mL 容量瓶中,并加水稀释至刻度,即得到0.01mg/mL磷标准溶液 8.铬高试样空白参比溶液(于剩余显色液中滴加3%KMnO4至呈红色放置1min 以上,滴加Na2SO3溶液至红色消退) 四、实验步骤:
总磷测定方法
总磷 在天然水和废水中,磷几乎都以各种磷酸盐的形式存在,它们分为正磷酸盐,缩合磷酸盐(焦磷酸盐、偏磷酸盐和多磷酸盐)和有机结合的磷酸盐,它们存在于溶液中,腐殖质粒子中或水生生物中。 天然水中磷酸盐含量较微。化肥、冶炼、合成洗涤剂等行业的工业废水及生水污水中常含有较大量磷。磷是生物生长的必需的元素之一。但水体中磷含量过高(超过0.2mg/L)可造成藻类的过量繁殖,直至数量上达到有害的程度(称为富营养化),造成湖泊、河流透明度降低,水质变坏。 1.方法的选择 水中磷的测定,通常按其存在的形式,而分别测定总磷、溶解性正磷酸盐和总溶解性磷,如下图所示 消解 2.样品的采集和保存
总磷的测定,于水样采集后,加硫酸酸化至PH≤1保存。溶解性正磷酸盐的测定,不加任何试剂。于2—5℃冷处保存,在24h内进行分析。 水样的预处理 采集的水样立即经0.45μm微孔滤膜过滤,其滤液可溶性正磷酸盐的测定。滤液经下述强氧化剂的氧化分解,测得可溶性总磷。取混合水样(包括悬浮物),也经下述强氧化剂分解,测得水中总磷含量。 (一)过硫酸钾消解法 仪器 (1)医用手提式高压蒸汽消毒器或一般民用压力锅(1— 1.5kg/cm2)。 (2)电炉,2kw。 (3)调压器、2kvA(0—220v) (4)50ml(磨口)具塞刻度管。 试剂 5%(m/V)过硫酸钾溶液:溶解5g过硫酸钾于水中,并稀释至100 ml。 步骤
(1)吸取25.00 ml混匀水样(必要时,酌情少取水样,并加水至 25 ml,使含磷量不超过30μg)于50 ml具塞刻度管中,加过硫 酸钾溶液4 ml,加塞后管口包一小块纱布并用线扎紧,以免加热时玻璃塞冲出。将具塞刻度管放在大烧杯中,置于高压蒸汽消毒器或民用压力锅中加热,待锅内压力达1.0kg/cm2 (相应温度为120℃)时,调节电炉温度使保持此压力30min后,停止加热,待压力表指针将至零后,取出放冷。 (2)试剂空白和标准溶液系列也经同样的消解操作。 注意事项 (1)如采样时水样用酸固定,则用过硫酸钾消解前将水样调至中性。 (2)一般民用压力锅,在加热至顶压阀出气孔冒气时,锅内温度为120℃。 (3)当不具备压力消解条件时,亦可在常压下进行,但操作步骤如下: 分取适量混匀水样(含磷不超过30μg)于150ml锥形瓶中,加水至50 ml,加数粒玻璃珠,加1 ml3+7硫酸溶液,5ml 5%过硫酸钾溶液,置电炉上加热煮沸,调节温度使保持微沸30—40min,至最后体积为10ml 止。放冷,加1滴酚酞指示剂,滴加氢氧化钠溶液至刚呈微红色,再滴加1mol/L硫酸溶液使红色腿去,充分摇匀。如溶液不澄清,则用滤纸过滤于50 ml比色管中,用水洗锥形瓶及滤纸,一并移入比色管中,加水至标线,供分析用。
实验27 钢中锰含量的测定
实验27 钢中锰含量的测定 一. 实验目的 1. 学习分光光度法测定试样浓度; 2. 掌握移液管、容量瓶、比色管及滴定管等基本操作。 二. 背景知识及实验原理 1. 钢样中锰含量测定的化学反应原理 将一定质量的钢样用混合酸(含硝酸、硫酸及磷酸)溶解,再用过硫酸铵做氧化剂,使溶解于酸中的锰氧化成具有特征颜色的高锰酸根离子。为了加速反应的进行,常加入硝酸银做催化剂。 钢样溶解后产生的硝酸铁为黄褐色,会干扰比色的进行,混合酸中的磷酸可与硝酸铁形成无色配合物,因此磷酸时作为干扰物Fe3+的掩蔽剂。 溶液呈现不同颜色是由于物质对光具有选择吸收所造成的,含有高锰酸根离子的溶液对绿色光有强烈的吸收,因此高锰酸根溶液呈现出绿光的互补色——紫红色。分析高锰酸根溶液可以选择530nm的单色光。 2.分光光度法 利用光电池代替人眼睛,测量有色溶液对某一波长的单色光的吸收程度,从而求得待测物质含量的方法叫分光光度法。这种方法可以提高测量的准确度。 分光光度法测定试样的浓度,首先要做标准曲线,即配制一系列不同浓度的标准溶液,测定其光密度值,然后以光密度为纵坐标,以浓度为横坐标,绘制标准曲线。在相同条件下测定未知试样的光密度值,由光密度可从标准曲线上找到对应点,该点在横坐标对应的浓度,即为待测溶液的浓度。 二. 实验仪器和药品 1. 仪器 移液管、比色管、容量瓶、滴定管、722型分光光度计。 2. 药品 钢样、标准高锰酸钾溶液、混合酸、硝酸银、过硫酸铵溶液、NaNO2溶液。 三. 实验内容与操作 1.标准系列溶液的配制 将所用的比色管、容量瓶、滴定管及烧杯等用自来水洗净,再用少量蒸馏水冲洗。从共
钢铁中磷的测定磷钼蓝吸光光度法
钢铁中磷的测定磷钼蓝 吸光光度法 公司标准化编码 [QQX96QT-XQQB89Q8-NQQJ6Q8-MQM9N]
钢铁中磷的测定——磷钼蓝吸光光度法 实 验 报 告 班级:应121-2 姓名:曲红玲 学号:3222 同组人:王双孙艺
指导老师:王美兰老师 一、实验目的 1、了解钢铁中磷的测定意义。 2、掌握钢铁中磷的测定方法。 3、掌握溶液的定量转移配制,称量等基本操作。 二、实验原理 1、磷的测定是钢铁分析的一个必测指标。磷是典型的非金属元素,它在钢铁及 合金中主要以固熔体的磷化铁(Fe 2P、Fe 3 P)形式存在,还有少量的磷酸盐等夹杂 物,其来源一般从矿石带入。磷是钢铁的有害元素,它使钢铁发生冷脆,降低冲击韧性和影响锻接,一般钢材P控制不大于%,高级的合金钢在%以下,在某些特殊钢中,为提高其耐磨性而只允许达%左右,因此,钢铁及合金中磷的测定是一项必不可少的项目。 2、工厂实用分析方法有:滴定法,分光光度法。 分光光度法有钒钼黄和钼蓝法两类。钒钼黄是磷酸与钒酸、钼酸作用形成磷钒钼黄杂多酸直接测定。钼蓝法是将磷钼杂多酸还原成钼蓝后进行测定,所用还原剂有氯化亚锡、抗坏血酸、硫酸联胺和亚硫酸盐等。 3、分析方法
4、本实验采用磷钼蓝吸光光度法 试样用王水溶解,高氯酸冒烟以氧化磷,加钼酸铵使磷转化为磷钼配合离子。用氟化物掩蔽铁离子,以氯化亚锡还原成钼蓝.分光光度法测定。主要反应: 3Fe 3P+41HNO 3 →9Fe(NO 3 ) 3 +3H 3 PO 4 +14NO↑+16H 2 O Fe 3P+13HNO 3 →3Fe(NO 3 ) 3 +3H 3 PO 3 +4NO↑+5H 2 O 4H 3PO 3 +HClO 4 →4H 3 PO 4 +HCl H 3PO 4 +12H 2 MoO 4 →H 3 (P(MoO 10 ) 4 )+12 H 2 O H 3(P(MoO 10 ) 4 )+8H++4Sn2+→()+4Sn4++4H 2 生成的磷钼蓝络合物的蓝色深浅与磷的含量成正比,据此可比色测定磷的含量。 三、仪器与试剂 1、实验仪器 721分光光度计,分析天平,移液管(10ml,5ml,2ml,1ml),吸耳球,烧杯(100ml 5个,400ml 1个,500ml 1个),50ml容量瓶4个,100ml容量瓶2个,玻璃棒,电炉,量筒(10ml 4个,50ml 1个),秒表,滤纸,洗瓶。 2、实验试剂 王水(盐酸:硝酸=3:1) 高氯酸(浓) 亚硫酸钠溶液(10%) 钼酸铵溶液(5%) 6%的H 2SO 4 溶液:量取466mL蒸馏水至500 mL烧杯中,再量取28 mL浓硫酸缓 慢加入水中,用玻璃棒引流并搅拌, 6.氟化钠-氯化亚锡溶液:称取氟化钠溶解于100 mL水中,必要时加热,加入氯化亚锡,搅拌溶解,当天使用。
废水中总磷的测定
废水中总磷的测定 一、实验目的 1、了解磷的测定方法。 2、掌握紫外可见光光度计的使用。 3、熟悉水样的过硫酸钾消解法的预处理。 二、实验仪器 压力锅、电炉(2kw)、调压器(2kva 0~220v)、50ml具塞刻度管、紫外可见光光度计 三、实验试剂 1、5%过硫酸钾溶液:溶解5g过硫酸钾,并稀释到100ml。 2、(1+1)硫酸 3、10%抗坏血酸溶液:溶解10g抗坏血酸于水中,并稀释到100ml。 4、钼酸盐溶液:溶解12g钼盐酸铵。溶解酒石酸锑氧钾于100ml 的水中。 在不断的搅拌下,将钼盐酸铵加到300ml(1+1)硫酸中,加入酒石酸锑氧钾溶液并混合均匀。 5、浊度—色度补偿液:混合两份体积(1+1)硫酸和一份体积的10%抗坏血酸溶液。 6、磷酸盐标准溶液:汲取10ml磷酸盐储备于250ml容量瓶中,用水稀释。此时浓度为2ug/ml。 7、磷酸盐储备溶液:将优级纯磷酸二氢钾于110℃干燥2h,在干燥器中放冷。然后溶于水,移入1000ml容量瓶中加(1+1)硫酸5ml,用水稀释至标线。 四、实验原理 在酸性条件下,正磷酸盐与钼酸盐铵、酒石酸锑氧钾反应,生成磷钼杂多酸,被还原剂抗坏血酸还原,则生成蓝色络合物,通常即称为磷钼蓝。 五、使用范围 本方法最低出浓度为L(吸光度A=时所对应的浓度):测定上限为L。 可适用于测定地表水、生活污水及化工、磷肥、机加工金属表面磷化处理、农药、钢铁、焦化等行业的工业废水中的正磷盐分析。 六、实验步骤 1、水样预处理
汲取25ml混匀水样于50ml具塞刻度管中,加过硫酸钾溶液4ml,具塞管后管口包一块纱布并用线扎紧,以免加热时玻璃塞冲出。将具塞管放在大烧杯中,置于高压压力锅中加热,待锅内压力达到cm2,调节电炉温度使保持压力30min后,停止加热,待压力降为零后,取出放冷。如有浑浊,则用滤纸过滤,洗涤后定容。 2、校准曲线的绘制 取七只50ml具塞管,分别加入磷酸盐溶液标准使用液0、、、、、、加水至50ml。 向具塞管中加入1ml10%抗坏血酸溶液混合均匀。30s后加入2ml 钼酸盐溶液混合均匀,放置15min。 用10mm或30mm比色皿,于700nm波长处,以零浓度溶液为参考,测量吸光度。 3、样品测定 经过水样预处理后的待测水样,用水稀释至标线。以下按绘制校准曲线的步骤进行显色和测量。减去空白试验的吸光度,并从校准曲线上查出含磷量。 七、试验数据记录及计算
钢中锰含量的测量
钢中锰含量的测量 1.实验目的 (1)了解用分光光度法测定钢中锰含量的原理和方法; (2)熟练掌握分光光度计的使用,进一步训练移液管、容量瓶的正确使用; (3)练习作图法处理实验数据。 2.实验原理 将已知质量的钢样溶解于由硝酸、硫酸和磷酸组成的混合酸中。Fe+6HN03 = Fe(N03)3+3NO2十+3H20 Mn+4HN03 = Mn(N03)2+2N02十+2H20 Fe3++2H3PO4 = H3[Fe(P04)2] +3H+ Ag+ 2Mn2++5S2O82-+8H20 = 2MnO4-+10SO42-+16H+ 所得到的MnO4-溶液,以空白试样为参比液,可用分光光度计在波长530nm处测定其吸光度。将一系列已知浓度的Mn04-标准溶液,按上述相同方法处理后,用分光光度计测出它们的吸光度。以吸光度(A)为纵坐标,标准溶液浓度(c)为横坐标作图,得到A与c的关系曲线,叫工作曲线。通过工作曲线可查到样品溶液的吸光度所对应的浓度,进而可换算出钢样中锰的含量, 3.仪器与试剂 仪器:721型分光光度计,分析天平,容量瓶(50mL),移液管(10mL),吸量管(5mL),滴管,洗耳球,酒精灯。
试剂:HN03-H2S04—H3P04的混合酸(1:1:1) 1%AgN03,KMn04标准溶液 (含Mn 1mg·mL-1),(NH4)2S2O8 (15%),钢样。 4.实验内容 (1)标准KMn04系列溶液的配制:用移液管吸取10mL的标准KMnO4溶液 于100mL容量瓶中,用去离子水稀释至刻度。盖上瓶盖后摇匀备用。另取6只50ml容量瓶。每只容量瓶按表5—4用量,用移液管(或吸量管)分别加入备用的标准KMn04溶液、混合酸、(NH4)2S2O8和AgN03,并用去离子水稀释至刻度,盖上瓶塞后摇匀。 (2)钢样的处理及钢样溶液的配制: 用分析天平准确称量一份钢样(60~ 80mg),放人50mL烧杯中,加入17mL混合酸,在通风橱中用低温电势板加热,使钢样溶解,待棕色N02气体不再产生时,加入10mL (NH4)2S2O8和3mL AgN03溶液,继续加热至沸腾。煮沸lmin后即可停止加热。待溶液冷却至室温后,全部转移到50mL溶量瓶中,用去离子水稀释至刻度,盖上瓶塞,摇匀(3)溶液吸光度的测定:将分光光度计波长调至530nm(使用方法参见第二章2.4节),使用0.5cm 比色皿装待测液,以空白试样为参比液,分别测定5个标准KMnO4溶液及钢样溶液的吸光度。 5.数据处理 以溶液的吸光度为纵坐标,KMn04浓度为横坐标,在坐标纸上作
水中的镍含量及测定原理
水中的镍含量及测定原理 天然水中镍的含量很少,在清洁的地表水中,镍的含量在1μg/L左右,采矿、冶炼、电镀等工业排放的废水、废渣,是导致水体镍污染的主要原因。镍盐易引起过敏性皮炎,镍有致癌性,对水生生物也有明显的毒害作用。 为什么要化验水中的镍? 天然水中镍的含量很少,在清洁的地表水中,镍的含量在1μg/L左右,采矿、冶炼、电镀等工业排放的废水、废渣,是导致水体镍污染的主要原因。 镍盐易引起过敏性皮炎,镍有致癌性,对水生生物也有明显的毒害作用。 镍含量(丁二酮肟光度法)的测定原理是什么? 在氨性溶液中,有氧化剂碘存在时,镍与丁二酮肟作用,生成组成比为1:4的酒红色可溶络合物。络合物在波长为440nm和530nm处有两个吸收峰。为了消除柠檬酸铁干扰,可选择在灵敏度稍低的530nm波长处进行测定。 镍含量(丁二酮肟光度法)是如何测定的? (1)校准曲线 ①按下表准确吸取一组镍标准使用液,分别注入一组25mL具塞比色管中,加50%柠檬酸铵2.0mL、O.05mol/L碘溶液1.0mL,加水至20mL,摇匀。 ②分别加人O.5%丁二酮肟溶液2.0mL,摇匀。加5%NO:一EDTA溶液2.0mL,加水至刻 中心以化工行业技术需求和科技进步为导向,以资源整合、技术共享为基础,分析测试、技术咨询为载体,致力于搭建产研结合的桥梁。以“专心、专业、专注“为宗旨,致力于实现研究和应用的对接,从而推动化工行业的发展。
度,摇匀。 ③放置5min后,用10mm比色皿,于530nm波长处,以水作参比,测量吸光度,并作空白校正,绘制吸光度一镍含量曲线。 (2)水样测定 ①取适量水样(含镍10~100μg)置于25mL具塞比色管中,用氢氧化钠溶液调至中性,然后按(1)中②③步骤测定吸光度,测得的吸光度扣除空白(试剂水)吸光度后,从校准曲线上查得镍含量。 ②如果废水中含有悬浮物或有机络合物时,可取适量水样,加硝酸消解后,再按本方法显色测定。 水样中镍含量戈(mg/L)可按下式计算: 中心以化工行业技术需求和科技进步为导向,以资源整合、技术共享为基础,分析测试、技术咨询为载体,致力于搭建产研结合的桥梁。以“专心、专业、专注“为宗旨,致力于实现研究和应用的对接,从而推动化工行业的发展。
8 钢铁中锰的测定方法
实验八钢铁中锰的测定方法 亚砷酸钠-亚硝酸钠滴定法测定锰量 一、实验目的 1.掌握钢铁中锰的亚砷酸钠—亚硝酸钠测定法 2.掌握钢铁试样的溶样方法 二、实验原理 试样经酸溶解,在硫酸、磷酸介质中,以硝酸银为催化剂,用过硫酸铵将锰氧化成七价,用亚砷酸钠—亚硝酸钠标准溶液滴定。本方法适用于生铁、碳钢、合金钢和铁粉中锰量(0.10%~2.50%)的测定。 三、试剂 1.浓硝酸(p=1.42g/ml) 2.硝酸(2+98) 3.浓盐酸(P=1.19g/ml) 4.浓硫酸(p=1.84g/ml) 5.硫酸(2+3)配制100ml,全班共用 6.硫酸(1+1)配制250ml,全班共用 7.双氧水 8.氨水 9.硫酸—磷酸混合酸A:将30ml硫酸(p=1.84g/ml)、30ml磷酸(p=1.70g/ml) 缓慢加入到140ml水中,并不断搅拌、冷却。 10.硫酸—磷酸混合酸B:硫酸(p=1.84g/ml)、磷酸(p=1.70g/ml)和水按等体 积混合,冷却。 11.硝酸银溶液(0.5%):称取0.5g硝酸银溶于水中,滴加数滴硝酸(p=1.42g/ml) 用水稀释至100ml,储存在棕色瓶中。 12.过硫酸铵溶液(20%):用时配制(每组100ml) 13.氯化钠溶液(0.5%):称取0.5g氯化钠,用硫酸(2+98)溶解,并稀释至 100mL 14.高锰酸钾溶液(0.16%)
21V C V T ?=15.锰标准溶液 (1) 称取1.4383g 基准高锰酸钾,置于600ml 烧杯中,加入30ml 水溶解, 加10ml 硫酸(1+1),滴加过氧化氢(p=1.10g/ml )至红色刚好消失,加热煮沸5~10min 冷却、移入1000ml 容量瓶中,用水稀释至刻度,混匀。此溶液1ml 含500ug 锰 (2) 称取0.5000g 电解锰(99.99%)置于250ml 烧杯中,加20ml 硝酸(1+3), 加热溶解,煮沸驱尽氮氧化物,取下冷却至室温,移入1000ml 容量瓶中,用水稀释至刻度,混匀。此溶液1ml 含500ug 锰。(电解锰处理方法:将电解锰放入硫酸(5+95)中清洗,待表面氧化锰洗净后,取出,立即用蒸馏水反复洗,再放入无水乙醇中洗4~5次,取出放入干燥中干燥后,方可使用)。 16.亚砷酸钠—亚硝酸钠标准溶液。 (1) 配制 称取1.63g 亚砷酸钠和0.86g 亚硝酸钠,置于1000ml 烧杯中,用水溶解并稀释至1000ml ,混匀。或称取1.25~1.30g 三氧化二砷,置于1000ml 烧杯中,加25ml 15%氢氧化钠溶液,低温加热溶解,用水稀释至200ml 。滴加硫酸(2+3)使溶液呈酸性并过量2~3ml ,然后用15%碳酸钠溶液中和至pH=6~7,再加0.86g 亚硝酸钠,用水稀释至1000ml ,混匀。 (2) 亚砷酸钠—亚硝酸钠溶液的标定 称取与试样量相近似的铁粉(含锰量不大于0.002%)三份,分别置于300ml 锥形瓶中,加30ml 硫酸—磷酸混合酸A ,加热溶解后,滴加5ml 硝酸破坏碳化物,煮沸驱尽氮氧化物,取下冷却,分别加入锰标准溶液(锰量与试样中锰量相似),用水稀释至体积约80ml ,以下按试样的滴定方法进行。 亚砷酸钠—亚硝酸钠标准溶液对锰的滴定度按下式计算: 式中,T —亚砷酸钠—亚硝酸钠 标准溶液对锰的滴定度,g/ml V 1—移取锰标准溶液的体积,ml C —锰标准溶液的浓度,g/ml
红土镍矿 镍、钴含量的测定
红土镍矿镍、钴含量的测定 编制说明 1 任务来源 根据国家认监委“国认科函[2009]号” 《关于组织申报2009年检验检疫行业标准制(修)订计划项目的通知》,《红土镍矿化学分析方法镍、钴含量的测定-火焰原子吸收光谱法》制标任务(计划编号2009B049),由天津出入境检验检疫局负责起草,定于2010年完成。 2 标准编写原则和编写格式 本标准是根据GB/T1.1-2009《标准化工作导则第1部分:标准的结构和编写规则》和GB/T20001.4-2001《标准编写规则第4部分:化学分析方法》的要求进行编写的。 3标准编写的目的、意义 长期以来,我国镍主要用于冶金行业,其次是轻工行业等领域,消费量起伏变化不大,基本上与生产处于动态平衡状态。但随着国民经济的发展和汽车行业、建筑行业、电池等新材料领域的需求,以及国家近几年对不锈钢工业的支持,使我国的不锈钢消费量以每年25 %的速度增长,这有力的带动了我国镍消费量的大幅增涨。近几年来,由于我国镍资源的消耗增长速度远远大于镍精矿的产量增长速度,使得镍原料生产与供给不足已成为制约我国镍工业发展的关键性因素,为缓解国内镍原料的供应紧张局面,国内主要镍生产企业开始采取进口各种镍原料,2004年我国各种镍原料的贸易逆差达到了100436 万美元。2006年起,天津港、日照、连云港、鲅鱼圈等很多港口开始进口菲律宾、印度尼西亚等国家红土镍矿,进口红土镍矿数量剧增,全年共进口红土镍矿37717 万吨, 同比增长681 %;2007 年全年进口红土镍矿超过1500 万吨, 其中90 %以上为红土镍矿。 前几年,大量进口菲律宾红土镍矿的主要是日本,早期的菲日矿业公司只寻找2.0%以上品位的镍矿,运送回新日铁或是住友商社,经过30年的变化,这些矿山前几年堆满了低品位的镍矿,这两年大批运往中国。以天津港口为例,进口红土镍矿中镍的品位大都在2%以下,有的甚至仅为0.8%左右。镍矿以品位计价,而如“泥巴”状的红土镍矿的镍、钴、铁等主要元素含量的高低直接关系到货物的总值,检验结果的准确性直接影响到企业的经济效益。由于红土镍矿未列入法检目录, 从事红土镍矿检验的机构众多, 红土镍矿进口集中于近几年, 国内外对红土镍矿的品质指标没有统一的规定, 检验标准和检验经验缺乏。再加上近两年来的红土镍矿市场剧烈振荡, 贸易商为了谋取经济利益, 人为操作因素, 国内外检验结果差异较大, 不同检验机构之间结果差异较大, 国内进口商与国外发货商之间, 国内贸易商与使用厂家之间, 贸易纠纷频繁。为规范进口红土镍矿检验市场, 提高红土镍矿检验水平,促进红土镍矿贸易的健康发展, 保证国家利
丁二酮肟镍重量法测定钢样中镍含量
实验九丁二酮肟镍重量法测定钢样中镍含量 一、实验目的 1、学习有机沉淀剂在重量分析中应用。 2、学习重量分析法操作技能。 二、实验原理 丁二酮肟分子式为C4H8O2N2相对分子质量为116.2,是二元弱酸,以H2D表示,在氨性溶液中以为主,与发生配合反应: 沉淀经过滤、洗涤,在120下烘干恒重,称丁二酮肟镍沉淀的质量,则Ni的质量分数为: 丁二酮肟镍沉淀的条件,pH=8~9氨性溶液pH值过小则生成H2D沉淀易溶解,pH值过高易形成Ni(NH3)42+同样增加沉淀的溶解度。 Fe3+,Al3+,Cr3+,Ti3+在氨水中也生成沉淀,有干扰;Cu2+,Cr2+,Fe2+,Pd2+亦可以形成配合物,产生共沉淀,加入柠檬酸或酒石酸掩蔽干扰离子。 三、试剂与器材 混合酸HCl+HNO3+H2O(3+1+2),50%酒石酸或柠檬酸溶液,丁二酮肟(1%乙醇溶液),氨水(1:1),2HNO3,HCl(1:1),0.1AgNO3,氨-氯化铵洗涤液(100mL水中加1mL NH3· H2O+1g NH4Cl);钢样。G4微孔玻璃坩埚2个。 四、实验方法 称取钢样(含Ni 30~80mg)两份,分别置于400mL烧杯中,加入20~40mL混合酸,盖上表面皿,低温加热溶解后,煮沸出去氮的氧化物,加入5~10mL50%酒石酸溶液(每克试样加10mL),然后,在不断搅动下,滴加1:1 NH3·H2O至溶液pH=8~9,此时溶液转变为蓝绿色。如有不溶物,应将沉淀过滤,并用热的NH3· H2O + NH4Cl洗涤液,洗涤3次,洗涤液与滤液合并。滤液用1:1HCl酸化,用热水稀释至300mL, 加热至70~80,在搅拌下,加入1%丁二酮肟乙醇溶液(每毫克约需1mL10%丁二酮肟溶液),最 后再多加20~30mL,但所加试剂的总量不要超过试液体积的1/3,以免增大沉淀的溶解度。然后再不断搅拌下,滴加1:1氨水,至pH=8~9(在酸性溶液中,逐步中和而形成均相沉淀,有利于大晶体产生)。在 60~70下保温30~40min(加热陈化),取下、冷却、用G4微孔玻璃坩埚进行减压过滤,用微氨性的2%酒石酸洗涤烧杯和沉淀8~10次,再用温热水洗涤沉淀至无Cl-离子(用AgNO3检验),将沉淀与微孔坩埚在130~150烘箱中烘1h,冷却,称重,再烘干,冷却称量直至恒重,计算镍的质量分数。 五、思考与讨论 1、溶解试样时加氨水起什么作用? 2、用丁二酮肟沉淀应控制的条件是什么? 3、实验中,丁二酮肟沉淀也可灼烧,试比较,灼烧与烘干的利弊。
钢铁中磷的测定——磷钼蓝吸光光度法
钢铁中磷的测定——磷钼蓝吸光光度法 实验报告 班级:应101-2 姓名:宋跃进 学号:201055501236 同组:韩瑞李宁
一、实验目的 1.通过本实验了解钢铁中磷的测定意义; 2.掌握钢铁中磷的测定方法; 3.掌握溶液的定量转移配制,称量等基本操作。 二、仪器与试剂 实验仪器: 721分光光度计,分析天平,移液管(10ml,5ml,2ml,1ml),吸耳球,烧杯(100ml 5个,400ml 1个,500ml 1个),50ml容量瓶4个,100ml容量瓶2个,玻璃棒,电炉,量筒(10ml 4个,50ml 1个),秒表,滤纸,洗瓶。 实验试剂: 1.王水(盐酸十硝酸=3+1) 2.高氯酸(浓) 3.亚硫酸钠溶液(10%) 4.钼酸铵溶液(5%) 5.6%的H2SO4溶液,量取466mL蒸馏水至500 mL烧杯中,再量取28 mL浓硫酸缓慢加入水中,用玻璃棒引流并搅拌, 6.氟化钠-氯化亚锡溶液(称取2.4g氟化钠溶解于100 mL水中,必要时加热,加入0.2g氯化亚锡,搅拌溶解,当天使用。) 7.磷标准溶液(0.01mg/mL),取10 mL0.1mg/mL磷标准溶液该溶液放入100 mL 容量瓶中,并加水稀释至刻度,即得到0.01mg/mL磷标准溶液 8.铬高试样空白参比溶液(于剩余显色液中滴加3%KMnO4至呈红色放置1min 以上,滴加Na2SO3溶液至红色消退) 三、实验原理 1、磷是典型的非金属元素,它在钢铁及合金中主要以固熔体的磷化铁(Fe2P、Fe3P)形式存在,还有少量的磷酸盐等夹杂物,其来源一般从矿石带入。磷是钢铁的有害元素,它使钢铁发生冷脆,降低冲击韧性和影响锻接,一般钢材P控制不大于0.06%,高级的合金钢在0.03%以下,在某些特殊钢中,为提高其耐磨性而只允许达0.10%
试样中氧化锰含量的测定(精)
实验五十试样中氧化锰含量的测定 【实验目的】 掌握分光光度法测定试样中微量锰的原理和方法。 【实验原理】 在酸性溶液中将Mn2+氧化成MnO4-是一个高灵敏度的特效反应,适用于MnO 含量在0.005~1.0%范围样品的测定;大于1%的可用原子吸收分光光度法测定。 高碘酸钾(钠)比色法是在硫酸-磷酸混酸存在下,加KIO4(或NaIO4)、(NH4 2S2O8和AgNO3混合显色剂,水浴加热将Mn2+氧化成紫红色的MnO4-: 2Mn2+ + 5IO4-+ 3H2O = 2MnO4-+ 5IO3-+ 6H+ 采用标准曲线法可计算试样中MnO的含量。 【仪器和试剂】 1.仪器:刻度移液管、电炉、水浴锅、比色管。 2.试剂:显色剂混合液(5mL H2SO4加5mL H3PO4,用水稀释至100mL。称取1g NaIO4于此混合酸中,微热溶解后,加0.5g过硫酸铵和0.05g硝酸银,搅拌使其溶解及混匀。使用前配制)、锰标准溶液(100 μg·mL-1)(准确称取0.2186g MnSO4溶于水,加10mL 3mol·L-1H2SO4硫酸,用水定容于1000mL容量瓶中。) 【实验步骤】 1.系列标准溶液的配制及显色 分别移取0、1.00、2.00、3.00、4.00、5.00mL锰标准溶液于50mL比色管中,加10mL显色剂混合液,沸水浴中加热20分钟,冷却后用水稀释至刻度,摇匀。 2.吸收曲线的绘制 在分光光度计上,用1 cm吸收池,以试剂空白溶液为参比,在480~580 nm之间,每隔10 nm测定一次4号锰标准溶液的吸光度A,以波长为横坐标,吸光度为纵坐标,绘制吸收曲线,从而选择测定锰的最大吸收波长。(最大吸收波长525nm) 3.标准曲线的测绘 以试剂空白溶液为参比,用1 cm吸收池,在选定波长下测定2~6号各显色标准溶液的吸光度。在坐标纸上,以锰的浓度为横坐标,相应的吸光度为纵坐标,绘制标准曲线。
(完整版)丁二酮肟分光光度法测定合金钢中的镍含量不确定度的评定
丁二酮肟分光光度法测定合金钢中 镍含量不确定度的评定 1 被测对象 满足GB/T 223.23-1994丁二酮肟分光光度法测定镍含量的合金钢试样。 2 引用文件 GB/T 223.23-1994 丁二酮肟分光光度法测定镍量 JJF 1059-1999 测量不确定度评定与表示 CNAL/AG 07:2002 化学分析中不确定度评估指南 CSM 01 01 01 00-2006 化学成分分析测量不确定度评定导则 3 分析方法和测量参数概述 称取0.1000g 某合金钢试样于锥形瓶中,用酸溶解,高氯酸冒烟,加水溶解盐类,冷却定容至100mL 容量瓶中。吸取10.00mL 试液于100mL 容量瓶中,以酒石酸为掩蔽剂,在强碱性介质中,以过硫酸铵为氧化剂,生成丁二酮肟镍红色络合物,测量其吸光度。每个工作曲线溶液测量三次,试液测量两次,由工作曲线查出试液中镍的浓度,计算镍的质量分数。7次重复测量结果分别为1.886%,1.898%,1.878%,1.886%,1.892%,1.892%,1.886%。 使用10mL 滴定管分别移取了2.00mL ,4.00mL ,6.00mL ,8.00mL 和10.00mL 镍标准溶液[(50±0.12)μg/mL (k=2)]于100mL 容量瓶中,以下直接发色,操作同试样,绘制工作曲线。 分析所使用的仪器和标准溶液试剂有: 天平:万分之一,检定允许差±0.1mg 容量瓶:100mL ,B 级,允许差±0.2mL 吸量管:10mL ,A 级,允许差±0.05mL 滴定管:10mL ,A 级,允许差±0.025mL 镍标准溶液:(50±0.12)μg/mL ,k=2 4 测量的数学模型 100106 10 ?????= -V m V V c w Ni 式中: w Ni -镍的质量分数,%
钢铁中磷的分析
工业分析与检验一班2009113040119 王栋 钢铁中磷的分析 [摘要]研究了分光光度法、磷钼蓝光度法、ICP一AES法、原子吸收分光光度计测定钢铁中磷的方法的稳定性问题。及对磷的介绍。 [关键字]分光光度法磷钼蓝光度法ICP一AES法原子吸收分光光度计法磷钢铁 关于磷的分析方法的研究已有许多报道, 磷钼蓝光度法作为测定钢铁中磷的方法已有较长的历史, 目前我国检验检疫系统对钢材中的磷的测定一般采用比色法或使用ICP 等方法, 对于磷含量在0.020%左右及以下的情况下, 分析所得到的结果偏差较大。原子吸收因灵敏度高, 干扰少而广泛用于分析领域。本文将介绍几种关于磷的分析方法。 磷的分析方法 1分光光度法 1.1实验部分 1.11主要仪器与试剂:分光光度计:721型;上海第三分析仪器厂产;硝酸:2:3(2份浓HN03与3份水混合均匀);高锰酸钾溶液:4%;酒石酸钾钠一钥酸按混合液:20%的钼酸铵与20%的酒石酸钾钠溶液等体积混合; NaF一SnCl2几混合液:先配制 2.4%NaF溶液,然后每100rnLNaF 溶液中加人0.2gSnCl2,溶解摇匀(现用现配)。经常使用时可大量配制NaF溶液,在使用时取部分溶液加人SnCl2飞。NaF溶液可长时间单独保存;硫脲溶液:1%(当日配制)。 1.1 2.实验步骤:(l)称取试样50mg,置于150mL锥形瓶中,加人硝酸(2:3)10mL,加热至试样溶解。加高锰酸钾2一3滴,继续煮沸10s,取下,加人酒石酸钾钠一钼酸铵混合液5mL,立即加NaF一SnCl2几混合液40rnL,摇匀,流水冷却,立即以水作参比,用2cm比色皿,在波长650nm处测量吸光度。(2)步骤同(1),只是在加人NaF一SnCl2混合液40mL后,加人硫脲50mL,摇匀,流水冷却,立即测吸光度;待35min后,再测其吸光度。 1.13标准曲线的绘制:(l)称取与试样同质量而含磷量不同的标钢,按1.2中(l)的分析步骤测定吸光度,并绘制曲线。 1.2结果与讨论 1.21硫脲的加入量与溶液颜色稳定时间的关系本法采用在显色后的溶液中,加人适量的硫脉作稳定剂,加人硫脲使显色后的磷钼蓝颜色由纯蓝色立即转变为天蓝色,使天蓝色能稳定的持续时间延长,达30一40而n,从而提高了结果的准确性。硫脲的加人量与溶液颜色稳定时间的关系,见图l。 从图1看出,加人硫腮40一801llL,溶液的天蓝色均可稳定35而n以上,本法采用加人硫脲601llL。 1.22标准曲线 按1.3所绘制的三条标准曲线是重合的,如图2所示。
