fy六方最密堆积晶胞中正八面体空隙和正四面体空隙中心的分数坐标-加练习20150430

金属的结构和性质 体心立方堆积中八面体空隙与四面体空隙半径计算
08金属的结构和性质 【8.1】半径为R 的圆球堆积成正四面体空隙,试作图计算该四面体的边长和高、中心到顶点距离、中心距离地面的高度、中心到两顶点连县的夹角以及中心到球面的最短距离。 解:4个等径圆球作紧密堆积的情形示于图9.1(a )和(b),图9.1(c)示出堆积所形成的正四面体空隙。该正四面体的顶点即球心位置,边长为圆球半径的2倍。 图9.1 由图和正四面体的立体几何知识可知: 边长AB=2R 高 () 12 12 2 2222 13AM AE EM AB BE DE ????=-=--?? ? ????? ? ( )1 12 2 222 222 11223AB AB AE R R R ???????????=--=--??? ? ???????????????? 1.633R =≈ 中心到顶点的距离:3 1.2254OA AM R R ==≈ 中心到底边的高度: 10.4084OM AM R = =≈ 中心到两顶点连线的夹角为:AOB ∠ ()( )) ( )() 2 2 2 2 2 1122/22cos cos 22/2R OA OB AB OA OB θ--?? -??+-??==???? ?????? ()1 cos 1/3109.47-=-=? 中心到球面的最短距离0.225OA R R =-≈ 本题的计算结果很重要。由此结果可知,半径为R 的等径圆球最密堆积结构中四面体空 隙所能容纳的小球的最大半径为0.225R 。而0.225正是典型的二元离子晶体中正离子的配位 多面体为正四面体时正、负离子半径比的下限。此题的结果也是了解hcp 结构中晶胞参数的
六方最密堆积中正八面体空隙和正四面体空隙
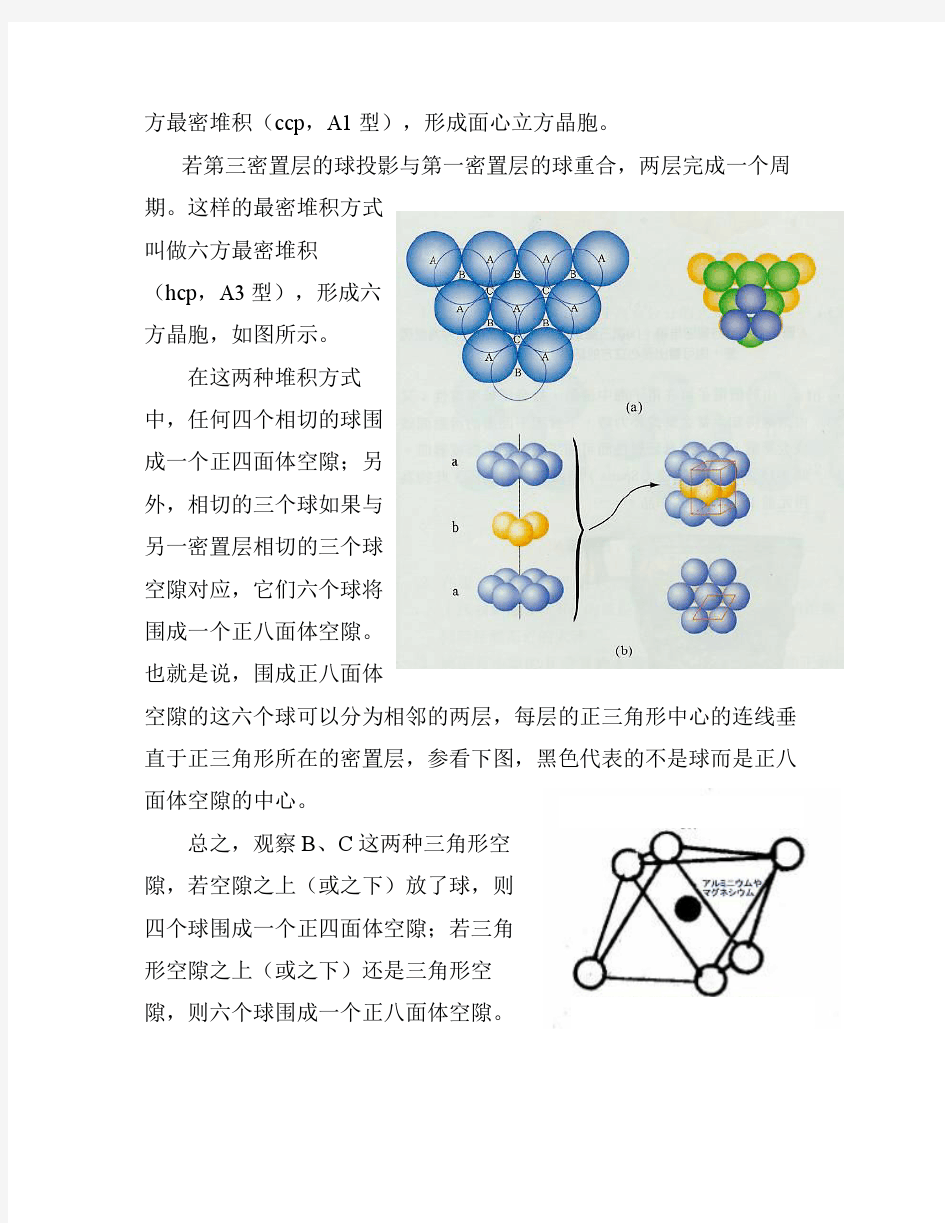
六方最密堆积中正八面体空隙 和正四面体空隙中心的分数坐标 等径圆球紧密排列形成 密置层,如图所示。 在密置层内,每个圆球 周围有六个球与它相切。相 切的每三个球又围出一个三 角形空隙。仔细观察这些三 角形空隙,一排尖向上,接 着下面一排尖向下,交替排列。而每个圆球与它周围的六个球围出的 六个三角形空隙 中,有三个尖向 上,另外三个尖向 下。如图所示,我 们在这里将尖向上 的三角形空隙记为 B,尖向下的三角 形空隙记为C。第 二密置层的球放在 B之上,第三密置
层的球投影在C中, 三层完成一个周期。 这样的最密堆积方式 叫做立方最密堆积 (ccp,记为A1 型),形成面心立方 晶胞。 若第三密置层的 球投影与第一密置层的球重合,两层完成一个周期。这样的最密堆积方式叫做六方最密堆积(hcp,记为A3型),形成六方晶胞,如图所示。 在这两种堆积方式中,任何四个相切的球围成一个正四面体空隙;另外,相切的三个球如果与另一密置层相切的三个球空隙对应,它们六个球将围成一个正八面体空隙。也就是说,围成正八面体空隙的这六个球可以分为相邻的两层,每层的正三角形中心的连线垂直于正三角形所在的密置层,参看下图, 黑色代表的不是球而是正八面体的中 心。 在这两种最密堆积方式中,每个 球与同一密置层的六个球相切,同时 与上一层的三个球和下一层的三个球
相切,即每个球与周围十二个球相切(配位数为12)。中心这个球与周围的球围出八个正四面体空隙,平均分摊到每个正四面体空隙的是八分之一个球。这样,每个正四面体空隙分摊到的球数是四个八分之一,即半个。中心这个球周围还围出六个八面体空隙,它平均分摊到每个正八面体空隙的是六分之一个球。这样,每个正八面体空隙分摊到的球数是六个六分之一,即一个。总之,这两种最密堆积中,球数: 正八面体空隙数: 正四面体空隙数= 1:1:2 。 面心立方最密堆积(ccp,A1型)中正八面体空隙和正四面体空隙的问题比较简单、直观。下面我们集中讨论六方最密堆积(hcp,A3型)中正八面体空隙和正四面体空隙中心的分数坐标。 在六方最密堆积中画出一个六方晶胞,如下面两幅图所示。
六方晶系四指数推导
1.4 晶向指数和晶面指数 一晶向和晶面 1 晶向 晶向:空间点阵中各阵点列的方向(连接点阵中任意结点列的直线方向)。晶体中的某些方向,涉及到晶体中原子的位置,原子列方向,表示的是一组相互平行、方向一致的直线的指向。 2 晶面 晶面:通过空间点阵中任意一组阵点的平面(在点阵中由结点构成的平面)。晶体中原子所构成的平面。 不同的晶面和晶向具有不同的原子排列和不同的取向。材料的许多性质和行为(如各种物理性质、力学行为、相变、X光和电子衍射特性等)都和晶面、晶向有密切的关系。所以,为了研究和描述材料的性质和行为,首先就要设法表征晶面和晶向。为了便于确定和区别晶体中不同方位的晶向和晶面,国际上通用密勒(Miller)指数来统一标定晶向指数与晶面指数。 二晶向指数和晶面指数的确定 1 晶向指数的确定方法 三指数表示晶向指数[uvw]的步骤如图1所示。 (1)建立以晶轴a,b,c为坐标轴的坐标系,各轴上的坐标长度单位分别是晶胞边长a,b,c,坐标原点在待标晶向上。 (2)选取该晶向上原点以外的任一点P(xa,yb,zc)。 (3)将xa,yb,zc化成最小的简单整数比u,v,w,且u∶v∶w = xa∶yb∶zc。 (4)将u,v,w三数置于方括号内就得到晶向指数[uvw]。 图1 晶向指数的确定方法 图2 不同的晶向及其指数 当然,在确定晶向指数时,坐标原点不一定非选取在晶向上不可。若原点不在待标晶向上,那就需要选取该晶向上两点的坐标P(x1,y1,z1)和Q(x2,y2,z2),然后将(x1-x2),(y1-y2),
(z 1-z 2)三个数化成最小的简单整数u ,v ,w ,并使之满足u ∶v ∶w =(x 1-x 2)∶(y 1-y 2)∶(z 1-z 2)。则[uvw ]为该晶向的指数。 显然,晶向指数表示了所有相互平行、方向一致的晶向。若所指的方向相反,则晶向指数的数字相同,但符号相反,如图3中[001]与[010]。 说明: a 指数意义:代表相互平行、方向一致的所有晶向。 b 负值:标于数字上方,表示同一晶向的相反方向。 c 晶向族:晶体中原子排列情况相同但空间位向不同的一组晶向。用
金属的结构和性质 体心立方堆积中八面体空隙与四面体空隙半径计算
08金属的结构和性质 【】半径为R 的圆球堆积成正四面体空隙,试作图计算该四面体的边长和高、中心到顶点距离、中心距离地面的高度、中心到两顶点连县的夹角以及中心到球面的最短距离。 解:4个等径圆球作紧密堆积的情形示于图(a )和(b),图(c)示出堆积所形成的正四面体空隙。该正四面体的顶点即球心位置,边长为圆球半径的2倍。 图 由图和正四面体的立体几何知识可知: 边长AB=2R 高 () 12 12 2 2222 13AM AE EM AB BE DE ????=-=--?? ? ????? ? ()1 12 2 2 2 2 222 113223AB AB AE R R R ???????????=--=--??? ? ???????????????? 26 1.6333R R =≈ 中心到顶点的距离:36 1.22542OA AM R R ==≈ 中心到底边的高度: 160.40846OM AM R R = =≈ 中心到两顶点连线的夹角为:AOB ∠ ()()) ()() 22 2 2 2 11226/22cos cos 226/2R R OA OB AB OA OB R θ--?? -??+-??==???? ?????? ()1 cos 1/3109.47-=-=? 中心到球面的最短距离0.225OA R R =-≈ 本题的计算结果很重要。由此结果可知,半径为R 的等径圆球最密堆积结构中四面体空
隙所能容纳的小球的最大半径为。而正是典型的二元离子晶体中正离子的配位 多面体为正四面体时正、负离子半径比的下限。此题的结果也是了解hcp 结构中晶胞参数的基础(见习题。 【】半径为R 的圆球堆积成正八面体空隙,计算中心到顶点的距离。 解:正八面体空隙由6个等径圆球密堆积而成,其顶点即圆球的球心,其棱长即圆球的直径。空隙的实际体积小于八面体体积。图中三图分别示出球的堆积情况及所形成的正八面体空隙。 图 由图(c )知,八面体空隙中心到顶点的距离为: 111 2222222OC AC AB R R = ==?= 而八面体空隙中心到球面的最短距离为: 20.414OC R R R R -=-≈ 此即半径为R 的等径圆球最密堆积形成的正八面体空隙所能容纳的小球的最大半径。 是典型的二元离子晶体中正离子的配位多面体为正八面体时/r r +-的下限值。 【】半径为R 的圆球围成正三角形空隙,计算中心到顶点的距离。 解:由图可见,三角形空隙中心到顶点(球心)的距离为: 223 1.15533OA AD R R = =≈ 图 三角形空隙中心到球面的距离为: 1.1550.155OA R R R R -≈-=
6.晶体中原子堆垛方式
()四晶体中的原子堆垛方式 因此面心立方晶格和密排六方晶格均属于最紧密排列的结构 对各类晶体的配位数和致密度进行分析计算的结果表明,配位数以12为最大,致密度以0.74为最高 为什么两者的晶体结构不同而却会有相同的密排程度 为了回答这一向题需要了解晶体中的原子堆垛方式 图1-10a为在一个平面上原子最紧密排列的情况原子之间彼此紧密接触 这个原子最紧密排列的平面即密排面,对于密排六方品格而言是其底面,对于面心立方品格而言,则为垂直于立方体空间对角线的对角面 密排面的六边形模型: 可以把密排面的原子中心连结成六边形网格,该六边形网格又可分为六个等边三角形,而这六个三角形的中心又与原子的六个空隙中心相重合。从图1.10可以看出,这六个空隙可分为b、c组,每组分别构成一个等边三角形。 第二层密排面的排列原则如图1.11所示: 为了获得最紧密的排列,第二层密排面()层 B的每个原子应当正好坐落在下面一层()层 A密排面的b组空隙()组 或c上 关键是第三层密排面它有两种堆垛方式: 1.第一种是第三层密排面的每个原子中心正好对应第一层()层 A密排面的原子中心,第四层密排面又与第二层重复,以下依次类推。因此,密排面的堆垛顺序是ABABAB,按照这种堆垛方式,即构成密排六方晶格,如图1.12所示 C的每个原子中心不与第一层密排面的2.第二种堆垛方式是第三层密排而()层 原子中心重复,而是位于既是第二层原子的空隙中心,又是第一层原子的空
隙中心处。之后,第四层的原子中心与第一层的原子中心重复,第五层的又与第二层的重复,照此类推,它的堆垛方式为ABCABCABC,这就构成了面心立方晶格,如图1.13所示 体心立方晶格的原子堆垛方式: 1.密排面是哪个:在体心立方晶胞中,除位于体心的原子与位于顶角的八个原 子相切外,八个顶角上的原了彼此间并不相互接触。显然,原子排列较为紧密的面相当于连结晶胞立方体的两个斜对角线所组成的面。 2.密排面模型:若将该面取出并向四周扩展,则可画成如图1.14所示的形式。 3.密排面比较:由图可以看出,这层原子面的空隙是由四个原子所构成,而密 排六方品格和面心立方晶格密排面的空隙由三个原子所构成,显然,前者的空隙较后者大,原子排列的紧密程度较差,通常称其为次密排面。 4.原子堆垛方式:为了获得较为紧密的排列,第二层次密排面()层 B的每个原子应坐落在第一层()层 A的空隙中心上,第三层的原子位于第二层的原子空隙处并与第一层的原子中心相重复,依此类推。因而它的堆垛方式为 ABABAB,由此构成体心立方晶格,如图1.14所示
金属的结构和性质体心立方堆积中八面体空隙与四面体空隙半径计算
~ 08金属的结构和性质 【】半径为R 的圆球堆积成正四面体空隙,试作图计算该四面体的边长和高、中心到顶点距离、中心距离地面的高度、中心到两顶点连县的夹角以及中心到球面的最短距离。 解:4个等径圆球作紧密堆积的情形示于图(a )和(b),图(c)示出堆积所形成的正四面体空隙。该正四面体的顶点即球心位置,边长为圆球半径的2倍。 图 由图和正四面体的立体几何知识可知: 边长AB=2R 高 () 12 12 2 222 2 13AM AE EM AB BE DE ????=-=--?? ?????? ? \ ()112 2 222 222 113223AB AB AE R R R ???????????=--=--??? ? ???????????????? 26 1.6333R R =≈ 中心到顶点的距离:36 1.2254OA AM R R ==≈ 中心到底边的高度:160.4084OM AM R = =≈ 中心到两顶点连线的夹角为:AOB ∠ ()()) ()() 2 2 2 2 2 1122 6/22cos cos 226/2R R OA OB AB OA OB R θ--?? -??+-??==???? ?????? ()1 cos 1/3109.47-=-=? 中心到球面的最短距离0.225OA R R =-≈ } 本题的计算结果很重要。由此结果可知,半径为R 的等径圆球最密堆积结构中四面体空
隙所能容纳的小球的最大半径为。而正是典型的二元离子晶体中正离子的配位 多面体为正四面体时正、负离子半径比的下限。此题的结果也是了解hcp 结构中晶胞参数的基础(见习题。 【】半径为R 的圆球堆积成正八面体空隙,计算中心到顶点的距离。 解:正八面体空隙由6个等径圆球密堆积而成,其顶点即圆球的球心,其棱长即圆球的直径。空隙的实际体积小于八面体体积。图中三图分别示出球的堆积情况及所形成的正八面体空隙。 图 、 由图(c )知,八面体空隙中心到顶点的距离为: 1112222222OC AC AB R R = ==?= 而八面体空隙中心到球面的最短距离为: 20.414OC R R R R -=-≈ 此即半径为R 是典型的二元离子晶体中正离子的配位多面体为正八面体时/r r +-的下限值。 【】半径为R 的圆球围成正三角形空隙,计算中心到顶点的距离。 ~ 解:由图可见,三角形空隙中心到顶点(球心)的距离为: 223 1.15533OA AD R R = =≈ 图 三角形空隙中心到球面的距离为: 1.1550.155OA R R R R -≈-= 此即半径为R 的圆球作紧密堆积形成的三角形空隙所能容纳的小球的最大半径,是“三角形
三维化学-正八面体与正方体
高中化学竞赛辅导专题讲座——三维化学 第三节 正八面体与正方体 前文我们学习了正方体与正四面体,现在我们来学习另一种空间正多面体——正八面体。由于在高中立体几何中并未涉及这种立体图形,使同学们在理解上存在一定的困难,那么就让我们先来讨论一下正八面体吧! 【讨论】顾名思义,正八面体应该有八个完全相同的面,如右图3-1所示,每个面都是正三角形;另外正八面体有六个顶点,十二条棱。让我们与正方体作一对比,它们都有十二条棱,正方体有六个面(正八面体六个顶点)、八个顶点(正八面体八个面),与正八面体的面数和顶点数正好相反,它们是否存在内在的空间关系呢?我们连接正方体六个面的面心形成 的是什么空间图形呢?它就是正八面体(能理解了吧!我们也可以将空间直角坐标系xyz 轴上与原点等距的六个点连起来构成正八面体)。正八面体与正方体都是十二条棱,它们的空间位置显然是不一样的,但它们的十二条棱的棱心的空间位置又如何呢?应该是一样的吧。先让我们看个例题再讨论吧! 【例题1】已知[Co(NH 3)6]3+的立体结构如图3-2所示,其中1~6处 的小圆圈表示NH 3分子,且各相邻的NH 3分子间的距离相等(图中虚线长度相同)。Co 3+位于八面的中心,若其中两个NH 3被Cl -取代,所形成的[Co(NH 3)4Cl 2]+的同分异构体的数目是 ① A 1 B 2 C 3 D 4 【分析】正八面体每个顶点在空间是完全等价的, 另五个顶点就在空间形成两种相对的位置,四个是相邻的,的,故二氯取代物是两种,两个氯的距离分别是边长和对角线长。 【解答】B 【练习1】SF 6SF 6的分子结构如图3-3所示,呈正八面体型。如果F 的同位素,则SF 6的不同分子种数为 ② A 6种 B 7种 C 10种 D 12种 【讨论】用同位素考察分子的空间结构是一种新方法,方法。本题中主要来确定S a F 3b F 3的种数,三个a F 在空间也只有两种形式,即△和├;另外S a F 2b F 4与S a F 4b F 2的种数应该是一样的吧?(想 想为什么)! F F F S F F F
正四、六、八面体的组合
第 1 页 共 5 页 高中化学竞赛辅导专题讲座——三维化学 第四节 正四、六、八面体的组合 前文我们学习了正方体、正四面体与正八面体,本节我们将对内容做进一步的巩固复习,并将探讨一下正四、八面体的组合。 【例题1】XeF 8是一种尚未合成的化合物,预测它的空间构型 ;F 有二种同位素,则XeF 8有 种不同分子。 (不计顺反异构和旋光异构)① 【分析】八个原子在空间的最对称排列是正方体。 在着重讨论过正四面体与正八面体后,再看这个正方体 问题。不妨设正方体八个顶点全被a F 占据,我们每一次 用0,1,2,3……8个b F 去取代,看两个b F ,有3 种,分别在棱上,面对角线上,体对角线上;看三个b F ,也 有3种,三个b F 构成的三角形边长分别为1,1,2;1,2,3;2,2,2。关键是看四个b F 时有几种。如图4-1所示正方体,四个b F 共面时有2种(如面ABCD 与面A 1B 1CD 型),四个b F 构成正三棱锥有2种(如正四面体型的ACB 1D 1与三棱垂直的ABDA 1),另外还各有一个ABCC 1型和ABCD 1型。因此总数应为(1+1+3+3)×2+6=22种。 【解答】正方体 22 【练习1】1964年Eaton 合成了一种新奇的烷,叫立方烷,化学式为C 8H 8 (A )。20年后,在Eaton 研究小组工作的博士后XIONG YUSHENG (译音熊余生)合成了这种烷的四硝基衍生物(B ), 是一种烈性炸药。最近,有人计划将B 的硝基用19种氨基酸取代,得到立方烷的四酰胺基衍生物 (C ),认为极有可能从中筛选出最好的抗癌、抗病毒,甚至抗爱滋病的药物来。四硝基立方烷理论上可以有多种异构体,但仅只一种是最稳定的,它就是(B ),请画出它的结构式;C 中每个酰胺基是一个氨基酸基团。请估算,B 的硝基被19种氨基酸取代,理论上总共可以合成多少种氨基酸组成不同的四酰胺基立方烷(C )?(不考虑光学异构体)② 【讨论】C 8H 8分子是正方体型的结构,其中四个氢被硝基取代的产物应有6种,而最稳定的是正四面体型的构型,它的对称性最强。关于正方体中取正四面体问题,我们在第一节中就已详细讨论。 第二问是个排列组合问题,相当于从19种酰胺基填入4个完全相同的位置。在数学排列组合问题中,关键是如何分类计算,我们根据这四个位置上酰胺基是否重复可分为A 4、A 3B 、A 2B 2、A 2BC 、ABCD 5类,总数分别为:119C 、219P 、219C 、218119C C 、419C 。 (关于排列组合问题在后面专题讨论) 图4-1
金属的结构及性质体心立方堆积中八面体空隙及四面体空隙半径计算.doc
8 金属的结构和性质 【 8.1 】半径为 R 的圆球堆积成正四面体空隙,试作图计算该四面体的边长和高、中心到顶点距离、中心距离地面的高度、中心到两顶点连县的夹角以及中心到球面的最短距离。 解: 4 个等径圆球作紧密堆积的情形示于图 9.1 ( a )和 (b) ,图 9.1(c) 示出堆积所形成 的正四面体空隙。该正四面体的顶点即球心位置,边长为圆球半径的 2 倍。 图 9.1 由图和正四面体的立体几何知识可知: 边长 AB=2R 2 2 1 2 2 1 AMAE EM 2 AB BE DE 高 3 1 2 2 1 2 1 2 2 2 2 2 AB 2 1 AB 1 A E R 2 3 R 2R 2 3 3 2 6R 1.633R 3 OA 3 AM 6 R 1.225R 中心到顶点的距离: 4 2 OM 1 AM 6 R 0.408R 中心到底边的高度: 4 6 中心到两顶点连线的夹角为: AOB 2 6R / 2 2 2 2 2 2 2R cos 1 OA OB AB cos 1 2 6R / 2 2 2 OA OB cos 1 1/3 109.47 中心到球面的最短距离 OA R 0.225R 本题的计算结果很重要。由此结果可知,半径为 R 的等径圆球最密堆积结构中四面体空 隙所能容纳的小球的最大半径为 0.225R 。而 0.225 正是典型的二元离子晶体中正离子的配 位
多面体为正四面体时正、 负离子半径比的下限。 此题的结果也是了解 hcp 结构中晶胞参数的基础 ( 见习题 9.04) 。 【8.2 】半径为 R 的圆球堆积成正八面体空隙,计算中心到顶点的距离。 解:正八面体空隙由 6 个等径圆球密堆积而成, 其顶点即圆球的球心, 其棱长即圆球的直径。空隙的实际体积小于八面体体积。 图 9.2 中三图分别示出球的堆积情况及所形成的正八面体空隙。 图 9.2 由图( c )知,八面体空隙中心到顶点的距离为: 1 1 1 OCAC 2 AB 2 2R2R 2 2 2 而八面体空隙中心到球面的最短距离为: OC R 2R R 0.414R 此即半径为 R 的等径圆球最密堆积形成的正八面体空隙所能容纳的小球的最大半径。 0.414 是典型的二元离子晶体中正离子的配位多面体为正八面体时 r / r 的下限值。 【 8.3 】半径为 R 的圆球围成正三角形空隙,计算中心到顶点的距离。 解:由图 9.3 可见,三角形空隙中心到顶点(球心)的距离为: OA 2 AD 2 3R 1.155R 3 3 图 9.3 三角形空隙中心到球面的距离为: OA R 1.155R R 0.155R 此即半径为 R 的圆球作紧密堆积形成的三角形空隙所能容纳的小球的最大半径, 0.155 是“三 角形离子配位多面体”中 r / r 的下限值。 A3 a c
第四节 正四、六、八面体的组合
第四节 正四、六、八面体的组合 前文我们学习了正方体、正四面体与正八面体,本节我们将对内容做进一步的巩固复习,并将探讨一下正四、八面体的组合。 【例题1】XeF 8是一种尚未合成的化合物,预测它的空间构型 ;F 有二种同位素,则XeF 8有 种不同分子。 (不计顺反异构和旋光异构) 【分析】八个原子在空间的最对称排列是正方体。在着重讨论过 正四面体与正八面体后,再看这个正方体问题。不妨设正方体八个顶 点全被a F 占据,我们每一次用0,1,2,3……8个b F 去取代,看两 个b F ,有3种,分别在棱上,面对角线上,体对角线上;看三个b F , 也有3种,三个b F 构成的三角形边长分别为1,1,2;1,2,3 ;2,2 ,2。关键是看四个b F 时有几种。如图4-1所示正方体,四个b F 共面时有2种(如面ABCD 与面A 1B 1CD 型),四个b F 构成正三棱锥有2种(如正四面体型的ACB 1D 1与三棱垂直的ABDA 1),另外 还各有一个ABCC 1型和ABCD 1型。因此总数应为(1+1+3+3)×2+6=22种。 【解答】正方体 22 【练习1】1964年Eaton 合成了一种新奇的烷,叫立方烷,化学式为C 8H 8 (A )。20年后,在Eaton 研究小组工作的博士后XIONG YUSHENG (译音熊余生)合成了这种烷的四硝基衍生物(B ), 是一种烈性炸药。最近,有人计划将B 的硝基用19种氨基酸取代,得到立方烷的四酰胺基衍生物(C ),认为极有可能从中筛选出最好的抗癌、抗病毒,甚至抗爱滋病的药物来。四硝基立方烷理论上可以有多种异构体,但仅只一种是最稳定的,它就是 (B ),请画出它的结构式;C 中每个酰胺基是一个氨基酸基团。请估算,B 的硝基被19种氨基酸取代,理论上总共可以合成多少种氨基酸组成不同的四酰胺基立方烷(C )?(不考 虑光学异构体) 【讨论】C 8H 8分子是正方体型的结构,其中四个氢被硝基取代的产物应有6种,而最稳定的是正四面体型的构型,它的对称性最强。关于正方体中取正四面体问题,我们在 第一节中就已详细讨论。 第二问是个排列组合问题,相当于从19种酰胺基填入4个完全相同的位置。在数学排列组合问题中,关键是如何分类计算,我们根据这四个位置上酰胺基是否重复可分为 A 4、A 3 B 、A 2B 2、A 2B C 、ABC D 5类,总数分别为:119C 、219P 、219C 、218119C C 、419C 。(关于排列组合问题在后面专题讨论) 【例题2】金刚烷(C 10H 16)是一种重要的脂肪烷烃,其结构高度对称, 如图4-2所示。金刚烷能与卤素发生取代反应,其中一氯一溴金刚烷 (C 10H 14ClBr )的同分异构体数目是 A 4种 B 6种 C 8种 D 10种 【分析】金刚烷有10个碳原子,它们在空间是如何排列的呢?这10个 碳原子有2种,分别是4个叔碳原子与6个仲碳原子。4个叔碳原子在空间 图4-1 图4-2
第二章 晶体结构
晶体结构分类方法
(B) 2.1 符号中的第一个大写字母表示结构的类型,后面的数字为第个大写字母表示结构的类型后面的数字为顺序号,不同的顺序号表示不同的结构,例如A1是铜型结 结构等。 构,B2是CsCl型结构等,C3是FeS 2
Pearson符号 它所属的布喇菲点阵类型(例如P、I、F、C等),第三个数 等) 字表示单胞中的原子数。 2.2 金属单质的晶体结构 在元素周期表中,共有70多种金属元素。
由于金属键不具有饱和性和方向性,使金属的晶体结构倾向配位数(
将用原子刚性球模型讨论每个单胞所含的原子数以及这些构中的间隙等。 2.2.1 面心立方结构 结构符号是A1,Pearson 符号是c F4。 原子坐标为0 0 0,0 1/2 1/2,1/2 0 1/2和1/2 1/2 0 每个晶胞含4个原子 最紧密排列面是{111},密排方向 是<110>。原子直径是a/2<110>的 长度,即 面心立方结构的晶胞体积为a 3, 晶胞内含4个原子,所以它的致密 度η为4 2a r =423443443 3 33? ??? ????×=×=ππηa r 每个原子有个最近邻原子,它的 配位数(CN )是12。 74 .062 ==πa a
面心立方结构的最密 排面是{111},面心立 方结构是以{111}最密 排面按一定的次序堆 垛起来的。 第一层{111}面上有两个 可堆放的位置:▲和▼位 可堆放的位置▲和▼位 置,在第二层只能放在一 种位置,在面上每个球和 下层3个球相切,也和上 层3个球相切。 第一层为A,第 二放在B 位置, 第三层放在C 位 置,第四层在 置第四层在 放回A位置。 {111}面 按…abcabc… 顺序排列,这 就形成面心立 方结构。
典型的晶体结构
典型的晶体结构 1.铁 铁原子可形成两种体心立方晶胞晶体:910℃以下为α-Fe,高于1400℃时为δ-Fe。在这两种温度之间可形成γ-面心立方晶。这三种晶体相中,只有γ-Fe能溶解少许C。问:1.体心立方晶胞中的面的中心上的空隙是什么对称?如果外来粒子占用这个空隙,则外来粒子与宿主离子最大可能的半径比是多少? 2.在体心立方晶胞中,如果某空隙的坐标为(0,a/2,a/4),它的对称性如何?占据该空隙的外来粒子与宿主离子的最大半径比为多少? 3.假设在转化温度之下,这α-Fe和γ-F两种晶型的最相邻原子的距离是相等的,求γ铁与α铁在转化温度下的密度比。 4.为什么只有γ-Fe才能溶解少许的C? 在体心立方晶胞中,处于中心的原子与处于角上的原子是相接触的,角上的原子相互之间不接触。a=(4/3)r。 ①②③ 1.两个立方晶胞中心相距为a,也等于2r+2r h[如图①],这里r h是空隙“X”的半径,a =2r+2r h=(4/3)r r h/r=0.115(2分) 面对角线(2a)比体心之间的距离要长,因此该空隙形状是一个缩短的八面体,称扭曲八面体。(1分) 2.已知体心上的两个原子(A和B)以及连接两个晶体底面的两个角上原子[图②中C和D]。连接顶部原子的线的中心到连接底部原子的线的中心的距离为a/2;在顶部原子下面的底部原子构成晶胞的一半。空隙“h”位于连线的一半处,这也是由对称性所要求的。所以我们要考虑的直角三角形一个边长为a/2,另一边长为a/4[图③],所以斜边为16 /5a。(1分)r+r h=16 /5a=3/5r r h/r=0.291(2分) 3.密度比=42︰33=1.09(2分) 4.C原子体积较大,不能填充在体心立方的任何空隙中,但可能填充在面心立方结构的八面体空隙中(r h/r=0.414)。(2分) 2.四氧化三铁 科学研究表明,Fe3O4是由Fe2+、Fe3+、O2-通过离子键而组成的复杂离子晶体。O2-的重复排列方式如图b所示,该排列方式中存在着两种类型的由O2-围成的空隙,如1、3、6、7的O2-围成的空隙和3、6、7、8、9、12的O2-围成的空隙,前者为正四面体空隙,后者为正八面体空隙,Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中正四面体空隙数与O2-数之比为2:1,其中有12.5%正四面体空隙填有Fe3+,有50%正八面体空隙没有被填充。 Fe3O4中三价铁离子:亚铁离子:O原子=2:1:4 晶胞拥有8个正四面体空隙,4个O2-离子;所以2:1 一半三价铁离子放入正四面体空隙,即一个三价铁离子,所以为1/8=12.5%晶胞实际拥有4个正八面体空隙,其中已经有一个放Fe3+,另外一个Fe2+占据一个正八面体空隙,所以50%的正八面体空隙没有被填充。
标注六方晶系晶向指数的平行投影修正系数法
用平行投影修正系数法标注六方晶系晶向指数 桂进秋席生岐※张建勋范群成 西安交通大学材料科学与工程学院 摘要:介绍了采用平行投影修正系数法标注六方晶系晶向指数的新方法,并对其原理进行了论证。 关键词:六方晶系晶向指数Miller-Bravais指数平行投影 0前言 众所周知,金属中常见的3种晶体结构为体心立方、面心立方和密排六方,其中密排六方结构属于六方晶系。由于其对称性特点,在晶体学中惯用四轴坐标表示六方晶系的晶面和晶向,称为Miller-Bravais 指数[1]。在这种体系中对晶面指数的标注并未有什么不便,但是对晶向指数的标注却比较麻烦,容易出错。正如范群成[2]所指出,晶向[1213]在文献[3]中被误标为[1212],而在文献[4]中又被误标为[1211]。 在一般的教科书[1,4,5,6]中,六方晶系Miller-Bravais晶向指数[uvtw]有2种主要的标注方法。一种是所谓的移步法[4],选择合适的路径沿4个晶轴方向从待定晶向上的一点(通常是坐标原点)依次移动到另一点,而合适的路径要求满足u+v=-t约束条件。由于这一约束条件的限制,移动路径及距离的选取决定相当困难,不易寻找。另一种是公式法[1,4,6],即先在三轴坐标系中标出[UVW],再利用公式:u=(2U-V)/3, v=(2V-U)/3, t= -(u+v), w=W 换算成[uvtw]。该方法不但麻烦,完全依赖于对换算公式的记忆,而且不直观,不便于对晶向的理解和把握。 为更直观地从晶胞结构图中直接计算来标出六方晶系中的晶向指数,范群成曾提出了正射投影修正系数法[2]。如图1所示,这种方法是由待标晶向上任一点(常取特殊点)分别向a1,a2,a3和c轴作垂直投影,求出以晶格常数为单位的投影值,并给c轴的投影值乘以修正系数3/2,然后化为最小简单整数。这种方法在一个晶胞中通过垂直投影来计算出晶向指数,和晶胞结合,直观性有改进,和移步法的结果有一致性,比移步法容易操作。 受正射投影法的启示,在《材料科学基础》课堂讨论的过程中,我们提出了另一种也较为简便易行的来标定六方晶系Miller-Bravais晶向指数的方法——平行投影修正系数法。本文就对这种新方法做一详细介绍。
六方最密堆积中正八面体空隙和正四面体空隙中心的分数坐标
密堆积中正八面体空隙和正四面体空隙 晶体结构的密堆积原理密堆积结构是指在由无方向性的金属键,离子键和范德华力结合的晶体中,原子、分子或离子等微粒总是趋向于相互配位数高,能充分利用空间的堆积密度大的那些结构。密堆积方式由于充分利用了空间,从而可使体系的势能尽可能降低。结构稳定。最常见的密堆积型式有:面心立方最密堆积(A1),六方最密堆积(A3)和体心立方密堆积 (A2)。 我们主要介绍面心立方密堆积和六方密堆积。 等径圆球紧密排列形成密置层, 如图所示。 在密置层内,每个圆球周围有六 个球与它相切。相切的每三个球又围 出一个三角形空隙。仔细观察这些三 角形空隙,一排尖向上,接着下面一 排尖向下,交替排列。而每个圆球与 它周围的六个球围出的六个三角形空 隙中,有三个尖向上,另外三个尖向 下。如图所示,我们在这里将尖向上 的三角形空隙记为B,尖向下的三角形空隙记为C。第二密置层的球放在B之上,第三密置层 的球投影在C中,三层完成一个周 期。这样的最密堆积方式叫做立方 最密堆积(ccp,记为 A1型), 形成面心立方晶胞。
若第三密置层的球投影与第一密置层的球重合,两层完成一个周期。这样的最密堆积方式叫做六方最密堆积(hcp ,记为A3型),形成六方晶胞,如图所示。 在这两种堆积方式中,任何四个相切的球围成一个正四面体空隙;另外,相切的三个球如果与另一密置层相切的三个球空隙对应,它们六个球将围成一个正八面体空隙。也就是说,围成正 八面体空隙的这六个球可以分为相邻的两层,每层的正三角形中心的连线垂直于正三角形所在的密置层,参看下图,黑色代表的不是球而是正八面体的中心。 在这两种最密堆积方式中,每个球与同一密置层的六个球相切,同时与上一层的三个球和下一层的三个球相切,即每个球与周围十二个球相切(配位数为12)。中心这个球与周围的球围出八 个正四面体空隙,平均分摊到每个正四面体空隙的是八分之一个球。这样,每个正四面体空隙分摊到的球数是四个八分之一,即半个。中心这个球周围还围出六个八面体空隙,它平均分摊到每个正八面体空隙的是六分之一个球。这样,每个正八面体空隙分摊到的球数是六个六分之一,即一个。总之,这两种最密堆积中,球数 : 正八面体空隙数 : 正四面体空隙数 = 1:1:2 。等径球的两种最密堆积具有相同的堆积密度,都为74.05%. 下面计算四面体空隙和八面体空隙中所能容纳的球的半径的大小。
典型的晶体结构
典型得晶体结构 1、铁 铁原子可形成两种体心立方晶胞晶体:910℃以下为α-Fe,高于1400℃时为δ-Fe。在这两种温度之间可形成γ-面心立方晶。这三种晶体相中,只有γ-Fe能溶解少许C。问: 1.体心立方晶胞中得面得中心上得空隙就是什么对称?如果外来粒子占用这个空隙,则外来粒子与宿主离子最大可能得半径比就是多少? 2.在体心立方晶胞中,如果某空隙得坐标为(0,a/2,a/4),它得对称性如何?占据该空隙得外来粒子与宿主离子得最大半径比为多少? 3.假设在转化温度之下,这α-Fe与γ-F两种晶型得最相邻原子得距离就是相等得,求γ铁与α铁在转化温度下得密度比。 4.为什么只有γ-Fe才能溶解少许得C? 在体心立方晶胞中,处于中心得原子与处于角上得原子就是相接触得,角上得原子相互之间不接触。a=(4/3)r。 ①②③ 1.两个立方晶胞中心相距为a,也等于2r+2r h[如图①],这里r h就是空隙“X”得半径,a =2r+2r h=(4/3)r r h/r=0、115(2分) 面对角线(2a)比体心之间得距离要长,因此该空隙形状就是一个缩短得八面体,称扭曲八面体。(1分) 2.已知体心上得两个原子(A与B)以及连接两个晶体底面得两个角上原子[图②中C与D]。连接顶部原子得线得中心到连接底部原子得线得中心得距离为a/2;在顶部原子下面得底部原子构成晶胞得一半。空隙“h”位于连线得一半处,这也就是由对称性所要求得。所以我们要考虑得直角三角形一个边长为a/2,另一边长为a/4[图③],所以斜边为16 /5a。(1分) r+r h=16 /5a=3/5r r h/r=0、291(2分) 3.密度比=42︰33=1、09(2分) 4.C原子体积较大,不能填充在体心立方得任何空隙中,但可能填充在面心立方结构得八面体空隙中(r h/r=0、414)。(2分) 2、四氧化三铁 科学研究表明,Fe3O4就是由Fe2+、Fe3+、O2-通过离子键而组成得复杂离子晶体。O2-得重复排列方式如图b所示,该排列方式中存在着两种类型得由O2-围成得空隙,如1、3、6、7得O2-围成得空隙与3、6、7、8、9、12得O2-围成得空隙,前者为正四面体空隙,后者为正八面体空隙,Fe3 O4中有一半得Fe3+填充在正四面体空隙中,另一半Fe3+与Fe2+填充在正八面体空隙中,则Fe3O4晶体中正四面体空隙数与O2-数之比为 2:1,其中有12、5%正四面体空隙填有Fe3+,有 50%正八面体空隙没有被填充。ClMXxzK。zNa2qb4。 Fe3O4中三价铁离子:亚铁离子:O原子=2:1:4 晶胞拥有8个正四面体空隙,4个O2-离子;所以2:1 一半三价铁离子放入正四面体空隙,即一个三价铁离子,所以为1/8=12、5% 晶胞实际拥有4个正八面体空隙,其中已经有一个放Fe3+,另外一个Fe2+占据一个正八面体空隙,所以50%得正八面体空隙没有被填充。USLphY1。N1iF2Vt。
第三节正八面体与正方体
第三节 正八面体与正方体 【讨论】顾名思义,正八面体应该有八个完全相同的面,如右图3-1所示,每个面都是正三角形;另外正八面体有六个顶点,十二条棱。让我们与正方体作一对比,它们都有十二条棱,正方体有六个面(正八面体六个顶点)、八个顶点(正八面体八个面),与正八面体的面数和顶点数正好相反,它们是否存在内在的空间关系呢?我们连接正方体六个面的面心形成的是什么空间图形呢?它就是正八面体(能理解了吧!我们也可以将空 间直角坐标系xyz 轴上与原点等距的六个点连起来构成正八面体)。正八面体与正方体都是十二条棱,它们的空间位置显然是不一样的,但它们的十二条棱的棱心的空间位置又如何呢?应该是一样的吧。先让我们看个例题再讨论吧! 【例题1】已知[Co(NH 3)6]3+ 的立体结构如图3-2所示,其中1~6处的小圆圈表示NH 3分子,且各相邻的NH 3分子间的距离相等(图中虚线长度相同)。Co 3+位于八面的中心,若其中两个NH 3被Cl -取代,所形成的[Co(NH 3)4Cl 2]+的同分异构体的数目是 ① A 1 B 2 C 3 D 4 【分析】正八面体每个顶点在空间是完全等价的,当选定一个顶 点后,另五个顶点就在空间形成两种相对的位置,四个是相邻的,一 个是相对的,故二氯取代物是两种,两个氯的距离分别是边长和对角线长。 【解答】B 【练习1】SF 6是一种无色气体,具有很强的稳定性,可用于灭火。SF 6的分子结构如图3-3所示,呈正八面体型。如果F 元素有两种稳定的同位素,则SF 6的不同分子种数为 ② A 6种 B 7种 C 10种 D 12种 【讨论】用同位素考察分子的空间结构是一种新方法,也是一种好方法。本题中主要来确定S a F 3b F 3的种数,三个a F 在空间也只有两种形 式,即△和├;另外S a F 2b F 4与S a F 4b F 2的种数应该是一样的吧?(想想为什么)! 【练习2】正方体ABCD —A 1B 1C 1D 1中截取最大正八面体,再从该正八面体中截取最大正方体A ’B ’C ’D ’—A 1’B 1’C 1’D 1’,计算它们的体积比。 【讨论】本题是用来巩固正方体与正八面体的关系,利用立体几何 知识并不难解决。 如果我们连接大正方体的对角线,则该对角线也正好通过小正方体 的对角线和正八面体的两个面的面心, 且与正八面体这两个面正好垂直。我们沿这条对角线观察正八面体,可得如图3-4所示的图形,它是我们 从另一种角度观察得到的图形,也是一种很重要的图形,请看例题2: 图3-4
典型的晶体结构
4 ?为什么只有丫― Fe 才能溶解少许的 C ? 在体心立方晶胞中,处于中心的原子与处于角上的原子是相接触的,角上的原子相互之间不接触。1.铁 铁原子可形成两种体心立方晶胞晶体: 间可形成Y-面心立方晶。这三种晶体相中,只有 1 ?体心立方晶胞中的面的中心上的空隙是什么对称?如果外来粒子占用这个空隙,则外来粒子与宿主 离子最大可能的半径比是多少? 2 ?在体心立方晶胞中,如果某空隙的坐标为( 子与宿主离子的最大半径比为多少? 3 ?假设在转化温度之下,这a 化温度下的密度比。 910 C 以下为a — Fe ,高于1400 C 时为S — Fe 。在这两种温度之 丫― Fe 能溶解少许C 。问: 0, a/2, a/4),它的对称性如何?占据该空隙的外来粒 Fe 和丫- F 两种晶型的最相邻原子的距离是相等的,求丫 铁 与a 铁在转 a = 1 XI A 丿 i 0 \J 1 ?两个立方晶胞中心相距为 (4/ , 3)r r h /r = 0.115 ( 2 分) 面对角线(J 2 a )比体心之间的距离要长,因此该空隙形状是一个缩短的八面体,称扭曲八面体。( 分) 2?已知体心上的两个原子( A 和B )以及连接两个晶体底面的两个角上原子[图②中 C 和D ]。连接 顶部原子的线的中心到连接底部原子的线的中心的距离为 a/2;在顶部原子下面的底部原子构成晶胞的一半。 空隙“ h ”位于连线的一半处,这也是由对称性所要求的。所以我们要考虑的直角三角形一个边长为 a/2,另 一边长为a/4 [图③],所以斜边为 5/16 a o ( 1分) r + r h = ,5/16 a =、5/3 r r h /r = 0.291 (2 分) 3 .密度比=4 .2 : 3、3 = 1.09 (2 分) 4. C 原子体积较大,不能填充在体心立方的任何空隙中,但可能填充在面心立方结构的八面体空隙中 (r h /r = 0.414)。( 2 分) 2.四氧化三铁 a ,也等于2r + 2r h [如图①],这里 r h 是空隙“ X ”的半径, a = 2r + 2r h 科学研究表明,Fe 3O 4是由Fe 2+、Fe 3+、O 2—通过离子键而组成的复杂离子晶体。 O 2— 的重复排列方式如图b 所示,该排列方式中存在着两种类型的由 O 2— 围成的空隙,如1、3、 6 7的O 2—围成的空隙和3、6、7、& 9、12的O 2—围成的空隙,前者为正四面体空隙, 后者为正八 面体空隙,Fe 3O 4中有一半的卩63+填充在正四面体空隙中,另一半 Fe 3+和Fe 2+ 填充在正八面体空隙中,则 Fe 3O 4晶体中正四面体空隙数与 O 2—数之比为2: 1,其中有1 2.5%正四面体空隙填有Fe 3+ ,有50%正八面体空隙没有被填充。 Fe 3O 4中三价铁离子:亚铁离子: O 原子=2: 1: 4 晶胞拥有8个正四面体空隙,4个O 2— 离子;所以2: 一半三价铁离子放入正四面体空隙,即一个三价铁离子, 晶胞实际拥有4个正八面体空隙,其中已经有一个放 面体空隙,所以50%的正 八面体空隙没有被填充。 ?铁的原子核是最稳定的原子核组态,所以在可以孕育生命的大红星中,累积很多,这导致铁在宇宙的 含量很多, 地球也含有很多铁。 1 ?在制作青灰瓷中,Fe 2O 3被部分还原,产生 这些不同氧化铁化合物的存在,造成了青灰瓷的特殊色彩。 1 所以为 1/8=12.5% Fe 3+,另外一个Fe 2+ 占据一个正八 ① (4/ .. 3)r 。 小障中心 的混合物, (Fe 3O 4 )
