第三章有机化合物知识点归纳总结
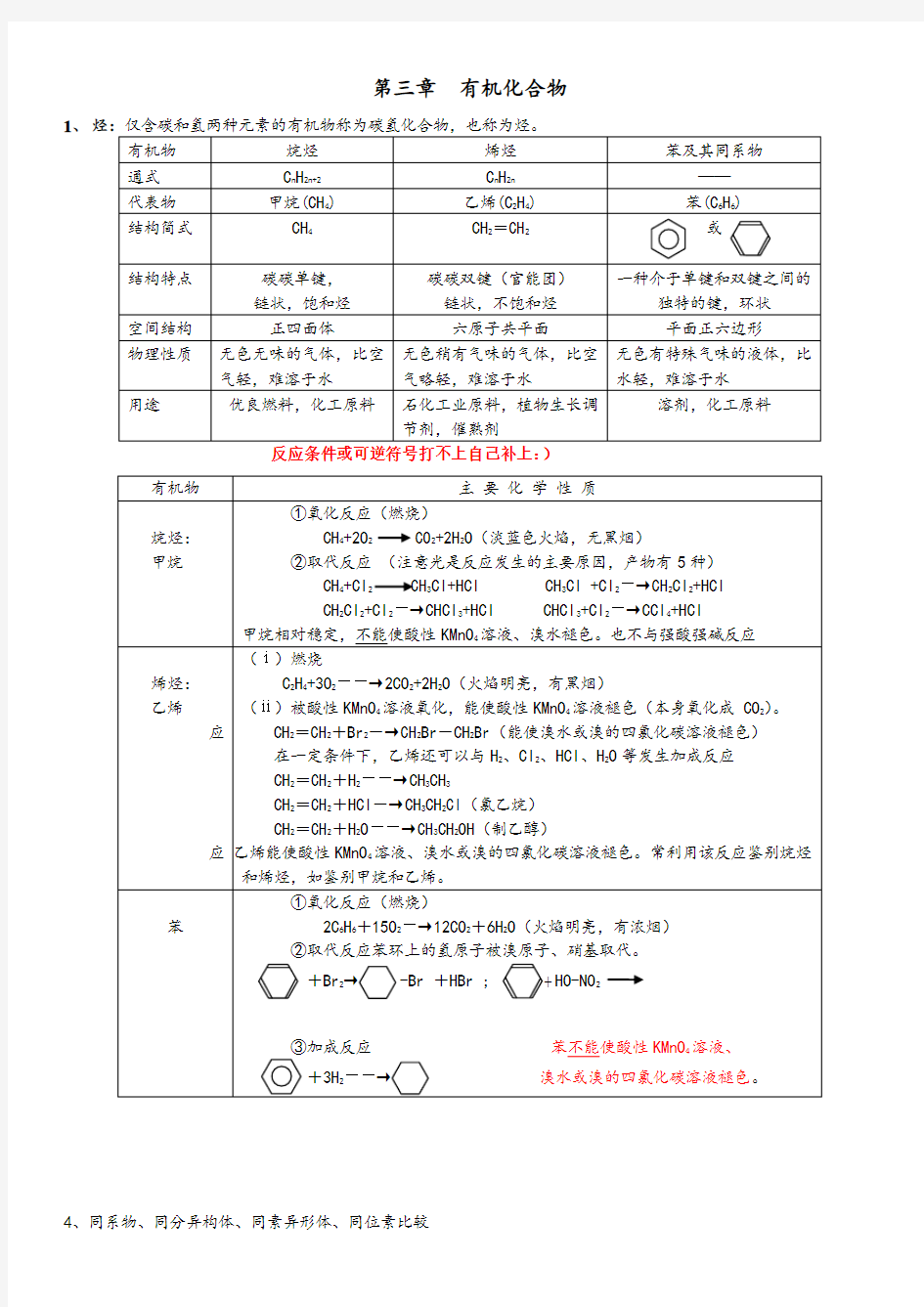

第三章有机化合物1、
反应条件或可逆符号打不上自己补上:)
4、同系物、同分异构体、同素异形体、同位素比较
1
2、乙醇、水、碳酸、乙酸中羟基氢原子的活泼性
O= O=
CH3CH2—OH,H—OH,HO-C-OH(碳酸),CH3-C--OH中均有羟基,
由于这些羟基相连的基团不同,羟基上氢原子的活动性也就不同,现比较如下:
注意:利用羟基的活动性不同,可判断分子结构中羟基的类型,从而推断有机物的性质。
3、乙醇与乙酸的酯化反应:原理酸脱羟基醇脱氢。 酯化反应也属于取代反应,它是取代反应中的一种。
CH 3COOH+C 2H 5OH CH 3COOC 2H 5+H 2O
实验装置图:
实验中的注意事项(这是本节知识的考点)
1、加药品的先后顺序:乙醇、浓硫酸、冰醋酸。
2、浓硫酸的作用:催化剂(加快反应速率)、吸水剂(使可逆反应向生成乙酸乙酯的方向移动)。
3、加热的目的:加快反应速率、及时将产物乙酸乙酯蒸出以利于可逆反应向生成乙酸乙酯的方向移动。(注意:加热时须小火均匀进行,这是为了减少乙醇的挥发,并防止副反应发生生成醚。)
4、导气管伸到饱和碳酸钠溶液液面上的目的:防止受热不均引起倒吸。
5、饱和碳酸钠溶液的作用:吸收未反应的乙酸和乙醇、降低乙酸乙酯的溶解度使之易分层析出。
6、不能用NaOH 溶液代替饱和碳酸钠溶液:因为NaOH 溶液碱性强促进乙酸乙酯的水解。
7、提高乙酸乙酯的产率的方法:加入浓硫酸、加入过量的乙酸或乙醇、及时将产物乙酸乙酯蒸出。 4、酯化反应与酯水解反应的比较
OH
浓硫酸
△
蛋白质盐析和变性的比较
有机化合物知识点总结
有机化合物知识点总结 Company number:【WTUT-WT88Y-W8BBGB-BWYTT-19998】
有机化合物重要知识点总结 一.有机物的密度 小于水的密度,且与水(溶液)分层的有:各类烃、酯(包括油脂) 二、重要的反应 1.能使溴水(Br 2/H 2O )或(Br 2/CCl 4)褪色的物质 通过加成反应使之褪色:含有、—C ≡C —的不饱和化合物 通过氧化反应使之褪色:含有—CHO (醛基)的有机物 2.能使酸性高锰酸钾溶液(KMnO 4/H +)褪色的物质 含有、—C≡C—、—CHO 的物质 与苯环相连的侧链碳上有氢原子的苯的同系物(与苯不反应) 3.与Na 反应的有机物:含有—OH 、—COOH 的有机物 (—OH --- 1/2H 2 —COOH----1/2H 2) 与NaOH 反应的有机物:常温下,易与含有酚羟基... 、—COOH 的有机物反应;加热时,能与酯反应(取代反应)、卤代烃的水解反应、有醇存在时卤代烃的消去反应 与Na 2CO 3反应的有机物:含有酚.羟基的有机物反应生成酚钠和NaHCO 3; 含有—COOH 的有机物反应生成羧酸钠,并放出CO 2气体; 与NaHCO 3反应的有机物:含有—COOH 的有机物反应生成羧酸钠并放出等物质的量的CO 2气体。 4.银镜反应的有机物 (1)发生银镜反应的有机物: 含有—CHO 的物质:醛、甲酸、甲酸盐、甲酸酯、还原性糖(葡萄糖、麦芽糖等) 银镜反应的一般通式: RCHO + 2Ag(NH 3)2OH 2 Ag ↓+ RCOONH 4 + 3NH 3 + H 2O 【记忆诀窍】: 1—水(盐)、2—银、3—氨 (2)定量关系:—CHO ~2Ag(NH)2OH ~2 Ag HCHO ~4Ag(NH)2OH ~4 Ag 5.与新制Cu(OH)2悬浊液的反应 羧酸(中和)、甲酸(先中和,但NaOH 仍过量,后氧化)、醛、还原性糖(葡萄糖、麦芽 糖) 三、各类烃的代表物的结构、特性 类 别 烷 烃 烯 烃 炔 烃 苯及同系物 通 式 C n H 2n+2(n ≥1) C n H 2n (n ≥2) C n H 2n-2(n ≥2) C n H 2n-6(n ≥6) 代表物结构 式 H —C≡C—H 相对分子质量Mr 16 28 26 78 分子形状 正四面体 6个原子 共平面型 4个原子 同一直线型 12个原子共平面(正六边形) 主要化学性 质 光照下的卤代;裂化;不使酸性 跟X 2、H 2、HX 、H 2O 、HCN 加成,易被氧化(使酸 跟X 2、H 2、HX 、HCN 加成;易被氧跟H 2加成;FeX 3催化下卤代;硝化。
第一章认识有机化合物知识点复习
第一章认识有机化合物知识点复习 考点1:有机物的特点 1.无机化合物和有机化合物的划分 无机化合物(简称无机物)通常指不含碳元素的化合物,无机物包括酸、碱、盐、氧化物等,另外,单质也属于无机物。有机化合物(简称有机物)是一类含有碳元素的化合物,比如烃及其各种衍生物就是我们常见的有机物。 无机物和有机物的划分不是绝对的,少数含碳化合物性质更像无机物,所以将它们划分为无机物的范畴。中学常见含碳无机物有: 2.有机物的特点 在结构上: 在性质上: 在反应上: 考点2:碳原子的成键特点和结合方式 1.C原子的成键特点 (1)通常以共价键与其它原子结合——所以有机物多数是共价化合物。 (2)总是形成4个价键——是有机物种类繁多的一个重要原因。 (3)C原子的价键具有一定的空间伸展方向——这样有机物就有一定的立体空间形状。 2.C原子结合方式 有机物中C原子可以以单键结合,也可以以双键、三键结合,还可以像苯环这样介于单双键之间的独特方式相结合。C原子可以结合成链状,也可以结合成环状。 考点3:有机物分子结构 1.有机分子的空间结构及表示方法—— 有机物绝大多数为共价化合物,分子中原子之间依靠共价键结合。通常用 式表示有机物分子中原子间的结合情况。对于环状化合物,用键线式表示则比较方便。 由于共价键具有一定的空间伸展方向,这使得有机物分子具有一定的空间形状。若一个碳原子周围是一个双键和两个单键,其双键和单键的夹角总接近120o,若是一个三键和一个单键,则它们的夹角总接近180o,若碳原子形成四个单键,则它们的夹角总接近109.5o。 有机物的空间结构可以用粗略表示。下面是几种具有代表性的有机物分子结构。
地理各模块知识点总结
地理各模块知识点总结 地理知识点总结了一篇又一篇,每次都是以不一样的视角去告诉学生,如果考试是这样考的,这样的知识点就必须要记住,今天也不例外,每块知识都是从不同角度来分析,这一定就是我们需要掌握的知识! 一、生态问题 1 水土流失问题 我国典型地区:黄土高原、南方低山丘陵地区 产生的原因: (1)自然原因:季风气候降水集中,多暴雨;地表植被稀少;黄土土质疏松黄土高原)。 (2)人为原因:植被的破坏;不合理的耕作制度;开矿。 治理的措施:压缩农业用地,扩大林、草种植面积;植树造林;小流域综合治理。 治理的意义: 有利于因地制宜地进行产业结构的调整,使农林牧副渔全面发展,可以增加农民收入,促进当地经济发展,改善农民生活条件,提高生活质量;有利于改善当地的生态环境,建立良性生态系统;建立生态农业模式,有利于促进生态和经济可持续发展。 2 荒漠化问题 我国典型的地区:西北地区(新疆、青海、内蒙等地) 产生的原因: (1)自然原因:全球变暖,蒸发旺盛;处于内陆地区,降水少;鼠害;蝗害。 (2)人为原因:过度放牧;过度樵采;过度开垦;水资源的不合理利用;交通线等工程建设保护不当。 治理措施: 制定草场保护的法律、法规,加强管理;控制载畜量;营造“三北防护林”建设;退耕还林、还牧;建设人工草场;推广轮牧;禁止采伐发菜等 治理意义: 有利于因地制宜地进行产业结构的调整,使农林牧副渔全面发展,可以增加农民收入,促进当地经济发展,改善农民生活条件,提高生活质量;有利于保护土地资源改善当地的生态环境;有利于促进生态和经济可持续发展。 3 干旱缺水问题 我国典型地区:华北地区、西北、长江中下游地区 华北地区:
高中化学有机化合物知识点总结
结 高中化学有机物知识点总 一、重要的物理性质 1.有机物的溶解性 同)醇、醛、(1)难溶于水的有:各类烃、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下羧酸等。 糖。 (2)易溶于水的有:低级的[一般指N(C)≤4]醇、醛、羧酸及盐、氨基酸及盐、单糖、二 (3)具有特殊溶解性的: ①乙醇是一种很好的溶剂,既能溶解许多无机物,又能溶解许多有机物。 ②乙酸乙酯在饱和碳酸钠溶液中更加难溶,同时饱和碳酸钠溶液还能通过反应吸收挥发出的乙酸,溶解吸 。 收挥发出的乙醇,便于闻到乙酸乙酯的香味 盐(包括铵盐)溶液中溶解度减小,会析出(即 金属 ③有的淀粉、蛋白质可溶于水形成胶.体.。蛋白质在浓轻 盐析,皂化反应中也有此操作)。 ④线型和部分支链型高聚物可溶于某些有机溶剂,而体型则难溶于有机溶剂。 绛蓝色溶液。 ⑤氢氧化铜悬浊液可溶于多羟基化合物的溶液中,如甘油、葡萄糖溶液等,形成 2.有机物的密度 小于水的密度,且与水(溶液)分层的有:各类烃、酯(包括油脂) 3.有机物的状态[常温常压(1个大气压、20℃左右)] (1)气态: [C(CH3)4]亦为气态 ①烃类:一般N(C)≤4的各类烃注意:新戊烷 ②衍生物类: 一.氯.甲.烷.(.C.H.3.C..l,.沸.点.为.-.2..4..2.℃.).甲.醛.(.H.C.H.O.,.沸.点.为.-.2.1.℃.). (2)液态:一般N(C)在5~16的烃及绝大多数低级衍生物。如, 己烷C H3(CH2)4CH3甲醇CH3OH 甲酸HCOOH乙醛CH3CHO ★特殊: 不饱和程度高的高级脂肪酸甘油酯,如植物油脂等在常温下也为液态 (3)固态:一般N(C)在17或17以上的链烃及高级衍生物。如, 石蜡C12以上的烃 为固态 饱和程度高的高级脂肪酸甘油酯,如动物油脂在常温下 4.有机物的颜色 ☆绝大多数有机物为无色气体或无色液体或无色晶体,少数有特殊颜色 色溶液; 绛蓝 ☆多羟基有机物如甘油、葡萄糖等能使新制的氢氧化铜悬浊液溶解生成 1
有机化合物知识点归纳总结
第三章有机化合物1、 反应条件或可逆符号打不上自己补上:) 4、同系物、同分异构体、同素异形体、同位素比较
1 2、乙醇、水、碳酸、乙酸中羟基氢原子的活泼性 O=O= CH3CH2—OH,H—OH,HO-C-OH(碳酸),CH3-C--OH中均有羟基, 由于这些羟基相连的基团不同,羟基上氢原子的活动性也就不同,现比较如下:
3、乙醇与乙酸的酯化反应:原理酸脱羟基醇脱氢。 酯化反应也属于取代反应,它是取代反应中的一种。 CH 3COOH+C 2H 5OHCH 3COOC 2H 5+H 2O 实验装置图: 实验中的注意事项(这是本节知识的考点) 1、加药品的先后顺序:乙醇、浓硫酸、冰醋酸。 2、浓硫酸的作用:催化剂(加快反应速率)、吸水剂(使可逆反应向生成乙酸乙酯的方向移动)。 3、加热的目的:加快反应速率、及时将产物乙酸乙酯蒸出以利于可逆反应向生成乙酸乙酯的方向移动。(注意:加热时须小火均匀进行,这是为了减少乙醇的挥发,并防止副反应发生生成醚。) 4、导气管伸到饱和碳酸钠溶液液面上的目的:防止受热不均引起倒吸。 5、饱和碳酸钠溶液的作用:吸收未反应的乙酸和乙醇、降低乙酸乙酯的溶解度使之易分层析出。 6、不能用NaOH 溶液代替饱和碳酸钠溶液:因为NaOH 溶液碱性强促进乙酸乙酯的水解。 7、提高乙酸乙酯的产率的方法:加入浓硫酸、加入过量的乙酸或乙醇、及时将产物乙酸乙酯蒸出。 4 、酯化反应与酯水解反应的比较 浓硫酸 △
蛋白质盐析和变性的比较 淀粉、纤维素水解实验的注意问题 (1)淀粉、纤维素水解都用H2SO4做催化剂,但淀粉用 20%H2SO4,纤维素用90%H2SO4,均需微热; (2)检验产物时,必须用 ...NaOH ........,才能用银氨溶液或新制Cu(OH)2,进行检验。 ....溶液中和过量的酸 (3)淀粉是否发生水解的判断: 利用淀粉遇碘变蓝的反应和其水解最终产物葡萄糖能发生银镜反应来判断淀粉是否发生水解和水解进行程度。 如淀粉没有水解,则不能发生银镜反应;如淀粉已完全水解,则遇碘不能变蓝色;如既能发生银镜反应,又能遇碘变蓝色,则说明淀粉仅部分水解。 有机化合物燃烧规律 有机化合物的燃烧涉及的题目主要是烃和烃的衍生物的燃烧。烃是碳氢化合物,烃的衍生物主要是含氧衍生物,它们完全燃烧的产物均为二氧化碳和水,题目涉及的主要是燃烧的耗氧量及生成CO2和H2O的量的问题。 设烃的通式为:C x H y, 烃的含氧衍生物的通式为:C x H y O z 烃燃烧的通式:CxHy+(x+y/4)O2=xCO2+y/2H2O 烃的含氧衍生物燃烧的通式:CxHyOz+(X+Y/4-Z/2)O2→xCO2+y/2H20 (1)比较有机物燃烧的耗氧量,以及生成的CO2和H2O的量的相对大小:根据上述两燃烧通式可归纳出以下规律: ①等物质的量的烃完全燃烧时的耗氧量,取决于(x+y/4) 的值,生成的CO2和H2O的量取决于x和y的值。还
最新外研版(新)八年级上册英语各模块知识点归纳总结
英语初二上册重点知识点讲解 Module 1 How to learn English 1.pair n. (相关的)两个人,一对,一双,一副 a pair of socks一双袜子 a pair of gloves一副手套two pairs of trousers两条裤子 e.g.A pair of teenage boys are watching a football game.两个青少年正在看足球赛。 2.correct (1)v. 改正,纠正 e.g.The teacher returned to her room to correct exercise books.老师回到房间去改练习本。 Correct the spelling.纠正拼写。 (2)adj.正确的;恰当的 e.g.correct pronunciation 正确发音 Do you have the correct time?你的表走得准吗? 3.advice (1)n.意思是“意见,建议”,为不可数名词,可用some,much,a piece of,pieces of等修饰,不能说an advice或many/a few advices。 (2)表示“有关……的建议”时,用介词on,接名词、代词或由疑问词引导的不定式。 advice on what to do next. 我们去征求一下他的意见下一步该怎么办。 e.g.Let’s ask for his 常见搭配: take/follow one’s advice接受某人的建议 ask for advice 征求意见 接受(拒绝)某人的建议 accept/refuse one’s advice offer advice to sb. 向某人提供建议 拓展: advise vt.建议 常见搭配:advise sb. to do sth.
最新高中化学有机化合物知识点总结资料
高中化学有机物知识点总结 一、重要的物理性质 1.有机物的溶解性 (1)难溶于水的有:各类烃、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。 (2)易溶于水的有:低级的[一般指N(C)≤4]醇、醛、羧酸及盐、氨基酸及盐、单糖、二糖。 (3)具有特殊溶解性的: ①乙醇是一种很好的溶剂,既能溶解许多无机物,又能溶解许多有机物。 ②乙酸乙酯在饱和碳酸钠溶液中更加难溶,同时饱和碳酸钠溶液还能通过反应吸收挥发出的乙酸,溶解吸 收挥发出的乙醇,便于闻到乙酸乙酯的香味。 ③有的淀粉、蛋白质可溶于水形成胶体 ..。蛋白质在浓轻金属盐(包括铵盐)溶液中溶解度减小,会析出(即盐析,皂化反应中也有此操作)。 ④线型和部分支链型高聚物可溶于某些有机溶剂,而体型则难溶于有机溶剂。 ⑤氢氧化铜悬浊液可溶于多羟基化合物的溶液中,如甘油、葡萄糖溶液等,形成绛蓝色溶液。 2.有机物的密度 小于水的密度,且与水(溶液)分层的有:各类烃、酯(包括油脂) 3.有机物的状态[常温常压(1个大气压、20℃左右)] (1)气态: ①烃类:一般N(C)≤4的各类烃注意:新戊烷[C(CH3)4]亦为气态 ②衍生物类: 一氯甲烷( ....,沸点为 ...HCHO ...). ....-.21℃ ...-.24.2℃ .....CH ..3.Cl..,.沸点为 .....).甲醛( (2)液态:一般N(C)在5~16的烃及绝大多数低级衍生物。如, 己烷CH3(CH2)4CH3甲醇CH3OH 甲酸HCOOH 乙醛CH3CHO ★特殊: 不饱和程度高的高级脂肪酸甘油酯,如植物油脂等在常温下也为液态 (3)固态:一般N(C)在17或17以上的链烃及高级衍生物。如, 石蜡C12以上的烃 饱和程度高的高级脂肪酸甘油酯,如动物油脂在常温下为固态 4.有机物的颜色 ☆绝大多数有机物为无色气体或无色液体或无色晶体,少数有特殊颜色 ☆多羟基有机物如甘油、葡萄糖等能使新制的氢氧化铜悬浊液溶解生成绛蓝色溶液; ☆淀粉溶液(胶)遇碘(I2)变蓝色溶液; ☆含有苯环的蛋白质溶胶遇浓硝酸会有白色沉淀产生,加热或较长时间后,沉淀变黄色。 5.有机物的气味 许多有机物具有特殊的气味,但在中学阶段只需要了解下列有机物的气味: ☆甲烷无味 ☆乙烯稍有甜味(植物生长的调节剂) ☆液态烯烃汽油的气味 ☆乙炔无味
人教版八年级上册数学各单元知识点归纳总结
第十一章三角形 一、知识框架: 二、知识概念: 1.三角形:由不在同一直线上的三条线段首尾顺次相接所组成的图形叫做三角形. 2.三边关系:三角形任意两边的和大于第三边,任意两边的差小于第三边. 3.高:从三角形的一个顶点向它的对边所在直线作垂线,顶点和垂足间的线段叫做三角形 的高. 4.中线:在三角形中,连接一个顶点和它对边中点的线段叫做三角形的中线. 5.角平分线:三角形的一个内角的平分线与这个角的对边相交,这个角的顶点和交点之间 的线段叫做三角形的角平分线. 6.三角形的稳定性:三角形的形状是固定的,三角形的这个性质叫三角形的稳定性. 7.多边形:在平面内,由一些线段首尾顺次相接组成的图形叫做多边形. 8.多边形的内角:多边形相邻两边组成的角叫做它的内角. 9.多边形的外角:多边形的一边与它的邻边的延长线组成的角叫做多边形的外角. 10.多边形的对角线:连接多边形不相邻的两个顶点的线段,叫做多边形的对 角线. 11.正多边形:在平面内,各个角都相等,各条边都相等的多边形叫正多边形. 12.平面镶嵌:用一些不重叠摆放的多边形把平面的一部分完全覆盖,叫做用 多边形覆盖平面, 13.公式与性质: ⑴三角形的内角和:三角形的内角和为180° ⑵三角形外角的性质: 性质1:三角形的一个外角等于和它不相邻的两个内角的和. 性质2:三角形的一个外角大于任何一个和它不相邻的内角. n-·180° ⑶多边形内角和公式:n边形的内角和等于(2) ⑷多边形的外角和:多边形的外角和为360°. n-条对角 ⑸多边形对角线的条数:①从n边形的一个顶点出发可以引(3)
线,把多边形分成(2)n -个三角形.②n 边形共有(3)2 n n -条对角线. 第十二章 全等三角形 一、知识框架: 二、知识概念: 1.基本定义: ⑴全等形:能够完全重合的两个图形叫做全等形. ⑵全等三角形:能够完全重合的两个三角形叫做全等三角形. ⑶对应顶点:全等三角形中互相重合的顶点叫做对应顶点. ⑷对应边:全等三角形中互相重合的边叫做对应边. ⑸对应角:全等三角形中互相重合的角叫做对应角. 2.基本性质: ⑴三角形的稳定性:三角形三边的长度确定了,这个三角形的形状、大小就全确定,这个性质叫做三角形的稳定性. ⑵全等三角形的性质:全等三角形的对应边相等,对应角相等. 3.全等三角形的判定定理: ⑴边边边(SSS ):三边对应相等的两个三角形全等. ⑵边角边(SAS ):两边和它们的夹角对应相等的两个三角形全等. ⑶角边角(ASA ):两角和它们的夹边对应相等的两个三角形全等. ⑷角角边(AAS ):两角和其中一个角的对边对应相等的两个三角形全等. ⑸斜边、直角边(HL ):斜边和一条直角边对应相等的两个直角三角形 全等. 4.角平分线: ⑴画法: ⑵性质定理:角平分线上的点到角的两边的距离相等. ⑶性质定理的逆定理:角的内部到角的两边距离相等的点在角的平分线上. 5.证明的基本方法: ⑴明确命题中的已知和求证.(包括隐含条件,如公共边、公共角、对顶 角、角平分线、中线、高、等腰三角形等所隐含的边角关系)
选修5-第一章--认识有机化合物--知识点与典型题例
选修5 第一章认识有机化合物知识点与典型题例考点1有机物的命名 1.烷烃的习惯命名法 (1)碳原子数在十以下的,从一到十依次用甲、乙、丙、丁、戊、己、庚、辛、壬、癸来表示。 (2)碳原子数在十以上的,就用数字来表示。 (3)当碳原子数相同时,在某烷(碳原子数)前面加“正”“异”“新”等。 * 如C5H12的同分异构体有3种,分别是: 2.烷烃的系统命名法 烷烃命名的基本步骤是:选主链,称某烷;编号位,定支链;取代基,写在前;标位置,短线连;不同基,简到繁;相同基,合并算。 (1)最长、最多定主链。 ①选择最长碳链作为主链。如: | 应选含6个碳原子的碳链为主链,如虚线所示。 ②当有几个等长的不同的碳链时,选择含支链最多的一个作为主链。如 含7个碳原子的链有A、B、C三条,因A有三个支链,含支链最多,故应选A为主链。 (2)编号位要遵循“近”“简”“小”。 ①以离支链较近的主链一端为起点编号,即首先要考虑“近”。如: -
②有两个不同的支链,且分别处于距主链两端同近的位置,则从较简单的支链一端开始编号。即同“近”,考虑“简”。如: ③若有两个相同的支链,且分别处于距主链两端同近的位置,而中间还有其他支链,从主链的两个方向编号,可得两种不同的编号系列,两系列中各位次和最小者即为正确的编号,即同“近”、同“简”,考虑“小”。如: (3)写名称。 按主链的碳原子数称为相应的某烷,在其前写出支链的位号和名称。原则是:先简后繁,相同合并,位号指明。阿拉伯数字用“,”相隔,汉字与阿拉伯数字用“-”连接。如: ] 3.烯烃和炔烃的命名
4.苯的同系物命名 (1)苯作为母体,其他基团作为取代基。 例如:苯分子中的氢原子被甲基取代后生成甲苯,被乙基取代后生成乙苯,如果两个氢原子被两个甲基取代后生成二甲苯,有三种同分异构体可分别用邻、间、对表示。 (2)将某个甲基所在的碳原子的位置编为1号选取最小位次给另一个甲基编号。 ¥ 特别提醒有机化合物的命名看似简单,对生疏物质的命名往往易产生误差,主要体现在主链选取过程,号码编写过大,取代基主次不分。 题组训练 1.根据有机化合物的命名原则,下列命名正确的是() 解析A选项应该从右边开始编号,A项错误;B选项应该为2-丁醇,B项错误;C选项最长的碳链含
八年级上册英语外研版各模块知识点归纳总结
八年级上册英语外研版各模块知识点归纳总结
Module 1 How to learn English advice take/follow one’s advice接受某人的建议ask for advice 征求意见accept/refuse one’s advice接受(拒绝)某人的建议 offer advice to sb. 向某人提供建议 try to (1)try to do sth .努力做某事try doing sth.试着做某事 try/do one’s best to do sth. 尽某人的全力做某事 5.as…as possible/one can time at a time一次,每一次at one time曾经,一度 at times /from time to time 有时,偶尔on time 准时 all the time 总是,一直in time及时,迟早 ①It’s time for sb. to do sth./It’s (high) time sb. did sth. Suggest
(2)形容词比较级用法 ①表示两者进行比较时用形容词比较级,最明显的提示词是than,其结构为“A…+比较级+than+B”。 ②有表示程度的副词a little,a bit,a few,a lot,much,even,still,far,rather,any等修饰时,用形容词比较级。 ③比较级前面可以加上表示具体数量差别的结构,表示具体“大多少”,“小多少”,“长多少”,“短多少”等。 ④表示“两者之间最……一个(of the two)”时,常用“the+比较级”结构。 ⑤表示“越来越……”,用比较级重叠结构,即“比较级+and+比较级”,多音节词和部分双音节词时用“more and more+形容词原级”。 ⑥表示“越……就越……”时,用“the+比较级,the+比较级”结构。 Module 4 Planes, ships and trains 形容词最高比较级用法 ①表示三者或三者以上的人或物进行比较时,用最高级形式。形容词最高级前必须加定冠词the,句末常跟一个in/of短语来表示范围。(of表示同范围,in 表示不同范围)
第三章 有机化合物知识点
第三章有机化合物知识点 绝大多数含碳的化合物称为有机化合物,简称有机物。像CO、CO2、碳酸、碳酸盐、金属碳化物等少数化合物,它们属于无机化合物。 一、烃 1、烃的定义:仅含碳和氢两种元素的有机物称为碳氢化合物,也称为烃。 2、甲烷、乙烯和苯的性质比较: 有机物烷烃烯烃苯 通式C n H2n+2C n H2n—— 代表物甲烷(CH4) 乙烯(C2H4) 苯(C6H6) 结构简式CH4 CH2=CH2 或 (官能团) 结构特点单键,链状,饱和烃 双键,链状,不饱和烃(证 明:加成、加聚反应) 一种介于单键和双键之间的 独特的键(证明:邻二位取 代物只有一种),环状 空间结构正四面体(证明:其二氯 取代物只有一种结构) 六原子共平面平面正六边形 物理性质无色无味的气体,比空 气轻,难溶于水 无色稍有气味的气体,比空 气略轻,难溶于水 无色有特殊气味的液体,密 度比水小,难溶于水 用途优良燃料,化工原料石化工业原料,植物生长调 节剂,催熟剂 有机溶剂,化工原料 3、烃类有机物化学性质 有机物主要化学性质 甲烷1、甲烷不能使酸性KMnO4溶液、溴水或溴的四氯化碳溶液褪色,与强酸、强碱也不反应,性质比较稳定。 2、氧化反应(燃烧)注:可燃性气体点燃之前一定要验纯 CH4+2O2? ?→ ?点燃CO2+2H2O(淡蓝色火焰) 3、取代反应(条件:光;气态卤素单质;以下四反应同时进行,产物有5种)CH4+Cl2?→ ?光CH3Cl+HCl CH3Cl +Cl2?→ ?光CH2Cl2+HCl CH2Cl2+Cl2?→ ?光CHCl3+HCl CHCl3+Cl2?→ ?光CCl4+HCl 注意事项: ①甲烷与氯气在光照下发生取代反应,甲烷分子里的四个氢原子逐步被氯原子取代; ②反应能生成五种产物,四种有机取代产物都不溶于水,常温下,一氯甲烷是气体,其他是液体,三氯甲烷称氯仿,四氯甲烷可作灭火剂;产物中HCl气体产量最多; ③取代关系:1H~~Cl2; ④烷烃取代反应是连锁反应,产物复杂,多种取代物同时存在。 4、高温分解: 2 1000 4 2H C CH C+ ? ?→ ?
认识有机化合物 知识总结
第一章认识有机化合物知识总结 一、有机物分类: 二、烃基和官能团 烃基和官能团不但是有机化学中的重要概念,而且是有机物分类的依据和决定该化合物化学特性的关键结构部分。 1、应掌握的烃基除甲基、乙基外还应知道: 2、必须掌握的官能团有:
(1)有机物的官能团不同,类别不同,性质不同。 (2)有机物的官能团相同,若连接方式或连接位置不同,类别相同,性质不同 (3)有机物的性质就是官能团的性质,有机反应一般就是官能团的反应,与碳干结构无关。 三、有机化合物的结构特点 1、碳原子的成键特点: (1)碳原子价键数为四个; (2)碳原子间的成键方式有三种:C —C 、C=C 、C≡C ; (3)碳原子的结合方式有二种:碳链和碳环 2、有机物分子里原子共线、共面: 共线、共面其实是分子的构型问题,掌握并会画出以下分子的构型: (1)4CH :正四面体,键角109о28′,若是3223,,CHCl Cl CH Cl CH 则仅是四面体, H
注意:分子中有饱和碳则所有原子不可能共面。 四、同分异构体 凡分子式相同,但分子结构不同,因而性质也不同的几种化合物互称同分异构体。同分异构体可以属于同一类物质,也可以属于不同类物质。 1.结构不同指:碳链骨架不同或官能团在碳链上的位置不同或官能团种类、个数不同。 2.同分异构体之间分子式相同,其式量也一定相等,但式量相等的物质不一定是同分异构体。如式量为44的化合物有:CO 2、C 3H 8、C 2H 4O 、N 2O ;式量为28的化合物有CO 、N 2、C 2H 4但它们不是同分异构体。 3.同分异构体之间各元素的质量分数(最简式)均相同。但化合物之间各元素质量分数 (最简式)均相同的物质不一定为同分异构体。如符合最简式为CH 2O 的有:HCHO 、CH 3COOH 、CH 3CHCOOH 、C 6H 12O 6、HOCH 2、CHO 等。 4.同分异构体不一定是同类物,其物理性质、化学性质可能相似,也可能有较大的差 异(如酸和酯这样的类型异构)。 5.同分异构体不仅存在于有机物之间,还存在于有机物与无机物之间[如尿素CO(NH)2与氰酸铵NH 4CNO]、无机物和无机物之间。 6.书定同分异构体顺序可按类型异构 碳链异构 位置异构的思维顺序。类型异构一般有: 烯烃 炔烃 醇 酚 醛 羧酸 葡萄糖 环烷烃 二烯烃 醚 芳香醇 酮 酯 果糖 蔗糖 麦芽糖 一定要掌握从已知有机化合物的分子式,写出可能的同分异构体的结构简式这一基本技能。通常情况下,写出异构体结构简式时应(1)根据分子式先确定可能的官能团异构有几类;(2)在每一类异构中先确定不同的碳链异构;(3)再在每一条碳链上考虑位置异构有几种,这样考虑思路清晰,思维有序,不会混乱。写出时还要注意避免出现重复或遗漏现象,还应注意遵循碳原子价数为4,氧原 、 、、、、
高二化学《有机化合物的结构特点》知识点归纳总结 例题解析
有机化合物的结构特点 【学习目标】 1.通过有机物中碳原子的成键特点,了解有机物存在异构现象是有机物种类繁多的原因之一; 2.掌握同分异构现象的含义,能判断简单有机物的同分异构体,初步学会同分异构体的书写。 【要点梳理】 要点一、有机化合物中碳原子的成键特点 1.碳元素位于第二周期ⅣA族,碳原子的最外层有4个电子,很难得到或失去电子,通常以共用电子对的形式与其他原子形成共价键,达到最外层8个电子的稳定结构。 说明:根据成键两原子间共用电子的对数,可将共价键分为单键、双键和三键。即成键两原子间共用一对电子的共价键称为单键,共用两对电子的共价键称为双键,共用三对电子的共价键称为三键。 2.由于碳原子的成键特点,在有机物分子中,碳原子总是形成4个共价键,每个碳原子不仅能与氢原子或其他原子(如氧、氯、氮、硫等)形成4个共价键,而且碳原子之间可以形成单键(C—C)、双键(C=C)、三键(C≡C)。多个碳原子可以相互结合成长短不一的碳链,碳链也可以带有支链,还可以结合成碳环,碳链与碳环也可以相互结合,因此,含有原子种类相同,每种原子数目也相同的分子,其原子可能具有多种不同的结合方式,形成具有不同结构的分子。 说明: (1)在有机物分子中,碳原子仅以单键与其他原子形成4个共价键,这样的碳原子称为饱和碳原子,当碳原子以双键或三键与其他原子成键时,这样的碳原子称为不饱和碳原子。 (2)同种元素的原子间形成的共价键称为非极性键,不同种元素的原子间形成的共价键称为极性键。共价键的极性强弱与两个成键原子所属元素的电负性差值大小有关,电负性差值越大,键的极性就越强。 种类实例含义应用范围 化学式CH4C2H2 (甲烷) (乙炔) 用元素符号表示物质分子组成的式 子。可反映出一个分子中原子的种类 和数目 多用于研究分子晶体 最简式(实验式) 乙烷最简式为CH3, C6H12O6的最简式为 CH2O ①表示物质组成的各元素原子最简 整数比的式子②由最简式可求最简 式量 ①有共同组成的物质②离 子化合物、原子晶体常用它 表示组成 电子式用小黑点等记号代替电子,表示原子 最外层电子成键情况的式子多用于表示离子型、共价型的物质 结构式①具有化学式所能表示的意义,能反 映物质的结构②表示分子中原子的 结合或排列顺序的式子,但不表示空 间构型①多用于研究有机物的性质②能反映有机物的结构,有机反应常用结构式表示 结构简式(示性式) CH3—CH3 (乙烷) 结构式的简便写法,着重突出结构特 点(官能团) 同“结构式”① 球棍模型小球表示原子,短棍表示价键用于表示分子的空间结构 (立体形状) 比例模型用不同体积的小球表示不同原子的 大小用于表示分子中各原子的相对大小和结合顺序
有机化合物知识点总结
有机化合物重要知识点总结 一.有机物的密度 小于水的密度,且与水(溶液)分层的有:各类烃、酯(包括油脂) 二、重要的反应 1.能使溴水(Br2/H2O)或(Br2/CCl4)褪色的物质 通过加成反应使之褪色:含有、—C≡C—的不饱和化合物 通过氧化反应使之褪色:含有—CHO(醛基)的有机物 2.能使酸性高锰酸钾溶液(KMnO4/H+)褪色的物质 含有、—C≡C—、—CHO的物质 与苯环相连的侧链碳上有氢原子的苯的同系物(与苯不反应) 3.与Na反应的有机物:含有—OH、—COOH的有机物(—OH --- 1/2H2—COOH----1/2H2)与NaOH反应的有机物:常温下,易与含有酚羟基 ...、—COOH的有机物反应;加热时,能与酯反应(取代反 应)、卤代烃的水解反应、有醇存在时卤代烃的消去反应与Na2CO3反应的有机物:含有酚.羟基的有机物反应生成酚钠和NaHCO3; 含有—COOH的有机物反应生成羧酸钠,并放出CO2气体; 与NaHCO3反应的有机物:含有—COOH的有机物反应生成羧酸钠并放出等物质的量的CO2气体。 4.银镜反应的有机物 (1)发生银镜反应的有机物: 含有—CHO的物质:醛、甲酸、甲酸盐、甲酸酯、还原性糖(葡萄糖、麦芽糖等) 银镜反应的一般通式:RCHO + 2Ag(NH3)2OH 2 Ag↓+ RCOONH4 + 3NH3 + H2O 【记忆诀窍】:1—水(盐)、2—银、3—氨 (2)定量关系:—CHO~2Ag(NH)2OH~2 Ag HCHO~4Ag(NH)2OH~4 Ag 5.与新制Cu(OH)2悬浊液的反应 羧酸(中和)、甲酸(先中和,但NaOH仍过量,后氧化)、醛、还原性糖(葡萄糖、麦芽糖) 三、各类烃的代表物的结构、特性 类别烷烃烯烃炔烃苯及同系物 通式C n H2n+2(n≥1) C n H2n(n≥2) C n H2n-2(n≥2) C n H2n-6(n≥6) 代表物结构式H—C≡C—H 相对分子质量 Mr 16 28 26 78 分子形状正四面体6个原子 共平面型 4个原子 同一直线型 12个原子共平面 (正六边形) 主要化学性质光照下的卤代; 裂化;不使酸性 KMnO4溶液褪色 跟X2、H2、HX、H2O、 HCN加成,易被氧 化(使酸性KMnO4 溶液褪色);可加聚 跟X2、H2、HX、 HCN加成;易被 氧化;能加聚得 导电塑料 跟H2加成;FeX3 催化下卤代;硝 化。 四、烃的衍生物的重要类别和各类衍生物的重要化学性质 类 别 通式官能团代表物分子结构结点主要化学性质
人教版九年级英语各单元知识点总结
九年级英语全册各单元知识点总结 Unit 1 How can we become good learners? 一、短语: 1.have conversation with sb. 同某人谈话 2.connect …with… 把…和…连接/联系起来 3.the secret to… ……的秘诀 4.be afraid of doing sth./to do sth. 害怕做某事 5.look up 查阅 6.repeat out loud 大声跟读 7.make mistakes in 在……方面犯错误8.get bored 感到厌烦 9.be stressed out 焦虑不安的10.pay attention to 注意;关注 11.depend on 取决于;依靠12.the ability to do sth. 做某事的能力 二、知识点: 1. by + doing:通过……方式(by是介词,后面要跟动名词,也就是动词的ing形式); 2. a lot:许多,常用于句末; 3. aloud, loud与loudly的用法,三个词都与“大声”或“响亮”有关。 ①aloud是副词,通常放在动词之后。 ①loud可作形容词或副词。用作副词时,常与speak, talk, laugh等动词连用,多用于比较级, 须放在动词之后。 ①loudly是副词,与loud同义,有时两者可替换使用,可位于动词之前或之后。 4. not …at all:一点也不,根本不,not经常可以和助动词结合在一起,at all 则放在句尾; 5. be / get excited about sth.:对…感到兴奋; 6. end up doing sth:终止/结束做某事;end up with sth.:以…结束; 7. first of all:首先(这个短语可用在作文中,使得文章有层次); 8. make mistakes:犯错make a mistake 犯一个错误; 9. laugh at sb.:笑话;取笑(某人)(常见短语) 10. take notes:做笔记/记录; 11. native speaker 说本国语的人; 12. make up:组成、构成; 13. deal with:处理、应付; 14. perhaps = maybe:也许; 15. go by:(时间)过去; 16.each other:彼此; 17.regard… as … :把…看作为…; 18.change… into…:将…变为…; 19. with the help of sb. = with one's help 在某人的帮助下(注意介词of和with,容易出题) 20. compare … to …:把…比作… compare with 拿…和…作比较; 21. instead:代替,用在句末,副词; instead of sth / doing sth:代替,而不是(这个地方考的较多的就是instead of doing sth,也就是说如果of后面跟动词时,要用动名词形式,也就是动词的ing形式) 22.Shall we/ I + do sth.? 我们/我…好吗? 23. too…to:太…而不能,常用的句型是too+形容词/副词+ to do sth.
-有机化合物知识点总结
-有机化合物知识点总结 2、碳酸、碳酸盐、金属碳化物等少数化合物,它们属于无机化合物。 一、烃 1、烃的定义:仅含碳和氢两种元素的有机物称为碳氢化合物,也称为烃。 2、甲烷、乙烯和苯的性质比较:有机物烷烃烯烃苯通式CnH2n+2CnH2n代表物甲烷(CH4)乙烯(C2H4)苯(C6H6)结构简式 CH4CH2=CH2或(官能团)结构特点单键,链状,饱和烃双键,链状,不饱和烃(证明:加成、加聚反应)一种介于单键和双键之间的独特的键(证明:邻二位取代物只有一种),环状空间结构正四面体(证明:其二氯取代物只有一种结构)六原子共平面平面正六边形物理性质无色无味的气体,比空气轻,难溶于水无色稍有气味的气体,比空气略轻,难溶于水无色有特殊气味的液体,密度比水小,难溶于水用途优良燃料,化工原料石化工业原料,植物生长调节剂,催熟剂有机溶剂,化工原料 3、烃类有机物化学性质有机物主要化学性质甲烷 1、甲烷不能使酸性KMnO4溶液、溴水或溴的四氯化碳溶液褪色,与强酸、强碱也不反应,性质比较稳定。 2、氧化反应(燃烧)注:可燃性气体点燃之前一定要验纯CH4+2O2CO2+2H2O(淡蓝色火焰)
3、取代反应(条件:光;气态卤素单质;以下四反应同时进行,产物有5种)CH4+Cl2CH3Cl+HCl CH3Cl +Cl2CH2Cl2+HClCH2Cl2+Cl2CHCl3+HCl CHCl3+Cl2CCl4+HCl注意事项:①甲烷与氯气在光照下发生取代反应,甲烷分子里的四个氢原子逐步被氯原子取代;②反应能生成五种产物,四种有机取代产物都不溶于水,常温下,一氯甲烷是气体,其他是液体,三氯甲烷称氯仿,四氯甲烷可作灭火剂;产物中HCl气体产量最多; ③取代关系:1H~~Cl2;④烷烃取代反应是连锁反应,产物复杂,多种取代物同时存在。 4、高温分解: 乙烯 1、氧化反应 I、燃烧C2H4+3O22CO2+2H2O(火焰明亮,伴有黑烟)II、能被酸性KMnO4溶液氧化为CO2,使酸性KMnO4溶液褪色。 2、加成反应 CH2=CH2+Br2CH2Br-CH2Br(能使溴水或溴的四氯化碳溶液褪色)在一定条件下,乙烯还可以与H 2、Cl 2、HCl、H2O等发生加成反应CH2=CH2+H2CH3CH3 CH2=CH2+HClCH3CH2Cl(氯乙烷:一氯乙烷的简称)CH2=CH2+ H2OCH3CH2OH(工业制乙醇) 3、加聚反应 nCH2=CH2(聚乙烯)注意:①乙烯能使酸性KMnO4溶液、溴水或溴的四氯化碳溶液褪色。常利用该反应鉴别烷
有机化合物纯知识点
教学过程 一、复习预习 本节课咱们主要讲必修2中所学习过的基础有机化学进行习题的复习一遍。 二、知识讲解 考点1重要的物理性质 1.有机物的溶解性 (1)难溶于水的有:各类烃、卤代烃、硝基化合物、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。 (2)易溶于水的有:低级的[一般指N(C)≤4]醇、(醚)、醛、(酮)、羧酸及盐、氨基酸及盐、单糖、二糖。(它们都能与水形成氢键)。 考点2重要的反应 1.能使溴水(Br2/H2O)褪色的物质 (1)有机物①通过加成反应使之褪色:含有、—C≡C—的不饱和化合物 ②通过取代反应使之褪色:酚类注意:苯酚溶液遇浓溴水时,除褪色现象之外还产生白色沉淀。 ③通过氧化反应使之褪色:含有—CHO(醛基)的有机物(有水参加反应)注意: 纯净的只含有—CHO(醛基)的有机物不能使溴的四氯化碳溶液褪色
④ 通过萃取使之褪色:液态烷烃、环烷烃、苯及其同系物、饱和卤代烃、饱和酯 (2)无机物① 通过与碱发生歧化反应 3Br 2 + 6OH - == 5Br - + BrO 3- + 3H 2O 或Br 2 + 2OH - == Br - + BrO - + H 2O ② 与还原性物质发生氧化还原反应,如H 2S 、S 2-、SO 2、SO 32-、I -、Fe 2+ 2.能使酸性高锰酸钾溶液KMnO4/H+褪色的物质 1)有机物:含有 、—C≡C—、—OH (较慢)、—CHO 的物质 苯环相连的侧链碳上 有氢原子的苯的同系物(但苯不反应) 2)无机物:与还原性物质发生氧化还原反应,如H 2S 、S 2-、SO 2、SO 32-、Br -、I -、Fe 2+ 3.与Na 反应的有机物:含有—OH 、—COOH 的有机物 与NaOH 反应的有机物:常温下,易与含有酚羟基... 、—COOH 的有机物反应 加热时,能与卤代烃、酯反应(取代反应) 与Na 2CO 3反应的有机物:含有酚. 羟基的有机物反应生成酚钠和NaHCO 3; 含有—COOH 的有机物反应生成羧酸钠,并放出CO 2气体; 含有—SO 3H 的有机物反应生成磺酸钠并放出CO 2气体。 与NaHCO 3反应的有机物:含有—COOH 、—SO 3H 的有机物反应生成羧酸钠、磺酸钠并放出等物质的量的CO 2气体。 4.既能与强酸,又能与强碱反应的物质 (1)氨基酸,如甘氨酸等 H 2NCH 2COOH + HCl → HOOCCH 2NH 3Cl H 2NCH 2COOH +NaOH →H 2NCH 2COONa + H 2O (2)蛋白质分子中的肽链的链端或支链上仍有呈酸性的—COOH 和呈碱性的—NH 2,故蛋白质仍能与碱和酸反应。 5.银镜反应的有机物 (1)发生银镜反应的有机物:含有—CHO 的物质:醛、甲酸、甲酸盐、甲酸酯、还原性糖(葡萄糖、麦芽糖等) (2)银氨溶液[Ag(NH 3)2OH](多伦试剂)的配制: 向一定量2%的AgNO 3溶液中逐滴加入2%的稀氨水至刚刚产生的沉淀恰好完全溶解消失。 (3)反应条件:碱性、水浴加热....... 酸性条件下,则有Ag(NH 3)2+ + OH - + 3H + == Ag + + 2NH 4+ + H 2O 而被破坏。 (4)实验现象:①反应液由澄清变成灰黑色浑浊;②试管内壁有银白色金属析出 (5)有关反应方程式:AgNO 3 + NH 3·H 2O == AgOH↓ + NH 4NO 3AgOH + 2NH 3·H 2O == Ag(NH 3)2OH + 2H 2O 银镜反应的一般通式: RCHO + 2Ag(NH 3)2OH 2 A g ↓+ RCOONH 4 + 3NH 3 + H 2O 【记忆诀窍】: 1—水(盐)、2—银、3—氨 甲醛(相当于两个醛基):HCHO + 4Ag(NH 3)2OH 4Ag↓+ (NH 4)2CO 3 + 6NH 3 + 2H 2O 乙二醛: OHC-CHO + 4Ag(NH 3)2OH 4Ag↓+ (NH 4)2C 2O 4 + 6NH 3 + 2H 2O 甲酸: HCOOH + 2 Ag(NH 3)2OH 2 A g ↓+ (NH 4)2CO 3 + 2NH 3 + H 2O 葡萄糖:CH 2OH(CHOH)4CHO +2Ag(NH 3)2OH 2A g ↓+CH 2OH(CHOH)4COONH 4+3NH 3 + H 2O
