明矾的制备实验报告

明矾的制备、组分含量测定及其晶体的培养
一. 实验目的
1. 熟练掌握无机物的提取、提纯、制备、分析等方法的操作及方案设计。
2. 学习设计综合利用废旧物的化学方法。
3. 学习从溶液中培养晶体的原理和方法。
4. 自行设计鉴定产品的组成、纯度和产率的方法,并鉴定之。
仪器和试剂
(1)仪器: 100cm3烧杯,布氏漏斗,抽滤瓶,表面皿,玻璃棒,试管,电子天平,容量瓶(250 mL、100mL),移液管,锥形瓶(两个),烘箱。
(2)试剂废铝(易拉罐),NH
3· H
2
O(6mol·dm-3),H
2
SO
4
(9mol·dm-3),
KAl(SO
4)
2
·12H
2
O 晶种, EDTA溶液(0.02599mol·L-1),二甲酚橙(XO,2g·L-1)
水溶液,HCl(6mol·L-1,3mol·L-1),NH
3·H
2
O(1+1),六次甲基四胺溶液
(200g·L-1),Zn2+(0.02581 mol·L-1);NH
4
F溶液:200 g·L-1,贮于塑料瓶中;
KOH溶液:1.5mol/L 取8.416g KOH定容于100ml容量瓶中;
氯化钡溶液:0.25g/mL ,取25.45克氯化钡溶于100mL蒸馏水中;
硫酸根标准贮备溶液:550ug/mL,准确称取1.3522g已烘干的基准硫酸钾定容于100mL容量瓶中。
二. 实验提要
目前使用的铝制品的包装和用具较多,因此废旧饮料罐、盒,铝质导线等废
铝很多,设计简便的方法由铝制的易拉罐制备明矾(KAl(SO
4)
2
·12H
2
O),并培
养明矾的单晶,计算产率和鉴定产品的质量。
1、实验原理
(1)明矾的制备
将铝溶于稀氢氧化钾溶液制得偏铝酸钾:
2Al+2KOH+2H
2O=2KAlO
2
+3H
2
往偏铝酸钾溶液中加入一定量的硫酸,能生成溶解度较小的复盐
KAl(SO
4)
2
·12H
2
O] 反应式为:
KAlO
2+2H
2
SO
4
+10H
2
O=KAl(SO
4
)
2
.12H
2
O
温度 T/K 物质种类
27
3
28
3
29
3
30
3
31
3
33
3
35
3
36
3
KAl(SO
4)
2
·12H
2
O/g
3.
00
3.
99
5.
90
8.
39
11
.7
24
.8
71
.0
10
9
243
.2 .5 .4 .4 .8 .2 .0 .8
K 2SO
4
/g 7.
4
9.
3
11
.1
13
.0
14
.8
18
.2
21
.4
22
.9
单晶的培养
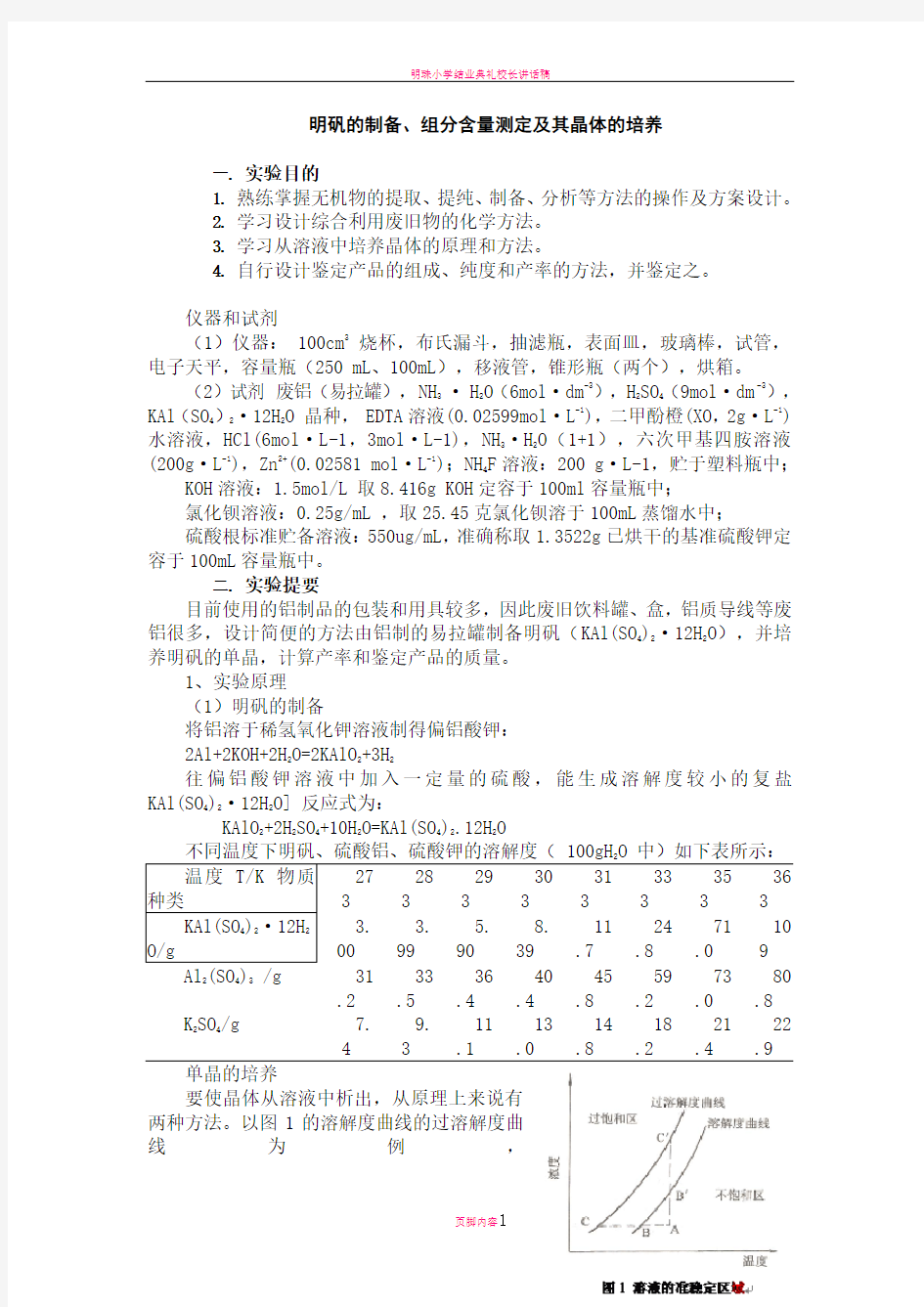
要使晶体从溶液中析出,从原理上来说有两种方法。以图1的溶解度曲线的过溶解度曲线为例,
为溶解度曲线,在曲线的下方为不饱和区域。若从处于不饱和区域的 A 点状态的溶液出发,要使晶体析出,其中一种
方法是采用的过程,即保持浓度一定,降低温度的冷却法;另一种办法是采用
的过程,即保持温度一定,增加浓度的蒸发法。用这样的方法使溶液的状态进入到
线上方区域。一进到这个区域一般就有
晶核产生和成长。但有些物质,在一定条件下,虽处于这个区域,溶液中并不析出晶体,成为过饱和溶液。可是过饱和度是有界限的,一旦达到某种界限时,稍加震动就会有新的,较多的晶体析出(在图中,
表示过饱和的界限,此曲线称为过溶解度曲线)。在和
之间的区域为准稳定区域。要使晶体能
较大地成长起来,就应当使溶液处于准稳定区域,让它慢慢地成长,而不使细小的晶体析出。
根据溶解与结晶原理,在饱和溶液中采用加入人工晶种方法培养硫酸铝钾的单晶。
KAl(SO
4)
2
·12H
2
O 为正八面体晶形。为获得棱角完整、透明的单晶,应让籽
晶(晶种)有足够的时间长大,而晶籽能够成长的前提是溶液的浓度处于适当过
饱和的准稳定区(图 11 的区)。
本实验通过将室温下的饱和溶液在室温下静置,靠溶剂的自然挥发来创造溶液的准稳定状态,人工投放晶种让之逐渐长成单晶。
2、制备:
制备工艺路线大致如下:
步骤及现象:
2.1.1清除废铝表层的污染物,洗净,干燥。
2.1.2称取1.8g 废铝,加入KOH 50ml,加热溶解。有大量的气泡产生,随着产品的溶解,溶液瞬间变成黑色,溶解到无气泡再产生,固体几乎消失时停止。
2.1.3抽滤,取下清液。滤液显微黄色。
2.1.4往清液中滴加硫酸时产生絮状沉淀,继续滴加硫酸时产生白色沉淀,继续滴加硫酸至不再产生沉淀,加热,溶液变澄清。
2.1.5。浓缩结晶。用涤纶线把预先准备的晶种系好,剪去余头,缠在玻棒上悬吊在饱和溶液中,一天后,可得到棱角完整齐全、晶莹透明的大块晶体。
样品总重量/g 54.549
滤纸/g 0.712
净重/g 53.837
三. 产品鉴定
准确称取0.6013g产品,加入3—5ml 1:3HCl,微热,冷却后,定容于100ml容量瓶中。
1、铝离子鉴定:
实验原理
由于Al3+易水解而形成一系列多核氢氧基络合物,且与EDTA反应慢,络合比不恒定,常用返滴定法测定铝含量。
加入定量过量的EDTA标准溶液,加热煮沸几分钟,使络合完全,继在pH为5~6,以二甲酚橙为指示剂,用Zn2+标准溶液滴定过量的EDTA。然后,加入过量的NH
F,加热至沸,使AlY-与F-之间发生置换反应,释放出与Al3+等物质的量的EDTA, 4
再用Zn2+盐标液滴定释放出来的EDTA而得到铝的含量.有关反应如下:
pH = 3.5时, Al3+(试液)+ Y4-(过量)=AlY- , Y4-(剩)
pH = 5~6时,加XO指示剂,用Zn2+盐标液滴定剩余的 Y4-
Zn2++ Y4-(剩) = ZnY2-
终点:Zn2+(过量)+XO= Zn-XO 颜色变化:黄色→紫红色
3-+Y4-(置换)
置换反应: AlY-+6F-=AlF
6
滴定反应: Y4-(置换)+ Zn2+= ZnY2-
终点:Zn2+(过量)+XO=Zn-XO 颜色变化:黄色→紫红色步骤与现象:
吸取所配试液25.00ml于250ml锥形瓶中,加入10ml 0.02mol/L EDTA溶液,二甲酚橙指示剂1滴,用1:1氨水调至溶液恰成紫红色,然后滴加1:3HCl 3滴,将溶液煮沸3min左右,冷却,加入20%六次甲基四胺溶液20ml,此时溶液应成黄色,如不成黄色,可用HCl调节,再补加二甲酚橙指示剂1滴,用锌标准溶
F溶液10ml,液滴定至溶液从黄色变为红紫色(此时,不计体积)。加入20%NH
4
将溶液加热至微沸,流水冷却,再补加二甲酚橙指示剂1滴,此时溶液应呈黄色,若溶液呈红色,应滴加1:3HCl使溶液呈黄色,再用锌标准溶液滴定至溶液由黄色变为紫红色时,即为终点。根据消耗的锌盐溶液的体积,计算Al3+的百分含量。
实验数据:
2、硫酸根鉴定:
2.2.1 标准曲线的绘制:
精确吸取硫酸根标准溶液1、2、3、4、5mL 于5 个25mL 比色管中。同时加入0.25g/mL 氯化钡溶液直至没沉淀产生, 用蒸馏水稀释至刻度,匀速搅拌1分钟,将浑浊液倒入1 厘米比色皿中,静置4 分钟,在420nm 处,以蒸馏水作空白,分别测其吸光度。以吸取硫酸根标准溶液ml数为横坐标,以吸光度为纵坐标绘制标准曲线。
2.2.2 样品的测定:吸取上述待用溶液1.00mL 于25mL 容量瓶中,同时加入0.25g/mL 氯化钡溶液直至没沉淀产生, 用蒸馏水稀释至刻度,匀速搅拌1分钟。将浑浊液倒入1 厘米比色皿中,静置4 分钟,在波长420nm处,以蒸馏水作空白,测其吸光度。
2-
