保健食品注册检验申请表式样
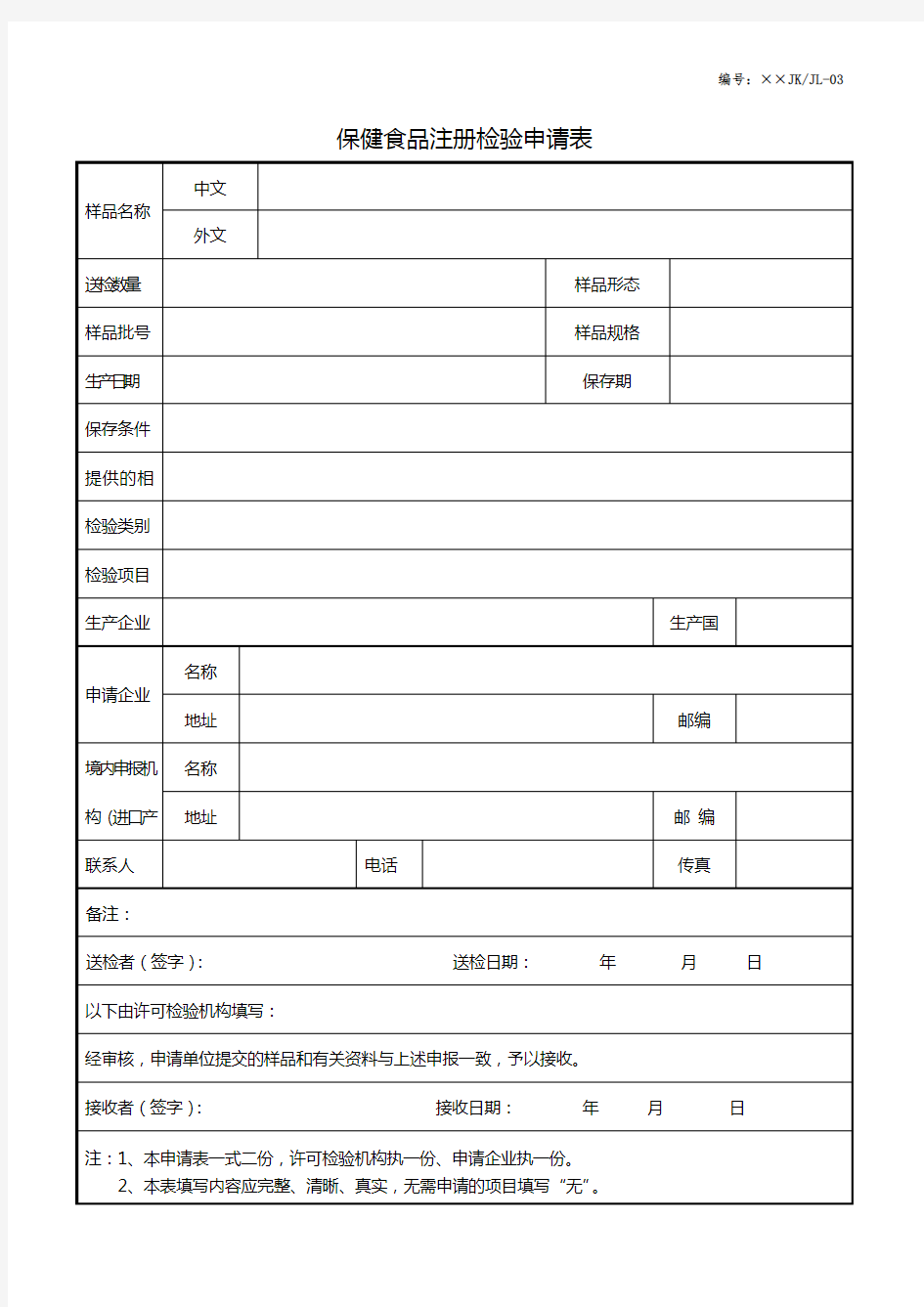
编号:××JK/JL-03 保健食品注册检验申请表
保健食品经营许可标准
长春市保健食品经营许可实施标准 第一章总则 第一条经营保健食品应取得《食品流通许可证》,按照批准的名称、经营场所、负责人、主体类型、许可范围等许可事项从事保健食品经营活动。 第二条申请《食品流通许可证》时,应明确经营场所的具体地址。 第三条申请《食品流通许可证》时,应明确经营方式和拟经营保健食品的名称、批准文号、生产许可证号、生产企业名称。审批部门应核对产品信息,用以审核确定许可范围。企业变更经营范围应向发证机关提出申请。 第四条从事保健食品经营和质量管理工作的人员,应符合有关法律法规规定,不得有相关法律法规禁止从业的情形。 第五条保健食品经营企业[专卖店(含批发)兼营店(大型商场、连锁超市、药店)]变更许可事项应向具有审批权限的食品药品监督管理部门提出申请。 第六条《食品流通许可证》有效期为3年,持证人应在有效期届满前30日内,向原发证机关申请延续。
第二章人员 第七条保健食品经营企业从事质量管理、保管、销售(营业员)等直接接触保健食品岗位的工作人员,应每年进行一次健康检查,患有精神病、传染病和其它可能污染保健食品疾病的人员,不得从事直接接触保健食品工作。企业应建立员工健康档案。 第八条企业应设立质量管理机构和专(兼)职质量管理人员,达到一定规模的企业应任命安全总监。安全总监应具有大专以上(含大专)学历(应优先考虑食品或医学、药学、生物、护理、化学等相关专业),或具有中级以上(含中级)相关专业技术职称,并具有2年以上保健食品经营企业工作经验。安全总监应经监管部门考试合格。 第九条安全总监应履行下列职责: (一)质量文件的批准; (二)供货商、购进保健食品的资质审核和购进保健食品的质量查验; (三)指导采购、销售、保管、养护等岗位质量工作; (四)销售保健食品的质量控制和召回。 第十条企业应对从业人员进行相关法律、法规、卫生
产 品 检 验 报 告
编号: 审核:批准:日期 QR0905-10
编号: 审核:批准:日期 QR0905-10
编号: 审核:批准:日期 QR0905-10
编号: 审核:批准:日期QR0905-10文案编辑词条 B 添加义项?
文案,原指放书的桌子,后来指在桌子上写字的人。现在指的是公司或企业中从事文字工作的职位,就是以文字来表现已经制定的创意策略。文案它不同于设计师用画面或其他手段的表现手法,它是一个与广告创意先后相继的表现的过程、发展的过程、深化的过程,多存在于广告公司,企业宣传,新闻策划等。 基本信息 中文名称 文案 外文名称 Copy 目录 1发展历程 2主要工作 3分类构成 4基本要求 5工作范围 6文案写法 7实际应用 折叠编辑本段发展历程 汉字"文案"(wén àn)是指古代官衙中掌管档案、负责起草文书的幕友,亦指官署中的公文、书信等;在现代,文案的称呼主要用在商业领域,其意义与中国古代所说的文案是有区别的。 在中国古代,文案亦作" 文按"。公文案卷。《北堂书钞》卷六八引《汉杂事》:"先是公府掾多不视事,但以文案为务。"《晋书·桓温传》:"机务不可停废,常行文按宜为限日。" 唐戴叔伦《答崔载华》诗:"文案日成堆,愁眉拽不开。"《资治通鉴·晋孝武帝太元十四年》:"诸曹皆得良吏以掌文按。"《花月痕》第五一回:" 荷生觉得自己是替他掌文案。" 旧时衙门里草拟文牍、掌管档案的幕僚,其地位比一般属吏高。《老残游记》第四回:"像你老这样抚台央出文案老爷来请进去谈谈,这面子有多大!"夏衍《秋瑾传》序幕:"将这阮财富带回衙门去,要文案给他补一份状子。" 文案音译 文案英文:copywriter、copy、copywriting 文案拼音:wén àn 现代文案的概念: 文案来源于广告行业,是"广告文案"的简称,由copy writer翻译而来。多指以语辞进行广告信息内容表现的形式,有广义和狭义之分,广义的广告文案包括标题、正文、口号的撰写和对广告形象的选择搭配;狭义的广告文案包括标题、正文、口号的撰写。
保健食品注册申请指南
保健食品注册申请指南 一、保健食品审批工作程序 国产保健食品,由省、自治区、直辖市(食品)药品监督管理部门负责对国产保健食品注册申请资料的受理和形式审查,对申请注册的保健食品试验和样品试制的现场进行核查,组织对样品进行检验。进口保健食品,由申请人将申报资料和样品报送国家食品药品监督管理局。 二、申报资料的一般要求 (一)申报资料首页为申报资料项目目录,目录中申报资料项目按《保健食品注册申请表》中“所附资料”顺序排列。每项资料加封页,封页上注明产品名称、申请人名称,右上角注明该项资料名称。各项资料之间应当使用明显的区分标志,并标明各项资料名称或该项资料所在目录中的序号。整套资料用打孔夹装订成册。 (二)申报资料使用A4规格纸张打印(中文不得小于宋体小4号字,英文不得小于12号字),内容应完整、清楚,不得涂改。 (三)除《保健食品注册申请表》及检验机构出具的检验报告外,申报资料应逐页加盖申请人印章或骑缝章(多个申请人联合申报的,应加盖所有申请人印章),印章应加盖在文字处。加盖的印章应符合国家有关用章规定,并具法律效力。 (四)多个申请人联合申报的,应提交联合申报负责人推荐书。 (五)申报资料中同一内容(如产品名称、申请人名称、申请人地址等)的填写应前后一致。 (六)产品名称应包括品牌名、通用名和属性名。产品名称应符合以下要求: 1.符合国家有关法律、法规、规章、标准、规范的规定。 2.反映产品的真实性,简明易懂,符合中文语言习惯。 3.品牌名可以采用产品的注册商标或其他名称。 4.通用名应当准确、科学,不得使用明示或者暗示治疗作用以及夸大功能作用的文字。 5.属性名应当表明产品的客观形态,其表述应规范、准确。 6.增补剂型的产品,在命名时应采用同一品牌名和通用名,但需标明不同的属性名。 7.进口产品中文名称应与外文名称对应。可采用意译、音译或意、音合译,一般以意译为主。8.保健食品命名时不得使用下列内容: (1)消费者不易理解的专业术语及地方方言; (2)虚假、夸大和绝对化的词语,如“高效”、“第×代”; (3)庸俗或带有封建迷信色彩的词语; (4)外文字母、符号、汉语拼音等(注册商标除外);
鞋业行业标准之鞋类产品出厂前的最终检验标准(完整版)
鞋业行业标准之鞋类产品出厂前的最终检验标准 (1)实施原则 以全数及抽验的方式检查产品自成型结束后至装盒、配号、装箱、打包、进库、待运出厂的全部作业过程,保证产品品质正确。 检验分两个方面:一为品管检验,此为生产完成前对产品做100%全数检验;一为产品包装结束、进库待运出厂时,QC依公司所定的抽样比例抽样开箱检验,目的是防止厂方将不合格产品混装入箱出货。 (2)检验准备 A.QC应根据出货计划和工厂实际生产进度,安排最终检验时间。检验一般应安排在出运日的前两天。除特殊情况,QC应在生产和包装全部完成后进行检验;如情况特殊,也必须在生产和包装完成百份之八十后进行检验。 B.QC应要求工厂将待检产品按款式、颜色、配码、包装分类别整齐堆放。 C.检验前,QC应仔细查阅待检产品的有关物性测试记录,只有在确认所有测试项目都已完成并已达到规定要求后才能进行最终检验(参照物性测试标准) D.检验前,QC应带齐最终确认样、合同、包装资料及与产品检验相关的所有资料。 (3)检验方式 A.QC必须亲自到现场抽点箱号,严禁工厂人员替代抽点箱号。 B.检验以随机抽样方式进行,具体方法按AQL标准。抽检箱号必须至少间隔5箱,避免箱号连续,以保证被检产品的代表性。 (4)产品外观检验 外观检验原则以手感、目视方式进行,目测有疑义时以量具检验。 A.整体外观:手感与目测检查成鞋是否端正、对称、平附、色泽一致、清洁,标志齐全清晰及鞋帮、鞋里、鞋底、鞋眼等各部位有无缺陷,需要确认尺寸的点状缺陷时钢尺测量,确认线状的缺陷应以鞋用带尺测量。 B.前帮长度:以鞋用带尺贴紧前帮面,测量前帮子口端点至前帮面沿口边沿中点或特定部位(如前帮与鞋舌接缝处等),同方法可测外包头长度。 C.后帮高度:以鞋用带尺紧贴鞋后帮面,测量后帮子中点至后帮面沿口边沿中点的高度。D.特征部位:以鞋用带尺贴紧鞋,从某参照点量至某一考察点,检验同双两只鞋的差异。E.后缝歪斜:将鞋放置在水平物上,用宽座角尺垂直边对准后帮子口点,以钢尺测量帮后缝至角尺垂直边的最大距离。 F:缝线:目测缝线针码是否均匀,缝线是否整齐,是否有跳线、断线、翻线、开线、并线重针及缝线越轨等。针码密度用游标卡尺测量。 G.外包(后)跟、主跟(内后跟):目测外包(后)跟是否端正、平服,同双两只鞋的外包(后)跟两侧压,察看其变形及复原情况。 H.包头:目测外包头是否端正、平服,同双两只鞋的外包头是否对称,以拇指按压包头,察看其变形情况。 I.外底长度:以鞋用带尺(拉紧)测量外底面前端点至外底面(跟面)后端点之间的长度。J.外底宽度:将外底内侧底墙接触水平物体并垂直侧立,以钢尺垂直测量其外侧底墙距平板的最大距离即为外底宽度。 K.外底厚度:一般以钢尺测量底墙相关部位厚度,必要时沿外底轴线将鞋底切开,以钢直尺在切开处测量外底相关部位厚度,底墙异型或圆弧状等,用鞋用钢尺无法测量时可用游标卡尺测量。 L.内底长度:剪掉鞋带,以鞋用带尺贴紧内底,测量内底前后两点之间的距离,或抽取被检产品同品种同型号内底进行测量。
保健食品四大检测试验
保健食品四大检测试验 一、保健食品卫生学检测 1、卫生学试验检验项目的确定: 根据产品的详细配方和原料组成、主要工艺、剂型及其他相关资料,依据保健食品和各类食品相关国家、行业标准,确定卫生学检验项目。 2、卫生学试验常用检验方法 ?《食品卫生理化检验方法》 GB/T5009.1- 203-2003 GB/T5009.23;190;191-2006 ?《食品卫生微生物检验方法》 GB/T4789.1-31;33-35-2003 ?每个指标都要列出具体的检验方法,如一个指标的标准检验方法有多个,要列出具体用的是哪一个方法。 3、确定卫生学试验检验项目的主要依据之一是GB16740《保健(功能)食品通用标准》: ?感官指标 ?净含量 ?铅、总砷、总汞 ?微生物 (1)单件定量包装产品净含量允许负偏差
(2)铅、总砷、总汞 检测方法: 铅GB/T5009.12-2003 第一法:石墨炉原子吸收光谱法 第二法:氢化物原子荧光光谱法
第三法:火焰原子吸收光谱法总砷GB/T5009.11-2003 第一法:氢化物原子荧光光度法 第二法:银盐法 第三法:砷斑法 总汞GB/T5009.17-2003 第一法:原子荧光光谱法 第二法:冷原子吸收光谱法(3)微生物指标 检测方法: ?菌落总数:GB/T4789.2-2003 ?大肠菌群:GB/T4789.3-2003
?霉菌:GB/T4789.15-2003 ?酵母:GB/T4789.15-2003 ?致病菌(指肠道致病菌和致病性球菌) 沙门氏菌:GB/T4789.4-2003 志贺氏菌:GB/T4789.5-2003 金黄色葡萄球菌:GB/T4789.10-2003 溶血性链球菌:GB/T4789.11-2003 从安全性角度出发,测定胶囊类样品的铅、总砷、总汞、微生物指标时须包括胶囊皮。 (4)其他经常检测的卫生学指标
保健食品试验注册检验规范
保健食品注册检验复核检验管理办法 第一章总则 第一条为规范保健食品注册检验、产品质量复核检验工作,保证其公开、公平、公正、科学,制定本办法。 第二条本办法适用于保健食品注册检验、产品质量复核检验工作的监督管理。 第三条本办法所称保健食品注册检验(以下称注册检验)是指申请人向食品药品监督管理部门提出保健食品注册申请前,按照有关规定,在保健食品注册检验机构(以下称注册检验机构)所进行的产品安全性毒理学试验、功能学试验、功效成分或标志性成分检测、卫生学试验、稳定性试验等。 保健食品产品质量复核检验(以下称复核检验)是指食品药品监督管理部门受理保健食品注册申请后,注册检验机构按照申请人申报的产品质量标准对食品药品监督管理部门提供的样品所进行的全项目检验。 第四条国家食品药品监督管理局负责注册检验、复核检验工作的监督管理。 第五条注册检验机构应当依法经国家食品药品监督管理局遴选确定,并根据国家有关法律法规和标准规范的要求以及本办法的规定,开展注册检验、复核检验工作,提供准确可靠的保健食品注册检验、产品质量复核检验报告(以下均称检验报告)。 注册检验机构和检验人对出具的检验报告负责,并承担相应的法律责任。 第六条注册检验机构及其检验人从事注册检验、复核检验工作,应当尊重科学、恪守职业道德,并保证出具的检验报告客观、公正和准
确,不得出具虚假的检验报告。 第七条同一产品的复核检验不得由承担该产品注册检验工作的注册检验机构进行。 第八条省、自治区、直辖市食品药品监督管理部门(以下称省级食品药品监督管理部门)进行抽样时,应当保证抽样的代表性,抽样过程不得影响所抽样品的质量。 第二章申请与受理 第九条申请注册检验的单位(以下称申请单位)申请国产保健食品注册检验的,应当向产品试制所在地的省级食品药品监督管理部门提出抽样申请,填写抽样申请表。 省级食品药品监督管理部门在收到抽样申请表后,应当按照国家食品药品监督管理局有关规定及时派员到产品试制现场进行抽样并封样,同时填写抽样单。 申请单位应当将封样和抽样单一并提交注册检验机构。 第十条申请单位应当按照本办法及《保健食品注册检验复核检验规范》(以下称《检验规范》)的有关要求,向注册检验机构提交保健食品注册检验申请表及有关资料,国产保健食品提供封样样品、进口保健食品提供未启封的市售样品,并按有关规定缴纳注册检验费用。 注册检验机构应当按照《检验规范》的要求,对检验样品及有关资料进行审核,符合要求的,出具保健食品注册检验受理通知书(以下称注册检验受理通知书),进行注册检验受理编号,并与申请单位签订协议书。 第十一条食品药品监督管理部门受理保健食品注册申请后,应当按照有关规定向注册检验机构发出保健食品产品质量复核检验通知书(以下称复核检验通知书),并提供产品质量标准和连续三个批号规定
产品型式检验报告
产品型式检验报告内部编号:(YUUT-TBBY-MMUT-URRUY-UOOY-DBUYI-0128)
型式检验报告 报告是型式检验机构出具的型式检验结果判定文件。型式检验主要适用于对产品综合定型鉴定和评定企业所有产品质量是否全面地达到标准和设计要求的判定。目录 1 2 3 4 5 基本介绍 报告是机构出具的结果判定文件。 型式检验是为了证明产品质量符合产品标准的全部要求而对产品进行的,它是构成许多种类型认证的基础,是对一个或多个具有生产代表性的产品样品利用检验手段进行合格评价。这时检验所需样品数量由部门或确定和现场抽样封样;取样地点从制造单位的最终产品中随机抽取。检验地点应在经认可的独立的检验机构进行。 工作内容 1. 约请型式检验机构: 申请产品制造许可的单位,在获得受理通知后,应按相关管理办法向有型式检验资格的机构提出申请制造许可的产品型式检验意向,同时提交制造许可受理通知书(复印件)。型式检验机构根据受理通知书中申请制造许可的产品类别、品种进行型式检验。 2. 型式检验机构在接到申请单位的约请后,按双方应约定的时间,派出2~4名检验检测人员组成型式检验组,由一名具有评审资格的评审员担任组长,到制造单位进行产品抽样、并完成相关检查等工作。 3. 具体工作内容: 产品抽样:由型式检验组根据标准规定的产品抽样规则进行抽样。产品抽样应在制造单位库房中随机抽取经制造单位质检部门检验合格的库存产品。
设计资料审查:型式检验组对抽样产品的图纸、计算书等设计资料进行审查。 型式检验:制造单位现场具备型式检验条件的,产品抽样后在制造单位现场进行试验。制造单位现场不具备型式检验条件的,产品抽样后,由制造单位负责将封好的产品发运到型式检验机构所在地; 出具型式检验报告:型式检验机构在完成产品型式检验后规定日期内出具型式检验报告(三年有效期),报告一式数分制造单位、评审机构、受理机构并存档。 工作原则 人员应遵循的原则: —认真执行型式检验工作有关法律、法规、规章、标准的规定。 —积极宣传、贯彻、执行国家相关标准、规定、程序及型式检验机构的规定和程序,对所有委托者,保证型式检验工作的客观性和公正性。 —遵纪守法、团结协作、、。 —实事求是、作风正派、坚持原则、、勤奋工作,严格按型式检验范围从事型式检验工作,做到准确、公正。 —严格遵守保密规定。 —热情为客户服务,认真对待来信、来访,正确对待批评和投诉。 —不得以任何借口接受委托进行产品型式检验的组织或其工作人员及任何有利益关系的组织或个人的、礼品及以其他任何方式谋取私利。 —服从领导、钻研业务、不断提高工作质量和技能,维护型式检验机构的声誉和型式检验工作的权威性。 —接受安全监察行政部门的监督与管理。 检验情形 1. 新产品和老产品生产的试制定型鉴定。 2. 正式生产后,由于结构、材料、工艺有较大改变,可能影响产品性能时。 3. 正常生产时,定期或积累一定产量后,应周期性进行一次检验。
保健食品经营的自查报告
XXX药店 年度保健食品经营情况自查报告根据西安市药品监督管理局建立《保健食品经营单位食品安全信用档案目录》精神,结合药店的实际经营情况,本着实事求是、不断完善提高、逐步规范的原则,现将本药店保健食品经营自查的情况作如下报告。 自接到去药监部门的通知后,我们立即向员工传达了通知精神,同时采取集中学习和员工自学的方式,认真学习了《食品安全法》等文件。通过学习,进一步提高了员工对保健食品专项整治工作重要性的认识,达到进一步规范保健食品经营行为,提高消费者的自我保护意识和能力,保障公众使用保健食品安全有效的目的。具体自查情况如下: (1)保健食品管理制度及其落实情况:建立健全了索证索票制度、卫生管理制度、进货检查验收制度、储存制度、出库制度、不合格产品处理制度、培训等制度,并能按照制度要求落实工作。 (2)标识标签:经营的保健食品标识标签符合《保健食品标签标识管理规定》要求。 (3)产品保质期:未发现经销过期保健食品。 (4)供货商及产品资质:能索取供货商及产品资质。包括供货商许可证件、营业执照,保健食品批准证书(注册批件),产品检验合格报告(从生产企业购进必须索取) (5)进货查验记录:进货查验记录及票据完整。记录和票据真实齐
全,并按规定妥善保管。 (6)产品台帐:能清楚的显示进销存记录。记录包括所经销保健食品产品名称、进货时间、数量、供货商等内容。 (7)从业人员体检情况:从业人员均有健康体检证明。 (8)场地卫生安全及产品码放:经营场所干净卫生、安全,符合经营保健品要求;产品陈列有相对独立的专用销售区域或专用货柜。(9)店内宣传:店内无夸大保健食品功效的宣传资料,不存在宣称预防、治疗疾病功能等违法违规行为。 (10)签订了保健食品经营单位质量安全承诺书。 在保健食品经营的实践中,我们经常遇到新问题,为了保障公众使用保健食品安全有效的目的,我们在今后的工作中一定加强法律法规及业务知识的学习,加强质量环节的管理,同时欢迎药监部门的莅临指导,以期最大限度地减少主观无过错现象地发生。 年月日
产品出厂检验报告.doc
产品出厂检验报告 审核: 日期: 珠海汉胜科技股份有限公司XX大学生实习报告总结3000字
社会实践只是一种磨练的过程。对于结果,我们应该有这样的胸襟:不以成败论英雄,不一定非要用成功来作为自己的目标和要求。人生需要设计,但是这种设计不是凭空出来的,是需要成本的,失败就是一种成本,有了成本的投入,就预示着的人生的收获即将开始。 小草用绿色证明自己,鸟儿用歌声证明自己,我们要用行动证明自己。打一份工,为以后的成功奠基吧! 在现今社会,招聘会上的大字板都总写着“有经验者优先”,可是还在校园里面的我们这班学子社会经验又会拥有多少呢?为了拓展自身的知识面,扩大与社会的接触面,增加个人在社会竞争中的经验,锻炼和提高自己的能力,以便在以后毕业后能真正的走向社会,并且能够在生活和工作中很好地处理各方面的问题记得老师曾说过学校是一个小社会,但我总觉得校园里总少不了那份纯真,那份真诚,尽管是大学高校,学生还终归保持着学生身份。而走进企业,接触各种各样的客户、同事、上司等等,关系复杂,但你得去面对你从没面对过的一切。记得在我校举行的招聘会上所反映出来的其中一个问题是,学生的实际操作能力与在校的理论学习有一定的差距。在这次实践中,这一点我感受很深。在学校,理论学习的很多,而且是多方面的,几乎是面面俱到的,而实际工作中,可能会遇到书本上没学到的,又可能是书本上的知识一点都用不上的情况。或许工作中运用到的只是简单的问题,只要套公式就能完成一项任务,有时候你会埋怨,实际操作这么简单,但为什么书本上的知识让人学的那么吃力呢?
两耳不闻窗外事,一心只读圣贤书“只是古代读书人的美好意愿,它已经不符合现代大学生的追求,如今的大学生身在校园,心儿却更加开阔,他们希望自己尽可能早地接触社会,更早地融入丰富多彩的生活。时下,打工的大学生一族正逐渐壮大成了一个部落,成为校园里一道亮丽的风景。显然,大学生打工已成为一种势不可挡的社会潮流,大学生的价值取向在这股潮流中正悄悄发生着改变。 对于大学生打工,一直是”仁者见仁,智者见智“,许多人的看法不尽相同。每个人都有自己的人生模式,我们有理由走自己选择的人生路,只要把握住自己,掌握好学习与打工的分寸,肯定能把大学这个人生阶段过得丰富多彩。 打工的途径或者形式多种多样,只要是对社会有益,对自己积累人生经历有益,还能够有少量收入,就可以毫不犹豫的参与其中。 虽然在实践中我只是负责比较简单的部分,但能把自己在学校学到的知识真正运用出来也使我颇感兴奋!在学校上课时都是老师在教授,学生听讲,理论占主体,而我对知识也能掌握,本以为到了企业能够应付得来,但是在企业里并没有想象的那么容易,平时在学校数字错了改一改就可以交上去,但在工厂里,数字绝对不可以错,因为质量是企业第一生命,质量不行,企业生产就会跟不上,而效率也会随之下降,企业就会在竞争的浪潮中失败。 因此,每一个环节都不能出错。这种要求是我们在课堂上学不到的。在学校里可能只需会解一道题,算出一个程式就可以了,但这里更需要的是与实际相结合,没有实际,只是纸上谈兵是不可能在社会立足的,所以一定要特别小心谨慎,而且一旦出错并不是像
保健食品自查报告
保健食品自查报告 保健食品药店的自查报告应该要如何写呢?以下是ww w .zicha b a o g a o.c o m小编收集的自查报告,仅供大家阅读参考! 保健食品自查报告一 一、企业概况
本企业位于XX县XX镇X市场首层1、2两卡,营业面积85平方米,本店在硬件方面:包括其布局、柜台、养护等设施设备,都能够达到XX市保健食品零售企业的有关要求。 二、企业的自查情况如下: 1、人员管理 本店设有食品质量管理员一名,具有药学初级资格,熟悉保健食品有关的法律法规和技术规范。所有从业人员均已通过健康检查,具备健康证。本店所有员工均参加过本店组织的保健食品法律法规培训,有培训记录。 2、质量管理 我店已建立比较齐全的质量管理制度,包括有索证管理制度、卫生管理制度、进货检查验收制度、储存制度、出库制度、不合格产品处理制度、召回制度、培训制度等。我店已索取供货方提供的加盖供货方公章的生产企业卫生许可证、营业执照、批准证书复印件及购进的产品检验报告等资料建档保全。我单位已建立真实完整的保健食品购进记录,内容包括进货时间、产品名称、数量、批号、供货单件等信息。 3、经营及储存条件 本店经营场所面积与经营规模相适应,场所整洁、干净;周围无污染源。配备有专用保健食品陈列橱柜,并有空调、风扇等用于保健食品储存的温控设施。 经自查,我店符合《广东省保健食品零售企业卫生许可现场验收工作指导原则》规定,现申请验收。
保健食品自查报告二 “民以食为天,食以安为先。”近年来,在保健食品生产取得了显著成效、生产安全状况总体较好、行业也取得了长足发展的大背景下,我公司上下员工齐心一致,特根据衢食药监函20175号《关于督促进一步做好保健食品生产企业监管工作的函》,我们公司的管理人员非常重视开展自查,通过狠抓落实保健食品安全、规范生产,我公司已获批的2个保健食品生产进展顺利。一直以来,在上级主管部门的指导下,严格按照《保健食品良好生产规范》组织生产,从原辅料采购生产过程管理及质量检测等方面全面落实质量控制制度和规范措施,确保产品质量安全,同时规范产品标签和说明书,不夸大宣传保健功效。在进行常规生产的过程中,响应上级领导明确“第一责任人”的意识也与日俱增,为公司今后继续生产合格产品做足工作。公司现有获保健食品批文的产品2个(?牌蜂胶软胶囊,批准文号为国食健字G20XX和牌破壁松花粉,批准文号为国食健字G20XX)。现将自查情况汇报如下: 一、根据《食品安全法》《保健食品良好生产规范》等法律法规,制定公司产品质量安全责任书,明确公司各部门负责人是本部的食品质量安全的第一责任人。 二、做好保健食品原辅料采购索证检验工作,做到不合格原辅料不进厂,保证所有的原辅料、添加剂等符合国家有关规定,并做好采购记录台帐。 三、生产环境符合GMP要求,加工工艺流程科学合理,生产加工过程严格规范,对生产关键工序进行严格控制,生产记录完整。 四、做好保健食品出厂检验工作,未经检验或检验不合格产品决不出厂。 五、加强库房卫生管理,保持良好的原辅料、成品库房环境。 六、严格按照GB7718《预包装食品标签通则》和《保健食品标识规定》制作产品标签和说明书。
产品检验控制程序.
科技有限公司产品检验控制程序 编制:审核:批准:日期:2012.04.16 日期:日期: 科技有限公司 产品检验控制程序 1 目的 为验证原材料、半成品、成品的质量特性是否符合规定要求, 确保经检验合格的原材料、半成品、成品投入使用。 2 适用范围 适用于进料、制程及最终成品的检验。 3 职责 3.1仓库 负责原材料、半成品、成品的入库及储存, 并负责对来料送检以及储存时间超过 3个月的半成品、成品出货前进行送检。 3.2 生产部 负责在制品的生产控制、检验,生产的半成品 /成品的送检。 3.3 品质部 负责进料、制程、成品检验,品质稽核及品质检验标准的制订。 3.4 技术部 负责制订原材料、在制品、半成品 /成品接收标准,检验过程中的技术支持和协助。 3.5 采购
负责原材料不良时与供应商的联络与处理。 4 名词术语 4.1 检验:通过观察和判断,适当时结合测量、试验所进行的符合性评价。 4.2 进料检验:对采购的原材料、配套件和委外加工件入厂时的检验。 4.3 制程检验:指为防止不合格品流入下道工序,而对各道工序加工的产品及影响产品质量的主要工序所进行的检验。 4.4 最终检验:是指在生产全部工序结束后,对其生产的半成品或成品的检验。 4.5 全检:质量不完全合乎标准的原材料或器件 , 其缺陷不对最终产品质量产生决定性影响, 经技术部和相关部门评估风险后,或征得客户意见,同意采用全检等方法进行处理。 4.6 原材料:指生产过程所需要的原料,包括主要材料、辅助材料、外购半成品、委外加工 半成品、修理用备件、包装材料等。 4.7 在制品:从一个生产工序转给另一个生产工序继续加工的自制半成品以及不能单独计算成本的自制半成品。 4.8 半成品:指经过一定生产过程并已检验合格,但尚未制造完工成为成品,仍需进一步加工的中间产品。 4.9 成品 :指已完成全部生产过程,按规定标准检验合格,可供销售的产品。 4.10 紧急放行:生产急需来不及验证就发放生产部使用,但生产部必须进行全检。 5 作业程序 5.1 进料点收、送检:
保健食品检测试验(DOC)
保健食品检测试验 一、保健食品卫生学检测 1、卫生学试验检验项目的确定: 根据产品的详细配方和原料组成、主要工艺、剂型及其他相关资料,依据保健食品和各类食品相关国家、行业标准,确定卫生学检验项目。 2、卫生学试验常用检验方法 《食品卫生理化检验方法》 GB/T5009.1- 203-2003 GB/T5009.23;190;191-2006 《食品卫生微生物检验方法》 GB/T4789.1-31;33-35-2003 每个指标都要列出具体的检验方法,如一个指标的标准检验方法有多个,要列出具体用的是哪一个方法。 3、确定卫生学试验检验项目的主要依据之一是 GB16740《保健(功能)食品通用标准》: 感官指标 净含量 铅、总砷、总汞 微生物 (1)单件定量包装产品净含量允许负偏差
(2)铅、总砷、总汞 检测方法: 铅GB/T5009.12-2003 第一法:石墨炉原子吸收光谱法 第二法:氢化物原子荧光光谱法 第三法:火焰原子吸收光谱法总砷GB/T5009.11-2003 第一法:氢化物原子荧光光度法 第二法:银盐法 第三法:砷斑法 总汞GB/T5009.17-2003 第一法:原子荧光光谱法 第二法:冷原子吸收光谱法
(3)微生物指标 检测方法: 菌落总数:GB/T4789.2-2003 大肠菌群:GB/T4789.3-2003 霉菌:GB/T4789.15-2003 酵母:GB/T4789.15-2003 致病菌(指肠道致病菌和致病性球菌) 沙门氏菌:GB/T4789.4-2003 志贺氏菌:GB/T4789.5-2003 金黄色葡萄球菌:GB/T4789.10-2003 溶血性链球菌:GB/T4789.11-2003 从安全性角度出发,测定胶囊类样品的铅、总砷、总汞、微生物指标时须包括胶囊皮。
保健食品申报流程
下面,我就保健食品申报注册的有关流程和需要注意的事项向大家做一介绍,我主要从三个方面介绍 一、保健食品发展现状及乳品行业保健品发展状况 目前,乳品保健品主要有以增强免疫力功能的牛初乳制品如(星驰牌牛初乳胶囊、长富牛牌牛初乳粉、中生牌牛初乳咀嚼片、海王牌牛初乳粉、南保牌牛初乳含片、伊利牛初乳片等)、以调节肠道菌群、通便为功能的酸奶制品、益生菌饮料(健能排益生菌酸奶、光明牌益生菌酸奶、碧悠牌达能酸牛奶、味全R活性乳酸菌饮料),因此乳品保健品市场发展一片光明。 二、申报保健食品的流程及时间 首先介绍以一下 1、什么是保健食品 所谓保健食品是指声称具有特定保健功能或以补充维生素、矿物质为目的的食品,即适宜于特定人群食用,具有调节机体功能,不以治疗疾病为目的,并且对人体不产生急性、亚急性或慢性危害的食品。 保健食品与普通食品的区别
保健食品与药品的区别 2、什么是保健食品注册 是指国家食品药品监督管理局根据申请人的申请,依照法定程序、条件和要求,对申请注册的保健食品的安全性、有效性、质量可控性以及标签说明书内容等进行系统评价和审查,并决定是否准予其注册的审批过程;包括对产品注册申请、变更申请和技术转让产品注册申请的审批。 3、申报保健食品注册的流程 保健食品申请注册过程包括以下过程 样品试制阶段——样品试验阶段——资料准备阶段——省级药局初审——国家药局专家评审——国家药局注册司行政审批。 下面,我将各阶段需要做的事情介绍一下 (1)样品试制阶段包括 ①确定申报产品的保健功能
目前,国家食品药品监督管理局批准申报的保健功能有27个及营养素补充剂,27个保健功能有: 营养素补充剂:只提供维生素及矿物质,不以提供能量为目的。 ②确定配方 根据保健功能确定产品配方(包括原辅料名称、用量、规格,每日食用量、适宜人群),配方中所使用的原辅料应为国家食品药品监督管理局公布的可用于保健食品的、卫生部公布或者批准的可以食用的以及生产普通食品所使用的原辅料。主要依据《卫生部关于进一步
产品最终检验规范
产品最终检验规范 文件编号: QD-T-02-003 文件名称:产品最终检验规范 版本号: A 编制: 审核: 批准: 制定日期: 2017-8-20 实施日期: 2017-8-25
1目的 为了进一步明确产品出厂检验标准和检测方法,提升产品品质控制手段。 2适用范围 适用于腾亚环境所有产品。 3引用标准 GB/T13914-2013 冲压件尺寸公差 GB/T 13915-2013 冲压件角度公差 GB/T 14295-2008 空气过滤器 GB/T 15055-2007 冲压件未注公差尺寸极限偏差 GB/T 18801-2008 空气净化器 GB/T 1804-2008 一般公差未注公差的线性和角度尺寸的公差 GB/T 21087-2007 空气-空气能量回收装置 JG/T 22-1999 一般通风用空气过滤器性能试验方法 GB/T 2408-2008 塑料燃烧性能的测定水平法和垂直法 GB/T 2423.8-1995 电工电子产品环境试验第2部分:试验方法试验Ed:自由落体 GB/T 2518-2008 连续热镀锌钢板及钢带 GB/T 2828.1-2012 计数抽样检验程序 JG/T 294-2010 空气净化器污染物净化性能测定 GB 3096-2008 声环境质量标准 GB/T 4706.1-2005 家用和类似用途电器的安全第一部分通用要求 GB/T 4706.45-2005 家用和类似用途电器的安全空气净化器的特殊要求 4矛盾处理 4.1本制度与上级制度有矛盾时,以上级制度为准。 4.2与原出厂检验规范冲突部分按本制度执行。 4.3未提及部分按原检验规范执行。 5质量符合性检验 5.1产品质量检查内容 5.1.1产品外观检验 a)外观要求 ?机组外表面无明显划伤、桔纹、流痕等缺陷 ?机组一级表面单面颗粒Ф≤0.4mm,数量≤2个;颗粒Ф≤0.2mm,数量≤4个,点距应大于50mm ?机组一级表面单面细划伤0.2×10mm,数量≤2个;0.2×5mm,,数量≤4个,线
保健食品检测试验
保健食品检测试验
保健食品检测试验 一、保健食品卫生学检测 1、卫生学试验检验项目的确定: 根据产品的详细配方和原料组成、主要工艺、剂型及其他相关资料,依据保健食品和各类食品相关国家、行业标准,确定卫生学检验项目。 2、卫生学试验常用检验方法 《食品卫生理化检验方法》 GB/T5009.1- 203-2003 GB/T5009.23;190;191-2006 《食品卫生微生物检验方法》 GB/T4789.1-31;33-35-2003 每个指标都要列出具体的检验方法,如一个指标的标准检验方法有多个,要列出具体用的是哪一个方法。 3、确定卫生学试验检验项目的主要依据之一是 GB16740《保健(功能)食品通用标准》: 感官指标 净含量 铅、总砷、总汞 微生物 (1)单件定量包装产品净含量允许负偏差 净含量 Q 负偏差 Q的百分比g或mL 5g~50g 5mL~50mL 9 —50g~100g 50mL~100mL — 4.5 100g~200g 100mL~ 200mL 4.5 —200g~300g —9
200mL~ 300mL 300g~500g 300mL~ 500mL 3 — 500g~1kg 500mL~1L —15 1kg~10kg 1L~10L 1.5 —(2)铅、总砷、总汞 项目 限量 一般产 品 个别产品 铅≤ (以Pb 计,mg/kg )0.5 一般胶囊产品1.5;以藻 类和茶类*为原料的固 体饮料和胶囊产品2.0 总砷≤ (以As 计,mg/kg )0.3 以藻类和茶类*为原料 的固体饮料和所有胶囊 产品1.0 总汞≤(以Hg — 以藻类和茶类*为原料 的固体饮料和所有胶囊
型式检验报告
型式检验 为了认证目的进行的型式检验,是对一个或多个具有生产代表性的产品样品利用检验手段进行合格评价。这时检验所需样品数量由质量技术监督部门或检验机构确定和现场抽样封样;取样地点从制造单位的最终产品中随机抽取。检验地点应在经认可的独立的检验机构进行。型式检验主要适用于对产品综合定型鉴定和评定企业所有产品质量是否全面地达到标准和设计要求的判定。 型式检验简介 型式检验(type inspection) 依据产品标准,由质量技术监督部门或检验机构对产品各项指标进行的抽样全面检验。检验项目为技术要求中规定的所有项目。 型式检验检验前提 往往在有下列情况之一时进行型式检验: 1、新产品或者产品转厂生产的试制定型鉴定; 2、正式生产后,如结构、材料、工艺有较大改变,可能影响产品性能时; 3、长期停产后恢复生产时; 4、正常生产,按周期进行型式检验; 5、出厂检验结果与上次型式检验有较大差异时; 6、国家质量监督机构提出进行型式检验要求时。 7、用户提出进行型式检验的要求时。 为了批准产品的设计并查明产品是否能够满足技术规范全部要求所进行的型式检验,是新产品鉴定中必不可少的一个组成部分。只有型式检验通过以后,该产品才能正式投入生产。 对于批量生产的定型产品,为检查其质量稳定性,往往要质量技术监督部门或检验机构进行定期抽样检验 (在某些行业该抽样检验又叫做确认检验)。 型式检验的依据是产品标准,为了认证目的所进行的型式检验必须依据产品国家标准。 型式检验流程 1. 约请型式检验机构:
申请产品制造许可的单位,在获得受理通知后,应按相关管理办法向有型式检验资格的机构提出申请制造许可的产品型式检验意向委托书,同时提交制造许可受理通知书(复印件)。型式检验机构根据受理通知书中申请制造许可的产品类别、品种进行型式检验。 2. 型式检验机构在接到申请单位的约请后,按双方应约定的时间,派出2~4名检验检测人员组成型式检验组,由一名具有评审资格的评审员担任组长,到制造单位进行产品抽样、并完成相关检查等工作。 3. 具体工作内容: 3.1 产品抽样:由型式检验组根据标准规定的产品抽样规则进行抽样。产品抽样应在制造单位库房中或在生产线末端经生产企业检验合格并包装好的产品中随机抽取经制造单位质检部门检验合格的库存产品。 3.2 设计资料审查:型式检验组对抽样产品的图纸、计算书等设计资料进行审查。 3.3 型式检验:制造单位现场具备型式检验条件的,产品抽样后在制造单位现场进行试验。制造单位现场不具备型式检验条件的,产品抽样后,由制造单位负责将封好的产品发运到型式检验机构所在地; 3.4 出具型式检验报告:型式检验机构在完成产品型式检验后规定日期内出具型式检验报告(三年有效期),报告一式数份,制造单位、评审机构、受理机构一并存档。
产品检验流程
产品检验流程 本流程为产品检验所制定。检验人员检验时需分清贸易成品、自购成品(半成品)和自产成品(半成品)。 一、贸易成品检验 1.1物品进仓后24小时内完成检验,无论合格与否邮件告知采购、业务。 1.2检验时明确订单号,依据订单产品描述和客人签样为检验标准。 1.3贸易成品检验合格,需提供合格的《外购物品检验报告》、大货照、单箱产品正侧唛照、单个产品照片、单个外箱尺寸和平均克重。 1.4如外购物品检验不合格,需提供不合格的《外购物品检验报告》并上报厂长签字确认。同时需提供不合格理由和照片。 二、自购物品检验 2.1物品进仓后48小时内完成检验。 2.2检验时明确订单号,依据订单产品描述、确认样《木柄检验标准》和《猪鬃检验标准》为检验标准。 2.3检验合格,需提供合格的《自购物品检验报告》。 2.4检验不合格,需提供不合格的《自购物品检验报告》上报厂长签字确认。同时需提供不合格理由和照片并邮件和电话至供应商确认。
2.5原辅材料仓库保管员根据合同描述检验,并在入库单上注明产品合格。 三、自产成品(半成品)检验 3.1自产成品(半成品)进仓前各负责人进行自检。 3.2自产成品(半成品)检验合格,填写入库单入库。 3.3自产成品(半成品)检验不合格,需提供《自检产品报告》,同时提供不合格理由和照片。 四、检验工作主要责任人 4.1贸易成品检验主要责任人:刘建春 4.2自购物品检验主要责任人:刘建春、华锋 4.3木柄、猪鬃(丝)检验主要责任人:华锋 4.4自产产品入库前检验主要责任人:刘建春、吴设 《产品检验流程》于2017年1月22日起实施,同时纳入日常工作考核。 2017年1月22日 上海神永制刷工具有限公司
保健食品申请书
受理 编号 受理 日期年月日 食品生产许可证 (保健食品) 申请书 申请单位XXX有限公司 联系人张XX 电话1387698XXXX 申请日期20XX年X月X 日 海南省食品药品监督管理局制
填表说明 1、本申请表从海南省食品药品监督管理局网站下载使用,网址:http//https://www.360docs.net/doc/4817798546.html, ; 2、除图纸外的申报资料均须打印; 3、本表申报内容应完整、清楚、不得涂改,空格处以“无”字填写; 4、填写此表前,请认真阅读有关法规及申报与受理规定;未按申报要求申报的,将不予受理; 5、生产品种明细表中委托生产情况填写委托方企业名称及地址,如无委托生产情况则不填。 6、申请表填好后交海南省人民政府政务中心省食品药品监督管理局窗口。 7、本表格及所有申请材料提交纸质版一式两份、扫描电子版一份。
企业名称XXX有限公司 社会信用代码91460000620312XXXX 企业地址XX市XX区XX路XX号邮编570XXX 生产地址XX市XX区XX路XX号邮编570XXX 法定代表人张XX 企业性质有限责任公司联系人王XX 联系电话1387698XXXX 职工人数XX 应体检人数XX XXXX m2固定资产(万元)XXXX 使用面积 申请单位保证书 本单位所填报内容及提供的生产经营场地、生产设备、检验设备、规章制度等资料均真实、可靠。如有虚假,愿承 担有关法律责任。 申请单位盖章:法定代表人签字: 20XX年X月X日
提供申报资料: (请在所提供资料前的□内打√) □l. 《食品生产许可证(保健食品)申请书》 □2.《企业营业执照》复印件 □3.保健食品注册批准证明文件或备案证明 □4. 产品配方和生产工艺说明等技术材料 □5. 产品标签、说明书样稿 □6. 保健食品企业标准 □7. 备案保健食品的安全性和保健功能的说明材料 □8. 生产场所和周围环境平面图 □9. 生产车间布局平面图 □10. 生产设备布局平面图 □11. 生产工艺流程图 □12. 生产设施设备清单 □13.生产质量管理体系文件目录 □14.申请人的身份证明文件;委托他人办理的,应提交授权委托书和代理人的身份证明文件
保健食品检验报告常见问题
保健食品检验报告常见问题 发布日期:2006-02-08 一、毒理学试验 (一)试验报告中常见的缺项、漏项 1、Ames试验:缺少未处理对照组数据; 2、骨髓细胞微核试验:未提供PCE/RBC比值;、 3、小鼠精子畸形试验:未提供精子畸形的类型数据; 4、30天喂养试验:未提供每周体重及增重、每周食物利用率、详细的组织病理学报告、脏/体体重比值及血红蛋白、谷草转氨酶等生化指标的检测。 (二)试验设计 1、一般性问题 (1)试验项目的选择未按照《保健食品检验与评价技术规范(2003年)》进行,如:未做30天喂养试验。 (2)毒理学与功能学试验所用样品批号不一致。 (3)受试物的给予途径不是最佳途径。 (4)剂量设计不合理,未依据《保健食品检验与评价技术规范(2003年版)》设计剂量。如:剂量计算错误;未按适宜人群设计剂量;30天喂养试验高剂量组未达到人体推荐量的100倍且未说明原因。 (5)未说明受试物配制方法及受试物浓度,或受试物配制浓度与剂量设计不符。 (6)样品前处理不符合《保健食品检验与评价技术规范(2003年版)》的要求,如:含乙醇的受试样品,如乙醇含量超15%时,未将其乙醇浓度调节至15%。 (7)溶剂选择不合理,如:样品为脂溶性,但试验中使用5%淀粉作为溶剂;样品为水溶性,而动物试验使用色拉油作为溶剂。 (8)动物试验使用普通级动物,或未说明实验动物级别。 2、急性毒性试验:按最大耐受量法进行试验时,试验设计不规范。 3、Ames试验 (1)试验未设未处理对照组。 (2)Ames试验中样品未进行前处理,或前处理方法错误。如:含组氨酸的受试物未去除组氨酸;产品中含有不耐热的活性物质而使用高压灭菌方法除菌等。 4、30天喂养试验 (1)饲料中受试物的掺入比例达10%而未调整饲料中蛋白的含量。 (2)动物起始体重控制不良,体重偏低或偏高,如:初始体重133~166克。 (3)试验所用动物的质量有问题:有的检验报告对照组动物体重增长异常,前两周体重增加太少,雄性大鼠增重和食物利用率太低;个别检验机构动物的病理诊断皆有脾脏的白髓萎缩,且每次高剂量组和对照组均有1-2只大鼠有此问题。 (4)试验操作不规范,动物进食量应每周称2次,有些检验机构每周仅称1次。 (5)对照组动物的进食量不符合一般规律,但未对异常情况进行分析说明。如:动物第4周进食量明显低于第1周,或动物各周进食量差别很小。 (6)对照组动物的食物利用率异常,周食物利用率过高或过低,不符合动物生长发育的规律,但未对异常情况进行分析说明。如:周食物利用率高达60%以上。 (7)血液学及血生化指标数据变异过大且未作统计学分析。如:白蛋白/球蛋白比值过高;甘油三酯、胆固醇数据波动大。
