高中化学高分子化合物与材料

高中化学高分子化合物与材料2019年4月4日
(考试总分:140 分考试时长: 120 分钟)
一、填空题(本题共计 10 小题,共计 40 分)
1、(4分)按要求回答下列问题:
(1)的名称为_____________;
(2)
的名称为_________________;
(3)邻甲基乙苯的结构简式为_________________;
(4)顺-2-戊烯的结构简式为_________________;
(5)分子式为C6H12的某烯烃所有碳原子一定共平面,则该烯烃的结构简式为_________________;
(6)某高聚物的结构简式如图:
则形成该高分子化合物的单体的结构简式为_________________。
2、(4分)感光性高分子也称为“光敏性高分子”,是一种在彩电荧光屏及大规集成电路制造中应用较广的新型高分子材料.其中一种的结构简式为:
试回答下列问题:
(1)已知它是由两种单体经酯化后聚合而成的,试推断这两种单体的结构简式_________________ 、_____ ___________.
(2)写出该高分子在氢氧化钠溶液中反应的化学反应方程式:___________。
(3)对此高聚物的性质判断不正确的是__________(填字母).
A.在酸性条件下可以发生水解 B.此高聚物不能使溴水褪色
C.此高聚物可以使酸性高锰酸钾溶液褪色 D.此高聚物可与液溴发生取代反应
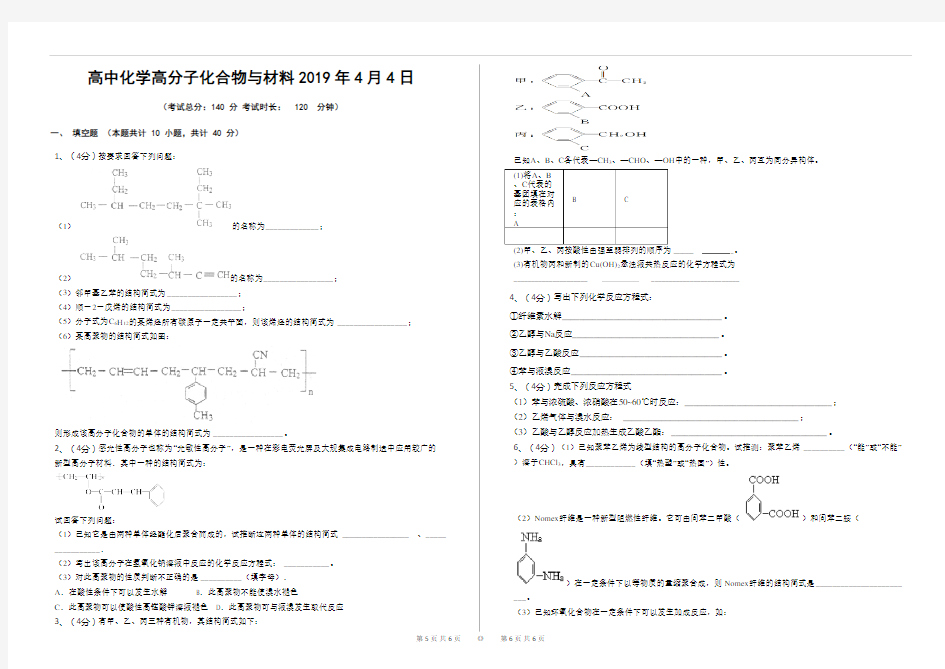
3、(4分)有甲、乙、丙三种有机物,其结构简式如下:
已知A、B、C各代表—CH3、—CHO、—OH中的一种,甲、乙、丙互为同分异构体。
_______ _。
(3)有机物丙和新制的Cu(OH)2悬浊液共热反应的化学方程式为
_____________________ _________________________
4、(4分)写出下列化学反应方程式:
①纤维素水解_____________________________________。
②乙醇与Na反应__________________________________。
③乙醇与乙酸反应_________________________________。
④苯与液溴反应___________________________________。
5、(4分)完成下列反应方程式
(1)苯与浓硫酸、浓硝酸在50~60℃时反应:__________________________________;
(2)乙烯气体与溴水反应: _________________________________________;
(3)乙酸与乙醇反应加热生成乙酸乙酯:____________________________________。
6、(4分)(1)已知聚苯乙烯为线型结构的高分子化合物。试推测:聚苯乙烯__________(“能”或“不能”)溶于CHCl3,具有____________(填“热塑”或“热固”)性。
(2)Nomex纤维是一种新型阻燃性纤维。它可由间苯二甲酸()和间苯二胺(
)在一定条件下以等物质的量缩聚合成,则Nomex纤维的结构简式是_____________________ ___。
(3)已知环氧化合物在一定条件下可以发生加成反应,如:
环氧树脂具有高度黏合力,广泛用作黏合剂。环氧树脂的合成过程如图所示:
请在下面相应的横线处填写单体A、B与环氧树脂C的结构简式:
A._______________________________________;
B._____________________________;
C._________________________________。
7、(4分)现有下列高聚物:A.聚乙烯 B.天然橡胶 C.硫化橡胶 D.用于制备电木的酚醛树脂
E.有机玻璃(聚甲基丙烯酸甲酯)。其中属于线型结构的是_____,属于体型结构的是_______,加热可熔融的是_____,常用于制备轮胎的是_____,用于制备插座、电器把手的是_______,用于制造汽车窗大灯玻璃罩的是_______。
8、(4分)
呋喃酚是合成农药的重要中间体,其合成路线如下:
(1)A物质核磁共振氢谱共有___个峰,B→C的反应类型是___ .
(2)已知x的分子式为C4H7C1,写出A→B的化学方程式:___ .
(3)Y是X的同分异构体,分子中无支链且不含甲基,则Y的名称(系统命名)是___ .
(4)下列有关化合物C、D的说法正确的是___ .
①可用氯化铁溶液鉴别C和D
②C和D含有的官能团完全相同
③C和D互为同分异构体
④C和D均能使溴水褪色
(5)E的同分异构体很多,写出一种符合下列条件的芳香族同分异构体的结构简式:___ .
①环上的一氯代物只有一种②含有酯基③能发生银镜反应.
9、(4分)以A为原料可制备C(丹皮酚)和D(树脂),其合成路线如下:
(1)A在空气中会缓慢变成粉红色,其原因是_____________________________________。
(2)A→B的反应类型为______________________;A生成D的反应中,试剂X(烃的含氧衍生物)为________ ____________(写结构简式)。
(3)只含有两个取代基的芳香化合物E是C的同分异构体,E既能与FeCl3溶液发生显色反应又能发生银镜反应和水解反应,则E共有________种(不考虑立体结构),其中核磁共振氢谱为六组峰且峰面积比为1:1:2:2:2:2 的结构简式为_______________。
10、(4分)按要求完成下列问题:
(1)反—2-丁烯的结构简式____;
(2) 的名称为________;
(3)丙氨酸在一定条件下发生缩聚反应的方程式:____________________;
(4) 单体的结构简式________________。
二、单选题(本题共计 20 小题,共计 100 分)
11、(5分)下列对有机反应类型的描述不正确的是
A.乙醇使酸性KMnO4溶液褪色,是因为发生了氧化反应
B.将苯加入溴水中,振荡后水层接近无色,是因为发生了取代反应
C.乙烯使溴的四氯化碳溶液褪色,是因为发生了加成反应
D.甲烷与氯气混合,光照一段时间后黄绿色消失,是因为发生了取代反应
12、(5分)制取较纯的一氯乙烷,用下列哪种方法
A.乙烷和氯气取代 B.乙烯加成氢气,再用氯气取代
C.乙烯和氯化氢加成 D.乙烯和氯气加成
13、(5分)苯丙炔酸()广泛用于医药、香料等化工产品中。下列关于苯丙炔酸的说法正确的是
A.不饱和度为5
B.是高分子化合物的单体
C.与丙炔酸()互为同系物
D. 1 mol苯丙炔酸最多可与4 mol 氢气发生反应
14、(5分)2008奥运吉祥物福娃,其外材为纯羊毛线,内充物为无毒的聚酯纤维(如图)。下列说法正确的是
A.羊毛与聚酯纤维的化学成分相同
B.该聚酯纤维的单体为对苯二甲酸和乙醇
C.聚酯纤维和羊毛一定条件下均能水解
D.聚酯纤维属于纯净物
15、(5分)下列说法正确的是
A.苯和苯乙烯是同系物
B.乙醇和乙醚是同分异构体
C.显酸性的有机化合物一定是羧酸
D.淀粉、纤维素、蛋白质都是高分子化合物
16、(5分)某有机玻璃的单体分子(只含C、H、O元素)结构模型如图所示。下列分析正确的是
A.该分子所有原子可能共面 B.与该单体互为同分异构体的羧酸类有4种
C.该有机高分子的链节为 D.该有机玻璃容器可贮存强酸强碱溶液
17、(5分)将CH3COOH和H18O—
C2H5混合加热发生酯化反应,已知酯化反应是可逆反应,反应达到平衡后,下列说法正确的是
A.18O存在于所有物质里 B.18O仅存在于乙醇和乙酸乙酯里
C.18O仅存在于乙醇和水里 D.有的乙醇分子可能不含18O
18、(5分)下列物质一定不是天然高分子的是( )
A.橡胶 B.羊毛 C.聚乙烯 D.纤维素
19、(5分)下列关于合成高分子化合物的说法正确的是
A.涤纶、锦纶、蚕丝都属于合成纤维
B.塑料、合成树脂和合成橡胶被称为“三大合成材料”
C.酚醛树脂是酚类物质和醛类物质加聚而成的高分子化合物
D. “尿不湿”中的高吸水性树脂属于功能高分子材料
20、(5分)下列各种高聚物中,具有热固性的是( )
A.有机玻璃 B.聚氯乙烯 C.聚丙烯 D.酚醛塑料
21、(5分)PHB塑料是一种可在微生物作用下降解的环保型塑料,其结构简式如下,则有关PHB的说法不正确的是
A. PHB是一种聚酯
B. PHB的单体是 CH3CH2CH(OH)COOH
C. PHB的降解产物可能是CO2和H2O
D. PHB是通过加聚反应制得的
22、(5分)体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中正确的是
A.该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
B.滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
C.该分子中的所有碳原子不可能共平面
D.1mol此物质分别与浓溴水和H2反应时最多消耗Br2和H2为4mol和7mol
23、(5分)下列有关生活中常见的物质,说法正确的是()
A. 苯分子中的化学键是单双键交替结构
B. 聚乙烯能和溴水发生加成反应
C. 所有的糖类都能水解
D. 75%的酒精可以用于医疗杀菌消毒
24、(5分)某种既耐低温,又耐高温的一种塑料,俗称“塑料王”,其成分是()
A.电木 B.聚四氟乙烯
C.聚苯乙烯 D.聚甲基丙烯酸甲酯
25、(5分)能在KOH的醇溶液中发生消去反应的是
A. CH3Cl B. (CH3)3CCH2Cl C.
D.
26、(5分)下列物质不属于天然高分子化合物的是
A.纤维素 B.蔗糖 C.蛋白质 D.淀粉
27、(5分)化学与生产和生活密切相关,下列说法正确的是( )
A.聚乙烯塑料的老化是因为发生了加成反应
B.煤经过气化和液化等物理变化可转化为清洁燃料
C.合成纤维、人造纤维及碳纤维都属于有机高分子材料
D.利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程
28、(5分)阴离子型聚丙烯酰胺(APAM)的水溶液广泛用于电镀厂、钢铁厂等废水(含铬离子、铜离子等)的絮凝沉降,其结构为:
下列说法正确的是
A. APAM是由一种单体加聚而成的
B. APAM难溶于水
C. APAM不发生水解
D. APAM能与金属阳离子结合成不溶性凝胶体聚沉
29、(5分)下列不饱和化合物(单体) 能在一定条件下发生加聚反应生成如图物质的是
A.丙烯 B. 2-甲基-1,3-丁二烯 C.乙烯和丙烯 D. 2-甲基-2-丁烯
30、(5分)从2008年6月1日起,各大超市、农贸市场不得提供免费的塑料袋。下列说法中不正确的是( ) A.这一举措的目的是为了限制和减少塑料袋的使用,遏制“白色污染”
B.塑料、合成纤维、合成橡胶是三大合成材料
C.线型结构的塑料具有热塑性(加热变形,冷却后定形)
D.塑料、纤维素、蛋白质、天然橡胶属于天然高分子
一、填空题(本题共计 10 小题,共计 40 分)
1、(4分)【答案】
3,3,6-三甲基辛烷 3,6-二甲基-1-庚炔
【解析】
(1)该有机物为烷烃,主碳链为8个碳,甲基分别位于3,3,6位的碳上,名称为3,3,6-三甲基辛烷;正确答案:3,3,6-三甲基辛烷。
(2)
该有机物物为炔烃,含有碳碳三键在内的主碳链为7个碳,甲基位于3,6位的碳上,名称为3,6-二甲基-1-庚炔;正确答案:3,6-二甲基-1-庚炔。
(3)甲基、乙基在苯环的邻位,邻甲基乙苯的结构简式为
;正确答案:
。
(4)甲基、乙基在同侧,顺-2-戊烯的结构简式为
;正确答案:
。
(5)乙烯分子为平面结构,6个原子共平面,把4个氢分别用4个甲基取代,即可得到分子式为C6H12的所有
碳原子一定共平面的烯烃,结构简式为:
;正确答案:
。
(6)该高聚物的形成过程属于加聚反应,加聚反应是由不饱和单体( 如碳碳双键,碳碳叁键以及碳氧双键等) 聚合形成高分子的反应,其产物只有一种高分子化合物;凡链节主链上只有碳原子并存在碳碳双键结构的高聚物,其规律是“见双键,四个碳,无双键,两个碳”画线断开,然后将半键闭合,即将单双键互换;
所以
的单体为
:
;正确答案:。2、(4分)【答案】
CH2=CH-OH
+nNaOH
→+ B
【解析】
(1)由于该新型高分子材料是由两种单体经酯化后聚合而成的,酯化反应和加成聚合反应的反应机理可知两种单体为:CH2=CH-OH 、;
(2)+nNaOH →+
(3)A、该聚合物含有酯基,能够发生水解反应,故A正确;
B、该聚合物含有碳碳双键,能与溴发生加成反应使溴水褪色,故B错误;
C、该聚合物含有碳碳双键,能被酸性高锰酸钾氧化,故C正确;
D、此高聚物中含有苯环,可与液溴发生取代反应,故D正确;
故选B。
3、(4分)【答案】
(1)A.—OH B.—CH3 C.—CHO (2)乙>甲>丙
(3
)
【解析】
(1)由于甲、乙、丙互为同分异构体,则根据三种有机物的结构简式可知,B是—
CH3,A是-OH,C是-CHO。
(2)羧基的酸性强于酚羟基的,酚羟基的酸性强于醇羟基的,则甲、乙、丙按酸性由强至弱排列的顺序为乙>甲>丙。
(3)醛基能被新制的氢氧化铜悬浊液氧化,反应的化学方程式是
。
4、(4分)【答案】
①
②2CH 3CH 2OH+2Na→2CH 3CH 2ONa+H 2↑ ③CH 3CH 2OH+CH 3
COOH CH 3COOCH 2CH 3+H 2O
④或
【解析】
①纤维素水解生成葡萄糖,反应的方程式为; ②乙醇与Na 反应放出氢气,反应的方程式为2CH 3CH 2OH+2Na→2CH 3CH 2ONa + H 2↑; ③乙醇与乙酸反应生成乙酸乙酯,反应的方程式为CH 3COOH+CH 3CH 2
OH CH 3COOCH 2CH 3+H 2O
;
④苯与液溴反应生成溴苯和溴化氢,反应的方程式为。
5、(4分)【答案】 (1)
(2)CH 2=CH 2+Br
2
CH 2BrCH 2Br
(3)CH 3COOH+CH 3CH 2OH CH 3COOCH 2CH 3+H 2O
【解析】
(1)苯与浓硫酸、浓硝酸在50~60
℃时发生取代反应生成硝基苯和水,反应方程式为
;
(2)乙烯气体与溴水发生加成反应生成1,2-二溴乙烷,反应方程式为CH 2=CH 2+Br 2
CH 2BrCH 2Br ;
(3)乙酸与乙醇在浓硫酸作用下发生酯化反应生成乙酸乙酯和水,化学方程式为CH 3COOH+CH 3CH 2OH
CH 3COOCH 2CH 3+H 2O 。 6、(4分)【答案】
能 热塑
【解析】
(1)已知聚苯乙烯为线型结构的高分子化合物,根据线形高分子的性质可推测聚苯乙烯能溶于CHCl 3,具有热塑性。
(2)间苯二甲酸(
)和间苯二胺(
)在一定条件下、以等物质的量缩聚合成
高分子时,由于反应时羧基提供羟基,氨基提供氢原子脱去水分子,则Nomex
纤维的结构简式是
。
(3)根据已知信息可知A 与B
发生加成反应生成
,因此A 和B
的结构简式分别是
、
。有机物
分子中含有氯原子和羟基,发生缩聚反应脱
去HCl 生成C ,则C 的结构简式为
。
7、(4分)【答案】
ABE CD ABE C D E 【解析】
线性结构是链状高聚物,是由于许多链节相互连成一条长链的高聚物,特点是具有高弹性、可在溶剂中能溶解,加热能熔融,硬度和脆度较小,属于线性结构的是聚乙烯、天然橡胶、有机玻璃,答案选ABE ;体型(网状)一般是由许多官能团单体相互作用,使链与链之间以共价键相连接,形成三维空间的立体结构,特点是没有弹性和可塑性,不能溶解和熔融,只能溶胀,硬度和脆度较大,不能反复熔化,只能一次加工成型,因此属于体型结构的是硫化橡胶、酚醛树脂,答案选CD ;加热熔融的是ABE ;用于制备轮胎的是C ;制备插座、电器把手的是D ;用于制造汽车大灯玻璃围罩的是E 。
8、(4分)【答案】
3 取代反应
4﹣氯﹣1﹣丁烯①③④
【解析】
(1)A分子中H原子的位置有3种,所以A物质核磁共振氢谱共有3个峰;B→C反应时羟基中的H原子被其它原子团替换,所以反应类型为取代反应。
(2)x的分子式为C4H7C1,对比B的结构简式可知x的结构简式为:ClCH2—
C(CH3)=CH2,与A
发生取代反应,化学方程式为:
(3)Y是X的同分异构体,分子中无支链且不含甲基,则碳碳双键位于1号C与2号C之间,Cl原子位于4号C 原子,所以Y的名称(系统命名)是:4-氯-1-丁烯。
(4)①C不含酚羟基,D含有酚羟基,故可用氯化铁溶液鉴别C和D,正确;②
C不含酚羟基,D含有酚羟基,错误;③C和D分子式相同而结构不同,所以二者互为同分异构体,正确;④C和D都含碳碳双键,均能使溴水褪色,正确。
(5)根据②含有酯基,③能发生银镜反应,说明苯环侧链含有甲酸酯,再根据①
环上的一氯代物只有一种,还含有3个—CH3,结构简式为:
9、(4分)【答案】
A中的酚羟基易被空气中的氧气氧化取代反应 HCHO 6
【解析】
由合成路线可知,A为间二酚,间二酚与醋酸发生取代反应生成B,B与乙酸酐发生取代反应生成C;类比酚醛树脂的制备,可以推断A与试剂X发生缩聚反应生成D,则X为甲醛。
(1)类比苯酚在空气中变为粉红色,可知A在空气中会缓慢变成粉红色的原因是A中的酚羟基易被空气中的氧气氧化。
(2)A→B的反应类型为取代反应;A生成D的反应中,试剂X(烃的含氧衍生物)为HCHO。
(3)只含有两个取代基的芳香化合物E是C ()的同分异构体,E既能与FeCl3溶液发生显色反应又能发生银镜反应和水解反应,则E分子中有酚羟基、醛基、酯基,E的苯环上只有两个取代基,则其中一个一定是羟基,另一个可能是—CH(CH3)OCHO或—
CH2CH2OCHO,这两个取代基在苯环上有邻、间、对三种位置关系,故E共有6种,其中核磁共振氢谱为六
组峰且峰面积比为1:1:2:2:2:2 的结构简式为。
10、(4分)【答案】
2-丁醇
CH2=CH-CH=CH2
【解析】
(1)2-丁烯的结构简式为:CH3CH=CHCH3,两个相同的原子或原子团排列在双键的同一侧称为顺式异构,两个相同的原子或原子团排列在双键的异侧称为反式异构,反—2-
丁烯的结构简式为:;(2)的官能团为羟基,属于醇类,命名时,应使羟基的位次最小,其名称为2-
丁醇;(3)丙氨酸分子中含有羧基和氨基,含有羧基和氨基脱水发生缩聚反应生成蛋白质,反应的化学方程式为:
;(4)的链节中含有碳碳
双键,则单体一定含有二烯烃,结合链节的碳原子数可知另一个单体为单烯烃,单体的结构简式为:
和CH2=CH-CH=CH2。
二、单选题(本题共计 20 小题,共计 100 分)
11、(5分)【答案】B
【解析】
A.甲苯可被酸性高锰酸钾氧化生成苯甲酸,故A正确;B.苯与溴水不反应,可与液溴在催化剂条件下发生取代反应,因溴易溶于苯,可萃取溴,但没有反应,故B错误;C.乙烯含有碳碳双键,可与溴发生加成反应,故C正确;D.己烷为饱和烃,可发生取代反应,与氯气在光照条件下发生取代反应,故D正确;故选B 。
12、(5分)【答案】C
【解析】
A.乙烷和氯气取代除了生成一氯乙烷还会生成1,2-
二氯乙烷,故A错误;B.的选项和A相似,乙烯和氢气加成后生成乙烷再与氯气取代,产物中仍然含有1,2-二氯乙烷,故B错误;D.乙烯和氯气加成生成1,2-二氯乙烷而不是一氯乙烷,故D错误;此题选C。
13、(5分)【答案】B
【解析】
A 、苯环的不饱和度为4,碳碳三键的不饱和度为2,羧基的不饱和度为1,则苯丙炔酸的不饱和度为7,故A 错误;
B 、
可发生加聚反应生成
,则
为
的单
体,故B 正确;C 、
含有苯环,与CH≡C ﹣COOH 结构不相似,不是同系物,故B 错误;
D 、能与氢气反应的为苯环和碳碳三键,则1 mol 苯丙炔酸最多可与5mol 氢气发生反应,故D 错误。故选B 。
14、(5分)【答案】C
【解析】
A .羊毛的主要成分为蛋白质,含有N 元素,与聚酯纤维化学成分不同,A 错误;
B .由结构简式可知聚酯纤维为对苯二甲酸和乙二醇发生缩聚反应生成,B 错误;
C .聚酯纤维含有酯基,羊毛含有肽键,在一定条件下都可水解,C 正确;
D .聚酯纤维属于高聚物,分子式中n 值介于一定范围之内,没有固定的值,则聚酯纤维为混合物,D 错误。 答案选C 。
15、(5分)【答案】D
【解析】
A .同系物必须满足结构相似,苯分子中不存在碳碳双键,而苯乙烯中存在碳碳双键,所以二者不属于同系物,A 错误;
B .乙醇的分子式为:
C 2H 6O ,乙醚的分子式为C 4H 10O ,二者分子式不同,不属于同分异构体,B 错误; C .显示酸性的有机物不一定为羧酸,如苯酚显示酸性,苯酚属于酚类,不属于羧酸,C 错误;
D .淀粉、纤维素、蛋白质都是高分子化合物,D 正确; 答案选D 。
16、(5分)【答案】C
【解析】
结构模型中最小的原子为氢原子,较大的原子为碳原子,黑色的原子为氧原子,所以该有机物为
。因为分子中存在饱和碳原子,所以不可能保证所有原子共平面,选项A 错误。与该单体
互为同分异构体的羧酸类有机物就是含有5个碳原子的羧酸(其中应该还有另外的一个结构带有1个不饱和度),5个碳原子的羧酸(戊酸)已经有4种了(丁基连羧基就是5个碳的羧酸,丁基有4种),再考虑到另外的
一个不饱和度,所以该同分异构体一定多于4种,选项B 错误。将该单体加聚得到高分子,
所以其链节为,选项C 正确。该高分子为聚酯类物质,酯基在强酸或强碱条件下都会水解
,所以选项D 错误。
17、(5分)【答案】B
【解析】
乙酸与乙醇发生酯化反应,乙酸提供羟基,醇提供羟基氢原子,二者结合生成水,其余部分互相结合成酯,
所以乙酸与乙醇反应方程式为CH 3COOH+CH 3CH 218OH
CH 3CO 18OCH 2CH 3+
H 2O ,由于酯化反应是可逆反应,故乙醇仍存在,故18O 只存在于乙醇和乙酸乙酯中.故选项B 正确。 18、(5分)【答案】C
【解析】
有机高分子化合物可以分为天然有机高分子化合物(如淀粉、纤维素、蛋白质、天然橡胶等)和合成有机高分子化合物(如聚乙烯、聚氯乙烯等),聚乙烯为乙烯通过加聚反应由人工合成的高分子化合物,答案选C 。
19、(5分)【答案】D
【解析】
A. 涤纶、锦纶属于合成纤维,蚕丝属于蛋白质,故A 错误;
B.
三大合成材料是指塑料、合成橡胶和合成纤维,合成树脂不属于“三大合成材料”,故B 错误;C. 酚醛树脂是酚类物质和醛类物质缩聚而成的高分子化合物,故C 错误;D. “尿不湿”中的高吸水性树脂属于功能高分子材料,故D 正确。答案选D 。
20、(5分)【答案】D
【解析】
酚醛塑料,为体型分子,属于热固性塑料,而有机玻璃的成分是聚甲基丙烯酸甲酯、聚氯乙烯塑料、聚丙烯塑料均为线型分子,属于热塑性塑料。 答案选D 。
21、(5分)【答案】D
【解析】
A.PHB 是CH 3CH 2CH(OH)COOH 发生缩聚反应产生的物质,所以是一种聚酯,故A 正确;
B.PHB 的单体是CH 3CH 2CH(OH)COOH ,故B 正确;
C.PHB 水解得到CH 3CH 2CH(OH)COOH ,CH 3CH 2CH(OH)COOH 在微生物作用下的降解产物可能有CO 2和H 2O ,故C 正确;
D.PHB 通过缩聚反应制得,故D 错误。 故选D 。
22、(5分)【答案】D
【解析】
A .该结构中含2个苯环,多个羟基,故不是酚类的同系物,故A 错误;
B .该物质含有碳碳双键,并含有还原性的酚羟基,都易被高锰酸钾氧化,不能证明其结构中存在碳碳双键
,故B 错误;C .由于碳碳单键之间可以旋转,而且每个苯环上所有的碳原子在一个平面上,题目中所有碳原子可以共面,故C 错误。;D .两个苯环需6
mol 氢气完全加成,一个碳碳双键需1mol 氢气完全加成,共需7mol 氢气;该结构中含碳碳双键,故可与浓溴
水发生加成反应需1mol 溴单质,该结构中含酚羟基,故与浓溴水发生邻对位取代需3mol ,共需4mol 溴单质,故D 正确.
23、(5分)【答案】D 【解析】
A.苯结构中无碳碳双键,不是单双键交替的结构,故A错误;
B. 聚乙烯中不存在碳碳双键,不能和溴水发生加成反应,故B错误;
C. 糖类中的单糖,不能水解,故C错误;
D、实践证明,70%的酒精对细菌的渗透能力最强,杀菌效果最好,故D正确;故选D。
24、(5分)【答案】B
【解析】
酚醛塑料,俗称电木,废旧热固性酚醛塑料可作燃料,不是既耐低温,又耐高温的一种塑料,所以不是“塑料王”,A错误;聚四氟乙烯几乎不受任何化学试剂腐蚀,如在浓硫酸、硝酸、盐酸,甚至在王水中煮沸,其重量及性能均无变化,也几乎不溶于所有的溶剂;聚四氟乙烯不吸潮,不燃烧,不导电,既耐高温,又耐低温,俗称“塑料王”,B正确;聚苯乙烯受热融化后冷却可以进行再加工,具有热塑性,C错误;聚甲基丙烯酸甲酯俗称“有机玻璃”,能溶于C HCl3,受热融化后冷却可以进行再加工,具有热塑性,D错误;正确选项B。
25、(5分)【答案】D
【解析】
A.CH3Cl不能发生消去反应,故A错误;B.(CH3)3CCH2Cl不能发生消去反应,故B错误;C .不
能发生消去反应,故C错误;D .能发生消去反应,故D正确;答案为D。
26、(5分)【答案】B
【解析】
A.纤维素为多糖,相对分子质量在10000以上,属于天然高分子化合物,A不符合;
B.蔗糖为二糖,分子式为C12H22O11,相对分子质量较小,不属于高分子化合物,B符合;
C.蛋白质的相对分子质量在10000以上,属于天然高分子化合物,C不符合;
D.淀粉为多糖,相对分子质量在10000以上,属于天然高分子化合物,D不符合;答案选B。
27、(5分)【答案】D
【解析】
A、聚乙烯结构中不存在碳碳双键,其不能发生加成反应,A错误;
B、煤的气化和液化均为化学变化,B错误;
C、碳纤维属于无机材料,C错误;
D、粮食酿酒是淀粉转化为葡萄糖,并进一步转化为乙醇,属于化学变化,D正确,答案选D。
28、(5分)【答案】D
【解析】
A.根据结构,APAM 的单体为和,故A错误;
B.
根据APAM的结构可知,分子中的酯基和卤素原子均为憎水基团,但酰胺键是亲水基团,因此该高分子化合物易溶于水,与题意阴离子型聚丙烯酰胺(APAM)的水溶液吻合,故B错误;C.
APAM中含有酯基和酰胺键,都能发生水解反应,故C错误;D.
根据题意,APAM能与金属阳离子(铬离子、铜离子等)结合成不溶性凝胶体聚沉,故D正确;故选D。
29、(5分)【答案】B
【解析】在中,主链上有四个碳原子并存在碳碳双键结构,根据规律“见双键,四个碳,无双键,两个碳”画线断开,然后将半键闭合,即将单双键互换,得到其单体为CH2=CH—
C(CH3)=CH2,即2-甲基-1,3-丁二烯,故选B。
30、(5分)【答案】D
【解析】
A.限制使用塑料袋,可以减少白色污染,故A正确;B.合成材料包括塑料、合成橡胶、合成纤维三类,故B正确;C.热塑性塑料中树脂的分子链都是线型或带支链的线型结构,故C正确;D.塑料是人工合成的,故D错误;故选D。
高中化学竞赛-配合物,络合物,配位化学,配体,配位数,中心体
高中化学奥林匹克竞赛辅导 配合物(配位化合物)化学基础 【竞赛要求】 配位键。常见的配合物的中心离子(原子)和常见的配体(水、羟离子、卤离子、拟卤离子、氨分子、酸根离子、不饱和烃等)。螯合物及螯合效应。常见的络合剂及常见的配合反应。定性说明配合反应与酸碱反应、沉淀反应、氧化还原反应的联系。配合物几何构型和异构现象的基本概念。配合物的杂化轨道理论。八面体配合物的晶体场理论。Ti(H2O)6的颜色。路易斯酸碱的概念。 1.配合物:由中心离子(或原子)和几个配体分子(或离子)以配位键相结合而形成的复杂分子 络合物。如[Co(NH3)6]3+、[Cr(CN)6]3–、Ni(CO)4都是配位单元,分别称作配阳离子、配阴离子、配分子。判断物质是配合物的关键在于物质是否含有配位单元。配合物和复盐的区别:前者一定含有配位键,后者没有配位键,如KCl·MgCl2·6H2O是复盐,不是配合物。 2.配合物的组成: 为外界,内外界(1)配合物的内界和外界:以[Cu(NH3)4]SO4为例,[Cu(NH3)4]2+为内界,SO-2 4 之间是完全电离的。内界是配位单元,外界是简单离子。又如K3[Cr(CN)6]之中,内界是[Cr(CN)6]3–,外界是K+。配合物可以无外界,但不能没有内界,如Ni(CO)4。 (2)中心离子(原子)和配位体: a.中心离子(原子):又称配合物的形成体或中心体,多为过渡金属离子,如Fe3+、Fe2+、Co2+、Ni2+、Cu2+,也有电中性的原子为配合物的中心原子,如Ni(CO)4、Fe(CO)5中的Ni和Fe都是电中性的原子。只要能提供接纳孤对电子的空轨道的离子或原子均可作中心体。 b.配位体:含有孤对电子的阴离子或分子。如NH3、Cl—、CN—等。配位体中直接同中心原子配合的原子,叫做配位原子。如[Cu(NH3)4]2+配阳离子中,NH3是配位体,其中N原于是配位原子。配位原子经常是含有孤对电子的原子。 (3)配位原子和配位数:配体中给出孤对电子与中心体直接形成配位键的原子,叫配位原子。配位单元中,中心体周围与中心体直接形成配位键的配位原子的个数,叫配位数。中心离子的配位数一般为2、4、6、8(配位数为8的较少见),如在[Pt(NH3)6]C14中,配位数为6,配位原子为NH3分子中的6个氮原子。一般说来,配位数大多是中心体电荷数的两倍,如Cu+、Ag+、Au+的配位数均为2,Cu2+、Zn2+的配位数均为4,Fe3+、Cr3+的配位数均为6,但也有例外。配位数与中心体和配体的性质有关:若中心离子的电荷高,半径大,则利于高配位;而配体的电荷高,半径大,则利于低配位。
人教版高中化学必修一金属材料.docx
高中化学学习材料 用途广泛的金属材料 一、选择题:(本题共6小题,每小题3分,共18分,每小题只有一个正确答案) 1.下列说法中不正确的是()A.人类历史上使用最早的合金是青铜 B.司母戊鼎是我国目前已发现的最重的青铜器 C.目前世界上使用量最大的合金是铝合金 D.目前世界上用途最广的合金是钢 2.适宜于制作不锈钢用具的钢是()A.低碳钢B.中碳钢C.高碳钢 D.合金钢 3.下列金属中属于黑色金属的是()A.铁B.金C.银D.铜 4.下列金属中不属于货币金属的是()A.铁B.金C.银D.铜 5.关于合金性质的说法中,错误的是()A.多数合金的硬度一般比其各成分金属的硬度高 B.多数合金的熔点一般比其各成分金属的熔点低 C.合金的物理性质一般与其各成分金属的的物理性质不同 D.合金的化学性质一般与其各成分金属的的化学性质不同 6.最不适宜于制作炊事用具的金属是()A.Fe B.Pb C.Al D.Cu 二、选择题(共10小题,每小题4分,计40分,每小题有1—2个正确答案,只有一个正 确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个该小题不给分。)7.下列物质中,不属于合金的是()
A.硬铝B.黄铜C.钢铁D.水银 8.把生铁冶炼成碳素钢要解决的主要问题是() A.除去生铁中的各种杂质,把生铁提纯 B.适当降低生铁里的含碳量,除去大部分硫、磷等有害杂质 C.用还原剂把铁的氧化物还原成铁 D.加入合金元素改善生铁性能 9.铝在人体中积累可使人慢性中毒,世界卫生组织将铝确定为食品污染源之一而加以控制。 铝在下列使用场合中,必须加以控制的是()A.制造炊具B.制防锈油漆C.制牙膏皮D.炼铝厂制造铝锭10.在电子工业中,制印刷电路时,常用氯化铁溶液作为铜的“腐蚀液”,该过程发生的反应为:2FeCl3+Cu=2FeCl2+CuCl2。该反应利用了铜的什么性质() A .氧化性 B.还原性 C.导电性 D.导热性 11.金属及其制品在腐蚀介质中很容易被腐蚀,其使用寿命大为降低。因此只有对腐蚀介质中的金属及其制品采取防护措施,才能保证金属工艺设备的安全性和工农业生产的顺利进行。下面对金属及其制品的防护措施中错误的是()A.铁锅用完后,用水刷去其表面的油污,置潮湿处保存 B.通过特殊工艺,增加铝制品表面的氧化膜 C.对于易生锈的铁制品(如防护网)要定期涂刷防护漆 D.把Cr、Ni等金属加入到普通钢里制成不锈钢 12.铜锌合金的颜色酷似金的颜色,所以近来用铜锌合金制成的假金元宝欺骗行人的事件屡有发生。下列不易区别其真伪的方法是()A.测定密度B.放入硝酸中C.放入盐酸中 D.观察外观 13.2003年10月15日,我国成功发射“神舟五号”载人飞船,飞船以铝粉与高氯酸铵的混合物为固体燃料,其中高氯酸铵的反应为:2NH4ClO4 N2↑+Cl2↑+2O2↑+4H2O。 下列有关叙述正确的是() A.该反应属于分解反应、氧化还原反应 B.上述反应瞬间能产生大量高温,高温是推动飞船飞行的主要因素 C.铝粉的作用是,点燃时氧化放热引发高氯酸铵反应 D.在反应中NH4ClO4仅起到氧化剂作用 14.2000年5月,在香港拍卖会上,保利集团花费3000多万港币购回火烧圆明园时流失的国宝:铜铸的牛首、猴首和虎首。普通铜器时间较长容易出现铜绿,其主要成分是 [Cu2(OH)2CO3]。这三件1760年铜铸的国宝在240年后看上去依然熠熠生辉,不生锈,下列对其原因的分析,最可能的是() A.它们的表面都镀上了一层耐腐蚀的黄金 B.环境污染日趋严重,它们表面的铜绿被酸雨溶解洗去
高中化学方程式大全(最最完整版)
优质解答 1、硝酸银与盐酸及可溶性盐酸盐溶液:Ag++Cl-=AgCl↓ 2、钠与水反应:2Na+2H2O=2Na++2OH–+H2↑ 3、钠与硫酸铜溶液:2Na+2H2O+Cu2+=2Na++Cu(OH)2↓+H2↑ 4、过氧化钠与水反应:2Na2O+2H2O=4Na++4OH–+O2↑ 5、碳酸氢盐溶液与强酸溶液混合:HCO3-+H+=CO2↑+H2O 6、碳酸氢盐溶液与醋酸溶液混合:HCO3-+CH3COOH=CO2↑+H2O+CH3COO- 7、氢氧化钙溶液与碳酸氢镁反应: Ca2++2OH-+2HCO3-+Mg2+=Mg(OH)2↓+CaCO3↓ 8、向碳酸氢钙溶液中加入过量的氢氧化钠: 2HCO3-+Ca2++2OH–=CaCO3↓+2H2O+CO32– 9、向碳酸氢钙溶液中加入少量的氢氧化钠:Ca2++HCO3-+OH–=CaCO3↓+H2O 10、澄清石灰水与少量小苏打溶液混合:Ca2++OH–+HCO3-=CaCO3↓+H2O 11、澄清石灰水通入少量CO2:Ca2++2OH–+CO3=CaCO3↓+H2O 12、澄清石灰水通入过量CO2:OH–+CO2=HCO3- 13、碳酸氢钠溶液与少量石灰水反应:Ca2++2OH–+2HCO3-=CaCO3↓+CO32–+2H2O 14、碳酸氢钠溶液与过量石灰水反应:HCO3-+OH–+Ca2+=CaCO3↓+H2O 15、等物质的量氢氧化钡溶液与碳酸氢铵溶液混合: Ba2++2OH–+NH4++HCO3-=BaCO3↓+H2O+NH3?H2O 16、碳酸钠溶液与盐酸反应:CO32–+H+=HCO3- 或CO32–+2H+=CO2↑+H2O 17、向氢氧化钠溶液中通入少量的CO2?:CO2+2OH–=CO32–+H2O 18、过量的CO2通入氢氧化钠溶液中:CO2+OH–=HCO3- 19、碳酸氢铵溶液中加入过量氢氧化钠溶液: NH4++HCO3-+2OH–=NH3↑+CO32–+2H2O 20、碳酸钙与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O 21、碳酸钙与醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O 22、澄清石灰水与稀盐酸反应:H++OH–=H2O 23、磷酸溶液与少量澄清石灰水:H3PO4+OH–=H2O+H2PO4– 24、磷酸溶液与过量澄清石灰水:2H3PO4+3Ca2++6OH–=Ca3(PO4)2↓+6H2O 25、碳酸镁溶于强酸:MgCO3+2H+=Mg2++CO2↑+H2O 26、硫酸镁溶液跟氢氧化钡溶液反应: Ba2++2OH–+Mg2++SO42–=BaSO4↓+Mg(OH)2↓ 27、硫酸溶液跟氢氧化钡溶液反应:Ba2++2OH–+2H++SO42–=BaSO4↓+2H2O 28、硫酸氢钠溶液与氢氧化钡反应至中性:2H++SO42–+2OH–+Ba2+=2H2O+BaSO4↓ 29、硫酸氢钠溶液与氢氧化钡反应至硫酸根完全沉淀: H++SO42–+OH–+Ba2+=BaSO4↓+H2O 30、硫酸铝溶液中加入过量氢氧化钡溶液: 2Al3++3SO42–+8OH–+3Ba2+=3BaSO4↓+2AlO2–+4H2O 31、氢氧化镁与稀硫酸反应:Mg(OH)2+2H+=Mg2++2H2O 32、铝跟氢氧化钠溶液反应:2Al+2OH–+2H2O=2AlO2–+3H2↑ 33、物质的量之比为1:1NaAl合金置于水中:Na+Al+2H2O=Na++AlO2–+2H2↑ 34、氧化铝溶于强碱溶液:Al2O3+2OH–=2AlO2–+H2O 35、氧化铝溶于强酸溶液:Al2O3+6H+=2Al3++3H2O
高中化学学业水平测试试卷
高中化学学业水平测试 试卷 集团档案编码:[YTTR-YTPT28-YTNTL98-UYTYNN08]
高中化学学业水平测试试卷 化学 一、单项选择题:在每题的四个选项中,只有一个选项是符合要求的(本大题17小题,每小题3分,共51分) 1.科学家目前正在求证一种仅由中个中子组成的微粒,这种微料称为"四中子",下列关于该微粒的说法正确的是() A.呈电中性 B.带四个单位负电荷 C.带四个单位正电荷 D.质量数为2 2.下列物质中属于有机物的是() A.氯化钾 B.二氧化碳 C.碳酸钠 D.乙烷 3.下列气体中不能用浓硫酸干燥的是() A.O2 B.CO2 C.NH3 D.SO2 4.某溶液中滴入KSCN溶液后变红,说明该溶液中存在() A.NO3-B.Fe3+ C.SO42- D.Mg2+ 5.常温下,铁与下列酸溶液作用产生H2的是() A.浓硫酸 B.稀硫酸 C.浓硝酸 D.稀硝酸 6.下列说法中错误的是() A.CO燃烧是放热反应 B.H2SO4与NaOH反应是放热反应 C.CaO与H2O反应是吸热反应 D.CaCO3受热分解是吸热反应 7.下列化学反应中,H2SO4作为氧化剂的是() A.2NaOH+H2SO4=Na2SO4+2H2O B.C+2H2SO4(浓)CO2↑+2SO2↑+2H2O C.BaCl2+H2SO4=BaSO4↓+2HCl D.CuO+H2SO4=CuSO4+H2O 8.下列离子在溶液中可以大量共存的一组是() A.H+ Na+ OH- B.Na+ NO3- Cl- C.K+ H+ HCO3- D.Ca2+ SO42- CO32- 9.下列关于苯的说法中,正确的是() A.在空气中燃烧时产生较多的黑烟 B.分子中含有三个C-C键和三个C=C键
高中化学竞赛配位化合物
高中化学竞赛专题练习 配位化合物 1、画出下列配合物可能有的旋光异构体的结构。 (1)[FeCl2(C2O4)en] ;(2) [Co(C2O4)3]3-;(3)[Co(en)2Cl2]+。 2、一些顺式铂的配合物可以作为活性抗癌药剂,如cis-PtCl4(NH3)2、cis-PtCl2(NH3)2、 cis-PtCl2(en)等。实验测得它们都是反磁性物质,试用杂化轨道理论说明它们的成键情况,指出它们是内轨型配合物还是外轨型配合物。 3、已知下列配合物的磁矩,根据价键理论指出各中心离子的价层电子排布、轨道杂化类型、 配离子空间构型,并指出配合物属内轨型还是外轨型。 (1) Mn(CN)63-(μ=2.8 B.M); (2) Co(H2O)62+(μ=3.88 B.M); 4、实验测得配离子Co(NH3)63+是反磁性的,问它属于什么几何构型?根据价键理论判断中心 离子采取什么杂化状态? 5、通过计算说明,在标准状况下金难溶于水,但用氰化钠溶液却可以浸取金矿砂中的金。 已知E°(Au+/Au)=1.69V,E°(O2/OH-)=0.401V,K稳°[Au(CN)2-]=2×1038 6、已知E°(Fe3+/Fe2+)=0.771V,E°(I2/I-)=0.535V,在标准状况下Fe3+可以将I-氧化为单 质I2。通过计算说明在标准状况下,下列反应能否自发进行? 2Fe(CN)63-+2I-=Fe(CN)64-+I2 已知K稳°(Fe(CN)63-)=1.0×1042,K稳°(Fe(CN)64-)=1.0×1035。 7、已知E°(Fe3+/Fe2+)=0.771V,E°(Sn4+/Sn2+)=0.14V,K稳°(FeF3)=1.15×1012。通过计算说明,下列氧化还原反应在标准状态下能否发生。若能发生写出有关的化学反应方程式。 (1)向FeCl3溶液中加入NaF,然后再加SnCl2; (2)向Fe(SCN)3溶液中加入SnCl2(K稳°(Fe(SCN)3)=4.4×105); (3)向Fe(SCN)3溶液中加入KI(E°(I2/I-)=0.535V)。 8、某Ⅷ族不活泼金属A溶于足量的王水生成B的溶液(A的含量为47.60%);将SO2通入B 的溶液中,得到C的溶液(A的含量为57.56%)。已知B、C的组成元素完全相同,且阴离子所带电荷也相同。 (1)通过计算推理,确定A的元素符号; (2)写出所涉及反应的化学方程式。 (3)画出B、C阴离子的空间构型。 9、铝与三乙胺形成的单核配合物是电中性分子,实验测得其氢的质量分数为14.32%,画出 它的立体结构,指出中心原子的氧化态和杂化类型。要给出推理过程。 10、将2,2-联吡啶,冰醋酸和过氧化氢的混合物在75℃时水浴加热3小时后,析出细小的 针状晶体A。A可作为配体与许多过渡金属生成配合物,如与铬形成红紫色配合物B:CrA x Cl y(ClO4)z·H2O,元素分析结果如下:Cr 8.43%、C 38.95%、H 2.94%、Cl 17.25%、N 9.08%、O 23.35%。 (1)若A是双齿配体,易配位形成七元环,写出A的结构式。 (2)确定B的化学式,并计算该化合物的磁矩。 (3)写出B中的配离子所有可能的结构式。
高中化学学业水平考试必背知识点
20XX 年高中毕业会考 高中化学学业水平测试必修1、2必背考试点 1、化合价(常见元素的化合价): Na 、K 、Ag 、H :+1 F :—1 Ca 、Mg 、Ba 、Zn :+2 Cl :—1,+1,+5,+7 Cu :+1,+2 O :—2 Fe :+2,+3 S :—2,+4,+6 Al :+3 Mn :+2,+4,+7 N :—3,+2,+4,+5 2、氧化还原反应 定义:有电子转移(或者化合价升降)的反应 本质:电子转移(包括电子的得失和偏移) 特征:化合价的升降 氧化剂(具有氧化性)——得电子——化合价下降——被还原——还原产物 还原剂(具有还原性)——失电子——化合价上升——被氧化——氧化产物 口诀:得——降——(被)还原——氧化剂 失——升——(被)氧化——还原剂 四种基本反应类型和氧化还原反应关系: 3、金属活动性顺序表 K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 还 原 性 逐 渐 减 弱 4、离子反应 定义:有离子参加的反应 电解质:在水溶液中或熔融状态下能导电的化合物 非电解质:在水溶液中和熔融状态下都不能导电的化合物 离子方程式的书写步骤: 第一步:写。写出化学方程式 第二步:拆。易溶于水、易电离的物质拆成离子形式;难溶(如CaCO 3、BaCO 3、BaSO 4、AgCl 、AgBr 、 AgI 、Mg(OH)2、Al(OH)3、Fe(OH)2、Fe(OH)3、Cu(OH)2等),难电离(H 2CO 3、H 2S 、CH 3COOH 、HClO 、H 2SO 3、NH 3·H 2O 、H 2O 等),气体(CO 2、SO 2、NH 3、Cl 2、O 2、H 2等),氧化物(Na 2O 、MgO 、Al 2O 3等)不拆 第三步:删。删去方程式两边都有的离子 第四步:查。检查前后原子守恒,电荷是否守恒。 离子共存问题判断: ①是否产生沉淀(如:Ba 2+和SO 42-,Fe 2+和OH -); ②是否生成弱电解质(如:NH 4+和OH -,H +和CH 3COO -)
高中化学竞赛辅导无机化学16.2配位化合物的同分异构现象知识点素材
§16-2 配位化合物的同分异构现象 The Isomerism of Complexes 一、总论: 1.Definition:凡是化学组成相同的若干配合物,因原子间的连接方式或空间排列方式的不同而引起的结构和性质不同的现象,称为配合物的同分异构现象(isomerism)。 2.Classification (1) 化学结构异构现象(chemical structure isomerism):化学组成相同,原 子间的连接方式不同而引起的异构现象,称为化学结构异构现象。例如: [Co(NH3)5(NO2)]2+和 [Co(NH3)5(ONO)]2+ (2) 立体异构现象(stereo isomerism):化学组成相同,空间排列不同而引起 的异构现象,称为立体异构现象。例如:Pt(NH3)2Cl2
cis – 二氯·二氨合铂(II) trans - 二氯·二氨合铂(II) 二、化学结构异构现象,大致分为五类: Ionization isomerism, Hydrate isomerism, Linkage isomerism, Coordination isomerism, Polymerization isomerism. 1.Ionization isomerism (1) Two coordination compounds which differ in the distribution of ions between those directly coordinated and counter-ions present in the crystal lattice are called ionization isomers. (2) e.g. [Cr(NH 3)5Br]SO 4 and [Cr(NH 3)5SO 4]Br 2.Hydrate isomerism (Solvent isomerism) (1) Hydrate isomerism is similar to ionization isomerism except that an uncharged ligand changes from being coordinated to a free-lattice position whilst another ligand moves in the opposite sense. (2) e.g. [Cr(H 2O)6]Cl 3 ,[Cr(H 2O)5Cl]Cl 2·H 2O ,[Cr(H 2O)4Cl 2]Cl ·2H 2O 3.Linkage isomerism (1) The first example of this type of isomerism was provided by J φrgensen, W erner’s contemporary. His method of preparation was as follows : A"solution "Cl]Cl )[Co(NH 23N aN O H Cl N H 253???→???→???→? red Co(ONO)]Cl )[(NH A"solution "253cold in stand let ?????→? yellow )]Cl Co(NO )[(NH A"solution "2253H Cl conc heat ???→???→?? (2) It deals with a few ligands (ambidenatate) that are capable of bonding through are type of donor atom in one situation not a different atom in another complex. Some authors refer to this type of isomerism as “structura l i somerism” but inasmuch as all isomerism is basically “structural” , the term linkage isomerism is preferable. (3) e.g. +252SCN]O)[Cr(H and +252NCS]O)Cr(H [ +]SSO )Co(NH [353 and +S]OSO )[Co(NH 253 4.Coordination isomerism (1) This may occur only when the cation and anion of a salt are both complexes, the two isomers differing in the distribution of ligands between the cation and anion (2) e.g. ]Cr(Ox)][)Co(NH [363 and ]][Co(Ox))[Cr(NH 363 ] ][Cr(SCN))[Cr(NH 663 and ](SCN))][Cr(NH (SCN))[Cr(NH 423243 ]PtCl ][)[Pt(NH 643 and ]][PtCl Cl )[Pt(NH 4243
3.2 金属材料--【新教材】人教版(2019)高中化学必修一基础知识讲义
第二节金属材料 (一)铁合金 一、合金 1、定义:合金是由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质 2、成分:一种金属为主,另一种或几种是金属或非金属 3、制作过程:熔合 4、特性:(1)合金的硬度一般比各成分金属的大 (2)合金的熔点一般比各成分金属的低 (3)合金的物理、化学及机械性能一般优于各成分金属 注:1、合金是混合物 2、稀土元素被称为“冶金工业的维生素” 5、结构变化:纯金属中,所有原子大小、形状都相同,排列规整;加入其它元素的原子后,改变 了金属原子有规则的层状排列,使原子层之间的相对滑动变得困难,导致合金的硬 度变大。 二、铁合金 (1)铁碳合金 1、分类:含碳量为0.03%-2%,为钢;含碳量为2%-4.3%,为生铁。 2、性能及用途:生铁硬度大、抗压、性脆、可以铸造成型,是制造机座、管道的重要材料; 钢有良好的延展性,机械性能良好,可以锻轧和铸造,广泛用于制造机械和交通工具等 (2)钢 钢是用量最大、用途最广的合金。根据化学成分,钢分为两大类:碳素钢和合金钢 1、碳素钢:铁与碳的合金 2、合金钢:也叫特种钢,在碳素钢中适量加入一种或几种合金元素,使钢的组织结构发生变化,从而具有特殊性能 例:不锈钢是最常见的一种合金钢,它的合金元素主要是铬和镍。 不锈钢特点:比较稳定,不易生锈,有很强的抗腐蚀能力;
不锈钢用途:医疗器材、厨房用具、餐具、地铁列车车体 (二)铝和铝合金 一、铝的性质 1、物理性质:铝是地壳中含量最多的金属。银白色,有金属光泽的固体,熔点较低,硬度较小,是电和热的良导体。常温下在空气中常被氧化成致密的氧化膜(Al2O3熔点2050℃),这层膜起到保护内部金属Al(熔点660℃)的作用,所以活泼的Al可以在空气中稳定存在。 2、化学性质: (1)与非金属反应:①与氧气反应:4Al+3O2点燃 2Al2O3 ②与氯气反应:2Al+3Cl2点燃 2AlCl3 (2)与酸反应:2Al+6HCl=2AlCl3+3H2↑ 2Al+6H+=2Al3++3H2↑ (3)与碱反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 2Al+2OH―+2H2O=2AlO2-+3H2↑实质:先与水反应,生成的氢氧化铝再与强碱溶液反应 (4)与某些氧化物反应(即铝热反应):2Al+Fe2O3高温2Fe+ Al2O3 3、铝合金的用途 ①铝合金:向铝中加入少量法合金元素,如Cu、Mg、Si、Mn、Zn及稀土元素等,可制成铝合金。铝合金是目前用途广泛的合金之一。 ②硬铝是一种铝合金,密度小,强度高,具有较强的抗腐蚀能力,是制造飞机和宇宙飞船的理想材料。 二、氧化铝的性质 1、物理性质:白色固体,难溶于水,熔点高(2050℃),很坚固。 天然的氧化铝俗名叫刚玉,机械手表中的轴承就是用它制作的,手表中的“17钻”就是由17个刚玉做成的轴承; 若刚玉中混入了微量的铬,就成了红宝石,若混入了微量的钛或铁,就成了蓝宝石。 2、化学性质:两性氧化物:既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物 ①与酸反应:Al2O3+6HCl=2AlCl3+3H2O Al2O3+6H+=2Al3++3H2O ②与强碱反应:Al2O3+2NaOH=2NaAlO2+H2O Al2O3+2OH-=2AlO2-+H2O 注:铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物 三、氢氧化铝的性质
高中化学方程式(超全版非常推荐)
高中化学方程式(自己整理) 一、非金属单质(F2,Cl2,O2,S,N2,P,C,Si,H) 1、氧化性: F2+H2===2HF (阴暗处爆炸) F2+Xe(过量)==XeF2 2F2(过量)+Xe==XeF4 (XeF4是强氧化剂,能将Mn2+氧化为MnO4–) nF2+2M===2MFn(M表示大部分金属) 2F2+2H2O===4HF+O2(水是还原剂) 2F2+2NaOH===2NaF+OF2+H2O F2+2NaCl===2NaF+Cl2 F2+2NaBr===2NaF+Br2 F2+2NaI===2NaF+I2 7F2(过量)+I2===2IF7 F2+Cl2(等体积)===2ClF (ClF属于类卤素:ClF+H2O==HF+HClO ) 3F2(过量)+Cl2===2ClF3(ClF3+3H2O==3HF+HClO3 ) Cl2+H22HCl (将H2在Cl2点燃;混合点燃、加热、光照发生爆炸) 3Cl2+2P2PCl3Cl2+PCl3PCl5 Cl2+2Na2NaCl 3Cl2+2Fe2FeCl3Cl2+Cu CuCl2 Cl2+2FeCl2===2FeCl3 (在水溶液中:Cl2+2Fe2+===2Fe3++3Cl-) Cl2+2NaBr===2NaCl+Br2Cl2+2Br-=2Cl-+Br2 Cl2+2KI===2KCl+I2Cl2+2I-=2Cl-+I2 3Cl2(过量)+2KI+3H2O===6HCl+KIO3 3Cl2+I–+3H2O=6H++6Cl–+IO3– 5Cl2+I2+6H2O===2HIO3+10HCl 5Cl2+I2+6H2O=10Cl–+IO3–+12H+ Cl2+Na2S===2NaCl+S↓Cl2+S2–=2Cl–+S↓ Cl2+H2S===2HCl+S↓(水溶液中:Cl2+H2S=2H++2Cl–+S↓ Cl2+SO2+2H2O===H2SO4+2HCl Cl2+SO2+2H2O=4H++SO42–+2Cl– Cl2+H2O2===2HCl+O2Cl2+H2O2=2H++Cl–+O2 2O2+3Fe Fe3O4O2+K===KO2 S+H2H2S 2S+C CS2S+Zn ZnS S+Fe FeS (既能由单质制取,又能由离子制取) S+2Cu Cu2S (只能由单质制取,不能由离子制取) 3S+2Al Al2S3(只能由单质制取,不能由离子制取)
第09讲 络合物(配位化合物)化学基础
高中化学奥林匹克竞赛辅导讲座 第9讲络合物(配位化合物)化学基础 【竞赛要求】 配位键。重要而常见的配合物的中心离子(原子)和重要而常见的配位(水、羟离子、卤离子、拟卤离子、氨分子、酸根离子、不饱和烃等)。螯合物及螯合效应。重要而常见的络合剂及其重要而常见的配合反应。配合反应与酸碱反应、沉淀反应、氧化还原反应的联系(定性说明)。配合物几何构型和异构现 的颜色。路易斯酸碱的概念。象基本概念。配合物的杂化轨道理论。八面体配合物的晶体场理论。Ti(H2O)+3 6 【知识梳理】 一、配合物基本知识 1、配合物的定义 由中心离子(或原子)和几个配体分子(或离子)以配位键相结合而形成的复杂分子或离子,通常称为配位单元。凡是含有配位单元的化合物都称作配位化合物,简称配合物,也叫络合物。 [Co(NH3)6]3+,[Cr(CN)6]3–,Ni(CO)4都是配位单元,分别称作配阳离子、配阴离子、配分子。 [Co(NH3)6]Cl3、K3[Cr(CN)6]、Ni(CO)4都是配位化合物。[Co(NH3)6]、[Cr(CN)6] 也是配位化合物。判断的关键在于是否含有配位单元。 思考:下列化合物中哪个是配合物 ①CuSO4·5H2O②K2P t Cl6 ③KCl·CuCl2 ④Cu(NH2CH2COO)2 ⑤KCl·MgCl2·6H2O ⑥Cu(CH3COO)2 注意:①配合物和配离子的区别 ②配合物和复盐的区别 2、配合物的组成 中心离子 内界单齿配体 配位体多齿配体 配合物螯合配体 外界 (1)配合物的内界和外界 以[Cu(NH3)4]SO4为例: [Cu(NH3)4]2+ SO-2 4 内界外界 内界是配位单元,外界是简单离子。又如K3[Cr(CN)6] 之中,内界是[Cr(CN)6]3–,外界是K+。可以无外界,如Ni(CO)4。但不能没有内界,内外界之间是完全电离的。 (2)中心离子和配位体 中心离子:又称配合物的形成体,多为金属(过渡金属)离子,也可以是原子。如Fe3+、Fe2+、Co2+、Ni2+、Cu2+、Co等,只要能提供接纳孤对电子的空轨道即可。 配位体:含有孤对电子的阴离子或分子。如NH3、H2O、Cl-、Br-、I-、CN-、CNS-等。
最全的高中化学方程式大全
最全的高中化学方程式大全 一、非金属单质(F2,Cl2,O2,S,N2,P,C,Si,H) 1、氧化性: F2+H2===2HF(阴暗处爆炸) F2+Xe(过量)==XeF2 2F2(过量)+Xe==XeF4(XeF4是强氧化剂,能将Mn2+氧化为MnO4–) nF2+2M===2MFn(M表示大部分金属) 2F2+2H2O===4HF+O2(水是还原剂) 2F2+2NaOH===2NaF+OF2+H2O F2+2NaCl===2NaF+Cl2 F2+2NaBr===2NaF+Br2 F2+2NaI===2NaF+I2 7F2(过量)+I2===2IF7 F2+Cl2(等体积)===2ClF(ClF属于类卤素:ClF+H2O==HF+HClO) 3F2(过量)+Cl2===2ClF3(ClF3+3H2O==3HF+HClO3) Cl2+H22HCl(将H2在Cl2点燃;混合点燃、加热、光照发生爆炸) 3Cl2+2P2PCl3Cl2+PCl3PCl5Cl2+2Na2NaCl 3Cl2+2Fe2FeCl3Cl2+CuCuCl2 Cl2+2FeCl2===2FeCl3(在水溶液中:Cl2+2Fe2+===2Fe3++3Cl) Cl2+2NaBr===2NaCl+Br2Cl2+2Br=2Cl+Br2 Cl2+2KI===2KCl+I2Cl2+2I=2Cl+I2 3Cl2(过量)+2KI+3H2O===6HCl+KIO3 3Cl2+I–+3H2O=6H++6Cl–+IO3– 5Cl2+I2+6H2O===2HIO3+10HCl 5Cl2+I2+6H2O=10Cl–+IO3–+12H+ Cl2+Na2S===2NaCl+S↓Cl2+S2–=2Cl–+S↓
高中化学学业水平测试知识点总结
高中化学学业水平测试知识点总结 专题一物质的分类、结构、反应及实验基本操作一、物质的分类及转化 溶液 混合物胶体 浊液有机化合物 物质化合物 纯净物无机化合物 单质 金属 二、化学反应的类型 1、四种基本反应类型:化合反应分解反应置换反应复分解反应 2、四种基本反应类型与氧化还原反应的关系: 置换反应一定是氧化还原反应,复分解反应一定不是氧化还原反应,化合反应、分解反应可能是氧化还原反应 3、氧化还原反应 本质:电子的转移(得失或者偏移)特征:化合价的改变(判断氧化还原反应的依据) 概念:升(化合价)---失(电子)---氧(氧化反应)------还(还原剂) 降(化合价)--- 得(电子)---还(氧化反应)------ 氧(还原剂) 表示方法: 单线桥双线桥 2e- 失去2e- -1 0 -1 0 0 -1 2 KBr + Cl2====Br2+2KCl 2 KBr + Cl2 ==== Br2+2KCl 得到2e- 三、物质的量 1、定义:表示一定数目微粒的集合体符号:n 单位:摩尔 2、阿伏加德罗常数:0.012kgC-12中所含有的碳原子数。用N A表示。约为6.02x1023 N 3、微粒与物质的量的关系:公式:n= NA 4、摩尔质量:单位物质的量的物质所具有的质量用M表示单位:g/mol 数值上等于该物质的
式量 5、质量与物质的量的关系:公式:n=M m 6、体积与物质的量的关系:公式:n= Vm V 标准状况下 ,1mol 任何气体的体积都约为22.4l 7、阿伏加德罗定律:同温同压下, 相同体积的任何气体都含有相同的分子数 8、物质的量浓度:单位体积溶液中所含溶质B 的物质的量。符号C B 单位:mol/l 9、物质的量浓度与物质的量的关系:公式:C B = V nB 10、物质的量浓度的配制 配制前要检查容量瓶是否漏水 步骤:①. 计算 m=c ×v ×M ②.称量③. 溶解 ④.转移 (洗涤2---3次 洗涤液转入容量瓶) ⑤.定容⑥.摇匀⑦. 装瓶贴签 四、分散系 溶 液 胶体 浊液 1、分散质大小(nm ) <10-9 10-9 ~10-7 >10-7 2、胶体的性质:丁达儿现象(光亮的通路 ) 用于 区分溶液与胶体 3、电解质:在水溶液中或者熔化状态下能导电的化合物 4、非电解质:在水溶液中和熔化状态下能导电的化合物 蔗糖 酒精 SO 2 CO 2 NH 3等 强酸HCl H 2SO 4 HNO 3 5、强电解质:在水溶液中能全部电离的电解质 强碱NaOH KOH Ca (OH )2 Ba (OH )2 大多数的盐 弱酸 弱电解质:在水溶液中能部分电离的电解质 弱碱 水 五、物质的分离与提纯 1、过滤法:适用于分离一种组分可溶,另一种不溶的固态混合物 如:粗盐的提纯 2、蒸发结晶:混合物中各组分物质在溶剂中溶解性的差异 3、蒸馏法:适用于分离各组分互溶,但沸点不同的液态混合物。如:酒精与水的分离 主要仪器: 蒸馏烧瓶 冷凝器 4、分液:分离互不相容的两种液体 5、萃取:溶质在互不相溶的溶剂里溶解度不同 溴水 CCl4 分层 上层无色 下层橙红色 不用酒精萃取 六、离子的检验 焰色反应 钠焰色:黄色 钾的焰色:紫色 (透过蓝色钴玻璃) Cl-检验 :加硝酸银产生的白色沉淀不溶解于稀硝酸 SO42-检验: 加Ba(NO3)2产生的白色沉淀不溶解于稀硝酸 NH 4+ 检验:加入NaOH 加热产生气体使湿润的红色石蕊试纸变蓝 Fe 3+检验:加入KSCN 溶液出现红色 Fe3++3SCN-==Fe (SCN )3 Al 3+检验:加入NaOH 先出现白色沉淀后沉淀消失 七、原子结构 质子 Z 原子核 1、原子 A Z X 中子 N = A-Z
高中化学方程式大全(绝对全)
高考总复习之高中化学方程式总结 化学 第一册 第一章 卤素 第一节 氯气 1、NaCl 2Cl Na 22?? →?+点燃 2、22CuCl Cl Cu ?? →?+点燃 3、32FeCl 2Cl 3Fe 2??→?+点燃 4、HCl 2Cl H 22?? ??→?+点燃(光照) 5、32PCl 2Cl 3P 2??→?+点燃 6、523PCl Cl PCl →+ 、 7、HClO HCl O H Cl 22+→+ 8、O H 2CaCl ClO Ca Cl 2OH Ca 222222++→+)()( 9、HClO 2CaCO O H CO ClO Ca 3222+↓→++)( 10、O H NaCl NaClO Cl NaOH 222++→+ 11、↑++?→? +? 2222Cl O H 2MnCl MnO HCl 4 12、O H 8Cl 5KCl 2MnCl 2HCl 16KMnO 22224+↑++→+(浓) 13、2O HCl 2HClO 2+?? →?见光 第二节 氯化氢 14、↑+→+HCl NaHSO SO H NaCl 44 2(浓) 15、↑+?→? +?HCl SO Na NaCl NaHSO 424 《 16、↑+?→?+?HCl 2SO Na SO H NaCl 2424 2(浓)(14、15结合)
17、33HNO AgCl AgNO HCl +↓→+ 18、33NaNO AgCl AgNO NaCl +↓→+ 19、33KNO AgCl AgNO KCl +↓→+ 20、↑++→+2223CO O H CaCl CaCO HCl 2 第三节 氧化还原反应 21、O H Cu H CuO 22+?→? +? 22、O H 2NO 4CO HNO 4C 2223+↑+↑→+ 23、O H 3NO NH NO Zn 4HNO 10Zn 4234233++?→?+?)((极稀) 24、4243324SO H 15PO H 6P Cu 5O H 24CuSO 15P 11++→++ ( 25、O H 3KCl Cl 3HCl 6KClO 223+↑→+(浓) 26、O H 3NO NH NO Mg 4HNO 10Mg 4234233++?→?+? )((极稀) 27、O H 31SO K SO Fe 9SO Cr SO H 31O Fe 6O Cr K 2423423424243722+++→++)()( 28、↑+↑+→++2223CO 3N S K S C 3KNO 2 第四节 卤族元素 29、HF 2F H 22→+ 30、HBr 2Br H 22→+ 31、HI 2I H 22→+ 32、22Br NaCl 2Cl NaBr 2+→+ 33、22I KCl 2Cl KI 2+→+ , 34、22I KBr 2Br KI 2+→+ 35、33NaNO AgBr AgNO NaBr +↓→+ 36、33KNO AgI AgNO KI +↓→+
高中化学毕业班下学期开学考试试题
河北定州中学2017-2018学年第 二学期高四化学开学考试 一、单选题 1.下列指定反应的离子方程式正确的是 A. NO2通入水中: 3NO2+H2O=2H++2NO2-+NO B. Fe(OH)3溶于HI 溶液: Fe(OH)3+3H+=Fe3++3H2O C. (NH4)2SO4溶液中加入Ba(OH)2溶液: NH4++SO42-+Ba2++OH-=BaSO4↓+NH3·H2O D. 向NaAlO2溶液中滴入NaHCO3溶液产生白色沉淀:AlO2-+HCO3-+H2O=Al(OH)3↓+CO2 3 2.2.一种从含Br-废水中提取Br2的过程,包括过滤、氧化、正十二烷萃取及蒸馏等步骤。已知:
下列说法正确的是() A. 用甲装置过滤时,需不断搅拌 B. 用乙装置将Br-氧化为Br2 C. 丙装置中用正十二烷而不用CCl4,是因为其密度小 D. 可用装置丁进行蒸馏,先收集正十二烷再收集Br2 3.锂—铜空气燃料电池(如图)容量高、成本低,该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法错误的是 A. 整个反应过程中,氧化剂为O2 B. 放电时,正极的电极反应式为:Cu2O+H2O+2e-=2Cu+2OH- C. 放电时,当电路中通过0.1 mol电子的电量时,有0.1 mol Li+透过固体电解质向Cu极移动,有标准状况下1.12 L氧气参与反应 D. 通空气时,铜被腐蚀,表面产生Cu2O 4.设N A为阿伏加德罗常数的值,下列说法正确的是 A. 硅晶体中,有N A个Si就有2 N A个Si—Si键 B. 常温常压下,等物质的量浓度的Na2CO3与Na2S溶液中Na+数目相等 C. 惰性电极电解食盐水,若线路中通过2 N A个电子的电量时,则阳极产生气体22.4 L D. 标准状况下,2 mol Na2O2与44.8 L SO2完全反应,转移的电子数目为2 N A 5.下列关于有机化合物的说法正确的是 A. 制备聚四氟乙烯的单体属于不饱和烃 B. 分子式为C4H10O的醇有4种同分异构体 C. 苯乙烯()分子的所有原子不可能在同一平面上 D. 异丁烯及甲苯均能使溴水褪色,且褪色原理相同 6.已知pC=-lgc;Ksp[Cu(OH)2]=2.2×10-20和Ksp[Mg(OH)2]=1.8×10-11,测得两种金属离子的PC与pH的变化关系如下图所示。下列说法正确的是
高中化学学业水平考试知识点。。。
化学必修1知识点 主题1 认识化学科学 一化学科学发展史 1 分析空气成分的第一位科学家——拉瓦锡; 2 近代原子学说的创立者——道尔顿(英国); 3 提出分子概念——何伏加德罗(意大利); 4 候氏制碱法——候德榜(1926年所制的“红三角”牌纯碱获美国费城万国博览会金奖); 5 金属钾的发现者——戴维(英国); 6 Cl2的发现者——舍勒(瑞典); 7 在元素相对原子量的测定上作出了卓越贡献的我国化学家——张青莲;8 元素周期表的创立者——门捷列夫(俄国); 9 1828年首次用无机物氰酸铵合成了有机物尿素的化学家——维勒(德国);11 镭的发现人——居里夫人。12 人类使用和制造第一种材料是——陶瓷 10 苯是在1825年由英国科学家——法拉第首先发现,德国化学家——凯库勒定为单双键相间的六边形结构,简称凯库勒式; 二化学基本概念 1.分子:分子是能够独立存在并保持物质化学性质的一种微粒。 2.原子:原子是化学变化中的最小微粒。确切地说,在化学反应中原子核不变,只有核外电子发生变化。 (1)原子是组成某些物质(如金刚石、晶体硅、二氧化硅等)和分子的基本微粒。(2)原子是由原子核(中子、质子)和核外电子构成的。 3.离子:离子是指带电荷的原子或原子团。 (1)离子可分为阳离子:Li +、Na + 阴离子:Cl-、OH - (2)存在离子的物质:①离子化合物中:NaCl、CaCl2 、Na2SO 4…②电解质溶液中:盐酸、NaOH溶液等 4.元素:元素是具有相同核电荷数(即质子数)的同一类原子的总称。 (1)元素与物质、分子、原子的区别与联系:从宏观看物质是由元素组成的; 从微观看物质是由分子、原子或离子构成的。 (2)某些元素可以形成不同的单质(性质、结构不同)———同素异形体。 5.同位素:是指同一元素不同核素之间互称同位素,即具有相同质子数,不同中子数的同一类原子互称同位素。如H有三种同位素: 11H、21H、31H(氕、氘、氚)。 6.核素:核素是具有一定数目的质子和一定数目的中子的一种原子。 (1)同种元素可以有若干种不同的核素。 (2)同一种元素的各种核素尽管中子数不同,但它们的质子数和电子数相同。核外电子排布相同,因而它们的化学性质几乎是相同的 7.原子团:原子团是指由多个原子结合成的集体,在许多反应中,原子团作为一个集体参加反应。原子团包括:复杂离子如:酸根离子,有机基团。 8.物理变化和化学变化 物理变化:没有生成其他物质的变化,仅是物质形态的变化。化学变化:变化时有其他物质生成。又叫化学反应。化学变化的特征有新物质生成,伴有放热、发光、变色等现象 变化本质:旧键断裂和新键生成或转移电子等。二者的区别是:前者无新物质生成,仅是物质形态、状态的变化。 9.混合物:由两种或多种物质混合而成的物质叫混合物,一般没有固定的熔沸点; 10.纯净物:由一种物质组成的物质叫纯净物。它可以是单质或化合物。由同素异形体组成的物质为混合物,如红磷和白磷。由不同的同位素原子组成同一分子的物质是纯净物,如H2O与D2O混合为纯净物。 11.单质:由同种元素组成的纯净物叫单质。单质分为金属单质与非金属单质两种。 12.化合物:由不同种元素组成的纯净物叫化合物。 从不同的分类角度,化合物可分为多种类型,如:离子化合物和共价化合物; 电解质和非电解质;无机化合物和有机化合物; 酸、碱、盐和氧化物等。 13.酸:电离理论认为:电解质电离出的阳离子全部是H +的化合物叫做酸。 常见强酸如:HClO4、H 2SO 4、HCl、HBr、HI、HNO3… 常见弱酸如:H2SO3、H 3PO4、HF、HNO2、CH3COOH、HClO、H2CO3、H2SiO3、HAlO2… 14.碱:电离理论认为,电解质电离时产生的阴离子全部是OH-的化合物叫碱。 常见强碱如:NaOH、KOH、Ca(OH)2、Ba(OH)2… 常见弱碱如:NH3.H2O、Mg(OH)2、Al(OH)3、Fe(OH)3… 15.盐:电离时生成金属阳离子(或NH4+)和酸根离子的化合物叫做盐。盐的分类①正盐 ②酸式盐③碱式盐④复盐(电离后生成两种或两种以上的金属阳离子或铵根的盐) 16.氧化物:由两种元素组成,其中一种是氧元素的化合物叫氧化物,氧化物的分类方法,按组成分:金属氧化物、非金属氧化物,按性质分:不成盐氧化物、成盐氧化物、酸性氧化物、碱性氧化物、两性氧化物、过氧化物等 17.同素异形体:由同种元素所形成的不同的单质为同素异形体。(1)常见同素异形体:红磷与白磷;O2与O3;金刚石与石墨。
