用清除有机自由基DPPH法评价竹叶提取物抗氧化能力

第28卷,第7期 光谱学与光谱分析Vol 128,No 17,pp157821582
2008年7月 Spectroscopy and Spectral Analysis J uly ,2008
用清除有机自由基DPPH 法评价竹叶提取物抗氧化能力
郭雪峰,岳永德3,汤 锋,王 进,姚 曦
国际竹藤网络中心,国家林业局竹藤科学与技术重点开放实验室,北京 100102
摘 要 通过对1,12二苯基苦基苯肼(DPP H )溶液吸收光谱、DPP H 溶液反应体系的研究,得出以下结论,
分光光度法测定DPP H 溶液反应体系的测定波长为51814nm ,反应体系为4100mL 25717mg ?L -1的DP 2P H 溶液中加1mL 不同浓度的抗氧化剂,反应体系加入抗氧化剂后反应时间为40min ;用上述方法研究评价合成抗氧化剂叔丁基对苯二酚(TB HQ )和2,62二叔丁基对甲酚(B H T )对DPP H 自由基清除率和浓度的关系,以IC 50值(清除率为50%时,抗氧化剂的浓度值)作为评价指标,测得合成抗氧化剂和效果最好竹叶提取物样品IC 50值分别为,TB HQ (21114mg ?L -1),B H T (42109mg ?L -1),M40(108140mg ?L -1),M40等竹叶提取物可以作为天然抗氧化剂进行开发。
关键词 竹叶提取物;1,12二苯基苦基苯肼;清除率;IC 50值中图分类号:TS20112 文献标识码:A 文章编号:100020593(2008)0721578205
收稿日期:2007209208,修订日期:2007212218
基金项目:国家“十一五”科技支撑项目(2006BAD19B08)和国际竹藤网络中心基本科研业务费专项资金(06/072B14)资助 作者简介:郭雪峰,1972年生,国际竹藤网络中心讲师 3通讯联系人 e 2mail :yueyd @https://www.360docs.net/doc/4d1055327.html,
引 言
竹叶作为一种“药食两用的天然植物”已被广大消费者所
接受,竹叶提取物主要功能性成分为竹叶黄酮糖苷,具有抗氧化和抑菌活性,可以作为一种生物黄酮类保健营养素进行开发,前景广阔。迄今为止,国内外用于评价植物抗氧化能力的方法已有很多,如硫氰酸盐(thiocyanate )法[1]、硫代巴比妥酸(thiobarbituric acid ,TBA )法[2]、抗氧化能力指数法(oxygen radicalabsorbance capacity ,ORAC )[3]、化学发光法[4]等,还有很多清除自由基的检测评价方法[528],这些方法都有各自的不足之处。1,12二苯基苦基苯肼(1,12Diphenyl 222picrylhydrazyl ,DPP H )检测法是通过分子中1个稳定的DPP H 自由基与抗氧化剂提供的1个电子配对结合,使DP 2P H 的特征紫色消失,因此可用于抗氧化剂清除自由基能力的评价。近年来,国内外已有人初步利用DPP H 溶液的紫红色吸光度变化作为清除自由基能力的分光光度测定[9212],但其准确性、灵敏度和可行性还需进一步系统的探讨。
1 材料和方法
111 仪器和试剂
Ultrospec 3300pro 分光光度计,英国Biochrom 公司;1,12二苯基苦基苯肼(DPP H ),Fluka 公司;叔丁基对苯二酚
(TB HQ ),北京科华特种试剂朕合开发中心;2,62二叔丁基
对甲酚(B H T ),国药集团化学试剂有限公司;乙醇、AB 28大
孔树脂等均为国产分析纯试剂。112 竹叶材料及前处理方法
毛竹(phy llostachys edulis )叶于2006年9月采自江苏南京林业大学竹种园。取6000g 毛竹叶粉,95%乙醇,温度60℃,回流提取4次,提取液过滤浓缩得竹叶提取物浸膏。竹叶提取物浸膏溶解于95%乙醇后过AB 28大孔树脂柱,分别用纯水、20%乙醇、40%乙醇、60%乙醇、80%乙醇、丙酮洗脱,水洗脱组分弃用,其他洗脱组分浓缩得干膏,备用。各洗脱组分分别简称如下:M20,毛竹叶提取物浸膏过AB 28大孔树脂柱,水洗脱后,20%乙醇洗脱下组分;M40,20%乙醇洗脱后,40%乙醇洗脱下组分;M60,40%乙醇洗脱后,60%乙醇洗脱下组分;M80,60%乙醇洗脱后,80%乙醇洗脱下组分;MA ,80%乙醇洗脱后,丙酮洗脱下组分。113 溶液配制11311 样品试液的配制
分别称取合成抗氧化剂叔丁基对苯二酚(TB HQ )012669g ,2,62二叔丁基对甲酚(B H T )013186g ;再分别称取样品M20013207g ,M40013073g ,M60013200g ,M80012952g ,MA 012974g ,用95%乙醇定容到100mL ,得到溶液质量浓度值分别为,TB HQ 21669mg ?mL -1,B H T 31186mg ?mL -1,M2031207mg ?mL -1,M4031073mg ?mL -1,M6031200mg ?mL -1,M8021952mg ?mL -1,MA 21974
mg ?mL -1,待测。11312 DPP H 溶液的配制
准确称取DPP H 试剂011288g ,用95%乙醇溶解定容至500mL 容量瓶中,得浓度为25717mg ?L -1DPP H 贮备液(615×10-4mol ?L -1),摇匀置于冰箱中冷藏备用。114 清除DPPH 自由基能力的测定步骤
(1)在10mL 比色管中依次加入410mL 25717mg ?L -1DPP H 溶液和110mL 95%乙醇,混匀反应稳定后,以95%乙醇液为参比,在λmax 处测吸光值,记为A 0。
(2)在10mL 比色管中依次加入410mL 25717mg ?L -1DPP H 溶液的溶剂(95%的乙醇溶液)和110mL 待测试样溶液,混匀反应稳定后,以95%乙醇液为参比,在λmax 处测吸光值,记为A r 。
(3)在10mL 比色管中依次加入410mL 25717mg ?L -1DPP H 溶液和110mL 待测试液,混匀反应稳定后,以95%乙醇液为参比,在λmax 处测吸光值,记为A s 。
(4)计算自由基清除率(Y ),按式(1)计算。
Y (%)=
1-
As -A r
A 0
×100
(1)
2 结果与分析
211 DPPH 的吸收光谱与测定波长的确定
每个DPP H 分子在溶液中可生成一个稳定的含氮自由基,具有典型紫色,当它与提供1个电子的自由基清除剂作用时,生成无色产物,使溶液的典型紫色变浅。对有机自由基DPP H 溶液在200~700nm 处进行全波长扫描。从图1可以看出,有机自由基DPP H 溶液有两个特征吸收峰32719和51814nm ,加入抗氧化剂叔丁基对苯二酚(TB HQ )、2,62二叔丁基对甲酚(B H T )后两个吸收峰皆降低,加入M40后32719nm 吸收峰被M40成分吸收峰履盖,但51814nm 吸收的降低较显著,故51814nm 处吸收峰的变化可以反应抗氧化剂清除自由基的情况,选用可见光51814nm 的吸收峰的变化来表示DPP H 含量的变化,用以评价竹叶提取物的抗氧化能力,
这与Larrauri [9]等和陈丛瑾[13]等报道DPP H 吸收峰在517nm 基本一致,与彭长连等[14]报道的525nm 略有差异。
Fig 11 Absorb ancy spectra of DPPH
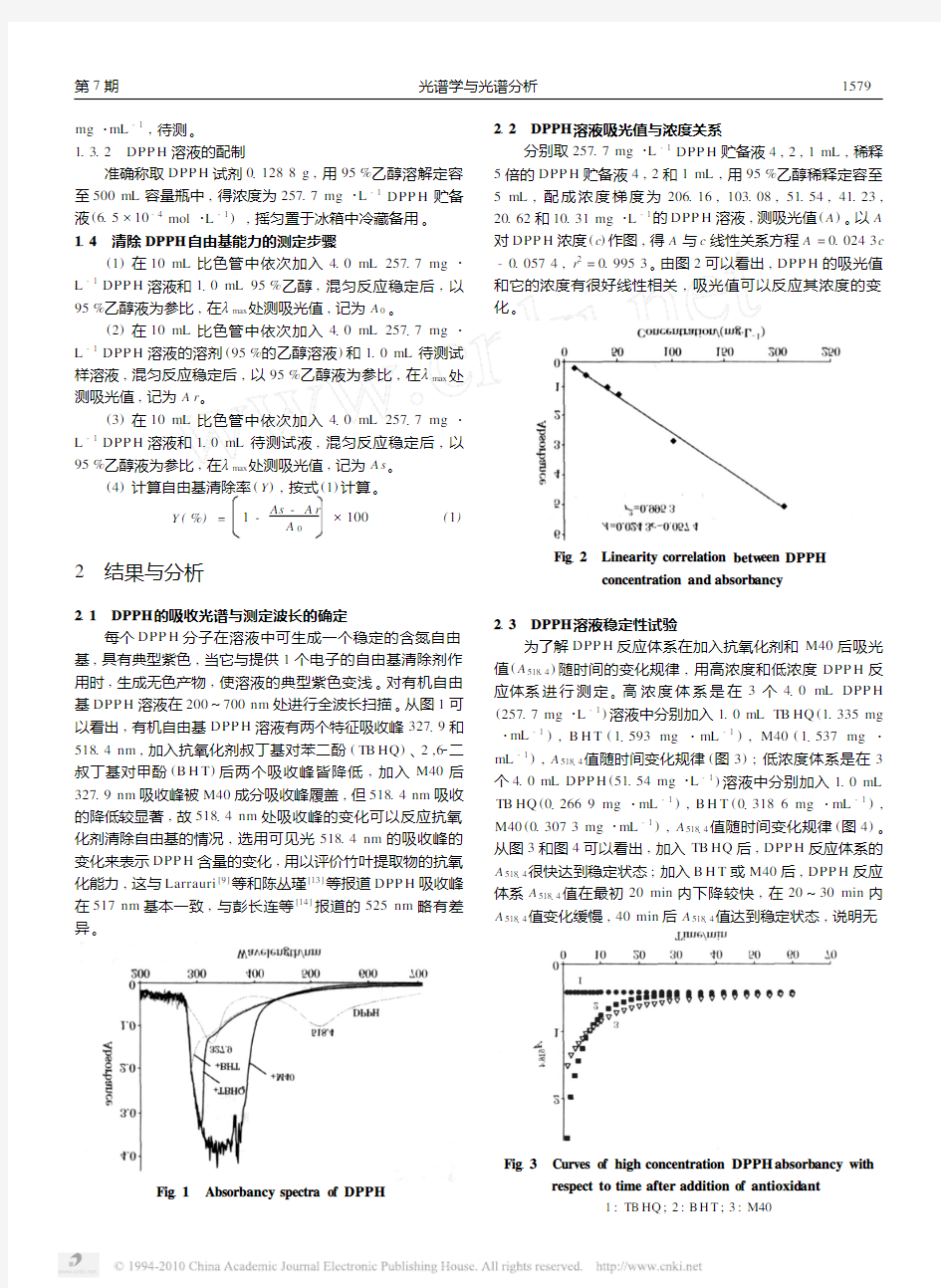
212 DPPH 溶液吸光值与浓度关系
分别取25717mg ?L -1DPP H 贮备液4,2,1mL ,稀释5倍的DPP H 贮备液4,2和1mL ,用95%乙醇稀释定容至5mL ,配成浓度梯度为206116,103108,51154,41123,20162和10131mg ?L -1的DPP H 溶液,测吸光值(A )。以A 对DPP H 浓度(c )作图,得A 与c 线性关系方程A =010243c -0
10574,r 2=019953。由图2可以看出,DPP H 的吸光值和它的浓度有很好线性相关,吸光值可以反应其浓度的变化。
Fig 12 Linearity correlation betw een DPPH
concentration and absorb ancy
213 DPPH 溶液稳定性试验
为了解DPP H 反应体系在加入抗氧化剂和M40后吸光值(A 51814)随时间的变化规律,用高浓度和低浓度DPP H 反应体系进行测定。高浓度体系是在3个410mL DPP H (25717mg ?L -1)溶液中分别加入110mL TB HQ (11335mg ?mL -1),B H T (11593mg ?mL -1),M40(11537mg ?mL -1),A 51814值随时间变化规律(图3);低浓度体系是在3个410mL DPP H (51154mg ?L -1)溶液中分别加入110mL TB HQ (012669mg ?mL -1),B H T (013186mg ?mL -1),M40(013073mg ?mL -1),A 51814值随时间变化规律(图4)。从图3和图4可以看出,加入TB HQ 后,DPP H 反应体系的A 51814很快达到稳定状态;加入B H T 或M40后,DPP H 反应体系A 51814值在最初
20min 内下降较快,在20~30min 内A 51814值变化缓慢,40min 后A 51814值达到稳定状态,说明无
Fig 13 Curves of high concentration DPPH absorb ancy with
respect to time after addition of antioxid ant
1:TB HQ ;2:B H T ;3:M40
9
751第7期 光谱学与光谱分析
Fig 14 Curves of low concentration DPPH absorb ancy with
respect to time after addition of antioxid ant
1:TB HQ ;2:B H T ;3:M40
论加入哪种抗氧化剂,40min 后反应体系的A 51814值都趋于稳定,所以选择DPP H 与抗氧化剂反应的时间为40min ,由于DPP H 反应体系在加入抗氧化剂后,吸光值降低,所以选浓度高的反应体系。214 两种合成抗氧化剂的抗氧化能力及其评价方法
分别对合成抗氧化剂叔丁基对苯二酚(TB HQ )、2,62二叔丁基对甲酚(B H T ),逐级稀释,按114节方法进行测定,计算抗氧化剂对DPP H 的清除率,以清除率Y 对抗氧化剂浓度c 作图。从图5和图6(a )图可以看出:在TB HQ 浓度大于37137mg ?L -1,B H T 浓度大于63172mg ?L -1之后,它们对DPP H 的清除率基本上维持在一个稳定的水平上,导致线性关系很差;从图5和图6(b )图可以看出:两种抗氧化剂对DPP H 的清除率在20%~80%范围内,清除率与浓度呈良好的线性关系
。
由于抗氧化剂浓度较高时,其浓度与DPP H 清除率不成线性关系,因此,清除率不能很好地表示抗氧化剂的活性,也不能很好地对不同的抗氧化剂进行比较。为了便于比较说明不同抗氧化剂的抗氧化性强弱,选用IC 50值作为抗氧化剂的自由基清除能力的测定指标。将待测抗氧化剂配制成系列溶液,测定各浓度抗氧化剂对DPP H 自由基清除率,在清除率20%~80%的范围内,绘制清除率对浓度曲线,计算出清除率为50%时的浓度值,即为IC 50值。采用此法测定的TB 2
HQ ,B H T 的IC 50值分别为21114,42109,IC 50值越低,抗氧
化剂的自由基清除能力越强,可见TB HQ 清除DPP H 自由基能力强于B H T 。
215 竹叶提取物抗氧化能力的评价
按114节方法测定和计算,得各竹叶提取物样品清除率
Y 与浓度c 之间关系(图7),计算出IC 50值分别为:M20
(141111mg ?L -1),M40(108140mg ?L -1),M60(177138mg ?L -1),M80(268121mg ?L -1),MA (837167mg ?
0851光谱学与光谱分析 第28卷
L -1),根据IC 50值,各样品清除DPP H 自由基能力由强到弱
依次为:M40>M20>M60>M80>MA ,其中以M40,
M20,M60清除DPP H 自由基能力较强,M40最强
。
Fig 17 Linearity correlation betw een DPPH scavenging rate and concentration of b amboo leaf extract
3 结 论
通过研究DPP H 溶液吸收光谱,质量浓度与吸光值的关系,以及高和低浓度DPP H 溶液体系中加入TB HQ ,B H T ,M40后的吸光值变化等,得出以下结论,采用分光光度法测定抗氧化剂清除DPP H 自由基能力的测定波长为51814nm ,反应体系为25717mg ?L -1的DPP H 4100mL 溶液中加
1mL 不同浓度抗氧化剂,反应时间40min ,以IC 50值作为评
价抗氧化剂清除DPP H 自由基能力的指标。用此法测定竹叶提取物抗氧化能力,得出M20,M40,M60抗氧化能力较强,M40最强,尽管比合成抗氧化剂TB HQ 和B H T 稍差一些,但考虑到竹叶提取物只是个粗提物,可以说明竹叶提取物M40等样品具有很好的抗氧化能力,IC 50值可以作为评价抗氧化能力的指标。
1
851第7期 光谱学与光谱分析
2851光谱学与光谱分析 第28卷
参考文献
[1] Osawa T,Namiki M A.Agric.Biol.Chem.,1981,45(3):735.
[2] Ottolenghi A.Arch.Biochem.Biophys.,1959,79:355.
[3] Cao G H,Alessio H M,Culter R G.Free Radic.Biol.Med.,1993,14(3):303.
[4] WU Y ong2jun,SHI Jie,QU Ling2bo,et al(吴拥军,石 杰,屈凌波,等).Spectroscopy and Spectral Analysis(光谱学与光谱分析),
2006,26(9):1688.
[5] SON G Huai2en,WEN Ren(宋怀恩,闻 韧).Chinese Journal of Medicinal Chemistry(中国药物化学杂志),2003,13(2):119.
[6] ZH EN G Jing2quan(郑晶泉).Foreign Medical Sciences(Section of Hygiene)(国外医学:卫生学分册),2000,27(1):37.
[7] L IAN G Ai2hui,J IAN G Zhi2liang,ZHOU Su2mei,et al(梁爱惠,蒋治良,周苏梅,等).Spect roscopy and Spectral Analysis(光谱学与光
谱分析),2006,26(11):2113.
[8] ZHAN G Li2wei,WAN G Jin2shan,J IAN G Chong2qiu(张立伟,王金山,江崇球).Spectroscopy and Spectral Analysis(光谱学与光谱分
析),2004,24(9):1103.
[9] Larrauri J A,Sanchez M C,Saura C F.J.Agric.Food Chem.,1998,46(7):2694.
[10] Y okozawa T,Dong E,Natagawa T.J.Agric.Food Chem.,1998,46(6):2143.
[11] Hideyuki L,Kahara T.Bioscience,Biotechnology and Biochem.,2001,65(10):2162.
[12] Ostrakhovich E A,Carles C.Journal of Pharmacological and Toxicological Met hods,2000,44(3):507.
[13] CH EN Cong2jin,HUAN G Ke2ying,L I De2liang,et al(陈丛瑾,黄克瀛,李德良,等).Chemistry and Industry of Forest Product s(林产
化学与工业),2006,26(3):69.
[14] PEN G Chang2lian,CH EN Shao2wei,L IN Zhi2fang,et al(彭长连,陈少薇,林植芳,等).Progress in Biochemistry and Biophysics(生物
化学与生物物理进展),2000,27(6):658.
Detection of Antioxidative C apacity of B amboo Leaf Extract by Scavenging Organic Free R adical DPPH
GUO Xue2feng,YU E Y ong2de3,TAN G Feng,WAN G Jin,YAO Xi
International Centre for Bamboo and Ratten,State Forestry Administration Key Open Laboratory on Bamboo and Rattan Science and Technology,Beijing 100102,China
Abstract By studying on absorption spectrum of DPP H solution and DPP H reaction system,the conclusion was drawn as fol2 lows,the wavelength for the determination of DPP H reaction system by spectrophotometric method was chosen to be51814nm, DPP H reaction system was4100mL of25717mg?L-1DPP H+1mL of antioxidant solution with the reaction time of DPP H re2 action system of40min.The relation between DPP H radical scavenging rate and the concentration of TB HQ and B H T was stud2 ied,and IC50(the value of antioxidant concentration for scavenging half of DPP H radical)was used as the index to evaluate scav2 enging capacity.The determining IC50values were as follows:TB HQ(21114mg?L-1),B H T(42109mg?L-1)and M40 (108140mg?L-1).Bamboo leaf extract could be used as natural antioxidant.
K eyw ords Bamboo leaf extract;DPP H;Scavenging rate;IC50value
(Received Sep.8,2007;accepted Dec.18,2007) 3Corresponding author
羟基自由基清除注意事项
一般而言,对于Fenton试剂与有机化合物氧化能力的影响因素大致上可分为: A.亚铁离子浓度。 B.过氧化氢浓度。 C.溶液于反应时的反应温度。 D.溶液中的pH值。 以下将对此四项变因做详细的探讨: A.亚铁离子浓度的影响 在Fenton试剂的反应中,亚铁离子主要是扮演着催化过氧化氢的角色。因此,若溶液中没有亚铁离子当触媒,则其溶液可能就没有氢氧自由基的生成。所以,大致上分解反应会随亚铁离子的浓度增加而加快,亚铁添加量会影响脱色效率,亚铁剂量愈高效果愈佳,此原因为增加亚铁剂量将使氧化反应更加完全并且可产生混凝机制而进行脱色(26)。但亚铁离子本身会与有机物形成竞争,亚铁离子浓度过高会增加氢氧自由基的消耗,反而造成处理效果的下降,反应式如下: Fe2+ + ·OH Fe3+ + OH- 故当浓度到达某一定值时,则其分解速率便不会在随着亚铁离子浓度的增加而持续加快,且亚铁离子浓度和生成物的比值也将可能会影响生成物的分布。一般而言,亚铁离子浓度皆维持在亚铁离子与其反应物之浓度比值为1:10-50(wt/wt)。 此外,亚铁在Fenton程序中除了扮演催化过氧化氢的角色外,亦具有混凝的功能,因此过量的铁离子加入将会造成过度的混凝,降低Fenton程序处理的效果,其可能的反应如下所示: B.过氧化氢浓度的影响 反应过程中,过氧化氢的浓度会直接影响氧化有机物的效果。一般而言,随着过氧化氢添加量的增加,有机物的氧化效果亦将随之提升,并且过氧化氢的添加浓度不同,则分解反应生成的产物将会有所差异。大致而言,在过氧化氢浓度越高的情况下,则其氧化反应产物,将会更趋近于最终产物。但是,当溶液中的过氧化氢浓度过高时,反而会使过氧化氢与有机物竞争氢氧自由基,而造成反应速率的结果可能不如预期一般增加。此外,当Fenton试剂系统中过氧化氢浓度远高于亚铁离子浓度时,Fenton法所产生的氢氧自由基会与过氧化氢反应产生perhydroxyl radical (HO2.)及一系列反应,且三价铁离子会与HO2.进行氧化还原反应生成superoxide radical anion (O2.),造成过氧化氢消耗量的增加,过量的过氧化氢加药量并不必然增加氢氧自由基的浓度,氢氧自由基达到稳定浓度所需反应时间随加药量增加而增加(27)。因此,若以连续之方式加入低浓度之过氧化氢,减少因为过氧化氢初始浓度过高所导致的抑制效应,亦可得到较好的氧化效果。 C.温度的影响 根据Arrhennius' Law:k=k0exp(-Ea/RT)可得知温度的改变会影响活化能及反应速率常数,进而影响反应速率。 对于Fenton试剂反应而言,一般若选用的反应温度条件是在小于20℃以下时,其对有机物的氧化速率将会随温度升高而加快。但是,倘若将其反应的温度升高至40-50℃时,其Fenton反应将会可能因为温度过高,进而使过氧化氢自行分解成水与氧(2H2O2 → 2H2O + O2 ),造成Fenton试剂对氧化有机物之反应速率减慢。 因此,当过氧化氢浓度超过10-20 g/L时,在其经济与安全的考量下,应谨慎选择适当的温度。在一般商业应用上,通常皆将其反应的温度设定在20-40℃之间。 D. pH值的影响 于Fenton试剂反应中,其反应溶液之pH值对Fenton法之影响,关系到铁离子错合效应、铁
超氧自由基清除能力测定法-操作图解
超氧自由基(·O2-)的清除能力测定法(连苯三酚自氧 化法) (适用于:SOD及各种抗氧化剂) 操作图解 具体方法 1 溶液配制 1.1 Tris溶液(0.1mol/L):1.21 gTris(三羟甲基氨基甲烷,M.W. 121.1)+100 mL蒸馏水。 1.2 HCl溶液(0.1mol/L):取0.1 mL浓盐酸,加蒸馏水稀释到6 mL。 1.3 Tris-HCl缓冲液(0.05mol/L,pH7.4,含1mmol/L Na2EDTA) 40 mL0.1 mol/L Tris溶液+ x mL0.1 mol/L HCl溶液+15.2 mg Na2EDTA,混合,稀释到80 mL。用pH 计测量,pH应为7.4。用棕色瓶保存在冰箱内(最多保存三天) 。(以上为一个样品的用量)用前稍热至室温,再测pH值,符合要求即可。 1.4 60 mmol/L连苯三酚溶液(溶于1 mmol/L盐酸中) 取0.1mol/L HCl溶液(见1.2项)20μL,用蒸馏水稀释到2 mL,得1 mmol/L盐酸溶液(用pH计测量,pH=2.5-3.0)。再往里加连苯三酚14.6 mg (M。W.126.1 ),即得。(当天有效,以上为1个样品的用量)。 2 测试液 2.1连苯三酚溶液:取2950μL Tris-HCl缓冲液加入到石英比色皿中,再加约50μL连苯三酚溶液,迅速混合(颠覆式),开始计时,每隔30秒读数一次A值(325nm),至300秒(5min)时为止。(空白参比:Tris-HCl 缓冲液) ΔA=A325nm,300s - A325nm,30s。由于ΔA值反映了生成·O2的初始浓度,所以,对于同一批实验而言,此时的ΔA值必须相等。此时的ΔA为ΔA0。 3.2 样品溶液:取xμL样品溶液加入到大石英比色皿中,再加(2950-x)μL Tris-HCl缓冲液,再加50μL 连苯三酚溶液,迅速混合(颠覆式),开始计时,每隔30秒读数一次(A值,325nm),至300秒时为止。(空白参比:Tris-HCl缓冲液) ΔA=A325nm,300s - A325nm,30s。此时的ΔA为ΔA样。 3 计算公式
DPPH自由基清除法
DPPH自由基清除法 李熙灿/Xican Li (广州中医药大学) [文献] Xican Li, Jing Lin, Yaoxiang Gao, Weijuang Han, Dongfeng Chen. Antioxidant activity and mechanism of Rhizoma Cimicifugae. Chemistry Central Journal. 2012; 6(1):140. [原理] DPPH(1,1-Diphenyl-2-picrylhydrazyl radical)即1,1-二苯基-2-苦基肼基自由基。分子中,由于存在多个吸电子的-NO2和苯环的大π键,所以,氮自由基能稳定存在。 N 2 2 当DPPH自由基被清除,其最大吸收波长519nm处的吸光度A值随之减小。DPPH这种稳定的自由基为清除自由基活性的检测提供了一个理想而又简单的药理模型。 [实验步骤] 1.1 DPPH测试液的配制 取DPPH 1mg溶于约20mL溶剂(乙醇、95乙醇或甲醇)中,超声5min,充分振摇,务使上下各部分均匀。取1mL 该DPPH溶液,在519nm处测A值,使A=1.2-1.3之间最佳。该DPPH溶液最好避光保存,3.5小时内用完。 1.2 样品液的配制 样品用合适的溶剂溶解,为便于计算,可配成1mg/mL浓度。溶剂根据样品的极性进行选择,首选95乙醇或无水乙醇,如不溶可用DMSO。 1.3 预试 取DPPH溶液2mL,往其中加少量样品液,加样时,先少后多渐加,边加边混合,并观察溶液的褪色情况,当溶液颜色基本褪去时,记下样品的加样量。 此加样量即为样品的最大用量,在此最大用量的基础上,往前设置5个用量,使之成等差数列。 【如】在预试过程中,发现加样到200μL时,DPPH溶液颜色基本褪去,则100μL为该样品液的最大用量。其用量梯度宜设为40、80、120 、160、200μL。 1.4测量 A0值的测量:取DPPH溶液2 mL加入到小试管(或玻璃瓶)中,加95乙醇(或无水乙醇)1mL,充分混合,测A值(519nm),此A值为A0(A0多在0.7-0.9之间)。 A值的测量:取DPPH溶液2mL加入到小试管(或玻璃瓶)中,加样品液xμL (x是根据1.3 预试结果确定样品液的用量),再加(1000 -x)μL 95乙醇(或无水乙醇),混合,静置30分钟后,测A值(519nm)。如:某样品的用量梯度为40、80、120 、160、200μL,则加样表如下: 表1 加样表 1.5 正式测量
超氧阴离子清除实验
·O2ˉ自由基清除实验 (1) 实验原理 黄嘌呤氧化酶 黄嘌呤+H2O+O2尿酸+H2O2+·O2ˉ 即黄嘌呤氧化酶在有氧条件下催化黄嘌呤转化为尿酸,同时产生超氧阴离子自由基(·O2ˉ)。·O2ˉ与NBT结合后呈蓝色,样品清除能力越大,与NBT结合的·O2ˉ越少,溶液的颜色越浅。 (2)试剂 Xanthine(黄嘌呤): (C5H4N4O2 ), MW=152.1, 6.084mg/100mL(0.4mmol/l) 实际配制:1.216mg/10mL,与NBT等体积混合使用 Xanthine oxidase(黄嘌呤氧化酶)贮液: 1 unit/mL , (溶解酶的溶液要高压灭菌!防止蛋白酶对酶的降解!) 0.05 unit/mL,每次取200uL稀释到4mL(PBS溶解) NBT: (Nitro blue tetrazolium chloride氯化硝基四氮唑蓝), MW=817.65, 黄色19.6236mg/100mL(0.24mmol/l) 实际配制3.925mg/10mL,与Xanthine等体积混合使用 PBS(0.01mol/L,pH=8.0): NaCl 8g, KCl 0.2g, Na2HPO4(无水) 1.44g, KH2PO4 0.24g, 800mL水,用NaOH(1M)调pH到8.0,定容到1000mL。 实际配制500mL。高压灭菌,室温保存。 PBS(0.01mol/L,pH=7.4): 配制同上 Ascorbic acid: MW=176.12 母液为1mg/mL 先两倍逐级稀释5个浓度 实际配制见记录本! HCl(1M): MW=36.5 310ul/10ml.(36% HCl密度1.18g/ml) 实际配制:800uL浓盐酸+9mL水,于塑料管中4℃保存。 NaOH(1M): MW=40 0.4g/10mL, 存于冰箱 (3) 测定方法 超氧阴离子自由基清除能力的测定参照Bae等人的方法略加改进。样品溶液1-5mg/ml 起始浓度,用于水或50%乙醇溶液。 Bae, S.W., Suh, H.J., 2007. Antioxidant activities of ve different mulberry cultivars in Korea.
清除自由基能力的研究概况
清除自由基能力的研究概况 陶涛 (西南林业大学林学院农学(药用植物)昆明 650224) 摘要:自由基及其诱导的氧化反应是导致生物衰老和某些疾病如癌症、糖尿病、一心血管疾病等的重要因素。乳酸茵作为一种高效、低毒的生物源天然抗氧化荆,正逐步受到食品、制药、化工等领域的广泛关注。就目前国内外常用的乳酸茵抗氧化活性的筛选方法、乳酸茵抗氧化机理的国内外研究进展及未来的发展趋势作一综述。 关键词:自由基;乳酸茵;抗氧化. Study on the scavenging ability of lactic acid bacteria on free radical bstract:Free radical and its inducing oxiditative reaction may CaUSe biological doat and certain diseases such as Cancers,diabetes and the cat- diovascular.The lactic acid baaeria as one ofbiological SOUrCeS oxidation inhibitor is becoming more and more popular in the fields offood.,drug manufacture and chemical industry.This article mainly reviews the screening methods for antioxidative of lactic add bacteria among domestic and foreign countries,the advance of the research progress in lactic add bacteria antioxidative and r∞earch trends in future. 引言 氧化过程可以提供能量.对大多数生物体来说,是维持生命必不可少的一个能量转化过程。但过多的氧化过程会对生物大分子引起损伤.氧化损伤主要是由于自由基和过氧化产物作用于人体而产生的。 自由基(free radicals)27..称游离基.为人体氧化代谢过程中形成含有一个不成对电子的原子或原子团。人体的自由基主要包括超氧阴离子自由基(o2)、
氧自由基与氧自由基清除剂依达拉奉
氧自由基与氧自由基清除剂依达拉奉 山东大学齐鲁医院麻醉科(250012)于金贵 一、氧自由基 (一)自由基的概念 自由基(free radical,FR)是指外层轨道上有未配对电子的原子、原子团、分子或离子的总称。因其含有未配对的电子,故化学性质非常活泼,极易与其生成部位的其他物质发生反应,而这种反应的最大特点是以连锁反应的形式进行。氧原子上有未配对电子的自由基称为氧自由基。人体吸入的分子氧,在正常状态下绝大多数(98%)都连接4个电子,它们最终与H+结合,代谢还原为H2O。但有极少数氧(1~2%)在代谢过程中被夺去或接受一个电子而形成活性氧,即氧自由基。 (二)氧自由基的生理作用 氧自由基在生理上是必需的物质,如合成ATP 和前列腺素、中性粒细胞杀灭细菌、酸性粒细胞杀灭寄生虫等过程都必须有氧自由基参与。氧自由基在体内的生成与清除保持动态平衡,且在体内存在时间甚短。由于其化学性极强,反应剧烈,过量产生会对机体造成极大危害。 (三)氧自由基的种类及其作用
1. 超氧化物阴离子:氧自由基连锁反应的启动者,使生物膜、激素和脂肪酸过氧化。 2. 羟自由基(OH∙):作用最强的自由基,可破坏氨基酸、蛋白质、核酸和糖类。 3. 过氧化氢(H2O2):过渡型氧化剂,主要使巯基氧化,可氧化不饱和脂肪酸。 4. 单线态分子氧(1O2):氧分子的激发状态,亲电子性强,在光作用下可由O2直接产生,对细胞有杀伤作用。 5. 其他含氧的自由基如脂质过氧化物(ROOH):易于分解再产生自由基,腐化脂肪,破坏DNA,可与蛋白质交联使之形成变性交聚物。 (四)机体抗氧化机制 机制一:直接提供电子,以确保氧自由基还原;机制二:增强抗氧化酶的活性,以有效地消除或抵御氧自由基的破坏作用如酶类抗氧化剂超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-PX);非酶类抗氧化剂如维生素E、维生素C、辅酶Q、还原型谷胱甘肽(GSH)、葡萄糖、含硫氨基酸和不饱和脂肪酸等。 SOD多存在于细胞的线粒体内,作用是将氧自由基歧化,将其一半转变成H2O,另一半转变成O2,从而清除氧自由基。CAT是血红蛋白酶类之一,作用是分解H2O2,并将其清除之。
自由基清除剂
第五章自由基清除剂 本章要点 1.自由基理论的产生机理及来源 2.自由基对机体活动的影响 3.自由基清除剂的基本概念 随着生命科学的飞速发展,英国人Harman于1956年提出了自由基学说。该学说认为,自由基攻击生命大分子造成组织细胞损伤,是引起机体衰老的根本原因,也是诱发肿瘤等恶性疾病的重要起因,其中的观点被越来越多的实验所证明。 自由基(Free radical)是人体生命活动中各种生化反应的中间代谢产物,具有高度的化学活性,是机体有效的防御系统,若不能维持一定水平则会影响机体的生命活动。但自由基产生过多而不能及时地清除,它就会攻击机体内的生命大分子物质及各种细胞器,造成机体在分子水平、细胞水平及组织器官水平的各种损伤,加速机体的衰老进程并诱发各种疾病。 近年来,国内外对自由基及自由基清除剂的研究十分活跃,在各类食品科学、生命科学及医学书籍上都有许多关于自由基及其清除剂的研究报道,自由基清除剂作为功能性食品的重要原料成分之一,通过人们日常消费的食品来调节人体内自由基的平衡,已受到食品营养学家的广泛重视。 第一节自由基理论 一、自由基的产生机理及来源 自由基又叫游离基,它是由单质或化合物的均裂(Homdytic Fission)而产生的带有未成对电子的原子或基团。它的单电子有强烈的配对倾向,倾向于以各种方式与其他原子基团结合,形成更稳定的结构,因而自由基非常活泼,成为许多反应的活性中间体。 人体内的自由基分为氧自由基和非氧自由基。氧自由基占主导地位,大约占自由基总量的95%。氧自由基包括超氧阴离子(O2-·)、过氧化氢分子(H2O2)、羟自由基(OH·)、氢过氧基(HO2-·)、烷过氧基(ROO·)、烷氧基(RO·)、氮氧自由基(NO·)、过氧亚硝酸盐(ONOO-)、氢过氧化物(ROOH)和单线态氧(1O2)等,它们又统称为活性氧(reactive oxygen species,ROS),都是人体内最为重要的自由基。非氧自由基主要有氢自由基(H·)和有机自由基(R·)等。 (一)自由基的产生 人体细胞在正常的代谢过程中,或者受到外界条件的刺激(如高压氧、高能辐射、抗癌剂、抗菌剂、杀虫剂、麻醉剂等药物,香烟烟雾和光化学空气污染物等作用),都会刺激机体产生活性氧自由基。 人体内酶催化反应是活性氧自由基产生的重要途径。人体细胞内的黄嘌呤氧化酶、髓过氧化物酶和NADPH氧化酶等在进行酶促催化反应时,会诱导产生大量的自由基中间产物。除酶促反应外,生物体内的非酶氧化还原反应,如核黄素、氢醌、亚铁血红素和铁硫蛋白等单电子氧化反应也会产生自由基。外界环境,如电离辐射和光分解等也能刺激机体产生自由基反应,如分子中的共价键均裂后即形成自由基。 自由基反应包含3个阶段,即引发、增长和终止阶段。反应之初,引发阶段占主导地位,反应体系中的新生自由基形成许多链的开端,反应物浓度高。引发后的扩展阶段为反应的主体,若起始有几个引发自
DPPH抗氧化能力测定
DPPH.法测定绿原酸清除自由基能力 2.1 待测液的制备 将绿原酸(纯度56%)、维生素C 和没食子酸分别配制成体积分数为0.1mg/mL 的无水乙醇溶液。 2.1.1 绿原酸母液的配制 称取 9.0 mg 绿原酸,定容到50ml ,即可得到绿原酸的母液0.1mg/mL 。然后,再将所配制的母液按照要求稀释成不同浓度的溶液。 分别为 mg/ml; mg/ml; mg/ml; mg/ml; mg/ml; mg/ml; mg/ml 。 2.1.2 Vc 母液的配制 称取 mg VC ,定容到100ml ,即可得到VC 的母液。然后,再将所配制的母液按照要求稀释成不同浓度的溶液。 分别为 mg/ml; mg/ml; mg/ml; mg/ml; mg/ml; mg/ml; mg/ml 。 2.1.3 没食子酸母液的配制 称取 mg 没食子酸,定容到100ml ,即可得到没食子酸的母液。然后,再将所配制的母液按照要求稀释成不同浓度的溶液。 分别为 mg/ml; mg/ml; mg/ml; mg/ml; mg/ml; mg/ml 。 2.1.4 DPPH 母液的配制 称取 mg DPPH ,用无水乙醇定容到100ml ,即可得到DPPH 的母液。然后,再将所配制的母液按照要求稀释成至一定浓度的溶液。C DPPH = mg/ml 。(建议用0.025mg/mL ) 2.2 DPPH.溶液的可见光谱 以无水乙醇为对照,在分光光度计上对DPPH.溶液进行在440~600nm 下扫描。A max = nm 2.3 抗氧化活性测定 DPPH.是一种稳定的自由基,它的乙醇溶液呈紫色,在可见光区最大吸收峰为 nm 。当DPPH.溶液中加入自由基清除剂时,溶液颜色变浅,517nm 处的吸光度变小,而吸光度变小的程度与自由基被清除的程度呈线性关系。因此,可用来检测自由基的清除情况,从而评价某物质的抗氧化能力,其能力用清除率(Scavenging Rate,SR)来表示,清除率越大,抗氧化能力越强 [4.5]。 具体实验步骤及方法: 精确吸取的DPPH.溶液2mL 与2ml 无水乙醇混合均匀后,以相对应的溶剂(4mL 无水乙醇)为对照,用分光光度计测定上述溶液在 nm 处的吸光度值(A 0)。 A 0= 2.3.1 绿原酸样品溶液的抗氧化能力测定 精确吸取上述不同浓度的绿原酸溶液2mL ,分别与浓度 mg/ml 的DPPH.溶液2mL 混合,摇匀后放置30min 。以相对应的溶剂(无水乙醇)为对照调零,用分光光度计分别测定上述溶液在 nm 处的吸光度值(A i ),分别测得A i 值。 A 1 ;A 2 ;A 3 ;A 4 ;A 5 ;A 6 ;A 7 。 精确吸取上述不同浓度的绿原酸溶液2mL ,分别与2mL 无水乙醇混合均匀后,以无水乙醇为对照,用分光光度计分别测定各混合液在波长 nm 处的吸光度值(A j ),分别测得A j 值。 A 1 ;A 2 ;A 3 ;A 4 ;A 5 ;A 6 ;A 7 。 将以上数据代入下列公式计算其清除率。 清除率SR(%)=%100A A A 10j i ???? ? ?? -- 其中, A i :为2mL 绿原酸、维生素C 和没食子酸与 2mL 的DPPH.溶液混合后在波长 nm 处的吸光度值; A j :为2mL 绿原酸、维生素C 和没食子酸分别与2mL 无水乙醇溶剂混合后在波长 nm 处的光值; A 0:2mLDPPH.溶液与2mL 无水乙醇溶剂混合后在波长 nm 处的吸光度值。
清除氧自由基
1、超氧负离子 黄嘌呤-黄嘌呤氧化酶系统产生超氧负离子产生超氧负离子 黄嘌呤、黄嘌呤氧化酶、 清除超氧自由基负离子O2- 徐艳,曲婷婷. 甘草消除氧自由基的体外研究[J]. 食品研究与开发,2006,(8). 2、1.2.2NBT 光还原反应中主要试剂的配制 1.2.2.1 测试缓冲液: 0.026 mol/LMet- 磷酸钠缓冲液具体配制方法: 首先配制0.1 mol/LpH7.8Na2HPO4- NaH2PO4缓冲液 a 称取Na2HPO4·12H2O( MW=358.14) 3.581 4 g 于100 mL 小烧杯中, 加少量蒸馏水溶解后, 移入100 mL容量瓶中, 用蒸馏水定容至刻度。 b 称取NaH2PO4·2H2O(MW=156.01)0.780 g 于50 mL小烧杯中, 加少量蒸馏水溶解后, 移入50 mL 容量瓶中, 用蒸馏水定容至刻度。 c 量取91.5 mL a 液与8.5 mL b 液混合后, 该液即为0.1 mol/LpH7.8 磷酸钠缓冲液。 d 称取L- Met( MW=149.2) 0.194 1 g 于50 mL 小烧杯中, 用少量0.1 mol/LpH7.8 磷酸钠缓冲液溶解后, 移入50 mL 容量瓶中, 用0.1 mol/LpH7.8 磷酸钠缓冲液定容至刻度。 1.2.2.2 NBT( 氯化硝基四氮唑蓝) 的配制(7.5×10-4mol/L) 称取NBT( MW=817.7) 0.061 3 g 于50 mL 小烧杯中, 用少量蒸馏水溶解后, 移入100 mL 容量瓶中, 用蒸馏水定容至刻度。 1.2.2.3 核黄素溶液(2×10-5 mol/L) a.称取EDTA( MW=292) 0.002 92 g 于50 mL 小烧杯中, 用少量蒸馏水溶解。 b.称取核黄素( MW=376.36) 0.073 5 g 于50 mL 小烧杯中, 用少量蒸馏水溶解。合并 a 液和 b 液, 移入100 mL 容量瓶中, 用蒸馏水定容至刻度( EDTA0.1 mmol,核黄素2 mmol)。贮于冰箱中, 避光保存, 用时稀释100 倍。 1.2.3 甘草提取物溶液的配制 1.2.3.1 甘草酸溶液的配制 称取甘草酸0.05 g 用少量稀醇(10 %乙醇溶液)溶解后, 移入50 mL 容量瓶中, 用稀乙醇定容至刻度, 即为 1 g/ mL 的甘草酸溶液。 1.2.3.2 甘草次酸溶液的配制 称取甘草次酸0.05 g 用少量稀醇(10 %乙醇溶液)溶解后, 移入50 mL 容量瓶中, 用稀乙醇定容至刻度,即为 1 g/mL 的甘草次酸溶液。 1.2.3.3 甘草总黄酮组溶液的配制
如何清除体内自由基
如何清除体内自由基 消除体内自由基,应该要了解自由基的来源,从外界到身体内部的代谢一起中和性的描叙不要单方面的讲叙体内各种酶与自由基之间的关系 人体内的自由基有两个来源:其一是来自环境,如环境污染、食品污染、过度的紫外线照射和各种辐射、杀虫剂、室内外废气、吸烟、二手烟、酗酒、工作压力、生活不规律等等,都会直接导致人体内产生过多的自由基(活性氧);食品添加剂、食用脂肪和熏炸烤肉、某些抗癌药物、安眠药、抗生素、有机物腐烂物、塑料用品制造过程、油漆干燥挥发、石棉粉尘、空气污染、化学致癌物、大气中的臭氧等也都能诱发人体内产生自由基。 其二是来自体内,人体内组织细胞的新陈代谢也会产生自由基,这是人体代谢过程的正常产物,十分活跃又极不稳定,它们会附着于健康细胞之上,再慢慢瓦解健康细胞,而被破坏的细胞则又再转而侵害更多健康的细胞,如此恶性循环从而导致人体的衰老和疾病的发生。另外,组织器官损伤后的缺血一段时间后又突然恢复供血(即重灌流),如心肌梗塞、脑血栓、外伤、外科手术后,自由基会大量生成。正常人体有一套清除自由基的系统,但这个系统的力量会因人的年龄增长及体质改变而减弱,致使自由基的负面效应大大增强,引起多种疾病发病率的提高。活性氧自由基对人体的损害实际上是一种氧化过程。因此,要降低自由基的损害,就要从抗氧化做起。 听说过抗氧化剂吗?它对人体的健康可是有着密切的关系。既然自由基不仅存在于人体内,也来自于人体外,那么,降低自由基危害的途径也有两条:一是,利用内源性自由基清除系统清除体内多余自由基;二是发掘外源性抗氧化剂——自由基清除剂,阻断自由基对人体的入侵。 大量研究已经证实,人体内本身就具有清除多余自由基的能力,这主要是靠内源性自由基清除系统,它包括超氧化物歧化酶(SOD)、过氧化氢酶、谷胱甘肽过氧化物酶等一些酶和维生素C、维生素E、还原型谷胱甘肽、β-胡萝卜素和硒等一些抗氧化剂。酶类物质可以使体内的活性氧自由基变为活性较低的物质,从而削弱它们对肌体的攻击力。酶的防御作用仅限于细胞内,而抗氧化剂有些作用于细胞膜,有些则是在细胞外就可起到防御作用。这些物质就深藏于我们体内,只要保持它们的量和活力它们就会发挥清除多余自由基的能力,使我们体内的自由基保持平衡。 要降低自由基对人体的危害,除了依靠体内自由基清除系统外,还要寻找和发掘外源性自由基清除剂,利用这些物质作为替身,让它们在自由基进入人体之前就先与自由基结合,以阻断外界是自由基的攻击,使人体免受伤害。在自然界中,可以作用于自由基的抗氧化剂范围很广,种类极多。目前,国内外已陆续发现许多有价值的天然抗氧化剂。如β-胡萝卜素(维生素A)、维生素C、维生素E、番茄红素、辅酶q10、等等。此外,我国很多中草药植物中的有效成分都是天然抗氧化剂,例如,银杏黄酮、甘草黄酮等,另外还有巴西菇、灰树花、茯苓、黄芪、丹参、银杏、枸杞、灵芝、人参......。 吃什么可以减少体内自由基 在正常的生命过程中,自由基为维持生命所必需。体内自由基不断产生,也不断地被清除,两者 处于动态平衡之中,使之维持在一个正常的生理水平上。自由基在生物体内具有参与吞噬病原体,参 与前列腺素和凝血酶原的合成、解毒,参与体内部分生化反应和胶原蛋白的合成,调节细胞增殖与分化,参与机体免疫和环核苷酸的生物合成,以及生殖和胚胎发育等重要的生理功能。但是当自由基过 量时,自由基在机体内损伤蛋白质、核酸和生物膜,导致细胞凋亡,并参与许多疾病的发病过程。 由基清除剂即抗氧化剂清除机体自由基,保护机体免受氧化损害中起重要作用。因此,近年来对 自由基清除剂的研究备受关注。多吃点抗氧化剂食物有利于减少体内多余自由基。 方法/步骤 1.全面复方自由基清除剂:葡茶多酚胶囊。适当吃葡茶多酚可以全面清除体内多余自由
DPPH和ABTS、PTIO自由基清除实验-操作图解-李熙灿-Xican-Li
DPPH?和ABTS+?自由基清除实验(含PTIO?自由基清除实验):详细说明与疑难解答 李熙灿(广州中医药大学中药学院, 2019.7) (以下内容系来源于实验经验及三个参考文献[1]Li, X., Comparative Study of 1,1-Diphenyl-2-picryl-hydrazyl Radical (DPPH?) Scavenging Capacity of the Antioxidant Xanthones Family. Chemistryselect, 2018. 3,13081-13086. [2]Li, X.; Ouyang, X.; Cai, R.; Chen, D. 3’,8”-Dimerization Enhances the Antioxidant Capacity of Flavonoids: Evid ence from Acacetin and Isoginkgetin. 2019, Molecules. 24, 2039. [3]Li, X.C., 2-Phenyl-4,4,5,5-tetramethylimidazoline-1-oxyl 3-Oxid e (PTIO?) Radical Scavenging: A New and Simpl e Antioxidant Assay In Vitro. J. Agric. Food Chem., 2017. 65,6288-6297 【概述】DPPH?、ABTS+?、PTIO?自由基三者,都是常用的自由基。概述如下表: 1
紫色墨绿色蓝紫色 2
3
清除自由基研究方法汇总
电子自旋共振法(ESR)、高效液相色谱法、化学发光法、比色法、分光光度法 自由基清除剂也称为抗氧化剂,可清除体内多余的自由基,减轻它们对机体的损伤。目前常用超氧阴离子自由基体系(O2-·)、羟基自由基体系(·OH)、二苯代苦味酰基自由基体系(DPPH·)对某抗氧化剂的体外清除自由基能力进行了研究。 其中ESR法和气相色谱法、HPLC 法对自由基的检测灵敏度高,但对设备要求较高,操作复杂,无法在一般实验室普及。而其中的分光光度法、化学发光法、荧光分析法等不需要昂贵的仪器,易于被一般实验室所采用,但测定过程中的干扰因素较多,容易对测定的准确性和灵敏度造成影响。分光光度法最常用。 原理部分: 1.DPPH·法测试机理 DPPH·(二苯代苦味脐基自由基)的甲醇溶液呈深紫色,可见光区最大吸收峰为492nm。当自由基清除剂加入到DPPH·溶液中时,DPPH·的单电子被配对而使其颜色变浅,在最大吸收波长处的吸光度减少,而且颜色变浅的程度与配电子数成化学计量关系,因此,可通过吸光度减弱的程度来评价自由基被消除的情况。 2. 羟基自由基(·OH) 1)邻二氮菲法[70]
实验原理:邻二氮菲可与Fe2+形成络合物,此络合物在510nm 处有最大吸收峰,是一常用的氧化还原指示剂,其颜色变化可敏锐地反映溶液氧化还原状态的改变。H2O2/ Fe2+体系可通过Fenton 反应产生羟自由基,邻二氮菲-Fe2+水溶液被羟自由基氧化为邻二氮菲-Fe3+后,其510nm 最大吸收峰消失。如果反应体系中同时存在羟自由基清除剂,则Fenton 反应产生的羟自由基将被此清除剂全部或部分清除,邻二氮菲-Fe2+络合物受到的破坏将会随之减少。根据这一原理,可建立以A510变化反映自由基清除剂对羟自由基清除作用的比色测定法。 2)水杨酸法[71] 实验原理:羟自由基易攻击芳环化合物产生羟基化合物,因此可用水杨酸捕集Fenton 反应体系中的·OH,生成的2,3-二羟基苯甲酸用乙醚萃取,用钨酸钠和亚硝酸钠显色,然后用分光光度计测定其在510nm 处的吸光值,此吸光值可反映体系中的羟自由基浓度。 3)甲基紫-Fe2+-H2O2反应体系 测定原理:在Fenton反应的基础上加入甲基紫作显色剂,反应式如下: Fe2++H2O2→Fe3++OH-+·OH 甲基紫在酸性溶液中呈现紫色[9],在578nm 处有强吸收。反应产生的·OH 具有高的反应活性,容易进攻高电子云密度点,会与甲基紫中具有高电子云密度的-C=C-基团发生亲电加成反应,使甲基紫褪色。通过测定甲基紫在578nm 处吸光度值的变化可间接测定出·OH 的生成量。当有清除自由基的物质存在时,会阻断甲基紫与·OH 的反应,从而使得甲基紫的颜色有所加重,因此可利用抗氧化剂加入前后溶液吸光度值的变化来评价物质的抗氧化性强弱。
羟基自由基清除能力测定法的简易操作图解-脱氧核糖降解法-脱氧核糖分析法
羟基自由基(·OH)清除能力测定法的简易操作图解 (适用于各种抗氧化剂) 文献来源 [1] Xican Li. Solvent effects and improvements in the deoxyribose degradation assay for hydroxyl radical-scavenging. Food Chemistry, 2013, 141(3):2082-2088. 操作图解 图1 羟基自由基(·OH)清除能力测定法(脱氧核糖降解法)的实验操作图 具体方法 1 溶液配制 0.2 MKH2PO4溶液: 100mL蒸馏水+2.7218g KH2PO4。 0.2 M Na2HPO4溶液: 500mL蒸馏水+35.814g Na2HPO4·12H2O。 磷酸盐KH2PO4-Na2HPO4缓冲液phosphate buffer(0.2M, pH7.4, 100mL):19mL0.2 MKH2PO4+ 81mL 0.2 MNa2HPO4. (注意:19:81是大概的体积比,具体的比例以pH=7.4为准)。 Na2EDTA溶液:(1mM, 25mL):8.4 mg+25mL蒸馏水。 FeCl3溶液:(3.2mM, 5mL):4.2 mg+5mL蒸馏水。 抗坏血酸溶液:(1.8mM, 50mL):15 mg+50mL蒸馏水。 H2O2溶液:(50 mM,5mL):30 mg 30% H2O2+5mL蒸馏水。 脱氧核糖溶液:(50 mM, 2 mL):15 mg脱氧核糖+2 mL蒸馏水(该用量约可做40个数据) 。 三氯乙酸溶液TCA(10%, 10 mL):1 g + 10 mL蒸馏水。 硫代巴比妥酸溶液TBA:(5%, W/V, 20mL):取1gTBA+20mL蒸馏水+20mgNaOH (临用时配,超声溶解. 该用量可做40个数据) 。 样品溶液:选合适的溶剂(如甲醇、无水乙醇等),先配成1mg/mL的溶液试试。 2 操作方法与注意事项 2.1 操作方法(见图1) 2.2 注意事项 1 测试前,一定要检查试管是否干净,不净的试管不能用。正式测试前,盛装样品的容器(小瓶或试管) 必须用铬酸洗液洗净。 2 样品溶液加入到试管后,先彻底挥干溶剂,再用样品的残渣,进行实验检测(见:操作图解)。这一步至关重要,因为有机溶剂都会产生数十倍的干扰。其原因中文献[1]已做详细说明。 3 最后显色时,如颜色太淡,可能是加热温度不够高; 4 加样:在10μL以下最好用进样针,插到瓶底;取样:力保均匀。 5 如平行样之间差别太大,系混合不均所致。两次水浴前,都要充分振荡。振荡时,用保鲜膜盖住管 口上下剧烈振荡。
超氧阴离子自由基清除
一.实验原理: 该方法利用NADH-PMS-NBT为超氧阴离子(O2·-)生成系统,超氧阴离子清除剂能减少NBT 的蓝色。通过检测560nm处吸光值可判断体系中还原物质的还原能力。 二.实验仪器:分光光度计 三.实验试剂: 一:液体40mL×1瓶; 二:液体1mL一瓶; 三:粉剂一支; 四:粉剂一支; 五:1mg/mL芦丁标准品,1mL 四.溶液配制: 一工作液:用时加双蒸水360mL,也就是10倍稀释,得到400mL试剂一工作液; 二工作液:用赠送的棕色瓶配制。试剂二工作液由试剂二加上100mL试剂一工作液配得,现配现用,注意避光; 三工作液:试剂三工作液由试剂三溶解于100mL试剂一工作液配得,现配现用; 四工作液:粉剂一支。用50mL双蒸水溶解,摇匀后,取10mL,加入90mL试剂一,配成试剂四工作液,现配现用,用赠送的棕色瓶盛装。注意避光,配好的试剂请于2小时内用完。五工作液:阳性对照,按需配制,-20℃保存。 五.实验步骤: 测定吸光值。
六.清除能力计算: 超氧阴离子自由基清除(%)=[空白孔吸光值-(测定孔吸光值-对照孔吸光值)]/空白孔吸光值*100 注: 1 如未做对照孔,可以将其视作为0; 2 阳性对照求值时将其视作测定孔进行计算即可。 七.注意事项: 1. 如样品中色素物质不是分析对象,建议先通过SEP C18柱进行脱色处理,处理后样品可不做对照孔; 2. 如不确定样品的超氧阴离子自由基清除能力,可先做不同浓度的稀释液进行摸索,并选择适宜浓度进行测定,高浓度下,浓度与清除率间并不线性相关。 3. 试剂三建议全程冰上操作。试剂四切记避光保存,特别是配制后,且应尽快用完。建议在做好一切其它准备工作后再配制试剂四应用液。试剂四正常颜色为黄色,强光照射下,5-10分钟内会变为绿色,随后变为蓝色,变色后试剂不可再用! 4. 试剂二、三应用液和样品混匀后再加入试剂四,次序颠倒会导致不显色。 5. 部分物质会导致显色加深,导致求得的抑制率是负值,如遇到此类现象请先确定该物质是否具有超氧阴离子清除能力,再考虑更换方法,如邻苯三酚自氧化法等进行测试。
dpph自由基清除测定
dpph自由基清除测定 DPPH法测定黄芩黄酮的抗氧化活性 抗氧化就是任何以低浓度存在就能有效抑制自由基的氧化反应的物质,其作用机理可以是直接作用在自由基,或是间接消耗掉容易生成自由基的物质,防止发生进一步反应。 目前对自由基清除剂的研究方法主要有2类,一类是体外模型,另一类是体内模型,其中DPPH法是体外模型中最常用的方法。 DPPH又称1,1-二苯基-2-三硝基苯肼,是一种很稳定的氮中心的自由基,他的稳定性主要来自共振稳定作用的3个苯环的空间障碍,使夹在中间的氮原子上不成对的电子不能发挥其应有的电子成对作用。它的无水乙醇溶液呈紫色,在517nm波长处有最大吸收,吸光度与浓度呈线性关系。。向其中加入自由基清除剂时,可以结合或替代DPPH?,使自由基数量减少,吸光度变小,溶液颜色变浅,借此可评价清除自由基的能力。即通过在517nm波长处检测样品清除DPPH?的效果,来计算抗氧化能力。 [1]实验研究表明,黄芩黄酮中清除DPPH自由基活性的主要成分是黄芩苷,黄芩苷中含有羧羟基和酚羟基能与DPPH反应,反应式如下: ONON22 +H+NNONNONNH22 NONO22 DPPH与抗氧化剂反应原理 材料:DPPH(1,1-二苯基-2-三硝基苯肼);无水乙醇; 仪器:分光光度计 1.DPPH贮备液的制备
准确称取DPPH试剂3(5mg,用无水乙醇溶解,并定量转入10mL容量瓶中,用无水乙醇定容至刻度,取2mL至100ml容量瓶中,摇匀得浓度为0.0178mmol,L DPPH贮备液,置于冰箱中冷藏备用。 2.试液的制备(只作参考) 准确称取5.2mg干燥的黄酮提取物(32.75%),用无水乙醇溶解,并定量转入 50ml容量瓶中,用无水乙醇定量至刻度,取10ml至100ml容量瓶中,摇匀得浓度为0.0233mmol,L试液。 3.DPPH?清除率的测定 在10mL比色管中依次加入4.0mLDPPH溶液和黄酮提取液,再加入无水乙醇至刻度,混匀立即用1cm比色皿在517nm波长处测吸光值(A),吸光值记为Ai,再在温室避光保存30min后测吸光值,记为Aj,对照试验为只加DPPH的乙醇溶液,其吸光值记为Ac。按下式计算自由基清除率(K): K(%)=[1-(Ai-Aj)/Ac]*100% 试验重复三次,取其平均值作为最后结果。 [1].刘玉萍,Purusotam Basnet,小松かっ子,曹晖.黄芩清除自由基活性与黄芩苷含量的相关性研究[J].中国中药杂志,2002,27(8):575-579 药品:DPPH(1,1-二苯基-2-三硝基苯肼); 推荐厂家:上海如吉生物科技发展有限公司; 北京诺博莱德科技有限公司; 报价:380元/瓶;500元/瓶; 规格:1g/瓶; 含量:99%; 产地:日本进口 DPPH稳定性不好,要用时,新鲜配制 DPPH浓度要根据样品的活性来定,一般在20-100μg/mL
超氧阴离子清除能力检测试剂盒说明书 可见分光光度法
第1页,共2页 超氧阴离子清除能力检测试剂盒说明书可见分光光度法 注意:正式测定之前选择2-3个预期差异大的样本做预测定。货号:BC1410规格:50T/48S 产品内容: 提取液:液体50mL×1瓶,4℃保存。试剂一:液体2mL×1瓶,4℃避光保存。 试剂二:粉剂×1瓶,4℃避光保存。临用前加8mL蒸馏水充分溶解。试剂三:液体10mL×1瓶,4℃保存。试剂四:液体10mL×1瓶,4℃避光保存。试剂五:液体10mL×1瓶,4℃避光保存。产品说明: 超氧阴离子自由基作为生物体代谢过程中产生的一种自由基,可攻击生物大分子,如脂质、蛋白质、核酸和聚不饱和脂肪酸等,使其交链或者断裂,引起细胞结构和功能的破坏,与机体衰老和病变有很密切的关系,清除超氧阴离子自由基的研究已经得到了广泛的关注。 AP-TEMED系统产生超氧阴离子,与盐酸羟胺反应生成NO 2- ,NO 2- 与对氨基苯磺酸和α-萘胺的作用生成红色的偶氮化合物,在530nm处有特征吸收峰,样品对超氧阴离子的清除能力与530nm的吸光值呈负相关。自备实验用品及仪器: 天平、研钵、低温离心机、可见分光光度计/酶标仪、1ml玻璃比色皿、恒温水浴锅。操作步骤:一、样品处理 1.组织:按照质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g,加入1mL提取液)加入提 取液,冰浴匀浆后于4℃,10000g离心10min,取上清置于冰上待测。
2.细胞:按照细胞数量(104个):提取液体积(mL)为500~1000:1的比例(建议500万细胞加入1mL提取 液),冰浴超声波破碎细胞(功率300w,超声3秒,间隔7秒,总时间3min);然后4℃,10000g离心10min,取上清置于冰上待测。 3.培养液或其它液体:直接检测。 4.粉剂药物可配制成相同浓度,比如1mg/mL。 二、测定操作 空白管对照管测定管 试剂一(μL)404040 试剂二(μL)160160 H2O(μL)260100 充分混匀,25℃反应1min 样品(μL)100 试剂三(μL)200200200 充分混匀,37℃反应30min 试剂四(μL)200200200 试剂五(μL)200200200 充分混匀,37℃显色20min,于1ml玻璃比色皿,以空白管调零,在530nm处测定对照管 和测定管的吸光值,分别记为A对照管和A测定管。 注意:空白管只需测定一次。 三、计算公式 超氧阴离子清除率I%=(A对照管-A测定管)/A对照管×100% 注意事项: 1.试剂一4℃可保存2个月,配制好的试剂二4℃可保存一周,建议实验前配制,并尽快使用。 2.样品处理完后立即进行测定,或者低温保存不超过24小时。 第2页,共2页
