高分子第三章习题
第三章自由基聚合
2、60℃过氧化二碳酸二乙基己酯在某溶剂中分解,用碘量法测定不同时间得残留引发剂浓度,数据如下,计算分解速率速率常数与半衰期。
解:引发剂分解属于一级反应,故-d[I]/dt=kd[I] 积分得ln[I]/[I]0=-kdt,以ln[I]/[I]0对t作图,所得直线得斜率为-kd。
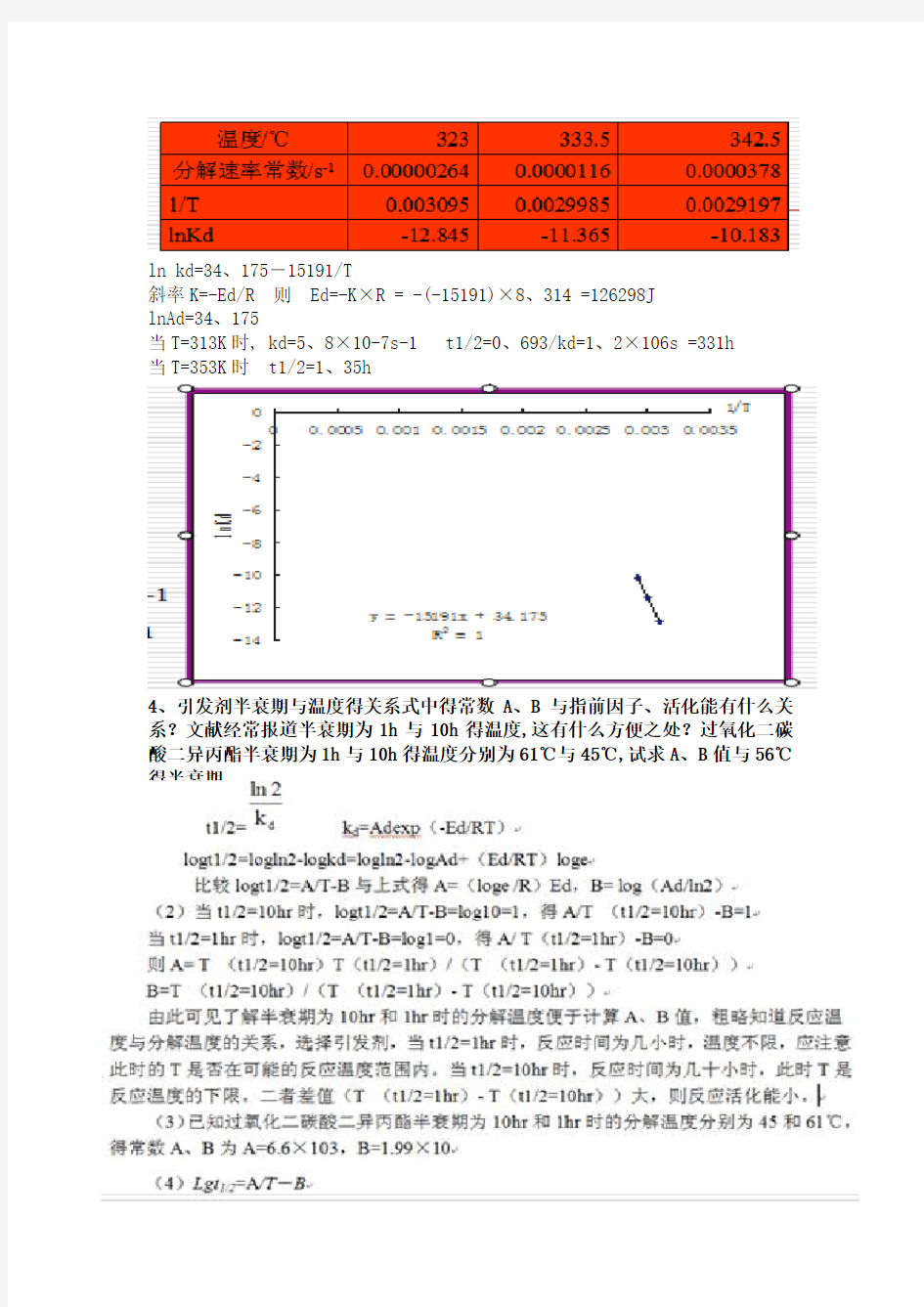
3、在甲苯中不同浓度下测定偶氮二异丁腈得分解速率常数,数据如下,求分解活化能。再求40℃与80℃下得半衰期,判断在这两温度下聚合就是否有效。
解:引发剂分解速率常数与温度得关系遵守Arrhenius 经验式:
kd=Ade-Ed/RT ln kd=lnAd-Ed/RT
在不同温度下,测定一引发剂得分解速率常数,作ln kd—1/T图,呈一直线。由截距可求得指前因子Ad,而根据斜率可求出分解活化能Ed。
ln kd=34、175-15191/T
斜率K=-Ed/R 则 Ed=-K×R = -(-15191)×8、314 =126298J
lnAd=34、175
当T=313K时, kd=5、8×10-7s-1 t1/2=0、693/kd=1、2×106s =331h
当T=353K时 t1/2=1、35h
4、引发剂半衰期与温度得关系式中得常数A、B与指前因子、活化能有什么关系?文献经常报道半衰期为1h与10h得温度,这有什么方便之处?过氧化二碳酸二异丙酯半衰期为1h与10h得温度分别为61℃与45℃,试求A、B值与56℃得半衰期。
列方程组容易解此题
5.过氧化二乙基得一级分解速率常数为1、0×1014exp(-146、5kJ/RT),在什么温度范围使用才有效?
解:引发剂得半衰期在1-10h内使用时,引发剂较为有效
由于kd=ln2/t1/2,根据题意kd= 1、0×1014exp(-146、5kJ/RT),
6、苯乙烯溶液浓度为0、20mol·L-1,过氧类引发剂浓度为4、0×10-3 mol·L-1,在60℃下聚合,如引发剂半衰期为44h,引发剂效率f=0、80,kp=145L·mol-1·s-1,kt=
7、0×107L·mol-1·s-1,欲达到50%转化率,需多长时间?
解: 不考虑[I]变化时,引发剂得半衰期为t1/2=44h,则
用引发剂引发时,聚合速率方程为: 积分得:(绿色得)
当转化率为50%时,
在计算时,假定引发剂得浓度不随时间变化而变化;实际上引发剂随时间增加而减少。反应时间远大于引发剂半衰期,表明在该温度下引发剂不合适,或者升高反应温度,或改用半衰期更长得引发剂。
7.过氧化二苯甲酰引发某单体聚合得动力学方程为:Rp=kP[M](fkd/kt)1/2[I]1/2,假定各基元反应得速率常数与f都与转化率无关,[M]0=2 mol L-1,[I]=0、01 mol L-1,极限转化率为10%。若保持聚合时间不变,欲将最终转化率从10%提高到20%,试求:
(1)[M]0增加或降低多少倍?(2)[I]0增加或降低多少倍?[I]0改变后,聚合速率与聚合度有何变化? (3)如果热引发或光引发聚合,应该增加或降低聚合
温度? Ed、Ep、Et分别为124、32 与8 kJ mol-1。
解:低转化率下聚合动力学方程:
令
(1)当聚合时间固定时,C与单体初始浓度无关,故当聚合时间一定时,改变不改变转化率。
(2)当其它条件一定时,改变,则有:
即引发剂浓度增加到4、51倍时,聚合转化率可以从10%增加到20%。由于聚合速率 ,故[I]0增加到4、51倍时,Rp 增加2、12倍。聚合度 ,故[I]0 增加到4、51倍时,Rp下降到原来0、471。即聚合度下降到原来得1/2、12。
(3)引发剂引发时,体系得总活化能为:
热引发聚合得活化能与引发剂引发得活化能相比,相当或稍大,温度对聚合速率得影响与引发剂引发相当,要使聚合速率增大,需增加聚合温度。
光引发聚合时,反应得活化能如下:
上式中无Ed项,聚合活化能很低,温度对聚合速率得影响很小,甚至在较低得温度下也能聚合,所以无需增加聚合温度。
8、以过氧化二苯甲酰作引发剂,苯乙烯聚合时各基元反应得活化能为Ed=125kJ·mol-1 , Ep=32、6kJ·mol-1 , Et=10kJ·mol-1 ,试比较从50 ℃增至60℃以及从80 ℃增至90 ℃聚合速率与聚合度得变化。光引发得情况又如何?
解:根据
E=Ep-Et/2+Ed/2=90、1×103J·mol-1则,
T1=323K T2=333K时
同理,T3=353K T4=363K时, Rp4/Rp3=2、33
假设没有链转移,并且温度升高不影响链终止得方式,则聚合度之比就等于其动力学链长之比。
E=Ep-Et/2-Ed/2=-34、9×103J·mol-1,则
(聚合度变化)
同理: Xn4/Xn3=v4/v3=0、72
光引发得情况下:(不考)
Ed=0,反应速率与平均聚合度关系中,表观总活化能均为E=Ep-Et/2=27、
6kJ·mol-1 ,所以反应速率与平均聚合度得变化情况相同
由50 ℃变化到60 ℃ Rp2/Rp1=v2/v1=1、36
由80 ℃变化到90℃ Rp4/Rp3=v4/v3=1、30
9.以过氧化二苯甲酰为引发剂,在60℃进行苯乙烯聚合动力学研究,数据如下:
a、 60℃苯乙烯得密度为0、887 g cm-3;
b、引发剂用量为单体重得0、109%;
c、Rp=0、25510-4 mol(L s)-1;
d、聚合度=2460;
e、 f=0、80;
f、自由基寿命=0、82 s。试求k-d、kp、kt,建立三常数得数量级概念,比较 [M]与[M]得大小,比较RI、Rp、Rt得大小。
10、 27℃苯乙烯分别用AIBN与紫外光引发聚合,获得相同得聚合速率(0、001mol·L-1·s-1)与聚合度(200),77 ℃聚合时,聚合速率与聚合度各就是多少?
解:根据公式
查表得各步活化能为 Ep=32、6kJ·mol-1 Et=10kJ·mol-1 Ed=128、4kJ·mol-1
则总表观活化能为E=Ep-Et/2+Ed/2=91、8 kJ·mol-1
11.对于双基终止得自由基聚合物,每一大分子含有1、30个引发剂残基,假设无链转移发生,试计算歧化终止与偶合终止得相对分子量。
解:活性链数目为X,偶合终止得Xc,则歧化反应得为X—Xc
根据终止后引发剂残基数相等X=[Xc/2+(X-Xc)]·1、30
化简:Xc/X = 2 – 2/1、3 Xc/X = 0、46 偶合46% 歧化54% 11、对于双基终止得自由基聚合物,每一大分子含有1、30个引发剂残基,假定无链转移反应,试计算歧化终止与偶合终止得相对量、
解:
设歧化终止与偶合终止得到得大分子相对量分别为x与y,
歧化终止,一个大分子链含1个引发剂残基
偶合终止,一个大分子链含2个引发剂残基
列方程组:
设进行歧化终止与偶合终止得链自由基得相对量分别为x与y,
歧化终止,1个链增长自由基生成一个大分子
偶合终止,2个链增长自由基生成一个大分子
列方程组:
12、以过氧化叔丁基作引发剂,60℃时苯乙烯在苯中进行溶液聚合,苯乙烯浓度为1、0mol·L-1,过氧化物浓度为0、01mol·L-1初期引发速率与聚合速率分别为4、0×10-11mol·L-1·s-1 与1、5×10-7mol·L-1·s-1 、苯乙烯-苯为理想体系,计算fkd、初期聚合度、初期动力学链长与聚合度,求由过氧化物分解所产生得自由基平均要转移几次,分子量分布宽度如何?
计算时采用如下数据:
CM=8、0×10-5 ,CI=3、2×10-4 ,CS=2、3×10-6 ,60℃下苯乙烯密度为0、
887g·mL-1 ,苯得密度为0、839g·mL-1
解: ①引发速率
②初期动力学链长,初期不发生链终止所以聚合度与动力学链长相等。
③聚合度,苯乙烯在60℃时动力学链全部为偶合终止
若无链转移,则Xn=2v=7500
若同时发生链转移,则
代入数据:
转移次数:由以上数据可计算出偶合终止生成得大分子占56%,转移终止生成得占44%。即有2×56个链自由基发生偶合终止就有44次链转移终止,因此每个增长链在失活前平均转移0、39次。(仅供参考)
分子量分布宽度:由于链转移终止得到得大分子得聚合度不同于偶合终止生成大分子得聚合度,聚合物分子量更不均一,所以分子量分布变宽。
高分子化学 第三章
第三章参考答案 2.下列烯类单体适于何种机理聚合自由基聚合,阳离子聚合或阴离子聚合 并说明理由。 解: ①.氯乙烯,适于自由基聚合。Cl -是吸电子基团,有共轭效应,但均较弱 ②.偏二氯乙烯,适于自由基聚合,但也可进行阴离子聚合。两个Cl -原子的共同作用使其可进行两种聚合。 ③.丙稀腈,适于自由基聚合和阴离子聚合。CN -基是强吸电子基团,并有共轭效应。
④. 2-腈基丙稀腈,适于阴离子聚合。两个CN -基的吸电子基团倾向 过强,只能阴离子聚合。 ⑤. 丙稀,由于烯丙基效应,使其易向单体转移,不能进行自由基聚 合。一般采取配位聚合的方式合成聚合物。 ⑥. 异丁烯,适于阳离子聚合。3CH -是供电子基团,且与双键有超共 轭效应,而且两个3CH -的共同作用,使其可以阳离子聚合。 ⑦. 苯乙烯,适于自由基聚合,阳离子和阴离子聚合。因为共轭体系π 电子容易极化并易流动。 ⑧. 四氟乙烯,适于自由基聚合。F -原子体积小,结构对称。 ⑨. 2-腈基丙烯酸酯,适于阴离子聚合和自由基聚合。CN -基和 COOR -两个吸电子基团使其易于阴离子聚合,同时又具有共轭效应, 可进行自由基聚合。 ⑩. 异戊二烯,适于自由基聚合,阳离子和阴离子聚合。因为共轭体 系π电子容易极化并易流动。 3. 判断下列烯类能否进行自由基聚合,并说明理由。 解: ①. CH 2=C(C 6H 5)2 偏二苯乙烯,不能。因为二苯基的空间位阻过大,只能 形成二聚体。
②. ClHC=CHCl 1,2-二氯乙烯,不能。因为单体结构对称,1,2-二取代又 具有较大的空间位阻。 ③. CH 2=C(CH 3)C 2H 5 2-甲基丁烯,不能。由于双键上的电荷密度过大, 不利于自由基的进攻,且易转移生成稳定的烯丙基自由基。 ④. CH 3CH=CHCH 3 2-丁烯,不能。因为单体结构对称,空间位阻较大, 且易生成烯丙基自由基。 ⑤. CH 2=CHOCOCH 3 丙烯酸甲酯,能。酯基有弱的吸电子效应及共轭效 应。 ⑥. CH 2=C(CH 3)COOCH 3 甲基丙烯酸甲酯,能。1,1-二取代空间位阻小, 且酯基有共轭效应。 ⑦. CH 3CH==CHCOOCH 3 2-丁烯酸甲酯,不能。由于 1,2-二取代具有较 大的空间位阻。 ⑧. CF 2=CFCl 三氟氯乙烯,能。由于氟的原子半径小,位阻效应可以忽略。 5. 是否所有的自由基都可以用来引发烯类单体聚合试举活性不等自由基3~4例,说明应用结果。() 不是。过于活波和过于稳定的自由基都不能引发烯类单体聚合。只有活性适中的自由基才能引发单体聚合。例如:??3 CH H 和过于活波,易引起爆聚,很少在自由基聚合中应用;??256 RCH H C 和自由基都可以用来引发烯类单体聚合;而()?C H C 356有三个苯环与P 独电子共轭,非常稳定,无引发能力,而成为阻聚剂。
第七章-糖类药物
第七章糖类药物 概述 1812年,俄国化学家基尔霍夫在加酸煮沸的淀粉中,得到葡萄糖。 1819年法国科学家布拉孔诺从木屑、亚麻和树皮中也得到葡萄糖,才认识到组成淀粉和纤维素的基本“单元”都是葡萄糖,得实验式C6H12O6。 1886年,德国化学家基利阿尼证明了葡萄糖的碳为直链,没有与完整的水分子相结合。 随后,糖的诸多其他生物学功能也已被逐步揭示和认识。糖蛋白、糖脂是细胞膜的重要组成部分,它们作为生物信息的携带者和传递者,调节细胞的生长、分化、代谢及免疫反应等。 概念及分类 定义:糖类是一类多羟基醛、酮及其衍生物的总称。 分类:按照糖类物质含糖单位数目分: (1)单糖:不能被水解成更小分子的糖 (2)寡糖:由单糖缩合而成的短链结构(一般为2~9个单糖分子) (3)多糖:由10个以上单糖链接而成的糖(一般的糖类药物指的就是多糖) (一)糖类药物的分类 糖类药物种类繁多,其分类方法也有多种,按照含有糖基数目不同可分为以下几类。 (1)单糖类:如葡萄糖、果糖、氨基葡萄糖和维生素C等。 (2)低聚糖类:如蔗糖、麦芽乳糖、乳果糖等。 (3)多糖类:多糖又有多种,根据其来源不同又可分为: ①来源于植物的多糖,如黄芪多糖、人参多糖、刺五加多糖; ②来源于动物的多糖,如肝素、透明质酸、硫酸软骨素等; ③来源于微生物的多糖,如香菇多糖、猪苓多糖、灵芝多糖、云芝糖肽等。 (4)糖的衍生物:如1,6-二磷酸果糖、6-磷酸葡萄糖、磷酸肌醇等。 糖缀化合物:包括糖蛋白和糖脂两大类复合多糖,它们是一种糖类和一种蛋白质或一种脂类缔合的产物。糖基:与活性或抗原性相关。半乳糖、甘露糖、乙酰氨基葡萄糖、乙酰氨基半乳糖等。 糖蛋白通常分为:胶原型、粘多糖型、蛋白聚糖型、寡聚甘露糖苷型和N-乙酰乳糖胺型,其中寡聚甘露糖苷型和N-乙酰乳糖胺型属于N-糖基蛋白。 寡糖残基:在发挥生物功能中期决定作用,贮存生物信息,捕获细胞间各种相互作用信息,联系其他细胞和细胞内外之间传递各种物质。 局限:长期以来,糖苷键合的高级多聚体的研究,仅限于储能物质和支撑结构的同质多聚体。 20世纪70年代起,糖缀合物尤其糖蛋白研究逐渐居于重要地位。
第三章 高分子溶液(2).
π 渗透压的产生是由于溶液的蒸汽压的降低 由于: 故:
溶剂可从良溶剂转变为劣溶剂,或从劣溶剂转变为良溶剂,从而导致高分子在溶剂中的溶解能力的变化。 G ?<聚合物与溶剂在任意比例下完全互溶?'?'' a ? b ?下变化时可能发生相分离,称为亚稳态。 ?'?'' a ? b ?当: 相分离的临界条件即为: 211C ?= +21C ?= 当 有: 1x 111 C χ=+熵的贡献
14 二、相分离的动力学 1、旋节线机理 体系的总组成位于两拐点之间,相分离按照旋节线机理进行。相分离自发缓慢进行,两相组成随时间逐渐变化,接近平衡组成。 分散相微区有一定的连接 最终形成双连续结构 相畴(即微区)尺寸的增长: 扩散 液体流动16 2、成核与生长机理 体系的总组成位于极小值和拐点之间,相分离按成核和生长机理进行。相分离必须克服热力学位垒,形成两分散相的核,然后不断生长。 分散相一般不会相互连接。 所需的界面能有关,即依赖于界面张力系数和核的表面积。 形态结构为:珠滴/基体型(海岛结构) 18 ★处于均相的共混物,当因温度的改变而进入旋节线和双节线之间的区域时,体系在热力学上处于亚稳态,不会进行相分离,但“相核”一旦形成,相分离便按成核和生长机理进行。★当体系随温度变化进入旋节线内的区域时,体系在热力学上是不稳定的,会自动产生相分离,相分离按照旋节线机理进行。
20含结晶性聚合物共混物的相分离过程(了解) Phase diagram of Polycaproloactone/Polystyrene (PCL/PS, 聚己内酯/聚苯乙烯) blends A :旋节相分离和结晶同时进行 B :双节线相分离和结晶同时进行 C :结晶诱导相分离 D :相分离诱导结晶 E :共混物淬冷到玻璃态,随后加 热过程中发生旋节相分离,同时诱导聚合物结晶。 凝胶和冻胶高分子溶液失去流动性
高分子化学 第三章教学教材
高分子化学第三章
第三章参考答案 2.下列烯类单体适于何种机理聚合?自由基聚合,阳离子聚合或阴离子聚 合?并说明理由。 解: ①.氯乙烯,适于自由基聚合。Cl -是吸电子基团,有共轭效应,但均较弱 ②.偏二氯乙烯,适于自由基聚合,但也可进行阴离子聚合。两个Cl -原子的共同作用使其可进行两种聚合。 ③.丙稀腈,适于自由基聚合和阴离子聚合。CN -基是强吸电子基团,并有共轭效应。
④. 2-腈基丙稀腈,适于阴离子聚合。两个CN -基的吸电子基团倾向过 强,只能阴离子聚合。 ⑤. 丙稀,由于烯丙基效应,使其易向单体转移,不能进行自由基聚 合。一般采取配位聚合的方式合成聚合物。 ⑥. 异丁烯,适于阳离子聚合。3CH -是供电子基团,且与双键有超共轭 效应,而且两个3CH -的共同作用,使其可以阳离子聚合。 ⑦. 苯乙烯,适于自由基聚合,阳离子和阴离子聚合。因为共轭体系π电 子容易极化并易流动。 ⑧. 四氟乙烯,适于自由基聚合。F -原子体积小,结构对称。 ⑨. 2-腈基丙烯酸酯,适于阴离子聚合和自由基聚合。CN -基和COOR -两个吸电子基团使其易于阴离子聚合,同时又具有共轭效应,可进行自由基聚合。 ⑩. 异戊二烯,适于自由基聚合,阳离子和阴离子聚合。因为共轭体系π 电子容易极化并易流动。 3. 判断下列烯类能否进行自由基聚合,并说明理由。 解: ①. CH 2=C(C 6H 5)2 偏二苯乙烯,不能。因为二苯基的空间位阻过大,只 能形成二聚体。
②. ClHC=CHCl 1,2-二氯乙烯,不能。因为单体结构对称,1,2-二取 代又具有较大的空间位阻。 ③. CH 2=C(CH 3)C 2H 5 2-甲基丁烯,不能。由于双键上的电荷密度过大, 不利于自由基的进攻,且易转移生成稳定的烯丙基自由基。 ④. CH 3CH=CHCH 3 2-丁烯,不能。因为单体结构对称,空间位阻较 大,且易生成烯丙基自由基。 ⑤. CH 2=CHOCOCH 3 丙烯酸甲酯,能。酯基有弱的吸电子效应及共轭效 应。 ⑥. CH 2=C(CH 3)COOCH 3 甲基丙烯酸甲酯,能。1,1-二取代空间位阻 小,且酯基有共轭效应。 ⑦. CH 3CH==CHCOOCH 3 2-丁烯酸甲酯,不能。由于 1,2-二取代具有 较大的空间位阻。 ⑧. CF 2=CFCl 三氟氯乙烯,能。由于氟的原子半径小,位阻效应可以忽 略。 5. 是否所有的自由基都可以用来引发烯类单体聚合?试举活性不等自由基 3~4例,说明应用结果。(P.67) 不是。过于活波和过于稳定的自由基都不能引发烯类单体聚合。 只有活性适中的自由基才能引发单体聚合。例如:??3 CH H 和过于活波,易引起爆聚,很少在自由基聚合中应用;??256 RCH H C 和自由基都可
第三章 高分子溶液课后习题
第3章高分子溶液 一、思考题 1.与高分子稀溶液相比,高聚物的浓溶液有何特性? 2.为高聚物选择溶剂时可采用哪几个原则?对某一具体高分子—溶剂体系,这几个原则都适用吗? 3.非晶态高聚物溶解与结晶高聚物溶解有何特点?为何说结晶高聚物比非晶高聚物的抗溶剂性好?结晶高聚物分别为极性和非极性时溶解机理有何不同? 4.什么叫高分子的θ溶液,它与理想溶液有何区别? 5.什么是溶剂化?结晶度、交联度和对聚合物的溶解度有怎样的影响? 6.高分子溶液晶格模型与小分子溶液晶格模型有何不同?写出Flory-Huggins 理论中M S ?、M H ?、M G ?的表达式,该理论的假设有哪些不合理之处?Huggins 参数的物理意义是什么? 7.何谓高聚物的溶胀比?如何测定它的数值?它与交联高聚物的网链平均分子量有何关系? 8.增塑剂对高聚物的增塑机理有哪两种较极端的情况?实际高聚物中的增塑机理如何? 9.什么是凝胶和冻胶?它们的结构区别是什么?何者能被加热溶解? 二、选择题 1.下列哪个溶剂是θ溶剂? ( ) ①1χ=0.1 ② 1χ=0.5 ③ 1χ=0.9 2.以下哪种溶剂是良溶剂? ( ) ①1χ=1 ② 2A =1 ③α=1 3.对于给定相对分子质量的某一聚合物,在何时溶液黏度最大? ( ) ①线型分子链溶于良溶剂中 ②支化分子链溶于良溶剂中 ③线型分子链溶于不良溶剂中 4.高分子良溶液的超额化学位变化 ( ) ①小于零 ②等于零 ③ 大于零 13.PVC 的沉淀剂是 ( ) ①环已酮 ② 氯仿 ③四氢呋喃 5.在高分子—良溶剂的稀溶液中,第二维利系数是 ( ) ①负数 ②正数 ③零 6.对于Flory-Huggins 的高分子溶液似晶格模型,符合其假定的是 ( ) ①V ?=0 ② H ?=0 ③ S ?=0 7.将高聚物在一定条件下(θ溶剂、θ温度)配成θ溶液,此时 ( ) ①大分子之间作用力=小分子之间作用力=大分子与小分子之间作用力 ②大分子之间作用力>大分子与小分子之间作用力 ③大分子之间作用力<大分子与小分子之间作用力 8.对非极性高聚物,选择溶剂应采用哪一原则较为合适? ( ) ①极性相似原则 ②溶剂化原则 ③溶度参数相近原则
第三章高分子溶液
第三章高分子溶液 第四章聚合物的分子量和分子量分布 一、 基本概念 1、溶胀;无限溶胀;有限溶胀 2、数量分数;重量分数 3、数均分子量;粘均分子量;重均分子量;Z均分子量 4、多分散性指数;分子量分布宽度指数;分子量分布 5、哈金斯参数;第二维列系数;溶度参数 6、混合熵;混合热;混合自由能 7、凝胶;冻胶 8、级分;校正曲线;普适校正曲线 9、θ溶剂;θ温度;θ溶液 10、特性粘数;溶胀度 11、粘度;爱因斯坦粘度定律 12、物理交联和化学交联 13、散射;瑞利散射;瑞利因子 14、过量化学位 15、临界共溶温度;上临界共溶温度;下临界共溶温度 16、体积排斥理论 17、柱效;分辩率 18、Zimm作图法 19、数量微分分布,重量微分分布,积分分布 20、内干涉,外干涉 21,凝胶渗透色谱法 二、选择题 1、下列四种聚合物在各自的良溶剂中,常温下不能溶解的为()。 A、聚乙烯, B、聚甲基丙烯酸甲酯, C、无规立构聚丙烯, D、聚氯乙烯 2、高分子溶液与小分子理想溶液比较,说法正确的是()。 A、高分子溶液在浓度很小时,是理想溶液。 B、高分子溶液在θ温度时,△μ1E=0,说明高分子溶液是一种真的理想溶液。 C、高分子溶液在θ条件时,△H M 和△S M 都不是理想值,不是理想溶液。 D、高分子溶液在θ条件时,高分子链段间与高分子链段和溶剂分子间相互作用不等。 3、聚合物溶度参数一般与其()无关。 A、分子量 B、极性大小 C、分子间力 D、内聚能密度 4、Huggins参数χ1在θ温度下的数值等于() A、0.0, B、0.5 , C、1.0, D、2.0 5、溶剂对聚合物溶解能力的判定原则,说法错误的是()。 A、“极性相近”原则 B、“高分子溶剂相互作用参数χ1大于0.5”原则 C、“内聚能密度或溶度参数相近”原则 D、“第二维修系数A2大于0”原则 6、下列哪种高聚物是单分散的为() A、HDPE B、PVC C、DNA 7、渗透压法测得的平均分子量,其物理意义为() A、数均分子量 B、粘均分子量 C、重均分子量
第三章 高分子的溶液性质
第七章 高聚物的力学性质 1 298K 时聚苯乙烯的剪切模量为1.25×109N ?m -2 ,泊松比为0.35,求其拉伸模量(E)和本体模量(B)是多少?并比较三种模量的数值大小. 解: 2991038.3)35.01(1025.12)1(2-??=+??=+=m N G E ν 299 1075.3) 35.021(31038.3)21(3-??=?-?=-=m N E B ν ∴ 本体模量(B) > 拉伸模量(E) > 剪切模量(G) 2 一种橡胶的剪切模量为107 cm -2 ,试用N ?m -2 和kg ?cm -2 表示时该模量的数值为多大? 解:)1.01(101.01022267---?=??=?=m N cm dyn m N G 24 6 2.1010 81.910-?=?=cm kg G 3 试证明当形变较小而各向同性的材料,在形变前后体积近似不变时,其泊松比υ=1/2,并指出各种模量的极限值. 解: 由题意, 0=?V ,或∞=?=V PV B /0 在)21(3)1(2νν-=+=B G E 中,得 0)21(3=-=νB E ,即2 1 =ν和G E 3= 故有 2 1 ~0=ν, G G E 3~2=, ∞=~3/E B , 3/~2/E E G =. 4 边长为2×10-2m 的粘弹立方体,其剪切柔量与时间的关系为1279]10/10[)(--?+=N m t t J ,今要使它在10-4、10-2、100、104、106s 后各产生剪切形变为m 3 104-?=?γ.试计算各需多重的砝码? (实验测定装置示意图见下).(缺图) 解: 由题意,剪切应变 2.002 .01043 =?=?=-D x s ε 由]10/10[)(7 9 t t J +=-,当t=10-4 s 时,
第三章高分子溶液
第三章习题 一、概念 1.溶度参数: 2. Huggins参数: 3.第二维利系数: 4. θ溶液: 二、选择答案 1、下列四种聚合物在各自的良溶剂中,常温下不能溶解的为( A )。 A、聚乙烯, B、聚甲基丙烯酸甲酯, C、无规立构聚丙烯, D、聚氯乙烯 2、高分子溶液与小分子理想溶液比较,说法正确的是(C )。 A、高分子溶液在浓度很小时,是理想溶液。 B、高分子溶液在θ温度时,△μ1E=0,说明高分子溶液是一种真的理想溶液。 C、高分子溶液在θ条件时,△H M 和△S M 都不是理想值,不是理想溶液。 D、高分子溶液在θ条件时,高分子链段间与高分子链段和溶剂分子间相互作用不等。 3、聚合物溶度参数一般与其(A )无关。 A、分子量 B、极性大小 C、分子间力 D、内聚能密度 4、Huggins参数χ1在θ温度下的数值等于(B ) A、0.0, B、0.5, C、1.0, D、2.0 5、溶剂对聚合物溶解能力的判定原则,说法错误的是(B )。 A、“极性相近”原则 B、“高分子溶剂相互作用参数χ1大于0.5”原则 C、“内聚能密度或溶度参数相近”原则 D、“第二维修系数A2大于0”原则 6、下列四种溶剂(室温下Huggings相互作用参数)中,室温能溶解聚氯乙烯的为( A )。 A、四氢呋喃(χ1=0.14) B、二氧六环(0.52) C、丙酮(0.63), D、丁酮(1.74) 7、下列四种溶剂中,对PVC树脂溶解性最好的是( A )。 A 环己酮, B 苯, C 氯仿, D 二氯乙烷 8、同一种聚合物在( A )中,其分子链的均方末端距最大。 A、良溶剂, B、浓溶液, C、熔体, D、θ溶液 三、填空题 1、Huggins参数和第二维利系数都表征了高分子“链段”与溶剂分子间之间的相互作用。 2、判定溶剂对聚合物溶解力的原则有(1)极性相近原则、(2) 溶度参数相近原则 和(3) 。 3、在高分子的θ溶液中,Huggins参数χ1=1/2 ,第二维列系数A2=0 ,此时高分子链段间的相互作用力等于高分子链段与溶剂分子间的作用力。 四、回答下列问题 1、为何称高分子链在其θ溶液中处于无扰状态?θ溶液与理想溶液有何本质区别?
第七章 高分子的结构 习题与思考题
第七章高分子的结构 习题与思考题 1.高分子的结构有何特点?高分子结构可以分为哪些结构层次?各结构层次包括哪些内容?它们对聚合物的性能会产生什么影响? 特点:①链式结构:结构单元103-105数量级 ②链的柔顺性:内旋转产生非常多的构象 ③多分散性,不均一性,长短不一。 ④结构单元间的相互作用对其聚集态结构和物理性能有着十分重要的影响。 ⑤凝聚态结构的复杂性:包括晶态、非晶态,球晶、串晶、单晶、伸直链晶等。 ⑥可填加其它物质改性。 分为:链结构和聚集态结构。 内容:链结构分为近程结构和远程结构。近程结构主要涉及分子链化学组成、构型、构造;远程结构主要涉及分子链的大小以及它们在空间的几何形态。聚集态结构包 括晶态、非晶态、液晶态、取向态结构及织态结构等。 影响:高分子结构中各个结构层次不是孤立的,低结构层次对搞结构层次的形成具有较大影响,近程结构决定了高分子的基本性能,而聚集态结构直接影响高分子的使 用性能。 2.写出线型聚异戊二烯的各种可能构型。 顺式1,4-加成反式1,4-加成1,2-加成全同立构1,2-加成间同立构 1,2-加成无规立构3,4-加成全同立构3,4-加成间同立构3,4-加成无规立构 3.名词解释 (1)构型:是指分子中由化学键所固定的原子在空间的几何排列。 (2)构象:由于分子中的单键内旋转而产生的分子在空间的不同形态 (3)链柔性:高分子链能够通过内旋转作用改变其构象的性能 (4)内聚能密度::单位体积的内聚能,CED = ?E/Vm。内聚能是克服分子间作用力,把1mol液体或固体分子移至分子引力范围之外所需的能量 (5)结晶形态:试样中结晶部分所占的质量分数(质量结晶度xcm)或者体积分数(体积结晶度xcv)。 (6)取向:聚合物取向是指在某种外力作用下分子链或其他结构单元沿着外力作用方向择优排列 (7)液晶:一些物质的结晶结构受热熔融或被溶剂溶解后,表观上虽然变成了具有流动性的液体物质,但结构上仍然保持着晶体结构特有的一维或二维有序排列,形成一种兼有部分晶体和液体性质的过渡状态 4.聚合物的构型和构象有何区别?假若聚丙烯的等规度不高,能否通过改变构象的方法来提高其等规度?全同立构聚丙烯有无旋光性? 构型是指分子中由化学键所固定的原子在空间的几何排列。构象由于分子中的单键内旋转而产生的分子在空间的不同形态。 不行。等规度指的是全同或间同立构单元所占的百分数。所以改变等规度必须是同构改变构型才能来改变。没有旋光性 5.从结构的角度出发,比较下列各组中聚合物的性能差异。 (1)高密度聚乙烯与低密度聚乙烯。 高密度聚乙烯为平面锯齿状链,为线型分子;低密度聚乙烯支化度高于高密度聚乙烯,结晶度较低
第三章 高分子的溶液性质.
第三章高分子的溶液性质 高聚物以分子状态分散在溶剂中所形成的均相混合物称为高分子溶液,它是人们在生产实践和科学研究中经常碰到的对象。高分子溶液的性质随浓度的不同有很大的变化。就以溶液的粘性和稳定性而言,浓度在1%以下的稀溶液,粘度很小而且很稳定,在没有化学变化的条件下其性质不随时间而变。纺丝所用的溶液一般在15%以上,属于浓溶液范畴,其粘度较大,稳定性也较差,油漆或胶浆的浓度高达60%,粘度更大。当溶液浓度变大时高分子链相互接近甚至相互贯穿而使链与链之间产生物理交联点,使体系产生冻胶或凝胶,呈半固体状态而不能流动。如果在高聚物中加入增塑剂,则是一种更浓的溶液,呈固体状,而且有—定的机械强度。此外能相容的高聚物共混体系也可看作是一种高分子溶液。 高分子的溶液性质包括很多内容: 热力学性质:溶解过程中体系的焓、熵、体积的变化,高分子溶液的渗透压,高分子在溶液中的分子形态与尺寸,高分子与溶剂的相互作用,高分子溶液的相分离等; 流体力学性质:高分子溶液的粘度、高分子在溶液中的扩散和沉降等;光学和电学性质:高分子溶液的光散射,折光指数,透明性,偶极矩,
介电常数等。 本章将着重讨论高分子溶液的热力学性质和流体力学性质。 第一节高聚物的溶解 3.1.1高聚物溶解过程的特点 ※高聚物的溶解过程要经过两个阶段,先是溶剂分子渗入高聚物内部,使高聚物体积膨胀,称为“溶胀”;然后才是高分子均匀分散在溶剂中,形成完全溶解的分子分散的均相体系。对于交联的高聚,只能停留在溶胀阶段,不会溶解。 ※溶解度与高聚物的分子量有关,分子量大的溶解度小,对交联高聚物来说,交联度大的溶胀度小,交联度小的溶胀度大。 ※晶态高聚物的溶解比非晶态高聚物要困难得多:非晶态高聚物的分子堆砌比较松散,分子间的相互作用较弱,因此溶剂分子比较容易渗入高聚物内部使之溶胀和溶解。晶态高聚物由于分子排列规整,堆砌紧密,分子间相互作用力很强,以致溶剂分子渗入高聚物内部非常困难。 3.1.2 高聚物溶解过程的热力学解释 溶解过程是溶质分子和溶剂分子互相混合的过程,在恒温恒压下,这种过程能自发进行的必要条件是Gibbs自由能的变化△F<0。
第七章 高分子的结构 习题与思考题讲解学习
第七章高分子的结构习题与思考题
第七章高分子的结构 习题与思考题 1.高分子的结构有何特点?高分子结构可以分为哪些结构层次?各结构层次包括哪些内容?它们对聚合物的性能会产生什么影响? 特点:①链式结构:结构单元103-105数量级 ②链的柔顺性:内旋转产生非常多的构象 ③多分散性,不均一性,长短不一。 ④结构单元间的相互作用对其聚集态结构和物理 性能有着十分重要的影响。 ⑤凝聚态结构的复杂性:包括晶态、非晶态,球 晶、串晶、单晶、伸直链晶等。 ⑥可填加其它物质改性。 分为:链结构和聚集态结构。 内容:链结构分为近程结构和远程结构。近程结构主要涉及分子链化学组成、构型、构造;远程结构主 要涉及分子链的大小以及它们在空间的几何形 态。聚集态结构包括晶态、非晶态、液晶态、取 向态结构及织态结构等。 影响:高分子结构中各个结构层次不是孤立的,低结构层次对搞结构层次的形成具有较大影响,近程结
构决定了高分子的基本性能,而聚集态结构直接 影响高分子的使用性能。 2.写出线型聚异戊二烯的各种可能构型。 顺式1,4-加成反式1,4-加成 1,2-加成全同立构 1,2-加成间同立构 1,2-加成无规立构 3,4-加成全同立构 3,4-加成间同立构 3,4-加成无规立构 3.名词解释 (1)构型:是指分子中由化学键所固定的原子在空间的几何排列。 (2)构象:由于分子中的单键内旋转而产生的分子在空间的不同形态 (3)链柔性:高分子链能够通过内旋转作用改变其构象的性能 (4)内聚能密度::单位体积的内聚能,CED = ?E/Vm。 内聚能是克服分子间作用力,把1mol液体或固体分 子移至分子引力范围之外所需的能量 (5)结晶形态:试样中结晶部分所占的质量分数(质量结晶度xcm)或者体积分数(体积结晶度xcv)。 (6)取向:聚合物取向是指在某种外力作用下分子链或其他结构单元沿着外力作用方向择优排列
第三章第三节合成高分子化合物
第三节合成高分子化合物 【学习目标】 1、了解高分子化合物的分类、组成与结构特点, 能根据加成聚合反应产物的分子式确定单 体和链节. 2、体会合成高分子化合物常用的两种方法——加成聚合反应、缩合聚合反应,能列举常见 高分子化合物的聚合反应并写出其反应的化学方程式(限于教材中列出的化学方程式) 3、知道高分子化学反应是合成某些特殊聚合物的方法,并能够实现高分子化合物的改性。 4、知道高分子材料与高分子化合物的关系,能举例说明一些常见高分子材料的用途,了解 几种功能高分子材料的特殊性能,体会高分子科学在发展经济、提高人们生活质量方面的作用。 【教学重难点】 1、能根据加成聚合反应产物的分子式确定单体和链节。 2、了解加成聚合反应和缩合聚合反应的特点 第一课时高分子化合物 【课前预习区】 1、【温故知新】写出下列反应的化学方程式 (1)生成聚氯乙烯: (2)生成聚苯乙烯: (3)生成聚四氟乙烯: (4)乙丙树脂是乙烯和丙烯(CH3—CH=CH2)通过加聚反应得到的。若乙烯和丙烯以1:1的物质的量发生加聚反应,试写出化学方程式:
2、【新知预习】 1.什么高分子化合物?它们的单体、链节、链节数如何定义的? 是指由许多小分子化合物以共价键结合成的,相对分子质量很高的一类化合物.简称为聚合物或高聚物.单体-能用来合成高分子化合物的小分子化合物。重复结构单元—链节。链节的数目n称为链节数。 2.高分子化合物是如何分类的? ①按来源分类 ②按分子链的连接形式分类 ③按受热时的不同行为分类 ④按工艺性质和使用分类 按来源分类:天然高分子(天然橡胶、纤维素、淀粉) 合成高分子(合成橡胶、合成纤维、塑料) 按高分子链的连接形式分类:线型高分子、支链型高分子、体型高分子; 按合成高分子化合物受热时的不同行为分类:热塑性高分子、热固性高分子 按工艺性质和应用分类:塑料、橡胶、纤维、涂料、黏合剂与密封材料。 3.什么是加聚反应、缩聚反应?二者有何区别和联系? 加成聚合反应:单体通过加成的方式生成高分子化合物的反应,简称加聚反应. 缩合聚合反应:单体通过分子间的相互缩合而生成高分子化合物的聚合反应,简称缩聚反应。【课堂互动区】 【问题组1】 1、从化学键断裂和形成角度分析,生成聚乙烯和聚苯乙烯反应的本质是什么? 2、乙烯和聚氯乙烯、苯乙烯和聚苯乙烯在组成上有什么共同点? 3、什么叫加聚反应?具有什么特点的有机物可以发生加聚反应? 4、什么是单体、链节、聚合度? 加成聚合反应:单体通过加成的方式生成高分子化合物的反应,简称加聚反应. 特点:单体含有不饱和键,没有副产物生成,链节和单体的化学组成是否相同 单体-能用来合成高分子化合物的小分子化合物。重复结构单元—链节。链节的数目n称为链节数。 【小结】一、高分子化合物 1、高分子化合物概述 几个概念:
高分子第三章习题参考答案
高分子第三章习题参考答案 第1题:无规、交替、嵌段、接枝共聚物的结构有何差异?在这些共聚物名称中,对前后单体的位置有何规定? 参考答案: 无规共聚物是聚合物中两单元M1、M2无规排列,而且M1、M2连续的单元树不多。 交替共聚物是聚合物中两单元M1、M2严格相间。 嵌段共聚物是聚合物中由较长的M1链段和另一较长的M2链段构成的大分子。 接枝共聚物是聚合物主链由单元M1组成,而支链则由另一单元M2组成。 无规共聚物名称中前一单体为主单体,后为第二单体。 嵌段共聚物名称中的前后单体则代表单体聚合的次序。 接枝共聚物中前单体为之链,后单体则为支链。 第3题;当r1= r2=1;r1= r2=0;r1>0,r2=0;r1·r2=1等特殊情况下,d[M1]/ d[M2]=f([M1]/ [M2]),F1=f(f1)的函数关系如何? 参考答案: 当r1= r2=1时,d[M1]/ d[M2]= [M1]/ [M2],F1= f1; 当r1= r2=0时,d[M1]/ d[M2]=1,F1= 0。5; 当r1>0,r2=0时,d[M1]/ d[M2]=1+r1·[M1]/ [M2],F1>50%; 当r1·r2=1 ,d[M1]/ d[M2]= r1·[M1]/ [M2] ,F1= r1·f1。
第6题:两单体的竞聚率r1=2.0,r2=0.5,如f10=0.5,转化率C=50%,试求共聚物组成。 参考答案:因为换化率大于10%,只能用积分公式计算。 式中 因为:γ=0 所以: 故而:
整理上式得:f12-3f1+1=0 解方程得: 将f1和f10及C代入: 解得:F1=0.62 第13题:甲基丙烯酸甲酯、丙烯酸甲酯、苯乙烯、马来酸酐、醋酸乙烯酯、丙烯腈等单体与丁二烯共聚,试以交替倾向的次序排列,说明原因。 参考答案: 根据r1·r2乘积的大小,可以判断两单体交替共聚的倾向。即r1·r2→0,两单体发生共聚;r1·r2越趋向于零,交替倾向月大。各单体的r1、r2和r1·r2值如下表:
高分子材料第三章题目
名解 电粘效应:当聚电解质溶液的浓度逐渐变稀时,电解质溶质在水中的电离度相应增加,大分子链上电荷密度增加,分子链更加舒张伸展,使得溶液黏度迅速上升 二.选择题 1. 溶剂对聚合物溶解能力的判定原则,说法错误的是(B) A“极性相近”原则 B“高分子溶剂相互作用参数X1大于0.5”原则 C“内聚能密度或溶度参数相近”原则 D“第二维修系数A2大于0”原则 2. 聚合物溶度参数一般与其(A)无关 A分子量 B极性大小 C分子间力 D内聚能密度 3. 聚合物的分子量(C) A 对于多分散性聚合物,数均分子量<重均分子量<粘均分子量 B 单分散性聚合物,数均分子量=重均分子量=粘均分子量 C 粘度法得到的是重均分子量 D 以上均不是 4. 下列哪项不属于溶解高分子材料溶剂选择的基本原则(A) A pH值相似原则 B 溶度参数相近原则 C 极性相似相溶原则 D 溶剂化原则 5..聚合物溶解必要条件是(A) A 、吉布斯自由能变化(△ Gm)小于零。 B 、吉布斯自由能变化(△ Gm )大于零。 C 、吉布斯自由能变化(△ Gm )等于。 D 、以上均不正确 6. 控释、缓释给药的机制不包括(C) A、扩散、溶解 B、渗透 C、释放和穿透 D、离子交换和高分子挂接 7. 高分子化合物分子量的测定方法为(B) A、气相色谱法 B、黏度法 C、X -衍射 D、原子吸收光谱 填空 既不溶于溶剂也不会熔融的高聚物属于(体)型高聚物。既可溶于适当
的溶剂,又会熔融的高聚物属于(线)型高聚物 2. 粘度为流体中两个液层之间内摩擦力大小的量,度粘度的表示方法有相对粘度、增比粘度、比浓粘度、比浓对数粘数、特性粘数 3、膜分离过程可概述为以下三种形式:渗析式膜分离、过滤式膜分离、液膜分离 简答问答 1. 高分子的溶解过程如何?对晶态和非晶态高聚物来讲,有何不同?答:聚合物的溶解是一个缓慢过程,包括两个阶段:先溶胀后溶解。 交联聚合物,由于交联的束缚不能溶解。但交联点之间的链段可发生弯曲和伸展,因此可发生溶胀。 非晶态聚合物:溶剂分子容易渗入高聚物内部使之溶胀和溶解。 晶态高聚物:溶解困难。加热到熔点附近才能溶解;如果发生强烈的相互作用,如形成氢键,则在室温下也可溶解。 2. 试述特性粘度与分子量的关系。 答:如果高聚物分子的分子量愈大,则它与溶剂间的接触表面也愈大,摩擦就大,表现出的特粘度也大。特性粘度和分子量之间的经验关系可以用Mark-Houwink方程(马克-霍温克方程)来表示: 式中,M为试样的分子量;K为比例常数;α是与分子形状有关的经验参数。K和α值与温度、聚合物、溶剂性质有关,也和分子量大小有关。K 值受温度的影响较明显,而α值主要取决于高分子线团在某温度下,某溶剂中舒展的程度。 3.在强聚电解质离子溶液中加入低分子电解质或外加的盐浓度达到临界浓度时,聚电解质离子从溶液中析出,那么引起这种相分离现象的原因是什么? 答:引起这种现象的原因主要有两个方面,一是低分子反离子屏蔽了聚离子的部分电荷,减少了聚离子本身之间的斥力,就像异号离子使胶体溶液沉淀一样;二是反离子与聚离子中某些基团形成定位束缚或络合,改变了基团的离子性质,提高了聚离子链中非高子链节的成分,从而降低了聚离子与水分子间的亲和力(溶剂化作用),当不断加入低分子电解质时,非离子链节不断增多,最后大分子便从水中析出。 4 高分子溶液的性质 荷电性(正电、负电)、粘性(粘稠性液体)、聚结特性(水化膜破坏、荷电发生改变)、胶凝性(温度降低时成为凝胶)、渗透压(较高,与浓度有关 5. 似晶格模型的不合理之处有哪些?
第三章有机合成及其应用合成高分子化合物
第三章有机合成及其应用合成高分子化合物 (2013年山东高考有机题)聚酰胺一66常用于生产帐篷、渔网、降落伞及弹力丝袜等织物, 可利用下列路线合成: CH 2CH^CH2CH 2 HC1 2NaCN *C1 OH D ① C 己知反应;R-CN 話J R-COOH R-CN-孟*氓YH 押2 (1) ________________________________________________________________________________ 能与银氨溶液反应的 B 的同分异构体的结构简式为 ______________________________________________________ (2) D 的结构简式为 ________________ ,①的反应类型为 ______________________ (3) _________________________________________________________________________ 为检验D 中的官能团,所用试齐炮括 NaOHK 溶液及 ___________________________________________________ (4 )由F 和G 生成H 的反应方程式为 ______________________________________________________________ 【本章教材整体说明】 有机合成是有机化学最令人瞩目的领域,在工业、农业和科学研究等方面,都有广泛 的应用。目前人类已知的有机化合物大多数是通过合成得到的。 在一个旧的自然界旁边建立 了一个新的“自然界”。 【第1节“有机化合物的合成”】 不仅可以让学生学习合成的路线设计的方法, 体会有机合成对人类的影响, 还可以起到全面 整合有机化合物、官能团、结构、反应、性质、转化和合成之间的关系,更深刻地体会有机 化学的内在联系和创造价值 。 【学习目标】 1. 初步了解有机合成路线设计的基本思路; 2. 知道有机合成设计的一般程序,能对给出的合成路线进行简单的分析和评价; 3. 能够运用逆推法设计简单有机分子的合成路线; 4. 了解使碳链增长、缩短的反应类型; 5. 综合各类有机物间的相互转化关系,知道在碳链上引入特定的官能团的反应途径; 6. 认识卤代烃的组成和结构特点,掌握卤代烃的重要化学性质。 CH 2CH2CH2CH 2 ----- CN CN E HC 聚St 胺一66) G 」
高分子分离膜
高分子分离膜polymeric membrane for separation 图片: gaofenzi fenlimo 高分子分离膜(卷名:化工) polymeric membrane for separation 由聚合物或高分子复合材料制得的具有分离流体混合物功能的薄膜。膜分离过程就是用分离膜作间隔层,在压力差、浓度差或电位差的推动力下,借流体混合物中各组分透过膜的速率不同,使之在膜的两侧分别富集,以达到分离、精制、浓缩及回收利用的目的。单位时间内流体通过膜的量(透过速度)、不同物质透过系数之比(分离系数)或对某种物质的截留率是衡量膜性能的重要指标。分离膜只有组装成膜分离器,构成膜分离系统才能进行实用性的物质分离过程。一般有平膜式、管膜式、卷膜式和中空纤维膜式分离装置。 沿革早在20世纪初已有用天然高分子或其衍生物制透析、电渗析、微孔过滤膜。1953年,美国C.E.里德提出了用致密的醋酸纤维素制的膜将海水分离为水和盐,当时由于水的透过速度极小而未能实用。1960年S.洛布和S.索里拉金成功地开发了各向异性的不对称膜的制备方法。由于起分离作用的活性层极薄,流体通过膜的阻力小,从而开拓了高分子分离膜在工业上的应用。之后出现了中空纤维膜,使高分子分离膜更适于工业用途。70年代以来,气体分离膜、透过蒸发膜、液体膜以及生物医学用膜的研究,开拓了高分子分离膜应用新领域。 分类高分子分离膜可按结构分为:①致密膜,膜中无微孔,物质仅从高分子链段之间的自由空间通过;②多孔质膜,一般膜中含有孔径为0.02~20μm的微孔,可用于截留胶体粒子、细菌、高分子量物质粒子等;③不对称膜,由同一种高分子材料制成,膜的表面层与膜的内部结构不相同,表面层为0.1~0.25μm薄的活性层,内部为较厚的多孔层;④含浸型膜,在高分子多孔质膜上含浸有载体而形成的促进输送膜和含有官能基团的膜,如离子交换膜;⑤增强膜,以纤维织物或其他方式增强的膜。 按膜的分离特性和应用角度可分为反渗透膜(或称逆渗透膜)、超过滤膜、微孔过滤膜、气体分离膜、离子交换膜、有机液体透过蒸发膜、动力形成膜、镶嵌带电膜、液体膜、透析膜、生物医学用膜等多种类别。 主要材料最初用作分离膜的高分子材料是纤维素酯类材料。后来,又逐渐采用了具有各种不同特性的聚砜、聚苯醚、芳香族聚酰胺(见芳香族聚酰胺纤维)、聚四氟乙烯(见氟树脂)、聚丙烯、聚丙烯腈、聚乙烯醇、聚苯并咪唑、聚酰亚胺等。高分子共混物和嵌段、接枝共聚物(见聚合物)也越来越多地被用于制分离膜,使其具有单一均聚物所没有的特性。制备高分子分离膜的方法有流延法、不良溶剂凝胶法、微粉烧结法、直接聚合法、表面涂覆法、控制拉伸法、辐射化学侵蚀法和中空纤维纺丝法等。 应用对近沸点混合物、共沸混合物、异构体混合物等难以分离的混合物体系,以及某些热敏性物质,能够实现有效的分离。采用反渗透法进行海水淡化所需能量仅为冷冻法的1/2,蒸发法的1/17,操作简单,成本低廉。因此,反渗透法有逐渐取代多级闪蒸法的趋势(见表)。
高分子物理第三章习题及解答
第三章 3.1 高分子的溶解 3.1.1 溶解与溶胀 例3-1 简述聚合物的溶解过程,并解释为什么大多聚合物的溶解速度很慢? 解:因为聚合物分子与溶剂分子的大小相差悬殊,两者的分子运动速度差别很大,溶剂分子能比较快地渗透进入高聚物,而高分子向溶剂地扩散却非常慢。这样,高聚物地溶解过程要经过两个阶段,先是溶剂分子渗入高聚物内部,使高聚物体积膨胀,称为“溶胀”,然后才是高分子均匀分散在溶剂中,形成完全溶解地分子分散的均相体系。整个过程往往需要较长的时间。 高聚物的聚集态又有非晶态和晶态之分。非晶态高聚物的分子堆砌比较松散,分子间的相互作用较弱,因而溶剂分子比较容易渗入高聚物内部使之溶胀和溶解。晶态高聚物由于分子排列规整,堆砌紧密,分子间相互作用力很强,以致溶剂分子渗入高聚物内部非常困难,因此晶态高聚物的溶解要困难得多。非极性的晶态高聚物(如PE)在室温很难溶解,往往要升温至其熔点附近,待晶态转变为非晶态后才可溶;而极性的晶态高聚物在室温就能溶解在极性溶剂中。 例3-2.用热力学原理解释溶解和溶胀。 解:(1)溶解:若高聚物自发地溶于溶剂中,则必须符合: 上式表明溶解的可能性取决于两个因素:焓的因素()和熵的因素()。焓的因素取决于溶剂对高聚物溶剂化作用,熵的因素决定于高聚物与溶剂体系的无序度。对于极性高聚物前者说影响较大,对于非极性高聚物后者影响较大。但一般来说,高聚物的溶解过程都是增加的,即>0。显然,要使<0,则要求越小越好,最好为负值或较小的正值。极性高聚物溶于极性溶剂,常因溶剂化作用而放热。因此,总小于零,即<0,溶解过程自发进行。根据晶格理论得 =(3-1) 式中称为Huggins参数,它反映高分子与溶剂混合时相互作用能的变化。的物理意义表示当一个溶剂分子放到高聚物中去时所引起的能量变化(因为)。而非极性高聚物溶于非极性溶剂,假定溶解过程没有体积的变化(即),其的计算可用Hildebrand的溶度公式: =(3-2) 式中是体积分数,是溶度参数,下标1和2分别表示溶剂和溶质,是溶液的总体积。从式中可知总是正的,当 时,。一般要求与的差不超过1.7~2。综上所述,便知选择溶剂时要求越小或和 相差越小越好的道理。 注意: ①Hildebrand公式中仅适用于非晶态、非极性的聚合物,仅考虑结构单元之间的色散力,因此用相近原则选择溶剂时有例外。相近原则只是必要条件,充分条件还应有溶剂与溶质的极性和形成的氢键程度要大致相等,即当考虑结构单元间除有色散力外,还有偶极力和氢键作用时,则有
第七章 无机高分子材料及其应用
摘要本文简要地介绍了无机高分子地定义、分类,以及一些重要无机高分子材料地性能及其应用. 关键词无机高分子材料无机聚合物性能和应用 、前沿 随着人们对健康、安全、环境意识地强化,尤其天然气和石油资源地日趋耗竭,材料未来总地发展趋向于:逐步由非金属材料部分地替代金属材料,而在非金属材料中,无机材料在许多领域中将越来越多地取代有机材料.因此,由蕴藏量极其丰富而廉价地无机矿物制备无毒、耐高温、耐老化、高强度甚至多功能化地无机材料是当今世界材料学研究地重要方向之一.无机高分子材料因能符合这些要求而日益引起重视.个人收集整理勿做商业用途 无机高分子也称为无机聚合物,是介于无机化学和高分子化学之间地古老而又新兴地交叉领域.实际上,传统地无机化学中许多内容属于无机聚合物,许多无机物本身就是聚合物,例如金刚石、二氧化硅、玻璃、陶瓷和氧化硼.第一届国际无机聚合物会议于年召开,会上把无机聚合物定义为:凡在主链上不含碳原子地多聚化合物称为无机聚合物,如此定义相当于把离子晶体及固态金属也包括在内,故后来有人建议把无机聚合物定义为:主链由非碳原子共价键结合而成地巨大分子.个人收集整理勿做商业用途 、无机高分子地分类 均链聚合物 主链由同种元素组成地聚合物为均链聚合物. 周期表中Ⅳ、Ⅴ、Ⅵ主族地大部分元素及Ⅲ族地元素能生成均链聚合物.例如金刚石和石墨,三维网络固态聚合物、、、、、、、和地聚合分子等.但由于形成主链地同种原子之间地键能低于———键能,表现为稳定性甚差、易分解,而且当前合成地均链聚合物聚合度甚低,所以缺乏应用价值.个人收集整理勿做商业用途 表一原子之间键能(计算值) 均链键能()杂链键能() 化学键键能化学键键能 —— —— —— —— —— —— —— — ——
