晶体结构,配合物结构知识点与习题1-1

117
晶体结构
一、基本概念(The Basic Concepts ): 1.晶体(Crystals ):
(1)物质的质点(分子、离子或原子)在空间有规则地排列而成的、具有整齐外形的、以多面体出现的固体物质,称为
晶体。
(2) 晶体有同质多象性 由同样的分子(或原子)可以以不同的方式堆积成不同的晶体,这种现象叫做同质多象性。但
同一种物质的气态、液态只存在一种结构。
(3) 晶体的几何度量和物理效应常随方向不同而表现出量上的差异,这种性质称为各向异性。 2.晶格(Crystal lattices )
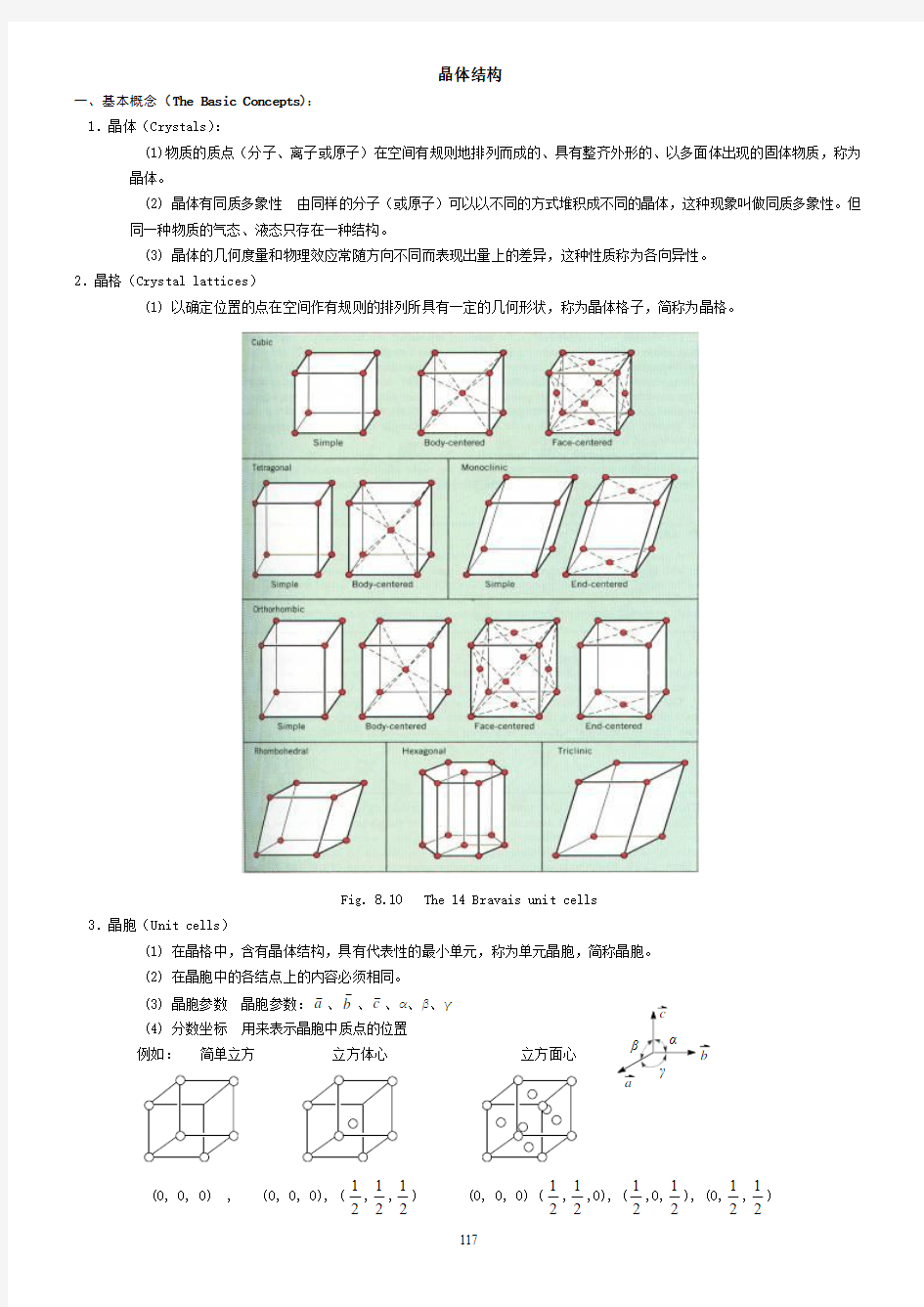
(1) 以确定位置的点在空间作有规则的排列所具有一定的几何形状,称为晶体格子,简称为晶格。
Fig. 8.10 The 14 Bravais unit cells
3.晶胞(Unit cells )
(1) 在晶格中,含有晶体结构,具有代表性的最小单元,称为单元晶胞,简称晶胞。 (2) 在晶胞中的各结点上的内容必须相同。 (3) 晶胞参数 晶胞参数:a
、b
、c
、α、β、γ (4) 分数坐标 用来表示晶胞中质点的位置
例如: 简单立方 立方体心 立方面心
(0, 0, 0) , (0, 0, 0), (21,21,21) (0, 0, 0) (21,21,0), (21,0,21), (0,21,2
1
) α
βγb
c a
118
在分数坐标中,绝对不能出现1,因为1即0。这说明晶胞是可以前后、左右、上下平移的。等价点只需要一个坐标来表示即可,上述三个晶胞中所含的质点分别为1、2、4,所以分数坐标分别为1组、2组和4组。
(5) 晶面指数 晶面在三维空间坐标上的截距的倒数(h 、k 、l )来表示晶体中的晶面,称为晶面指数,如立方晶系中
(100),(110),(111)面分别为
(100) (110)
(111)
l
Fig. 8.12 Selected planes and their Miller indices for cubic system
用X-ray 的衍射可以测量晶体中的面间距,2d ·sin θ = n ·λ。
d -晶体的面间距,θ-衍射角,n -衍射级数,λ-X-ray 的波长。
对于立方晶系,面间距(d )晶胞参数(a )之间的关系式:
222l k,h,/l k h a d ++=
4.根据晶体中质点内容的不同,晶体可分类成:金属晶体(metallic crystals )、离子晶体(ionic crystals)、原子晶体(atomic crystals)、分子晶体(molecular crystals)、混合晶体(mixture crystals) 二、金属键与金属晶体(Metallic Bond and Metallic Crystals ) 1.金属键理论(Metallic bond ) (1) 改性的共价键理论
(2) 能带理论(band theory )(以分子轨道理论为基础)
(a) 能带理论的基本要点
(i) 按照分子轨道理论,把整个金属晶体看作一
个大分子,把金属
中能级相同的原子轨道线性组合(原子轨道重叠)起来,成为整个金属晶
体共有的若干分子轨道,合称为能带(energy band),即金属晶体中的n 个原子中的每一种能量相等的原子轨道重叠所形成的n 个分子轨道,称为一个能带;
Fig. 8.15 Bands of molecular orbitals in a metal crystal.
Fig 8.14 Arrangement of atoms in a lithium crystal
119
Fig. 8.16 The partially filled band of “molecular orbitals ” in a metal. (Left) The highest filled level is referred to as the Fermi level. (Right) The electrons are freer to move in the now partially filled levels, this property accounts for the electrical conductivity of metals.
Fig. 8.17 Band theory applied to semiconductors and insulators. In contrast to metals, the band of filled levels (the valence band) is separated from the band of empty levels (the conduction band) by a band gap. The band gap can
range from just a few kJ ·mol -1 to 500 kJ ·mol -1
or more.
(ii) 按照分子轨道法,金属晶体中的多原子形成多原子离域键,n 个原子轨道线性组合成n 个分子轨道,其中有n /2个成键分子轨道,有n /2个反键分子轨道(图8.15);
(iii) 由n 个相同的充满电子的原子轨道重叠所形成的能带,称为满带(filled band );由n 个相同的未充满电子的原子轨道重叠所形成的高能量能带,称为导带(conduction band ),能带与能带之间的间隔是电子不能存在的区域,称为禁带(forbidden band )。凡无电子的原子轨道重叠所形成的能带,称为空带(empty bond );凡价电子所在的能带,称为价带(valence band )。满带与空带相互重叠,会使满带变成导带(conduction bond )(图8.16,8.17)。 (b) 能带理论的应用
(i) 可以区别导体、绝缘体和半导体 ?? 决定于禁带宽度(E g )。E g ≤0.3eV 的物质属于导体,0.3eV <E g ≤3eV 的物质属于半导体,E g ≥5eV 的物质属于绝缘体。
(ii) 可以说明金属的导电性随电性随温度的升高而降低。这是因为温度升高,金属中的原子或离子振动加剧,电子在导带中跃迁受到的阻力加大的缘故。
(iii) 可以解释金属具有光泽。这是由于金属中的价电子可吸收波长范围很广的光子射线而跳到较高能级,当跳回到较低能级时又可将吸收的光子发射出来的缘故。 2.金属晶体(Metallic crystals ):
(1) 金属晶体是以紧密堆积方式排列,此种排列方式的势能低,晶体较稳定,而且空间利用率大。空间利用率 = 晶胞中球所占的体积 / 晶胞的体积
(2) 平面密堆积(密置单层)
把金属原子看作等径的圆球,按右图方式堆积,此种堆积称为密置单层(图8.18)。在密置单层中,球数︰三角形空穴数=1︰2。
证明:在
ABCD 中,球数=4×(1/4),三角形空穴数=2,故证得。
另证:在正六边形中,三角形空穴数=6,球数=6 × (1/3) + 1=3, ∴球数︰三角形空穴数=3︰6=1︰2
Fig. 8.18 Closest-packing of spheres of one layer. Fig. 8.19 Closest-packing of spheres of two layers.
(3) 密置双层:第二密置层的球必须排在第一密置层的三角形空穴上(图8.19)。 a .密置双层中的空隙种类:
(i) 正四面体空隙 第一层的三个相切的球与第二层在其三角形空穴上的一个球组成(图8.20);(ii) 正八面体空隙 第一层的三个相切的球与第二层的三个相切的球,但上、下球组成的两个三角形方向必须相反(图8.21)。
120
Fig. 8.20 Tetrahedral holes are surrounded Fig. 8.21 Octahedral holes in a closest packed structure
by four atoms arranged toward are surrounded by six atoms arranged toward
the corners of a tetrahedron the corners of an octahedron b .证明:球数︰正四面体空隙︰正八面体空隙 = 2︰2︰1
上下两层各取四个球(图8.22),其中有两个正四面体空隙(5-1、2、3;4-6、7、8),一个正八面体空隙(3-5、2、平行四边形的贡献
4、7-6),球数为4 × (1/4) + 4 × (1/4) = 2(因为平行四边形顶点上的球对为1/4,即每个顶点上的球为四个平行四边形共享)故证得。 (4) 在密置双层上加第三层、第四层……(立体结构)
a .第一种密置方法:第三层与第一层(A 层)平行,第四层与第二层(B 层)平行,
形成ABABAB ……型(图
8.23
),称为透光型(或A 3型)的六方最紧密堆积 (hcp ,hexagonal closest packing )。 (i) 晶胞:六方晶胞如图8.23中的实线部分 (ii) 晶胞参数:a , c
(iii) 球数︰正四面体空隙︰正八面体空隙 = 1︰2︰1
Fig. 8.23 Hexagonal closest packing (ABAB ……)
证明(两种方法)
方法一:A 层与B 层构成密置双层,所以球数︰正四面体空隙︰正八面体空隙 = 2︰2︰1,而B 层与下一个A 层又构成密置双层,所
以球数︰正四面体空隙︰正八面体空隙 = 2︰2︰1,即每一层都用了两次或者说每层球对密置双层的贡献为1/2,球数减半,所以,球数︰正四面体空隙︰正八面体空隙 = 1︰2︰1。
方法二:在六方晶胞中,球数 = 8 × (1/8) + 1 = 1 + 1 = 2;晶胞内有两个正四面体空隙,c 轴的每条棱上都有2个正四面
体空隙(图8.24),所以正四面体空隙 = 2 + 8 × (1/4) = 2 + 2 = 4;正八面体空隙 = 2(图8.25),故球数︰正四面体空隙︰正八面体空隙= 2︰4︰2 = 1︰2︰1。
Fig. 8.24 The site of tetrahedral holes in A 3 type Fig. 8.25 The site of octahedral holes in A 3 type
b .第二种密置方法:第三层(C 层)不与第一层平行,而是盖在一、二两层未复盖的另一组三角形空穴上(图8.26),
第四层与第一层平行,组成ABCABCABC ……型,称为不透光型(或A 1型)的立方面心最紧密堆积(ccp )。
Fig. 8.22
121
Fig. 8.26 Cubic closest packing (ABCABC ……)
(i) 晶胞:立方面心晶胞如图8.26中的右图。 (ii) 晶胞参数:a
(iii) 球数:正四面体空隙︰正八面体空隙 = 1︰2︰1
证明:立方面心晶胞中,球数 = 8 × (1/8) + 6 × (1/2) = 1 + 3 = 4,正四面体空隙有8个,因为立方体的每个顶点与相邻的三个面心组成一个正四面体空隙(图8.27),正八面体空隙有12 × (1/4) + 1 =4,因为体心和每条棱的棱心都是正八面体空隙的位置(图8.28),故球数︰正四面体空隙︰正八面体空隙= 4︰8︰4 = 1︰2︰1。
Fig. 8.27 The site of tetrahedral holes in A 1 type Fig. 8.28 The sites of octahedral holes in A 1 type
(5) 上述两种最紧密堆积的空间利用率 六方最紧密堆积:
空间利用率 = %05.74622120sin )2(34
223
==????ππh
r r o ,其中,22)22332()2(r r h ??-= 立方面心最紧密堆积:空间利用率 = %05.7462)
22(316
34433
33==?=??πππr r a r
Practice Exercise :如何计算立方体心(A 2)与金刚石型(A 4)的空间利用率? 已知晶体的晶胞参数,求晶体的密度,反之,已知晶体密度,求晶胞参数。
Sample Exercise :钨具有体心立方晶格,已知密度为19.30 g ?cm -3
,试计算钨原子的半径。M w = 183.9
Solution :30.191010022.69
.183224
233=????=
-a ρ, ∴163.3022
.630.1910
9.18323
=???=
a ?
∵钨是体心立方,
r a 43=
∴ 1.37r a =?
三、离子晶体(Ionic Crystals )
1.正、负离子半径比(r
+ / r
)与配位数的关系:(对于AB 型离子晶体而言)
证明:六配位(立方面心)的最小半径比(r
+ / r
-)的计算: 从图8.29中可知,--+?=+r r r 22)(2 ∴ --+=+r r r 2
414.012=-=
122
Fig. 8.29 Cross section of an octahedral hole
八配位(简单立方)的最小半径比(r + / r
-)的计算:
∵立方体边长a = 2r
- ,体对角线为
2()r r +=
=--+
∴ 732.013/=-=-+r r
四配位 立方体的六个面对角线构成一个正四面体, 立方体的中心就是正四面体的中心(图8.27)。
从图8.28中可知:四面体的边长为立方体的面对角线,长为
a 2
,∴
/2r =-,立方体的体对角线长为 a r r 3)(2=+-+ ∴
/2r r +=-+
∴
0.225r r +
-?=-==???()
Fig. 8.30 The tetrahedron is shown as four vertices of a cube Fig. 8.31 The (110) face in Fig. 8.30 注意:r
+ / r
- 数值不是决定配位数的唯一因素,还有离子极化等因素对配位数发生影响。 2.常见二元离子化合物的典型结构型式 (1) NaCl 型 晶胞见图8.32 a .组成比1:14:414112:216818==??
?
??+???? ??
?+?
b .负离子堆积方式:立方最紧密堆积; c
.
离
子
坐
标
Cl
-
:
??
?
????? ????? ??212102102102121)000(,,,,,,,,,,,
Na +
:??
? ??
??? ?
???? ????? ??210002
10002
1
212121,,
,,,,,,,,, d .正、负离子配位数之比:6︰6; e .正离子所占空隙种类及占有率:正八面体空隙 100% (2) CsCl 型 晶胞见图8.33 a .组成比 1:11:)8
18(=? b .负离子堆积方式:简单立方堆积
c .离子坐标 Cl -
:)000(,,
,Cs +:??
? ??212121,, d .正负离子配位数之比:8︰8
e .正离子所占空隙种类及占有率:立方体空隙 100% (3) 立方ZnS 型 晶胞见图8.34 a .组成比 1:14:44:616818==??
?
???+?
b .负离子堆积方式:立方最密堆积
c .离子坐标 S 2
-:??
? ?
???? ????? ??212102102
102
1
21)000(,,,,,,,,,,,
Zn
2+
:
??
?
????? ????? ????? ??434341434143414343414141,,,,,,,,,,,
Fig. 8.32 The unit cell of
sodium
Fig. 8.33 The unite cell of cesium chloride
Fig. 8.34 The unit cell of zinc
Fig. 8.36 The unit cell of wurtzite
d.正负离子配位数之比:4︰4
e.正离子所占空隙种类及占有率:正四面体空隙50%
(4) 六方ZnS型晶胞见图8.36
a.组成比1:1
2:2
1
4
1
4
:
1
8
1
8=
=
?
?
?
?
?
+
?
?
?
?
?
?
+
?
b.负离子堆积方式:六方紧密堆积
c.离子坐标S2-:?
?
?
?
?
2
1
3
2
3
1
)0
0(,
,
,
,
,
Zn+:?
?
?
?
?
8
1
3
2
3
1
)
8
5
0(,
,
,
,
,
d.正、负离子配位数之比:4︰4
e.正离子所占空隙种类及占有率:正四面体空隙50%
(5) CaF2型晶胞见图8.37
a.组成比2
:1
8:4
8:)
2
1
6
8
1
8(=
=
?
+
?
b.负离子堆积方式:简单立方堆积
c.离子坐标
Ca2+:?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
2
1
2
1
2
1
2
1
2
1
2
1
)0
0(,
,
,
,
,
,
,
,
,
,
,
F-:
111331313133
444444444444
????????
? ? ? ?
????????
,,,,,,,,,,,,
333331313131
444444444444
????????
? ? ? ?
????????
,,,,,,,,,,,
d.正负离子配位数之比:8︰4
e.正离子所占空隙种类及占有率:立方体空隙50%
Fig. 8.36 The unit cell of wurtzite
Fig. 8.35 The crystal structure of wurtzite
Fig. 8.37 The unit cell of calcium fluorite
123
124
晶体结构习题与解答
第三章晶体结构习题与解答 3-1 名词解释 (a)萤石型和反萤石型 (b)类质同晶和同质多晶 (c)二八面体型与三八面体型 (d)同晶取代与阳离子交换 (e)尖晶石与反尖晶石 答:(a)萤石型:CaF2型结构中,Ca2+按面心立方紧密排列,F-占据晶胞中全部四面体空隙。 反萤石型:阳离子和阴离子的位置与CaF2型结构完全相反,即碱金属离子占据F-的位置,O2-占据Ca2+的位置。 (b)类质同象:物质结晶时,其晶体结构中部分原有的离子或原子位置被性质相似的其它离子或原子所占有,共同组成均匀的、呈单一相的晶体,不引起键性和晶体结构变化的现象。 同质多晶:同一化学组成在不同热力学条件下形成结构不同的晶体的现象。 (c)二八面体型:在层状硅酸盐矿物中,若有三分之二的八面体空隙被阳离子所填充称为二八面体型结构三八面体型:在层状硅酸盐矿物中,若全部的八面体空隙被阳离子所填充称为三八面体型结构。 (d)同晶取代:杂质离子取代晶体结构中某一结点上的离子而不改变晶体结构类型的现象。 阳离子交换:在粘土矿物中,当结构中的同晶取代主要发生在铝氧层时,一些电价低、半径大的阳离子(如K+、Na+等)将进入晶体结构来平衡多余的负电荷,它们与晶体的结合不很牢固,在一定条件下可以被其它阳离子交换。 (e)正尖晶石:在AB2O4尖晶石型晶体结构中, 若A2+分布在四面体空隙、而B3+分布于八面体空 隙,称为正尖晶石; 反尖晶石:若A2+分布在八面体空隙、而B3+一半分 布于四面体空隙另一半分布于八面体空隙,通式为 B(AB)O4,称为反尖晶石。 3-2 (a)在氧离子面心立方密堆积的晶胞中,画出 适合氧离子位置的间隙类型及位置,八面体间隙位 置数与氧离子数之比为若干四面体间隙位置数与氧 离子数之比又为若干 (b)在氧离子面心立方密堆积结构中,对于获得稳 定结构各需何种价离子,其中: (1)所有八面体间隙位置均填满; (2)所有四面体间隙位置均填满; (3)填满一半八面体间隙位置; (4)填满一半四面体间隙位置。 并对每一种堆积方式举一晶体实例说明之。 解:(a)参见2-5题解答。 (b)对于氧离子紧密堆积的晶体,获得稳定的结构 所需电价离子及实例如下: (1)填满所有的八面体空隙,2价阳离子,MgO; (2)填满所有的四面体空隙,1价阳离子,Li2O; (3)填满一半的八面体空隙,4价阳离子,TiO2; (4)填满一半的四面体空隙,2价阳离子,ZnO。
晶体的结构和性质(竞赛)
高一化学竞赛辅导——晶体的结构和性质(第12周) 学习重难点: 1.了解晶体的特性,理解晶胞。 2.. 分子晶体、原子晶体、离子晶体和金属晶体组成粒子,粒子间作用力、熔沸点、硬度、导电性; 3.理解影响晶体熔点和沸点的因素、能进行不同晶体熔沸点比较。 学习过程: 一、晶体和晶胞 1、通常人们说的固体包括两类物质: 和 。 其中,橡胶、玻璃、琥珀、树脂属于 。 晶体具有的本质特征是“自范性”。即晶体能够自发的呈现封闭的规则凸多面体的外形,非晶态物质没有自范性。 2、晶面夹角不变定律(大概了解即可) 3、晶胞 (1)用锤子轻轻敲打具有整齐外形的晶体,会发现晶体劈裂出现的心晶面与某原来晶面平行,这种现象叫做晶体的解理性。古人由晶体解理性猜测,晶体是由无数个肉眼看不到的,形状、大小、组成原子数目和种类、取向相同的微小几何体堆积而成的,后来,这种观念发展成为晶胞的概念。 (2)晶胞:整块晶体是由完全等同的晶胞无隙并置堆积而成的。 注意:永远不要将晶胞看成是一个孤立的多面体,而应视为晶体微观空间中的一个单元,看见它,就要想象它的上下左右有完全相同的晶胞。 (3)晶胞中原子的计算 [例1] 如下图,是某晶体最小的结构单元,试写出其化学式。 分析:此题采用延伸法: 顶点上的原子,被8个晶体所共用,对每一个晶体只提供81 棱边上的原子,被4个晶体所共用,对每一个晶体只提供41 面心上的原子,被2个晶体所共用,对每一个晶体只提供2 1 体心上的原子,被1个晶体所共用,对每一个晶体只提供1 据此:1:3:11:4 1 12:818::=??=z y x 化学式为
[例2] 下图是超导化合物----钙钛矿晶体中最小重复单元(晶胞)的结构。请回答: (1)该化合物的化学式为 。 (2)在该化合物晶体中,与某个钛离子距离最近且相等的其他钛离子共有 个。 [例3] 根据离子晶体的晶胞(晶体中最小重复单元),求阴、阳离子个数比的方法是: (1)处于顶点的离子,同时为8个晶胞共有,每个离子有1/8属于晶胞; (2)处于棱上的离子同时为4个晶胞共有,每个离子有1/4属于晶胞; (3)处于面上的离子,同时为2个晶胞共有,每个离子有1/2属于晶胞; (4)处于内部的离子,则完全属于该晶胞。 现有甲、乙、丙三种晶胞,可推知甲晶体化学式为 ,乙晶体的化学式为 ,丙晶体中C 与D 的个数比为 。 [例4] 下图是NaCl 晶体结构的示意图: (1)若用+ -?Na - -Cl O ,请将位置表示出来; (2)每个+ Na 周围与它最接近且距离相等的+ Na 有 个。 分析:解答此类问题常用的是“分割法”——从晶体中分出最小的结构单元,或将最小的结构单元分成若干个面。 答案:12 二、分子晶体 ①概念:只含___________的晶体,称为分子晶体。 ②构成晶体的微粒是___________ ③晶体内微粒间的作用: 分子内原子间_______________________,相邻分子之间__________________________。 ④分子晶体的物理性质是: 熔点和沸点较______,有些分子具有易挥发、升华的性质。 硬度_________,一般都是绝缘体,熔融态_______导电。 2.常见的分子晶体 ①所有____________________,如水、硫化氢、氨、氯化氢、甲烷等。 ②部分____________________,如卤素(X 2)、氧(O 2)、硫(S 8)、氮(N 2)、白磷(P 4)、碳60(C 60)、稀有气体等。
晶体结构 补充习题
晶体结构补充习题 班级学号姓名 一、是非题(判断下列叙述是否正确,正确的在括号中画√,错误的画X) 1、离子半径是离子型化合物中相邻离子核间距的一半。..................................() 2、所有层状晶体均可作为润滑剂和导电体使用。.................................................() 二、选择题(在下列各题中,选择出符合题意的答案,将其代号填入括号内) 1、下列离子中极化力和变形性均较大的是...............................................................()。 (A)Mg2+;(B)Mn2+;(C)Hg2+;(D)Al3+。 2、金属钙具有面心立方结构,在每个单位晶胞中含有Ca原子的个数为....()。 (A)1;(B)2;(C)3;(4)4。 3、下列两组物质:①MgO、CaO、SrO、BaO ②KF、KCl、KBr、KI 每组中熔点最高的分别是............................................................................................()。 (A)BaO和KI;(B)CaO和KCl;(C)SrO和KBr;(D)MgO和KF。 4、下列关于分子晶体的叙述中正确的是....................................................................()。 (A)分子晶体中只存在分子间力; (B)分子晶体晶格结点上排列的分子可以是极性分子或非极性分子; (C)分子晶体中分子间力作用较弱,因此不能溶解于水; (D)分子晶体在水溶液中不导电。 5、下列各组原子或离子半径大小顺序,其中错误的是.......................................()。 (A)Ca2+
最新(四)竞赛专项练习题之晶体结构
(四)竞赛专项练习题 之晶体结构
(四)晶体结构 一、(2005)(12分) LiCl和KCl同属NaCl型晶体,其熔点分别为614℃和776℃。Li+、K+和Cl-的半径分别为76pm、133pm和181pm。在电解熔盐LiCl以制取金属锂的生产工艺中,加入适量的KCl晶体,可使电解槽温度下降至400℃,从而使生产条件得以改善。 1.说明加入熔点高的KCl反而使电解温度大大下降的原因; 2.有人认为,LiCl和KCl可形成固溶体(并画出了“固溶体的晶胞”)。但实验表明,液相LiCl和KCl能以任意比例混溶而它们的固相完全不混溶(即不能生成固溶体!)。请解释在固相中完全不混溶的主要原因。 3.写出计算LiCl和KCl两种晶体密度之比的表达式(须包含离子半径的符号); 4.在KCl晶体中,K+离子占据由Cl- 离子围成的八面体空隙,计算相距最近的八面体空隙中心之间的距离。 5.实验证明,即使产生了阳离子空位,KCl晶体在室温下也不导电。请通过计算加以说明。 二、(2005)(12分)为纪念1905年爱因斯坦连续发表6篇论文导致物理学大变革100周年,今年被定为国际物理年。本题涉及的“热电效应”机理也是爱因斯坦首先阐释的,即他提出的被后人称为“爱因斯坦振荡器”的独立振荡原子与温度关系的模型。
1.左上图是热电效应之一的图解。给出图中所有英文单词(或词组)及物理学符号的意义,并为此图写一篇不超过200字(包括标点符号等)的说明文。 2.右上图是化学家合成的能实现热电效应的一种晶体的晶胞模型。图中的大原子是稀土原子,如镧;小原子是周期系第五主族元素,如锑;中等大小的原子是周期系VIII 族元素,如铁。按如上结构图写出这种热电晶体的化学式。给出计算过程。提示:晶胞的6个面的原子数相同。设晶体中锑的氧化态为-1,镧的氧化态为+3,问:铁的平均氧化态多大? 三、(2005B)(10分)固体发光材料是一种能将激发的能量转变为可见光的固体物质。在基质中掺入杂质,含量可达千分之几或百分之几,可调整发光效率、余辉及发光光谱。如在刚玉Al2O3基质中掺入0.05~1.0%的Cr3+及在Y2O3基质中掺入Eu3+等均可制成固体发光材料。 1.推测Al2O3基质中掺入Cr3+的发光原理。 2.Y2O3属立方晶系,将Y2O3的立方晶胞分为8个小立方体,Y在小立方体的面心和顶点,O位于小立方体内的四面体空隙,画出这样四个小立方体,指出Y和O的配位数。 【答案】
金属的晶体结构习题答案
第一章 金属的晶体结构 (一)填空题 3.金属晶体中常见的点缺陷是 空位、间隙原子和置换原子 ,最主要的面缺陷是 。 4.位错密度是指 单位体积中所包含的位错线的总长度 ,其数学表达式为V L =ρ。 5.表示晶体中原子排列形式的空间格子叫做 晶格 ,而晶胞是指 从晶格中选取一个能够完全反应晶格特征的最小几何单元 。 6.在常见金属晶格中,原子排列最密的晶向,体心立方晶格是 [111] ,而面心立方晶格是 [110] 。 7 晶体在不同晶向上的性能是 不同的 ,这就是单晶体的 各向异性现象。一般结构用金属为 多 晶体,在各个方向上性能 相同 ,这就是实际金属的 伪等向性 现象。 8 实际金属存在有 点缺陷 、 线缺陷 和 面缺陷 三种缺陷。位错是 线 缺陷。 9.常温下使用的金属材料以 细 晶粒为好。而高温下使用的金属材料在一定范围内以粗 晶粒为好。 10.金属常见的晶格类型是 面心立方、 体心立方 、 密排六方 。 11.在立方晶格中,各点坐标为:A (1,0,1),B (0,1,1),C (1,1,1/2),D(1/2,1,1/2),那么AB 晶向指数为10]1[- ,OC 晶向指数为[221] ,OD 晶向指数为 [121] 。 12.铜是 面心 结构的金属,它的最密排面是 {111} ,若铜的晶格常数a=,那么 最密排面上原子间距为 。 13 α-Fe 、γ-Fe 、Al 、Cu 、Ni 、Cr 、V 、Mg 、Zn 中属于体心立方晶格的有 α-Fe 、Cr 、V , 属于面心立方晶格的有 γ-Fe 、Al 、Cu 、Ni 、 ,属于密排六方晶格的有 Mg 、 Zn 。 14.已知Cu 的原子直径为0.256nm ,那么铜的晶格常数为 。1mm 3Cu 中的原子数 为 。 15.晶面通过(0,0,0)、(1/2、1/4、0)和(1/2,0,1/2)三点,这个晶面的晶面指数为 . 16.在立方晶系中,某晶面在x 轴上的截距为2,在y 轴上的截距为1/2;与z 轴平行,则 该晶面指数为 (140) . 17.金属具有良好的导电性、导热性、塑性和金属光泽主要是因为金属原子具有 金属键 的 结合方式。 18.同素异构转变是指 当外部条件(如温度和压强)改变时,金属内部由一种金属内部由 一种晶体结构向另一种晶体结构的转变 。纯铁在 温度发生 和 多晶型转变。 19.在常温下铁的原子直径为0.256nm ,那么铁的晶格常数为 。 20.金属原子结构的特点是 。 21.物质的原子间结合键主要包括 离子键 、 共价键 和 金属键 三种。 (二)判断题 1.因为单晶体具有各向异性的特征,所以实际应用的金属晶体在各个方向上的性能也是不相同的。 (N) 2.金属多晶体是由许多结晶位向相同的单晶体所构成。 ( N) 3.因为面心立方晶体与密排六方晶体的配位数相同,所以它们的原子排列密集程度也相同 4.体心立方晶格中最密原子面是{111}。 Y 5.金属理想晶体的强度比实际晶体的强度高得多。N 6.金属面心立方晶格的致密度比体心立方晶格的致密度高。 7.实际金属在不同方向上的性能是不一样的。N 8.纯铁加热到912℃时将发生α-Fe 向γ-Fe 的转变。 ( Y ) 9.面心立方晶格中最密的原子面是111},原子排列最密的方向也是<111>。 ( N ) 10.在室温下,金属的晶粒越细,则其强度愈高和塑性愈低。 ( Y ) 11.纯铁只可能是体心立方结构,而铜只可能是面心立方结构。 ( N ) 12.实际金属中存在着点、线和面缺陷,从而使得金属的强度和硬度均下降。 ( Y ) 13.金属具有美丽的金属光泽,而非金属则无此光泽,这是金属与非金属的根本区别。N
几种常见晶体结构分析
几种常见晶体结构分析文档编制序号:[KK8UY-LL9IO69-TTO6M3-MTOL89-FTT688]
几种常见晶体结构分析 河北省宣化县第一中学 栾春武 邮编 075131 栾春武:中学高级教师,张家口市中级职称评委会委员。河北省化学学会会员。市骨干教师、市优秀班主任、模范教师、优秀共产党员、劳动模范、县十佳班主任。 联系电话: E-mail : 一、氯化钠、氯化铯晶体——离子晶体 由于离子键无饱和性与方向性,所以离子晶体中无单个分子存在。阴阳离子在晶体中按一定的规则排列,使整个晶体不显电性且能量最低。离子的配位数分析如下: 离子数目的计算:在每一个结构单元(晶胞)中,处于不同位置的微粒在该单元中所占的份额也有所不同,一般的规律是:顶点上的微粒属于该 单元中所占的份额为18,棱上的微粒属于该单元中所占的份额为1 4,面上 的微粒属于该单元中所占的份额为1 2,中心位置上(嚷里边)的微粒才完 全属于该单元,即所占的份额为1。 1.氯化钠晶体中每个Na +周围有6个Cl -,每个Cl -周围有6个Na +,与一个Na +距离最近且相等的Cl -围成的空间构型为正八面体。每个Na +周围与其最近且距离相等的Na +有12个。见图1。 图1 图2 NaCl
晶胞中平均Cl-个数:8×1 8 + 6× 1 2 = 4;晶胞中平均Na+个数:1 + 12×1 4 = 4 因此NaCl的一个晶胞中含有4个NaCl(4个Na+和4个Cl-)。 2.氯化铯晶体中每个Cs+周围有8个Cl-,每个Cl-周围有8个Cs+,与一个Cs+距离最近且相等的Cs+有6个。 晶胞中平均Cs+个数:1;晶胞中平均Cl-个数:8×1 8 = 1。 因此CsCl的一个晶胞中含有1个CsCl(1个Cs+和1个Cl-)。 二、金刚石、二氧化硅——原子晶体 1.金刚石是一种正四面体的空间网状结构。每个C 原子以共价键与4个C原子紧邻,因而整个晶体中无单 个分子存在。由共价键构成的最小环结构中有6个碳原 子,不在同一个平面上,每个C原子被12个六元环共用,每C—C键共6 个环,因此六元环中的平均C原子数为6× 1 12 = 1 2 ,平均C—C键数为 6×1 6 = 1。 C原子数: C—C键键数= 1:2; C原子数: 六元环数= 1:2。 2.二氧化硅晶体结构与金刚石相似,C被Si代替,C与C之间插 氧,即为SiO 2晶体,则SiO 2 晶体中最小环为12环(6个Si,6个O), 图3 CsCl 晶 图4 金刚石晶
第3章-晶体结构习题
第 3 章晶体结构习题 1.选择题: 3-1.下列物质的熔点由高到低的顺序正确的为………………………… ( ) (A) CuCl2>SiO2>NH3>PH3 (B) SiO2>CuCl2>NH3>PH3 (C) SiO2>CuCl2>PH3>NH3 (D) CuCl2>SiO2>PH3>NH3 3-2.下列物质中,共价成分最大的是…………………………………… ( ) (A) A1F3 (B)FeCl3 (C) FeCl2 (D) SnCl4 3-3.下列碳酸盐中,分解温度最低的是…………………………………( ) (A) Na2CO3 (B) (NH4)2CO3 (C) ZnCO3 (D) MgCO3 3-4.下列各物质中只需克服色散力就能使之气化的是………………… ( ) (A)HCl (B)C (C)N2 (D)MgCO3 3-5.下列哪种稀有气体沸点最低………………………………………… ( ) (A) He (B) Ne (C) Ar (D) Xe 3-6.下列哪一种物质的沸点最高…………………………………………( ) (A) H2Se (B) H2S (C) H2Te (D) H2O 3-7.下列离子中,极化率最大的是………………………………………()(A)Na+(B)I—(C)Rb+(D)Cl— 3-8.若已知某种物质有两种或两种以上晶体,这种现象叫做…………()(A)同质多晶现象(B)类质同晶现象 (C)同构现象(D)异构现象 3-9.下列离子中,变形性最大的是………………………………………()(A)CO32—(B)SO42—(C)ClO4—(D)MnO4— 3-10.试判断下列化合物熔点变化顺序,正确的是………………………( ) (A) MgO>BaO>BN>ZnCl2>CdCl2 (B) BN>MgO>BaO>CdCl2>ZnCl2 (C) BN>MgO>BaO>ZnCl2>CdC12 (D) BN>BaO>MgO>ZnCl2>CdCl2
常见的金属晶体结构
第二章作业 2-1 常见的金属晶体结构有哪几种它们的原子排列和晶格常数有什么特点 V、Mg、Zn 各属何种结构答:常见晶体结构有 3 种:⑴体心立方:-Fe、Cr、V ⑵面心立方:-Fe、Al、Cu、Ni ⑶密排六方:Mg、Zn -Fe、-Fe、Al、Cu、Ni、Cr、 2---7 为何单晶体具有各向异性,而多晶体在一般情况下不显示出各向异性答:因为单晶体内各个方向上原子排列密度不同,造成原子间结合力不同,因而表现出各向异性;而多晶体是由很多个单晶体所组成,它在各个方向上的力相互抵消平衡,因而表现各向同性。第三章作业3-2 如果其它条件相同,试比较在下列铸造条件下,所得铸件晶粒的大小;⑴金属模浇注与砂模浇注;⑵高温浇注与低温浇注;⑶铸成薄壁件与铸成厚壁件;⑷浇注时采用振动与不采用振动;⑸厚大铸件的表面部分与中心部分。答:晶粒大小:⑴金属模浇注的晶粒小⑵低温浇注的晶粒小⑶铸成薄壁件的晶粒小⑷采用振动的晶粒小⑸厚大铸件表面部分的晶粒小第四章作业 4-4 在常温下为什么细晶粒金属强度高,且塑性、韧性也好试用多晶体塑性变形的特点予以解释。答:晶粒细小而均匀,不仅常温下强度较高,而且塑性和韧性也较好,即强韧性好。原因是:(1)强度高:Hall-Petch 公式。晶界越多,越难滑移。(2)塑性好:晶粒越多,变形均匀而分散,减少应力集中。(3)韧性好:晶粒越细,晶界越曲折,裂纹越不易传播。 4-6 生产中加工长的精密细杠(或轴)时,常在半精加工后,将将丝杠吊挂起来并用木锤沿全长轻击几遍在吊挂 7~15 天,然后再精加工。试解释这样做的目的及其原因答:这叫时效处理一般是在工件热处理之后进行原因用木锤轻击是为了尽快消除工件内部应力减少成品形变应力吊起来,是细长工件的一种存放形式吊个7 天,让工件释放应力的时间,轴越粗放的时间越长。 4-8 钨在1000℃变形加工,锡在室温下变形加工,请说明它们是热加工还是冷加工(钨熔点是3410℃,锡熔点是232℃)答:W、Sn 的最低再结晶温度分别为: TR(W) =(~×(3410+273)-273 =(1200~1568)(℃)>1000℃ TR(Sn) =(~×(232+273)-273 =(-71~-20)(℃) <25℃ 所以 W 在1000℃时为冷加工,Sn 在室温下为热加工 4-9 用下列三种方法制造齿轮,哪一种比较理想为什么(1)用厚钢板切出圆饼,再加工成齿轮;(2)由粗钢棒切下圆饼,再加工成齿轮;(3)由圆棒锻成圆饼,再加工成齿轮。答:齿轮的材料、加工与加工工艺有一定的原则,同时也要根据实际情况具体而定,总的原则是满足使用要求;加工便当;性价比最佳。对齿轮而言,要看是干什么用的齿轮,对于精度要求不高的,使用频率不高,强度也没什么要求的,方法 1、2 都可以,用方法 3 反倒是画蛇添足了。对于精密传动齿轮和高速运转齿轮及对强度和可靠性要求高的齿轮,方法 3 就是合理的。经过锻造的齿坯,金属内部晶粒更加细化,内应力均匀,材料的杂质更少,相对材料的强度也有所提高,经过锻造的毛坯加工的齿轮精度稳定,强度更好。 4-10 用一冷拔钢丝绳吊装一大型工件入炉,并随工件一起加热到1000℃,保温后再次吊装工件时钢丝绳发生断裂,试分析原因答:由于冷拔钢丝在生产过程中受到挤压作用产生了加工硬化使钢丝本身具有一定的强度和硬度,那么再吊重物时才有足够的强度,当将钢丝绳和工件放置在1000℃炉内进行加热和保温后,等于对钢丝绳进行了回复和再结晶处理,所以使钢丝绳的性能大大下降,所以再吊重物时发生断裂。 4-11 在室温下对铅板进行弯折,越弯越硬,而稍隔一段时间再行弯折,铅板又像最初一样柔软这是什么原因答:铅板在室温下的加工属于热加工,加工硬化的同时伴随回复和再结晶过程。越弯越硬是由于位错大量增加而引起的加工硬化造成,而过一段时间又会变软是因为室温对于铅已经是再结晶温度以上,所以伴随着回复和再结晶过程,等轴的没有变形晶粒取代了变形晶粒,硬度和塑性又恢复到了未变形之前。第五章作业 5-3 一次渗碳体、二次渗碳体、三次渗碳体、共晶渗碳体、共析渗碳体异同答:一次渗碳体:由液相中直接析出来的渗碳体称为一次渗碳体。二次渗碳体:从 A 中析出的渗碳体称为二次渗碳体。三次渗碳体:从 F 中析出的渗碳体称为三次渗碳体共晶渗碳体:经共晶反应生成的渗碳体即莱氏体中的渗碳体称为共晶渗碳体共析渗碳体:经共析反应生成的渗碳体即珠光体中的渗
第一章晶体结构和倒格子
第一章 晶体结构和倒格子 1. 画出下列晶体的惯用元胞和布拉菲格子,写出它们的初基元胞基矢表达式,指明各晶体的结构及两种元胞中的原子个数和配位数。 (1) 氯化钾 (2)氯化钛 (3)硅 (4)砷化镓 (5)碳化硅 (6)钽酸锂 (7)铍 (8)钼 (9)铂 2. 对于六角密积结构,初基元胞基矢为 → 1a =→→+j i a 3(2 →→→+-=j i a a 3(22 求其倒格子基矢,并判断倒格子也是六角的。 3.用倒格矢的性质证明,立方晶格的[hkl]晶向与晶面(hkl )垂直。 4. 若轴矢→→→c b a 、、构成简单正交系,证明。晶面族(h 、k 、l )的面间距为 2222) ()()(1c l b k a h hkl d ++= 5.用X 光衍射对Al 作结构分析时,测得从(111)面反射的波长为1.54?反射角为θ=19.20 求面间距d 111。 6.试说明:1〕劳厄方程与布拉格公式是一致的; 2〕劳厄方程亦是布里渊区界面方程; 7.在图1-49(b )中,写出反射球面P 、Q 两点的倒格矢表达式以及所对应的晶面指数和衍射面指数。 8.求金刚石的几何结构因子,并讨论衍射面指数与衍射强度的关系。 9.说明几何结构因子S h 和坐标原点选取有关,但衍射谱线强度和坐标选择无关。 10. 能量为150eV 的电子束射到镍粉末上,镍是面心立方晶格,晶格常数为3.25×10-10m,求最小的布拉格衍射角。 附:1eV=1.602×10-19J, h=6.262×10-34J ·s, c=2.9979×108m/s 第二章 晶体结合 1.已知某晶体两相邻原子间的互作用能可表示成 n m r b r a r U +-=)( (1) 求出晶体平衡时两原子间的距离; (2) 平衡时的二原子间的互作用能; (3) 若取m=2,n=10,两原子间的平衡距离为3?,仅考虑二原子间互作用则离解能为4ev ,计算a 及b 的值; (4) 若把互作用势中排斥项b/r n 改用玻恩-梅叶表达式λexp(-r/p),并认为在平衡时对互作 用势能具有相同的贡献,求n 和p 间的关系。 2. N 对离子组成的Nacl 晶体相互作用势能为 ??????-=R e R B N R U n 024)(πεα
化合物的晶体结构
实验6 化合物的晶体结构 一、一、实验目的: 巩固化合物晶体结构知识。 二、二、实验内容: 典型的化合物的晶体结构有: 1.1.NaCl型结构 NaCl晶体结构是如图6-1所示的立方面心格子,属立方晶系Fm3m空间群,a0=0.5628nm。阴离子按立方最紧密方式堆积,阳离子充填于全部的八面体空隙中,阴、阳离子的配位数都是6。 属于NaCl型晶体结构的晶体有很多,列于表6-1中。 (A) 立方面心格子(B) 晶胞(C) 晶胞绘制图 图6-1 氯化钠晶体结构 2. CsCl型结构 CsCl晶体结构是立方原始格子(图6-2),属立方晶系Pm3m空间群,a0=0.411nm。Cl-处于立方原始格子的八个角顶上,Cs+位于立方体中心,阴、阳离子的配位数都是8。 属于CsCl型晶体结构的晶体有CsBr、CsI、TlCl、NH4Cl。 图6-2 CsCl晶体结构图6-3 纤锌矿晶体结构 3. 纤锌矿(α-ZnS)型结构 纤锌矿(α-ZnS)的晶体结构属立方晶系P63mc空间群,a0=0.382nm,c0=0.625nm,Z=2。在纤锌矿结构中(图6-3),S2-按六方紧密堆积排列,Zn2+充填于1/2的四面体空隙中,阴、阳离子的配位数都是4。 属于纤锌矿(α-ZnS)型晶体结构的晶体有BeO、ZnO和AlN。
4. 闪锌矿(β-ZnS)型结构 闪锌矿(β-ZnS)的晶体结构属立方晶系空间群,a 0=0.540nm ,Z=4。如图6-4所示的闪锌矿结构是立方面心格子,S 2-位于立方面心的结点位置,Zn 2+交错地分布于立方体内的1/8小立方体的中心,阴、阳离子的配位数都是4。如果将S 2-看成是作立方最紧密堆积,则Zn 2+充填于1/2的四面体空隙中。 属于闪锌矿(β-ZnS)型晶体结构的晶体有β-SiC 、GaAs 、AlP 和InSb 。 图6-4 闪锌矿的晶体结构 5. CaF 2型结构 萤石的晶体结构如图6-5所示,属立方晶系Fm3m 空间群,a 0=0.545nm ,Z=4。Ca 2+ 位于立方面心的结点位置,F -位于立方体内的八个小立方体的中心,Ca 2+的配位数是8,F -的配位数是4。在萤石结构中可以将Ca 2+看成是作立方紧密堆积,F -充填于全部四面体空隙中,而全部的八面体空隙都没有被充填,因此,在结构中八个F -离子之间就形成一个“空洞”, 这些“空洞”为F -离子的扩散提供了条件。 属于萤石型晶体结构的晶体有BaF 2、PbF 2、SnF 2、CeO 2、ThO 2和UO 2,还有一些晶体的结构与萤石的完全相同,只是阴、阳离子的位置完全互换,如Li 2O 、Na 2O 、K 2O 等。 图6-5 萤石晶体结构 6. 金红石(TiO 2)型结构 金红石(TiO 2)的晶体结构以及结构中Ti —O 八面体链的排列示于图6-6中,金红石结构属四方晶系P42/mnm 空间群,a 0=0.459nm ,c 0=0.459nm ,Z=2。金红石结构为四方原始格子,Ti 4+位于四方原始格子的结点位置,体中心的Ti 4+自成另一套四方原始格子,O 2-在晶胞中处于一些特定位置上,Ti 4+的配位数是6,O 2-的配位数是3。 金红石结构中Ti-O 八面体以共棱的方式排成链状,晶胞中心的链和四角的Ti-O 八面体链的排列方向相差90?,链与链之间由Ti-O 八面体以共顶相连。如果把O 2-看成近似于六方紧密堆积,则Ti 4+位于1/2的八面体空隙之中。 属于金红石型晶体结构的晶体有GeO 2、SnO 2、PbO 2、MnO 2、MoO 2、NbO 2、WO 2、CoO 2、MnF 2、MgF 2。 m F 3 4
竞赛习题-晶体结构题
专题练习:晶体结构 1. 石墨晶体由如图(1)所示的C 原子平面层堆叠形成。有一种常见的2H 型石墨以二层重复的堆叠方式构成,即若以A 、B 分别表示沿垂直于平面层方向(C 方向)堆叠的两个不同层次,它的堆叠方式为ABAB……。图(2)为AB 两层的堆叠方式,O 和●分别表示A 层和B 层的C 原子。 ⑴ 在图(2)中标明两个晶胞参数a 和b 。 ⑵ 画出2H 型石墨晶胞的立体示意图,并指出晶胞类型。 2. 有一离子晶体经测定属立方晶系,晶胞参数a =4.00?(1?=10-8cm),晶胞的顶点位置为Mg 2+,体心位置为K +,所有 棱边中点为F -。 ⑴ 该晶体的化学组成是 ; ⑵ 晶胞类型是 ; ⑶ Mg 2+的F -配位数是 ,K +的F -配位数是 ; ⑷ 该晶体的理论密度是 g·cm -3。 ⑸ 设晶体中正离子和负离子互相接触,已知F -的离子半径为1.33?,试估计Mg 2+的离子半径是 ?,K +的离子半径是 ?。 3. NiO 晶体为NaCl 型结构,将它在氧气中加热,部分Ni 2+被氧化为Ni 3+,晶体结构产生镍离子缺位的缺陷,其组成成为 Ni x O(x<1),但晶体仍保持电中性。经测定Ni x O 的立方晶胞参数a=4.157?,密度为6.47g·cm -3。 ⑴ x 的值(精确到两位有效数字)为 ;写出标明Ni 的价态的Ni x O 晶体的化学式 。 ⑵ 在Ni x O 晶体中Ni 占据 空隙,占有率是 。 4. 完成下列各题: Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl ⑴ 两种铜溴配合物晶体中的一维聚合链结构的投影图 (其中部分原子给出标记)如下。 ①分别指出两种结构的结构基元由几个Cu 原子和几个Br 原子组成: 图 ⑴ 为 个Cu 原子, Br 原子; 图 ⑵ 为 个Cu 原子, 个Br 原子。 ② 用笔在图中圈出相应的一结构基元。 ⑵图⑶是由氯苯分子构成的平面点阵结构。 ① 在图中标出一个正当单位来,并标明两个基本向量a 和b ; ② 指出正当单位的组成 (内容); ③ 指出这种平面格子的正当单位的形式。 5. 甲烷水合物(nCH 4 · 46H 2O)是一种具有重要经济价值的化合物,在海洋深处蕴藏量非常大,是未来的重要能源之一。 它的晶体结构可看作由五角十二面体[512]和十四面体[51262]共面连接堆积形成。在立方晶胞中,[512]的中心处在顶角和体心位置;[51262]中心位置坐标为(0,1/4,1/2)、(0,3/4,1/2)、(1/2,0,1/4)、(1/2,0,3/4)、(1/4,1/2,0)、(3/4,
晶体结构练习题答案
晶体结构练习题 一、(2005全国初赛)下图是化学家合成的能实现热电效应的一种晶体 的晶胞模型。图中的大原子是稀土原子,如镧;小原子是周期系第五主 族元素,如 锑;中等大小的原子是周期 系VHI族元素,如铁。按如上结构图写出这种热电晶体的化学式。给出 计算过程。提示: 晶胞的6个面的原子数相同。设晶体中锑的氧化态为一1,镧的氧化态为+3,问:铁的平均 氧化态多大? 解析:晶胞里有2个La原子(处于晶胞的顶角和体心); 有 8个Fe原子(处于锑形成的八面体的中心);锑八面体是共顶角 相连的,平均每个八面体有6/2 = 3个锑原子,晶 胞中共有8个八面体,8x3=24个锑原子;即:La2Fe8Sb24。 答案:化学式LaFe4Sb12 铁的氧化态9/4 = 2.25 二、(2004年全国初赛)最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的结构可看作由镁原子和镍原子在一起进行(面心)立方最密堆积(ccp),它们的排列有序,没有相互代换的现象(即没有平均原子或统计原子),它们构成两种八面体空隙,一种由镍原子构成,另一种由镍原子和 镁原子一起构成,两种八面体的数量比是 1 : 3,碳原子只填充在 镍原子构成的八面体空隙 中。 (1)画出该新型超导材料的一个晶胞(碳原子用小球,镍原子用大O球,镁原子用大球)。 (2)写出该新型超导材料的化学式。 (1) (在(面心)立方最密堆积—填隙模型中,八面体空隙与堆积球的 比例为 1 : 1,在如 图晶胞中,八面体空隙位于体心位置和所有棱的中心位置,它们的比例 是 1 : 3,体心位置 的八面体由镍原子构成,可填入碳原子,而棱心位置的八面体由2个镁 原子和4个镍原子一起构成,不填碳原子。)
第一章-晶体结构
第一章 P4 问题 对14种布拉菲点阵中的体心立方,说明其中每一个阵点周围环境完全相同 答:①单看一个结晶学单胞可知,各个顶点上的阵点等价,周围环境相同。 ②将单个结晶学单胞做周期性平移后可知,该结晶学单胞中的体心阵点亦可作为其他结晶学原胞的顶点阵点,即体心阵点与顶点阵点也等价,周围环境也相同。 综上所述,体心立方中每一个阵点周围环境完全相同。 问题 在二维布拉菲点阵中,具体说明正方点阵的对称性高于长方点阵。 答:对称轴作为一种对称要素,是评判对称性高低的一种依据。正方点阵有4条对称轴而长方点阵只有两条对称轴,故正方点阵的对称性高于长方点阵。 P9 问题 晶向族与晶面族概念中,都有一个“族”字。请举一个与族有关的其他例子,看看其与晶向族、晶面族有无相似性? 答:“上班族”、“追星族”… 它们与晶向族、晶面族的相似性在于同一族的事物都有某一相同的性质。 问题 几年前一个同学问了这样的问题:() 2πe 晶面该怎么画?你如何看待他的问题?应该指出,这位同学一定是动了脑筋的!结论是注重概念 答:晶面无意义、不存在。晶向是晶面的法向量,相同指数的晶面与晶向是一一对应的。在晶体中原子排布规则中,各阵点是以点阵常数为单位长度构成的离散空间,阵点坐标值均为整数,晶向指数也应为整数,因此晶面指数应为整数时晶面才有意义。(晶体学的面与数学意义下的面有区别,只有指数为整数的低指数面才有意义。) 问题 说明面心立方中(111)面间距最大,而体心立方中(110)面间距最大。隐含了方法 答:①面心立方中有晶面族{100}、{110}、{111},它们的面间距分别为 因此面心立方中{111}面间距最大。 ②体心立方中有晶面族{100}、{110}、{111},其面间距分别为 因此体心立方中{110}面间距最大。 (密排面的晶面间距最大)
晶体结构课后练习
1. 立方晶系中为什么不存在底心立方晶胞?为什么不带电荷的原子或分子都不以简单立 方形成晶体?为什么对于相同的单质而言,六方紧密堆积(hcp )结构和立方紧密堆积(ccp )具有相同的密度?在这两种紧密堆积中,原子的配位数是多少? 2. 已知Cu 为立方面心结构,其原子量为63.54,密度ρ = 8.936g/cm 3,晶胞参数为3.165?, 试求:(1)阿佛加德罗数,(2)铜的金属半径 3. 铁存在几种晶型:体心立方的α型和面心立方的γ型等等,在910℃时,α型可以转变 成γ型。假设在转变温度条件下,最相邻的两个铁原子之间的距离是相同的,试计算在转变温度条件下,α型对γ型的密度之比为多少? 4. 金属Cu 属于立方面心结构 (1) 分别画出(111)、(110)和(100)晶面上Cu 原子的分布情况 (2) 计算这些面上的原子堆积系数(= 球数×球面积/球占面积) 5. 下列几种具有NaCl 结构的化合物,它们之间的阳—阴离子距离列表如下: MgO 2.10? MgS 2.60 ? MgSe 2.73 ? MnO 2.24 ? MnS 2.59 ? MnSe 2.73 ? (1) 你如何解释这些数据? (2) 从这些数据中,计算S 2–离子的半径。 6. 金属钛属于立方面心晶体。它与碳或氢气反应,形成碳化物或氢化物,外来的原子分别 占满金属钛晶体存在的不同类型的空隙。 (1) 氢原子、碳原子分别占有什么样的空隙?对你的判断解释之。 (2) 写出钛化碳和钛化氢的化学式 7. 一个Ca 和C 的二元化合物具有四方晶胞:a = b = 3.87?,c = 6.37?,(α = β = γ = 90?), 晶胞图如右图,图中钙原子用较大的黑圆圈表示(●), 碳原子用空心圆圈表示(○)。在位于原点的钙原子上面 的碳原子的坐标为为x = 0,y = 0,z = 0.406。(1? = 10 –8cm ) (1) 导出这个化合物的化学式为 , (2) 一个晶胞中所含的化学式单位的数目 为 , (3) C 2基团中C —C 键长为 ?, (4) 最短的Ca —C 距离为 ?, (5) 两个最短的非键C C 间距离为 、 ?, (6) 这一结构与 型离子化合物的结构密切相关。 8. 晶体是质点(分子、离子或原子)在空间有规则地排列而成的,具有整备的外形,以多 面体出现的固体物质,在空间里无限地周期性的重复能成为晶体具有代表性的最小单位,称为单元晶胞。 一种Al-Fe 合金的立方晶胞如右图 所示,请回答: (1) 导出此晶体中Fe 原子与Al 原子的个数比,并写 出此种合金的化学式。 (2) 若此晶胞的边长a = 0.578nm ,计算此合金的密度 (3) 试求Fe-Al 原子之间的最短距离(相对原子的质 量:Al:27 Fe:56) 9. 有一种镧(La )、镍合金,属六方晶系,晶胞参数为a = 511pm ,c = 397pm ●Al ○Fe
最新化学竞赛晶体结构综合例题
晶体结构综合例题 一.有一立方晶系的离子晶体,其结构如右图所示,试回答: 1.晶体所属的点阵形式及结构基元; 2.已知r Cs+=169pm,r Cl-=181pm,试问此两种离于联合组 成了何种型式的密堆积; 3.Cu2+处在何种空隙里? 4.指出各离子的配位情况? 解:1. 立方P,CaCsCl3 ; 2. A1型(立方面心)堆积, Cs+,Cl-离子半径大致相近; 3. 八面体空隙中; 4. Cu2+周围Cl-配位数6,Cs+配位数8;Cl-周围Cu2+配位数2,Cs+配位数4;Cs+周围Cl-配位数12,Cu2+配位数8。 二.黄铜矿是最重要的铜矿,全世界的2/3的铜是由它提炼 的。 1.右图为黄铜矿的晶胞。计算晶胞中各种原子的数目,写出 黄铜矿的化学式; 2.在高温下,黄铜矿晶体中的金属离子可以发生迁移。若铁 原子与铜原子发生完全无序的置换,可将它们视作等同的金属离 子,请说出它的晶胞。 3.在无序的高温型结构中,硫原子作什么类型的堆积? 金属原子占据什么类型的空隙?该空隙被金属原子占据的分数是 多少? 4.计算黄铜矿晶体的密度; (晶胞参数:a=52.4pm, c=103.0pm;相对原子量:Cu 63.5 Fe 55.84 S 32.06)。 解:1. 各种原子的数目Cu, Fe, S: 4, 4, 8; 黄铜矿的化 学式CuFeS2 ; 2.它的晶胞与ZnS晶胞相同;但金属离子随机性为50%; (如图); 3.硫原子作A1型(立方F)堆积; 金属原子占据四面体空 隙; 该空隙被金属原子占据的分数1/2; 4.容易计算黄铜矿晶体的密度4.31g/cm3 .
晶胞计算习题答案
创作编号: GB8878185555334563BT9125XW 创作者:凤呜大王* 1、【答案】(1)mol-1(2)①8 4 ②48③ 【解析】(1)铜晶胞为面心立方最密堆积,1个晶胞能分摊到4个Cu原子;1个晶胞的体积为a3cm3;一个晶胞的质量为a3ρ g;由=a3ρ g,得N A=mol -1。 (2) ①每个Ca2+周围吸引8个F-,每个F-周围吸收4个Ca2+,所以Ca2+的配位数为8,F-的配位数为4。②F-位于晶胞内部,所以每个晶胞中含有F-8个。含有Ca2+为×8+×6=4个。 ③ρ===a g·cm-3, V=。 2、【解析】 试题分析:本考查学生对知识综合利用能力,要求对晶胞知识能够融会贯通。依题意画出侧面图,设正立方体边长为a,则体积为a3。,AC=4r, 故原子半径,根据均摊法得,每个正立方体包括金属原子 8×1/8+6×1/2=4(个),球体体积共
4×空间利用率为:. 考点:均摊法计算 点评:本题考查相对综合,是学生能力提升的较好选择。 3、(1)34.0% (2)2.36 g/cm3 【解析】(1)该晶胞中Si原子个数=4+8×1/8+6×1/2=8,设Si原子半径为xcm,该晶胞中硅原子总体积=,根据硬球接触模型可知,体对角线四分之一处的原子与顶点上的原子紧贴,设晶胞边长为a,所以,解得a=,晶胞体积=()3,因此空间利用率=×100%=34.0%。(2)根据以上分析可知边长=,所以密度==2.36g/cm3。 4、【答案】(1)4(2)金属原子间相接触,即相切 (3)2d3(4) 【解析】利用均摊法解题,8个顶点上每个金原子有属于该晶胞,6个面上每个金原子有属于该晶胞,故每个晶胞中金原子个数=8×+6×=4。假设金原子间相接 触,则有正方形的对角线为2d。正方形边长为d。所以V晶= (d)3=2d3,V m=N A=d3N A,所以ρ==。 5、【答案】(1)YBa2Cu3O7(2)价n(Cu2+)∶n(Cu3+)=2∶1 【解析】(1)由题图所示晶胞可知:一个晶胞中有1个Y3+,2个Ba2+。晶胞最上方、最下方分别有4个Cu x+,它们分别被8个晶胞所共用;晶胞中间立方体的8个顶点各有一个Cu x+,它们分别被4个晶胞共用,因此该晶胞中的Cu x+为n(Cu x+)=(个)。晶胞最上方、最下方平面的棱边上共有4个氧离子,分别被4个晶胞共用;又在晶胞上的立方体的竖直棱边上和晶胞下方的立方体的竖直棱
