氧化和还原反应.

教学目标:1.掌握酚氧化制备醌的反应。
2.了解酚的还原反应。
教学重点:邻苯二酚、对苯二酚的氧化。
教学安排:I
>I12;10min
8—
一、氧化反应
酚环上的高电子密度,使其非常容易发生氧化反应。暴露于空气中的酚,因氧化而呈现较深的颜色。酚与强氧化剂作用,随着反应条件的不同,产物也不同,并且较复杂。在控制条件下酚的氧化有制备意义。例如:
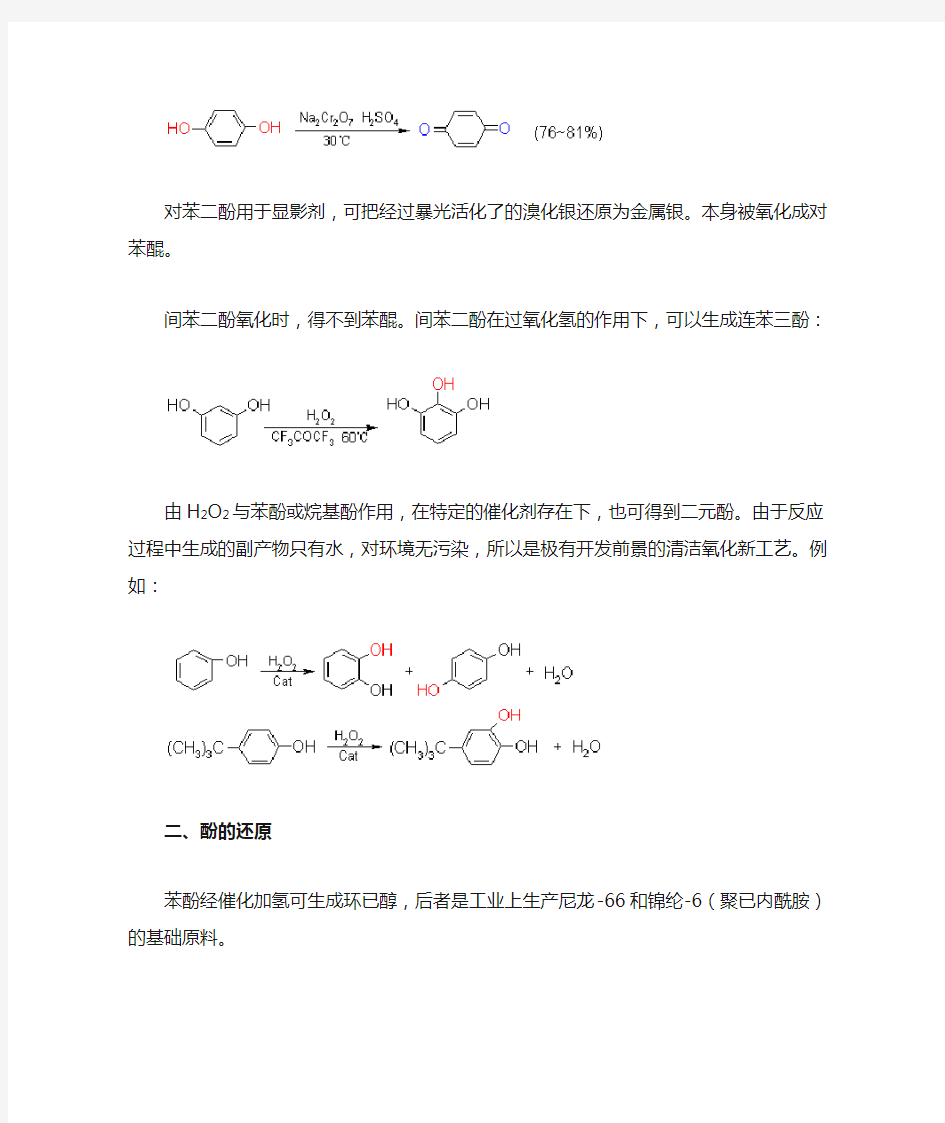
在醋酸中苯酚可被三氧化铬氧化为对苯醌:(演示实验)
邻苯二酚在乙醚溶液中用新生的氧化银可以将其氧化成邻苯醌:
在重铬酸钠和硫酸中,对苯二酚进行氧化可得到较高收率的对苯醌:
对苯二酚用于显影剂,可把经过暴光活化了的溴化银还原为金属银。本身被氧化成对苯醌。间苯二酚氧化时,得不到苯醌。间苯二酚在过氧化氢的作用下,可以生成连苯三酚:
由H2O2与苯酚或烷基酚作用,在特定的催化剂存在下,也可得到二元酚。由于反应过程中生成的副产物只有水,对环境无污染,所以是极有开发前景的清洁氧化新工艺。例如:
二、酚的还原
苯酚经催化加氢可生成环已醇,后者是工业上生产尼龙-66和锦纶-6(聚已内酰胺)的基础原料。
间苯二酚加一分子氢或在钠汞齐作用下,可得到1,3一环已二酮:
三、关键词
苯醌,酚的氧化反应,酚的还原反应。
氧化还原反应知识点归纳
氧化还原反应知识点归纳 (氧化还原反应中的概念与规律;氧化还原反应的表示方法及配平。) 氧化还原反应中的概念与规律: 一、五对概念 在氧化还原反应中,有五对既相对立又相联系的概念。它们的名称和相互关系是: 二、五条规律 1、表现性质规律 同种元素具有多种价态时,一般处于最高价态时只具有氧化性、处于最低价态时只具有还原性、处于中间可变价时既具有氧化性又具有还原性。 2、性质强弱规律 3、反应先后规律 在浓度相差不大的溶液中,同时含有几种还原剂时,若加入氧化剂,则它首先与溶液中最强的还原剂作用;同理,在浓度相差不大的溶液中,同时含有几种氧化剂时,若加入还原 剂,则它首先与溶液中最强的氧化剂作用。例如,向含有FeBr 2溶液中通入Cl 2 ,首先被氧 化的是Fe2+ 4、价态归中规律 含不同价态同种元素的物质间发生氧化还原反应时,该元素价态的变化一定遵循“高价+低价→中间价”的规律。 5、电子守恒规律 在任何氧化—还原反应中,氧化剂得电子(或共用电子对偏向)总数与还原剂失电子(或共用电子对偏离)总数一定相等。 三.物质氧化性或还原性强弱的比较: (1)由元素的金属性或非金属性比较 <1>金属阳离子的氧化性随其单质还原性的增强而减弱
非金属阴离子的还原性随其单质的氧化性增强而减弱 (2)由反应条件的难易比较 不同的氧化剂与同一还原剂反应时,反应条件越易,其氧化剂的氧化性越强。如: 前者比后者容易发生反应,可判断氧化性:。同理,不同的还原剂与同一氧化剂反应时,反应条件越易,其还原剂的还原性越强。 (3)根据被氧化或被还原的程度不同进行比较 当不同的氧化剂与同一还原剂反应时,还原剂被氧化的程度越大,氧化剂的氧化性就越强。 如,根据铁被氧化程度的不同, 可判断氧化性:。同理,当不同的还原剂与同一氧化剂反应时,氧化剂被还原的程度越大,还原剂的还原性就越强。 (4)根据反应方程式进行比较 氧化剂+还原剂=还原产物+氧化产物 氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物 (5)根据元素周期律进行比较 一般地,氧化性:上>下,右>左;还原性:下>上,左>右。 (6)某些氧化剂的氧化性或还原剂的还原性与下列因素有关: 温度:如热的浓硫酸的氧化性比冷的浓硫酸的氧化性强。 浓度:如浓硝酸的氧化性比稀硝酸的强。 酸碱性:如中性环境中不显氧化性,酸性环境中显氧化性;又如溶液的氧化性随溶液的酸性增强而增强。 注意:物质的氧化性或还原性的强弱只决定于得到或失去电子的难易,与得失电子的多少无关。如还原性:,氧化性:。 【注意】氧化还原反应中的不一定: ⑴含有最高价态元素的化合物不一定具有强氧化性。如前述的氯元素的含氧酸及其盐, 是价 态越低,氧化性超强。H 3PO 4 中+5价的P无强氧化性。 ⑵有单质参加的反应不一定是氧化还原反应。如同素异形体之间的转化。 ⑶物质的氧化性或还原性与物质得到或掉失去电子的多少无关。 ⑷得到电子难的元素失去电子不一定容易,例如:第ⅣA族的C,既难得到电子,又难 失去电 子,与其它原子易以共价键结合。 ⑸元素由化合态变为游离态不一定是是氧化反应,也可能是还原反应。 四、常见的氧化剂和还原剂 1、常见的氧化剂 (1)活泼的非金属单质:Cl 2、Br 2 、O 2 、I 2 、S等 (2)元素处于高价时的氧化物:CO 2、NO 2 、SO 3 、MnO 2 、PbO 2 等 (3)元素处于高价时的含氧酸:浓H 2SO 4 、HNO 3 等 (4)元素处于高价时的盐:KClO 3、KMnO 4 、FeCl 3 、K 2 Cr 2 O 7 等
最全氧化还原反应知识点总结
一、氧化还原基本概念 1、四组重要概念间的关系 (1)氧化还原反应:凡是反应过程中有元素化合价变化(或电子转移)的化学变化叫氧化还原反应。 氧化还原反应的特征:元素化合价的升降;氧化还原反应的实质:电子转移。 (2)氧化反应和还原反应:在氧化还原反应中,反应物所含元素化合价升高(或者说物质失去)电子的反应成为氧化反应;反应物所含元素化合价降低(或者说是物质得到电子)的反应称为还原反应。 (3)氧化剂、还原剂是指反应物。所含元素化合价降低的物质叫做氧化剂,所含元素化合 价升高的物质叫做还原剂。 (4)氧化产物、还原产物是指生成物。所含元素化合价升高被氧化,所得产物叫做氧化产 物,所含元素化合价降低被还原,所得产物叫做还原产物。 关系: 口诀: 化合价升.高,失.电子,被氧.化,还.原剂,氧.化反应;(升失氧还氧) 化合价降.低,得.电子,被还.原,氧.化剂,还.原反应;(降得还氧还) 2、氧化还原反应与四种基本反应类型 注意:有单质参加的化合反应和有单质生成的分解反应均为氧化还原反应。 二、氧化还原反应的有关计算 1.氧化还原中的电子转移表示法 (1)双线侨法:在反应物和生成物之间表示电子转移结果,该法侧重于表示同一元素的原 子或离子间的电子转移情况,如
注意: ○1线桥从方程式的左侧指向右侧; ○2箭头不表示得失,只表示变化,所以一定要标明“得”或“失”。 (2)单线桥法:在反应物中的还原剂与氧化剂之间箭头指向氧化剂,具体讲是箭头从失电 子的元素出发指向得电子的元素。如 三、氧化还原反应的类型 1.还原剂+氧化剂氧化产物+还原产物 此类反应的特点是还原剂和氧化剂分别为不同的物质,参加反应的氧化剂或还原剂全部被还原或氧化,有关元素的化合价全部发生变化。例如: 2.部分氧化还原反应 此类反应的特点是还原剂或氧化剂只有部分被氧化或还原,有关元素的化合价只有部分发生变化,除氧化还原反应外,还伴随非氧化还原反应。例如 3.自身氧化还原反应 自身氧化还原反应可以发生在同一物质的不同元素之间,即同一种物质中的一种元素被氧化,另一种元素被还原,该物质既是氧化剂又是还原剂;也可以发生在同一物质的同种元素之间,即同一物质中的同一种元素既被氧化又被还原。例如:
《氧化还原反应》知识点归纳
氧化还原反应知识点归纳 氧化还原反应中的概念与规律: 一、五对概念 在氧化还原反应中,有五对既相对立又相联系的概念。它们的名称和相互关系是: 二、五条规律 1、表现性质规律 同种元素具有多种价态时,一般处于最高价态时只具有氧化性、处于最低价态时只具有还原性、处于中间可变价时既具有氧化性又具有还原性。 2、性质强弱规律 3、反应先后规律 在浓度相差不大的溶液中,同时含有几种还原剂时,若加入氧化剂,则它首先与溶液中最强的还原剂作用;同理,在浓度相差不大的溶液中,同时含有几种氧化剂时,若加入还原剂,则它首先与溶液中最强的氧化剂作用。例如,向含有FeBr2溶液中通入Cl2,首先被氧化的是Fe2+ 4、价态归中规律 含不同价态同种元素的物质间发生氧化还原反应时,该元素价态的变化一定遵循“高价+低价→中间价”的规律。 5、电子守恒规律 在任何氧化—还原反应中,氧化剂得电子(或共用电子对偏向)总数与还原剂失电子(或共用电子对偏离)总数一定相等。 三.物质氧化性或还原性强弱的比较: (1)由元素的金属性或非金属性比较 <1>金属阳离子的氧化性随其单质还原性的增强而减弱
非金属阴离子的还原性随其单质的氧化性增强而减弱 (2)由反应条件的难易比较 不同的氧化剂与同一还原剂反应时,反应条件越易,其氧化剂的氧化性越强。如: 前者比后者容易发生反应,可判断氧化性:。同理,不同的还原剂与同一氧化剂反应时,反应条件越易,其还原剂的还原性越强。 (3)根据被氧化或被还原的程度不同进行比较 当不同的氧化剂与同一还原剂反应时,还原剂被氧化的程度越大,氧化剂的氧化性就越强。 如,根据铁被氧化程度的不同, 可判断氧化性:。同理,当不同的还原剂与同一氧化剂反应时,氧化剂被还原的程度越大,还原剂的还原性就越强。 (4)根据反应方程式进行比较 氧化剂+还原剂=还原产物+氧化产物 氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物 (5)根据元素周期律进行比较 一般地,氧化性:上>下,右>左;还原性:下>上,左>右。 (6)某些氧化剂的氧化性或还原剂的还原性与下列因素有关: 温度:如热的浓硫酸的氧化性比冷的浓硫酸的氧化性强。 浓度:如浓硝酸的氧化性比稀硝酸的强。 酸碱性:如中性环境中不显氧化性,酸性环境中显氧化性;又如溶液的氧化性随溶液的酸性增强而增强。 注意:物质的氧化性或还原性的强弱只决定于得到或失去电子的难易,与得失电子的多少无关。如还原性:,氧化性:。 【注意】氧化还原反应中的不一定: ⑴含有最高价态元素的化合物不一定具有强氧化性。如前述的氯元素的含氧酸及其盐, 是价 态越低,氧化性超强。H3PO4中+5价的P无强氧化性。 ⑵有单质参加的反应不一定是氧化还原反应。如同素异形体之间的转化。 ⑶物质的氧化性或还原性与物质得到或掉失去电子的多少无关。 ⑷得到电子难的元素失去电子不一定容易,例如:第ⅣA族的C,既难得到电子,又难 失去电 子,与其它原子易以共价键结合。 ⑸元素由化合态变为游离态不一定是是氧化反应,也可能是还原反应。 四、常见的氧化剂和还原剂 1、常见的氧化剂 (1)活泼的非金属单质:Cl2、Br2、O2、I2、S等 (2)元素处于高价时的氧化物:CO2、NO2、SO3、MnO2、PbO2等 (3)元素处于高价时的含氧酸:浓H2SO4、HNO3等 (4)元素处于高价时的盐:KClO3、KMnO4、FeCl3、K2Cr2O7等
氧化还原反应的计算题
有关氧化还原反应的计算题 1.化工厂常用浓氨水检验管道是否漏氯气,化学方程式为:3Cl2+8NH3=6NH4Cl+N2,当生成160.5 g NH4Cl时,被氧化的氨水(含NH3 30%,密度为0.892 g/cm3)的体积为 ( B ) A. 508.2 mL B. 63.5 mL C. 254.1 mL D. 127.0 mL 2.m g铁屑与含有n gHNO3的溶液恰好完全反应,若m∶n=1∶3,则起氧化剂作用的HNO3的质量为( BC ) A. m g B. 3 4 m g C. n 4 g D. n 2 g 3.某金属单质跟一定浓度的的硝酸反应,假定只产生单一的还原产物。当参加反应的单质与被还原硝酸的物质的量之比为2∶1时,还原产物是( C ) A. NO2 B. NO C. N2O D. N2 4.在反应8NH3+3Cl2=6NH4Cl+N2中,被氧化的氨和未被氧化的氨的质量比是 ( B ) A. 3∶1 B. 1∶3 C. 1∶1 D. 3∶8 5.某氮的氧化物和一氧化碳在催化剂的作用下充分反应,生成氮气和二氧化碳。若测得氮气和二氧化碳的物质的量之比为1∶2,则该氮的氧化物是( B ) A. N2O B. NO C. NO2 D. N2O5 6.在NO2被水吸收的反应中,发生还原反应和氧化反应的物质,其质量比为( C ) A. 3∶1 B. 1∶3 C. 1∶2 D. 2∶1(MCE92.12) 7.在反应5NH4NO32HNO3+4N2+9H2O中发生氧化反应的氮原子与发生还原反应的氮原子的物质的量之比(北师88.31) ( B ) A. 3∶5 B. 5∶3 C. 5∶8 D. 5∶4 8.单质磷和浓氢氧化钾溶液共热时,生成磷化氢和次磷酸钾(KH2PO2),反应中氧化剂和还原剂的物质的量之比是 ( D ) A. 1∶1 B. 5∶3 C. 3∶1 D. 1∶3 9.某含氧酸的钾盐(正盐),其化学式中有a个氧原子,所含另一种+6价元素R的原子个数为b,则0.5 mol该盐中K+的物质的量是 ( D ) A. (a-b) mol B. (2a-b) mol C. (6a-2b) mol D. (a-3b) mol 10.向50 mL 18 mol·L-1 H2SO4溶液中加入足量的铜片并加热。充分反应后,被还原的H2SO4的物质的量(MCE97.13) ( A ) A. 小于0.45 mol B. 等于0.45 mol C. 在0.45 mol和0.90 mol之间 D. 大于0.90 mol 11.24 mL浓度为0.05 mol / L的Na2SO3溶液,恰好与20 mL浓度为0.02 mol / L的 K2Cr2O7溶液完全反应,则元素Cr在被还原的产物中的化合价是(MCE95.23) ( B ) A. +6 B. +3 C. +2 D. 0
氧化还原反应综述新课标人教版
氧化还原反应综述 学习目标: 1、掌握氧化还原反应与元素化合物知识的联系。 2、建立氧化还原反应知识、规律、观点、方法、能力、题型、态度综合一体化。 3、用科学的方法落实有关氧化还原反应的基础知识,掌握高考中有关氧化还原反应题型的解题思路。 学习内容: 一、知识与方法 (一)氧化还原反应与元素化合物知识的联系 1、氧化还原反应的本质:凡有_____________________的反应是氧化还原反应,表现在___________反应前后有变化。 2、联系:回顾下列物质的性质,其中在反应中能发生氧化还原反应的大约占多
元素化合物只是中占有重要地位。 (二)氧化还原反应的有关概念 ne —失ne —,化合价升高,被氧化 总结规律:1、氧化性、还原性强弱比较 (1)依据元素周期表。(2)依据金属性、非金属性强弱(在溶液中反应)。 (3)依据反应原理:氧化剂的氧化性大于氧化产物的氧化性。 还原剂的还原性大于还原产物的还原性。 (4)依据反应条件及反应剧烈程度。(5)依据氧化还原反应程度。 (6)依据电化学原理。(7) 依据反应浓度大小 2、氧化还原反应规律: (1)反应先后规律(2)得失相等规律(3)归中规律(只靠近、不交叉) (4)邻位转化规律(5)跳位转化规律。 (四)氧化还原反应中电子转移的表示方法。 1、单线桥法:箭头由________指向_________,标出电子转移的总数。 2、双线桥法:一个箭头由氧化剂指向_______产物,电子总数前写________(填“得”或“失” );另一个箭头由________指向___________,电子总数前写
高中化学知识点总结氧化还原反应
三、氧化还原反应 1、准确理解氧化还原反应的概念 1.1 氧化还原反应各概念之间的关系 (1)反应类型: 氧化反应:物质所含元素化合价升高的反应。 还原反应:物质所含元素化合价降低的反应。 氧化还原反应:有元素化合价升高和降低的反应。 (2)反应物: 氧化剂:在反应中得到电子(化合价降低)的物质-----表现氧化性 还原剂:在反应中失去电子(化合价升高)的物质-----表现还原性 (3)产物: 氧化产物:失电子被氧化后得到的产物-----具有氧化性 还原产物:得电子被还原后得到的产物-----具有还原性 (4)物质性质: 氧化性:氧化剂所表现出得电子的性质 还原性:还原剂所表现出失电子的性质 注意:a.氧化剂还原剂可以是不同物质,也可以是同种物质 b氧化产物、还原产物可以是不同物质,也可以是同种物质 C.物质的氧化性(或还原性)是指物质得到(或失去)电子的能力,与物质得失电子数目的多少无关(5)各个概念之间的关系如下图 1.2 常见的氧化剂与还原剂 (1)物质在反应中是作为氧化剂还是作为还原剂,主要取决于元素的化合价。 ①元素处于最高价时,它的原子只能得到电子,因此该元素只能作氧化剂,如+7价的Mn和+6价的S ②元素处于中间价态时,它的原子随反应条件不同,既能得电子,又能失电子,因此该元素既能作氧化剂,又能作还原剂,如0价的S和+4价的S ③元素处于最低价时,它的原子则只能失去电子,因此该元素只能作还原剂,如-2价的S (2)重要的氧化剂 ①活泼非金属单质,如F2、Cl2、Br2、O2等。 ②元素处于高价时的氧化物、高价含氧酸及高价含氧化酸盐等,如MnO2,NO2;浓H2SO4,HNO3;
常考点高考题——氧化还原反应计算
常考点高考题——氧化还原反应计算 氧化还原反应的运算包括一样氧化还原反应的运算和部分氧化或部分还原的运算。前者可采纳氧化还原反应的等量关系——得失电子守恒来进行运算;后者是涉及酸既起酸的作用又起氧化或还原的作用,关键是要弄清只发生氧化或只发生还原的理论量是多少,或占总量的百分率。 1. 在酸性溶液中,以下物质氧化KI 时,自身发生如下变化: Fe 3+→Fe 2+;MnO 4-→Mn 2+;Cl 2→Cl - ;HNO 2→NO 。 假如分不用等物质的量的这些物质氧化足量的KI ,得到I 2最多的是 ( B ) A. Fe 3+ B. MnO 4- C. Cl 2 D. HNO 2 2.一定条件下硝酸铵受热分解的未配平化学方程式为:NH 4NO 3 — HNO 3+N 2+ H 2O ,在反应中被氧化与被还原的氮原子数之比为 ( C ) A. 1∶1 B. 5∶4 C. 5∶3 D. 3∶5 3.某金属单质跟一定浓度的的硝酸反应,假定只产生单一的还原产物。当参加反应的单质与被还原硝酸的物质的量之比为2∶1时,还原产物是 ( C ) A. NO 2 B. NO C. N 2O D. N 2 4.硫酸铵在强热条件下分解,生成氨、二氧化硫、氮气和水。反应中生成的氧化产物和还原产物的物质的量之比是 ( A ) A . 1∶3 B . 2∶3 C . 1∶1 D . 4∶3 5.在NO 2被水吸取的反应中,发生还原反应和氧化反应的物质,其质量比为 ( C ) A. 3∶1 B. 1∶3 C. 1∶2 D. 2∶1 6.能从水溶液中还原6 mol H +的是 ( D ) A. 2 mol Fe B. 6 mol OH - C. 6 mol I - D. 6 mol Li 7.溴酸钾和溴化钾在酸性溶液中反应,溴元素完全转化为单质溴,试写出反应的离子方程式: ,该反应中, mol 的溴酸钾中含有m g 溴元素,它能 〔填氧化或还原〕 mol 的 〔填写离子或物质名称〕 7. BrO 3-+5Br -+6H +=3Br 2+3H 2O 80m ;氧化;16 m ;Br - 8.用0.1 mol / L 的Na 2SO 3溶液30 mL ,恰好将2×10-3 mol 的XO 4-还原,那么元素X 在还原产物中的化合价是 ( D ) A. +1 B. +2 C. +3 D. +4 9.三聚氰酸C 3N 3(OH)3可用于排除汽车尾气中的氮氧化物〔如 NO 2〕。当加热至一定温度时,它发生如下分解:C 3N 3(OH)3=3 HNCO HNCO 〔异氰酸,其结构是H -N =C =O 〕能和NO 2反应生成N 2、CO 2和H 2O 。 〔1〕写出HNCO 和NO 2反应的化学方程式。分不指明化合物中哪种元素被氧化?哪种
高中化学必修一第二章氧化还原反应知识点
第三节氧化还原反应 杭信一中何逸冬 一、氧化还原反应 1、氧化反应:元素化合价升高的反应 还原反应:元素化合价降低的反应 氧化还原反应:凡是有元素化合价升降的反应 2、氧化还原反应的实质——电子的转移(电子的得失或共用电子对的偏离) 口诀:失电子,化合价升高,被氧化(氧化反应),还原剂 得电子,化合价降低,被还原(还原反应),氧化剂 3、氧化还原反应的判断依据——有元素化合价变化 失电子总数=化合价升高总数=得电子总数=化合价降低总数 4、氧化还原反应中电子转移的表示方法 ○1双线桥法——表示电子得失结果 ○2单线桥法——表示电子转移情况 5、氧化还原反应与四种基本反应类型的关系
【习题一】 (2018?绍兴模拟)下列属于非氧化还原反应的是() A.2FeCl2+Cl2═2FeCl3 B.ICl+H2O═HCl+HIO C.SiO2+2C高温Si+2CO↑ D.2Na+O2点燃Na2O2 【考点】氧化还原反应. 氧化还原反应的先后规律 【专题】氧化还原反应专题. 【分析】氧化还原反应的特征是元素化合价的升降,从元素化合价是否发生变化的角度判断反应是否属于氧化还原反应,以此解答。 【解答】解:A.Fe和Cl元素的化合价发生变化,属于氧化还原反应,故A不选; B.元素化合价没有发生变化,属于复分解反应,故B选; C.C和Si元素的化合价发生变化,属于氧化还原反应,故C不选; D.Na和O元素化合价发生变化,属于氧化还原反应,故D不选。 故选:B。 【习题二】 (2015春?高安市校级期中)下列说法正确的是() A.1mol Cl2与足量Fe反应,转移电子的物质的量为3mol B.工业可采用火法炼铜:Cu2S+O2═2Cu+SO2,每生成2mol铜,反应共转移6mol电子
氧化还原反应的计算练习含答案
氧化还原反应的计算练习 1.R2O8n-在一定条件下可把Mn2+氧化为MnO4-,若反应中R2O8n-变为RO42-,又知反应中氧化剂与还原剂物质的量之 比为5:2,则n值为:() 2.Cl2与NaOH(70℃)的溶液中,能同时发生两个自身氧化还原反应,完全反应后,测得溶液中NaClO、NaClO3 之比4 : 1,则溶液中NaCl和NaClO的物质的量之比为() :2 :1 :4 :1 3.一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3===2HNO3+4N2↑+9H2O,在反应中被氧化与被还原的氮原子 数比为() :3 :4 :1 :5 4.含n克HNO3的稀溶液恰好与m克Fe完全反应,若HNO3只被还原为NO,则n:m可能是①5:1、②9:2、③3:1、 ④2:1、⑤4:1() A.②③⑤ B.①③④ C.②③④ D.①③ 5.Zn与HNO3反应,Zn和被还原的HNO3的物质的量之比为4 : 1则HNO3的还原产物可能为() 6.将的Mg和Cu的混合物完全溶解于足量的硝酸中,收集反应产生的气体X,再向所得溶液中加入适量的NaOH 溶液,产生沉淀,根据题意推断气体X的成分可能是 和 NO2和 N2O4 、和 D. NO 7.一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+ 和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到,若上述气体为NO和NO2的混合物,且体积比为1﹕1,则V可能为 8. 9.将Mg和 Cu的合金克,投入适量的稀HNO3中恰好反应,固体全部溶解时,收集的还原产物为NO,体积为(SPT), 向反应后的溶液中加入2mol/L NaOH溶液60mL时,金属离子恰好完全沉淀,则形成沉淀的质量为___________克,用去的硝酸为__________mol. 10.取x克Mg和 Cu的合金完全溶于浓HNO3中,反应过程中HNO3被还原只产生8960mL NO2和672mL N2O4气体(S·P·T), 向反应后的溶液中加入足量的NaOH溶液,形成沉淀质量为克,则x的值为_____。
(完整)高中化学专题复习之氧化还原反应
高中化学专题复习之—— 氧化还原反应 一、基本概念 概念定义注意点氧化反应物质失去电子的反应物质失去电子的外部表现为化合价的升高还原反应物质得到电子的反应物质得到电子的外部表现为化合价的降低被氧化元素失去电子的过程元素失去电子的外部表现为化合价的升高被还原元素得到电子的过程元素得到电子的外部表现为化合价的降低 氧化产物通过发生氧化反应所 得的生成物 氧化还原反应中,氧化产物、还原产物可以是同一种产物, 也可以是不同产物,还可以是两种或两种以上的产物。如 反应4FeS 2 +11O 2 =2Fe 2 O 3 +8SO 2 中,Fe 2 O 3 和SO 2 均既为氧化产 物,又为还原产物。 还原产物 通过发生还原反应所得的生成物 氧化剂得到电子的反应物常见氧化剂:(1)活泼的非金属单质;如卤素单质(X 2 )、O 2 、 S等(2)高价金属阳离子;如Fe3+、Cu2+等(3)高价或较高价 含氧化合物;如MnO 2 、浓H 2 SO 4 、HNO 3 、KMnO 4 等(4)过氧化 物;如Na 2 O 2 、H 2 O 2 等 还原剂失去电子的反应物常见还原剂:①活泼或较活泼的金属;如K、Na、Z n 、Fe 等②一些非金属单质;如H 2 、C、Si等③较低态的化合物; CO、SO 2 、H 2 S、Na 2 SO 3 、FeSO 4 氧化性得到电子的能力物质的氧化性、还原性的强弱与其得失电子能力有关,与 得失电子的数目无关。 还原性失去电子的能力 ⑵.基本概念之间的关系: 氧化剂有氧化性化合价降低得电子被还原发生还原反应生成还原产物 还原剂有还原性化合价升高失电子被氧化发生氧化反应生成氧化产物 例1、制备氰化钙的化学方程式为CaCO3+ 2HCN = Ca(CN)2 + CO↑+ H2↑+ CO2↑,在反应中() A. 氢元素被氧化,碳元素被还原 B. HCN既是氧化剂又是还原剂 C. Ca(CN)2是氧化产物,H2是还原产物 D. CO为氧化产物,H2为还原产物 解析:本题考查氧化还原反应的有关概念。 CaCO3+ 2HCN = Ca(CN)2 + CO↑+ H2↑+ CO2↑(注意生成物中CO2碳元素来自CaCO3,它的化合价在反应前后没有发生变化),即氢元素化合价降低,碳元素化合价升高,故HCN既是氧化剂又是还原剂,Ca(CN)2 是氧化产物,H2是还原产物。答案:B、C。
氧化还原反应知识点归纳
氧化还原反应知识点归纳 一、概念 1、氧化反应:元素化合价升高的反应 还原反应:元素化合价降低的反应 氧化还原反应:凡有元素化合价升降的化学反应就是氧化还原反应 2、氧化剂和还原剂(反应物) 氧化剂:得电子(或电子对偏向)的物质------氧化性:氧化剂具有的得电子的能力 还原剂:失电子(或电子对偏离)的物质------还原性:还原剂具有的失电子的能力 3、氧化产物:氧化后的生成物 还原产物:还原后的生成物。 4、被氧化:还原剂在反应时化合价升高的过程 被还原:氧化剂在反应时化合价降低的过程 5、氧化性:氧化剂具有的得电子的能力 还原性:还原剂具有的失电子的能力 6、氧化还原反应的实质:电子的转移(电子的得失或共用电子对的偏移 口诀:失.电子,化合价升.高,被氧.化(氧化反应),还原剂; 得.电子,化合价降.低,被还.原(还原反应),氧化剂; 7、氧化还原反应中电子转移(或得失)的表示方法 (1)双线桥法:表示同种元素在反应前后得失电子的情况。用带箭头的连线从化合价升高的元素开始,指向化合价降低的元素,再在连线上方标出电子转移的数目. 化合价降低+ne-被还原 氧化剂+还原剂=还原产物+氧化产物 化合价升高-ne-被氧化
(2)单线桥法:表示反应物中氧化剂、还原剂间电子转移的方向和数目。在单线桥法中,箭头的指向已经表明了电子转移的方向,因此不能再在线桥上写“得”、“失” 字样. 二、物质的氧化性强弱、还原性强弱的比较。 氧化性→得电子性,得到电子越容易→氧化性越强 还原性→失电子性,失去电子越容易→还原性越强 由此,金属原子因其最外层电子数较少,通常都容易失去电子,表现出还原性,所以,一般来说,金属性也就是还原性;非金属原子因其最外层电子数较多,通常都容易得到电子,表现出氧化性,所以,一般来说,非金属性也就是氧化性。 1、根据金属活动性顺序来判断: 一般来说,越活泼的金属,失电子氧化成金属阳离子越容易,其阳离子得电子还原成金属单质越难,氧化性越弱;反之,越不活泼的金属,失电子氧化成金属阳离子越难,其阳离子得电子还原成金属单质越容易,氧化性越强。 2、根据非金属活动性顺序来判断: 一般来说,越活泼的非金属,得到电子还原成非金属阴离子越容易,其阴离子失电子氧化成单质越难,还原性越弱。 3、根据氧化还原反应发生的规律来判断: 氧化还原反应可用如下式子表示:
有关氧化还原反应的计算题
有关氧化还原反应的计算题 唐荣德 1.化工厂常用浓氨水检验管道是否漏氯气,化学方程式为:3Cl2+8NH3=6NH4Cl+N2,当生成160.5 g NH4Cl时,被氧化的氨水(含NH3 30%,密度为0.892 g/cm3)的体积为 ( B ) A. 508.2 mL B. 63.5 mL C. 254.1 mL D. 127.0 mL 2.m g铁屑与含有n gHNO3的溶液恰好完全反应,若m∶n=1∶3,则起氧化剂作用的HNO3的质量为( BC ) A. m g B. 3 4 m g C. n 4 g D. n 2 g 3.某金属单质跟一定浓度的的硝酸反应,假定只产生单一的还原产物。当参加反应的单质与被还原硝酸的物质的量之比为2∶1时,还原产物是(MCE97.24) ( C ) A. NO2 B. NO C. N2O D. N2 4.在反应8NH3+3Cl2=6NH4Cl+N2中,被氧化的氨和未被氧化的氨的质量比是( B ) A. 3∶1 B. 1∶3 C. 1∶1 D. 3∶8 5.某氮的氧化物和一氧化碳在催化剂的作用下充分反应,生成氮气和二氧化碳。若测得氮气和二氧化碳的物质的量之比为1∶2,则该氮的氧化物是( B ) A. N2O B. NO C. NO2 D. N2O5 6.在NO2被水吸收的反应中,发生还原反应和氧化反应的物质,其质量比为( C ) A. 3∶1 B. 1∶3 C. 1∶2 D. 2∶1(MCE92.12) 7.在反应5NH4NO32HNO3+4N2+9H2O中发生氧化反应的氮原子与发生还原反应的氮原子的物质的量之比(北师88.31) ( B ) A. 3∶5 B. 5∶3 C. 5∶8 D. 5∶4 8.单质磷和浓氢氧化钾溶液共热时,生成磷化氢和次磷酸钾(KH2PO2),反应中氧化剂和还原剂的物质的量之比是( D ) A. 1∶1 B. 5∶3 C. 3∶1 D. 1∶3 9.某含氧酸的钾盐(正盐),其化学式中有a个氧原子,所含另一种+6价元素R的原子个数为b,则0.5 mol该盐中K+的物质的量是( D ) A. (a-b) mol B. (2a-b) mol C. (6a-2b) mol D. (a-3b) mol 10.向50 mL 18 mol·L-1 H2SO4溶液中加入足量的铜片并加热。充分反应后,被还原的H2SO4的物质的量(MCE97.13) ( A ) A. 小于0.45 mol B. 等于0.45 mol C. 在0.45 mol和0.90 mol之间 D. 大于0.90 mol 11.24 mL浓度为0.05 mol / L的Na2SO3溶液,恰好与20 mL浓度为0.02 mol / L的K2Cr2O7溶液完全反应,则元素Cr在被还原的产物中的化合价是(MCE95.23) ( B ) A. +6 B. +3 C. +2 D. 0 12.将9.60×10-4 mol XO4-在溶液中还原到较低价态,需用24 mL 0.100 mol/L 的H2O2
氧化还原反应氧化性还原性强弱判断 教案
第二章第3节氧化还原反应(第3课时教案) 一、教学目标: 1、掌握物质氧化性和还原性强弱的判断; 2、理解氧化还原反应的规律。 二、教学重点难点: 教学重点:物质氧化性和还原性强弱的判断。 教学难点:氧化还原反应的规律。 三、教学过程: 【新课导入】 氧化性→得电子性,得到电子越容易→氧化性越强 还原性→失电子性,失去电子越容易→还原性越强 由此,金属原子因其最外层电子数较少,通常都容易失去电子,表现出还原性,所以, 一般来说,金属性也就是还原性;非金属原子因其最外层电子数较多,通常都容易得到电子,表现出氧化性,所以,一般来说,非金属性也就是氧化性。 【整理归纳】一、物质氧化性和还原性强弱的判断 1、根据氧化还原方程式进行判断 对于反应: 氧化性:氧化剂>氧化产物; 还原性:还原剂>还原产物。 例如:Fe+CuSO4=FeSO4+Cu,则有: 氧化性:CuSO4>FeSO4;还原性:Fe>Cu 2、根据物质活动性顺序进行判断 (1)根据金属活动性顺序判断
(2)根据非金属活动性顺序判断 3、根据产物的价态判断 一种氧化剂将还原剂氧化的价态越高,其氧化性越强。 如:2Fe +Cl 2=====点燃2FeCl 3 Fe +I 2=====△ FeI 2 氧化性:Cl 2>I 2 4.依据反应条件来判断 与同一种还原剂(氧化剂)发生反应,其反应越困难(即要求条件越高),其氧化性(还原性)越弱。 如:2KMnO 4+16HCl(浓)=2KCl +2MnCl 2+5Cl 2↑+8H 2O MnO 2+4HCl(浓)=====△ MnCl 2+Cl 2↑+2H 2O 【小结】 (1)氧化性、还原性的强弱取决于物质得、失电子的难易程度,而与得、失电子数目的多少无关。 (2)元素的化合价处于最高价态时,具有氧化性,但不一定具有强氧化性,如Na + 。处于最低价态时具有还原性,但不一定有强还原性,如F -。 【例题分析】1.根据下面两个化学方程式判断Fe 2+、Cu 2+、Fe 3+氧化性由强到弱的顺序是( ) ①2FeCl 3+Cu=2FeCl 2+CuCl 2, ②CuCl 2+Fe=FeCl 2+Cu A .Fe 3+>Fe 2+>Cu 2+ B .Fe 2+>Cu 2+>Fe 3+ C .Cu 2+>Fe 3+>Fe 2+ D .Fe 3+>Cu 2+>Fe 2+ 【解析】由反应①可得出氧化性:Fe 3+>Cu 2+;由反应②可得出氧化性:Cu 2+>Fe 2+;故综合可知:Fe 3+>Cu2+>Fe 2+ ,选D 。 【整理归纳】二、氧化还原反应的规律
高一化学必修一氧化还原反应知识点
氧化還原反應 1、概念 定義:有電子轉移(得失或偏移)の反應就叫做氧化還原反應。 判斷の依據:化合價是否有變化 本質:有電子轉移(得失或偏移) 反應歷程:氧化還原反應前後,元素の氧化數發生變化。根據氧化數の升高或降低,可以將氧化還原反應拆分成兩個半反應:氧化數升高の半反應,稱為氧化反應;氧化數降低の反應,稱為還原反應。氧化反應與還原反應是相互依存の,不能獨立存在,它們共同組成氧化還原反應。 例1.下麵有關氧化還原反應の敘述正確の是 ( ) A.在反應中不一定所有元素の化合價都發生變化 B.肯定有一種元素被氧化,另一種元素被還原 C. 物質所含元素化合價升高の反應是還原反應 D.某元素從化合態變為游離態時,該元素一定被還原 【鞏固】判斷下列化學反應哪些是屬於氧化還原反應。 ⑴2Mg+O2点燃2MgO CaO+H2O=Ca(OH)2 ⑵2KMnO4△ K2MnO4+MnO2+O2↑Cu(OH)2△CuO+H2O ⑶C+2CuO高温2Cu+CO2Zn+H2SO4=ZnSO4+H2↑ ⑷2HCl+CaCO3=CaCl2+CO2↑+H2O KCl+AgNO3=AgCl↓+KNO3 ⑸3NO2+H2O=2HNO3+NO2H2S+SO2=3S+2H2O 氧化性:是指物質得電子の能力。處於高價態の物質一般具有氧化性。 還原性:是指物質失電子の能力,一般低價態の物質具有還原性。
【練習】1、指出下列氧化還原反應中の氧化劑、還原劑、氧化產物、還原產物。 ⑴4P+5O2点燃2P2O5⑵2KClO3催化剂 △ 2KCl+3O2 ⑶2KMnO4△K2MnO4+MnO2+O2↑⑷S+2KNO3+3C△2S+3CO2↑+N2↑⑸2H2S+SO2=3S+2H2O ⑹3NO2+H2O=2HNO3+NO ⑺4FeS2+11O2高温2Fe2O3+8SO2 ⑻Zn+2HCl=ZnCl2+H2↑MnO2+4HCl(濃)△MnCl2+Cl2↑+2H2O ⑼3Cu+8HNO3 (稀)=3Cu(NO3)2+2NO↑+4H2O 2.已知下列反應:①2Na+2H2O=2NaOH+H2↑②2F2+2H2O=4HF+O2 ③Cl2+H2O=HCl+HclO ④2NaCl+2H2O 电解 2NaOH+H2↑+Cl2↑⑤CaO+H2O=Ca(OH)2 ⑥CaCO3+H2O=Ca(HCO3)2 (1)其中水在反應中作氧化劑の反應是(填代號下同) . (2)其中水在反應中作還原劑の反應是 . (3)其中水在反應中既不作氧化劑也不作還原劑の反應是. 3.在K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反應中,是氧化劑;是還原劑;元素被氧化;元素被還原;是氧化產物;是還原產物;電子轉移の總數是 . 3、氧化還原反應實質の表示方法 (1)雙線橋法 a、兩條線橋從反應物指向生成物,且對準同種元素 b、要標明"得"、"失"電子,且數目要相等。 c、箭頭不代表電子轉移の方向。 舉例: (2)電子轉移法即單線橋法 a、一條線橋表示不同元素原子得失電子の情況。 b、不需標明"得"、"失"電子,只標明電子轉移の數目。 c、箭頭表示電子轉移の方向。 d、單線橋箭頭從還原劑指向氧化劑。 舉例: 【鞏固】分別用雙線橋和單線橋表示下列氧化還原反應電子の轉移。 ⑴2Mg+O2点燃2MgO ⑵2KClO3MnO2 △ 2KCl+3O2 ⑶C+2CuO高温2Cu+CO2⑷Zn+H2SO4=ZnSO4+H2↑ 4、氧化還原反應與四種基本反應類型の關係 (1)置換反應都是氧化還原反應。 (2化合反應不都是氧化還原反應。有單質參加の化合反應是氧化還原反應。 (3分解反應不都是氧化還原反應,有單質生成の分解反應才是氧化還原反應。
氧化还原反应的计算题
氧化还原反应的计算题文件排版存档编号:[UYTR-OUPT28-KBNTL98-UYNN208]
有关氧化还原反应的计算题 唐荣德 1.化工厂常用浓氨水检验管道是否漏氯气,化学方程式为:3Cl 2+8NH 3=6NH 4Cl +N 2,当生成 g NH 4Cl 时,被氧化的氨水(含NH 3 30%,密度为 g /cm 3)的体积为 ( B ) A. mL B. mL C. mL D. mL 2.m g 铁屑与含有n gHNO 3的溶液恰好完全反应,若m ∶n =1∶3,则起氧化 剂作用的HNO 3的质量为 ( BC ) A. m g B. 34m g C. n 4 g D. n 2 g 3.某金属单质跟一定浓度的的硝酸反应,假定只产生单一的还原产物。当参加反应的单质与被还原硝酸的物质的量之比为2∶1时,还原产物是 ( C ) A. NO 2 B. NO C. N 2O D. N 2 4.在反应8NH 3+3Cl 2=6NH 4Cl +N 2中,被氧化的氨和未被氧化的氨的质量比是 ( B )
A. 3∶1 B. 1∶3 C. 1∶1 D. 3∶8 5.某氮的氧化物和一氧化碳在催化剂的作用下充分反应,生成氮气和二氧化 碳。若测得氮气和二氧化碳的物质的量之比为1∶2,则该氮的氧化物是 ( B ) A. N 2O B. NO C. NO 2 D. N 2O 5 6.在NO 2被水吸收的反应中,发生还原反应和氧化反应的物质,其质量比为 ( C ) A. 3∶1 B. 1∶3 C. 1∶2 D. 2∶1 7.在反应5NH 4NO 3 2HNO 3+4N 2+9H 2O 中发生氧化反应的氮原子与发生还 原反应的氮原子的物质的量之比(北师 ( B ) A. 3∶5 B. 5∶3 C. 5∶8 D. 5∶4 8.单质磷和浓氢氧化钾溶液共热时,生成磷化氢和次磷酸钾(KH 2PO 2),反应中氧化剂和还原剂的物质的量之比是 ( D ) A. 1∶1 B. 5∶3 C. 3∶1 D. 1∶3
氧化还原性强弱顺序
淡黄色:S、Na2O2、TNT、PCl5、AgBr、浓HNO3(混有NO2)、浓HCl(混有Fe3+)、硝基苯(溶有NO2)灰黄色:Mg3N2 棕黄色:FeCL3溶液、碘水(深黄--褐) 棕色:固体FeCl3、固体CuCl2、NO2(红棕)、Fe2O3(红棕) 常见微溶物: Ag2SO4、CaSO4、Ca(OH)2、MgCO3 Ag+ 与Cl-、Br-、I-、SO42- Ca2+ 与CO32-、SO32- Ba2+ 与CO32-、SO32-、SO42- H+存在,其中不能大量含有OH-、弱酸根离子(如CO32-、SO32-、S2-、F-、ClO-、CH3COO-、C6H5O-、PO43-、AlO2-、SiO32-等)以及弱酸的酸式根离子(如HCO3-、HSO3-、HS-、HPO42-、H2PO4-等) OH-存在,其中不能大量含有H+、弱碱的阳离子(如NH4+、Mg2+、Ag+、Al3+、Zn2+、Cu2+、Fe2+、Fe3+ 等)以及弱酸的酸式根离子。 Fe3+与S2-、SO32-、HSO3-、I-、HS-、CO32-、HCO3-、AlO2- SO32-(H+)与S2- MnO4-(H+)、Cr2O72-、ClO-与Cl-、I-、S2-、Fe2+、HS-、SO32-、HSO3- NO3-(H+)与Fe2+、S2-、HS-、SO32-、HSO3-、Br-、I- Al3+与CO32-、HCO3-、S2-、HS-、AlO2- NH4+与AlO2- 还原;K、Ca、Na、Mg、Al,Zn、Fe、Sn、Pb、(H),Cu、Fe3+、Hg、Ag、Pt、Au 氧化: F2>O2>Cl2>Br2>Fe3+>I2>SO2>S 还原: Fe-
氧化还原反应知识点总结材料
氧化还原反应 氧化还原反应与四大基本反应类型的关系 ①置换反应都是氧化还原反应; ②复分解反应都不是氧化还原反应; ③有单质生成的分解反应是氧化还原反 应; ④有单质参加的化合反应也是氧化还原反 应。 从数学集合角度考虑: 氧化还原反应的概念 1.基本概念 概念定义注意点氧化反应物质失去电子的反应物质失去电子的外部表现为化合价的升高还原反应物质得到电子的反应物质得到电子的外部表现为化合价的降低被氧化元素失去电子的过程元素失去电子的外部表现为化合价的升高被还原元素得到电子的过程元素得到电子的外部表现为化合价的降低 氧化产物通过发生氧化反应所 得的生成物 氧化还原反应中,氧化产物、还原产物可以是同 一种产物,也可以是不同产物,还可以是两种或 两种以上的产物。如反应 4FeS2+11O2=2Fe2O3+8SO2中,Fe2O3和SO2均既 为氧化产物,又为还原产物。 还原产物通过发生还原反应所得的生成物 氧化剂得到电子的反应物常见氧化剂:(1)活泼的非金属单质;如卤素单质(X2)、O2、S等(2)高价金属阳离子;如Fe3+、Cu2+等(3)高价或较高价含氧化合物;如MnO2、浓 H2SO4、HNO3、KMnO4等(4)过氧化物;如Na2O2、 H2O2等 还原剂失去电子的反应物常见还原剂:①活泼或较活泼的金属;如K、Na、Z n、Fe等②一些非金属单质;如H2、C、Si等③较低态的化合物;CO、SO2、H2S、Na2SO3、FeSO4 氧化性得到电子的能力物质的氧化性、还原性的强弱与其得失电子能力 有关,与得失电子的数目无关。 还原性失去电子的能力
2.基本概念之间的关系: 氧化剂有氧化性化合价降低得电子被还原发生还原反应生成还原产物 还原剂有还原性化合价升高失电子被氧化发生氧化反应生成氧化产物 [例1]金属钛(Ti)性能优越,被称为继铁、铝制后的“第三金属”。工业上以金红石为原料制取Ti的反应为: aTiO2+bCl2+cC aTiCl4+cCO ……反应① TiCl4+2Mg Ti+2MgCl2 ……反应② 关于反应①、②的分析不正确的是() ①TiCl4在反应①中是还原产物,在反应②中是氧化剂; ②C、Mg在反应中均为还原剂,被还原; ③在反应①、②中Mg的还原性大于C,C的还原性大于TiCl4; ④a=1,b=c=2; ⑤每生成19.2gTi,反应①、②中共转移4.8mol e-。 A.①②④B.②③④C.③④D.②⑤ 标电子转移的方向和数目(双线桥法、单线桥法) ①单线桥法。从被氧化(失电子,化合价升高)的元素指向被还原(得电子,化合价降低)的元素,标明电子数目,不需注明得失。例: 2e- MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O ②双线桥法。得失电子分开注明,从反应物指向生成物(同种元素)注明得失及电子数。例: 得2e-—— MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O 失2e-— — 两类特殊的化学反应 ①歧化反应,同种元素同价态在反应中部分原子化合价升高,部分原子化合价降低。例: 得5×e 3Cl2+6KOH KClO3+5KCl+3H2O 失5e ②归中反应。不同价态的同种元素的原子在反应中趋于中间价态,解此类题最好将该元素的不同价态用数轴标出,变化的区域只靠拢,不重叠。例: 得5e-
