硫及其重要化合物(新)
第1页
硫及其重要化合物
一、 硫及其重要化合物的思维导图
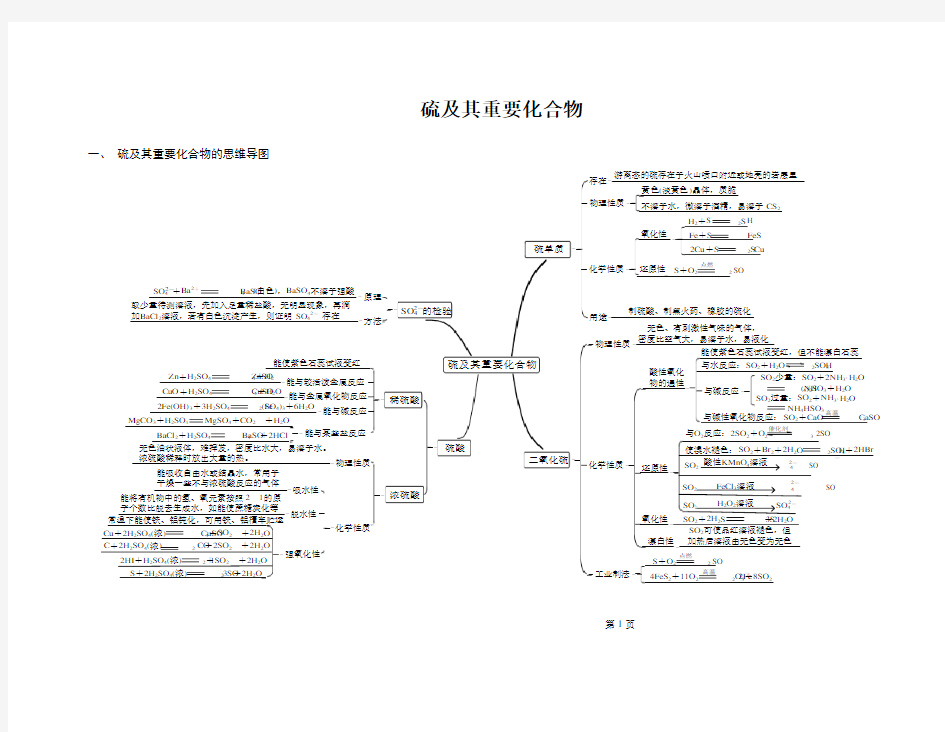
硫及其重要化合物
硫单质
-
-黄色(淡黄色)晶体,质脆
物理性质不溶于水,微溶于酒精,易溶于CS
2
-存在游离态的硫存在于火山喷口附近或地壳的岩层里
-化学性质氧化性
还原性
-H 2+S H 2S
Fe +S FeS
-S +O 2 SO 2
点燃
-用途制硫酸、制黑火药、橡胶的硫化二氧化硫
-
-物理性质无色、有刺激性气味的气体,
密度比空气大,易溶于水,易液化
-化学性质
-
酸性氧化物的通性能使紫色石蕊试液变红,但不能漂白石蕊
使溴水褪色:SO 2+Br 2+2H 2O H 2SO 4+2HBr
与水反应:SO 2+H 2O H 2SO 3
与碱反应
-SO 2少量:SO 2+2NH 3·H 2O
(NH 4)2SO 3+H 2O SO 2过量:SO 2+NH 3·H 2O
NH 4HSO 3还原性
-
工业制法
-与碱性氧化物反应:SO 2+CaO CaSO 3
与O 2反应:2SO 2+O 2 2SO 3催化剂
SO 2 SO 4
2--
SO 2 SO 4
2-
SO 2 SO 4
氧化性
-
漂白性
-SO 2+2H 2S 3S +2H 2O
SO 2可使品红溶液褪色,但加热后溶液由无色变为无色
S +O 2 SO 2
点燃
4FeS 2+11O 2 2Fe 2O 3+8SO 2
高温
硫酸
SO 4 的检验
2-
-稀硫酸
浓硫酸
-
能使紫色石蕊试液变红
能与较活泼金属反应Zn +H 2SO 4 ZnSO 4+H 2
能与金属氧化物反应
CuO +H 2SO 4 CuSO 4+H 2O 能与碱反应
2Fe(OH)3+3H 2SO 4 Fe 2(SO 4)3+6H 2O 能与某些盐反应
物理性质
化学性质无色油状液体,难挥发,密度比水大,易溶于水。
浓硫酸稀释时放出大量的热。能吸收自由水或结晶水,常用于干燥一些不与浓硫酸反应的气体
吸水性
脱水性
-
能将有机物中的氢、氧元素按照2 1的原子个数比脱去生成水,如能使蔗糖炭化等强氧化性
-常温下能使铁、铝钝化,可用铁、铝槽车贮运
Cu +2H 2SO 4(浓) CuSO 4+SO 2 +2H 2O
2HI +H 2SO 4(浓) I 2+SO 2 +2H 2O BaCl 2+H 2SO 4 BaSO 4 +2HCl MgCO 3+H 2SO 4 MgSO 4+CO 2 +H 2O
-
- -
-原理
方法-
SO 4 +Ba 2+ BaSO 4 (白色),BaSO 4不溶于强酸
2-取少量待测溶液,先加入足量稀盐酸,无明显现象,再滴加BaCl 2溶液,若有白色沉淀产生,则证明SO 42- 存在
2Cu +S Cu 2S
S +2H 2SO 4(浓) 3SO 2 +2H 2O
高温
酸性KMnO 4溶液FeCl 3溶液H 2O 2溶液2-C +2H 2SO 4(浓) CO 2 +2SO 2 +2H 2O
第1页
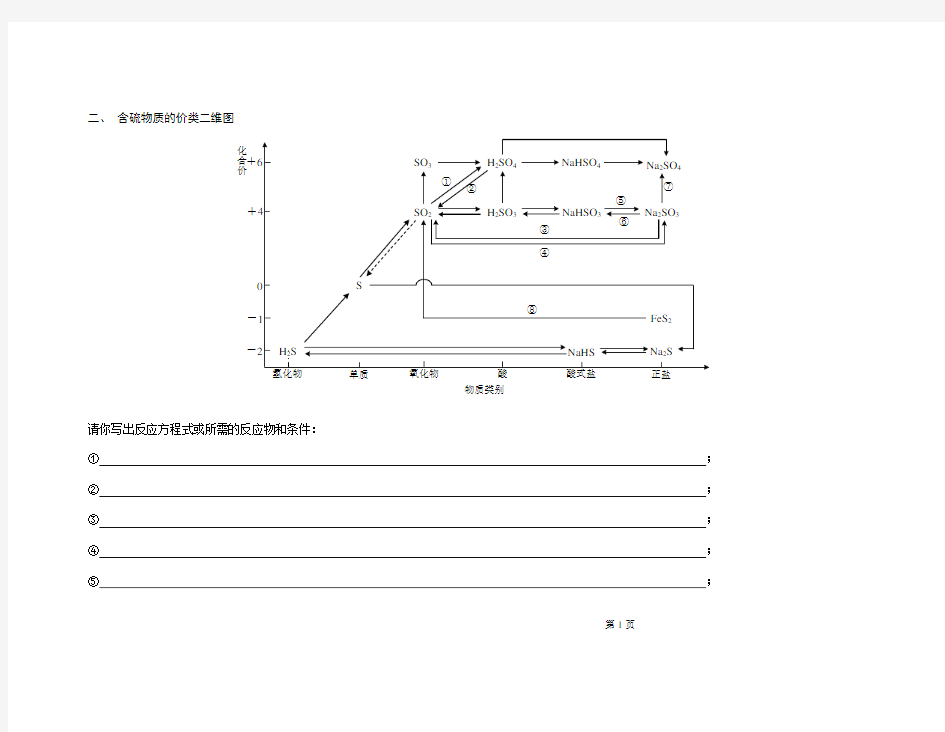
化合价
物质类别
+-+-
二、 含硫物质的价类二维图
请你写出反应方程式或所需的反应物和条件:
① ; ② ; ③ ; ④ ; ⑤ ;
⑥;⑦;⑧。
三、有关含硫物质性质或应用等的判断
第1页
第1页
14. 1 mol SO2与足量O2在一定条件下反应生成SO3,共转移2mol电子。29. 铜和浓硫酸反应后的试管中与白色固体生成,加水后溶液呈蓝色。
15. 燃煤中加入CaO可以减少酸雨的形成。30. 检查肠胃用作“钡餐”的是BaSO4。
