第2讲物质的分离和提纯
第2讲物质的分离和提纯
1.物质分离与提纯的区别
(1)物质的分离
将混合物的各组分分离开来,获得几种纯净物的过程。
(2)物质的提纯
将混合物中的杂质除去而得到纯净物的过程,又叫物质的净化或除杂。
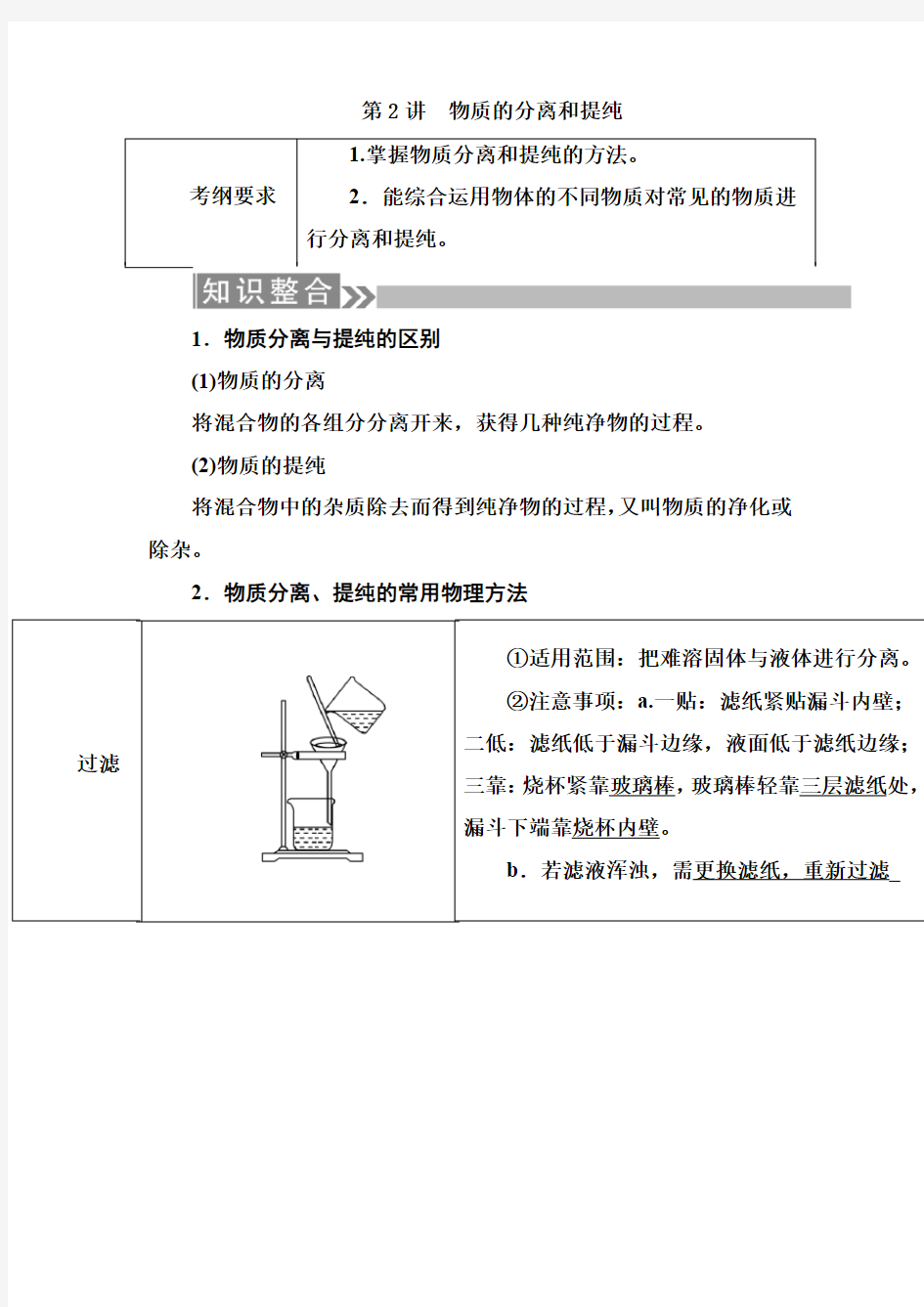
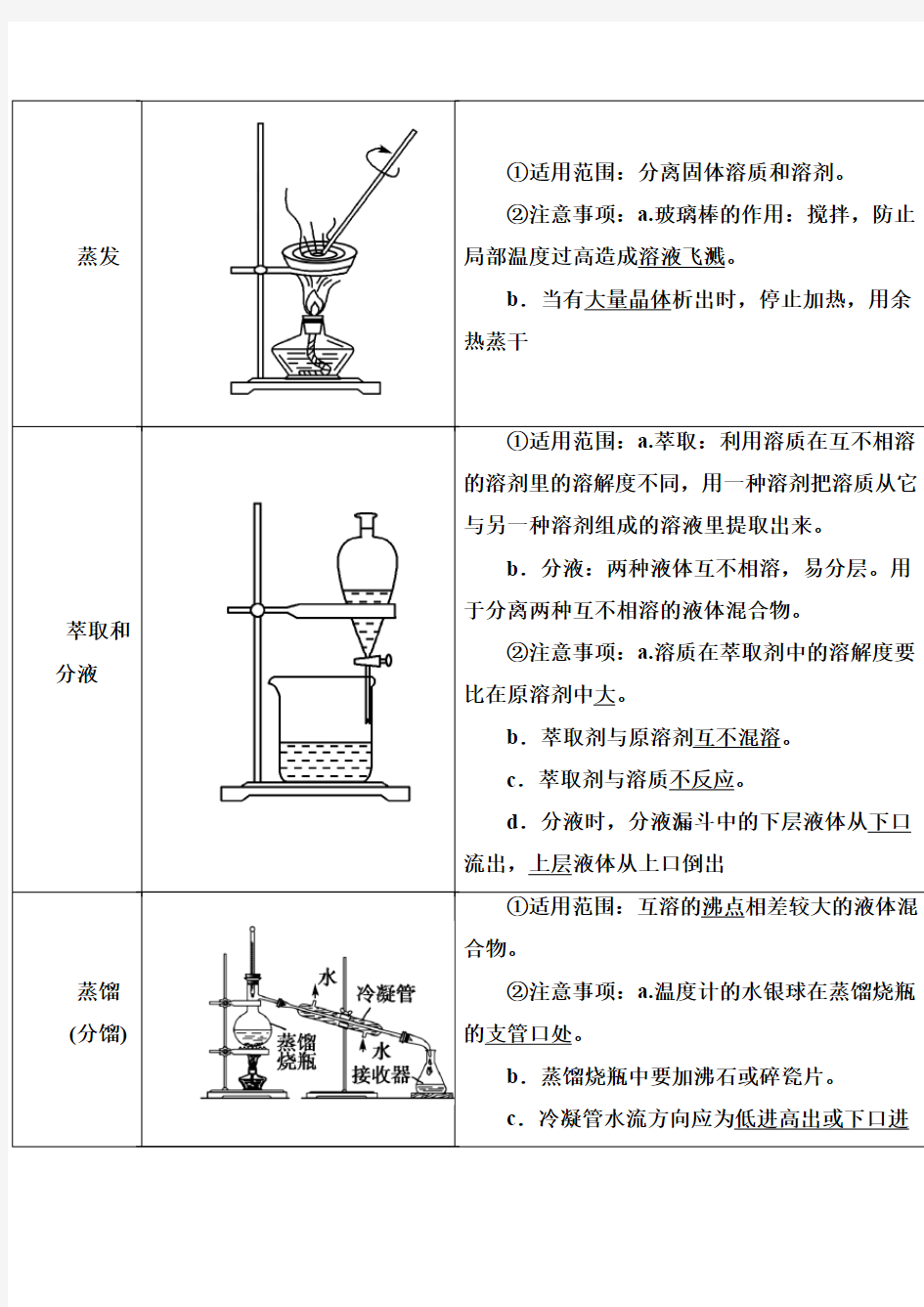
2.物质分离、提纯的常用物理方法
1.物质的分离与提纯有何不同?
提示:分离要求各物质都要保留,只是分离开来;提纯则只保留主要物质,杂质除去不要。
2.过滤和蒸发、分液和蒸馏两组分离方法的特点分别是什么?
提示:过滤和蒸发都是分离固体和液体的,前者是不溶性固体,后者是可溶性固体;分液和蒸馏是分离液体与液体的,前者不溶,后
者混溶。
根据物质的状态选择恰当的分离方法
(1)“固+固”混合物的分离(提纯)
(2)“固+液”混合物的分离(提纯)
(3)“液+液”混合物的分离(提纯)
考向一物质分离、提纯方法的选择
1.按以下实验方案可从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。
下列说法错误的是()
A.步骤(1)需要过滤装置
B.步骤(2)需要用到分液漏斗
C.步骤(3)需要用到坩埚
D.步骤(4)需要蒸馏装置
解析:滤液与不溶物是用过滤的方法分离的,A项正确;分离水层与有机层,需要用分液漏斗,B项正确;溶液蒸发结晶应用蒸发皿,C项错误;用蒸馏的方法从有机层溶液中蒸出甲苯,D项正确。
答案:C
2.下列实验中,所采取的分离方法与对应原理都正确的是()
互溶,不能用分液的方法分离,B错误;除去硝酸钾中的氯化钠可用重结晶的方法,是由于氯化钠在水中的溶解度受温度变化的影响较小,故C错误;乙醚和丁醇互溶,但沸点相差较大,可用蒸馏的方法进行分离,D正确。
答案:D
考向二对分离、提纯操作的考查
3.下列实验操作中错误的是()
A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B.蒸馏操作时.应使温度计水银球靠近蒸馏烧瓶的支管口处
C.蒸馏中,冷却水应从冷凝管的下口通入,上口流出
D.蒸发操作时,应使混合物中的水分完全蒸干后,再停止加热答案:D
4.海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图:
(1)实验室焙烧海带,需要下列仪器中的________(填字母)。
a.试管b.烧杯c.坩埚d.泥三角e.三脚架f.酒精灯
(2)指出提取碘的过程中有关的实验操作名称:①________,
③________。
(3)提取碘的过程中,可选择的有机试剂是______(填字母)。
A.甲苯、酒精B.四氯化碳、苯
C.汽油、乙酸D.汽油、甘油
(4)为使海藻灰中碘离子转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有______、______。
(5)小组用CCl4萃取碘水中的碘,在右图的分液漏斗中,下层液体呈________色;他们打开分液漏斗活塞,却未见液体流下,原因可能是_________________________________________。
(6)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出下面实验装置图中的错误之处:
①___________________________________________________;
②___________________________________________________;
③___________________________________________________。
(7)进行上述蒸馏操作时,使用水浴加热的原因是__________________________________________________________ _______________________________________________________ _________________,最后晶体碘在________里聚集。
解析:海带要在坩埚中焙烧,选择萃取剂要与水互不相溶。蒸馏操作时注意冷凝水的方向,加热烧杯要垫石棉网。
答案:(1)cdef(2)过滤萃取分液(3)B
(4)分液漏斗普通漏斗
(5)紫红分液漏斗上口活塞小孔未与空气相通
(6)①缺石棉网②温度计插到了液体中③冷凝管进出水的方向颠倒
(7)使蒸馏烧瓶受热均匀,控制加热温度不至过高蒸馏烧瓶
考点二物质分离、提纯的化学方法
物质分离、提纯的化学方法
1.用过量氨水除去Al3+溶液中的Fe3+是否可行,为什么?
提示:不可行,因为生成的Al(OH)3不溶于过量氨水,无法与Fe(OH)3分离。
2.除去乙醇中少量H2O,如何操作?
提示:先加入生石灰与H2O反应生成Ca(OH)2,然后蒸馏,得到纯净的乙醇。
分离和提纯物质应遵循的原则
(1)不引入新杂质的原则。如果引入杂质则在后续操作中必须除
去。
(2)不损耗、不减少被提纯物质的原则。
(3)实验操作要简便易行的原则。
1.下列实验操作正确的是()
A.向混有少量乙酸的乙酸乙酯中加入过量饱和碳酸钠溶液,振荡静置,用装置甲分液,放出水相后再从分液漏斗下口放出有机相B.用装置乙加热分解法除去Na2CO3中混有的少量NaHCO3
C.用装置丙除去氯气中的HCl气体
D.除去Cu粉中混有的CuO:加适量稀硫酸后,过滤、洗涤答案:D
2.下列除杂方案错误的是()
3.除去下列混合物中少量的杂质(括号内的物质为杂质)所选试剂、主要仪器及操作方法都合理的是()
KMnO4溶液将C2H4氧化为CO2,会引入新的杂质,应选择溴水;D 项中操作方法应为萃取、分液。
答案:B
1.(2017·高考全国卷Ⅰ)《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是()
A.蒸馏B.升华
C.干馏D.萃取
解析:“将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结……”,属于固体直接转化为气体,类似于碘的升华,因此涉及的操作方法是升华,故选B。
答案:B
2.(2016·高考北京卷)下列中草药煎制步骤中,属于过滤操作的是()
热,故错误;C.箅渣取液属于过滤操作,故正确;D.灌装是液体转移,故错误。
答案:C
3.(2016·高考全国卷Ⅲ)过氧化钙微溶于水,溶于酸,可用作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。回答下列问题:
(一)碳酸钙的制备
(1)步骤①加入氨水的目的是________。小火煮沸的作用是使沉淀颗粒长大,有利于________。
(2)右图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。
a .漏斗末端颈尖未紧靠烧杯壁
b .玻璃棒用作引流
c .将滤纸湿润,使其紧贴漏斗壁
d .滤纸边缘高出漏斗
e .用玻璃棒在漏斗中轻轻搅动以加快过滤速度 (二)过氧化钙的制备
CaCO 3――――――→稀盐酸、煮沸、过滤②滤液――――→氨水和双氧水冰浴③ ――→过滤
白色结晶
(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈____性(填“酸”、“碱”或“中”)。将溶液煮沸,趁热过滤。将溶液煮沸的作用是________________。
(4)步骤③中反应的化学方程式为________,该反应需要在冰浴下进行,原因是________________。
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是____________。
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是________,产品的缺点是________。
解析:(1)反应中盐酸过量,且溶液中含有铁离子,因此步骤①加入氨水的目的是中和多余的盐酸,沉淀铁离子;小火煮沸的作用是使沉淀颗粒长大,有利于过滤。
(2)a.过滤时漏斗末端颈尖应该紧靠烧杯内壁,a错误;b.玻璃棒用作引流,b正确;c.将滤纸湿润,使其紧贴漏斗壁,防止有气泡,c 正确,d.滤纸边缘应该低于漏斗,d错误;e.用玻璃棒在漏斗中轻轻搅动容易弄碎滤纸,e错误,答案选ade。
(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,溶液中有二氧化碳生成,因此溶液呈酸性。溶液含有二氧化碳,而过氧化钙能与酸反应,因此将溶液煮沸的作用是除去溶液中溶解的CO2。
(4)根据原子守恒可知反应中还有氯化铵和水生成,则步骤③中反应的化学方程式为CaCl2+2NH3·H2O+H2O2===CaO2↓+2NH4Cl+2H2O;双氧水不稳定,受热易分解,因此该反应需要在冰浴下进行的原因是防止过氧化氢分解。
(5)过氧化钙在乙醇中的溶解度小,使用乙醇洗涤的目的是去除结晶表面的水分。
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入
双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是原料来源丰富、操作简单,产品的缺点是得到产品的纯度较低。
答案:(1)调节溶液pH使Fe(OH)3沉淀过滤分离(2)ade(3)酸除去溶液中溶解的CO2
(4)CaCl2+2NH3·H2O+H2O2===CaO2↓+2NH4Cl+2H2O温度过高时过氧化氢分解
(5)去除结晶表面水分
(6)工艺简单、操作简单纯度较低
4.研究物质的性质时,首先要分离提纯物质,对物质进行分离提纯是化学实验的重要内容。
Ⅰ.现需要纯净的氯化钠溶液,但实验室中只有混有硫酸钠、碳酸氢铵的氯化钠固体。某同学设计了一个除去杂质获得纯净氯化钠溶液的实验方案:
(1)操作①中发生反应的化学方程式是_____________________
_______________________________________________________ __。
(2)操作②中BaCl2溶液能否改用硝酸钡溶液________(填“能”或“不能”)。如果能,下一空不需要回答;如果不能,请说明理由:__________________________________________________ _______________________________________________________ ___
_________________________________________________________。
(3)操作③的目的是____________________________________ _________________________________________________________。
(4)操作④的目的是___________________________________。 Ⅱ.为提纯某Fe 2O 3样品(主要杂质有SiO 2、Al 2O 3)参照上述实验操作,请设计一种以框图形式表示的实验方案(注明物质和操作)。
解析:Ⅰ.NH 4HCO 3可通过加热分解而除去;Na 2SO 4中的SO 2-
4
可通过加入BaCl 2溶液除去。Ba(NO 3)2会引入NO -3杂质。操作③加过量Na 2CO 3除去过量的Ba 2+;加热煮沸除去滤液中溶解的CO 2和HCl 。Ⅱ.Fe 2O 3是碱性氧化物,SiO 2是酸性氧化物,Al 2O 3是两性氧化物,可据此选择试剂。
答案:Ⅰ.(1)NH 4HCO 3=====△
NH 3↑+CO 2↑+H 2O (2)不能 选用Ba(NO 3)2溶液会引入新的杂质离子NO -3 (3)除去过量的Ba 2+
(4)除去溶解在溶液中的CO 2气体和HCl Ⅱ.
