病毒载体

基因导入系统(gene delivery system)是基因治疗的核心技术,可分为病毒载体系统和非病毒载体系统。本章主要论述用于人类基因治疗的病毒载体系统。
用于基因治疗的病毒载体应具备以下基本条件:
1、携带外源基因并能包装成病毒颗粒;
2、介导外源基因的转移和表达;
3、对机体不致病。
然而,大多数野生型病毒对机体都具有致病性。因此需要对其进行改造后才能用于人体。原则上,各种类型的病毒都能被改造成病毒载体。但是由于病毒的多样性及与机体复杂的依存关系,人们至今对许多病毒的生活周期、分子生物学、与疾病发生及发展的关系等的认识还很不全面,从而限制了许多病毒发展成为具有实用性的载体。近20年来,只有少数几种病毒如反转录病毒(包括HIV病毒)、腺病毒、腺病毒伴随病毒、疱疹病毒(包括单纯疱疹病毒、痘苗病毒及EB病毒)、甲病毒等被成功地改造成为基因转移载体并开展了不同程度的应用。
第一节病毒载体产生的原理
病毒载体的产生建立在对病毒的生活周期和分子生物学认识的基础之上。研究病毒载体首先要对病毒的基因组结构和功能有充分的了解,最好能获得病毒基因组全序列信息。病毒基因组可分为编码区和非编码区。编码区基因产生病毒的结构蛋白和非结构蛋白;根据其对病毒感染性复制的影响,又可分为必需基因和非必需基因。非编码区中含有病毒进行复制和包装等功能所必需的顺式作用元件。
各种野生型病毒颗粒都具有一定的包装容量,即对所包装的病毒基因组的长度有一定的限制。一般来说,病毒包装容量不超过自身基因组大小的105~110%。
基因重组技术的发展使病毒载体的产生成为可能。最简单的做法是,将适当长度的外源DNA 插入病毒基因组的非必需区,包装成重组病毒颗粒。比如,本实验室曾将4.5kb的lacZ基因表达盒(CMV-lacZ-polyA)插入HSV1病毒的UL44(糖蛋白C)基因的XbaI位点中,病毒基因组的其余部分不改变,构建成重组病毒HSV1-lacZ100(吴小兵等,1998)。由于UL44基因产物对于HSV病毒在培养细胞中产毒性感染是非必需的,因此,该重组病毒可以在细胞中增殖传代。用这种重组病毒感染细胞,能将lacZ基因带入细胞并高效表达。用同样的方法,将AAV-2病毒的rep和cap基因片段(4.3kb)插入HSV1病毒的UL2(编码尿嘧啶DNA糖基化酶)或UL44(编码糖蛋白C)基因中,构建成具有提供重组AAV载体复制和包装所需的全部辅助功能的辅助病毒rHSV-rc(伍志坚等,1999)。
然而,这样的重组病毒作为基因转移载体有许多缺点。首先,许多野生型病毒通过在细胞中产毒性复制而导致细胞裂解死亡;或带有病毒癌基因而使细胞发生转化。因此必须经过改造使其成为复制缺陷性病毒并且删除致癌基因后才能用于基因治疗。其次,插入外源DNA的长度受到很大限制,尤其对于基因组本身较小的病毒如腺病毒伴随病毒(AAV,4.7kb)、反转录病毒(8~10kb)、腺病毒(36kb),如果不去除病毒基因,可供外源DNA插入的容量就十分小。因此,必须删除更多的病毒基因以腾出位置插入较大的外源DNA。为了增加病毒载体插入外源DNA的容量,除了可以删除病毒的非必需基因外,还可以进一步删去部分或全部必需基因,这些必需基因的功能由辅助病毒或包装细胞系反式提供。
病毒载体大体上可分为两种类型:
重组型病毒载体:这类载体是以完整的病毒基因组为改造对象。一般的步骤是选择性地删除病毒的某些必需基因尤其是立早基因或早期基因,或控制其表达;缺失的必需基因的功能由互补细胞反式提供;用外源基因表达单位替代病毒非必需基因区;病毒复制和包装所需的顺式作用元件不变。这类载体一般通过同源重组方法将外源基因表达单位插入病毒基因组中。
如在传统的重组腺病毒构建方法中,将外源基因表达盒(exogenous gene expression cassette)插入穿梭质粒(如pXCX2或pFGdX1)的腺病毒同源序列中,与辅助质粒(含有腺病毒基因组的质粒如JM17或pBHG)共转染293细胞,通过细胞内的同源重组获得含有外源基因的重组腺病毒(Graham FL and Prevec L1995)。
无病毒基因的病毒载体(gutless vectors):这类载体在不同的病毒载体系统中的称谓不同。对于腺病毒,一般称为mini-Ad;在HSV载体系统,一般称为扩增子(amplicon)载体或质粒型载体。重组AAV载体也属于无病毒基因的病毒载体。这类载体系统往往由载体质粒和辅助系统组成。重组载体质粒主要由外源基因表达盒、病毒复制和包装所必需的顺式作用元件及质粒骨架组成。辅助系统包括病毒复制和包装所必需的所有反式作用元件。在辅助系统的作用下,重组载体质粒(包含或不包含质粒骨架)以特定形式(单链或双链,DNA或RNA)被包装到病毒壳粒中,其中不含有任何病毒基因。这类病毒载体的优点在于载体病毒本身安全性好,容量大。缺点在于往往需要辅助病毒参与载体DNA的包装,而辅助病毒又难以同载体病毒分离开来,造成最终产品中辅助病毒污染,从而影响其应用。实际上,无病毒基因的病毒载体可以看作是重组病毒载体的一种极端减毒情况。
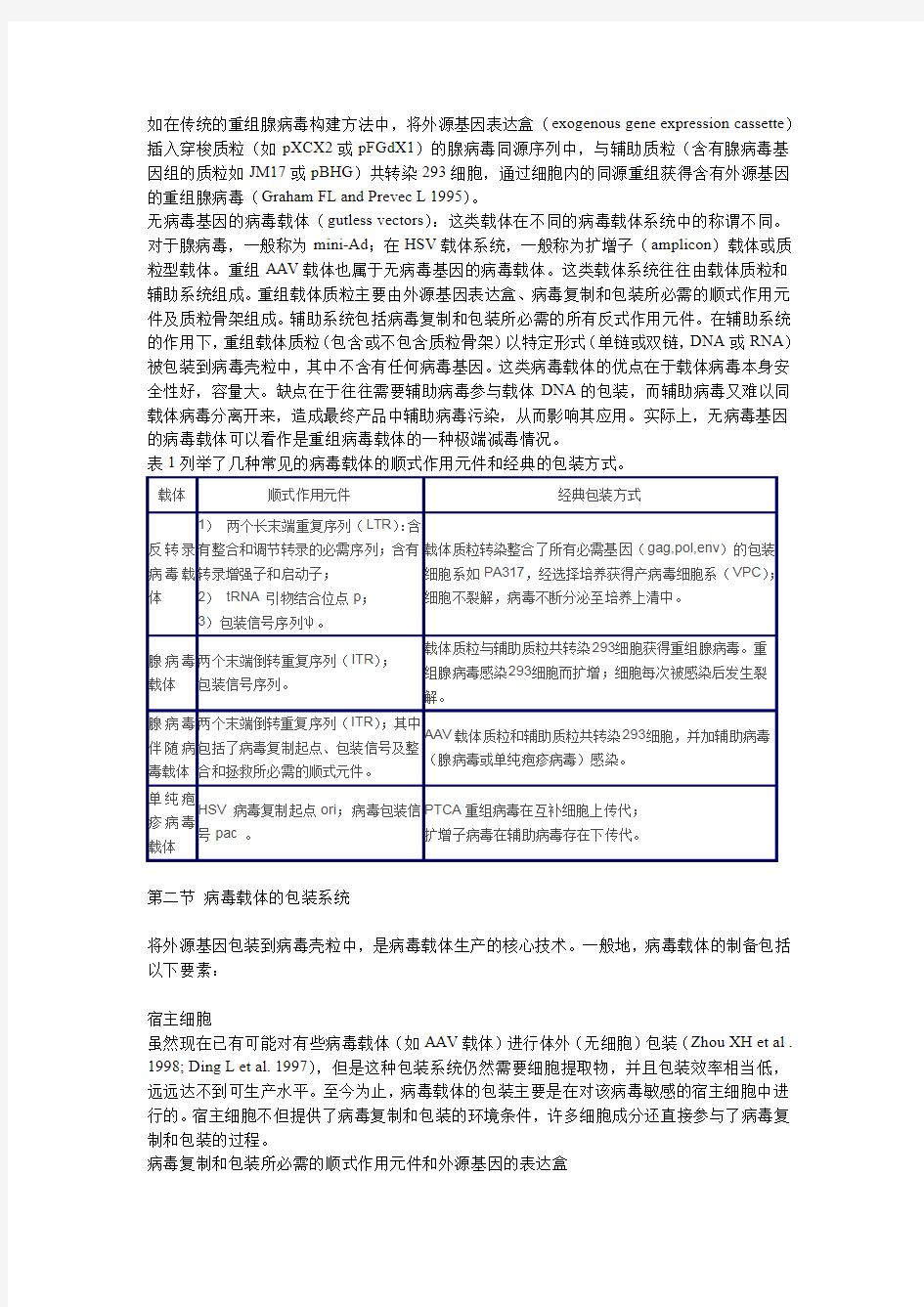
表1列举了几种常见的病毒载体的顺式作用元件和经典的包装方式。
载体顺式作用元件经典包装方式
反转录病毒载体1)两个长末端重复序列(LTR):含
有整合和调节转录的必需序列;含有
转录增强子和启动子;
2)tRNA引物结合位点p;
3)包装信号序列ψ。
载体质粒转染整合了所有必需基因(gag,pol,env)的包装
细胞系如PA317,经选择培养获得产病毒细胞系(VPC);
细胞不裂解,病毒不断分泌至培养上清中。
腺病毒载体两个末端倒转重复序列(ITR);
包装信号序列。
载体质粒与辅助质粒共转染293细胞获得重组腺病毒。重
组腺病毒感染293细胞而扩增;细胞每次被感染后发生裂
解。
腺病毒伴随病毒载体两个末端倒转重复序列(ITR);其中
包括了病毒复制起点、包装信号及整
合和拯救所必需的顺式元件。
AAV载体质粒和辅助质粒共转染293细胞,并加辅助病毒
(腺病毒或单纯疱疹病毒)感染。
单纯疱疹病毒载体HSV病毒复制起点ori;病毒包装信
号pac。
PTCA重组病毒在互补细胞上传代;
扩增子病毒在辅助病毒存在下传代。
第二节病毒载体的包装系统
将外源基因包装到病毒壳粒中,是病毒载体生产的核心技术。一般地,病毒载体的制备包括以下要素:
宿主细胞
虽然现在已有可能对有些病毒载体(如AAV载体)进行体外(无细胞)包装(Zhou XH et al. 1998;Ding L et al.1997),但是这种包装系统仍然需要细胞提取物,并且包装效率相当低,远远达不到可生产水平。至今为止,病毒载体的包装主要是在对该病毒敏感的宿主细胞中进行的。宿主细胞不但提供了病毒复制和包装的环境条件,许多细胞成分还直接参与了病毒复制和包装的过程。
病毒复制和包装所必需的顺式作用元件和外源基因的表达盒
一般地,病毒复制和包装所必需的顺式作用元件和外源基因的表达盒由细菌质粒携带,组成病毒载体质粒,是被包装的对象。由于病毒复制方式的不同,有些病毒载体如单纯疱疹病毒扩增子(HSV amplicon)载体在包装时,整个载体质粒都被包装进入病毒颗粒中;而有些病毒载体如反转录病毒、腺病毒伴随病毒载体的质粒骨架部分并不被包装到病毒颗粒中,只有病毒复制和包装所必需的顺式作用元件和外源基因表达盒被包装到病毒颗粒中。
构建重组型病毒载体时,病毒复制和包装所需的顺式作用元件存在于病毒基因组中(病毒基因组可以由具有感染性的病毒颗粒提供,也可以质粒形式提供)。先将外源基因表达盒插入穿梭质粒携带的病毒同源序列中;将重组穿梭质粒转染至细胞中,再用辅助病毒超感染;或将重组穿梭质粒与病毒基因组质粒共转染细胞;重组质粒与病毒基因组在细胞中进行同源重组而产生表达外源基因的重组病毒。重组腺病毒(Graham FL and Prevec L1995)和重组单纯疱疹病毒(Pyles RB et al.1997;Kramm CM et al.1997)的传统制备方法都是采用这种方式。
为了使病毒载体的生产更为方便,病毒复制和包装所必需的顺式作用元件和外源基因的表达盒除了可以用质粒携带以外,也可以用另一种病毒(往往是辅助病毒)或生产细胞来携带。
辅助元件
包括病毒复制和包装所必需的所有反式作用元件。这些元件一般包括病毒基因转录调控基因、病毒DNA合成和包装所需的各种酶类的基因、病毒的外壳蛋白基因等。辅助元件的表现形式可以多种多样。常用的形式有:
①辅助质粒(helper plasmid),如用于产生重组腺病毒的质粒JM17,用于重组AAV包装的辅助质粒pAAV/Ad(Rolling F and Samulski J1995)等;
②辅助病毒(helper virus),如用于HSV扩增子载体包装的辅助病毒HSV1tsK株;
③包装细胞系如用于反转录病毒载体包装的PA317细胞。
这些表现形式之间可以相互转化或合并。例如,辅助病毒可以转化为辅助质粒:传统的AA V 载体生产系统常用腺病毒作为辅助病毒。研究发现,并非腺病毒的所有基因对AAV病毒的产生都是必需的,只需要腺病毒E1a,E1b,E2a,E4和VA RNA5种基因就行了。因此,将这5种基因置于同一个质粒中,构建成的这种新的辅助质粒就完全可以替代原来的辅助病毒(Xiao X et al.1998;Grimm D et al.1998),不但提高了包装效率,而且避免了产品中腺病毒污染的问题。
上述几种要素的不同组合,便产生了各种各样的病毒载体包装策略。根据病毒载体生产系统的组成因素的多少,可将其分成以下几种:
单组成因素生产系统(one-component system):
所有的组成成分都集中在生产细胞中。经典的反转录病毒生产系统就是由产病毒细胞(VPC)组成,重组反转录病毒由VPC细胞不断分泌至培养上清中。这种生产系统操作最为简单,但是往往产量不高或不稳定。采用这种策略,需要将重组病毒产生所需要的所有元件都稳定地置于生产细胞中。由于许多病毒基因产物本身对细胞有破坏作用或不能在细胞中稳定表达,因此这种策略在许多病毒载体的生产中难以实施。
双组成因素生产系统(two-component system)
这种生产系统一般由"一株病毒/一株细胞"组成。典型的例子是重组腺病毒生产系统。先用共转染的方法获得重组腺病毒毒种,再由该毒种和生产细胞(如293细胞)组成一个双组成因素的生产系统使病毒大量扩增。
多组成因素生产系统(multi-component system)
是由两种以上的组成因素组成的生产系统。传统的AAV载体生产系统就是由载体质粒,辅助质粒,辅助病毒和生产细胞4种因素组成。这种策略的缺点是影响因素多,操作复杂,产量不容易稳定,不利于大规模生产。以上各种生产系统也可以相互转化。我们实验室通过将上述AAV载体生产系统的4种因素进行两两合并,即将辅助质粒和辅助病毒合并成一种重组的辅助病毒,将载体质粒和生产细胞合并成AAV前病毒细胞株,成功地将其转化成一种双组成因素的新型高效生产系统(伍志坚等,1999)。
一般来说,发展新的包装策略主要是为了以下几种目的:
(1)减少生产系统中的组成因素,简化操作过程;
(2)提高生产效率,降低生产成本;
(3)避免或降低野生型病毒的产生;
(4)避免使用难以与产品病毒分离的辅助病毒。
病毒学试题(回忆版)
一、名词解释: 1. spike 2. DI(defective interfering) 3. Replication intermediate (RI) 4. Plague(噬斑) 5. PFU(噬斑形成单位)、CPE(细胞病变)、隐蔽期 6、信息体(informosome) 7、温度敏感性变异株连 8、抗原漂移与抗原转变 9 准种10、互补11、细胞原癌基因12、干扰素 13、Ribozyme 14、DNA疫苗15单克隆抗体 16法氏囊,网状内皮组织增殖症等(传染病英文翻译成中文) 二、简答题: 1、慢病毒感染的概念及原因(两个方面即病毒方面与机体方面) 2、病毒载体活疫苗的概念并举例说明病毒载体构建的技术路线 3、亚病毒的分类及其定义 4、病毒的特性及其疫苗的研究进展(病毒学) 5、病毒的吸附和侵入过程(分两步)(病毒学) 6、请设计试验方案,如何证明某一种病毒的核酸具有感染性(病毒学) 7、简述病毒对细胞的损害作用方式(病毒学) 8、叙述新病毒出现的机制(病毒学) 9、叙述反转录病毒的复制步骤(病毒学) 10、有几个是写出病毒的英文名称让写出分别属哪科、哪属(不常见的几个) 11、如果一牛场发生布氏杆菌,请制定免疫计划(传染病)? 12、假如发生烈性传染病如何做?(传染病) 三、论述题
1、详细叙述禽流感病毒的基因组结构,并写出每段基因组所编码的蛋白及其每 种蛋白的功能(病毒学) 2、详细叙述SARS病毒与禽流感病毒在分子水平上的异同(传染病)。 2003年农科院考博题 动物病毒学 一、名词解释 1 DI 2 Antigentic drift 3 感染性cDNA 4 核酸疫苗 5 PFU 6 Ribozyme 7 LTR 8 温度敏感突变株 9 envelope 10 准种 二、简答题 1 类病毒与朊病毒的区别。 2 鉴定新城疫病毒毒力的依据。 3 病毒血凝、血凝抑制作用及血吸附机理。 4 写出下列各科病毒的一种病毒 Herpesviridae, Adenoviridae, Coronaviridae, Rhabdoviridae, Orthomyxoviridae 5 黄病毒科有几个属,各写出一个病毒。 6 OIE高致病力禽流感病毒的特征。 7 J亚群白血病病毒的致病特点。 三、问答题 1 动物病毒的分离与鉴定过程。 2 以某动物病毒为例,论述研究病毒的分子致病机理的技术路线。 传染病试题可能与中国农大相同 2003年中国农业大学考博试题 微生物试题 1 名词解释: prion 感染性核酸回复突变CTL MAC 合胞体溶原化重组抗体cytokine 2 简答: 缺损病毒微RNA病毒属共有几个科,各种的代表病毒 动脉炎病毒属蛋白特性内源性抗原 胞内菌相关的细胞内免疫抗体产生的动力学 3 论述 阻断ELISA的原理,技术路线,操作,判定 分子生物学诊断技术 外源性抗原的加工过程 2003传染病试题 1 进口动物时应如何做 2 鸡呼吸道疾病的区别 3 子猪肠道疾病的病变 4 非典型猪瘟的控制 5 猪伪狂犬病的种猪场净化 6 从传染病流行的三因素,论述防治措施
慢病毒转染手册
慢病毒(Lentivirus)载体是以HIV-1(人类免疫缺陷I型病毒)为基础发展起来的基因治疗载体。区别一般的逆转录病毒载体,它对分裂细胞和非分裂细胞均具有感染能力。 基本概述 慢病毒载体的研究发展得很快,研究的也非常深入。该载体可以将外源基因有效地整合到宿主染色体上,从而达到持久性表达。在感染能力方面可有效地感染神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种类型的细胞,从而达到良好的的基因治疗效果,在美国已经开展了临床研究,效果非常理想,因此具有广阔的应用前景。 慢病毒的应用 目前慢病毒也被广泛地应用于表达RNAi的研究中。由于有些类型细胞脂质体转染效果差,转移到细胞内的siRNA半衰期短,体外合成siRNA对基因表达的抑制作用通常是短暂的,因而使其应用受到较大的限制。采用事先在体外构建能够表达siRNA的载体, 然后转移到细胞内转录siRNA的策略,不但使脂质体有效转染的细胞种类增加,而且对基因表达抑制效果也不逊色于体外合成siRNA,在长期稳定表达载体的细胞中,甚至可以发挥长期阻断基因表达的作用。在所构建的siRNA表达载体中,是由RNA聚合酶Ⅲ启动子来指导RNA合成的,这是因为RNA聚合酶Ⅲ有明确的起始和终止序列,而且合成的RNA不会带poly A尾。当RNA聚合酶Ⅲ遇到连续4个或5个T时,它指导的转录就会停止,在转录产物3’端形成1~4个U。U6和H1 RNA启动子是两种RNA聚合酶Ⅲ依赖的启动子,其特点是启动子自身元素均位于转录区的上游,适合于表达~21ntRNA和~50ntRNA茎环结构(stem loop)。在siRNA表达载体中,构成siRNA的正义与反义链,可由各自的启动子分别转录,然后两条链互补结合形成siRNA;也可由载体直接表达小发卡状RNA(small hairpin RNA, shRNA), 载体包含位于RNA聚合酶Ⅲ启动子和4~5T转录终止位点之间的茎环结构序列,转录后即可折叠成具有1~4 个U 3 ’ 突出端的茎环结构,在细胞内进一步加工成siRNA。构建载体前通常要通过合成siRNA的方法,寻找高效的siRNA,然后从中挑选符合载体要求的序列,将其引入siRNA表达载体。 慢病毒载体 慢病毒载体(Lentiviral vector)较逆转录病毒载体有更广的宿主范围,慢病毒能够有效感染非周期性和有丝分裂后的细胞。慢病毒载体能够产生表达shRNA的高滴度的慢病毒,在周期性和非周期性细胞、干细胞、受精卵以及分化的后代细胞中表达shRNA,实现在多种类型的细胞和转基因
病毒载体概述
病毒载体概述 引言 基因导入系统(gene delivery system)就是基因治疗的核心技术,可分为病毒载体系统与非病毒载体系统。本章主要论述用于人类基因治疗的病毒载体系统。 用于基因治疗的病毒载体应具备以下基本条件: 1、携带外源基因并能包装成病毒颗粒; 2、介导外源基因的转移与表达; 3、对机体不致病。 然而,大多数野生型病毒对机体都具有致病性。因此需要对其进行改造后才能用于人体。原则上,各种类型的病毒都能被改造成病毒载体。但就是由于病毒的多样性及与机体复杂的依存关系,人们至今对许多病毒的生活周期、分子生物学、与疾病发生及发展的关系等的认识还很不全面,从而限制了许多病毒发展成为具有实用性的载体。近20年来,只有少数几种病毒如反转录病毒(包括HIV病毒)、腺病毒、腺病毒伴随病毒、疱疹病毒(包括单纯疱疹病毒、痘苗病毒及EB病毒)、甲病毒等被成功地改造成为基因转移载体并开展了不同程度的应用。 第一节病毒载体产生的原理 病毒载体的产生建立在对病毒的生活周期与分子生物学认识的基础之上。研究病毒载体首先要对病毒的基因组结构与功能有充分的了解,最好能获得病毒基因组全序列信息。病毒基因组可分为编码区与非编码区。编码区基因产生病毒的结构蛋白与非结构蛋白;根据其对病毒感染性复制的影响,又可分为必需基因与非必需基因。非编码区中含有病毒进行复制与包装等功能所必需的顺式作用元件。 各种野生型病毒颗粒都具有一定的包装容量,即对所包装的病毒基因组的长度有一定的限制。一般来说,病毒包装容量不超过自身基因组大小的105~110%。
基因重组技术的发展使病毒载体的产生成为可能。最简单的做法就是,将适当长度的外源DNA插入病毒基因组的非必需区,包装成重组病毒颗粒。比如,本实验室曾将4、5kb的lacZ基因表达盒 (CMV-lacZ-polyA)插入HSV1病毒的UL44(糖蛋白C)基因的XbaI位点中,病毒基因组的其余部分不改变,构建成重组病毒HSV1-lacZ100(吴小兵等,1998)。由于UL44基因产物对于HSV病毒在培养细胞中产毒性感染就是非必需的,因此,该重组病毒可以在细胞中增殖传代。用这种重组病毒感染细胞,能将lacZ基因带入细胞并高效表达。用同样的方法,将AAV-2病毒的rep与cap基因片段(4、3kb)插入HSV1病毒的UL2(编码尿嘧啶DNA糖基化酶)或UL44(编码糖蛋白C)基因中,构建成具有提供重组AAV载体复制与包装所需的全部辅助功能的辅助病毒rHSV-rc(伍志坚等,1999)。 然而,这样的重组病毒作为基因转移载体有许多缺点。首先,许多野生型病毒通过在细胞中产毒性复制而导致细胞裂解死亡;或带有病毒癌基因而使细胞发生转化。因此必须经过改造使其成为复制缺陷性病毒并且删除致癌基因后才能用于基因治疗。其次,插入外源DNA的长度受到很大限制,尤其对于基因组本身较小的病毒如腺病毒伴随病毒(AAV,4、7kb)、反转录病毒(8~10kb)、腺病毒(36kb),如果不去除病毒基因,可供外源DNA插入的容量就十分小。因此,必须删除更多的病毒基因以腾出位置插入较大的外源DNA。为了增加病毒载体插入外源DNA的容量,除了可以删除病毒的非必需基因外,还可以进一步删去部分或全部必需基因,这些必需基因的功能由辅助病毒或包装细胞系反式提供。 病毒载体大体上可分为两种类型: 重组型病毒载体:这类载体就是以完整的病毒基因组为改造对象。一般的步骤就是选择性地删除病毒的某些必需基因尤其就是立早基因或早期基因,或控制其表达;缺失的必需基因的功能由互补细胞反式提供;用外源基因表达单位替代病毒非必需基因区;病毒复制与包装所需的顺式作用元件不变。这类载体一般通过同源重组方法将外源基因表达单位插入病毒基因组中。如在传统的重组腺病毒构建方法中,将外源基因表达盒(exogenous gene expression cassette)插入穿梭质粒(如pXCX2或pFGdX1)的腺病毒同源序列中,与辅助
腺病毒中文操作手册
腺病毒载体操作手册中文版 腺病毒重组系统 AdEasyTM操作手册 目录 第一章简介 1 第二章应用重组腺病毒的优点 2 第三章 AdEasyTM 技术 3 3.1 技术概况 3 3.2 AdEasyTM系统中产生重组腺病毒的时程 3 第四章主要流程 4 4.1 将基因克隆入AdEasyTM转移载体4 4.1.1 克隆的一般原则 4 4.1.2 构建重组AdEasyTM转移载体 5 4.2 细菌内AdEasyTM重组子的产生 5 4.2.1 共转化的一般原则 5 4.2.2 共转化方法 5 4.2.3 预期结果 5 4.3 AdEasyTM重组质粒的筛选和扩增6 4.4 AdEasyTM重组子转染QBI-293A 细胞 6 4.4.1 细胞铺板 6 4.4.2 磷酸钙转化技术 7 第五章常用技术 8 5.1 QBI-293A细胞培养 8 5.1.1 QBI-293A细胞的初始培养8 5.1.2 QBI-293A细胞的维持培养和增殖 8 5.1.3 QBI-293A细胞的冻存 8 5.2 QBI-293A细胞的转染和病毒空斑的产生 9 5.2.1 感染QBI-293A细胞 9 5.2.2 病毒空斑形成 9 5.2.3 琼脂糖覆盖被感染细胞 9 5.3 MOI测定 10 5.4 腺病毒感染力测定 10
5.4.1 X-Gal染色 11 5.5 重组腺病毒的筛选和纯化 11 5.5.1 挑选最佳重组腺病毒:表达和基因输送 11 5.5.2 病毒空斑挑选和小量扩增12 5.5.3 Western杂交 13 5.5.4 Southern杂交和点杂交 13 5.5.5 病毒裂解产物PCR 14 5.5.6 免疫测定 14 5.5.7 功能测定 14 5.6 病毒颗粒在QBI-293A细胞中的大量扩增 15 5.7 两次氯化铯密度梯度离心纯化重组腺病毒 16 5.7.1 不连续密度梯度离心 17 5.7.2 连续密度梯度离心 17 5.7.3 病毒溶液去盐和浓集 17 5.8 病毒滴度测定 18 5.8.1 O.D.260 nm (VP/ml) 19 5.8.2 空斑测定法 20 5.8.3 50%组织培养感染剂量法 20 第六章疑难解答 22 6.1 QBI-293A细胞培养 22 6.2 感染力测定 22 6.3 转移载体克隆 23 6.4 在BJ5183细胞中共转化和重组24 6.5 转染QBI-293A细胞 25 6.6 筛选和测定 25 6.7 在QBI-293A细胞中表达 26 6.8 重组腺病毒的扩增 26 6.9 纯化 26 6.10 病毒滴度测定 27 缩写英文全称中文全称 Ad Adenovirus 腺病毒 Ad5 Adenovirus serotype 5 血清5型腺病毒 AdV Adenoviral Vector 腺病毒载体Amp Ampicillin 氨苄青霉素 β-Gal β-Galactosidase β-半乳糖苷酶 bp Base Pair 碱基对
植物病毒载体
植物病毒载体的类型及应用 摘要:植物病毒载体可分为5种类型,烟草花叶病毒载体是最常用植物病毒载体。植物病毒载体应用广泛,有诸多优点,也存在一些问题。本文对植物病毒载体进行综述。 关键词:植物病毒载体;类型;烟草花叶病毒载体;应用 The Types and Application of Plant Virus Vectors Abstract: Plant virus vectors can be divided into five types. Tobacco Mosaic Virus vector is the most commonly used plant virus vector. Plant viral vectors are widely used. They have many advantages,as well as some problems. This article provides an overview of plant virus vectors. Key words: plant virus vectors; type; Tobacco Mosaic Virus vector;application DNA 体外重组是基因工程技术的重要步骤之一,它是将外源目的基因与适当的载体相连。要把一个目的基因通过基因工程手段送进生物细胞中,需要运载工具,这个携带目的基因进入受体细胞中的工具就称为载体(V ector)。载体有很多种,病毒载体是其中的一种。病毒载体是利用病毒的基因组序列元件构建的真核基因转录工具[1]。植物病毒载体的研究开展得较晚,1984 年才诞生了第一例由植物DNA病毒——花椰菜花叶病毒(Califlower mosic virus,CaMV)构建的载体。但是植物病毒载体具有很多优点,例如短时间内可以生产大量成本低廉的外源蛋白,满足医药及工业用蛋白的需求。因此,1984年之后,人们尝试了多种植物病毒载体构建方法。目前已经构建了多种类型的植物病毒载体,已有用植物病毒载体pClYVV 表达了绿色荧光蛋白基因[2]、Nodulin gene基因、人的α-干扰素基因及小球状病毒抗原蛋白基因等的报告[3]。近年来也逐步利用植物病毒载体作为探针,用于研究植物和植物病原基因的表达调控、编码产物的功能以及植物与病原的相互作用。 一植物病毒载体的类型 植物病毒载体可分为置换型载体、插入型载体、互补型载体、抗原展示型载体和融合/释放型载体5 种。 1置换型载体 置换型载体是最原始的载体类型,由外源基因置换对植物病毒基因组复制影响不大的基因构建而成,一般用于转染原生质体进行瞬时表达以验证构建载体的可行性,较少接种于植株来系统地表达外源基因。CaMV 首先被用于构建置换型载体的研究。用外源基因置换CaMV 的基因Ⅱ(蚜传因子)后不影响其侵染性,成功地表达了细菌二氢叶酸还原酶(DHFR)和人α-D 干扰素基因[4],IFN-αD 的表达量可达到2μg/g(鲜叶)。 DEC 2012
慢病毒载体使用手册
LentiCRISPRv2 and lentiGuide-Puro: lentiviral CRISPR/Cas9 and single guide RNA CRISPR (C lustered R egularly I nterspaced S hort P alindromic R epeats) is a microbial nuclease system involved in defense against invading phages and plasmids. CRISPR loci in microbial hosts contain a combination of CRISPR-associated (Cas) genes as well as non-coding RNA elements capable of programming the specificity of the CRISPR-mediated nucleic acid cleavage. Lentiviral CRISPR/Cas can infect a broad variety of mammalian cells by co-expressing a mammalian codon-optimized Cas9 nuclease along with a single guide RNA (sgRNA) to facilitate genome editing (Shalem*, Sanjana*, et al., Science 2014). Protocols for cloning into the lentiviral transfer plasmid and general considerations for producing lentivirus are described below. Separate protocols are available for amplifying the genome-scale CRISPR knock-out (GeCKO) libraries. This protocol is for creating individual lentiviral CRISPR plasmids targeting a single genomic locus. lentiCRISPRv2 (one vector system): This plasmid contains two expression cassettes, hSpCas9 and the chimeric guide RNA. The vector can be digested using BsmB I, and a pair of annealed oligos can be cloned into the single guide RNA scaffold. The oligos are designed based on the target site sequence (20bp) and needs to be flanked on the 3' end by a 3bp NGG PAM sequence, as shown on the next page. lentiGuide-Puro (two vector system): This plasmid expressed only the chimeric guide RNA. It does not contain Cas9. Please use lentiCas9-Blast (a separate lentiviral construct that delivers hSpCas9 and blasticidin resistance) to first integrate Cas9 into your cell line. The lentiGuide-Puro vector can be digested using BsmB I, and a pair of annealed oligos can be cloned into the single guide RNA scaffold. The oligos are designed based on the target site sequence (20bp) and needs to be flanked on the 3' end by a 3bp NGG PAM sequence, as shown on the next page. Which vector to use: lentiCRISPRv2 is identical to the original lentiCRISPRv1 but produces nearly 10X higher titer virus. lentiGuide-Puro produces >100X higher titer virus over lentiCRISPRv1 and should be used in cell lines where Cas9 has already been integrated in (e.g. using the separate lentiCas9-Blast lentivirus). For applications where Cas9 cannot first be introduced (e.g. primary cells), lentiCRISPRv2 is recommended. After transduction, use puromycin to select for cells with lentiCRISPRv2 or lentiGuide-Puro. Lentiviral production: Before starting any lentiviral work, please ensure compliance with your Environmental Health and Safety office and government/organization/university. Briefly, to make lentivirus, a transfer plasmid (e.g. lentiCRISPRv2 or lentiGuide-Puro) must be co-transfected into HEK293(F)T cells with the packaging plasmids pVSVg (AddGene 8454) and psPAX2 (AddGene 12260). As a positive control for viral production, we often use a CMV-EGFP lentiviral transfer plasmid (eg. AddGene 19319). Target design notes and online resources: For application of Cas9 for site-specific genome editing in eukaryotic cells and organisms, we have computationally identified suitable target sites for the S. pyogenes Cas9 and calculated most likely off-targets within the genome. Please visit https://www.360docs.net/doc/5e9262591.html, to access these Cas9 target design tools. Complete plasmid sequences, protocols, a discussion forum and additional information can be found at the Zhang Lab GeCKO website: https://www.360docs.net/doc/5e9262591.html,/gecko/ . Citation: Please reference the following publications for the use of this material. Improved lentiviral vectors and genome-wide libraries for CRISPR screening. Sanjana NE*, Shalem O*, Zhang F. Nature Methods (2014). Genome-scale CRISPR-Cas9 knockout screening in human cells. Shalem O*, Sanjana NE*, Hartenian E, Shi X, Scott DA, Mikkelsen T, Heckl D, Ebert BL, Root DE, Doench JG, Zhang F (2014). Science, 343, 83-7. DOI: 10.1126/science.1247005
腺病毒中文操作手册
腺病毒载体操作手册中文版腺病毒重组系统 AdEasyTM操作手册 目录 第一章简介1 第二章应用重组腺病毒的优点2 第三章AdEasyTM技术3 3.1技术概况3 3.2AdEasyTM系统中产生重组腺病毒的时程3 第四章主要流程4 4.1将基因克隆入AdEasyTM转移载体4 4.1.1 缩写英文全称中文全称 AdAdenovirus腺病毒 Ad5Adenovirusserotype5血清5型腺病毒AdVAdenoviralVector腺病毒载体 AmpAmpicillin氨苄青霉素 β-Galβ-Galactosidaseβ-半乳糖苷酶 bpBasePair碱基对 BSABovineSerumAlbumin小牛血清白蛋白cDNAComplementaryDNA互补DNA cccDNAClosedCircularCoiledDNA闭环螺旋DNA CPECytopathicEffect细胞病理效应CsClCesiumChloride氯化铯 DMEMDulbecco’sModifiedEagleMediumDMEM培养基DMSODimethylSulfoxide二甲基亚砜DTTDithiothreitol二硫苏糖醇EDTAEthyleneDiamineTetraaceticAcid乙二胺四乙酸EtBrEthidiumBromide溴化乙锭FBSFetalBovineSerum胎牛血清 HrHour小时 ITRInvertedTerminalRepeat反向末端重复KanKanamycin卡那霉素 kbKilobases千碱基对 KDaKiloDaltons千道尔顿LBLuria-Bertani(broth)LB培养基MCSMultipleCloningSite多克隆位点 MinMinute分钟 MOIMultiplicityofInfection(Virus/Cell)感染复数mRNAMessengerRNA信使RNA MWCOMOIecularWeightCut-off PAGEPolyAcrylamideGelElectrophoresis聚丙烯凝胶电泳PBSPhosphateBufferedSaline磷酸盐缓冲液PFUPlaqueFormingUnit空斑形成单位 piPostInfection感染后RCAReplicationCompetentAdenovirus增殖性腺病毒RITRRightInvertedTerminalRepeat右侧反向末端重复SDSSodiumDodecylSulfate十二烷基硫酸钠TBETrisBorate/EDTA三羟甲基氨基甲烷硼酸盐/乙二胺四乙酸 TCID50TissueCultureInfectiousDose5050%组织培养感染剂量 TCPTotalCellularProtein细胞总蛋白 TETris/EDTATE溶液 wtWildType野生型 X-Gal5-bromo-4-chloro-3-indolyl-D-Galactopyranoside5-溴-4-氯-3-吲哚-β-D-半乳糖苷 第一章简介 当今基因输送技术的发展日趋复杂,一些治疗药物(生长激素、干扰素、抗病毒和抗癌复合物)和诊断性蛋白(单克隆抗体)的设计、发展与合成需要更高效的基因输送工具。人类基因组计划和正不断发展的基因治疗同样急需发展快速有效和治疗性的分析工具。为解决这一问题,基因输送技术(通常使用病毒载体如增殖缺陷的腺病毒)通过基因工程不断发展,致力于生产基因表型药物。重组腺病毒提供了一类在基因转移系统发展中有极大潜力的新的生物治疗剂。 1953年对普通感冒病因的探索和研究导致了腺病毒的发现。迄今为止已发现了40多种不同血清型和93种不同种类的腺病毒,它们通常感染眼、呼吸道或胃肠上皮(Fields等,1996)。1977年,FrankGraham博士建立了一种细胞株,可在无辅助病毒的情况下产生重组腺病毒(Graham等,1977)。此后,腺病毒载体作为极具潜力的哺乳动物基因转移载体而得到广
pLVX-TetOne-Puro慢病毒载体使用说明
pLVX-TetOne-Puro pLVX-TetOne-Puro 载体基本信息: 载体名称: pLVX-TetOne-Puro 质粒类型: 慢病毒载体;四环素调控载体 高拷贝/低拷贝: 高拷贝 克隆方法: 限制性内切酶,多克隆位点 启动子: TRE3GS 载体大小: 9227 bp 5' 测序引物及序列: -- 3' 测序引物及序列: -- 载体标签: 无 载体抗性: 氨苄青霉素 筛选标记: 嘌呤霉素(Puromycin ) 克隆菌株: Stbl3 宿主细胞(系): 常规细胞系(293、CV-1、CHO 等) 备注: 慢病毒载体pLVX-TetOne-Puro 是集调控与应答功能于一体的四环素诱导载体。 稳定性: 稳表达 组成型/诱导型: 诱导型 病毒/非病毒: 慢病毒 pLVX-TetOne-Puro 载体质粒图谱和多克隆位点信息:
pLVX-TetOne-Puro载体序列: ORIGIN 1 TGGAAGGGCT AATTCACTCC CAAAGAAGAC AAGATATCCT TGATCTGTGG ATCTACCACA 61 CACAAGGCTA CTTCCCTGAT TAGCAGAACT ACACACCAGG GCCAGGGGTC AGATATCCAC 121 TGACCTTTGG ATGGTGCTAC AAGCTAGTAC CAGTTGAGCC AGATAAGGTA GAAGAGGCCA 181 ATAAAGGAGA GAACACCAGC TTGTTACACC CTGTGAGCCT GCATGGGATG GATGACCCGG 241 AGAGAGAAGT GTTAGAGTGG AGGTTTGACA GCCGCCTAGC ATTTCATCAC GTGGCCCGAG 301 AGCTGCATCC GGAGTACTTC AAGAACTGCT GATATCGAGC TTGCTACAAG GGACTTTCCG 361 CTGGGGACTT TCCAGGGAGG CGTGGCCTGG GCGGGACTGG GGAGTGGCGA GCCCTCAGAT 421 CCTGCATATA AGCAGCTGCT TTTTGCCTGT ACTGGGTCTC TCTGGTTAGA CCAGATCTGA 481 GCCTGGGAGC TCTCTGGCTA ACTAGGGAAC CCACTGCTTA AGCCTCAATA AAGCTTGCCT 541 TGAGTGCTTC AAGTAGTGTG TGCCCGTCTG TTGTGTGACT CTGGTAACTA GAGATCCCTC 601 AGACCCTTTT AGTCAGTGTG GAAAATCTCT AGCAGTGGCG CCCGAACAGG GACTTGAAAG 661 CGAAAGGGAA ACCAGAGGAG CTCTCTCGAC GCAGGACTCG GCTTGCTGAA GCGCGCACGG 721 CAAGAGGCGA GGGGCGGCGA CTGGTGAGTA CGCCAAAAAT TTTGACTAGC GGAGGCTAGA 781 AGGAGAGAGA TGGGTGCGAG AGCGTCAGTA TTAAGCGGGG GAGAATTAGA TCGCGATGGG 841 AAAAAATTCG GTTAAGGCCA GGGGGAAAGA AAAAATATAA ATTAAAACAT ATAGTATGGG 901 CAAGCAGGGA GCTAGAACGA TTCGCAGTTA ATCCTGGCCT GTTAGAAACA TCAGAAGGCT
植物病毒分子检测方法概述
植物病毒分子检测方法概述 邵碧英 (福建出入境检验检疫局 福州 350001) 植物病毒粒体主要由核酸和蛋白外壳构成,蛋白外壳由许多外壳蛋白(CP)组成。 CP和核酸因病毒的不同而异,是检测、鉴定植物病毒的主要依据。广义的植物病毒分子检测方法包括蛋白质检测(或血清学试验)和核酸检测方法,本文分别介绍。 1 以病毒外壳蛋白为基础的检测方法 植物病毒的CP具有抗原性,很多病毒可以被提纯并制备成高效价的抗血清,根据特异性的抗原抗体反应可检测植物病毒的存在。血清学方法有很多,应用较广泛的是酶联免疫吸附反应,在此基础上加以改进也发展了一些新的检测方法。 111 酶联免疫吸附反应(EL ISA) EL ISA是一种采用固相(主要为聚苯乙烯酶联板)吸附,将免疫反应和酶的高效催化反应有机结合的方法。酶标抗体(或抗抗体)与相应抗原反应时形成酶标记的免疫复合物,酶遇到相应的底物时产生颜色反应,颜色深浅与抗原量正相关。该方法已被用于各种植物病毒检测。 后来发展的用酶标A蛋白取代酶标抗抗体的EL ISA被称为A蛋白酶联吸附法(SPA-EL ISA)。几种植物病毒的SPA-EL ISA诊断试剂盒已被研制成功[1]。 EL ISA方法简单,灵敏度高,特异性强,适于大量样品的检测。 112 斑点免疫吸附法 20世纪80年代发展的以硝酸纤维素膜(NCM)为固相载体的酶联免疫吸附试验—斑点免疫吸附法,检测原理类似于EL ISA,但酶与底物反应产生不溶性产物,在NCM 上形成有色斑点,斑点颜色深浅与抗原的量成正比。也已用于各种病毒检测。 斑点法简便,反应时间短,反应结果可长期保存,不需任何特殊设备,也适合于大量样品的测定。 113 直接组织斑免疫测定法(IDD TB)与EL ISA相比,斑点法更为简便,但仍然需要提取病毒的粗提液或提纯制剂,试验过程较繁琐。改进后的直接组织斑免疫测定是直接把植物组织切块固定于膜上,然后利用抗原抗体特异反应来检测植物病毒。 鞠振林等[2]以IDD TB检测病组织中的马铃薯X病毒Potato virus X等多种病毒获得较好结果。徐明全等[3]采用IDD TB法从兰花叶片中检测到建兰花叶病毒Cymbidium mosaic virus。把石斛兰叶片从叶尖至叶尾每0.5cm切割1次并压印在膜上,检测结果可直接显示出感染病毒的具体部位。 组织印迹法明显比EL ISA和DIBA的试验程序简单、快速。但病毒在植物的不同部位分布不均匀,同一样品要重复多次,以提高检测的准确性。 114 电印迹免疫分析(EBLA) 电印迹免疫分析方法首先用SDS2PA GE 分离病毒CP,把蛋白带转移到膜上,再进行抗原杭体反应,根据CP分子量和吸附特异性抗血清的特殊带来判断该病毒的存在与否。 EBLA和EL ISA、DIBA相比具有明显的优点,通过电泳将植物病毒的CP和植物组织中的其它蛋白分离开来,排除了杂蛋白的干扰,可检测低浓度的植物病毒。此方法 — 7 7 3 —
过表达慢病毒载体构建和包装手册 version1
过表达慢病毒载体构建和包装手册 Version1.0 吉凯基因 二零一一年五月
目录 简介 (3) 第一部分过表达慢病毒载体的制备 实验流程 (4) 实验材料 (5) 过表达克隆制备 (6) 第二部分慢病毒包装与滴度检测 实验流程 (17) 实验材料 (18) L e n t i v i r u s病毒包装 (21) 病毒的收获及浓缩 (22) L e n t i v i r u s滴度测定 (24) 参考文献 (33)
简介 慢病毒(Lentivirus)载体是以人类免疫缺陷型病毒(HIV)为基础发展起来的基因治疗载体,它对分裂细胞和非分裂细胞均具有感染能力,并可以在体内较长期的表达且安全性高。吉凯基因提供的慢病毒为“自杀”性病毒,即病毒感染目的细胞后不会再感染其他细胞,也不会利用宿主细胞产生新的病毒颗粒。慢病毒中的毒性基因已经被剔除并被外源性目的基因所取代,属于假型病毒。但该病毒仍然具有可能的潜在的生物学危险,吉凯基因建议不要使用编码已知或可能会致癌的基因的假型病毒,除非已经完全公认某个基因肯定没有致癌性,否则均不建议采用假型病毒进行生物学实验。 吉凯基因慢病毒载体系统由GV慢病毒载体系列、pHelper 1.0载体和pHelper 2.0载体三质粒组成。GV慢载体中含有HIV的基本元件5’LTR和3’LTR以及其他辅助元件,例如WRE (woodchuck hepatitis virus posttranscriptional regulatory element)。通常根据不同的实验目的针对GV载体改造以进行基因功能研究。pHelper 1.0载体中含有HIV病毒的gag基因,编码病毒主要的结构蛋白;pol基因,编码病毒特异性的酶;rev基因,编码调节gag和pol基因表达的调节因子。pHelper 2.0载体中含有单纯疱疹病毒来源的VSV-G基因,提供病毒包装所需要的包膜蛋白。 吉凯基因过表达慢病毒产品可通过对GV慢病毒载体的改造和病毒包装,获得带有特定基因序列的慢病毒颗粒,以满足不同的实验需求。 本手册为吉凯基因RNAi慢病毒载体的构建和病毒包装的通用操作流程,目的是为了方便大家交流使用,部分细节内容未能做到一一详述,敬请谅解。同时希望大家能够针对手册中的错误和问题,提出宝贵的意见。
动物病毒学(DOC)
《动物病毒学》实验课 讲稿 任课教师:方六荣 授课对象:2002级动物医学专业1-4班 授课时间:2004.09-2005.01
目录 实验一鸡胚接种 (1) 实验二传代细胞培养与病毒在传代细胞中的培养 (6) 实验三原代细胞培养 (9) 实验四病毒TCID50的测定 (11) 实验五中和试验 (13)
实验一鸡胚接种 一、实验目的 了解鸡胚的基本结构与功能及鸡胚接种的方法,掌握常用的鸡胚接种方法。 二、鸡胚接种的作用 主要用于: ①分离病毒,并根据病变初步鉴定病毒 ②培养病毒,制造抗原和疫苗 ③测定各毒株之间的抗原关系(用鸡胚作中和试验和交叉保护实验) ④测定病毒毒力 三、材料 1、鸡胚10日龄 2、病毒鸡传染性支气管炎病毒(IBV) 3、照蛋灯 4、打孔器 5、石蜡 6、注射器 7、蛋座 8、酒精棉球、碘酊棉球 四、鸡胚用于病毒培养的优缺点 (一)优点 1、组织分化程度低 2、可选择不同的日龄和接种途径 3、病毒易于增殖 4、感染病毒的组织和液体中含大量病毒 5、容易采集和处理 6、来源充足 7、设备和操作简便易行 (二)缺点 1、胚内可能污染细菌和病毒 沙门氏菌、禽白血病病毒、新城疫、禽脑脊髓炎病毒 2、母源抗体 3、许多病毒在鸡胚中增殖缺乏特异性的感染指针
五、鸡胚的结构与功能 1、卵壳上有细孔,进行气体交换 2、壳膜使气体分子和液体分子在内外两方面进行交换。 3、气室呼吸和调节压力 4、绒毛尿囊膜起胚胎呼吸器官的功能,氧气的交换是在膜的血管内通过卵壳孔而进行的。 5、尿囊腔胚胎的排泄器官,内含有尿囊液,初为透明液体,是单纯生理盐溶液,以后尿囊液中 尿酸盐迅速增加,胚胎发育到第12-13天后,尿囊液开始变得混浊。 6、羊膜与羊膜腔其中盛有羊水,胎体浸泡于其中 7、卵黄在胚胎发育早期供给鸡胚营养。 8、卵白在胚胎发育晚期供给鸡胚营养。 六、受精卵的选择 1、最好是来自SPF鸡群,以降低母源抗体的影响。 2、受精卵的壳最好是白色的,以便于检卵。 3、受精卵必须新鲜,保存在5-20℃不要超过10天,保存一个月的受精卵,孵化率将近于零。 七、鸡胚的孵育 1、孵卵箱内的温度应保持在37.5-38.5℃ 2、相对湿度:50%-60% 3、必须保证具有充分的新鲜空气流通,特别是在孵化5-6天以后
pLVX-Puro慢病毒载体使用说明
pLVX-Puro pLVX-Puro载体基本信息: 载体名称: pLVX-Puro , pLVXpuro 质粒类型: 哺乳动物细胞慢病毒表达载体 高拷贝/低拷贝: 高拷贝 启动子: CMV 克隆方法: 多克隆位点,限制性内切酶 载体大小: 8102 bp 5' 测序引物及序列 : CMV-F:CGCAAATGGGCGGTAGGCGTG 3' 测序引物及序列: -- 载体标签: -- 载体抗性: 氨苄 筛选标记: 嘌呤霉素 备注: 含有组成型CMV启动子的慢病毒载体稳定性: / 组成型: -- 病毒/非病毒: 慢病毒 pLVX-Puro载体质粒图谱和多克隆位点信息:
pLVX-Puro载体简介: Description pLVX-Puro is an HIV-1-based, lentiviral expression vector. Lentiviral particles derived from the vector allow you to express your gene of interest in virtually any cell type, even primary cells. Expression of your gene is driven by the constitutively active human cytomegalovirus immediate early promoter (PCMV IE), located just upstream of the multiple cloning site (MCS), allowing constitutive, high level expression of your protein of interest. pLVX-Puro contains all of the viral processing elements necessary for the production of replication-incompetent lentivirus, as well as elements to improve viral titer, transgene expression, and overall vector function. The woodchuck hepatitis virus posttranscriptional regulatory element (WPRE) promotes RNA processing events and enhances nuclear export of viral and transgene RNA (1), leading to increased viral titers from packaging cells, and enhanced expression of your gene of interest in target cells. In addition, the vector includes a Rev-response element (RRE), which further increases viral titers by enhancing the transport of unspliced viral RNA out of the nucleus (2). Finally, pLVX-Puro also contains a central polypurine tract (cPPT) element that increases nuclear importation of the viral genome during target cell infection, resulting in improved vector integration and more effi cient transduction (3). In addition to lentiviral elements, pLVX-Puro contains a puromycin resistance gene (Puror) under the control of the murine phosphoglycerate kinase (PGK) promoter (PPGK) for the selection of stable transductants. The vector also contains a pUC origin of replication and an E. coli ampicillin resistance gene (Ampr) for propagation and selection in bacteria. Use pLVX-Puro constitutively expresses your gene of interest from PCMV IE when transduced into target cells. Before the vector can be transduced into cells, however, it must be transfected into 293T packaging cells with our Lenti-X? HT Packaging System (Cat. Nos. 632160 and 632161). This packaging system allows you to safely produce high titer, infectious, replication-incompetent, VSV-G pseudotyped lentiviral particles that can infect a wide range of cell types, including non-dividing and primary cells (4). pLVX-Puro载体序列: ORIGIN 1 TGGAAGGGCT AATTCACTCC CAAAGAAGAC AAGATATCCT TGATCTGTGG ATCTACCACA 61 CACAAGGCTA CTTCCCTGAT TAGCAGAACT ACACACCAGG GCCAGGGGTC AGATATCCAC 121 TGACCTTTGG ATGGTGCTAC AAGCTAGTAC CAGTTGAGCC AGATAAGGTA GAAGAGGCCA
