高一化学反应速率及图像计算练习题(附答案)

高一化学反应速率及图像计算练习题
一、单选题
1.可逆反应2NO 2(g)
2NO(g)+O 2(g),在容积固定的密闭容器中达到平衡状态的标志是( )
①单位时间内生成n mol O 2的同时生成2 mol n NO 2 ②单位时间内生成n mol O 2的同时生成2 mol n NO ③用NO 2、NO 、O 2表示的反应速率之比为2:2:1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态 A.①④⑥⑦
B.②③⑤⑦
C.①③④⑤
D.全部
2.在一定温度下,容器内某一反应中M 、N 的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( )
A .化学方程式:2M
N
B .t 2时,正逆反应速率相等,达到平衡
C .t 3时,正反应速率大于逆反应速率
D .t 1时,N 的浓度是M 浓度的2倍
3.反应()()()()3224NH g +5O g =4NO g +6H O g 在10 L 密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的平均速率()X v (反应物的消耗速率或产物的生成速率)可表示为( ) A.()()3NH =0.010 mol/L s v ? B.()()2O =0.0010 mol/L s v ? C.()()NO =0.0010 mol/L s v ?
D.()()2H O =0.0045 mol/L s v ?
4.—定温度下,在固定体积的密闭容器中发生下列反应:222HI =H +I 。若()HI c 由0.1 mol/L 降到0.07 mol/L 时需要15s 时间,那么c (HI)由0.07 mol/L 降到0.05mol/L 时,所需反应的时间( ) A.等于5s
B.等于10s
C.大于10s
D.小于10s
5.引起化学平衡移动的根本原因是( )
A.浓度的改变
B.压强的改变
C.使用了催化剂
D.正、逆反应速率的改变
6.下列说法正确的是( )
A .密闭容器中充入1mol N 2和3mol H 2可生成2mol NH 3
B .一定条件下,可逆反应达到平衡状态,该反应就达到了这一条件下的最大限度
C .对于任何反应增大压强,化学反应速率均增大
D .化学平衡是一种动态平衡,条件改变,原平衡状态不会被破坏
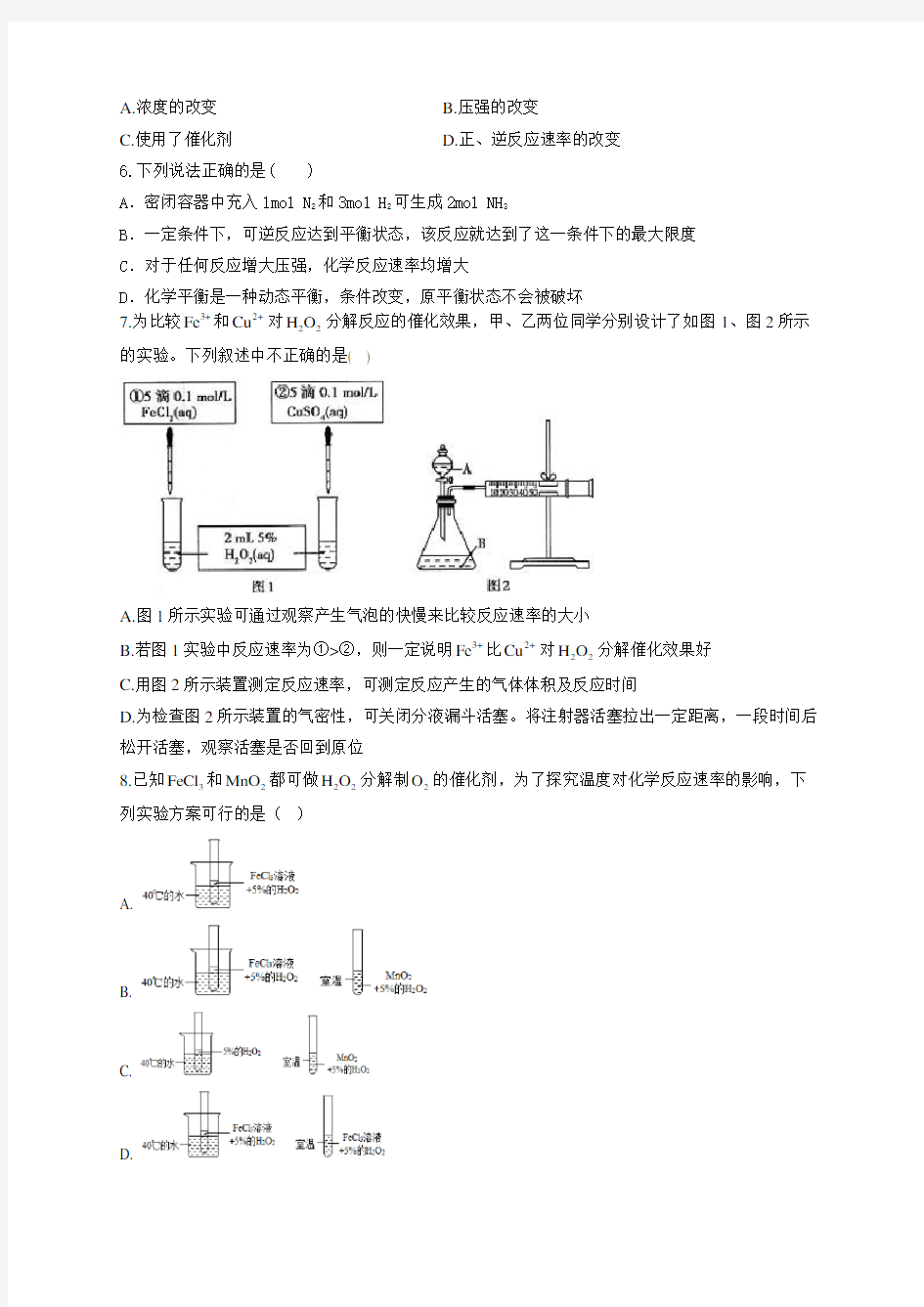
7.为比较3+Fe 和2+Cu 对22H O 分解反应的催化效果,甲、乙两位同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是( )
A.图1所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B.若图1实验中反应速率为①>②,则一定说明3+Fe 比2+Cu 对22H O 分解催化效果好
C.用图2所示装置测定反应速率,可测定反应产生的气体体积及反应时间
D.为检查图2所示装置的气密性,可关闭分液漏斗活塞。将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
8.已知3FeCl 和2MnO 都可做22H O 分解制2O 的催化剂,为了探究温度对化学反应速率的影响,下列实验方案可行的是( )
A.
B.
C.
D.
9.在不同浓度()c 、温度()T 条件下,蔗糖水解的瞬时速率()v 如下表,下列判断不正确的是( )
0.600 0.500 0.400 0.300
318.2 3.60 3.00 2.40 1.80 328.2 9.00 7.50 a 4.50 b 2.16
1.80
1.44
1.08
A.
B.同时改变反应温度和蔗糖的浓度, v 可能不变
C. 318.2b <
D.不同温度时,蔗糖浓度减少一半所需的时间相同 10.S 16O 2与18O 2在高温条件下发生反应2SO 2+O 22SO 3,达到化学平衡后,平衡混合物中含18O 的
微粒( ) A.只有SO 3
B.只有SO 2、SO 3
C.有SO 2、SO 3、O 2
D.只有O 2、SO 3
11.在一定温度下,容积不变的密闭容器中发生反应: 2C(s)+H O(g) 2CO(g)+H (g),下列不能
说明该可逆反应已经达到平衡状态的是( ) A.混合气体压强不再发生变化 B.混合气体质量不再发生变化
C.反应中CO 与2H 的物质的量之比为1:1
D.生成n mol CO 的同时生成n mol 2H O (g) 12.对于可逆反应A(g)B(g)C(g)D(g)m n p q ++?
,若其他条件都不变,只是在反应前是否加入
催化剂,可得到如下两种v t -图像,下列判断正确的是( )
A.12b b >,12t t >
B.12b b <,12t t <
C.两图中阴影部分面积相等
D.图II 中阴影部分面积更大
13.下列四个数据都表示反应222SO O +32SO 生成3SO 的反应速率,其中代表同一反应速率
的是( )
①()1
1
20.3v SO mol L min --=??
②()1
1
30.9v SO mol L min --=??
③()1
1
20.15v O mol L min --=??
④11
2() 2.25v O mol L min --=??
A.①②
B.①③
C.③④
D.②④ 二、填空题
14.某温度时,在2L 密闭容器中,X 、Y 、Z 三种物质的物质的量随时间变化的曲线如下所示。
回答下列问题。
(1)该反应的化学方程式为____________________。
(2)反应开始至2min 末,X 的反应速率为_____。 (3)该反应_____(填序号)。 ①是可逆反应 ②不是可逆反应
15.某温度时,在一个10L 的恒容容器中,X 、Y 、Z 均为气体,三种物质的物质的量随时间的变化曲线如下所示。
根据图中数据填空。
(1)反应开始至2min,以气体X 表示的平均反应速率为______。 (2)该反应的化学方程式为_________________。
(3)起始时容器内混合气体密度比平衡时______(填“大”“小”或“相等”,下同),混合气体的平均相对分子质量比平衡时______。
(4)a mol X 与b mol Y 的混合气体发生上述反应,反应到某时刻各物质的量恰好满足n(X)=n(Y)=n(Z),则原混合气体中a:b=_____。
16.向某容积固定的密闭容器中加入0.3mol A、0.1mol C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如下图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答下列问题。
(1)密闭容器的容积是_____L。
(2)若t1=15s,则t0~t1阶段以C物质浓度变化表示的反应速率为v(C)=_____。
(3)写出反应的化学方程式:__________________。
(4)B的起始物质的量是____。
17.一定温度下,某恒容密闭容器中含有NO2、N2O4两种气体,反应开始至达到平衡状态过程中,两种物质的浓度随时间的变化如下所示。
(1)表示NO2浓度变化的曲线是_____,写出相应的化学方程式:____________________。
(2)从反应开始至达到平衡的过程中,用N2O4表示的反应速率v(N2O4)=_____,a、b两点对应状态中,曲线X代表的物质的反应速率相对大小为v(a)_____v(b)。
(3)若平衡后改变温度,容器中气体平均摩尔质量变大,则反应向生成_____(填“NO2”或“N2O4”)的方向移动。
18.化学反应速率和限度与生产、生活密切相关。
1.某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集
原因是__________。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率__________(设溶液体积不变)。
2.另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是( )
A.蒸馏水
B.KCl溶液
C.KNO 3溶液
D.CuSO 4溶液
3.某温度下在4L 密闭容器中,X 、Y 、Z 三种气态物质的物质的量随时间变化曲线如图 ①该反应的化学方程式是__________。
②该反应达到平衡状态的标志是__________。 A.X 、Y 、Z 的反应速率相等 B.X 、Y 的反应速率比为3:1 C.容器内气体压强保持不变
D.生成1mol Y 的同时生成2mol Z ③2min 内X 的转化率为__________。
④若上述反应中X 、Y 、Z 分别为H 2、N 2、NH 3,且已知17g 氨气分解成氮气和氢气要吸收46kJ 热量,则该反应的热化学反应方程式为:__________。
19.某化学反应2A(g)
B(g)+D(g)在四种不同条件下(每次仅改变一个条件)进行,反应器为相同的
恒容密闭容器,B 、D 的起始浓度均为0,反应物A 的浓度(-1mol L ?)随反应时间(min)的变化情况如表所示: 实验序号
10
20
30
40
50
60
1 800 1.0
0.80 0.67 0.57 0.50 0.50 0.50 2 800 2c 0.60 0.50 0.50 0.50 0.50 0.50 3 800 3c
0.92 0.75 0.63 0.60 0.60 0.60 4
820
1.0
0.40
0.25
0.20
0.20
0.20
0.20
1.在实验1中,反应在10~20min 内用A 表示的平均反应速率为________________。
2.在实验2中,A 的初始浓度2c =____________-1
mol L ?,推测实验2中还隐含的条件是____________________。
3.10~30min 内,设实验3的反应速率为3v ,实验1的反应速率为1v ,则3v ___________(填“>”“<”或“=”)1v 。
4.实验2和实验4相比,A 的平衡转化率较高的是_______________(填“实验2”或“实验4”),该转化率等于_____________________。
20.在一定温度下,体积为2的密闭容器中,和之间发生反应:(红棕
色)
(无色),如图所示.
1.
曲线
(填“”或“
”)表示的物质的量随时间的变化曲线。 2.若降低温度,则
,
。(填“加快”或“减慢”或“不变”)。
3.若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中,
乙中,则
中反应更快。 4.在0到3
中内
的反应速率为
。
5.下列叙述能说明该反应已达到化学平衡状态的是( ) A.
B.容器内压强不再发生变化
C.
的体积分数不再发生变化
D.容器内气体原子总数不再发生变化
E.相同时间内消耗
的
的同时生成2
的
F.相同时间内消耗 的的同时消耗2 的 三、实验题
21.某学习小组研究影响锌与稀硫酸反应速率的外界条件,设计实验的数据如下: 速率最快的是__________(填实验序号)
2.实验1和2表明__________对反应速率有影响;实验1和3表明__________对反应速率有影响
3.进行实验2时,小组同学根据实验过程绘制的氢气体积(标准状况下)与时间的关系如图所示。
①在OA 、AB 、BC 三段中反应速率最快的是__________,其原因是__________
②2~4min 内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)v (H 2SO 4)=__________mol·L -1·min -1
22.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
1.上述实验中发生反应的化学方程式为。
2.要加快上述实验中气体产生的速率,还可采取的措施有(写两种)。
3.为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn 粒的反应容器中,收集产生的气体,记录获得相同体积的气体所需时间。
169=_______________; ②反应一段时间后,混合溶液A 中的金属呈_______________色,混合溶液E 中的金属呈_______________色;
③该同学最后得出的结论为:当加入少量CuSO 4溶液时,生成氢气的速率会大大提高。但当加入的CuSO 4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_____________________________________________。
1.实验4和5表明,__________对反应速率有影响,__________,反应速率越快,能表明同一规律的实验还有__________(填实验序号).
2.实验1、3、4、6、8表明反应物浓度对反应速率产生影响,能表明同一规律的实验还有
__________(填实验序号).
3.本实验中影响反应速率的其他因素还有__________,其实验序号是6和__________,8和
__________.
4.实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:__________.
:
2.实验Ⅰ和Ⅱ表明__________,化学反应速率越大。
3.能表明固体的表面积对反应速率有影响的实验编号是__________和__________。
4.请设计一个实验方案证明盐酸的浓度对该反应的速率的影响:__________。
参考答案
1.答案:A
解析:从平衡状态的两个重要特征上判断:(1)v(正)=v(逆),(2)混合物中各组成成分的百分含量不变。①单位时间内生成n mol O 2的同时生成2n mol NO 2,v(正)=v(逆),正确;②单位时间内生成n mol O 2的同时生成2n mol NO,二者均为正反应速率,不能作平衡标志,错误;③用NO 2、NO 、O 2表示的反应速率的比为2:2:1的状态,没有明确正、逆反应速率,不能作平衡标志,错误;④混合气体的颜色不再改变时,二氧化氮的浓度不再改变,达到平衡状态,正确;⑤该反应在体积固定的密闭容器中混合气体的密度不随反应的进行而变化,密度不变不能作为平衡标志,错误;⑥该反应前后气体物质的量不等,混合气体的压强不再改变的状态为平衡状态,正确;⑦该反应前后气体物质的量不等,混合气体的平均相对分子质量不再改变的状态为平衡状态,正确。 2.答案:D
解析:由图像可知,反应中M 的物质的量逐渐增多,N 的物质的 量逐渐减少,则在反应中N 为反应物,M 为生成物。在相等的时间内N 和M 的物质的量的变化量之比为2︰1,所以反应的化学方程式 应为2N
M,故A 错误;t 2时,反应没有达到平衡,此时反应继续向正反应方向进行,正反应速
率大于逆反应速率,故B 错误七时,反 应达到平衡.正、逆反应速率相等,故C 错误;t 1时,N 的物质的量为 6 mol ,M 的物质的量为3 mol ,N 的浓度是M 的浓度的2倍,故D 正确。 3.答案:C
解析:半分钟后,水蒸气的物质的量增加了0.45mol,则()20.45 0.0015/1030O ()mol
v H mol L s L s
==??,反应
速率之比是相应的化学计量数之比,则
v(NH 3)=0.0010mol/(L ·s),v(O 2)=0.00125mol/(L ·s),v(NO)=0.0010mol/(L ·s),C 项正确。 4.答案:C
解析:随着反应不断进行,(HI)c 逐渐减小,v 逐渐减小,所以,(HI)c 由0.07mol/L 降到0.05mol/L,所用时间应大于10s 。 5.答案:D
解析:正、逆反应速率相等是化学平衡的根本标志,当正、逆反应速率不相等时,化学平衡发生移动。 6.答案:B
解析:N 2和H 2生成NH 3的反应为可逆反应,1mol N 2和3mol H 2不能完全反应生成2mol NH 3,A 项错;压强是影响化学反应速率的一个因素,但并不适合于所有的反应,必须有气体参与的反应才适合,C 不正确;化学平衡是一种动态平衡,该平衡是建立在一定条件下的平衡,如果条件改变,平衡将发生移动,D 项不正确。 7.答案:B
解析:由于3FeCl 和4CuSO 的阴离子不相同,故若图1所示实验中反应速率为①>②,不能说明3+Fe 比2+Cu 对22H O 分解催化效果好。
8.答案:D
解析:A 项没有对比实验,错误;B 项中催化剂不同,温度不同,无法比较,错误;C 项,前者没有催化剂,后者有催化剂,且温度不同,无法比较,错误;D 项中只有温度不同,其他条件都相同,该方案可行。 9.答案:D
解析:根据题表信息可知,相同温度时,随着浓度以等差数列递减,其瞬时速率也以等差数列递减,故
6.00a =;同时改变反应温度和反应物浓度,瞬时速率有可能不变;相同浓度时,温度越高,反应速率越
快,故318.2b <;温度升高,瞬时速率加快,故蔗糖浓度减少一半时,所用时间并不相等,D 项错误。 10.答案:C
解析:本题易错之处是只考虑反应从正反应开始,忽略可逆反应可逆向进行而错选A 或D 。根据可逆反应的特点可知本题选C 。 11.答案:C
解析:反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度、含量等不再发生变化,以及由此衍生的其它量不变,A 项,反应前后气体的物质的量发生变化,容器中压强不变,说明反应到达平衡,A 项不符合题意;B 项,该反应中有固体参加,混合气体质量不再发生变化,说明反应到达到平衡状态,B 项不符合题意;C 项,反应中物质的物质的量之比等于对应的化学计量数之比不能说明反应达到平衡状态,C 项符合题意;D 项,生成n mol CO 的同时生成n mol 2H O (g),正逆反应速率相等,说明反应达到平衡状态,D 项不符合题意。 12.答案:C
解析:加入催化剂,反应速率增大,但催化剂只影响反应速率,不影响平衡移动。加入催化剂时,正、逆反应速率都增大,缩短了达到平衡的时间,由此可得,12a a <,12b b <,12t t >。阴影部分面积为反应物浓度的变化量,由于催化剂不影响平衡移动,故两图中阴影部分面积相等。 13.答案:B
解析:同一反应中,不同物质表示的反应速率之比等于化学方程式中对应物质的化学计量数之比。用2SO 表示的反应速率是110.3mol L min --??时,则同一反应中用3SO 表本的反应速率是
110.3mol L min --??,用2O 表示的反应速率是110.1?5mol L min --??,所以答案选B 。
14.答案:(1)Y+2Z
3X(2)0.1mol/(L·min)(3)①
解析:(1)根据题图可知Y 、Z 浓度降低,为反应物,X 浓度增大,为生成物,当各物质的物质的量不再变化时,反应达到平衡状态,此时Δn(Y)=1.2mol-1.0mol=0.2mol,Δn(Z)=2.0mol-1.6mol=0.4mol,Δn(X)=1.0mol-0.4mol=0.6mol,化学计量数之比等于Δn(Y):Δn(Z):Δn(X)=1:2:3,化学方程式可写为Y+2Z
3X 。
(2)反应开始至2min 末,()=X c ?0.8mol-0.4mol=0.4mol,()0.4=
=0.22 mol
X L
mol/L c ?,化学反应速率为
mol/L
=0.1mol/0.2(L min
)min 2?。
(3)反应开始3min 后,各物质的物质的量不再发生变化,说明反应达到平衡状态,即该反应是可逆反应。
15.答案:(1)0.015mol/(L·min)(2)3X+Y 2Z(3)相等;小
(4)5:3
解析:(1)反应开始至2min,气体X 的物质的量由1mol 变化到0.7mol,变化量为0.3mol,而容积为10L,根据化学反应速率的表示方法,计算得()0.3mol
X =0.015mol/L min 10L 2min
()v =
??。
(2)根据物质的量的变化量之比等于各化学计量数之比,写出反应的化学方程式。
(3)由于容器的容积不变、气体的总质量不变,所以混合气体的密度始终不变;由于该反应为气体分子数减小的反应,气体的总质量不变,因此混合气体的平均相对分子质量随着反应的进行增大,平衡时,达到最大值。
(4)设某时刻Y 的物质的量的变化量为n mol,则: ()() 3X + Y 2Z : a mol b mol 0: 3n mol n mol 2n mol :a 3n mol b n mol 2n mol
--垐?噲?初始转化某时刻
n(X)=n(Y)=n(Z),,即(a-3n)mol=(b-n)mol=2n mol 解得a=5n,b=3n,则原混合气体中a:b=5n:3n=5:3。 16.答案:(1)2(2)0.04mol·L -1·s -1(3)3A(g)
B(g)+2C(g)(4)0.04mol
解析:(1)根据加入0.3mol A,题图中的浓度为0.15mol·
L -1,可知容器的体积为2L 。 (2)t 0~t 1阶段C 物质的浓度变化为0.11mol·L -1-0.05mol·L -1=0.06mol·L -1,故t 0~t 1阶段以C 物质浓度变
化表示的反应速率()1
110.060.0415s
mol L v C mol L s ---?=
??=。 (3)根据反应过程中混合气体的平均相对分子质量没有变化,可知该反应是一个等体积反应,根据反应
速率之比等于物质的化学计量数之比,可写出化学方程式为3A(g)B(g)+2C(g)。
(4)根据化学方程式3A(g)
B(g)+2C(g),B 的物质的量的变化是C 的一半,故B 的物质的量的变化
0.06mol,因此B 的起始物质的量是0.05mol·L -1×2L-0.06mol=0.04mol 。 17.答案:(1)X;2NO 2
N 2O 4(2)0.4mol·L -1·min -1;>;(3)N 2O 4
解析:(1)根据题图,达到平衡时,X 的浓度降低了8mol·L -1,Y 的浓度增大了4mol·L -1,因此表示NO 2浓度变化的曲线是X,反应的化学方程式为2NO 2
N 2O 4。
(2)从反应开始至达到平衡的过程中,用N 2O 4表示的反应速率
()1112440.410mol L v N O mol L min min
---?=??=;a 、b 两点均未达到平衡状态,根据题图可知v(a)>v(b)。
(3)若平衡后改变温度,容器中气体平均摩尔质量变大,说明气体的物质的量变小,则反应向生成N 2O 4的方向移动。
18.答案:1.①2~3min;因该反应是放热反应,此时温度高且盐酸浓度较大,所以反应速率较快;②0.025mol/(L·min) 2.CD; 3.①3X(g)+Y(g)2Z(g) ②CD ③30%
④N 2(g)+3H 2(g)2NH 3(g) ΔH =-92kJ/mol;
解析:1.①相同条件下,反应速率越大,相同时间内收集的气体越多。经判断可知,反应速率最大的时间段是2~3min;由于并不是开始阶段的单位时间内收集到气体体积最多,说明该反应速率不仅与浓度有关,只能是因为该反应是放热,温度越高,反应速率越大。
②3~4min 生成氢气的体积时112mL,则消耗0.01mol HCl,故此时间内的反应速率为0.025mol·L·min
-1
2.加蒸馏水就是稀释,A 项可行;加KCl 溶液相当于稀释,B 项可行,加入KNO 3溶液后,由于溶液呈酸性,相当于存在稀硫酸,故无氢气存在,C 项不可行;加CuSO 4溶液,能形成铜锌原电池,加快反应速率,D 项不可行。
3.①前5min 内,X 、Y 分别减小了0.6mol 、0.2mol,Z 增加了0.4mol,故反应的化学方程式为3X(g)+Y(g)2Z(g);
②正反应速率与逆反应速率相等时才能证明达到化学平衡,A 中、B 中没有指出反应方向,A 项、B 项错误;反应前后气体的物质的量会发生变化,故压强不变可以作为达到化学平衡的标志,C 项正确;生成1mol Y 、生成2mol Z 的反应方向相反,数值相当,可作为化学平衡的标志,D 项正确; ③2min 内X 减少了0.3mol,故X 的转化率为30%;
④由数据可知,分解1mol NH 3吸收的热量为46kJ,故合成氨的热化学方程式为N 2(g)+3H 2(g)
2NH 3(g) ΔH =-92kJ·mol -1
19.答案:1.0.013-1-1mol L min ??
2.1.0;加入催化剂
3.>
4.实验4;80%
解析:1.反应在10~20min 内用A 表示的平均反应速率为
-1-1-1-10.80mol L -0.67mol L 0.013mol L min 10min
c v t ???===???
2.根据实验1、2中数据分析,温度相同,达到平衡后A 的物质的量浓度相同,且B 、D 的起始浓度均为0,所以两组实验中A 的起始浓度相同,均为1.0-1mol L ?;温度相同,达到平衡后A 的物质的量浓度相同,但达到平衡时实验2所用的时间较短,即实验2的反应速率较快所以只能是加入催化剂。
3.由实验1、3中数据可知,10~30min 内,-1-1-1-110.800.57
mol L min 0.0115mol L min 20
v -=
??=??,
-1-1-1-130.920.63
mol L min 0.0145mol L min 20
v -=
??=??,所以31v v >
4.在实验2中,A 的平衡转化率为
1.00.50
100%50%1.0
-?=;在实验4中,A 的平衡转化率为
1.00.20
100%80%1.0
-?=。
20.答案:1.X; 2.减慢; 减慢; 3.甲; 4.0.05mol/(L·min); 5.BCF
解析:1.由方程式2NO 2(g)(红棕色) N 2O 4(g)(无色),可知反应中NO 2的物质的量变化较大,则X 表示NO 2的物质的量随时间的变化曲线。 2.温度降低,正、逆反应速率都减慢。 3.分别测得甲中v(NO 2)=0.3mol/(L·s),乙中
v(N 2O 4)=6mol/(L·min),v(NO 2)=2v(N 2O 4)=2×6mol/(L·min)=0.2mol/(L·s),则甲反应较快。 4.
5.A 项,v(NO 2)=2v(N 2O 4),未体现正与逆的关系,错误;B 项,容器内压强不再发生变化,说明达到平衡状态,正确;C 项,X 的体积分数不再发生变化,说明达到平衡状态,正确;D 项,从反应发生容器中气体原子总数就不变,所以不能作达到平衡状态的标志,错误;E 项,只要反应发生就符合相同时间内消耗n mol 的Y 的同时生成2n mol 的X,所以不一定达到平衡状态,错误;F 项,相同时间内消耗n mol 的Y 的同时消耗2n mol 的X,说明达到平衡状态,正确。
21.答案:1.锌完全消失所需的时间; 5; 2.固体反应物的表面积; (是否形成)原电池 3.AB; 反应放热,使温度升高,反应速率加快; 0.06
解析:1.判断锌和稀硫酸反应速率大小可通过测定锌完全消耗所需的时间进行判断;5组实验数据进行对比不难看出,实验5用粉末状锌、较大浓度的硫酸、反应温度最高且滴加2滴CuSO 4溶液,其反应速率最快。
2.对比实验1和2的实验条件可知,固体反应物的表面积对反应速率有影响;对比实验1和3的实验条件可知,原电池反应对反应速率有影响。
3.①OA 、AB 、BC 三段反应时间相同,产生H 2最多的一段反应速率最快;②2~4 min 内产生H 2的体积179.2 mL-4
4.8 mL=134.4 mL,反应消耗的n (H 2SO 4)=n (H 2)=0.006 mol,v (H 2SO 4)=0.06 mol·L -1·min -1
22.答案:1.Zn+CuSO 4=ZnSO 4+Cu;Zn+H 2SO 4=ZnSO 4+H 2↑; 2.升高温度、适当增加硫酸的浓度(或增大锌粒的比表面积等)
3.①30;10;17.5②浅灰;暗红③当加入一定M 的CuSO 4后,生成的单质Cu 会沉积在Zn 的表面,减小了Zn 与H 2SO 4的接触面积.
解析:1.分析实验中涉及的物质:Zn 、CuSO 4、H 2SO 4,其中能发生的化学反应有2个:Zn+CuSO 4=ZnSO 4+Cu,Zn+H 2SO 4=ZnSO 4+H 2↑.
2.根据影响化学反应速率的外界因素,则加快反应速率的方法还有:增大反应物浓度,升高温度,使用催化剂,增大锌粒的比表面积等。注意H 2SO 4浓度不能过大,浓硫酸与Zn 反应不生成H 2。
3.若研究4CuSO 的量对2H 生成速率的影响,则实验中除4CuSO 的量不同之外,其他物质的量均相同,则1234530mL V V V V V =====,最终溶液总体积相同,由实验F 可知,溶液的总体积均为50mL,则
6910mL,17.5mL V V ==。随着4CuSO 的量增大,则附着在Zn 片表面的Cu 会越来越多,当Cu 完
全附盖Zn 片时,Zn 不能与24H SO 接触,则2H 生成速率会减慢,且Zn 片表面的Cu 为暗红色。 23.答案:1.固体反应物的表面积; 表面积越大; 1和2
2.2和5;
3.反应温度; 7; 9;
4.可能是稀硫酸过量,金属完全反应,放出的热量相等,所以使反应前后溶液的温度变化值相近
解析:1.实验4和5的差別是金属的状态,即固体的表面积影响化学反应速率,且表面积越大,反应速率越大,实验中1和2也能说明该规律。
2.实验中1、3、4、6、8表明浓度对化学反应速率的影响,另外2和5也可证明该规律。
3.除固体表面积、反应物的浓度对反应速率有影响,实验6和7,8和9还表明温度对反应速率的影响.
4.实验中可能是H 2SO 4过量,金属完全反应,放出的热量相等,使反应前后溶液的温度变化值相近。 24.答案:1.固体表面积; 温度; 2.温度越高; 3.Ⅱ; Ⅲ; 4.在相同的温度下,用相同状态的质量相同的锌片与两种体积相同,浓度不同的盐酸反应,比较收集等量H 2所需要的时间
解析:1.由表中实验内容可知,本实验是通过改变锌的状态和反应温度探究固体表面积、温度对锌和稀盐酸反应速率的影响。
4.要证明盐酸的浓度对该反应的速率的影响,需要在相同温度下使质量和状态均相同的锌与体积相同物质的量浓度不同的盐酸反应,比较收集等量2H 所需要的时间。
化学反应速率反应平衡图像题解析
化学反应速率反应平衡图像题解析 一、图像拾零 1.速率—时间图 此类图像定性地揭示了正、逆反应速率随时间(含条件变化对速率的影响)而变化的规律,体现了平衡的“逆、等、动、定、变、同”的基本特征,以及平衡移动的方向等。 如N2(g)+3H2(g) 2NH3(g);△H<0反应,其速率—时间图如下图所示:(1)当速率改变时分别是什么条件改变? t1, t3, t5, t7 (2)哪些时间段是平衡状态? (3)哪一段的N2的转化率最高? 2.浓度—时间图 此类图像能说明各平衡体系组分(或某一成分)在反应过程中的变化情况。此类图像要注意各物质曲线的折点(即达到平衡时)时间应该相同。且各物质的浓度变化值应该满足方程式的计量系数之比。此类图像可以用于推测反应方程式。 如图所示,800℃时,A、B、C三种气体在密闭容器中反应时浓度的变化,只从 图上分析不能得出的结论是() A.A是反应物 B.前2minA的分解速率是0.1mol(L min) C.若升高温度,A的转化率增大 D.增大压强,A的转化率减小 3.全程速率—时间图 如锌和盐酸的反应,反应速率随时间的变化出现如图所示的变化。 不同时间段的反应速率的变化情况不同。AB段反应速率逐渐增加是 因为该反应是放热反应,温度升高,反应速率加快。而BC段反应速 率减小是因为随反应的进行,盐酸逐渐被消耗,浓度减小,反应速率减小。故分析时要抓住各节段的主要矛盾,认真探究。 4.含量—时间—温度(压强)图 此类图像要注意的是,折点对应的时间即是达平衡所需要的时间,时间越短表示反应速率越快。而水平线的高低表示达到平衡时各物质的浓度,它表明的是平衡移动的方向。 常见的形式有以下几种:
化学反应速率和平衡图像
化学反应速率和平衡图像 一、回顾 1.影响化学反应速率的外界因素 2.影响化学平衡的外界因素 外界因素改变的条件平衡移动的方向 浓度增大反应物浓度减小反应物浓度增大生成物浓度减小生成物浓度 压强增大体系压强减小体系压强 温度 升高体系温度 降低体系温度
二、内容 1.速率—时间图 解法识记: 1.增加反应物浓度,v正跳上得更大;减小反应物浓度,v正跳下得更大 2.增加生成物浓度,v逆跳上得更大;减小生成物浓度,v逆跳下得更大 3.升高温度,吸热方向跳上得更大;降底温度,吸热方向跳下得更大 4.增大压强,计量数减小方向跳上得更大;减小压强,计量数减小方向跳下得更大 若v正在v逆的上方,即平衡向正反应方向移动;若v逆在v正的上方,即平衡向逆反应方向移动。 2.浓度(或物质的量)—时间图
1.可逆反应a X(g)+b Y(g) c Z(g) 在一定温度下的一密闭容器内达到平衡后, t0时改变某一外界条件,化学反应速率(v) —时间(t)图象如图,则下列说法中正确的 是( ) A.若a+b=c,则t0时只能是增大了容器的压强 B.若a+b=c,则t0时只能是加入了催化剂 C.若a+b≠c,则t0时只能是增大了容器的压强 D.若a+b≠c,则t0时只能是加入了催化剂 【典例2】(2013·成都模拟)可逆反应N2+3H2 2NH3是工业上合成氨的重要反应。 1)根据图1请写出合成氨的热化学方程式______________ ________________________(热量用E1、E2或E3表示)。 (2)图1中虚线部分是通过改变化学反应中的___________条件,该条件的改变与图2中哪一时刻条件的改变相同_________(用“t1…t6”表示)。
高一物理万有引力计算题练习
M N 万有引力基础练习 1.对某行星的一颗卫星进行观测,运行的轨迹是半径为r 的圆周,周期为T 。求: (1) 该行星的质量。 (2) 测得行星的半径为卫星轨道半径的十分之一,则此行星的表面重力加 速度有多大? 2、宇航员到达某行星表面后,用长为L 的细线拴一小球,让球在竖直面内做圆周运动。他测得当球通过最高点的速度为v 0时,绳中张力刚好为零。设行星的半径为R 、引力常量为G ,求: (1)该行星表面的重力加速度大小;(2)该行星的质量;(3)在该行星表面发射卫星所需要的最小速度。 3.一颗人造卫星的质量为m ,离地面的高度为h ,卫星做匀速圆周运动,已知地球半径为R ,地球表面重力加速度为g ,求: (1)卫星受到的向心力的大小 (2)卫星的速率 (3)卫星环绕地球运行的周期 4.2007年10月24日,中国首颗探月卫星“嫦娥一号”从西昌卫星发射中心发射升空,11月26日,中国第一幅月图完美亮相,中国首次月球探测工程取得圆满成功.我国将在2017年前后发射一颗返回式月球软着陆器,进行首次月球样品自动取样并安全返回地球。假设探月宇航员站在月球表面一斜坡上的M 点,并沿水平方向以初速度v 0抛出一个质量为m 的小球,测得小球经时间t 落到斜坡 上另一点N ,斜面的倾角为 ,已知月球半径为R ,月球的质量分布均匀,万有引力常量为G ,求: (1)月球表面的重力加速度/g ; (2)人造卫星绕月球做匀速圆周运动的最大速度.
5、我国发射的“嫦娥一号”探月卫星沿近似于圆形的轨道绕月飞行。设卫星距月球表面的高度为h ,做匀速圆周运动的周期为T 。已知月球半径为R ,引力常 量为G ,球的体积公式343 V R π=。求: (1)月球的质量M ; (2)月球表面的重力加速度g 月; (3)月球的密度ρ。 6、我国通信卫星的研制始于70年代331卫星通信工程的实施,到1984年4月,我国第一颗同步通信卫星发射成功并投入使用,标志着我国通信卫星从研制转入实用阶段.现正在逐步建立同步卫星与“伽利略计划”等中低轨道卫星等构成的卫星通信系统. (1)若已知地球的平均半径为R 0,自转周期为T 0,地表的重力加速度为g ,试求同步卫星的轨道半径R ; (2)有一颗与上述同步卫星在同一轨道平面的低轨道卫星,自西向东绕地球运行,其运行半径为同步轨道半径R 的四分之一,试求该卫星的周期T 是多少? (计算结果只能用题中已知物理量的字母表示) 7、据中国月球探测计划的有关负责人披露,未来几年如果顺利实现把宇航员送入太空的目标,中国可望在2010年以前完成首次月球探测.一位勤于思考的同学为探月宇航员设计了如下实验:在距月球表面高h 处以初速度v0水平抛出一个物体,然后测量该平抛物体的水平位移为x ,通过查阅资料知道月球的半径为R,引力常量为G ,若物体只受月球引力的作用,请你求出: (1)月球表面的重力加速度; (2)月球的质量; (3)环绕月球表面运动的宇宙飞船的速率是多少?
高中化学 化学反应速率的图像题选修4
化学反应速率的图像题 高考频度:★★★★☆难易程度:★★★☆☆ 根据vt图分析外界条件改变对可逆反应A(g)+3B(g) 2C(g) ΔH<0的影响。该反应的速率与时间的关系如图所示: 可见在t1、t3、t5、t7时反应都达到平衡,如果t2、t4、t6、t8时都只改变了一个反应条件,则下列对t2、t4、t6、t8时改变条件的判断正确的是 A.使用了催化剂、增大压强、减小反应物浓度、降低温度 B.升高温度、减小压强、减小反应物浓度、使用了催化剂 C.增大反应物浓度、使用了催化剂、减小压强、升高温度 D.升高温度、减小压强、增大反应物浓度、使用了催化剂 【参考答案】D 【题后反思】从“断点”入手突破改变的条件:可逆反应达到平衡后,若某一时刻外界条件发生改变,可能使vt图像的曲线出现不连续的情况,即出现“断点”。根据“断点”前后的速率大小,即可对外界条件的变化作出判断。如N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,其反应速率与时间关系如图所示:
则t2时刻改变的条件是升高温度而不是增大压强。原因是t2时刻出现“断点”,且v′(正)、v′(逆)均增大,故改变的条件应从“升高温度”或“增大压强”两方面分析,又因 v′(逆)>v′(正),平衡逆向移动,故改变的外界条件是升高温度。 化学反应速率的两类图像分析 1.物质的量(或物质的量浓度)—时间图像 物质的量(或物质的量浓度)—时间图像主要反映了反应物、生成物的量与反应时间的定量关系。 一般情况下,可以利用该类图像确定化学方程式和计算某物质在某时间段内的平均反应速率。 2.速率—时间图像 (1)放热反应的速率—时间图像 如Zn与足量盐酸的反应,化学反应速率随时间的变化出现如图所示情况。 ①AB段,反应放热,温度升高,v增大 ②BC段,反应物浓度减小,v减小
15:可逆反应三段式法在化学反应速率与平衡计算中的应用
可逆反应三段式在化学反应速率与平衡计算中的应用 【方法概述】 三段式法是化学平衡计算的最基本方法,根据题意和恰当的假设列出起始量、转化量、平衡量,再根 据要求进行相关计算。使用该方法时需注意写在各行中的物理量需保持一致。 【方法应用】 【例】把3molA和 2.5molB混合,充入2L密闭容器中,发生下列反应: 3A(g)+B(g)→xC(g)+2D(g) 经5秒钟反应达到平衡,生成1molD,并测得C的平均反应速率为0.1mol·L-1·s-1,则此反应中B的转 化率为,C的化学计量数x为,A的平衡浓度为。 [分析] 在反应方程式下用“三段式”列出各物质的开始、转化、平衡的量 3A(g)+B(g)→xC(g)+2D(g) 开始物质的量3mol 2.5mol 0 0 转化的物质的量 1.5mol 0.5 mol 1mol 平衡时物质的量 1.5mol 2 mol 1mol 1mol 由D的生成量,根据方程式可计算出A、B的转化量分别为1.5mol、0.5mol。 所以,B的转化率为0.5/2.5=20%。 由题意,D的反应速率为1mol/(2L·5s)=0.1mol·L-1·s-1 根据C、D的平均反应速率之比等于化学计量数比,可得x=2。 根据平衡时A的物质的量,A的平衡浓度为 1.5mol/2L=0.75mol/L。 【及时训练】 1、X、Y、Z 为三种气体,把 amolX 和 bmolY 充入一密闭容器中,发生反应 X+2Y 2Z,达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为() a + b (2a+b)(2a+b) a + b A. 5 ?100% B. 5b ?100% C. 5 ?100% D. 5a ?100% 2、在一定条件下,将 N2、H2混合气体 100mL 通人密闭容器内,达到平衡时,容器内的压强比反应前减小 1/5,有测得此时混合气体的平均相对分子质量为 9。试求: ⑴原混合气中N2的体积是_______毫升; ⑵H2的转化率是_______%。 【参考答案】 1.B 2. 20;37.5
高一物理计算题(含答案)
高一物理计算题 1、在距地面10m高处,以10m/s的速度抛出一质量为1kg的物体,已知物体落地时的速度为16m/s,求:(g取10m/s2)(1)抛出时人对物体做功为多少?(2)飞行过程中物体克服阻力做的功是多少? 2、汽车的质量为4×10 3㎏,额定功率为30kW,运动中阻力大小为车重的0.1倍。汽车在水 平路面上从静止开始以8×10 3 N的牵引力出发,求: (1)经过多长的时间汽车达到额定功率。 (2)汽车达到额定功率后保持功率不变,运动中最大速度多大? (3)汽车加速度为0.5 m/s2 时速度多大? 3、如图2所示,质量为m的物体静止在倾角为θ的斜面上,物体与斜面间的动摩擦因数为μ,在使斜面体向右水平匀速移动距离l,求: (1)摩擦力对物体做的功。 (2)斜面对物体的弹力做的功。 (3)斜面对物体做的功。 图2 4、如图所示,半径R=0.4m的光滑半圆环轨道处于竖直平面内,半圆环与粗糙的水平地面相切于圆环的端点A.一质量m=0.1kg的小球,以初速度v0=7m/s在水平地面上向左作加速度a=3m/s2的匀减速直线运动,运动4.0m后,冲上竖直半圆环,最后小球落在C点。求A、C之间的距离(g=10 m/s2)
5、AB 是竖直平面内的四分之一圆弧轨道,在下端B 与水平直轨道相切,如图所示。一小球自A 点起由静止开始沿轨道下滑。已知圆轨道半径为R ,小球的质量为m ,不计各处摩擦。求 (1)小球运动到B 点时的动能 (2)小球下滑到距水平轨道的高度为1 2 R 时的速度大小 (3)小球经过圆弧轨道的B 点和水平轨道的C 点时, 所受轨道支持力N B 、N C 各是多大? 6、如图所示,在光滑水平桌面上有一辆质量为M 的小车,小车与绳子的一端相连,绳子另一端通过滑轮吊一个质量为m 的砝码,砝码离地h 高。若把小车静止开始释放,则在砝码着地瞬间,求:(1)小车的速度大小。 (2)在此过程中,绳子拉力对小车所做的功为多少? 7、如图,斜面倾角30θ=?,另一边与地面垂直,高为H ,斜面顶点有一个定滑轮,物块A 和B 的质量分别为1m 和2m ,通过一根不可伸长的细线连结并跨过定滑轮,开始时两物块都位于距地面的垂直距离为1 2 H 的位置上,释放两物块后,A 沿斜面无摩擦地上滑,B 沿斜面 的竖直边下落,且落地后不反弹。若物块A 恰好能到达斜面 的顶点,试求1m 和2m 的比值。(滑轮质量、半径及摩擦均忽略) O m A B C R A B H 2 30?
化学反应速率及平衡图像专题训练
2. C% C% T2P2 T1P2 P1P2 T1P1 O t O t (4)(5) (1)p1________p2(2)p1________p2(3)p1_______p2 +_______q m n +______q +______q m n m n (4)p1_________p2,(5)T1与T2大小__________ m n +__________q△H________0 +_______q m n
N M t 1 t 2 t 3 3. ) (\ % ) (/p T C T p O (1) C% T 105 P a 107 P a (2) O C% P 100 ℃500 ℃ (1)△H _________0 (2)△H _________0 m n +________q m n +________q 4. []C t →(如图24—7) 此反应是从何物质开始的:____________; t 2时改变的条件是:____________________。 5. n t →(如图24—8) 则用A 、B 表示的化学方程式是:_______________________。 6. 如m =3,n =1,q =2,试作出C 分解时v 正随时间的变化曲线:(2C 3A +B ) 7. 读图24—9,写出用A 、B 表示的化学方程式。 二、练习 1.在一定温度下,容器内某一反应中M 、N 的物质的量随着反应时间变 化的曲线如图所示,下列表述中正确的是( ) A 、反应的化学方程式为:2M N B 、t 2时,正逆反应速率相等,达到平衡 C 、t 3时, 正反应速率大于逆反应速率 D 、t 1时,N 的浓度是M 浓度的2倍 2.对达到平衡的可逆反应X+Y W+Z ,增大压强则正、逆反应速度(v )的变化如下图,分析可知X ,Y ,Z ,W 的聚集状态正确的是( ) A B C t 1 t 2 t 图24—7 n 1.0 . 0.8 0.6 0.6 0.4 0.2 O 图24—8 t C B A α αA αB O 3 图24—9 n A B
化学反应速率的计算方法归纳
化学反应速率的计算方法归纳 化学反应速率的相关计算,是化学计算中的一类重要问题,常以选择题、填空题得形式出现在各类试题中,也是高考考查的一个重要知识点。本文针对化学反应速率计算题的类型进行归纳总结。 1.根据化学反应速率的定义计算公式: 公式:V=△C/t 【例1】在密闭容器中,合成氨反应N2 + 3H2→2NH3,开始时N2浓度8mol/L,H2浓度20mol/L,5min后N2浓度变为6mol/L,求该反应的化学反应速率。 解:用N2浓度变化表示: V(N2)=△C/t =(8mol/L- 6mol/L)/ 5min =0.4 mol/(L·min) 用H2浓度变化表示: V(H2)= 0.4 mol/(L·min) × 3=1.2mol/(L·min); 用NH3浓度变化表示: V(NH3)= 0.4 mol/(L·min) × 2= 0.8mol/(L·min) ; 2.根据化学计量数之比,计算反应速率: 在同一个反应中,各物质的反应速率之比等于方程式中的系数比。对于反应来说,则有。 【例2】反应4NH3+5O24NO+6H2O在5 L 密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol,则此反应的平均速率(X)(表示反应物的消耗速率或生成物的生成速率)为 A. (O2)=0.01 mol·L-1·s-1 B. (NO)=0.008 mol·L-1·s-1 C. (H2O)=0.003 mol·L-1·s-1 D. (NH3)=0.002 mol·L-1·s-1 解析:反应的平均速率是指单位时间内某物质浓度的变化量。已知容器体积为5 L,时间半分钟即30 s,NO的物质的量(变化量)为0.3 mol,则c(NO)
高中物理磁场经典计算题训练 人教版
高中物理磁场经典计算题训练(一) 1.弹性挡板围成边长为L = 100cm 的正方形abcd ,固定在光滑的水平面上,匀强磁场竖直向下,磁感应强度为B = 0.5T ,如图所示. 质量为m =2×10-4kg 、带电量为q =4×10-3C 的小球,从cd 边中点的小孔P 处以某一速度v 垂直于cd 边和磁场方向射入,以后小球与挡板的碰撞过程中没有能量损失. (1)为使小球在最短的时间内从P 点垂直于dc 射出来,小球入射的速度v 1是多少? (2)若小球以v 2 = 1 m/s 的速度入射,则需经过多少时间才能由P 点出来? 2. 如图所示, 在区域足够大空间中充满磁感应强度大小为B 的匀强磁场,其方向垂直于纸面向里.在纸面内固定放置一绝缘材料制成的边长为L 的等边三角形框架DEF , DE 中点S 处有一粒子发射源,发射粒子的方向皆在图中截面内且垂直于DE 边向下,如图(a )所示.发射粒子的电量为+q ,质量为m ,但速度v 有各种不同的数值.若这些粒子与三角形框架碰撞时均无能量损失,并要求每一次碰撞时速度方向垂直于被碰的边.试求: (1)带电粒子的速度v 为多大时,能够打到E 点? (2)为使S 点发出的粒子最终又回到S 点,且运动时间最短,v 应为多大?最短时间为多少? (3)若磁场是半径为a 的圆柱形区域,如图(b )所示(图中圆为其横截面),圆柱的轴线通过等边三角形的中心O ,且a =)10 1 33( L .要使S 点发出的粒子最终又回到S 点,带电粒子速度v 的大小应取哪些数值? 3.在直径为d 的圆形区域内存在匀强磁场,磁场方向垂直于圆面指向纸外.一电荷量为q , 质量为m 的粒子,从磁场区域的一条直径AC 上的A 点射入磁场,其速度大小为v 0,方向与AC 成α.若此粒子恰好能打在磁场区域圆周上D 点,AD 与AC 的夹角为β,如图所示.求该匀强磁场的磁感强度B 的大小. a b c d A C F D (a ) (b )
第三章化学反应速率和化学平衡答案
第三章 化学反应速率和化学平衡 习题3-1 什么是反应的速率常数?它的大小与浓度、温度、催化剂等因素有什么关系? 答:反应的速率大都可以表示为与反应物浓度方次的乘积成正比: υ=k·c α(A)·c β(B),式中比例常数k 就是速率常数。速率常数在数值上等于反应物浓度均为1 mol·L -1时的反应速率。k 的大小与反应物浓度无关,改变温度或使用催化剂会使速率常数k 的数值发生变化。 习题 3-2 什么是活化能? 答:Arrhenius 总结了大量实验事实,提出一个经验公式:速率常数k 的对数与1/T 有线形关系:C T R E k a +?-=1ln 式中E a 就是活化能,它表示活化分子具有的最低能量与反应分 子平均能量之差。 习题3-3 什么是催化剂?其特点有哪些? 答:某些物质可以改变化学反应的速率,它们就是催化剂。催化剂参与反应,改变反应历程,降低反应活化能。催化剂不改变反应体系的热力学状态,使用催化剂同样影响正、逆反应的速率。不影响化学平衡,只能缩短达到平衡的时间。 习题3-4 NOCl 分解反应为2NOCl→2NO+Cl 2实验测得NOCl 的浓度与时间的关系如下: t/s 0 10 20 30 40 50 c (NOCl )/mol·L -1 求各时间段内反应的平均速率;用作图法求t =25s 时的瞬时速率。 解:t=0-10s 时,10 42 .100.2-= ??= t c υ= ·L -1·s -1 t=10-20s 时,102099 .042.1--= ??=t c υ= ·L -1·s -1 t=20-30s 时,203071 .099.0--= ??=t c υ= ·L -1·s -1 t=30-40s 时,304056 .071.0--= ??=t c υ= ·L -1·s -1 t=40-50s 时,40 5048.056.0--=??=t c υ= ·L -1·s -1 作图法略。 习题3-5 660K 时反应2NO + O 2→2NO 2 ,NO 和O 2的初始浓度c (NO )和c (O 2)及反应的初始速率υ的实验数据: c (NO )/mol·L -1 c (O 2)/mol·L -1 υ/mol·L -1·s -1
化学反应速率化学平衡图像题精选精练
专题:化学反应速率化学平衡图像题精选精练(64题) A组基础训练型 1.右图中的曲线是在其他条件一定时反应:2NO(g)+O2(g)2NO2(g)(正反 应放热)中NO的最大转化率与温度的关系。图上标有A、B、C、D、E五点,其中表 示未达到平衡状态,且v正>v逆的点是 A A或E B C C B D D 2.有如下的可逆反应:X(g)+2Y(g)2Z(g)现将X和Y以1︰2的体积比混 合在密闭容器中,加压到3×107Pa,达到平衡后,已知平衡状态时反应物的总 物质的量和生成物的总物质的量相等时,对应图中坐标上的温度是 A 100℃ B 200℃ C 300℃ D 不能确定 3.在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应, 平衡后测得X,Y的转化率与起始时两物质的物质的量之比n x/n y的关系如图所 示,则X,Y的反应方程式可表示为 A 2X+Y3Z B 3X+2Y2Z C X+3Y Z D 3X+Y Z 4.在A(g)+B(g)=C(g)+D(g)的反应体系中,C的百分含量和时间 的关系如图所示,若反应分别在400℃和100℃下进行,所得曲线分别为Q与P,则 正反应是放热反应的图为 A B C D 5.可逆反应aX(g)+bY(g)cZ(g)在一定温度下的一密闭容 器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)-时间(t)图 象如右图。则下列说法中正确的是 A 若a+b=c,则t0时只能是增大了容器的压强 B 若a+b=c,则t0时只能是加入了催化剂 C 若a+b≠c,则t0时只能是增大了容器的压强 D 若a+b≠c,则t0时只能是加入了催化剂 6.现有可逆反应A(g)+2B(g)n C(g)(正反应放热),在相同温度、 不同压强时,A的转化率跟反应时间(t)的关系如右图所示,其中结论正确的 是 A p1>p2,n>3 B p1<p2,n>3 C p1<p2,n<3 D p1>p2,n=3 7.在容积不变的密闭容器中,一定条件下进行如下反应: NO(g)+CO(g)=0.5N2(g)+CO2(g);ΔH=-373.2 kJ/mol。 右图曲线a表示该反应过程中,NO的转化率与反应时间的关系。若改 变起始条件,使反应过程按照曲线b进行,可采取的措施是 A 加催化剂 B 向密闭容器中加入氩气 C 降低温度 D 增大反应物中NO的浓度 8.下图表示反应A(气)+B(气)nC(气)(正反应放热)在 不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。 下列有关叙述正确的是
化学反应速率的概念及计算
化学反应速率的概念及计算 1.表示方法 通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。 2.数学表达式及单位 v =Δc Δt ,单位为mol·L -1·min -1或mol·L -1·s -1。 3.化学反应速率与化学计量数的关系 同一反应在同一时间内,用不同物质来表示的反应速率可能不同,但反应速率的数值之比等于这些物质在化学方程式中的化学计量数之比。 如在反应a A(g)+b B(g) c C(g)+ d D(g)中,存在v (A)∶v (B)∶v (C)∶v (D)=a ∶b ∶c ∶d (1)对于任何化学反应来说,反应速率越大,反应现象越明显(×) (2)对于任何化学反应来说,都必须用单位时间内反应物或生成物浓度的变化量来表示化学反应速率(×) 解析 对于一些化学反应也可以用单位时间内某物质的质量、物质的量、体积、压强的变化量来表示化学反应速率。 (3)单位时间内反应物浓度的变化量表示正反应速率,生成物浓度的变化量表示逆反应速率(×) (4)化学反应速率为0.8 mol·L - 1·s - 1是指1 s 时某物质的浓度为0.8 mol·L - 1(×) (5)同一化学反应,相同条件下用不同物质表示的反应速率,其数值可能不同,但表示的意义相同(√) (6)同一化学反应,相同条件下用不同物质表示的反应速率,数值越大,表示化学反应速率越快(×) 题组一 化学反应速率的大小比较 1.(2018·郑州质检)对于可逆反应A(g)+3B(s)2C(g)+2D(g),在不同条件下的化学反应速 率如下,其中表示的反应速率最快的是( ) A.v (A)=0.5 mol·L - 1·min - 1 B.v (B)=1.2 mol·L - 1·s - 1 C.v (D)=0.4 mol·L - 1·min - 1 D.v (C)=0.1 mol·L - 1·s - 1 答案 D
化学反应速率、化学平衡图像专题练习
化学反应速率、化学平衡图像专题练习 一、ν-t图像或c-t图像 1. ν-t图像:分清正逆反应,分清各因素(浓度、温度、压强、催化剂)对反应速率和平衡移动的影响。 【练习1】对于反应2SO2(g)+O2(g) 2SO3(g) △H<0,填写改变的条件及平衡移动的方向。 t1时,, 平衡向移动。 t2时,, 平衡向移动。 t3时,, 平衡向移动。 t4时,, 平衡向移动。 小结:改变条件,图像一点保持连续;改 变,两点突变,_____________使正逆反应速率同等程度的增大而平衡不移动。 【练习2】对达到平衡状态的可逆反应X+Y Z+W,在其他条件不变的情况下,增大压强,反应速率变化如右图所示,则图像中关于X、Y、Z、W四种物质的聚集状态为( ) A.Z、W均为气体,X、Y中有一种是气体 B.Z、W中有一种是气体,X、Y皆非气体 C.X、Y、Z、W皆非气体 D.X、Y均为气体,Z、W中有一种为气体 【练习3】在密闭容器,一定条件下进行反应, mA(g)+nB(g) pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,变化过程均如右图所示,则 对该反应叙述正确的是 A.正反应是吸热反应B.逆反应是吸热反应 C.m+n>p+q D.m+n 1、(7分)一个静止在水平面上得物体,质量为2kg,受水平拉力F=6N得作用从静止开始 运动,已知物体与平面间得动摩擦因数为0、1,g取10 m/s2,则: (1)试画出木块得受力分析图; (2)物体2s末得速度大小就是多少? (3)物体在2s内得位移大小就是多少? 2、(8分)甲车以加速度3m/s2由静止开始做匀加速直线运动,乙车落后2s在同一地点由静 止开始,以加速度4m/s2做匀加速直线运动,两车得运动方向相同,则: (1)在乙车追上甲车之前,两车距离得最大值就是多少? (2)乙车出发后经多长时间可追上甲车?此时它们离开出发点多远? 3、(9分)质量为2kg得物体在水平推力F得作用下沿水平面做直线运动,一段时间后撤去F, 其运动得v—t图象如图所示。g取10 m/s2,则: (1)物体与水平面间得动摩擦因数就是多少? (2)水平推力F得大小为多少? (3)0~10s内物体运动位移得大小就是多少? 4、(8分)一辆汽车由静止开始,前10s内以3m/s2得加速度做匀加速直线运动。求: (1)汽车在10s末得速度大小v; (2)汽车在前10s内得位移大小x 5、(10分)如图所示,一质量m = 2、0kg得物块,在拉力F=12、0N得作用下,从静止开始 沿水平面做匀加速直线运动,在2、0s内物块运动得距离为8、0米。已知拉力F与水平方向得夹角θ= 37o,sin37o= 0、6,cos37o= 0、8。求: (1)物块运动得加速度大小; (2)物块与水平面间得动摩擦因数。 6、(10分)如图1所示,一物体受到水平推力F得作用,在水平地面上做直线运动。推 力F与速度v随时间t变化得规律如图2所示。求: (1)物体在前6s内得平均速度大小v; (2)物体得质量m。 7、(8分)如图所示,光滑斜面AB与光滑水平面BC平滑连接。斜面AB长度L=3、0m,倾角θ =37°。一小物块在A点由静止释放,先后沿斜面AB与水平面BC运动,接着从C点水平抛出,最后落在水平地面上。已知水平面BC与地面间得高度差h=0、80m。取重力加速度g=10m/s2,sin37°=0、60,cos37°=0、80。求: (1)小物块在斜面AB上运动得加速度大小a; (2)小物块从C点水平抛出到落在地面上,在水平方向上得位移大小x; (3)小物块从C点水平抛出到刚要落地过程中得速度变化量得大小v。 8、(8分)一个做匀加速直线运动得小球,其加速度a=0、5m/s2.某时刻得速度v0=2m/s,从这 一时刻开始计时,求: (1)t=2s时小球速度v得大小; (2)2s内小球通过得距离. 9、(8分)如图所示,光滑水平面上有一个质量m=7、0kg得物体,在F=14N得水平力作用下, 由静止开始沿水平面做匀加速直线运动.求: (1)物体加速度得大小; (2)5、0s内物体通过得距离. 10、(12分)如图所示,倾角θ=37°得粗糙斜面固定在水平面上,质量m=2、0kg得物块(可视 为质点),在沿斜面向上得拉力F作用下,由静止开始从斜面底端沿斜面向上运动.已知拉力F=32N,物块与斜面间得动摩擦因数为μ=0、25,sin37°=0、6,cos37°=0、8,且斜面足够长.求: (1)物块加速度得大小; (2)若在第2、0s末撤去拉力F,物块离斜面底端得最大距离; (3)物块重新回到斜面底端时速度得大小. 1.(09·全国卷Ⅱ·21)一玻璃砖横截面如图所示,其中ABC 为直角三角形(AC 边末画出),AB 为直角边ABC=45°;ADC 为一圆弧,其圆心在BC 边的中点。 此玻璃的折射率为1.5。P 为一贴近玻璃砖放置的、与AB 垂直的光屏。若一束宽 度与AB 边长度相等的平行光从AB 边垂直射入玻璃砖,则 ( ) A. 从BC 边折射出束宽度与BC 边长度相等的平行光 B. 屏上有一亮区,其宽度小于AB 边的长度 C. 屏上有一亮区,其宽度等于AC 边的长度 D. 当屏向远离玻璃砖的方向平行移动时,屏上亮区先逐渐变小然后逐渐变大 2.(09·浙江·18)如图所示,有一束平行于等边三棱镜截面的单色光从空气 射向点,并偏折到F 点,已知入射方向与边的夹角为,、分别为 边、的中点,则( ) A .该棱镜的折射率为 B .光在点发生全反射 C .光从空气进入棱镜,波长变小 D .从点出射的光束与入射到点的光束平行 3.(09·海南物理·18.(1))如图,一透明半圆柱体折射率为,半径为R 、长为L 。一平行光束从半圆柱体的矩形表面垂直射入,从部分柱面有光线射出。球该部分柱面的面积S 。 ∠ABC E AB o 30=θE F AB BC 3F F E 2n = 4.(09·宁夏·3 5.(2))一棱镜的截面为直角三角形ABC,∠A=30o,斜边AB=a。棱镜材料的折射率为n=。在此截面所在的平面内,一条光线以45o的入射角从AC边的中点M 射入棱镜射出的点的位置(不考虑光线沿原来路返回的情况) 5.(08·宁夏·32)一半径为R的1/4球体放置在水平面上,球体由折射率 为3的透明材料制成。现有一束位于过球心O的竖直平面内的光线, 平行于桌面射到球体表面上,折射入球体后再从竖直表面射出,如图所 3R。求出射角。 示。已知入射光线与桌面的距离为2/ 6.(2013山东37(2))如图乙所示,ABCD是一直角梯形棱镜的横截面,位于截面所在平面内的一束光线由O点垂直AD边射入。已知棱镜的折射率n=2,AB=BC=8cm,OA=2cm,∠OAB=60°。 ①求光线第一次射出棱镜时,出射光线的方向。 ②第一次的出射点距C cm。 化学反应速率的表达和计算 ————————————————————————————————作者:————————————————————————————————日期: 化学反应速率的表达和计算 适用学科化学适用年级高二适用区域新课标本讲时长(分钟)60 知识点 ?化学反应速率的概念 ?反应速率的表示方法及 简单计算 速率大小的比较 化学反应速率图像的分析方法 教学目标知识与技能 了解化学反应速率的含义 理解化学反应速率的表达式及其简单计算 了解化学反应速率的测量方法 过程与方法 通过学习化学反应速率的测量方法,培养设计实验的能力 情感态度与价值观 通过对化学反应速率的学习,感悟其在生产、生活和科学研究中的作用,提高对化学科学的认识。 教学重难点理解化学反应速率的表达式及其简单计算 教学过程 一、复习预习 1. 必修2关于化学反应速率的概念 2. 必修2关于化学反应速率的表达3.必修2影响化学反应速率的因素 二、知识讲解 考点1:化学反应速率的概念和注意问题 1.化学反应速率的概念:对于反应体系体积不变的化学反应,通常用单位时间内反应物浓度的减少或生成物浓度的增大来表示化学反应速率。 意义:描述化学反应快慢的物理量。 计算公式:v(A)=错误!未定义书签。 单位:mol·L -1 ·min -1 mo l·L -1·s -1 2.理解化学反应速率的表示方法时应注意的几个问题: (1)一般说在反应过程中都不是等速进行的,因此某一时间内的反应速率实际上是这一段时间内的平均速率。 (2)无论浓度的变化是增加还是减少,一般都取正值,所以化学反应速率一般为正值。 (3)不能用固体或纯液体表示化学反应速率,因为固体或纯液体的浓度在化学反应中视为定值。 (4)对于同一个反应来说,用不同的物质来表示该反应的速率时,其数值不同,但每种物质都可以用来表示该反应的快慢。 3.对化学反应速率要注意以下几个问题: (1)物质浓度是物质的量浓度以mol/L 为单位,时间单位通常可用s 、min 、h表示,因此反应速率的与常见单位一般为mol/(l·s)、mol/(l·m on)或m ol/(l·h)。 (2)化学反应速率可用反应体系中一种反应物或生成物浓度的变化来表示,一般是以最容易测定的一种物质表示之,且应标明是什么物质的反应速率。 (3)用不同的物质表示同一时间的反应速率时其数值可能不同,但表达的意义是相同的,各物质表示的反应速率的数值有相互关系,彼此可以根据化学方程式中的各化学计量数进行换算: 对于反应来说,则有。 )()()()(g qD g pc g nB g mA +=+q V p V n V m V D C B A === 高一物理必修1期末综合计算题 1(10分)如图所示,质量为m=10kg的物体,在F=60N水平向右的拉力作用下,由静止开始运 动。设物体与水平面之间的动摩擦因素μ=0.4,求: (1)物体所滑动受摩擦力为多大? (2)物体的加速度为多大? (3)物体在第3s内的位移为多大? 2(10分)某型号的舰载飞机在航空母舰的跑道上加速时,发动机产生的最大加速度为a=5m/s2,所需的起飞速度为v=50m/s,跑道长x=100m。 试通过计算判断,飞机能否靠自身的发动机从 舰上起飞?为了使飞机在开始滑行时就有一 定的初速度,航空母舰装有弹射装置。对于该 型号的舰载机,弹射系统必须使它具有多大的初速度v0? 3(10分)放在水平地面上的物体P的重量为 G P=10N,与P相连的细绳通过光滑的滑轮挂 了一个重物Q拉住物体P,重物Q的重量为 G Q=2N,此时两物体保持静止状态,绳与水平 方向成300角,则物体P受到地面对它的摩擦F1与地面对它的支持力F2各位多大? 4(10分)如图所示, 足球质量为m, 尼龙绳与墙壁 的夹角为θ,求 尼龙绳对足球 的拉力F1和墙壁对足球的支持力F2。5(10分)静止在水平地面上的木块,质量为 m=10kg,受水平恒力F作 用一段时间后撤去该恒力, 物体运动的速度时间图像 如图所示,求: (1)F的大(2)木块与地面间的动摩擦因 素μ v /m/s t/s 0 2 8 4 6 4 F P Q 6(10分)据报载,我国自行设计生产运行速度可达v =150m/s 的磁悬浮飞机。假设“飞机”的总质量m =5t ,沿水平直轨道以a =1m/s 2的加速度匀加速起动至最大速度,忽略一切阻力的影响,求: (1)“飞机”所需的动力F (2)“飞机”起动至最大速度所需的时间t 7(10分)如图所示,质量为m =2.0kg 的物体静止在水平面上,现用F =10N 的水平拉力拉物体,使物体做匀加速直线运动,经t =2.0s 物体的速度增大到v =4.0m/s ,求: (1)物体在此2.0s 内通过的位移 (2)物体与桌面间的动摩擦因素μ 8(10分)如图所示,水平传送带以不变的速度v 向右运动,将工件轻轻放在传送带的左端,由于摩擦力的作用,工件做匀加速运动,经过时间t ,速度变为v ;再经时间2t ,工件到达传送带的右端,求: (1)工件在水平传送带上滑动时的加速度 (2)工件与水平传送带间的动摩擦因素 (3)工件从水平传送带的左端到达右端通过的距离 9 一辆汽车正以s m v /300=的速度在平直路面上行驶,驾驶员突然发现正前方约m 50处有一个障碍物,立即以大小为2 /8s m 的加速度刹车。为了研究汽车经过s 2是否撞上障碍物,甲、乙两位同学根据已知条件作出以 下判断: 甲同学认为汽 车已 撞上障碍物,理由是: 在s 2时间内汽车通过的位移 m m at t v x 5076482 1 2302120>=??+?=+= 乙同学也认为汽车已撞上障碍物,理由是: 在s 2时间内汽车通过的位移 m m a v v x 5025.56) 8(23002-2 2 02>=-?-== 问:以上两位同学的判断是否正确?如果不正确,请指出错误的原因,并作出正确的解答。 v 化学反应速率和化学平衡图像 班别姓名学号1、速率——时间图 此类图像定性揭示了V 正、V 逆 ,对于条件的改变随时间变化的规律,体现了平 衡移动的方向和平衡的特征。认识此类图像的关键:若改变单一物质的浓度,图像是连续的,若改变体系的温度和压强,则图像不连续。对于反应: mA(气)+nB(气)pC(气)+qD(气) +Q,请根据提示完成以下的图像(→表示平衡向正反应方向移动,←表示平衡向逆反应方向移动)。 ( )( )( )(1)增大反应物浓度(2)减少生成物浓度(3)增大生成物浓度 ()( )()(4)减少反应物浓度(5)升高温度(Q>0)(6)降低温度(Q>0) ()() () (7)升高温度(Q<0)(8)降低温度(Q<0)(9)加压(m+n=p+q) ()( )( ) (10)减压(m+n=p+q) (11)加压(m+n>p+q) (12)减压(m+n>p+q) ()()() (13)加压(m+n (1)、该反应的化学方程式; (2)、反应开始至3min末,Y的反应速率为; (3)、该反应是由开始的(正反应、逆反应、正逆么应同时) 3、全程速率—时间图 此类图像的分析要抓住各个阶段的主要矛盾——影响速率的主要因素。如Z n与足量的盐酸反应,反应速率随时间的变化情况如图(17)所示。其中A~B速率变化的原因是;B~C速率变化的原因是。 4、含量(或转化率)—时间—温度(或压强)图 此类图像的分析应注意3个方面的问题: (1)纵坐标表示的意义;即是反应物还是生成物的含量,还是反应物的转化率?(2)达平衡的时间:温度越高(或压强越大),反应的速率越大,达到平衡的时间越短。 (3)平衡线的高低:根据纵坐标的含义与反应方程式的特点(放热或吸热以及反应前后气体分子数的关系)来判断平衡线的高低。 以反应mA(气)+nB(气)pC(气)+qD(气)+Q为例,图示如下: (18)当P一定,则Q (19)当T一定,则m+np+q 化学反应速率练习题及 答案解析 LEKIBM standardization office【IBM5AB- LEKIBMK08- LEKIBM2C】 2-1《化学反应速率》课时练 双基练习 1.反应4A(s)+3B(g)===2C(g)+D(g),经2 min,B的浓度减少 mol/L,对此反应速率的表示不正确的是() A.用A表示的反应速率是 mol/(L·min) B.分别用B、C、D表示反应的速率,其比值是3∶2∶1 C.在2 min内的反应速率,用B表示是 mol/(L·min) D.在这2 min内用B和C表示的反应速率的值都是逐渐减小的 解析:选项A,A为固体,不能用固体或纯液体表示化学反应速率,错误。选项B,用B、C、D表示反应速率之比等于化学方程式中B、C、D的系数之比,正确。选项C,v(B)=错误!= mol/(L·min),正确。选项D,在这2 min内,无论用B还是用C表示,二者的变化量都是逐渐减小的,则反应速率的值也都是逐渐减小的,正确。 答案:A 2.某温度下,浓度都是1 mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得物质的浓度分别为:c(X2)= mol/L,c(Y2)= mol/L,c(Z)= mol/L。则该反应的反应式可表示为() A.X2+2Y22XY2 B.2X2+Y2X2Y C.3X2+Y2===2X3Y D.X2+3Y22XY2 解析:本题考查了化学反应速率之比等于系数之比。首先求出三种物质的物质的量浓度变化值,分别为 mol/L、 mol/L、 mol/L。根据物质的量浓度变化之比等于反应速率之比等于系数之比,即可得系数之比为 3∶1∶2。 答案:C 3.下列说法正确的是() A.化学反应速率通常用单位时间内反应物或生成物的质量变化来表示 B.用不同物质的浓度变化表示同一时间内同一反应的速率时,其数值之比等于反应方程式中对应物质的化学计量数之比 C.化学反应速率的单位由时间单位和浓度单位决定 D.在反应过程中,反应物的浓度逐渐变小,所以用反应物表示的化学反应速率为负值 解析:化学反应速率通常用单位时内反应物或生成物的物质的量浓度的变化来表示,化学反应速率是取单位时间内浓度变化的绝对值,所以都为正值。 答案:B 4.在某一化学反应中,反应物A的浓度在15 s内从 mol/L变成 mol/L,在这15 s内A的化学反应速率为() A. mol/(L·s)B. mol/L C. mol/(L·s) D. mol/L 解析:直接根据速率公式计算; 错误!= mol/(L·s)。高一物理上学期计算题
高中物理光学计算经典习题与答案汇编
化学反应速率的表达和计算
高一物理必修1计算题及答案详解
化学反应速率和化学平衡图像练习题
化学反应速率练习题及答案解析
