第二章第三节大气环境第三课时

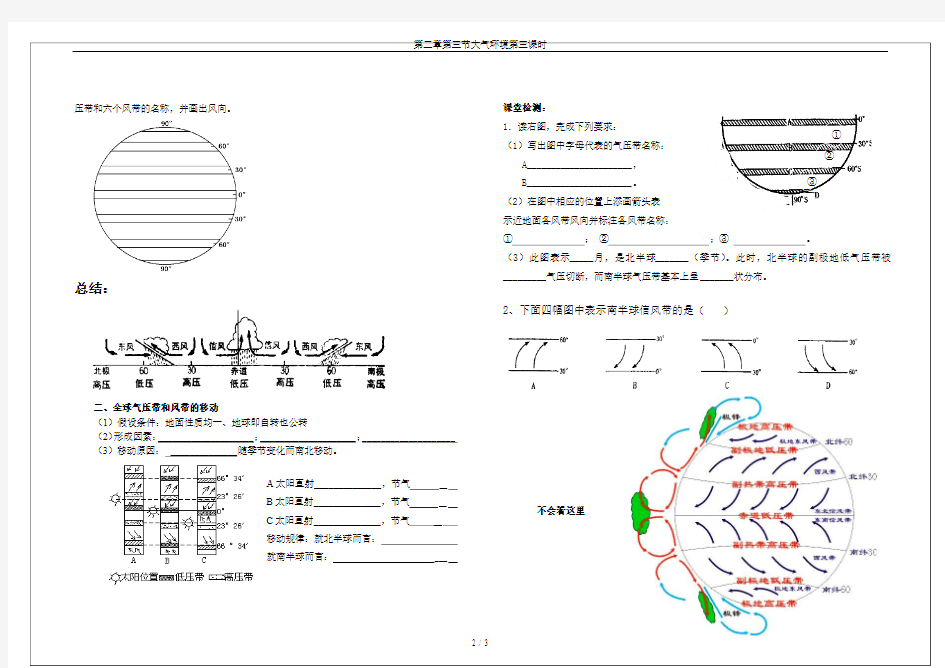
:画出中纬环流
中纬环流:近地面,副热带高压带一部分流向北,与此同时,从(:画出高纬环流
①
②
③
总结:
二、全球气压带和风带的移动
(1)假设条件:地面性质均一、地球即自转也公转
(2)形成因素:____________________;____________________;____________________
(3)移动原因:______________随季节变化而南北移动。
《大气环境化学》重点习题及参考答案
《大气环境化学》重点习题及参考答案 1.大气中有哪些重要污染物?说明其主要来源和消除途径。 环境中的大气污染物种类很多,若按物理状态可分为气态污染物和颗粒物两大类;若按形成过程则可分为一次污染物和二次污染物。按照化学组成还可以分为含硫化合物、含氮化合物、含碳化合物和含卤素化合物。主要按照化学组成讨论大气中的气态污染物主要来源和消除途径如下: (1)含硫化合物 大气中的含硫化合物主要包括:氧硫化碳(COS)、二硫化碳(CS 2 )、二甲基 硫(CH 3) 2 S、硫化氢(H 2 S)、二氧化硫(SO 2 )、三氧化硫(SO 3 )、硫酸(H 2 SO 4 )、 亚硫酸盐(MSO 3)和硫酸盐(MSO 4 )等。大气中的SO 2 (就大城市及其周围地区来 说)主要来源于含硫燃料的燃烧。大气中的SO 2约有50%会转化形成H 2 SO 4 或SO 4 2-, 另外50%可以通过干、湿沉降从大气中消除。H 2 S主要来自动植物机体的腐烂, 即主要由植物机体中的硫酸盐经微生物的厌氧活动还原产生。大气中H 2 S主要的 去除反应为:HO + H 2S → H 2 O + SH。 (2)含氮化合物 大气中存在的含量比较高的氮的氧化物主要包括氧化亚氮(N 2 O)、一氧化氮 (NO)和二氧化氮(NO 2)。主要讨论一氧化氮(NO)和二氧化氮(NO 2 ),用通式 NO x 表示。NO和NO 2 是大气中主要的含氮污染物,它们的人为来源主要是燃料的 燃烧。大气中的NO x 最终将转化为硝酸和硝酸盐微粒经湿沉降和干沉降从大气中去除。其中湿沉降是最主要的消除方式。 (3)含碳化合物 大气中含碳化合物主要包括:一氧化碳(CO)、二氧化碳(CO 2 )以及有机的碳氢化合物(HC)和含氧烃类,如醛、酮、酸等。 CO的天然来源主要包括甲烷的转化、海水中CO的挥发、植物的排放以及森林火灾和农业废弃物焚烧,其中以甲烷的转化最为重要。CO的人为来源主要是在燃料不完全燃烧时产生的。大气中的CO可由以下两种途径去除:土壤吸收(土 壤中生活的细菌能将CO代谢为 CO 2和 CH 4 );与HO自由基反应被氧化为CO 2 。 CO 2 的人为来源主要是来自于矿物燃料的燃烧过程。天然来源主要包括海洋
《 大气环境》教案(湘教版必修)
第三节大气环境(一) 一、课程标准 ●运用图表说明大气受热过程 (1)标准解读 本条以及后两条“标准”关注的对象是自然环境组成要素之一——大气。本条“标准”旨在认识导致大气运动的基本原理,为后面学习大气环流、天气系统以及全球气候变化打下理论基础。 本条“标准”虽然简短,但它要求的内容是比较多的。从有关大气各条“标准”综合来看,可以从以下几方面把握本条“标准”。 第一,作为自然环境组成要素,“标准”中的“大气”是指低层大气,其高度不超过对流层顶。 第二,了解大气受热,需要明确大气的热量来源,即导致大气运动的能量来源。太阳辐射是大气根本的热源,下垫面辐射(包括陆面和海面)是大气直接的热源。 第三,大气受热过程,实际上是太阳辐射、地面辐射和大气辐射之间相互转化的过程。其中,大气温室效应及其作用是需要重点阐述的基本原理。 第四,学习大气受热过程,是为理解大气运动打基础,所以,大气热力环流是需要阐述的另一个基本原理。大气热力环流是大气不均匀受热的结果。大气不均匀受热主要是由太阳辐射的纬度差异和下垫面性质差异引起的。大气不均匀受热是大气运动的主要原因,大气热力环流则是理解许多大气运动类型的理论基础。小到城市热岛环流,大到全球性大气环流,都可以用大气热力环流的原理来解释。 第五,学习和说明大气受热过程,需要借用一些原理示意图,如大气温室效应示意图、大气热力环流形成示意图等。 (2)教学重点 ●大气各垂直分层特点及与人类的关系; ●大气对太阳辐射的削弱作用; ●太阳辐射、地面辐射、大气辐射、大气逆辐射四种辐射之间的关系; ●大气的温室效应。 (3)教学目标 ●搜集资料说一说大气各垂直分层有哪些事物和现象,概括对流层大气与人类的关系。 ●列表比较大气对太阳辐射的削弱作用,并用所学解释实际事例。 ●画出简图说明大气的受热过程,解释大气受热的直接原因。能用简图推导月球表面昼夜温差大的原因。 ●结合温室大棚的实例,分析说明大气是怎样具有保温作用的。尝试写一段文字,表达温室大棚的原理 在农业、建筑、人体保健等方面的应用。 (4)教学方法 ●比较分析法、读图分析法、启发式教学法 二、知识结构(见第二节目标检测后) 三、教学过程 【引入新课】我们学习了地球的宇宙环境之后,知道了地球是宇宙中的一颗既普通又特殊的行星。说地球普通,因为地球具有和其他行星一样的特性,都是物质的和运动的;说地球特殊,则是因为地球是太阳系中唯一有生命物质存在的天体。地球上具有生命物质,其中一个非常重要的原因就是地球有可供生物呼吸的大气。今天我们共同探讨大气环境的一些最基本的特征。 地球的周围包围着的大气是厚厚的,从地面向上,可延伸数千千米的高空。那么,这么高的大气层在垂直方向上有什么变化特点呢? 一、大气的垂直分布(板书)
湘教版高一地理必修一第二章第三节大气环境第3课时教学案
第二章第三节大气环境 第3课时气压带和风带对气候的影响 班级姓名小组________第____号 【学习目标】 1.运用海陆性质差异原理||,解释北半球冬、夏季气压中心的形成和分布||。 2.理解东亚、南亚季风的成因及影响||。 3.举例说明气压带风带及气压中心对气候的影响||。 【重点难点】 1.掌握全球气压带、风带的分布及季节移动规律||,能够运用其分析全球气候类型的成因、分布和特点||。(重点) 2.识记北半球冬、夏季因海陆热力性质差异而形成的气压中心;理解东亚、南亚季风的成因及影响||。(重点) 【学情分析】 学生已经掌握了热力环流以及气压带风带的分布和移动规律||,理解本节内容相对不是很难||,但本节是重点||,需要学生们熟练的掌握||。 【导学流程】 自主学习内容 一、回顾旧知 1、影响大气水平运动的作用力||。 2.三圈环流 (1)低纬环流:位于赤道与__________之间||,形成北半球的__________带和南半球的__________带||。 (2)中纬环流:位于副热带与副极地之间||,形成__________带||。 (3)高纬环流:位于极地与副极地之间||,形成__________带||。 3.全球气压带和风带的移动 1.原因:__________有规律的南北移动||。 2.规律:就北半球来说||,大致是夏季__________||,冬季__________||。南半球则恰好相反||。 二、基础知识感知 (一)气压带和风带对气候的影响 1.气压带、风带季节移动与大气活动中心 (1)成因:海陆热力差异影响到海陆的__________分布||。夏季||,大陆上形成__________;冬季||,大陆上形成__________||。
环境化学答案73006
第一章绪论 4.根据环境化学的任务、内容和特点以及其发展动向,你认为怎样才能学好环境化学这门课程 (1)环境化学的任务、内容、特点:环境化学是在化学科学的传统理论和方法基础上发展起来的,以化学物质在环境中出现而引起的环境问题为研究对象,以解决环境问题为目标的一门新兴学科。环境化学是一门研究有害化学物质在环境介质中的存在、化学特性、行为和效应及其控制的化学原理和方法的科学。它既是环境科学的核心组成部分,也是化学科学的一个新的重要分支。 (2)环境化学的发展动向:国际上较为重视元素的生物地球化学循环及其相互耦合的研究;重视化学品安全评价;重视臭氧层破坏、气候变暖等全球变化问题。我国优先考虑的环境问题中与环境化学密切相关的是:以有机物污染为主的水质污染;以大气颗粒物和二氧化硫为主的城市空气污染;工业有毒有害废弃物和城市垃圾对大气、水和土地的污染等。 (3)学好这门课的观点:环境化学包含大气、水体和土壤环境化学多个分支学科,研究有害化学物质在大气、水体和土壤环境中的来源、存在、化学特性、行为和效应及其控制的化学原理和方法。这就决定了环境化学研究中需要运用现场研究、实验室研究、实验模拟系统研究和计算机模拟研究相结合的系统研究方法,主要以化学方法为主,还要配以物理、生物、地学、气象学等其他学科的方法。因此,要求研究人员具有较广泛的各相关学科的理论知识和实验动手能力。我们在日常学习中应当以开阔的视野,除了环境化学之外,广泛涉猎各相关学科,并注重培养自己的实验操作,如此才可能学好这门课。 5、环境污染物有哪些类别当前世界范围普遍关注的污染物有哪些特征 答:环境污染物的类别:环境污染物按受污染物影响的环境要素可分为大气污染物、水体污染物、土壤污染物等;按污染物的形态,可分为气体污染物、液体污染物和固体污染物;按污染物的性质,可分为化学污染物、物理污染物和生物污染物;按污染物在环境中物理、化学性状的变化,可分为一次污染物和二次污染物(一次污染物称为原生污染物,二次污染物又称为次生污染物)。当前世界范围最关注的化学污染物主要是持久性有机污染物,具有致突变、致癌变和致畸变作用的所谓“三致”化学污染物,以及环境内分泌干扰物。 第二章大气环境化学 1大气的主要层次是如何划分的每个层次具有哪些特点 根据温度随海拔高度的变化情况划分的:对流层气温随着海拔高度的增加而降低,大约每上升100m,温度降低℃、密度大;平流层温度随海拔高度的升高而明显增加、空气没有对流运动,平流运动占优势、空气比对流层稀薄得多、有厚约20km的一层臭氧层;中间层温度随海拔增加迅速降低、空气较稀薄、对流运动非常激烈;热层空气高度电离、更加稀薄、大气温度随海拔高度增加而迅速增加。
示范教案(第三节大气环境第一课时)
第三节大气环境 从容说课 本节教材内容多,容量大,主要介绍了对流层大气的受热过程,全球气压带、风带的分 第一部分:大气的受热过程是本节的重点,是为学习大气的运动和全球的气压带与风带作铺垫的,要求学生了解太阳辐射是地球上最主要的能量来源,大气对太阳辐射的吸收具有选择性,大气对地面起保温作用,并通过小活动,把大气保温作用与温室保温作对比,让学 第二部分:全球气压带和风带的分布、移动,既是本节的重点,也是难点。教学中可利用多媒体来模拟热力环流的形成过程,以此来突破难点,使学生真正理清环流形成的因果关系。关于“大气的水平运动”可通过多媒体演示,让学生观察分析高空和近地面不同受力情况下风向与等压线的关系,在理解了前面内容的基础上,利用多媒体课件来突破全球气压带、 第三部分:气压带和风带对气候的影响,也是本节的重难点之一。引导学生分析海陆分布对大气环流的影响,季风环流是大气环流的重要组成部分,对这部分内容可以利用活动题 第四部分:常见的天气系统,其中天气系统的形成及天气状况是重、难点,教学中可充分运用比较法指导学生,从不同角度对天气系统进行比较,并运用图示和列表对比的方法作 教学重点1. 2. 3. 4. 5. 教学难点1. 2. 3. 4. 教具准备 课时安排5 三维目标 一、知识与技能 1.运用图表分析 2.通过绘制全球气压带、风带分布示意图,了解气压带、风带的形成、分布、移动规律 3. 二、过程与方法 1. 2.通过绘制全球气压带、风带分布示意图,培养学生的动手能力,提高学生的读图和析 3.充分对比,理解概念的含义,如冷锋与暖锋,低压与高压,气旋与反气旋,培养学生 通过对自然现
第三节大气环境第2课时大气运动教案
第2课时大气运动教案 ●教学目标 知识与技能 1.理解热力环流形成,影响大气水平运动的“三力”及其作用下的风向。 2.掌握气旋、反气旋的运动方向。 3.在等压线图上表示实际大气中的风向。 过程与方法 1.通过分析等压线分布图,初步学会绘制气旋、反气旋示意图。 2.初步学会读简单的等压线图。 情感态度与价值观 1.使学生认识大气运动与人们生活和生产活动的关系,明确人类活动应如何趋利避害。 2.能将所学知识运用于实际,服务于社会。 ●教学重点 1.理解热力环流的形成。 2.理解大气的水平运动——风。 3.掌握气旋、反气旋的运动方向。 ●教学难点 1.热力环流的动态过程引起的等压面的弯曲方向。 2.影响大气水平运动的“三力”及其作用下的风向。 ●教学方法 1.实验法:结合本课的活动,课前安排学生实验观察证明热力环流。 2.利用多媒体课件演示气旋、反气旋的动态情况,帮助学生理解它们的运动。 3.讲述法:详细讲述分别受三种力作用下的风向。 ●教具准备 投影仪(片)、多媒体、补充资料及一些小实验用具如烧杯、燃纸片等工具。 ●课时安排 一课时 ●教学过程 [导入新课]
地球周围的大气好像一部巨大的机器,日夜不停地运动着。它的运动形式多种多样,范围有大有小,正是这种不停的大气运动,形成了地球上不同地区的天气和气候。大气为什么会运动,以及怎样运动这是我们这一节课要学习的内容。下面我们就来学习第三节的内容。 [讲授新课] 一、大气的运动(板书) 本课的引言部分可以看做是整个大气运动相关内容的前言部分。请同学们先阅读课本引言,分析一下引言概括了大气运动的哪些内容。 大气时刻不停地运动着。大气中热量和水汽的输送,以及一切天气变化,都是通过大气运动实现的。这说明了大气运动的重要性。 其次,大气运动的能量来源于太阳辐射。由于各纬度获得的太阳辐射能多少不均,造成高低纬度间温度的差异,这是引起大气运动的根本原因。 再次,大气运动的形式有水平运动和垂直运动之分。其中,大气的垂直运动表现为气流的上升或气流的下沉;大气的水平运动即是风。 (承转)同学们,课前安排大家观察烧一锅开水时,锅里沸腾的开水,中间水向上冒,锅边水往下沉。点燃一小堆纸时,纸片和灰烬从火堆上升,在空中流向四周,又从火堆四周下沉,然后又进入火堆。以上这两种现象都是由于中间和四周受热不均而形成的热力环流现象。那么,大气的运动情况到底是怎样的呢?我们先学习第一部分内容。 (一)、热力环流(板书) 由于地面冷热不均而形成的空气环流,称为热力环流。它是大气运动的一种最简单的形式。 下面我们就这两幅图一起来分析一下热力环流的动态过程。 (投影片展示) (1)若A、B、C三地(如左上图)受热均匀,则①三地气温相同;②三地气压相同;③三地气压随高度递减的规律相同;④三地上空同一水平面上各点的气压相等,等压面为互相平行的水平面。
西北大学环境化学习题
《环境化学》 第一章绪论 一、填空 1、造成环境污染的因素有物理、化学和生物的三方面,其中化学物质引起的约占________。 2、污染物的性质和环境化学行为取决于它们的和在环境中的。 3、环境中污染物的迁移主要有、和三种方式。 4、人为污染源可分为____________、____________、____________、和____________。 二、选择题 1、属于环境化学效应的是 A热岛效应 B温室效应 C土壤的盐碱化 D噪声 2、五十年代日本出现的痛痛病是由______污染水体后引起的。 A Cd B Hg C Pb D As 3、五十年代日本出现的水俣病是由______污染水体后引起的。 A Cd B Hg C Pb D As 三、问答题 1、环境中主要的化学污染物有哪些? 2、举例简述污染物在环境各圈的迁移转化过程。 第二章大气环境化学 一、填空 1、大气中的NO2可以转化成、和。 2、碳氢化合物是大气中的重要污染物,是形成烟雾的主要参与者。 3、大气颗粒物的去除与颗粒物的和有关,去除方式有 和。 4、当今世界上最引人瞩目的几个环境问题_________、__________、__________等是由大气 污染所引起的。 5、许多大气污染事件都与逆温现象有关,逆温可分为________、________、________。 6、大气中的重要自由基有、、、、等。 7、温室气体主要包括、、、、、等,其中 对温室效应贡献最大的是。 8、大气的扩散能力主要受__________和__________的影响。 9、污染物在大气中扩散取决于三个因素,即、、。 10、根据温度垂直分布可将大气圈分为对流层、平流层、________、热层和逃逸层。 11、硫酸型烟雾为型烟雾,而光化学烟雾为型烟雾。 12、大气中CH4主要来自________、________、_________的排放。
第二章 大气环境化学(3)
第二章大气环境化学(3) 第三节大气中污染物的转化 二、光化学反应基础 1、光化学反应 一个原子、分子、自由基或离子吸收一个光子所引发的反应,称为光化学反应。光化学反应的起始反应(初级过程)是: A + hν →A* (2-1) 式中A*为A的激发态,激发态物种A*进一步发生下列各种过程。 光解(离)过程:A* → B1 + B2+…(2-2) 直接反应:A* + B → C1+C2+… (2-3) 辐射跃迁:A* → A + hν(荧光、磷光) (2-4) 无辐射跃迁(碰撞失活):A* + M → A+M (2-5) 其中(2-2)、(2-3)为光化学过程,(2-4)、(2-5)为光物理过程。对于大气环境化学来说,光化学过程最重要的是受激分子会在激发态通过反应而产生新的物种。 初级光化学过程包括光解离过程、分子内重排等。分子吸收光后可解离产生原子、自由基等,它们可通过次级过程进行热反应;光解产生的自由基及原子往往是大气中·OH、HO2·和RO·等的重要来源;对流层和平流层大气中的主要化学反应都与这些自由基或原子的反应有关。 次级过程是指初级过程中反应物、生成物之间进一步发生的反应。例如,H2和Cl2混合物光解,发生链式反应: Cl2 + hν→2Cl· Cl· + H2→HCl + H· H· + Cl2→HCl + Cl· 2Cl·→Cl2 2、光化学定律 1)格鲁塞斯(Grotthus)与德雷伯(Drapper)提出了光化学第一定律:只有被分子吸收的光,才能有效地引起分子的化学变化。 2)爱因斯坦(Einstein)光化学第二定律:在光化学反应的初级过程中,被活化的分子数(或原子数)等于吸收光的量子数,或者说分子对光的吸收是单光子过程,即光化学反应的初级过程是由分子吸收光子开始的。 E=hν=hC/λ E = hνN0 = N0hC/λ 式中:λ为光量子的波长;h为普朗克常数,6.626×10-34J·s/光量子;C为光速,2.9979×1010 cm/s;N0为阿伏加德罗常数,6.022×1023/mol;代入上式得: E= 119.62 ×106/λ
第三节大气环境第3课时全球气压带和风带教案
第3课时全球气压带和风带教案 【教学目标】 知识与技能 1.理解三圈环流与气压带风带的形成与模式。 2.了解1月、7月北半球海陆气压形势。 3.掌握季风环流是大气环流的重要组成部分。 4.理解气压带和风带对气候的影响。 过程与方法 1.运用对比、类比方法,在三圈环流示意图上理解、识记三圈环流、七个气压带、六 个风带的特点。 2.读“亚洲季风”图,会分析季风的形成,特别是东亚、南亚季风形成的区别。 3.读1月、7月海平面等压线图,分析北半球海陆气压形势。 情感态度与价值观 1.通过三圈环流的学习,了解大气环流对全球的热量平衡和水量平衡的重要作用,同时也 影响各地天气变化和气候的形成,认识地理要素间相互影响、相互渗透、相互制约的辩证关系。 2.理解我国的气候深受季风环流的影响,从而能将所学知识用于实际,服务于社会。【教学重点】 1.近地面气压带和风带的名称、成因、对气候的影响。 2.亚洲和太平洋地区受海陆热力差异形成的高低压中心名称、所在位置、成因及冬夏 季风的关系。 3.气压带和风带对气候的影响。 【教学难点】 1.三圈环流形成的动态过程。 2.季风环流形成,东亚与南亚季风的区别。 【教学方法】 1.启发式教学,采用图文结合的方式,一边引导启发,一边画板图和读图讲授有助于学生理解本课难点。
2.讲授要循序渐进、前后呼应、步步深入,提高学生认识问题、分析问题的能力,最终促使学生对本节课知识要点的理解和有效地掌握。 【教具准备】 投影仪(片)、自绘或多媒体制作全球气压带、风带分布图及其运动图、季风图等。【课时安排】 一课时 【教学过程】 [导入新课] 大气时刻不停地运动着,运动的形式和规模复杂多样,既有尺度很小的局地性运动,像上节课我们所学内容可以说是小尺度的大气运动,也有规模很大的全球性运动。那么,全球性的大气运动又是怎么样运动?这就是今天这节课我们要学习的内容。 [讲授新课] 一、全球性大气环流(板书) 具有全球性的有规律的大气运动,通常称为大气环流。大气环流是大气运动的一种主要形式,它使高低纬度之间,海陆之间的热量和水汽得到交换,调整了全球的水热分布,对全球的热量平衡和水量平衡有重要作用,也是各地天气变化和气候形成的重要因素。本节课主要讲述最具典型意义的两种环流形式:三圈环流和季风环流。下面我们先来学习三圈环流。 (一)全球气压带和风带的分布(板书) 为了简化起见,假设大气是在均匀的地球表面上运动的,而且不考虑地球自转的影响,此时,引起大气运动的因素是高低纬度间的受热不均。因而在终年炎热的赤道地区,大气受热膨胀上升;在终年严寒的两极地区,大气冷却收缩下沉。这样,在高空,赤道形成高气压,气压梯度力的方向指向极地,大气由赤道上空流向两极上空。在近面,赤道地区形成低气压,两极形成高气压,气压梯度力 的方向指向赤道,大气由两极流回赤道。因此,在北半球, 赤道和极地之间形成了单圈闭合环流。
2021学年高中化学第二章第三节第3课时物质的量浓度课后训练含解析人教版必修一.docx
第3课时物质的量浓度 合格考过关检验 1.从100 mL 4 mol·L-1的KOH溶液中取出5 mL,这5 mL溶液中K+的浓度为( )。 A.2 mol·L-1 B.0.2 mol·L-1 C.4 mol·L-1 D.0.4 mol·L-1 答案C 解析这5mL溶液中K+的浓度与KOH的浓度相等,均为4mol·L-1,故选C。 2.下列溶液中,c(Cl-)与50 mL 1 mol·L-1的AlCl3溶液中c(Cl-)相等的是( )。 A.150 mL 1 mol·L-1的NaCl溶液 B.75 mL 2 mol·L-1的NH4Cl溶液 C.150 mL 3 mol·L-1的KCl溶液 D.75 mL 1 mol·L-1的BaCl2溶液 答案C 3.下列说法中正确的是( )。 A.40 g NaOH溶于水所得1 L溶液的浓度为1 mol·L-1 B.1 mol·L-1的Na2CO3溶液中Na+的浓度为1 mol·L-1 C.从1 L 0.1 mol·L-1的NaCl溶液中取出0.1 L溶液,则NaCl的浓度变为0.01 mol·L-1 D.1 L 0.2 mol·L-1的Na2SO4溶液中,Na+的物质的量为0.2 mol 答案A 解析40gNaOH的物质的量为1mol,溶液体积为1L,由公式得c=n n =1mol 1L =1mol·L-1,A项正 确;Na2CO3溶液的浓度为1mol·L-1,则Na+浓度为2mol·L-1,B项错误;原溶液浓度为0.1mol·L-1,则取出的0.1L溶液和剩余的0.9L溶液的浓度都为0.1mol·L-1,C项错 误;n(Na2SO4)=cV=0.2mol·L-1×1L=0.2mol,则n(Na+)=2n(Na2SO4)=2×0.2mol=0.4mol,D项错误。 4.容量瓶是用来配制一定物质的量浓度溶液的定量仪器,其上标有:①温度②浓度③容量 ④压强⑤刻度线⑥酸式或碱式这六项中的( )。 A.②④⑥ B.③⑤⑥ C.①②④ D.①③⑤ 答案D
(整理)大气环境化学.
第二章大气环境化学 本章重点:1 污染物在大气中迁移过程 2 光化学烟雾和硫酸型烟雾的形成过程和机理 第一节大气中污染物的转移 大气层简介 一、大气温度层结 对流层(troposphere) :(0km-17km)空气具有强烈的对流(垂直),集中了大气中90.9%天气现象,污染物排放直接进入对流层 平流层(stratosphere):17-55km气体状态稳定,垂直对流很小,大气透明度高 中间层(mesosphere):55-85Km气温下降达-92℃,垂直运动剧烈,发生光化学反应。 热层(thermsphere):800Km空气密度很小,温度升高到1000k,电离层 逸散层:>800Km 气体分子受地球引力极小,因而大气质点会不断向星际空间逃逸。 出示大图: 图1 大气温度的垂直分布 图2 大气密度的垂直分布 大气垂直递减率 二、辐射逆温层 三、绝热过程与干绝热过程 四、大气稳定度的判定 五、影响大气污染物迁移的因素 1、风和大气湍流的影响 风—使污染物向下风向扩散 湍流—使污染物向各风向扩散 浓度梯度—使污染物发生质量扩散 2、天气形势和地理地势的影响
第二节大气中污染物的转化 一、光化学反应基础 1、光化学反应过程 什么是光化学反应? 分子、原子、自由基或离子吸收光子而发生的化学反应称光化学反应,大气光化学反应分为两个过程。 初级过程: A + hνA* 次级过程 举例: HCl + hνH + Cl H + HCl H2 + Cl Cl + Cl Cl2 2、量子产率(不做介绍) 3、大气中重要吸光物质的光离解 (1)氧分子和氮分子的光离解 O2 + hνO + O N2 + hνN + N (2)臭氧的光离解 O3 + hνO + O2 (3)NO2的光离解 NO2 + hν N O + O (4)亚硝酸和硝酸的光离解 HNO2 + hνHO + NO HNO2 + hνH + NO2
环境化学习题答案
第二章 大气环境化学 1、对流层和平流层中臭氧各自特征? 答:①地球上90%的臭氧在平流层,10%在对流层; ②对流层中的臭氧是一种温室气体,其浓度与纬度、经度、高度和季节变化而变化,北半球比南半球高; ③平流层中的臭氧吸收了太阳发射到地球的大量对人类、动物和植物有害的紫外线,为地球提供了防止紫外线辐射的屏障; ④通过观测,平流层臭氧含量减少,对流层增多。由于90%臭氧在平流层,所以总量在减少; ⑤对流层臭氧形成人为来源:NOX 光解反应是它们在大气中最重要的化学反应,是大气中臭氧生成的引发反应,也是臭氧唯一的人为来源: 3 2420nm 2O O O O NO h N0→+?? +??→?+<ν 2、2、已知某污染大气中HO2自由基的浓度为:7.56×10-15molcm-3,HO2与SO2反应:HO2+SO2→HO+SO3 反应速率k=9×10-16 cm3个-1s-1,(1)求SO2每小时的转化百分数(氧化速率);(2)若定义SO2氧化到起始浓度的1/e(e=2.7183)所需要的时间为SO2与HO2反应的特征时间τ,计算τ值? 解:(1)根据SO2在单位时间的转化百分数可知 ]SO ][X [k dt ] SO [d 22-= HO 2·与SO 2反应: t ]HO [k 0 2t 22222e ]SO []SO []SO ][HO [k dt ] SO [d -=-=
于是1h 二氧化硫转化的百分数为 % 100)e 1(]SO []SO []SO [t ]HO [k 0 20 21h t 22?-=-- -= 已知k=9×10-16 cm3个-1s-1=6.022×1023×9×10-16cm-3mol-1s-1 =5.4198×108 cm-3mol-1s-1 所以: %479.1% 100)e 1(% 100)e 1(]SO []SO []SO [3600 1056.7104198.5t ]HO [k 0 20 21h t 215 8 2=?-=?-=-- ????--=- (2) ]SO [e 1 ]SO [e ]SO []SO [22t ]HO [k 02t 22= =-τ k[SO2]t=1 t=1/5.4198×108×7.56×10-15=2.44×105s=67.8h 第三章 水环境化学 4、在一个pH 为6.5,碱度为1.6 mmol/L 的水体中,若加入碳酸钠使其碱化,问需加多少mmol/L 的碳酸钠才能使水体pH 上升至8.0。若用NaOH 强碱,又需要加多少碱? 解: 总碱度 = ][][][2][233+ ----++H OH CO HCO 总碱度 = ][]/[)2(21++-++H H K c W T αα 令 2121 ααα+= 当pH 在5-9范围内、[碱度]≥10-3 mol/L 时,[H+]、[OH-]项可忽略不计,
湘教版高中地理必修一第二章第三节大气环境
第三节大气环境 三维目标 一、知识与技能 1. 2.通过绘制全球气压带、风带分布示意图,了解气压带、风带的形成、分布、移动规律 3.运用简易天气图,简要分析锋面、低压、高压等天气系统的特点。 二、过程与方法 1. 2.通过绘制全球气压带、风带分布示意图,培养学生的动手能力,提高学生的读图和析 3.充分对比,理解概念的含义,如冷锋与暖锋,低压与高压,气旋与反气旋,培养学生 通过对自然现象的科学解释,形成唯物主义的世界观,增强大气环境保护意识。 教学重点1. 2. 3 4. 5. 教学难点1. 2. 3. 4. 教具准备 课时安排5 第1课时 教学过程 导入新课 师 (情景导入)太阳辐射既能到达地球表面,又能到达月球表面,可是月球表面白天的温度可高达127 ℃,夜晚温度则降至-183 ℃。与月球相比,地球的昼夜温差要小得多, 生 师回答得非常好。大气为地球生命的繁衍和人类的发展提供了必要的条件。这节课,我们就来学习—— 板书: 第三节大气环境 推进新课
师 师 生( 师(总结)看来随着高度的变化,大气层也会发生变化,那么,大气在垂直方向上的变化规律如何呢? 投影: 师 生(观察图片,思考并回答)大气在垂直方向上分为:对流层→平流层→高层大气,其中,对流层的气温随着海拔的升高而逐渐降低,平流层的气温随着海拔的升高而升高,高 师 (1 (2 师(1)与人类关系最密切的是对流层;对流层是贴近地面大气的最底层,整个大气质
量的3/4和几乎全部水汽、固体杂质都集中在这一层,人类生活在对流层的底部, 因此,该 (2 )飞机飞行在平流层,这是因为该层水汽、固体杂质极少,天气晴朗,能见度好, (承转)太阳辐射透过大气到达地球表面,在地表和大气之间进行着一系列能量转换。 其中,对流层的气温变化和风、霜、雨、雪等天气过程,都是能量在对流层中传递和转换的 板 (一)大气对太阳辐射的吸收作用 师 生 (看书后回答)主要表现为吸收、散射和反射。 投影: 大气对太阳辐射的削弱作用表 7%(包括 X γ射 提问:在太阳辐射能中,波长由短到长,主要分为哪几类光?各波段能量分别占太阳辐 生 (读表后回答)按波长由短到长分别有紫外光、可见光、红外光。紫外光占太阳辐射能的比例为7%,波长范围是040微米以下。可见光占太阳辐射能的比例是50%,波长范围是0.40~0.76微米之间。红外光占太阳辐射能的比例是43%,波长范围是大于0.76微米。 师 (进行激励性评价并提问)这些光线在经过大气时被大气削弱的情况是否相同,为 生 (合作讨论后回答)不相同。紫外光几乎完全被上层大气吸收,绝大部分被臭氧层吸收。可见光绝大部分能直接到达地面,波长较短的蓝色光等易为大气分子所散射。对流层 师 激励性评价,并 问题探究:(1 (2 生 (小组合作探究并回答)(1)对流层大气基本上不能直接吸收太阳辐射的能量;对流层大气对太阳辐射的吸收具有选择性;波长较短的蓝色光最易被散射,因此散射也具有选 师 回答得非常好,那么晴朗的天空为什么呈蔚蓝色呢,请同学们结合投影图片思考回答。
第二章第三节第2课时
第2课时 影响化学平衡移动的因素(一) 浓度、压强对化学平衡移动的影响 [学习目标定位]1?通过外界条件对可逆反应速率的影响,掌握化学平衡移动的内在因素。 2?通过实验探究,讨论分析浓度、压强影响平衡移动的规律。 1. 在一定条件下,把 1 mol N 2和3 mol H 2充入一密闭容器中发生反应 2+ 3出 2NH 3, 一段时间后达到平衡。在某一时刻,保持容器容积不变,充入 N 2,此时,C (N 2)增大,v 正增 大,C (NH 3)不变,v 逆不变,随着反应的进行, C (N 2)减小,v 正减小,C (NH 3)增大,v 逆增大, 最终V 正=V 逆。 2?在一定条件下,可逆反应达到化学平衡状态,如果改变影响平衡的条件 (如浓度、气体反 应的压强、温度等),化学平衡状态被破坏(正、逆反应速率不再相等),直至正、逆反应速率 再次相等,在新的条件下达到新的化学平衡状态。 这种现象称作平衡状态的移动, 简称平衡 移动。 3. 化学平衡移动可表示为 反应开抽 化営平 1 1 建也平H [归纳总结] 化学平衡移动方向的判断 [■若v 正=V 逆,平衡不移动; 条件改变 < 若v 正>v 逆,平衡向正反应方向移动; 若V 正<v 逆,平衡向逆反应方向移动。 [活学活用] 1. 试根据下列图像判断化学平衡移动的方向。 ] I“1=#$ tl * (D 0 xi r G ri ③ 答案 ①向正反应方向移动;②向逆反应方向移动;③平衡不移动。 二浓度对化学平衡移动的影响 1. 按表中实验操作步骤完成实验,观察实验现象,填写下表: 些些*叫护呃 条件 时间
实验原理CnO:- + £0=^23:- +2H + (黄色) 实验步骤1 a 丁(I.L irul L 1 孑K心:O瞬揪 f_6 mol-L_, 4 N 0.4 mid L 1 实验现象橙黄色变为橙色橙黄色变为黄色 实验结论c(H )增大,平衡向逆反应方向移动 :NaOH溶液使c(H +)变小,平衡向正反 应方向移动 原理Fe + 3SCN Fe(SCN)3(红色) 实验(1)步骤L 地杆貢心牌淞Linwl-r1I rlT 齐KSMIS SinLD.mSnwl'L 'FHJ.聃港* 5mL0j[Hniol L 七 (D ? 现象溶液颜色变深溶液颜色变深 实验(2)步骤向试管①中滴加0.01 mol ? t NaOH溶液 向试管②中滴加0.01 mol L一1 NaOH溶液 现象溶液颜色变浅溶液颜色变浅 实验结论 对可逆反应Fe3 ++ 3SCN 一Fe(SCN)3,分别增大c(Fe3十)和c(SCN「)后,Fe(SCN)3的浓度均增大,即化学平衡均向正反应方向移动了;滴加NaOH 溶液,由于3OH「+ Fe3+ ===Fe(OH)3^,减小了Fe3+ 的浓度,Fe(SCN)3的浓度也减小了,即化学平衡向逆反应方向移动了 3?已知反应mA(g) + nB(g) pC(g) H<0 , m+ *p,当反应达到平衡后,有关物质的浓度发生改变,其反应速率的变化曲线分别如下图所示:
环境化学总复习题(附答案但不完全)
《环境化学》总复习题 第一章绪论 一、填空 1、造成环境污染的因素有物理、化学和生物的三方面,其中化学物质引起的约占80%-90%。 2、污染物的性质和环境化学行为取决于它们的化学性质和在环境中的迁移。 3、环境中污染物的迁移主要有机械、物理化学和生物三种方式。 4、人为污染源可分为工业、农业、交通运输和生活。 二、选择题 1、属于环境化学效应的是C A热岛效应 B温室效应 C土壤的盐碱化 D噪声 2、五十年代日本出现的痛痛病是由A污染水体后引起的。 A Cd B Hg C Pb D As 3、五十年代日本出现的水俣病是由B污染水体后引起的。 A Cd B Hg C Pb D As 三、问答题 1、环境中主要的化学污染物有哪些? 2、举例简述污染物在环境各圈的迁移转化过程。
第二章大气环境化学 一、填空 1、写出下列物质的光离解反应方程式 (1)NO2 + hνNO + O· (2)HNO2 + hνHO·+ NO 或HNO2 + hνH·+ NO2 (3)HNO3 + hνHO·+ NO2 (4)H2CO + hνH· + HCO·或H2CO + hνH2+ CO 2、大气中的NO2可以转化为HNO 3、N2O5和N2O3。 3、碳氢化合物是大气中的重要污染物,是形成光化学烟雾的主要参与者。 4、乙烯在大气中与O3的的反应机理如下: O3 + CH2 == CH2H2CO+H2COO CH2(O3)CH2 5、大气颗粒物的去除与颗粒物的粒度和_化学性质_有关,去除方式有干沉降和湿沉降。 6、制冷剂氯氟烃破坏臭氧层的反应机制是: CFmCln + hv CFmCln-1 + Cl· Cl·+ O3O2 + ClO· ClO·+O O2 + Cl 7、当今世界上最引人瞩目的几个环境问题_温室效应_、_臭氧层破坏_、_光化学烟雾_等是由大气污染所 引起的。 8、许多大气污染事件都与逆温现象有关,逆温可分为_辐射逆温_、_平流逆温_、_融雪逆温和地形逆温_。 9、SO2的催化氧化速度与_催化剂_、_温度_和_浓度和PH离子强度_有关。 10、大气中最重要的自由基为_HO·_。 11、燃烧过程中NO的生成量主要与_燃烧温度_和_空燃比_有关。 12、能引起温室效应的气体主要有_CO2_、_CH4_、_CO_、_氟氯烃_。 13、CFC-11的分子式为_CFCl3_和_CF2ClBr_。 14、大气的扩散能力主要受_风_和_湍流_的影响。 15、按污染成因分,气溶胶可分为_一次气溶胶_和_二次气溶胶_。 16、根据温度垂直分布可将大气圈分为对流层、平流层、_中间层_、热层和逃逸层。 17、伦敦烟雾事件是由_SO2_和_颗粒物_引起的。 18、大气中CH4主要来自_有机物的厌氧发酵_、_动物的呼吸作用_、_原油及天然气的泄漏_的排放。 19、富集因子法可以推断气溶胶污染源,如(EF)地壳>10,则表示待查元素i________。 20、降水中主要阴离子有_SO42-_、_NO3-_、_Cl-_、_HCO3-_。 二、选择题 1、由污染源排放到大气中的污染物在迁移过程中受到ABCD的影响。 A风B湍流C天气形式D地理地势 2、大气中HO 自由基的来源有ACD的光离解。 A O3 B H2CO C H2O2 D HNO2
第三节大气环境
第三节 大气环境 第1课时 对流层大气的受热过程 一、单项选择题 (自编题)地球大气层按其成分、温度、密度等物理性质在垂直方向上的变化,自下而上依次是:对流层、平流层和高层大气层,如下图。据此完成1~3题: 1、与人类关系最为密切的是大气层次: A 、对流层 B 、平流层 C 、高层大气 D 、电离层 2、从图中看出对流层大气对流运动强烈、平流层以水平运动为主的原因是: A 、对流层大气密度大,平流层大气密度小 B 、对流层温度低,平流层温度高 C 、对流层大气上热上冷,平流层下冷上热 D 、对流层天气变化复杂,平流层天气变化单一 3、有生命保护伞之称的“臭氧层”在: A 、对流层 B 、平流层 C 、高层大气 D 、对流层和平流层 (自编题)到达地面的太阳辐射能量比大气上界小得多,在太阳光谱上能量分布在紫外光谱区几乎绝迹,在可见光谱区减少40%,而在红外光谱区减至60%。据此完成4~5题: 4、下列关于大气对太阳辐射的削弱作用的理解正确的是: A 、大气对紫外区削弱的能量总量最多 B 、大气对太阳辐射各波长的削弱能力是相当的 C 、大气对可见光近乎于“透明的” D 、削弱能力比较:可见光区>红外光区>紫外光区 5、下列大气现象不能解释大气对太阳辐射削弱作用的是: A 、阴雨天空的灰蒙蒙 B 、极地夜空的极光现象 C 、一轮红日喷薄而出 D 、晴天气温日较差大,阴天气温日较差小 (自编题)读“太阳辐射能量在地球大气及地表流动图”(图中序号为不同形式的能源辐射),据此完成6~8题。 6. 对流层大气的直接热源是( ) A. 箭头① B. 箭头② C. 箭头③ D. 箭头④ 7. 表示大气对地面的保温效应的是( ) A. 箭头① B. 箭头② C. 箭头③ D. 箭头④ 8. 当大气中的云量和水汽含量增加时( ) ①箭头①可能减少 ②箭头②可能增强 太阳辐射 大气 地面 ① ② ③ ④ 地球 短波辐射 长波辐射
第二章 第三节 第3课时 教案及习题 【高中化学 选修4 步步高】
第3课时 温度、催化剂对化学平衡移动的影响 [核心素养发展目标] 1.变化观念与平衡思想:从变化的角度认识化学平衡的移动,即可逆反应达到平衡后,温度、催化剂改变,平衡将会发生移动而建立新的平衡。2.证据推理与模型认知:通过实验论证说明温度、催化剂的改变对化学平衡移动的影响,构建分析判断化学平衡移动方向的思维模型(勒夏特列原理)。 一、温度对化学平衡移动的影响 1.实验探究温度对化学平衡移动的影响 按表中实验步骤要求完成实验,观察实验现象,填写下表: 实验原理 红棕色2NO 2(g )无色N 2O 4(g ) ΔH =-56.9 kJ·mol -1 实验步骤 实验现象 热水中混合气体颜色加深; 冰水中混合气体颜色变浅 实验结论 混合气体受热颜色加深,说明NO 2浓度增大,即平衡向逆反应方向移动;混合气体被冷却时颜色变浅,说明NO 2浓度减小,即平衡向正反应方向移动 2.由图像分析温度对化学平衡移动的影响 已知反应:m A(g)+n B(g)p C(g) m +n
(2)图②表示的温度变化是降低,平衡移动方向是向正反应方向。 (3)正反应是放热反应,逆反应是吸热反应。 3.温度对化学平衡移动的影响规律 (1)任何化学反应都伴随着能量的变化(放热或吸热),所以任意可逆反应的化学平衡状态都受温度的影响。 (2)升高温度,v放、v吸均增大,但v吸增大程度大; 降低温度,v放、v吸均减小,但v吸减小程度大。 (3)当其他条件不变时: 温度升高,平衡向吸热反应方向移动; 温度降低,平衡向放热反应方向移动。 例1反应:A(g)+3B(g)2C(g)ΔH<0,达平衡后,将反应体系的温度降低,下列叙述中正确的是() A.正反应速率增大,逆反应速率减小,平衡向右移动 B.正反应速率减小,逆反应速率增大,平衡向左移动 C.正反应速率和逆反应速率都减小,平衡向右移动 D.正反应速率和逆反应速率都减小,平衡向左移动 答案 C 解析降低温度,v正、v逆均减小,平衡向放热反应方向移动,即平衡正向移动。 考点催化剂和温度变化对化学平衡移动的影响 题点温度影响化学平衡移动的规律 例2取五等份NO 2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:2NO2(g)N2O4(g)ΔH<0。反应相同时间后,分别测定体系中NO2的体积分数,并作出其随反应温度变化的关系图。下列示意图中,可能与实验结果相符的是()
(完整版)环境化学复习题库1
第一章绪论 一、填空 1、造成环境污染的因素有物理、化学和生物的三方面,其中化学物质引起的约占__80%-90%_。 2、环境化学研究的对象是:环境污染物。 3、环境中污染物的迁移主要有机械、物理-化学和生物迁移三种方式。 4、人为污染源可分为_工业_、__农业_、__交通_、和__生活_。 5、如按环境变化的性质划分,环境效应可分为环境物理、环境化学、环境生物三种。 二、选择题 1、属于环境化学效应的是 A A热岛效应B温室效应C土壤的盐碱化D噪声 2、五十年代日本出现的痛痛病是由___A _污染水体后引起的 A Cd B Hg C Pb D As 3、五十年代日本出现的水俣病是由_B__污染水体后引起的 A Cd B Hg C Pb D As 三、问答题 1、举例说明环境效应分为哪几类? 2、举例简述污染物在环境各圈的迁移转化过程。 第二章大气环境化学 一、填空题 1、写出下列物质的光离解反应方程式: (1)NO 2+ hν + O (2)HNO + hν NO 或HNO2 + hν H + NO2 (3)HNO 3 + hν + NO2 CO + hν + HCO 或H2CO + hν (4)H (5)CH 3X + hν + X 2、大气中的NO2可以转化成HNO 3、NO3和HNO3等物质。 3、碳氢化合物是大气中的重要污染物,是形成光化学烟雾的主要参与者。 4、乙烯在大气中与O3的反应机理如下: CH2(O3)CH2 O3 + CH2 == CH2H2CO+H2COO 5、大气颗粒物的去除与颗粒物的粒度、化学组成和性质有关,去除方式有 干沉降和湿沉降两种。 6、制冷剂氯氟烃破坏臭氧层的反应机制是: CFmCln + hv CFmCln-1 + Cl
