基础无机:Lewis共价键理论和共振结构式

基础无机:Lewis共价键理论和共振结构式
作者:虹Rreflect_F 本文受众:高中以上
Lewis共价键理论是经典的共价键理论。当然,在MO,VB等面前可能不值一提。但是原始与简单也有它的好处,如果我们可以用一些更为简单的方法去解释一些分子结构给出的信息,何乐而不为呢?就如同在适合的时候没必要使用洛仑兹变换而使用伽利略变换一样。这个也是它在基础有机化学中应用十分广泛的原因。故在这里提及一些关于Lewis结构式的内容。
*注:在Lewis结构式里我们讨论的是分子或者是以共价键组成的离子,而且主要针对主族元素。副族元素的化合物置于配位化合物部分进行讨论。
一.Lewis结构式的书写
1.八隅律
中心原子通过电子共用达到周围8价电子的稳定结构(H为2电子)。
2. 几种Lewis结构的书写方法:
一种(左图)是高中所熟知的电子式,标准式(中间)是把电子式中共用电子对用短线代替,只需要标出孤对电子。还有一种(右图)是在孤对电子较多时可以弃去孤对电子来表示分子的结构。
3. 键数的计算:
有了八隅律作为规则就可以轻易的算出化合物中的键数n。
我们设分子中有a个重原子(除了氢原子以外的其他原子,在等电子体部分中有提及)b个氢原子,那么我们所拥有的价电子数可以通过计算得出设为c。那么我们达到理想结构每个原子都达到8电子的稳定结构,所总共的电子为8a+2b,很显然我们多算了电子,而这个多算的电子数目是8a+2b-c。
这些多的电子通过共用电子对来实现互补,2个电子一根键所以总键数就是4a+b-c/2。
以HCN为例n=4*2+1-(1+4+5)/2=4,所以共4根键。
4. 形式电荷
有时我们画出来的分子周围多了电子或者少了电子,这样就可以看作多了电子的原子丢掉一个(或
者数个)电子,而这些电子被另一个原子得到,从而使每个原子达到8电子结构。如CO:
有了形式电荷了以后,就有助于我们对物质Lewis结构式稳定性的讨论。
二.共振结构式
1.什么叫共振?
这里的共振显然和物理学中的强迫运动没有关系。当一个分子,固定原子的位置,通过改变键连方式(三键,双键,单键乃至于无键的变换)写出的同一个结构的分子的不同共振结构式。共振式之间用双向箭头相接。
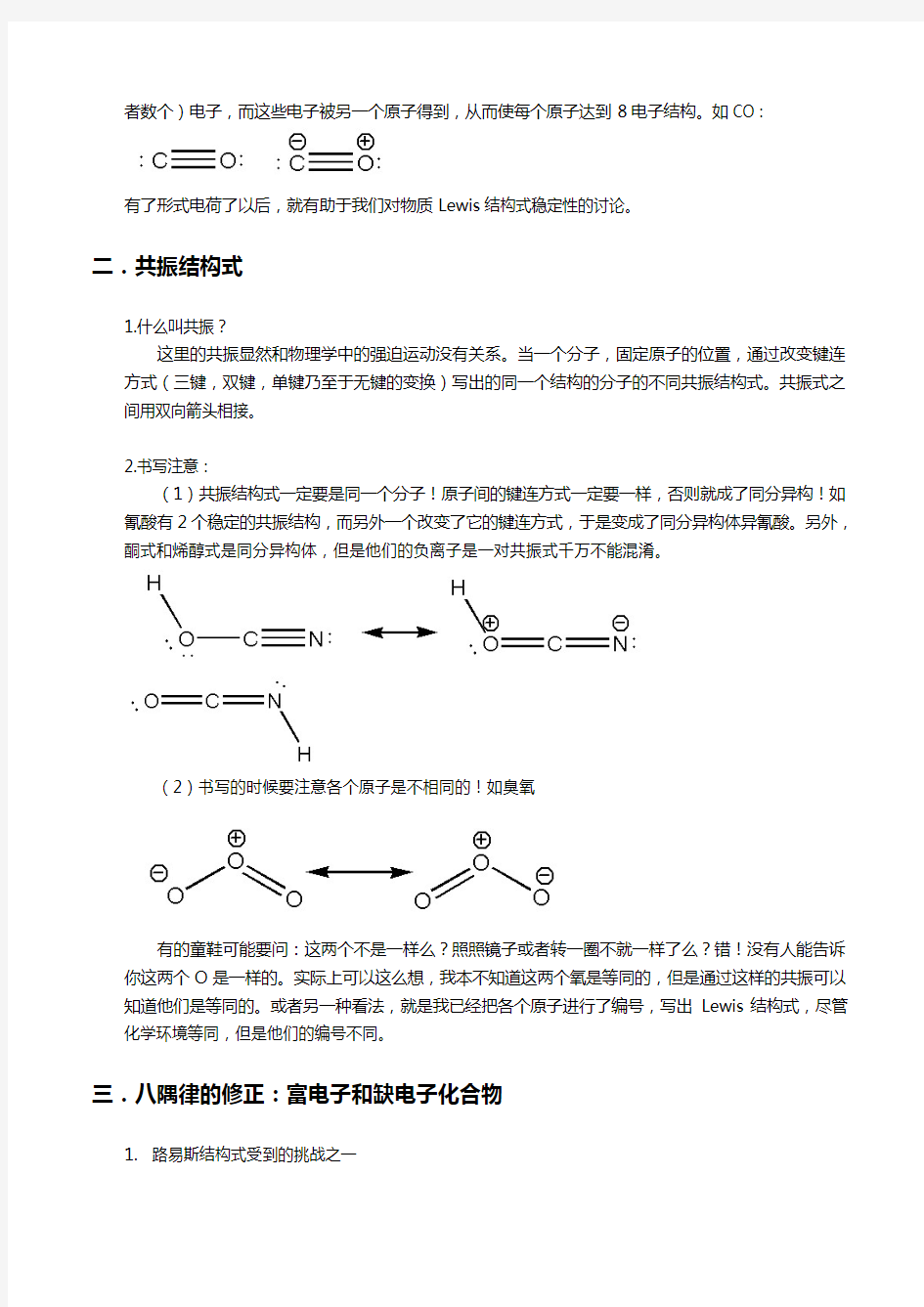
2.书写注意:
(1)共振结构式一定要是同一个分子!原子间的键连方式一定要一样,否则就成了同分异构!如氰酸有2个稳定的共振结构,而另外一个改变了它的键连方式,于是变成了同分异构体异氰酸。另外,酮式和烯醇式是同分异构体,但是他们的负离子是一对共振式千万不能混淆。
(2)书写的时候要注意各个原子是不相同的!如臭氧
有的童鞋可能要问:这两个不是一样么?照照镜子或者转一圈不就一样了么?错!没有人能告诉你这两个O是一样的。实际上可以这么想,我本不知道这两个氧是等同的,但是通过这样的共振可以知道他们是等同的。或者另一种看法,就是我已经把各个原子进行了编号,写出Lewis结构式,尽管化学环境等同,但是他们的编号不同。
三.八隅律的修正:富电子和缺电子化合物
1.路易斯结构式受到的挑战之一
对于一些化合物如SF6(12电子),PCl5(10电子)。无法用Lewis结构式反映它的真实结构(但是可以用八隅律写出来,建议读者自己想想怎么写?)。
2. 对中心电子数的修正
对于第二周期,只有6电子与4电子的修正如B,Be,C+等。
对于第三周期及以后往往富电子的修正更多一点,如P,S有10电子,12电子的修正。
往往这个都不是确定的,要具体情况具体分析。
四.共振结构式的稳定性分析
稳定性的比较有下面几个规则:
1.中心原子不缺电子稳定(即6电子或4电子结构是不稳定的如C+中间体,B,Be等)
也就是说有完整的价电子层就比较稳定。
2.形式电荷,正的在电负性大的原子上不稳定,负的在电负性小的原子上不稳定。
3.同种形式电荷距离越远越稳定。异种电荷距离越近越稳定。一个原子上带着2个单位电荷极不稳定
4.有异种电荷分离不稳定,可以看作要克服静电力做功。也就是说无形式电荷最稳定。
5.能形成更多的共价键越稳定(主要是针对富电子与缺电子的修正得到的结论)
五.书写共振结构式的一些技巧和注意事项
1.形式电荷并非是真正的电荷分部,因为路易斯结构式不能反映电子云在两个不同电负性的原子之间的分布。它只是简单认为是电子转移,不能认为一氧化碳中C带有一个单位的负电荷。
2.路易斯结构式不用标出键角,但是一般要标出孤对电子。原因是单凭Lewis共价键理论无法得出分子的构型。但是如果是题目让画结构式,一般都要写画出分子构型。
3.往往H和卤素在画结构式的时候放在外侧,而中心原子一般是成键数目比较多的原子如C,N,S,P等。因为中心原子成键数目小的话意味着它的形式电荷就会很高。
例:请写出S2O的Lewis结构式。(这里省去孤对电子)
如果是SSO的排列方式:
如果是SOS的排列方式:
结果显而易见。
六.与现代共价理论的联系
1.共振与离域π键
一般来说,一个分子有共振式意味着它有一个离域的π键,但是这个π键的成分不可能用Lewis共价键理论描述。通常分子的共振式中双键的移动就是一个离域的过程,离域的范围就是以移动的双键为范围。所以我们说共振式越多一般分子越稳定,因为离域范围变大。
2.形式电荷与配位键
一定要注意:路易斯共价键理论里面没有配位键的概念,而是用形式电荷已经解决了配位键的问题,如CO中有一个π配键:
3.富电子中心原子的修正与p-dπ键
如硫酸根:如果把S看作8中心体,其中两个看作配键的话:
得出这样的结构
如果把S看作12电子中心体,则有:
结果显而易见,但是这个原因是什么呢?原子不共平面不能形成p-pπ键为什么还有这么多共振式呢?因为是离域的p-dπ键。
4.单键的断开与超共轭效应
超共轭效应:是指一个σ键里的电子(通常是C-H或C-C)和一个临近的半满或全空的非键p轨道或反键的π轨道或全满的π轨道之间的相互作用,该相互作用能够使整个体系变得更稳定。图示应该为:
但是可以用Lewis结构式来表示超共轭效应:(没有固定的通式)
如叔丁基正离子:
这可能和常人的想想不同这也能算共振?!答案是肯定的。它与超共轭的结果吻合,为什么不可以呢?
七.用路易斯结构式算原子与原子间化学键的键级
注意,这里的键级和分子轨道中的键级不一样,远远没有MO严谨,但是也可以说明一些问题。
1.没有共振式的分子用目测法算出键级。(- -b)
2.有多个稳定性相同(或者相差不大时)的共振式的,取不同共振式中原子间的键级的平均值,如苯
中,任意的C-C键的键级为(1+2)/2,2种共振式,一个两碳之间键级为1,一个为2,平均得
1.5
3.在有最稳定结构(键级为y)时,取其他共振式中较稳定(这里叫次稳定的,不稳定的舍去,因为他
们的贡献小)算键级为x,然后键级取x到y
第二章 共价键理论和分子结构
第二章 分子结构 一、 填空题 1、C 2+的分子轨道为_________________,键级___________________; HCl 的分子轨道为________________,键级__________ 。 2、OF, OF +, OF -三个分子中, 键级顺序为________________。 3、HBr 分子基态价层轨道上的电子排布是 _________________________ 。 4、对称元素C 2与σh 组合,得到___________________;C n 次轴与垂直它的C 2组合,得到______________。 5、有一个 AB 3分子,实验测得其偶极矩为零且有一个三重轴,则此分子所属点群是_______________________。 6、判别分子有无旋光性的标准是__________。 7、既具有偶极矩,又具有旋光性的分子必属于_________点群。 二、选择题 1、 H 2+的H ?= 21?2- a r 1 - b r 1 +R 1, 此种形式已采用了下列哪几种方法: (A) 波恩-奥本海默近似 (B) 单电子近似 (C) 原子单位制 (D) 中心力场近似 2、对于"分子轨道"的定义,下列叙述中正确的是: (A) 分子中电子在空间运动的波函数 (B) 分子中单个电子空间运动的波函数 (C) 分子中单电子完全波函数(包括空间运动和自旋运动)
(D) 原子轨道线性组合成的新轨道 3、含奇数个电子的分子或自由基在磁性上: (A) 一定是顺磁性 (B) 一定是反磁性 (C) 可为顺磁性或反磁性 (D )没有磁性 4、下列分子的键长次序正确的是 (A) OF -> OF > OF + (B) OF > OF -> OF + (C) OF +> OF > OF - (D) OF - > OF +> OF 5、若以x 轴为键轴,下列何种轨道能与p y 轨道最大重叠? (A) s (B) d xy (C) p z (D) d xz 6、Cr 与 CO 形成羰基化合物 Cr(CO)6,其分子点群为 (A) D 4h (B) T d (C) O h (D) D 6h 7、2,4,6-三硝基苯酚是平面分子,存在离域π键,它是: (A) (B) (C) (D) 1612 Π1814Π1816Π1616Π三、简答题 1、在有机化合物中,C ═O(羰基)的偶极距很大(μ=7.67×10-30C ·m),而CO 分子的偶极距却很小,解释原因。 2、SO 42-中S —O 键长为149?pm ,比共价单键半径加和值(175?pm)短,说明原因。说明SiF 62-能稳定存在而SiCl 62-不稳定的原因。 判断 NO 和 CO 哪一个的第一电离能小,原因是什么? 3、CO 是一个极性较小的分子还是极性较大的分子? 其偶极矩的方向如何?为什么? 4、写出N 2基态时的价层电子组态, 并解N 2的键长(109.8?pm)特别短、
2-2-1 共价键与分子的立体结构
编号:15 第二节共价键与分子的立体结构 (第1课时) 2010年3月29日 班级__________ 姓名__________ 【学习目标】 1、理解杂化轨道理论的主要内容,掌握三种主要的杂化轨道类型; 2、学会用杂化轨道原理解释常见分子的成键情况与空间构型 【学习重难点】 重点:杂化轨道类型难点:杂化轨道类型 【学案导学过程】 活动·探究原理 规律 方法 技巧(一)甲烷分子的形成及立体构型 联想质疑:1、共价键决定原子的结合方式,决定分子的空间构型吗? 2、利用电子配对理论能解释甲烷的空间构型吗 3、为了解释甲烷的空间构型鲍林提出了什么理论? 4、甲烷分子形成过程:C: 2s22p x12p y13p z 观察左 图你能 用语言 描述一 下甲烷 的空间 构型的 形成过 程吗? 思考:1原子轨道为什么可以进行杂化?(提示从共价键键能大小和体系能量 变化来分析)
2、轨道杂化后在数目,形状,能量上是否发生变化? 3、轨道杂化的结果是什么? 4、尝试解释轨道杂化 (二)常见的SP杂化过程活动探究:SP杂化: 2、sp2杂化型 直线型 (BeCl 2 ) 交流与 讨论: 用杂化 轨道理 论分析 乙炔分 子的成 键情况 平面正 三角形 (BF3) 交流与 讨论: 用杂化 轨道理 论分析 乙烯分 子的成 键情况【当堂检测】
(A)1.在外界条件的影响下,原子内部______________________________的过程叫做轨道杂化,组合后形成的新的、____________________的一组原子轨道,叫杂化轨道。2.甲烷分子中碳原子的杂化轨道是由一个__________轨道和三个__________轨道重新组合而成的,这种杂化叫_____________________。 3.乙烯分子中碳原子的原子轨道采用sp2杂化。形成乙烯分子时,两个碳原子各用__________的电子相互配对,形成一个σ键,每个碳原子的另外_____________分别与两个氢原子的_______________的电子配对形成共价键;每个碳原子剩下的一个未参与杂化的__________的未成对电子相互配对形成一个__________键。 (B)4.下列分子的中心原子形成sp2杂化轨道的是() A.H2O B.NH3 C.C2H4D.CH4 5.在乙烯分子中有5个σ键、一个π键,它们分别是() A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键 B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键 C.C-H之间是sp2形成的σ键,C-C之间是未参加杂化的2p轨道形成的π键 D.C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键
价键理论
价键理论 自1916年路易斯提出经典的共价键理论以来,共价键理论有了很大的发展。现代共价键理论有两种,一是价键理论,二是分子轨道理论。 (一)价键理论的基本要点 价键理论,又称电子配对法,其基本要点如下: 1.具有自旋相反的未成对电子的两个原子相互接近,可以形成稳定的共价键。 如果A、B两个原子各有一个自旋相反的未成对的电子,那么这两个未成对电子可以相互配对形成稳定的共价键,这对电子为A、B两原子所共有(共用)。如果A、B各有两个或三个未成对的电子,则自旋相反的单电子可两两配对形成双键或叁键。 如果A原子有两个未成对电子,B原子有一个未成对电子,那么一个A原子能与两个B原子结合形成AB2型分子,…。 2.原子中未成对的电子数等于原子所能形成的共价键数目(共价键的饱和性)。 共价键是由成键原子中自旋相反的未成对电子配对形成的。一个原子的一个电子和另一个原子的一个电子配对以后,不能再和第二个电子配对。因为这时其中必有两个电子的自旋方向相同而相斥。也就是说一个原子所能形成共价键的数目是一定的。原子中未成对的电子数等于原子所能形成的共价键数目,这就是共键价的饱和性。例如,H原子只有一个未成对电子,它和另一个H原子的未成对电子配对后,就不能再与第二个H原子的电子配对了,……。 3.成键电子的电子云重叠越多,核间电子子云密度就越大,形成的共价键就越牢固(共价健的方向性)。 共价键的生成是由于自旋相反的单电子相互配对,电子云重叠的结果。因此,当两个原子形成分子时,电子云重叠的程度越大,则两原子间的电子云密度越大,生成的共价键就越牢固,所以,在形成共价键时,电子云总是尽可能达到最大程度的重叠。因此,在形成共价键时,原子间总是尽可能沿着电子云最大重叠方向成键。s电子云呈球形对称分布,p、d、f电子云在空间都有一定的伸展方向。在形成共价键时,除了s 电子云和s电子云可以在任何方向上都能达到最大程度的重叠外,p、d电子云的重叠,只有在一定方向上才能使电子云有最大程度的重叠。即共价键是有方向性的。例如,当氢原子1s电子云和氯原子的3p电子云重叠形成HCL分子时,氢原子的1s电子云总是沿着氯原子未成对电子的3p电子云对称轴方向作最大程度的重叠(图4-9(a))。其他方向都不能形成稳定的分子(图4-9(b)(c))。 电子云的三种重叠情况 图4-9 氢原子的1s电子云与氧原子的3P x (二)共价键的类型 共价键有两种成键方式。一种是电子云以:“头碰头”方式相重叠,电子云及重叠部分沿键轴(两核间连线)呈圆柱形对称分布,重叠部分绕轴旋转任何角度形状不会改变,这种键叫σ键。另一种是成键的两个电子云的对称轴相平行,以“肩并肩”方式相重叠,电子云重叠部分对通过键轴的一个平面具有对称性,这种键称为π键。 例如在N2分子中,氮原子的价层电子结构为:2p x12p y12p z1三个未成对的p电子分占三个互相垂直的p轨道。当两个氮原子结合成N2分子时,p x电子云沿x轴方向以“头碰头”方式重叠形成一个σ键,每个原
冲击和振动
冲击和振动 作者: Jonas Steibert 文件名: Shock and Vibration Basic.doc
1. 什么是冲击和振动? 3 1.2 怎样保护产品以防受到冲击和振动?3 2. 何时冲击?3 2.1 产品易碎性的判定 3 2.2 产品可能遇到的情况判定 4 2.3 振动 5 3. 减震材料 6 3.1 多孔聚乙烯EPE 8 3.1.1 模压材料9 3.1.2 挤压材料9 3.2 多孔聚丙烯EPP 11 3.3 多孔聚苯乙烯EPS 12 3.4 聚亚安酯PU 13 3.5 纤维减震材料15 作者: Jonas Steibert 文件名: Shock and Vibration Basic.doc
1.什么是冲击和振动? 冲击和振动指的是一种环境,在这种环境下产品处于运输当中,或处于包装箱的装卸过程中。 1.2 怎样保护产品以防受到冲击和振动? 为了保护产品,可在冲击和振动有发生可能性的几个地方采取措施。但为了减少冲击和振动发生的可能性,还有些问题需要考虑。产品是否易碎?产品价值是多少?产品是怎样运输的?产品的体积估计有多大?这些都是在选择包装材料前需要考虑的问题。 2. 何时冲击? 当产品的包装箱突然以某种方式掉落,冲击就会发生。大多数时间冲击都发生在意外事件中,但冲击也会在列车更换装运车厢或产品/包装箱的野蛮装卸过程中发生。 2.1 产品易碎性的判定 确定产品需要多大减震量的第一步是确定产品自身所能承受的机械冲击量,对于这一判定有一些常用术语,其中“易碎性”和“G因数”是最常用的。 易碎性通常用单位“G”表示,表明产品在不被损坏的条件下所能承受的最大负加速度。产品越易碎,其G因数越小。 [ G是加速度的单位,其值等于重力加速度:1g=9.81m/s2 。 负加速度是“负的加速度”,指在制动,减速到0,物体下落撞击地面时。 抗冲击垫物作用是通过压缩,延长速度v(m/s)降低的时间t (s),从而减小负加速度a (m/s2):A= v / t 给定质量m(kg)所承受的负加速度a (m/s2) 越小,产品所受的撞击力F (N)就越小: F= m * a] 理论上,易碎性的判定是将产品置于一系列剧烈度递增的冲击中(负加速度)以找出足以破坏产品的最小冲击力。产品在不被损坏条件下所能承受的最大负加速度,即为产品的G因数。 作者: Jonas Steibert 文件名: Shock and Vibration Basic.doc
机械振动理论基础及其应用
旋转机械振动与故障诊断研究综述 丄、八 1.前言 工业生产离不开回转机械,随着装置规模不断扩大,越来越多的高速回转机械应用于工业生产,诸如高速离心压缩机、汽轮机发电机组。动态失稳造成的重大恶性事故屡见不鲜。急剧上升的振动可在几十秒之内造成机组解体, 甚至祸及厂房,造成巨大的经济损失和人员伤亡。此外,机械振动可能降低设备机械性能,加速机械零部件的磨损,发出的噪声损害操作者的健康。但是振动也能合理运用,如工业上常用的振动筛、振动破碎等都是振动的有效利用。工程技术人员必须认真对待机械振动问题,当机组产生有害的振动时,及时分析原因,坚持用合理的振动测试标准,采取科学的防治措施。 2.旋转机械振动标准 旋转机械分类: I类:为固定的小机器或固定在整机上的小电机,功率小于15KW U类:为没有专用基础的中型机器,功率为15~75KW刚性安装在专用基础上功率小于300KW的机器。 川类:为刚性或重型基础上的大型旋转机械,如透平发电机组。 W类:为轻型结构基础上的大型旋转机械,如透平发电机组。 机械振动评价等级: 好:振动在良好限值以下,认为振动状态良好。 满意:振动在良好限值和报警值之间,认为机组振动状态是可接受的(合格),可长期运行。 不满意:振动在报警限值和停机限值之间,机组可短期运行,但必须加强监测并采 取措施。 不允许:振动超过停机限值,应立即停机。 3.振动产生的原因 旋转机械振动的产生主要有以下四个方面原因,转子不平衡,共振,转子不对中和
机械故障。 4.旋转机械振动故障诊断 4.1 转子不平衡振动的故障特征 当发生不平衡振动时,其故障特征主要表现在如下方面: 1 )不平衡故障主要引起转子或轴承径向振动,在转子径向测点上得到的频谱图, 转速频率成分具有突出的峰值。 2 )单纯的不平衡振动,转速频率的高次谐波幅值很低,因此在时域上的波形是一个正弦波。 3 )转子振幅对转速变化很敏感,转速下降,振幅将明显下降。 4 )转子的轴心轨迹基本上为一个圆或椭圆,这意味着置于转轴同一截面上相互垂直的两个探头,其信号相位差接近90°。 4.2 旋转机械振动模糊诊断 4.2.1 振动模糊诊断基本原理 振动反映了系统状态及变化规律的主要信息,统计资料表明:机械设备的故障有67 % 左右是由于振动引起的,并且能从振动和振动辐射出的噪声反映出来。回转机械的振动信息尤其明显,且振动诊断具有快速、简便、准确和在线诊断等一系列优点,所以振动诊断法是旋转机械状态识别和故障诊断的最有效、最常用的方法。 但是,由于机械系统本身的复杂性以及所摄取的振动信号强烈的模糊性,使故障之间没有清晰的界限,这时利用传统的振动频谱分析,对一个故障可能有多个征兆来表现,一个征兆也可能有多个故障原因的复杂现象,往往难定两者的对应关系进行指导维修。振动模糊法,将模糊数学与振动诊断相结合,利用模糊综合评判技术,较好地处理了回转机械故障的不确定性问题。 4.2.2 旋转机械振动模糊诊断法的实现 隶属函数的确定
共价键及分子结构知识梳理
共价键及分子结构知识梳理】 一、共价键 1-1共价键的实质、特征和存在实质:原子间形成共用电子对特征:a.共价键的饱和性,共价键的饱和性决定共价分子的。 b共价键的方向性,共价键的方向性决定分子的。 1-2共价键的类型 b键:S-Sb键、S-p c键、p-p b键,特征:轴对称。 n键:p-p n键,特征:镜像对称 【方法引领】b键和n键的存在规律b键成单键;n键成双键、三键。 共价单键为b键;共价双键中有1个b键、1个n键;共价三键中有1个b键、2个n 键。 对于开链有机分子:b键数=原子总数-1 ; n键数=各原子成键数之和- b键数(环 状有机分子,b键数要根据环的数目确定) 原子形成共价分子时,首先形成b键,两原子之间必有且只有1个b键;b键一般比n 键牢固,n键是化学反应的积极参与者。 形成稳定的n键要求原子半径比较小,所以多数情况是在第二周期元素原子间形成。如 C02分子中碳、氧原子之间以p-p b键和p-p n键相连,而SiO2的硅、氧原子之间就没有p-p n键。 【课堂练习1】 (1)下列说法不正确的是 A .乙烷分子中的6个C —H和1个C —C键都为b键,不存在n键 B ?气体单质中,一定有b键,可能有n键 C.两个原子间共价键时,最多有一个b键 D . b键与n键重叠程度不同,形成的共价键强度不同 (2)有机物CH2= CH —CH2—C三CH分子中,C—H b键与C —C b键的数目之比为;b键与n 键的数目之比为。 二、键参数一一键能、键长与键角 2-1键能的意义和应用 a.判断共价键的强弱 b.判断分子的稳定性 c.判断物质的反应活性 d.通过键能大小比较,判断化学反应中的能量变化 【思考】 比较C —C和C= C的键能,分析为什么乙烯的化学性质比乙烷活跃,容易发生加成反 应? 2-2键长的意义和应用 键长越短,往往键能越大,表明共价越稳定。(键长的长短可以通过成键原子半径大小 来判断) 2个原子间的叁键键长v双键键长v单键键长 2-3键角的意义 键角决定分子的空间构型,是共价键具有方向性的具体表现。 【典例分析】碳、氮两种元素都能形成单键、双键和叁键。测得二者键能有如下规律: 3 E N> 2 E N =N > E N—N; -3E C V E c= c< E C—C 试分析为什么氮分子不易发生加成反应,而乙烯和乙炔容易发生加成反应?
振动试验理论基础与方法培训
奥 申 检 测 振动试验理论基础与方法培训 主讲人:洪城明 上海奥申检测科技有限公司 培训目的: (1)基本了解振动试验相关的基础理论(2)掌握理解振动试验相关的核心理论 (3)了解振动试验设备结构、功能,掌握其主要参数范围 (4)了解振动试验传感器关键参数、掌握核查方法与使用注意点(5)理解并掌握正弦振动、随机振动的试验方法(6)理解并掌握冲击试验方法 (7)了解夹具要求、开发验证过程,掌握共振搜寻确认方法(8)掌握GMW17010对零件振动试验的要求、流程和方法
奥 申 检 测 1.1振动试验目的 在实验室内模拟一连串实际的振动现象,测试产品在寿命周期中,是否能承受运输、储存或使用过程的振动环境的考验。 1.2应用 (1)耐久测试——获得临界使用条件,确定产品设计和功能的使用边界、制定要求标准。 (2)质控测试——考核产品耐振动性能是否达标、提前筛检出不良品,确认质量和提升产品的可靠性。 (3)失效分析——模拟失效环境,分析失效模式,助力改进。 1.3测试原理 通过振动硬件(振动台、夹具、控制器、传感器),按照目标振动条件输入振动参数,对目标施加外部振动激励,目标产生振动响应,通过采集和分析响应信号,分析目标振动状态和耐振性。 2测试硬件 2.1振动试验台 2.1.1分类 振动试验设备分机械振动试验台、电液振动试验台、电动振动试验台、模拟汽车运输试验台。 (1) 机械式振动试验台:适宜于低频定振试验或低频定位移扫频试验。 (2) 电液式振动试验台:适宜于低频定振试验或中低频扫频试验及随机试验和冲击实验。 (3) 电动式振动试验台:适宜于任何形式的给定信号的振动及冲击试验。 (4) 模拟汽车运输试验台:可代替实际跑车试验 2.1.2电动振动台结构(振动台-振动发生器、控制器、功放、冷却器) 2.1.3电动振动台原理 励磁线圈如图示2-2在振动台台体内建立磁场,励磁线圈与直流电源相连,在环行气隙里产生一个高磁通量。动圈部件,包括台面、骨架和驱动线圈,悬挂在振动台的环行气隙里,当交流电流通过驱动线圈时,电磁力会在驱动线圈的绕组上产生,使得台面产生向上和向下的往复移动,如图示2-2中双向箭头处显示。台面的移动量取决于振动控制器输出的驱动信号的大小和频率以及扩展台面(如果有的话)的质量、所加的负载质量和台面悬挂系统的刚度。
机械振动理论基础及其应用(张).
机车传动轴振动分析与仿真优化Vibration Analysis of Commercial Vehicle Driveline 摘要:机车传动轴的振动及噪声直接影响了整车传动的平稳性与乘坐的舒适性,甚至影响到整车的可靠性。作为商用车制造厂,必须对传动轴的振动情况进行研究并对传动轴系进行合理的布置与设计,从根本上控制产生振动与噪声的因素。为了尽快解决某车型传动系振动带来的汽车传动轴中间支承横梁开裂的问题,本文应用了国内外的一些研究成果,从理论和试验两方面分析了某重型机车传动系振动的原因和机理,提出解决措施,并对传动系进行了优化设计。同时,本文还从系统论的观点出发,对传动系振动问题寻求最优解决方案。 关键词:传动轴系振动分析仿真优化 Abstract:The NVH of commercial-vehicle driveline directly affects easiness andsafety of the whole vehicle.In order to reduce the vibration and noise,it isnecessary for the vehicle manufacture to research the NVH of driveline and tocarry out rational layout and design to the driveline which is the fundamentalways of all.In this paper,some research results of the domestic and foreign havebeen applied to analyze the vibration of driveline theoretically andexperimentally.Furthermore,the vehicle chassis intermediate mounting crossmember abruption problem due to the vibration of driveline has been resolvedby optimizing the driveline layout.Based on system theory,this thesis givesout the optimal solution to the driveline vibration. Keywords: Vehicle Drive line;Vibration Analysis;Optimization 第一章引言 1.1课题背景和实际意义 机车是一个复杂的多自由度“质量—刚度—阻尼”振动系统,是由多个具有固有振动特性的子系统组成,如车身的垂直振动、纵向角振动和侧倾振动、发动机曲轴
机械振动理论基础及其应用
旋转机械振动与故障诊断研究综述 1.前言 工业生产离不开回转机械,随着装置规模不断扩大,越来越多的高速回转机械应用于工业生产,诸如高速离心压缩机、汽轮机发电机组。动态失稳造成的重大恶性事故屡见不鲜。急剧上升的振动可在几十秒之内造成机组解体,甚至祸及厂房,造成巨大的经济损失和人员伤亡。此外,机械振动可能降低设备机械性能,加速机械零部件的磨损,发出的噪声损害操作者的健康。但是振动也能合理运用,如工业上常用的振动筛、振动破碎等都是振动的有效利用。工程技术人员必须认真对待机械振动问题,当机组产生有害的振动时,及时分析原因,坚持用合理的振动测试标准,采取科学的防治措施。 2.旋转机械振动标准 ●旋转机械分类: Ⅰ类:为固定的小机器或固定在整机上的小电机,功率小于15KW。 Ⅱ类:为没有专用基础的中型机器,功率为15~75KW。刚性安装在专用基础上功率小于300KW的机器。 Ⅲ类:为刚性或重型基础上的大型旋转机械,如透平发电机组。 Ⅳ类:为轻型结构基础上的大型旋转机械,如透平发电机组。 ●机械振动评价等级: 好:振动在良好限值以下,认为振动状态良好。 满意:振动在良好限值和报警值之间,认为机组振动状态是可接受的(合格),可长期运行。 不满意:振动在报警限值和停机限值之间,机组可短期运行,但必须加强监测并采取措施。 不允许:振动超过停机限值,应立即停机。 3.振动产生的原因 旋转机械振动的产生主要有以下四个方面原因,转子不平衡,共振,转子不对中和
机械故障。 4.旋转机械振动故障诊断 4.1转子不平衡振动的故障特征 当发生不平衡振动时,其故障特征主要表现在如下方面: 1 )不平衡故障主要引起转子或轴承径向振动,在转子径向测点上得到的频谱图, 转速频率成分具有突出的峰值。 2 )单纯的不平衡振动,转速频率的高次谐波幅值很低,因此在时域上的波形是一个正弦波。 3 )转子振幅对转速变化很敏感,转速下降,振幅将明显下降。 4 )转子的轴心轨迹基本上为一个圆或椭圆,这意味着置于转轴同一截面上相互垂直的两个探头,其信号相位差接近90°。 4.2旋转机械振动模糊诊断 4.2.1 振动模糊诊断基本原理 振动反映了系统状态及变化规律的主要信息,统计资料表明:机械设备的故障有67 % 左右是由于振动引起的,并且能从振动和振动辐射出的噪声反映出来。回转机械的振动信息尤其明显,且振动诊断具有快速、简便、准确和在线诊断等一系列优点,所以振动诊断法是旋转机械状态识别和故障诊断的最有效、最常用的方法。 但是,由于机械系统本身的复杂性以及所摄取的振动信号强烈的模糊性,使故障之间没有清晰的界限,这时利用传统的振动频谱分析,对一个故障可能有多个征兆来表现,一个征兆也可能有多个故障原因的复杂现象,往往难定两者的对应关系进行指导维修。振动模糊法,将模糊数学与振动诊断相结合,利用模糊综合评判技术,较好地处理了回转机械故障的不确定性问题。 4.2.2旋转机械振动模糊诊断法的实现 隶属函数的确定
机械振动理论及工程应用
机械振动学学习报告 摘要:简述了机械振动学的发展历程,振动利用中的若干新工艺理论与技术,振动机械及其相关技术的应用与发展,介绍了振动在人类生活工作中起到了非常重要的作用。通过对具体实例——单电机振动给料机的计算分析,得出机械振动对机器工作性能的影响。并介绍了单自由度、多自由度的线性振动系统振动的基本理论和隔振的基本原理。关键词:机械振动;振动给料机;线性振动系统 Abstract:This paper describes the development course of study of mechanical vibration and the utilization of some new technology theory and technology. The vibration has played a very important role in human life and work. By analyzing the practical example-single motor , vibrating feeder calculation and analysis of mechanical vibration machine has influence on the performance. And introduced the single-degree-of-freedom, multi-freedom system vibration of the linear vibration of the basic theory and the basic principle of vibration isolation. Keywords:Mechanical vibration; Vibrates the feeding machine; Linear vibration system 第一章绪论 1.1振动振动学的发展 振动振动学科是20世纪后半期逐渐形成和发展起来的一门新学科。目前正处在迅速发展过程中,由于该学科所涉及的有关技术与工业生产及人类生活联系十分密切,它能为社会创造重大的经济效益和社会效益,能为人类生活提供极大的方便和良好的服务,目前已成为人类生产活动与生活过程中一种不可缺少的手段与必要的机制。国内以闻邦椿院士为首的科研团队一直以极大的精力从事这一领域的研究,在振动利用工程这一学科的多个领域取得了一系列的研究成果,促进了该学科的形成与发展。自然界和人类社会中的某一个量随时间或大或小的变化即称为振动。振动是物质世界运动的一种基本形式,物质世界中的每一个物体及其中的每一个分子都始终处于振动之中。毫无例外,人类自身的每一器官也每时每刻都处在振动之中,例如,心脏的搏动、血液的循环、肺部的张缩呼吸、脑细胞的思维以及耳膜的振动和声带的振动等,前面所列举的这些振
基础无机:Lewis共价键理论和共振结构式
基础无机:Lewis共价键理论和共振结构式 作者:虹Rreflect_F 本文受众:高中以上 Lewis共价键理论是经典的共价键理论。当然,在MO,VB等面前可能不值一提。但是原始与简单也有它的好处,如果我们可以用一些更为简单的方法去解释一些分子结构给出的信息,何乐而不为呢?就如同在适合的时候没必要使用洛仑兹变换而使用伽利略变换一样。这个也是它在基础有机化学中应用十分广泛的原因。故在这里提及一些关于Lewis结构式的内容。 *注:在Lewis结构式里我们讨论的是分子或者是以共价键组成的离子,而且主要针对主族元素。副族元素的化合物置于配位化合物部分进行讨论。 一.Lewis结构式的书写 1.八隅律 中心原子通过电子共用达到周围8价电子的稳定结构(H为2电子)。 2. 几种Lewis结构的书写方法: 一种(左图)是高中所熟知的电子式,标准式(中间)是把电子式中共用电子对用短线代替,只需要标出孤对电子。还有一种(右图)是在孤对电子较多时可以弃去孤对电子来表示分子的结构。 3. 键数的计算: 有了八隅律作为规则就可以轻易的算出化合物中的键数n。 我们设分子中有a个重原子(除了氢原子以外的其他原子,在等电子体部分中有提及)b个氢原子,那么我们所拥有的价电子数可以通过计算得出设为c。那么我们达到理想结构每个原子都达到8电子的稳定结构,所总共的电子为8a+2b,很显然我们多算了电子,而这个多算的电子数目是8a+2b-c。 这些多的电子通过共用电子对来实现互补,2个电子一根键所以总键数就是4a+b-c/2。 以HCN为例n=4*2+1-(1+4+5)/2=4,所以共4根键。 4. 形式电荷 有时我们画出来的分子周围多了电子或者少了电子,这样就可以看作多了电子的原子丢掉一个(或
共价键理论
教案用纸 教学内容、方法及过程 附 记第5讲 (2课时) 授课日期:2016.10.06 教学目的:掌握共价键形成,特征,类型及键参数 教学重点:共价键特征及类型; 教学难点:共价键类型及键参数 教学设计:1、首先给大家引入共价键的形成原理。 2、着重分析共价键的类型以及三种键参数。 教学内容: 第六章分子结构与晶体结构 第一节共价键理论 1916年,路易斯提出共价键理论。 靠共用电子对,形成化学键,得到稳定电子层结构。 定义:原子间借用共用电子对结合的化学键叫作共价键。 对共价键的形成的认识,发展提出了现代价键理论和分子轨道理论。 一、共价键的形成和本质(应用量子力学) 当两个氢原子(各有一个自旋方向相反的电子)相互靠近,到一定距离时,会发生 相互作用。每个H原子核不仅吸引自己本身的1s电子还吸引另一个H原子的1s电子,平衡之前,引力>排斥力,到平衡距离d,能量最低:E0﹤2E,形成稳定的 共价键。 H原子的玻尔半径:53pm,说明H2分子中两个H原子的1S轨道必然发生
教案用纸 教学内容、方法及过程 附 记重叠,核间形成一个电子出现的几率密度较大的区域。这样,增强了核间电子云对 两核的吸引,削弱了两核间斥力,体系能量降低,更稳定。 (核间电子在核间同时受两个核的吸引比单独时受核的吸引要小,即位能低,∴能 量低) 二、价键理论的要点 1、要有自旋相反的未配对的电子 H↑+ H↓ -→ H↑↓H 表示:H:H或H-H 2、电子配对后不能再配对即一个原子有几个未成对电子,只能和同数目的自旋方 向相反的未成对电子成键。如:N:2s22p3,N≡N或NH3 ,这就是共价键的饱和 性。 3、原子轨道的最大程度重叠(重叠得越多,形成的共价键越牢固) 三、共价键的特征 饱和性、方向性 四、共价键的类型 1、σ键和π键(根据原子轨道重叠方式不同而分类) s-s :σ键,如:H-H s-p :σ键,如:H-Cl p-p :σ键,如:Cl-Cl π键, 单键:σ键
分子结构与晶体结构完美版
第六章分子结构与晶体结构 教学内容: 1.掌握杂化轨道理论、 2.掌握两种类型的化学键(离子键、共价键)。 3.了解现代价键理论和分子轨道理论的初步知识,讨论分子间力和氢键对物质性质的影响。 教学时数:6学时 分子结构包括: 1.分子的化学组成。 2.分子的构型:即分子中原子的空间排布,键长,键角和几何形状等。 3.分子中原子间的化学键。 化学上把分子或晶体中相邻原子(或离子)之间强烈的相互吸引作用称为化学键。化学键可分为:离子键、共价键、金属键。 第一节共价键理论 1916年,路易斯提出共价键理论。 靠共用电子对,形成化学键,得到稳定电子层结构。 定义:原子间借用共用电子对结合的化学键叫做共价键。 对共价键的形成的认识,发展提出了现代价键理论和分子轨道理论。 1.1共价键的形成 1.1.1 氢分子共价键的形成和本质(应用量子力学) 当两个氢原子(各有一个自旋方向相反的电子)相互靠近,到一定距离时,会发生相互作用。每个H原子核不仅吸引自己本身的1s电子还吸引另一个H原子的1s电子,平衡之前,引力>排斥力,到平衡距离d,能量最低:形成稳定的共价键。 H原子的玻尔半径:53pm,说明H2分子中两个H原子的1S轨道必然发生重叠,核间形成一个电子出现的几率密度较大的区域。这样,增强了核间电子云对两核的吸引,削弱了两核间斥力, 体系能量降低,更稳定。(核间电子在核间同时受两个核的吸引比单独时受核的吸引要小,即位能低,∴能量低)。
1.1.2 价键理论要点 ①要有自旋相反的未配对的电子 H↑+ H↓ -→ H↑↓H 表示:H:H或H-H ②电子配对后不能再配对即一个原子有几个未成对电子,只能和同数目的自旋方向相反的未成对电子成键。如:N:2s22p3,N≡N或NH3 这就是共价键的饱和性。 ③原子轨道的最大程度重叠 (重叠得越多,形成的共价键越牢固) 1.1.3 共价键的类型 ①σ键和π键(根据原子轨道重叠方式不同而分类) s-s :σ键,如:H-H s-p :σ键,如:H-Cl p-p :σ键,如:Cl-Cl π键, 单键:σ键 双键:一个σ键,一个π键 叁键:一个σ键,两个π键 例:N≡N σ键的重叠程度比π键大,∴π键不如σ键牢固。 σ键π键 原子轨道重叠方式头碰头肩并肩 能单独存在不能单独存在 沿轴转180O符号不变符号变 牢固程度牢固差 含共价双键和叁键的化合物的重键容易打开,参与反应。
无机化学第10章共价键与分子结构习题全解答.doc--12-19
第10章共价键与分子结构 1.写出下列物质的Lewis结构式并说明每个原子如何达到八电子结构:HF,H2Se, H2C2O4(草酸),CH3OCH3(甲醚),H2CO3,HClO,H2SO4,H3PO4。 解: ,,,, ,,。 上述分子中的原子除H原子外,其他原子通过所形成的共价键共有电子和价电子层孤对电子共同构成8电子结构。 2、用杂化轨道理论说明下列化合物由基态原子形成分子的过程(图示法)并判断分子的空间构型和分子极性:HgCl2,BF3,SiCl4,CO2,COCl2,NCl3,H2S,PCl5。 解: ①HgCl2 HgCl2分子的中心原子为Hg原子。基态时Hg原子的价电子构型为6s2。当Hg 原子与Cl原子相遇形成HgCl2时,Hg的6s轨道中的1个电子激发到1个6p轨道,然后6s轨道和该6p轨道采用sp杂化形成2个等同的sp杂化轨道: 并分别与两个Cl原子的3p单电子轨道重叠形成2个Hg-Cl σ键。HgCl2分子构型是直线形,为非极性分子。 ②BF3 BF3分子的中心原子是B原子。基态时B原子的价电子构型为2s22p1。当B原子与F原子相遇形成BF3分子时,B原子2s轨道中的1个电子激发到1个空的2p 轨道,然后采用sp2杂化形成3个等同的sp2杂化轨道: 并分别与3个F原子2p单电子轨道重叠形成3个B-F σ键。BF3分子构型是平面三角形,为非极性分子。 ③SiCl4 Si原子为SiCl4的中心原子,基态时价电子构型为3s23p2,当Si原子与Cl原子相遇形成SiCl4分子时,Si原子3s轨道的1个电子激发到一个空的3p轨道,然后
采用sp3杂化形成4个等同的sp3杂化轨道: 并分别与4个Cl原子3p单电子轨道重叠形成4个Si-Cl σ键。SiCl4分子构型是正四面体,为非极性分子。 ④CO2 C原子为CO2的中心原子。基态时C原子价电子构型为2s22p2,当C原子与O 原子相遇形成CO2分子时,C原子2s轨道的1个电子激发到一个空的2p轨道,然后采用sp杂化形成2个等同的sp杂化轨道: 并分别与2个O原子的2p单电子轨道重叠形成2个σ键,两个O原子的一个2p 单电子轨道与C原子未参与杂化的2p轨道肩并肩重叠形成π键。CO2分子构型是直线形,为非极性分子。 ⑤COCl2 C原子为COCl2的中心原子。基态时C原子价电子构型为2s22p2,当C原子与O 原子、Cl原子相遇形成COCl2分子时,C原子2s轨道的1个电子激发到一个空的2p轨道,然后采用sp2杂化形成3个sp2杂化轨道: 其中2个sp2杂化轨道分别与2个Cl原子的3p单电子轨道重叠形成2个C-Clσ键,另一个sp2杂化轨道和O原子的2p单电子轨道形成C-Oσ键,O原子另一个2p单电子轨道与C原子未参加杂化的2p轨道肩并肩重叠形成π键。COCl2分子构型是三角形,为极性分子。 ⑥NCl3 N原子为NCl3的中心原子。基态时N原子价电子构型为2s22p3, 当N原子与Cl 原子相遇形成NCl3分子时,N原子采取sp3杂化形成4个sp3杂化轨道: 其中3个sp3杂化轨道分别与3个Cl原子的3p单电子轨道重叠形成3个C-Clσ键,另一个sp3轨道被孤对电子占据。NCl3分子构型是三角锥,为极性分子。 ⑦H2S S原子为H2S的中心原子。基态时S原子价电子构型为3s23p4, 当S原子与H 原子相遇形成H2S分子时,S原子采取sp3杂化形成4个sp3杂化轨道: 其中2个sp3杂化轨道分别与2个H原子的1s单电子轨道重叠形成2个H-Sσ键,另外2个sp3杂化轨道被孤对电子占据。H2S分子构型是V形,为极性分子。
第十章共价键与分子结构
第十章共价键与分子结构(4学时) 教学重点:1.共价键的形成、特点; 2.了解物质的性质与分子结构和键参数的关系; 教学难点:1.价层电子对互斥理论; 2.杂化轨道理论。 分子结构研究的内容包括: (1)分子或晶体中直接相邻的原子或离子之间的化学键的类型及性质; (2)分子或晶体中原子或离子的排布(空间构型); (3)分子与分子之间存在的相互作用力(范德华力); (4)分子的结构与物质的物理、化学性质的关系等。 第一节现代价键理论 离子键理论虽能很好地说明离子型化合物的生成和性质,但对于由相同原 子结合形成的单质分子,例:H 2、Cl 2 、N 2 等的形成,或由性质相近的非金属原 子形成的化合物分子,例HCl、H 2 O等。其原子间的结合力和性质却不能以离 子键理论说明。因为在这类分子的形成过程中原子间并无明显的电子得失,不可能由静电引力把组成分子的原子结合在一起。共价键理论就是说明这类化学键的形成、特点及结合力的本质的理论。 1916年美国化学家路易斯为了说明分子的形成,提出了经典的价键理论。他认为分子中每个原子应具有稳定的稀有气体原子的电子层结构,但该结构不是靠电子转移,而是通过原子间共用一对或若干对电子来实现的。这种分子中原子间通过共用电子对结合形成的化学键称为共价键。例: 该理论优点:解释了相同原子或性质相近的不同原子组成的分子。例Cl 2 HCl, . 但也存在一些问题:如 1、由经典静电理论,同性电荷应该相斥,而二个电子皆带负电荷,为何不相斥,反而互相配对。 2、不能说明共价键的方向性。 3、有些化合物分子,中心原子最外层电子数虽少于8(如BF 3 )或多 于8(PCl 5 )也能稳定存在。 为解决以上问题,最终由鲍林在前人基础上,提出了现代价键理论,简称VB法(电子配对法)。
共价键理论
共价键理论 一.路易斯理论 1916年,美国的Lewis 提出共价键理论. 认为分子中的原子都有形成稀有气体电子结构的趋势,求得本身的稳定. 而达到这种结构,并非通过电子转移形成离子键来完成, 而是通过共用电子对来实现. 通过共用一对电子, 每个H均成为He 的电子构型, 形成共价键. 又如: Lewis的贡献在于提出了一种不同于离子键的新的键型, 解释了X 比较小的元素之间原子的成键事实. 但Lewis没有说明这种键的实质, 适应性不强. 在解释BCl3, PCl5等未达到稀有气体结构的分子时, 遇到困难: 二价键理论(Valence Bond Theory) 1927年, Heitler 和London 用量子力学处理氢气分子H2, 解决了两个氢原子之间化学键的本质问题, 使共价键理论从典型的Lewis理论发展到今天的现代共价键理论. 1. 氢分子中的化学键 量子力学计算表明, 两个具有电子构型的H 彼此靠近, 两个1s 电子以自旋相反的方式形成电子对, 使体系的能量降低. H < 0, 表示由2H 形成H2时, 放出热量. 相反过程: 吸热,即破坏H2的键要吸热(吸收能量), 此热量D 的大小与H2分子中的键能有关. 计算还表明, 若两个1s 电子保持以相同自旋的方式, 则r 越小, V 越大. 此时, 不形成化学键. 如图中上方红色曲线所示, 能量不降低. H2中的化学键可以认为是电子自旋相反成对, 使体系的能量降低. 从电子云角度考虑, 可认为H 的1s轨道在两核间重叠, 使电子在两核间出现的几率大, 形成负电区, 两核吸引核间负电区, 使H 结合在一
起. 如图: 2. 价键理论 将对H2的处理结果推广到其它分子中, 形成了以量子力学为基础的价键理论(V. B. 法) 1) 共价键的形成 A, B 两原子各有一个成单电子,当A, B 相互接近时, 两电子以自旋相反的方式结成电子对, 即两个电子所在的原子轨道能相互重叠, 则体系能量降低, 形成化学键, 亦即一对电子则形成一个共价键. 形成的共价键越多, 则体系能量越低, 形成的分子越稳定. 因此, 各原子中的未成对电子尽可能多地形成共价键. 例如: H2中, 可形成一个共价键. HCl 分子中, 也形成一个共价键. N2分子怎样呢? 已知N 原子的电子结构: 每个N原子有三个单电子, 所以形成N2 分子, N 与N 原子之间可形成三个共价键. 写成: 形成CO 分子时, 与N2相仿, 同样用了三对电子, 形成三个共价键. 不同之处是, 其中一对电子在形成共价键时具有特殊性: C 和O各出一个2p 轨道, 重叠, 而其中的电子是由O 单独提供的。 这样的共价键称为共价配位键. 于是, CO 可表示成: 配位键形成条件:一种原子中有对电子, 而另一原子中有可与对电子所在轨道相互重叠的空轨道. 在配位化合物中, 经常见到配位键. 在形成共价键时, 单电子也可以由对电子分开而得到, 如CH4: C原子: 2s 中一个电子跃迁到空的2p轨道中(注:需要吸收能量!), 称为激发. 则形成CH4分子时, C与4个H 成键. 这将比形成2个共价键释放更多的能量, 足以补偿激发时吸收的能量. 同样, 对PCl5的分子成键也容易解释了:
第二章共价键理论和分子结构讲解
第二章 化学键与分子结构 一、单项选择题(每小题1分) 1. σ型分子轨道的特点是( ) ① 能量最低 ② 其分布关于键轴呈圆柱形对称 ③ 无节面 ④ 由s 原子轨道组成 2. F 2+,F 2,F 2- 的键级顺序为( ) ① F 2+ > F 2 > F 2- ② F 2+ < F 2 < F 2- ③ F 2 > F 2- > F 2+ ④ F 2 < F 2- < F 2+ 3. 呋喃的分子图为 0.36 ,关于它的反应活性,下列说法正确的是( ) ① 自由基易在3位发生反应 ② 亲核基团易在1位发生反应 ③ 亲核基团易在3位发生反应 ④ 亲电试剂易在3位发生反应 4. 以下哪个分子的π电子离域能最大( ) ① 环丙稀自由基 ② 环丁二烯 ③ 环戊二烯负离子 ④ 苯分子 5. 属于下列点群的分子哪个为非极性分子( ) ① D 6h ② C s ③ C 3v ④ C ∞v 6. 分子轨道的含义是( ) ① 分子空间运动的轨迹 ② 描述分子电子运动的轨迹 ③ 描述分子空间轨道运动的状态函数 ④ 描述分子中单个电子空间运动的状态函数 7. π型分子轨道的特点是( ) ① 分布关于键轴呈圆柱形对称 ② 有一个含键轴的节面 ③ 无节面 ④ 由p 原子轨道组成 8. F 2+,F 2,F 2- 的键长顺序为( ) ① F 2+ > F 2 > F 2- ② F 2+ < F 2 < F 2- ③ F 2 > F 2- > F 2+ ④ F 2 < F 2- < F 2+ 9.CO 分子的一个成键轨道O C c c φφψ21+=,且|c 1|>|c 2|,此分子轨道中电子将有较大的几率出现在( ) ① C 核附近 ② O 核附近 ③ CO 两核连线中点 ④ CO 两核之间 10.属于下列分子点群的分子哪个偶极矩不为零( ) ① T d ② D n ③ D 4h ④ C ∞v 11.杂化轨道是由( ) ① 同一原子的原子轨道线性组合得到的 ② 两个原子中原子轨道的线性组合而得到的
