不同种类的元素周期表

不同种类的元素周期表
2015级六班甘浩弘1.扇形元素周期表
2.四棱锥形元素周期表
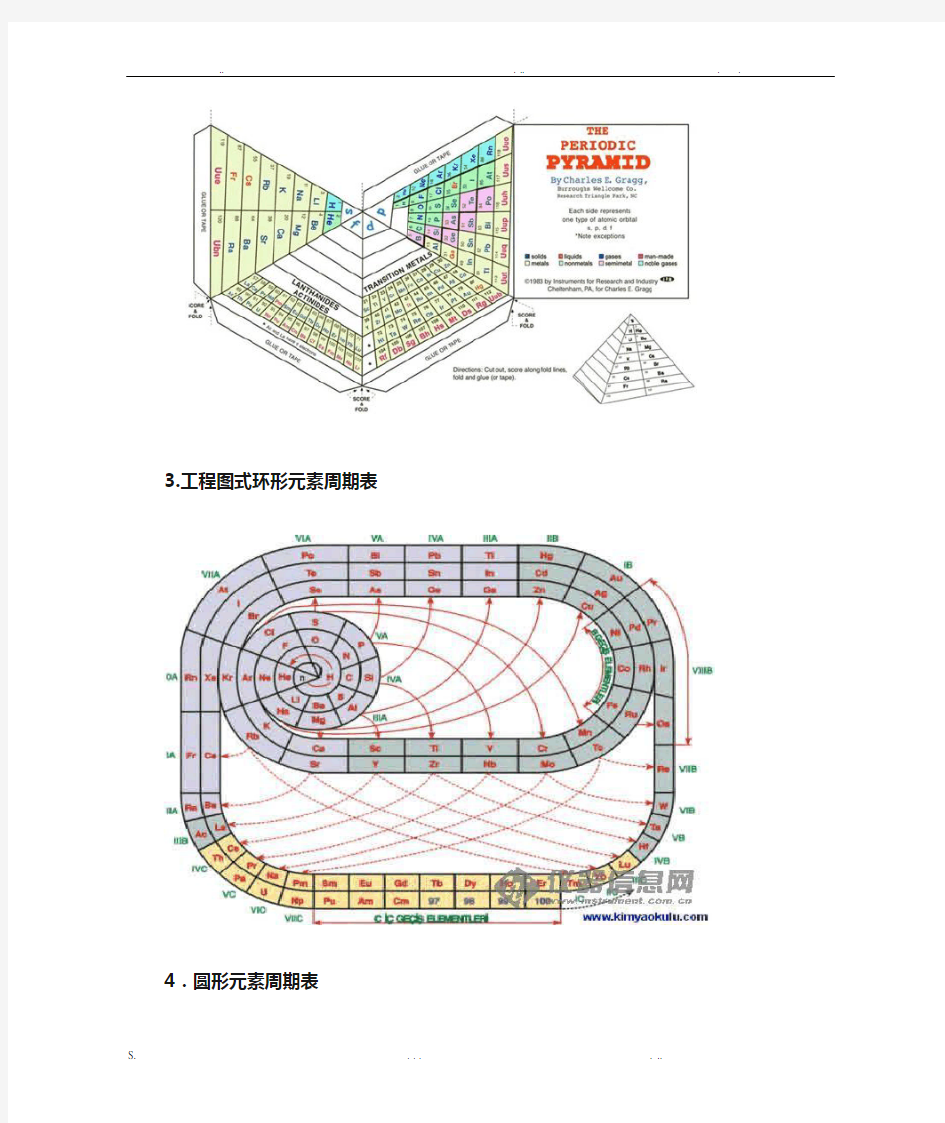
3.工程图式环形元素周期表
4.圆形元素周期表
5.圆环形元素周期表6
6.树式元素周期表
7.螺旋式立体元素周期表
8.塔式元素周期表
9.螺旋时钟式元素周期表
11.零件式元素周期表
12.太极八卦式元素周期表
规律:1.原子序数依次递增
2.不同种类的元素周期表都显示出元素性质与其位置之间的联系。
3.元素的最外层电子数显示出周期性的变化特征
4.在同一方向上的元素其性质往往有一定的相似性
5.元素相对原子质量随原子序数增加
高中化学第1章第2节原子结构与元素周期表第2课时核外电子排布与元素周期表原子半径教案鲁科版选修3
第2课时核外电子排布与元素周期表、原子半径 [学习目标定位] 1.了解核外电子排布规律与元素周期表中周期、族划分的关系,并能解释它们之间的变化规律。2.了解原子半径的意义及其测定方法,知道原子半径与原子核外电子排布的关系,并能解释原子半径在周期表中的变化规律。 一、核外电子排布与元素周期表 1.原子核外电子排布与周期的划分 (1)填写下表: (2)观察分析上表,讨论原子核外电子排布与周期划分的本质联系。 ①根据能级能量的差异,可将能量相近的能级分为七个能级组,同一能级组内,各能级能量相差较小,各能级组之间能量相差较大。 ②每一个能级组对应一个周期,且该能级组中最大的电子层数等于元素的周期序数。
③一个能级组最多容纳的电子数等于对应的周期所含的元素种数。 2.原子核外电子排布与族的划分 (1)将下列各主族元素的价电子数、价电子排布式填入表中: (2)以第4周期副族元素为例,填写下表: (3)依据上述表格,分析讨论族的划分与原子核外电子排布的关系。 族的划分依据与原子的价电子数目和价电子排布密切相关。 ①同主族元素原子的价电子排布相同,价电子全部排布在最外层的n s或n s n p轨道上。族序数与价电子数相同。 ②稀有气体的价电子排布为1s2或n s2n p6。 ③过渡元素(副族和第Ⅷ族)同一纵行原子的价电子排布基本相同。价电子排布式为(n-1)d1~10n s1~2,第ⅢB~ⅦB族的族序数与价电子数相同,第ⅠB、ⅡB族的族序数=n s轨道上的电子数,第Ⅷ族的价电子数分别为8、9、10。 3.原子核外电子排布与区的划分
(1)最外层电子排布与周期表的关系 ①原子的电子层数=能级中最高能层序数=周期序数 ②主族元素原子的最外层电子数=主族元素原子的价电子数=主族序数 (2)对价电子认识的误区提醒 ①价电子不一定是最外层电子,只有主族元素的价电子才是最外层电子。对于过渡元素还包括部分内层电子。 ②元素的价电子数不一定等于其所在族的族序数。这只对主族元素成立,对部分过渡元素是不成立的。 ③同一族元素的价电子排布不一定相同,如过渡元素中的镧系元素和锕系元素就不相同,在第Ⅷ族中部分元素的价电子排布也不相同。 例
元素周期表中的规律
元素周期表中的规律 一、元素周期表 1、周期表结构 横行——周期:共七个周期,三短三长一不完全。 各周期分别有2,8,8,18,18,32,26种元素。前三个周期为短周期,第四至第六这三个周期为长周期,第七周期还没有排满,为不完全周期。 纵行——族:七主七副一零一VIII,共16族,18列。要记住零族元素的原子序数以便迅速由原子序数确定元素名称。 周期:一二三四五六七 元素种类:28818183226 零族:2He10Ne 18Ar 36Kr54Xe86Rn 二、元素周期表中元素及其化合物的递变性规律 1.原子结构与元素周期表的关系 电子层数= 周期数 主族元素最外层电子数= 主族序数= 最高正化合价 由上述关系,就可以由原子结构找出元素在周期表中的位置,也可以由位置确定原子结构。 2、规律性
由此可见,金属性最强的元素在周期表的左下角即Cs(Fr具有放射性,不考虑),非金属性最强的元素在右上角即F。对角线附近的元素不是典型的金属元素或典型的非金属元素。 3、元素周期表中之最 原子半径最小的原子:H原子 质量最轻的元素:H元素; 非金属性最强的元素:F 金属性最强的元素:Cs(不考虑Fr) 最高价氧化物对应水化物酸性最强的酸:HClO4 最高价氧化物对应水化物碱性最强的碱:CsOH 形成化合物最多的元素:C元素 所含元素种类最多的族:ⅢB 地壳中含量最高的元素:O元素,其次是Si元素 地壳中含量最高的金属元素:Al元素,其次是Fe元素 含H质量分数最高的气态氢化物:CH4 与水反应最剧烈的金属元素:Cs元素 与水反应最剧烈的非金属元素:F元素 常温下为液态的非金属单质是Br2,金属单质是Hg …… 4、特殊性
元素周期表变化规律
(一)元素周期律和元素周期表 1.元素周期律及其应用 (1)发生周期性变化的性质 原子半径、化合价、金属性和非金属性、气态氢化物的稳定性、最高价氧化物对应水化物的酸性或碱性。 (2)元素周期律的实质 元素性质随着原子序数递增呈现出周期性变化,是元素的原子核外电子排布周期性变化的必然结果。也就是说,原子结构上的周期性变化必然引起元素性质上的周期性变化,充分体现了结构决定性质的规律。 2.比较金属性、非金属性强弱的依据 (1)金属性强弱的依据 1/单质跟水或酸置换出氢的难易程度(或反应的剧烈程度)。反应越易,说明其金属性就越强。 2/最高价氧化物对应水化物的碱性强弱。碱性越强,说明其金属性也就越强,反之则弱。 3/金属间的置换反应。依据氧化还原反应的规律,金属甲能从金属乙的盐溶液中置换出乙,说明甲的金属性比乙强。 4/金属阳离子氧化性的强弱。阳离子的氧化性越强,对应金属的金属性就越弱。 (2)非金属性强弱的依据 1/单质跟氢气化合的难易程度、条件及生成氢化物的稳定性。越易与反应,生成的氢化物也就越稳定,氢化物的还原性也就越弱,说明其非金属性也就越强。2/最高价氧化物对应水化物酸性的强弱。酸性越强,说明其非金属性越强。 3/非金属单质问的置换反应。非金属甲把非金属乙对应的阴离子从其盐溶液中置换出来,说明甲的非金属性比乙强。如Br2 + 2KI == 2KBr + I2 4/非金属元素的原子对应阴离子的还原性。还原性越强,元素的非金属性就越弱。 3.常见元素化合价的一些规律 (1)金属元素无负价。金属单质只有还原性。 (2)氟、氧一般无正价。 (3)若元素有最高正价和最低负价,元素的最高正价数等于最外层电子数;元素的最低负价与最高正价的关系为:最高正价+|最低负价|=8。 (4)除某些元素外(如N元素),原子序数为奇数的元素,其化合价也常呈奇数价,原子序数为偶数的元素,其化合价也常呈偶数价,即价奇序奇,价偶序偶。 若元素原子的最外层电子数为奇数,则元素的正常化合价为一系列连续的奇数,若有偶数则为非正常化合价,其氧化物是不成盐氧化物,如NO;若原子最外层电子数为偶数,则正常化合价为一系列连续的偶数。
元素周期表的规律总结
元素周期表的规律 一、原子半径 同一周期(稀有气体除外),从左到右,随着原子序数的递增,元素原子的半径递减; 同一族中,从上到下,随着原子序数的递增,元素原子半径递增。 二、主要化合价(最高正化合价和最低负化合价) 同一周期中,从左到右,随着原子序数的递增,元素的最高正化合价递增(从+1价到+7价),第一周期除外,第二周期的O、F元素除外最低负化合价递增(从-4价到-1价)第一周期除外,由于金属元素一般无负化合价,故从ⅣA族开始。元素最高价的绝对值与最低价的绝对值的和为8 三、元素的金属性和非金属性 同一周期中,从左到右,随着原子序数的递增,元素的金属性递减,非金属性递增;同一族中,从上到下,随着原子序数的递增,元素的金属性递增,非金属性递减; 四、单质及简单离子的氧化性与还原性 同一周期中,从左到右,随着原子序数的递增,单质的氧化性增强,还原性减弱;所对应的简单阴离子的还原性减弱,简单阳离子的氧化性增强。同一族中,从上到下,随着原子序数的递增,单质的氧化性减弱,还原性增强;所对应的简单阴离子的还原性增强,简单阳离子的氧化性减弱。元素单质的还原性越强,金属性就越强;单质氧化性越强,非金属性就越强。 五、最高价氧化物所对应的水化物的酸碱性 同一周期中,从左到右,元素最高价氧化物所对应的水化物的酸性增强(碱性减弱); 同一族中,从上到下,元素最高价氧化物所对应的水化物的碱性增强(酸性减弱)。 元素的最高价氢氧化物的碱性越强,元素金属性就越强;最高价氢氧化物的酸性越强,元素非金属性就越强。 六、单质与氢气化合的难易程度 同一周期中,从左到右,随着原子序数的递增,单质与氢气化合越容易; 同一族中,从上到下,随着原子序数的递增,单质与氢气化合越难。 七、气态氢化物的稳定性 同一周期中,从左到右,随着原子序数的递增,元素气态氢化物的稳定性增强; 同一族中,从上到下,随着原子序数的递增,元素气态氢化物的稳定性减弱。 此外还有一些对元素金属性、非金属性的判断依据,可以作为元素周期律的补充: 随同一族元素中,由于周期越高,价电子的能量就越高,就越容易失去,因此排在下面的元素一般比上面的元素更具有金属性。元素的气态氢化物越稳定,非金属性越强。 同一族的元素性质相近。 以上规律不适用于稀有气体。 八、位置规律判断元素在周期表中位置应牢记的规律: (1)元素周期数等于核外电子层数; (2)主族元素的族数等于最外层电子数。 九、阴阳离子的半径大小辨别规律 三看: 一看电子层数,电子层数越多,半径越大, 二看原子序数,当电子层数相同时,原子序数越大半径反而越小 三看最外层电子数,当电子层数和原子序数相同时最外层电子书越多半径越小 r(Na)>r(Mg)>r(Al)>r(S)>r(Cl)、r(Na+ ) >r(Mg2+ )>r(Al3+ )、r(O2- ) >r(F-) r(S2—)>r(Cl—)>r(Ar) >r(K+)>r(Ca2+)、r(O2—)> r(F—)> r(Na+)> r(Mg2+)> r(Al3+) r(Na+ )
元素周期率与元素周期表
专题六元素周期率与元素周期表 【考点分析】 1.掌握元素周期率的实质,了解元素周期表(长式)的结构(周期、族)。 2.以第3周期为例,掌握同一周期内元素性质(如:原子半径、化合价、单质及化合物性质)的递变规律与原子结构的关系;以ⅠA和ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。 3.以上知识是高考必考内容,常以选择题、简答题和推断填空题的形式出现。 【典型例题】 【例1】例1(2003上海理综)在人体所需的16种微量元素中有一种被称为生命元素的R 元素,对延长人类寿命起着重要的作用。已知R元素的原子有四个电子层,其最高价氧化物分子式为RO3,则R元素的名称 A.硫B.砷C.硒D.硅 【备选1】:周期表前20号元素中,某两种元素的原子序数相差1,它们形成化合物时,原子数之比为1﹕2,写出这些化合物的化学式______________ 【备选2】:X、Y、Z为短周期元素,这些元素原子的最外层电子数分别为1、4、6,则由这三种元素组成的化学式不可能是 A. XYZ B.X2YZ C.X2YZ2 D.X3YZ3 【例2】下列有关物质的性质比较正确的是 (1)同主族元素的单质从上到下,非金属性减弱,熔点增高 (2)元素的最高正化合价在数值上等于它所在的族序数 (3)同周期主族元素的原子半径越小,越难失去电子 (4)元素的非金属性越强,它的气态氢化物水溶液的酸性越强 (5)还原性:S2->Se2->Br->Cl- (6)酸性:HClO4>H2SO4>H3PO4>H2SiO3 A.(1)(3) B.(2)(4) C.(3)(6) D.(5)(6) 【备选1】下表是X、Y、Z三种元素的氢化物的某些性质: 元素熔点/℃沸点/℃与水的反应导电性(纯液体) X -283 -162 不反应不导电 Y -102 19 放热反应,形成酸性溶液不导电 Z 680 / 剧烈反应,生成H2,并形成碱性溶液导电 若X、Y、Z这三种元素属于周期表中的同一周期,则它们的原子序数递增的顺序是
元素周期表的九大规律
第七讲元素周期表和元素周期律 一、分析热点把握命题趋向 热点内容主要集中在以下几个方面:一是元素周期律的迁移应用,该类题目的特点是:给出一种不常见的主族元素,分析推测该元素及其化合物可能或不可能具有的性质。解该类题目的方法思路是:先确定该元素所在主族位置,然后根据该族元素性质递变规律进行推测判断。二是确定“指定的几种元素形成的化合物”的形式,该类题目的特点是:给出几种元素的原子结构或性质特征,判断它们形成的化合物的形式。解此类题的方法思路是:定元素,推价态,想可能,得化学式。三是由“位构性”关系推断元素,该类题目综合性强,难度较大,一般出现在第Ⅱ卷笔答题中,所占分值较高。 二.学法指导:1、抓牢两条知识链 (1)金属元素链:元素在周期表中的位置→最外层电子数及原子半径→原子失去电子的能力→元素的金属性→最高价氧化物对应水化物的碱性→单质置换水(或酸)中氢的能力→单质的还原性→离子的氧化性。 (2)非金属元素链:元素在周期表中的位置→最外层电子数及原子半径→原子获得电子的能力→元素的非金属性→最高价氧化物对应水化物的酸性→气态氢化物形成难易及稳定性→单质的氧化性→离子的还原性。
2、理解判断元素金属性或非金属性强弱的实验依据 (1)金属性强弱的实验标志 ①单质与水(或酸)反应置换氢越容易,元素的金属性越强。②最高价氧化物对应的水化物的碱性越强,元素的金属性越强。③相互间的置换反应,金属性强的置换弱的。④原电池中用作负极材料的金属性比用作正极材料的金属性强。⑤电离能 (2)非金属性强弱的实验标志 ①与氢气化合越容易(条件简单、现象明显),元素的非金属性越强。②气态氢化物越稳定,元素的非金属性越强。③最高价氧化物对应的水化物的酸性越强,元素的非金属性越强。④相互间置换反应,非金属性强的置换弱的。⑤电负性 三.规律总结: 1、同周期元素“四增四减”规律 同周期元素从左至右:①原子最外层电子数逐渐增多,原子半径逐渐减小;②非金属性逐渐增强,金属性逐渐减弱;③最高价氧化物对应的水化物的酸性逐渐增强,碱性逐渐减弱;④非金属气态氢化物的稳定性逐渐增强,还原性逐渐减弱。 2、同主族元素“四增四减四相同”规律 同主族元素从上到下:①电子层数逐渐增多,核对外层电子的引
元素周期表结构新题18-教师用卷答案修改
微专题--元素周期表结构新题答案 一、单选题 1、【答案】C 【解析】本题考查原子结构和元素周期律关系,侧重考查原子结构、元素周期表结构、元素化合物性质,正确推断Y元素是解本题的关键,题目难度中等。 【解答】W、X、Y、Z为同一短周期元素,根据图知,X能形成4个共价键、Z能形成1个共价键,则X位于第IVA族、Z位于第VIIA族,且Z核外最外层电子数是X核外电子数的一半,Z最外层7个电子,则X原子核外有14个电子,为Si,Z为Cl,该阴离子中Cl显?1价、X显+4价,根据阴离子中化合价的代数和为?1价,知Y为?3价,所以Y为P,根据阳离子所带电荷知,W为Na,通过以上分析知,W、X、Y、Z分别是Na、Si、P、Cl元素。 A.WZ为NaCl,NaCl的水溶液呈中性,故A错误; B.同一周期元素非金属性随着原子序数增大而增强,则非金属性Cl>P>Si,所以非金属性Z>Y>X,故B错误; C.Y为P,Y的最高价氧化物的水化物H3PO4为中强酸,故C正确; D.Y为P,其最外层有5个电子,P原子形成2个共价键且该阴离子得到W原子一个电子,所以P原子达到8电子结构,即Y原子达到8电子稳定结构,故D错误; 2、【答案】C 【解析】本题考查常见元素推断、同周期元素性质的递变规律、化学键类型的判断等,题目难度中等,熟练掌握元素周期表和元素周期律的知识是解题的关键。 【解答】由有机物分子结构式知,Y原子形成3个共价键,X能形成4个共价键,Z原子形成2个共价键,R形成一个共价键,再结合原子序数排序,R为氢或锂元素,Y为氮或磷元素,X为碳元素,Z为氧或硫元素。又因为R、Y的简单阴离子相差一个电子层,X、Y、Z位于同周期,所以R为氢元素,Y 为氮元素,Z为氧元素。 A.同周期从左到右原子半径逐渐减小,H原子半径最小,所以原子半径:C>N>O>H,故A错误; B.C同周期从左到右非金属性逐渐增强,C、N、O的非金属性依次增强,故B错误; C.H和O组成的简单化合物为H2O,只含极性共价键,故C正确; D.N的含氧酸中HNO2是弱酸,故D错误。 3、【答案】A 【解析】本题考查了离子键、共价键、离子化合物、共价化合物的判断,难度不大,注意离子化合物中可能含有共价键,但共价化合物中一定不含离子键。 【解答】A.根据电子式知,该物质中含有阴阳离子,所以是离子化合物,故A正确; B.根据电子式知,该物质中含有阴阳离子,所以是离子化合物不是共价化合物,故B错误; C.氢离子和铵根离子间存在离子键,铵根离子中氮原子和氢原子间存在共价键,故C错误; D.氢离子和铵根离子间存在离子键,铵根离子中氮原子和氢原子间存在共价键,故D错误。 4、【答案】A 【解析】本题考查原子结构与元素周期律,把握元素的性质、原子结构来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识及元素化合物知识的应用。 【解答】根据W、X、Y、Z为短周期原子序数依次增大的主族元素,W与X、Y、Z都能形成共价化合物,W应该为氢元素;Y、W形成的化合物溶于水显碱性,Y为N,Y、W形成的常见化合物为NH3;Z、W形成的化合物溶于水显酸性,Z可能为F、S、Cl,根据四种元素形成化合物的结构式为 可知,Z不可能为S;根据其原子序数之和为30,且W、X、Y、Z原子序数依次增大判 定Z不可能为F元素,故Z为Cl元素,则X为B元素。A.X为硼元素,选项A错误; B.Y为N,不属于第ⅣA族元素,选项B正确; C.Y、Z分别与W形成的常见化合物为NH3和HCl,它们能反应生成NH4Cl,属于盐,选项C正确; D.Z、Y最高价氧化物对应的水化物分别为HClO4、HNO3,酸性HClO4>HNO3,选项D正确。 5、【答案】A【解析】略 6、【答案】D 【解析】本题考查了原子结构与元素周期律的知识,侧重考查学生元素推断和知识迁移能力,难度中等。根据甲的结构与性质推断其原子结构是解答本题的关键。 【解答】根据题给信息可知,W、X、Y、Z位于三个不同的周期,且原子序数依次增大,X与Z的核外电子数之和是Y的核外电子数的2倍,W与Y同主族,则W为H,Y为Na。结合化合物甲结构可知,Z最外层有4个电子,则Z为Si,W为H,X为O,Y为Na。 A项,钠离子和氧离子的电子层数相同,且钠的原子序数大于氧的原子序数,相同电子层数时原子序数越大,离子半径越小,则离子半径:r(O2?)>r(Na+),故A错误; B项,同周期从左到右元素非金属性逐渐增大,同主族从上到下元素非金属性逐渐减小,则非金属性:O>S>Si,所以非金属性:O>Si,故B错误; C项,化合物甲为Si(OH)4,H原子最外层不满足8电子稳定结构,故C错误; D项,由W、X、Y三种元素形成的化合物为NaOH,NaOH溶液能与硅单质反应,故D正确; 7、【答案】C 【解析】本题考查结构性质位置关系,根据元素周期律进行分析,难度中等. 【解答】由题意推知,Y原子的最外层电子数为次外层电子数的2倍,则Y为C,根据R的结构式,知道这些元素的成键个数,Y(C)成4键,W成双键且和Y处于同一周期则W为O,X成1键且周期数小于Y(C),则X为H,Z处于Y(C)和W(O)之间,则Z为N,所以X、Y、Z、W分别为H、C、N、O; A.同周期元素从左到右原子半径逐渐减小,则原子半径:C>N>O,A项正确; B.同周期元素从左到右非金属性依次增强,非金属性越强,最高价氧化物对应水化物的酸性越强;非金属性:N>C,酸性:HNO3>H2CO3,B项正确; C.氮的氧化物不具有两性,C项错误; D.化合物R为氨基乙酸,其中的羧基具有酸性,能与NaOH溶液反应,D项正确; 8、【答案】C 【解析】本题考查位置、结构和性质的关系,为高频考点,题目难度不大,正确判断元素是解本题关键,试题侧重考查学生的分析能力及逻辑推理能力。 【解答】根据结构可知,X共用4对电子,W共用6对电子,Y共用2对电子,Z共用1对电子,因为Y和W同主族,所以为ⅥA族,根据原子序数大小关系,Y为O元素,W为S元素;因为原子半径 r(X)>r(Y)>r(Z),则X、Y、Z同周期,X为C元素,Z为F元素。 A.X为C元素,C的氢化物可以是甲烷、乙烷、丙烷等,有极性键,也可能含有非极性键,A错误; B.该物质为LiSO3CF3,O元素的化合价为?2价,B错误; C.Z为F元素,Y为O元素,2F2+2H2O=4HF+O2,C正确: D.Y为O元素,W为S元素,S2?的还原性大于O2?,D错误。
元素周期表中元性质递变规律
元素周期表中元性质递变规律
————————————————————————————————作者:————————————————————————————————日期:
专题一主要知识点 1. 元素周期表中元素性质的递变规律 同周期(从左到右)同主族(从上到下)原子半径逐渐减小逐渐增大 电子层排布电子层数相同 最外层电子数递增 电子层数递增最外层电子数相同 失电子能力逐渐减弱逐渐增强得电子能力逐渐增强逐渐减弱金属性逐渐减弱逐渐增强非金属性逐渐增强逐渐减弱 主要化合价最高正价(+1 →+7) 非金属负价 == ―(8―族 序数) 最高正价 == 族序数 非金属负价 == ―(8―族序 数) 最高氧化物的 酸性 酸性逐渐增强酸性逐渐减弱 对应水化物的 碱性 碱性逐渐减弱碱性逐渐增强 非金属气态氢化物的形成难易、稳定性形成由难→易 稳定性逐渐增强 形成由易→难 稳定性逐渐减弱
2. 3.几个规律: ①金属性强弱:单质与水或非氧化性酸反应难易; 单质的还原性(或离子的氧化性); M(OH)n的碱性; 金属单质间的置换反应; 原电池中正负极判断,金属腐蚀难易; 非金属性强弱:与氢气反应生成气态氢化物难易; 单质的氧化性(或离子的还原性); 最高价氧化物的水化物(H n RO m)的酸性强弱; 非金属单质间的置换反应。 ②半径比较三规律: 阴离子与同周期稀有气体电子层结构相同;阳离子与上周期稀有气体电子层结构相同。 (1)电子层数越多,半径越大
(2)电子层数相同,核电荷数越多,半径越小 (3)电子层数和核电荷数相同,最外层电子数越多,半径越大 ③元素化合价规律 主族最高正价 == 最外层电子数,非金属的负化合价 == 最外层电子数-8,最高正价数和负化合价绝对值之和为8;其代数和分别为:0、2、4、6。 化合物氟元素、氧元素只有负价(-1、-2),但HFO中0为+1价;金属元素只有正价; ④熔沸点高低的比较:详细见《导学》P24 原子晶体>离子晶体>分子晶体 ⑤1-20号元素符号、名称、原子结构、特殊化学性质。 ⑥电子式的书写 原子的电子式 离子的电子式: 分子或共价化合物电子式 离子化合价电子式,
专题23 位构性之元素周期表相关推断(教师版)
1.(2019·浙江高考真题)2019年是门捷列夫提出元素周期表150周年。根据元素周期律和元素周期表, 下列推断不合理 ...的是 A.第35号元素的单质在常温常压下是液体 B.位于第四周期第ⅤA族的元素为非金属元素 C.第84号元素的最高化合价是+7 D.第七周期0族元素的原子序数为118 【答案】C 【解析】A.35号元素是溴元素,单质Br2在常温常压下是红棕色的液体,合理;B.位于第四周期第ⅤA 族的元素是砷元素(As),为非金属元素,合理;C.第84号元素位于第六周期ⅥA族,为钋元素(Po),由于最高正价等于主族序数,所以该元素最高化合价是+6,不合理;D.第七周期0族元素是第七周期最后一个元素,原子序数为118,合理。故答案选C。 2.(2015·浙江高考真题)右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是() A.X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增 B.Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增C.YX2晶体熔化、液态WX3气化均需克服分子间作用力 D.根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性 【答案】D 【解析】从表中位置关系可看出,X为第2周期元素,Y为第3周期元素,又因为X、W同主族且W元素的核电荷数为X的2倍,所以X为氧元素、W为硫酸元素;再根据元素在周期表中的位置关系可 专题23 位构性之 元素周期表相关推断
推知:Y为硅元素、Z为磷元素、T为砷元素。A、O、S、P的原子半径大小关系为:P>S>O,三种元素的气态氢化物的热稳定性为:H2O>H2S>PH3,A不正确;B、在火山口附近或地壳的岩层里,常常存在游离态的硫,B不正确;C、SiO2晶体为原子晶体,熔化时需克服的微粒间的作用力为共价键,C不正确;D、砷在元素周期表中位于金属元素与非金属的交界线附近,具有半导体的特性,As2O3中砷为+3价,处于中间价态,所以具有氧化性和还原性,D正确。答案选D。3.(2019·全国高考真题)今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是 A.原子半径:W
元素周期表中的几个规律
河北省宣化县第一中学栾春武 一、电子排布规律 最外层电子数为或地原子可以是族、Ⅱ族或副族元素地原子;最外层电子数是~地原子一定是主族元素地原子,且最外层电子数等于主族地族序数.文档来自于网络搜索 二、序数差规律 ()同周期相邻主族元素地“序数差”规律 ①除第Ⅱ族和第Ⅲ族外,其余同周期相邻元素序数差为. ②同周期第Ⅱ族和第Ⅲ族为相邻元素,其原子序数差为:第二、第三周期相差,第四、第五周期相差,第六、第七周期相差.文档来自于网络搜索 ()同主族相邻元素地“序数差”规律 ①第二、第三周期地同族元素原子序数相差. ②第三、第四周期地同族元素原子序数相差有两种情况:第族和第Ⅱ族相差,其它族相差. ③第四、第五周期地同族元素原子序数相差. ④第五、第六周期地同族元素原子序数镧系之前相差,镧系之后相差. ⑤第六、第七周期地同族元素原子序数相差. 三、奇偶差规律 元素地原子序数与该元素在周期表中地族序数和该元素地主要化合价地奇偶性一致.若原子序数为奇数时,主族族序数、元素地主要化合价均为奇数,反之则均为偶数(但要除去元素,它有多种价态,元素也有).零族元素地原子序数为偶数,其化合价视为.文档来自于网络搜索 四、元素金属性、非金属性地强弱规律 ()金属性(原子失电子)强弱比较 ①在金属活动性顺序中位置越靠前,金属性越强. ②单质与水或非氧化性酸反应越剧烈,金属性越强. ③单质还原性越强或离子氧化性越弱,金属性越强.
④最高价氧化物对应地水化物碱性越强,金属性越强. ⑤若→,则比地金属性强. ()非金属性(原子得电子)强弱比较 ①与化合越容易,气态氢化物越稳定,非金属性越强. ②单质氧化性越强,阴离子还原性越弱,非金属性越强. ③最高价氧化物对应地水化物酸性越强,非金属性越强. ④若-→-,则比地非金属性越强. 需要补充地是,除了这些常规地判据之外,还有一些间接地判断方法:如在构成原电池时,一般来说,负极金属地金属性更强.还可以根据电解时,在阳极或阴极上放电地先后顺序来判断等.文档来自于网络搜索 需要注意地是,利用原电池比较元素金属性时,不要忽视介质对电极反应地影响.如--溶液构成原电池时,为负极,为正极;--(浓)构成原电池时,为负极,为正极.文档来自于网络搜索 五、元素周期表中地一些特点 ()短周期只包括前三个周期. ()主族中只有第Ⅱ族元素全部为金属元素. ()族元素不等同于碱金属元素,因为元素不属于碱金属元素. ()元素周期表第列是族,不是Ⅷ族,第、、列是第Ⅷ族,不是Ⅷ族. ()长周期不一定是种元素,第六周期就有种元素. 六、短周期元素原子结构地特殊性 ()原子核中无中子地原子:. ()最外层只有一个电子地元素:、、. ()最外层有两个电子地元素:、、. ()最外层电子数等于此外层电子数地元素:、.
元素周期表习题及答案
一、选择题(每小题3分,共42分,每小题有1-2个正确选项) 1.下列有关现在的长式元素周期表的判断中正确的是( ) A.从左向右数第七纵行是ⅦA族 B.从左向右数第十一纵行是ⅠB族 C.ⅠA族全部是金属元素 D.ⅦA族的全部元素只能表现非金属元素的性质 解析:A.它应是ⅦB族。C.氢元素在ⅠA族中。D.砹(At)是既能表现非金属性又能表现金属性的元素的典型之一。 答案:B 2.主族元素在周期表中的位置,取决于元素原子的( ) A.相对原子质量和核电荷数 B.电子层数和中子数 C.电子层数和最外层电子数 D.金属性和非金属性的强弱 解析:原子的电子层数决定其所在的周期;原子的最外层电子数决定它所在的族。 答案:C 3.下列关于现在的长式元素周期表的判断中不正确的是( ) A.所含元素种数最少的周期是第一周期所含元素种数最多的周期是第六周期C.所含元素种数最多的族是Ⅷ族 D.所含元素种数最多的族是ⅢB族 答案:C 4.下列原子序数所代表的元素中,全属于主族元素的一组是( ) A.22,26,11 B.13,15,38 C.29,31,16 D.18,21,14 答案:B 5.据国外有关资料报道,在独居石(一种共生矿,化学成分为Ce、La、Nd、……的磷酸盐)中,查明有尚未命名的116、124、126号元素。判断其中116号元素应位于周期表中的( ) A.第6周期ⅣA族B.第7周期ⅥA族 C.第7周期Ⅷ族D.第8周期ⅥA族 答案:B 6.(2011·天津卷)以下有关原子结构及元素周期律的叙述正确的是( ) A.第ⅠA族元素铯的两种同位素137Cs比133Cs多4个质子
B.同周期元素(除0族元素外)从左到右,原子半径逐渐减小 C.第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强 D.同主族元素从上到下,单质的熔点逐渐降低 解析:137Cs与133Cs是铯的两种同位素,二者质子数相等,中子数相差4,A项错误;同周期元素(除0族外)从左到右,核电荷数逐渐增大,原子半径逐渐减小,B项正确;同主族元素从上到下,非金属性逐渐减弱,其对应氢化物的稳定性逐渐减弱,C项错误;碱金属元素的单质,从上到下熔点逐渐降低,而卤族元素的单质,从上到下熔点逐渐升高,D项错误。 答案:B 7.国际无机化学命名委员会在1989年做出决定,把长式元素周期表原先的主副族及族号取消,由左至右改为18列。如碱金属元素为第1列,稀有气体元素为第18列。按此规定,下列说法错误的是( ) A.第9列元素中没有非金属元素 B.只有第2列元素原子最外层有2个电子 C.第1列和第17列元素的单质熔沸点变化趋势相反 D.在整个18列元素中,第3列的元素种类最多 解析:根据元素周期表的结构,第9列即原第Ⅷ族中的1个纵行,无非金属元素。而第18列的He元素最外层也有2个电子,所以B项错误。第1列为碱金属元素,第17列为卤素,两者熔沸点的变化趋势确实相反。由于第3列即第ⅢB族,包括镧系和锕系元素,镧系和锕系各包括15种元素,种类最多。 答案:B 点评:了解元素周期表的结构,利用信息进行知识的迁移考查了自学能力。 8.A、B两元素为某周期第ⅡA族和第ⅢA族元素,若A元素的原子序数为x,则B元素的原子序数可能为( ) ①x+1 ②x+8 ③x+11 ④x+18 ⑤x+25 ⑥x+32 A.①③ B.②④ C.①③⑤ D.②④⑥ 解析:在同一周期的前提下,若A、B为第二或第三周期元素,其原子序数之差为1,即B的原子序数为x+1。若A、B为第四或第五周期元素,其原子序数之差要加上10种过渡元素,B的原子序数为x+11。若A、B为第六或第七周期元素,其原子序数之差还包括15种镧系或锕系元素,即有24种过渡元素,B的原子序数为x+25。故答案为C。 答案:C 9.关于卤素(用X表示)的下列叙述正确的是( ) A.卤素单质与水反应均可用X2+H2O=HXO+HX表示 B.HX都极易溶于水,它们的热稳定性随核电荷数增大而增强
化学元素周期表变化规律
主族元素原子依次增大 同 同周期相同 主 族 依 同周期依次增多 相 次 同 增 由 同周期依次减小(0族除外) 多 小 到 同 大 主 族 由 小 到 大 同周期最高正价依次升高负价=n-8(F 除外) 同周期金属性逐渐减弱非金属性增强 同周期增强 同周期酸性逐渐增强碱性减弱 同主族酸性减弱碱性增强 同主族逐渐减弱 同主族金属性逐渐增强;非金属性逐渐 减弱 同主族最高正价相同 原子半径 核电荷数 电子层数最外层电子数 化合价 金属性非金属性 气态氢化物稳定性 最高价氧化物对应水化物酸碱性
元素周期表中元素及其化合物的递变性规律 1 原子半径 (1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小; (2)同一族的元素从上到下,随电子层数增多,原子半径增大。 注意:原子半径在VIB族及此后各副族元素中出现反常现象。从钛至锆,其原子半径合乎规律地增加,这主要是增加电子层数造成的。然而从锆至铪,尽管也增加了一个电子层,但半径反而减小了,这是与它们对应的前一族元素是钇至镧,原子半径也合乎规律地增加(电子层数增加)。然而从镧至铪中间却经历了镧系的十四个元素,由于电子层数没有改变,随着有效核电荷数略有增加,原子半径依次收缩,这种现象称为“镧系收缩”。镧系收缩的结果抵消了从锆至铪由于电子层数增加到来的原子半径应当增加的影响,出现了铪的原子半径反而比锆小的“反常”现象。 2 元素化合价 (1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外); (2)同一主族的元素的最高正价、负价均相同 (3) 所有单质都显零价 3 单质的熔点 (1)同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减; (2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增 4 元素的金属性与非金属性 (1)同一周期的元素电子层数相同。因此随着核电荷数的增加,原子越容易得电子,从左到右金属性递减,非金属性递增; (2)同一主族元素最外层电子数相同,因此随着电子层数的增加,原子越容易失电子,从上到下金属性递增,非金属性递减。 5 最高价氧化物和水化物的酸碱性 元素的金属性越强,其最高价氧化物的水化物的碱性越强;元素的非金属性越强,最高价氧化物的水化物的酸性越强。 6 非金属气态氢化物 元素非金属性越强,气态氢化物越稳定。同周期非金属元素的非金属性越强,其气态氢化物水溶液一般酸性越强;同主族非金属元素的非金属性越强,其气态氢化物水溶液的酸性越弱。 7 单质的氧化性、还原性 一般元素的金属性越强,其单质的还原性越强,其氧化物的阳离子氧化性越弱;元素的非金属性越强,其单质的氧化性越强,其简单阴离子的还原
元素周期表中的递变规律
元素周期表中的递变规律 同周期(左右)同主族(上下) 结构电子层结 构 电子层数相同递增 最外层电子数递增(18或2)相同(族序数)原子核内的质子数递增递增 性质原子半径 递减(除稀有气体元 素) 递增主要化合价 +1+7 —4—1 相似 元素原子失电子能力减弱增强元素原子得电子能力增强减弱 性质应用最高价氧 化物对应 水化物 酸性增强减弱 碱性减弱增强 非金属气 态氢化物 形成难易难易易难 稳定性增强减弱 金属单质与水或酸置换出氢气的难易 程度 变难变容易 短周期元素推断题记忆常见“题眼” (1)位置与结构 a.周期序数等于族序数两倍的短周期的元素是Li。 b.最高正价数等于最低负价绝对值三倍的短周期元素是S。 c.次外层电子数等于最外层电子数四倍的短周期元素是Mg。 d.次外层电子数等于最外层电子数八倍的短周期元素是Na。 e.族序数与周期数相等的短周期元素是H、Be、Al;族序数是周期数两倍的短周期元素是C、S;族序数是周期数三倍的短周期元素是O。 f.只由质子和电子构成的元素原子是H()。 (2)含量与物理性质
a.地壳中质量分数最大的元素是O,其次是Si。 b.地壳中质量分数最大的金属元素是Al。 c.氢化物中氢元素百分含量最高的元素是C。 d.其单质为天然物质中硬度最大的元素是C。 e.其气态氢化物最易溶于水的元素是N。在常温、常压下,1体积水溶解700体积NH 3 。 f.其气态氢化物沸点最高的非金属元素是O。 g.常温下,其单质是有色气体的元素是F、Cl。 h.所形成的化合物种类最多的元素是C。 i.在空气中,其最高价氧化物的含量增加会导致“温室效应”的元素是C。 j.其单质是最易液化的气体的元素是Cl。 k.其单质是最轻的金属元素的是Li。 l.其最高价氧化物的水化物酸性最强的元素是Cl。 m.常温下其单质呈液态的非金属元素是Br。 (3)化学性质与用途 a.单质与水反应最剧烈的非金属元素是F。 b.其气态氢化物与最高价氧化物对应水化物能起化合反应的是N。NH 3+HNO 3 =NH 4 NO 3 。 c.常温下其气态氢化物与其最低价氧化物能反应生成该元素的单质的元素是S。2H2S+SO2=3S+2H2O。 d.在空气中,其一种同素异形体易在空气中自燃的元素是P。 e.其气态氢化物水溶液可雕刻玻璃的元素是F。 f.其两种同素异形体对人类生存都非常重要的元素是O。臭氧(O 3 )层被称为人类和生物的保护伞。 g.能与强碱溶液作用的单质有:Al、Cl 2 、Si、S等。 常见元素化合价的一般规律 (1)金属元素无负价。因为金属元素最外层电子数目少,易失去电子变为稳定结构,故金属元素无负价,除零价外,在反应中只显正价。 (2)氟无正价,氧有正价但无最高正价。氟、氧得电子能力特别强,尤其是氟元素,只能夺取电子而成为稳定结构,除零价外,只显负价。氧只跟氟结合时,才显正价,如在OF2中氧呈+2价。 (3)在1~20号元素中,除O、F外,元素的最高正价等于最外层电子数;元素的最低负价与最高正价的关系为:最高正价+∣最低负价∣=8。 既有正价又有负价的元素一定是非金属元素;所有元素都有零价。 (4)除个别元素外(如氮元素),原子序数为奇数的元素,其化合价也常呈奇数价,原子序数为偶数的元素,其化合价也常呈偶数价,即序奇价奇,序偶价偶。 若原子的最外层电子数为奇数(m),则元素的正常化合价为一系列连续的奇数,从+1 到+m,若出现偶数则为非正常化合价,其氧化物是不成盐氧化物,例如NO 2 、NO;若原子 的最外层电子数为偶数,从—2价到+m。例如:Na 2S、SO 2 、H 2 SO 4 。 离子化合物与共价化合物的判断 (1)根据化合物类别判断 ①强碱、盐、大多数碱性氧化物属离子化合物; ②非金属氧化物、非金属氢化物、含氧酸、有机化合物属共价化合物。
元素周期律和元素周期表知识总结
元素周期律和元素周期表知识总结 考试大纲要求 1.理解原子的组成及同位素的概念。掌握原子序数、核电荷数、质子数、中子数、核外电子数,以及质量数与质子数、中子数之间的相互关系。 2.以第1、2、3周期的元素为例,掌握核外电子排布规律。 3.掌握元素周期律的实质及元素周期表(长式)的结构(周期、族)。 4.以第3周期为例,掌握同一周期内元素性质(如:原子半径、化合价、单质及化合物性质)的递变规律与原子结构的关系;以ⅠA族和ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。 知识规律总结 一、原子结构 1.几个量的关系() 质量数(A)=质子数(Z)+中子数(N) 质子数=核电荷数=原子序数=原子的核外电子数 离子电荷数=质子数-核外电子数 2.同位素 (1)要点:同——质子数相同,异——中子数不同,微粒——原子。 (2)特点:同位素的化学性质几乎完全相同;自然界中稳定同位素的原子个数百分数不变。 注意:同种元素的同位素可组成不同的单质或化合物,如H2O和D2O是两种不同的物质。 3.相对原子质量 (1)原子的相对原子质量:以一个12C原子质量的1/12作为标准,其它原子的质量跟它相比较所得的数值。它是相对质量,单位为1,可忽略不写。 (2)元素的相对原子质量:是按该元素的各种同位素的原子百分比与其相对原子质量的乘积所得的平均值。元素周期表中的相对原子质量就是指元素的相对原子质量。 4.核外电子排布规律 (1)核外电子是由里向外,分层排布的。 (2)各电子层最多容纳的电子数为2n2个;最外层电子数不得超过8个,次外层电子数不得超过18个,倒数第三层电子数不得超过32个。 (3)以上几点互相联系。 核外电子排布规律是书写结构示意图的主要依据。 5.原子和离子结构示意图 注意:①要熟练地书写1~20号元素的原子和离子结构示意图。 ②要正确区分原子结构示意图和离子结构示意图(通过比较核内质子数和核外电子数)。 6.微粒半径大小比较规律 (1)同周期元素(稀有气体除外)的原子半径随原子核电荷数的递增逐渐减小。 (2)同主族元素的原子半径和离子半径随着原子核电荷数的递增逐渐增大。 (3)电子层结构相同的离子,核电荷数越大,则离子半径越小。 (4)同种元素的微粒半径:阳离子<原子<阴离子。 (5)稀有气体元素的原子半径大于同周期元素原子半径。 (6)电子层数多的阴离子半径一定大于电子层数少的阳离子半径,但电子层数多的阳离子半径不一定大于电子层数少的阴离子半径。 二、元素周期律和周期表 1.位、构、性三者关系
高中化学元素周期表和元素题型归纳
元素周期律和元素周期表习题 知识网络 中子N 原子核 质子Z 原子结构 : 电子数(Z 个)核外电子 排布规律 → 电子层数 周期序数及原子半径 表示方法 → 原子(离子)的电子式、原子结构示意图 随着原子序数(核电荷数)的递增:元素的性质呈现周期性变化 ①、原子最外层电子的周期性变化(元素周期律的本质) 元素周期律 ②、原子半径的周期性变化 ③、元素主要化合价的周期性变化 ④、元素的金属性与非金属性的周期性变化 ①、按原子序数递增的顺序从左到右排列; 元素周期律和 排列原则 ②、将电子层数相同的元素排成一个横行; 元素周期表 ③、把最外层电子数相同的元素(个别除外)排成一个纵行。 ①、短周期(一、二、三周期) 周期(7个横行) ②、长周期(四、五、六周期) 周期表结构 ①、主族(ⅠA ~ⅦA 共7个) 族(18个纵行) ②、副族(ⅠB ~ⅦB 共7个) ③、Ⅷ族(8、9、10纵行) ④、零族(稀有气体) 同周期同主族元素性质的递变规律 ①、核外电子排布 ②、原子半径 性质递变 ③、主要化合价 ④、金属性与非金属性 ⑤、气态氢化物的稳定性 ⑥、最高价氧化物的水化物酸碱性 电子层数 相同条件下,电子层越多,半径越大。 判断的依据 核电荷数 相同条件下,核电荷数越多,半径越小。 最外层电子数 相同条件下,最外层电子数越多,半径越大。 微粒半径的比较 1、同周期元素的原子半径随核电荷数的增大而减小(稀有气体除外) 如:Na>Mg>Al>Si>P>S>Cl. 2、同主族元素的原子半径随核电荷数的增大而增大。如:Li
