毛细管电泳实验

毛细管电泳实验
1实验目的:1理解毛细管电泳的基本原理; 2 熟悉毛细管电泳仪器的构成;
3 了解影响毛细管电泳分离的主要操作参数并计算有效淌度。 2实验原理:
实验中采用一种中性化合物苯甲醇来单独测定电渗流淌度,然后求得被分析物的有效淌度μe 。根据下述公式
tV lL tE l a ==
μ, 其中l 和L 毛细管有效长度和总长度,t 迁移时间,V 为分离电压,μa 为表观淌度。 EOF e a μμμ+= EOF a μμμ-=e
先计算出电渗淌度以及不同离子的表观淌度,再求出有效淌度。注意,阴离子的有效淌度为负值,因为其电泳淌度与电渗淌度的方向相反。
3实验设备:一台Beckman 毛细管电泳仪,实验用毛细管总长度为48.5cm ,有效长度(从进样口到检测点的距离)为40cm ,分离电压为20kV 。 4仪器及试剂:
5 mL 移液管2只,1mL 移液管共2支,分别标上四种标样的标签,两组公用。每组10 mL 容量瓶2个,滴管2支,分别标上标准、未知的标签。塑料样品管共16个,每组8个,分别用于标准样品、未知样品、三种缓冲溶液、NaOH 、水和废液,做好标号。
滴瓶一共5个,分别装三种缓冲液(buffer)、1mol/L的NaOH和乙醇。镊子、洗瓶、吸耳球、试管架、塑料样品管架、废液烧杯每组一个。剪刀一把,记号笔一支,滤纸。
标样:苯甲醇、苯甲酸、水杨酸、对氨基水杨酸,均溶于二次水中,浓度1.00 mg/mL,作为标准品。
缓冲溶液(buffer):10 mmol/L NaH2PO4-Na2HPO4 1:1缓冲溶液(NaH2PO4和Na2HPO4 各5mMol/L);20 mmol/L NaH2PO4-Na2HPO41:1缓冲溶液(NaH2PO4和Na2HPO4 各10mMol/L),。
1mol/L NaOH溶液,二次去离子水。
5实验步骤:
1.仪器的预热和毛细管的冲洗:在实验教师的指导下,打开仪器和配套的工作站。工作温度设置为30℃,不加电压,冲洗毛细管,顺序依次是:1 mol/L NaOH溶液5 min,二次水5 min,10 mmol/L NaH2PO4-Na2HPO4 1:1缓冲溶液5 min,冲洗过程中出口(outlet)对准废液的位置。
2.混合标样的配制:毛细管冲洗的同时,配制混合标样。分别用5ml的移液管移取3ml苯甲醇、3ml苯甲酸,用1ml的移液管移取1ml水杨酸、0.5ml对氨基水杨酸于10ml 的容量瓶中,定容,得到苯甲醇(电渗流示踪剂)、苯甲酸、水杨酸、对氨基水杨酸浓度分别为300μg/mL、300μg/mL、100μg/mL、50.0μg/mL的混合溶液作为混合标样。混合标样的测定:待毛细管冲洗完毕,取1 ml混合标样,置于样品管中,放在电泳仪进口(Inlet)托架上开始进样。进样压力30 mbar,进样时间5 s。进样后将进口(Inlet)托架的位置换回缓冲溶液(buffer),选择方法,修改合适的文件说明,然后开始分析,记录各组分的迁移时间。
3.不同缓冲溶液下迁移时间的变化:未知浓度混合样品的测定完毕后,冲洗毛细管,顺序依次是:1 mol/L NaOH溶液5 min,二次水5 min,然后更换进出口两端的缓冲溶液为20 mmol/L NaH2PO4-Na2HPO4 pH为6,冲洗5 min;设置分离电压为20 kV,并在此条件下,记录各组分的迁移时间。
4.完成实验以后,用水冲洗毛细管10 min,再用空气吹干10 min。
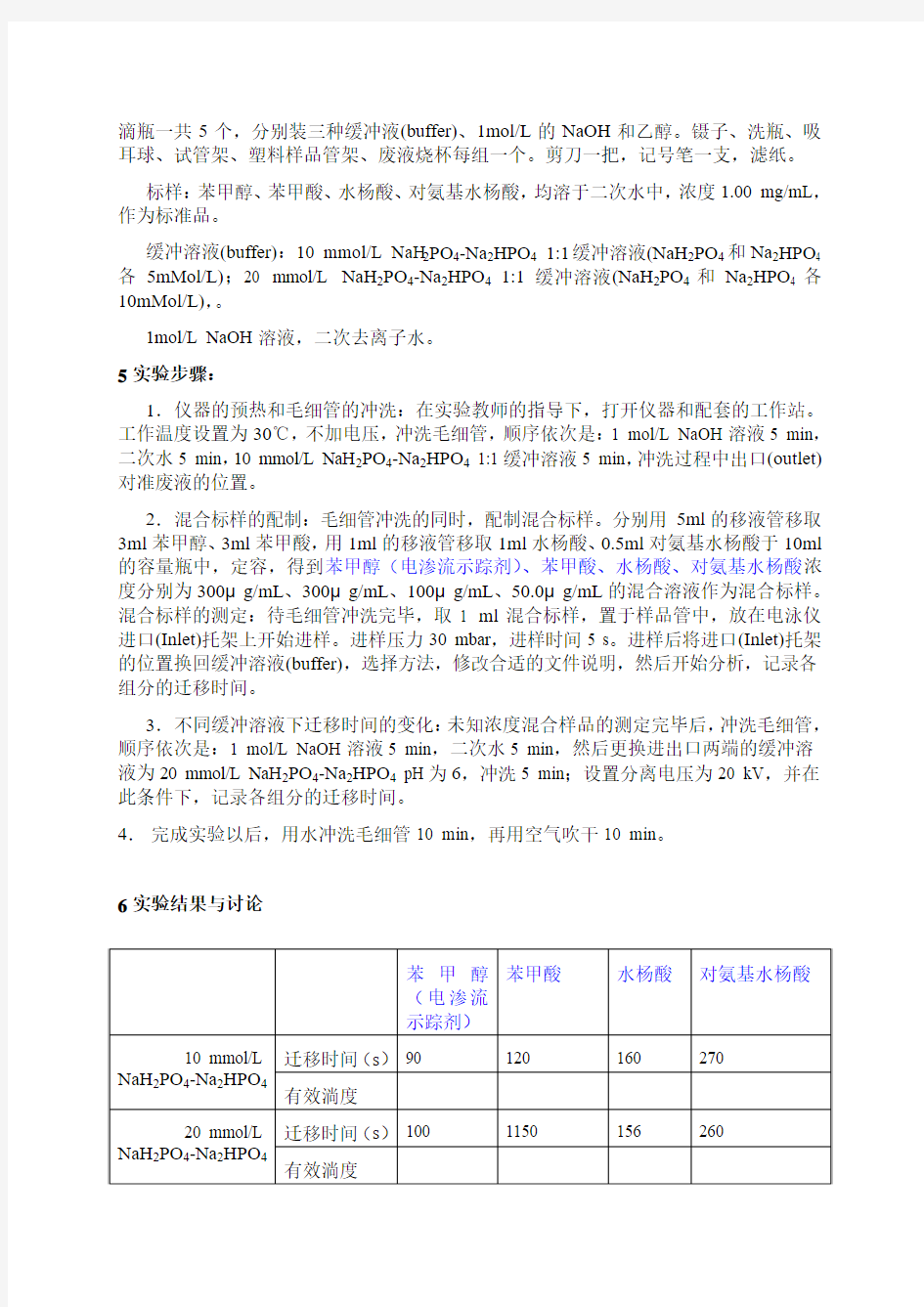
6实验结果与讨论
毛细管电泳的基本原理及应用
毛细管电泳的基本原理及应用 摘要:毛细管电泳法是以弹性石英毛细管为分离通道,以高压直流电场为驱动力,依据样品中各组分之间淌度和分配行为上的差异而实现分离的电泳分离分析方法。该技术可分析的成分小至有机离子、大至生物大分子如蛋白质、核酸等。可用于分析多种体液样本如血清或血浆、尿、脑脊液及唾液等,比HPLC 分析高效、快速、微量。 关键词:毛细管电泳原理分离模式应用 1概述 毛细管电泳(Caillary Electrophoresis)简称CE,是一类以毛细管为分离通道,以高压直流场为驱动力的新型液相分离分析技术。CE的历史可以追溯到1967年瑞典Hjerten最先提出在直径为3mm的毛细管中做自由溶液的区带电泳(Capillary Zone Electro-phoresis,CZE)。但他没有完全克服传统电泳的弊端[1]。现在所说的毛细管电泳(CE)是由Jorgenson和Lukacs在1981年首先提出,他们使用了75mm的毛细管柱,用荧光检测器对多种组分实现了分离。1984年Terabe将胶束引入毛细管电泳,开创了毛细管电泳的重要分支: 胶束电动毛细管色谱(MEKC)。1987年Hjerten等把传统的等电聚焦过程转移到毛细管内进行。同年,Cohen 发表了毛细管凝胶电泳的工作。近年来,将液相色谱的固定相引入毛细管电泳中,又发展了电色谱,扩大了电泳的应用范围。 毛细管电泳和高效液相色谱(HPLC)一样,同是液相分离技术,因此在很大程度上HPCE与HPLC可以互为补充,但是无论从效率、速度、样品用量和成本来说,毛细管电泳都显示了一定的优势毛细管电泳(C E)除了比其它色谱分离分析方法具有效率更高、速度更快、样品和试剂耗量更少、应用面同样广泛等优点外,其仪器结构也比高效液相色谱(HPLC)简单。C E只需高压直流电源、进样装置、毛细管和检测器。 毛细管电泳具有分析速度快、分离效率高、试验成本低、消耗少、操作简便等特点,因此广泛应用于分子生物学、医学、药学、材料学以及与化学有关的化工、环保、食品、饮料等各个领域[2]。
毛细管电泳出现问题分析
一、无样品峰出现 A、检查电流是否稳定: ①没有电流。 可能原因——毛细管堵塞或断裂。 解决方法——用水冲洗毛细管,并观察是否有水流出,若无水 流出请拆下卡盒检查毛细管两端和窗口是否断裂;毛细管没有 断裂的话可以用水反向高压冲洗以试图解决此问题。缓冲溶液 需要过滤,将样品过滤或者离心去除其中的颗粒。 ②电流波动很大,直至几乎消失。 可能原因——缓冲溶液中有气泡产生或者区带中样品析出。 解决方法——将缓冲溶液超声脱气,如果还有此现象发生,则 可能是样品区带有析出,可以通过降低样品浓度/延长ramp time来试图解决这一问题;对于在缓冲溶液中溶解度不高的样 品则需要在缓冲溶液中加入添加剂以解决此问题。 ③电流初始值较小,后逐渐增大。 可能原因——样品进样量过大。 解决方法——减少进样量,通常进样参数设置在0.5psi,5sec 左右。 ④电流正常。 可能原因:a样品浓度过低:使用高浓度样品测试,如果无法 解决则有可能是以下其他原因。b检测波长设置不正确:请确 认被分析物的特征吸收,检查方法中的检测波长设置。c分离
极性错误:对于蛋白样品,请注意蛋白在分离条件下其PI及所带电荷;对于核酸样品,通常条件下会带负电荷。d样品在毛细管内壁吸附:对于蛋白及核酸样品应尽量采用涂层毛细管分离,或采用极端pH条件或动态涂层防止样品吸附。e光学检测器或光纤损坏:进行标准样品的测试,如果没有对应的结果出现,则有可能存在硬件问题,请联系工程师。 B、检查毛细管窗口,是否有透明窗口: 可能原因——忘记开毛细管窗口或窗口位置不正。 解决方法——重新开毛细管检测窗口,或将窗口调整到正确位置。 二、样品峰出现拖尾 可能原因——样品在毛细管内壁吸附。 解决方法——对于蛋白及核酸样品应尽量采用涂层毛细管分离,或采用极端pH条件或动态涂层防止样品吸附。 三、样品峰形不对称 A、检查毛细管入口: 可能原因——毛细管入口切口不平齐。 解决方法——重新切割毛细管入口,注意毛细管切割方法,不可以用力过猛或反复刮擦。
荧光检测毛细管电泳法
通过荧光检测毛细管电泳法 快速灵敏地检测人体血浆中的亚硝酸盐的方法 本文选自塔兰塔(Talanta),爱思唯尔(Elsevier)出版,纯分析化学期刊。 作者:安范舒普代尔,来自比利时鲁汶大学。 摘要:分析亚硝酸盐,NO指示剂在体内的产生,为研究NO在体内的合成提供 了一个有用的工具。通过其衍生反应和2、3二氨基萘(DAN)中一个快速、灵敏荧光-毛细管电泳法被发展来测定了人体血浆中的亚硝酸盐。亚硝酸盐在人体血浆中很容易与DAN在酸性条件下反应得到收益率很高的荧光2,3-萘 酚三唑(NAT)。荧光检测是完成施达赛检测的最佳化方式,它允许一种等离子体样品的直接分析而不像大多数堆积样品的CE-UV方法。乙腈可去除蛋白质。短程注射和高压电(30千伏)可缩短分析时间。用20mm,pH值为9.23的缓冲溶液可更好的分离。NAT的分离在1.4分钟内完成,除蛋白等离子体样品以5s每50 mbar水动力地的速度被注射到60厘米×75微米的内部直径无涂层的玻璃毛细管里。激发波长被选中为一个宽带滤波器(240-400nm),发射光在418nm被测量通过采用一个截止过滤器。在2到500nm的范围内获得一个好的线性关系(R2=0.9975)。在原始血浆样本中亚硝酸盐的检测极限是0.6nm, 比我们此前的CE-UV法低了750倍。先进的荧光-毛细管电泳法相对于目前的荧光高效液相色谱法,具有更简单的系统和更低的成本优势,同时也很灵敏。这个研究表明该方法测定人体血浆中亚硝酸盐在的浓度与频繁报道的一致。 1介绍 研究表明,亚硝酸盐在生理和病理条件下有可能成为NO合成的一个标志,因此在实验和临床研究中可能作为一个生化参数。 但是到目前为止,还没有真正关于人体血浆中亚硝酸盐的浓度的共识。具报告,一般水平的亚硝酸盐在人体血浆中“不能检测”的范围达到26微米。人体血浆中亚硝酸盐的浓度最合理的范围是从100纳米到1微米,通过大多数研究者团体的测量最常报道的结果是从100纳米到200纳米。因此,对于分析学科来说测定人体血浆中的亚硝酸浓度是一个挑战。在样品配制的过程中,高灵敏度测定和一定的防范措施可以提高测量的精密度和准确度。荧光法已广泛用于亚硝酸盐的灵敏分析。这些方法涉及亚硝酸盐衍生化反应——由2,3-二氨基萘(DAN)合成2,3-萘酚三唑(NAT)。有一些使用高效液相荧光检测的方法用在检测水、尿液和细胞培养液中的亚硝酸盐。然而,大多数荧光高效液相色谱法对样品需要一个复杂的制备过程来去除一些小元件并需要一个保护柱。这些额外的合成步骤可能会引入环境中杂质
毛细管电泳实验报告
毛细管电泳实验报告 高乃群S0 实验目的 1.了解毛细管电泳实验的原理 2.掌握毛细管电泳仪的操作方法,并设计样品组分的分析过程. 3.学会处理实验数据,分析实验结果. 实验原理C E所用的石英毛细管柱, 在pH>3情况下, 其内表面带负电, 和溶液接触时形成了一双电层。在高电压作用下, 双电层中的水合阳离子引起流体整体地朝负极方向移动的现象叫电渗, 粒子在毛细管内电解质中的迁移速度等于电泳和电渗流(EOF)两种速度的矢量和, 正离子的运动方向和电渗流一致, 故最先流出;中性粒子的电泳流速度为“零”,故其迁移速度相当于电渗流速度;负离子的运动方向和电渗流方向相反, 但因电渗流速度一般都大于电泳流速度, 故它将在中性粒子之后流出, 从而因各种粒子迁移速度不同而实现分离。 电渗是CE中推动流体前进的驱动力, 它使整个流体像一个塞子一样以均匀速度向前运动, 使整个流型呈近似扁平型的“塞式流”。它使溶质区带在毛细管内原则上不会扩张。 一般来说温度每提高1℃, 将使淌度增加2% (所谓淌度, 即指溶质在单位时间间隔内和单位电场上移动的距离)。降低缓冲液浓度可降低电流强度, 使温差变化减小。高离子强度缓冲液可阻止蛋白质吸附于管壁, 并可产生柱上浓度聚焦效应, 防止峰扩张, 改善峰形。减小管径在一定程度上缓解了由高电场引起的热量积聚, 但细管径使进样量减少, 造成进样、检测等技术上的困难。因此, 加快散热是减小自热引起的温差的重要途径。
实验设备:电泳仪。仪器及试剂: 缓冲溶液(buffer):20 mmol/L Na 2B 4 O 7 缓冲溶液。1mol/L NaOH溶液,二次 去离子水。未知样饮料(雪碧和醒目) 1.实验步骤仪器的预热和毛细管的冲洗:打开仪器和配套的工作站。工作温度设置为30℃,不加电压,冲洗毛细管,顺序依次是:1 mol/L NaOH溶液5 min, 二次水5 min,10 mmol/L NaH 2PO 4 -Na 2 HPO 4 1:1缓冲溶液5 min,冲洗过程中出 口(outlet)对准废液的位置,并不要升高托架。 2.混合标样的配制:毛细管冲洗的同时,配制标样苯甲酸浓度依次为、、、、1 mg/ml。 3.做标准曲线:待毛细管冲洗完毕,取1 ml混合标样,置于塑料样品管,放在电泳仪进口(Inlet)托架上sample的位置,然后调整出口(outlet)对准缓冲溶液(buffer),升高托架并固定,然后开始进样。进样压力30 mbar,进样时间5 s。进样后将进口(Inlet)托架的位置换回缓冲溶液(buffer),切记换回buffer 的位置!选择方法,修改合适的文件说明,然后开始分析,电压25 kV,时间约10 min。 4.未知浓度混合样品的测定:方法与条件同上,测试未知浓度混合样品,分析时间约25min,据苯甲酸钠标准曲线测雪碧与醒目这两种饮料中的苯甲酸钠的
毛细管电泳分析方法在食品安全监控中的应用
毛细管电泳分析方法在食品安全监控中的应用(华东师大化学系叶建农) 食品安全是指食品中不应含有可能损害或威胁人体健康的有毒、有害物质或因素,从而导致消费者急性或慢性毒害或感染疾病、或产生危及消费者及其后代健康的隐患。近年来,世界范围内食品安全方面的恶性和突发事件不断发生。据美国疾控中心研究报告估计,美国每年因食品中毒而死亡的人数约5000人左右。日本也先后发生出血性大肠埃希菌O157食品中毒事件,以及导致上万人中毒的雪印牛奶事件。目前我国食品安全形势不容乐观,食品中毒事件时有所闻。据不完全统计,我国每年实际发生的食物中毒例数在200万人次以上,其中有相当比例是由违禁食品添加剂引起,如2005年“苏丹红”事件,2006年“瘦肉精”事件,2008年“三聚氰氨”事件等。这类事件不仅严重危害人们身体健康,而且也对经济发展和国家形象产生及其负面的影响。客观而言,目前我国食品安全仍处于风险高发期和矛盾凸显期,有必要进行全方位的整治。其中的一个环节,就是要切实做好食品安全监控工作。 食品分析大致可分为两大类,即食品中营养成分分析,以及
食品中化学添加剂、化学污染物的分析。由此可见,食品安全监控的主要内容,本质上是指能够准确分析和严格控制食品中化学添加剂及化学污染物的种类和含量。其中食品添加剂属限用品。根据我国卫生部2008年新修订的“食品添加剂使用卫生标准”(GB2760-2007)规定,在一定前提下可合法使用的食品添加剂总数为1812种,共分为22大类。这一千多种食品添加剂虽然已经卫生部认可,但对其允许的添加范围及添加量却有严格的规定和限制。至于化学污染物则属违禁品,有时又叫禁用品,即在任何条件下均不得人为添加,如苏丹红、瘦肉精、孔雀石绿、三聚氰氨等。 从理论上讲,现有的化学分析方法都有可能在某种程度上应用于食品安全监控。如比色法、滴定法、水解法、蔡氏砷斑法、凯氏定氮法、薄层色谱法、气相色谱法、高效液相色谱法、色谱-质谱联用法、毛细管电泳法等。 毛细管电泳(CapillaryElectrophoresis,CE)是近二十来发展最快的一种分离分析技术,具有分离效率高、所需样品量少、分析成本低等优点。毛细管电泳分析法是以毛细管为分离通道、以高压直流电场为驱动力,根据样品中各组分之间迁移速度的差
毛细管电泳操作手册
毛细管电泳操作手册 一.毛细管紫外检测器简介 分高压电源(左侧)与毛细管检测主机(右侧)(紫外检测器)。 1.高压电源 设置高压电源分离电压范围在0-30 kV,最高设置不能超过25 kV,参考文献中如若提及分离电压在30 kV,务必不要将本高压电源也设置在30 kV。 2.毛细管检测主机 主机分毛细管系统、进样系统、和紫外检测系统。
a.毛细管系统主要包括:缓冲池、冲洗器、毛细管、高压电极。 缓冲池是两个高约3.5 cm 的玻璃瓶,用于乘装运行缓冲液。 冲洗器包括弹簧压力器和2.5 mL的医用注射器,注射器中乘装与缓冲池中一样的运行缓冲液,依靠弹簧压力将运行缓冲液推入毛细管中。 毛细管主要用的是未涂层的50 μm口径石英毛细管,有效长度在50 cm左右。 高压电极的作用是将高压电源产生的高压传输到两个缓冲池中形成电回路。 b.进样系统为一可伸缩的高度进样杆,一般进样升到最高点,所产生的高度差提供0.5 psi 的进样压力。 c.紫外检测系统提供各个波长的紫外光,可根据所做物质的紫外吸收最大波长进行手动 调节。
二.毛细管电泳的日常维护以及注意事项 1.毛细管每次使用之前必须检查正负铂丝电极是否断裂——用手指轻轻挑动电极; 2.毛细管电泳使用完毕后一定要将干燥硅胶置入主机内,如若变红,须烘箱干燥后再放入; 3.毛细管主机内部不能用水清洗,只能在关机状态下用酒精浸泡的脱脂棉擦拭,或用小毛 刷扫除主机内部的灰尘; 4.非正常情况下不要将紫外检测器的暗池打开,以免损坏紫外光接收器; 5.高压电源与主机非正常情况下不要轻易移动位置; 6.实验中手法保持轻盈,毛细管较易折断,主机窗门轻开轻关; 7.实验结束后一定要将高压电源和主机的插头都拔掉,也不要将试验样品留在主机内部的 样品架上,要保持主机内部无任何附加的化学试剂; 8.下雨天或者潮湿天气不要开机,高压电源对湿度比较敏感,湿度较大的情况下开机可能 会使高压电源击穿,造成仪器损坏; 9.寒暑假实验室无人的情况下要将毛细管主机及高压电源用干净的实验服盖住,门窗关 好,保持实验室无人的状态下也干燥; 10.若仪器长时间不用,须定时在不插电关机状态下将毛细管冲洗一次,以免毛细管堵塞。
外文翻译--毛细管电泳电化学检测方法中文版-精品
毕业设计(论文)外文翻译 Electrochemical detection methods in capillary electrophoresis and applications to inorganic species 毛细管电泳电化学检测方法 在无机元素中的应用
电化学检测法在毛细管电泳 和无机元素中的应用 摘要:本文论述了毛细管电泳的三种电化学检测即电导检测法、安培检测法和电位检测法,并与较常见的光学检测方法进行了比较。详细介绍了三种检测方法的原理及其实现方法,同时介绍了它们在无机元素分析物中的应用情况。 关键字:电化学检测、毛细管电泳;无机阴离子、金属阳离子。 目录: 1.简介--------------------------------------------------------------1 2.电导检测法--------------------------------------------------------2 2.1原理----------------------------------------------------------2 2.2实现方法------------------------------------------------------3 3安培检测法--------------------------------------------------------6 3.1原理----------------------------------------------------------6 3.2实现方法------------------------------------------------------6 4电位检测法--------------------------------------------------------5 4.1原理----------------------------------------------------------9 4.2实现方法------------------------------------------------------9 5在无机元素中的应用------------------------------------------------9 6总结-------------------------------------------------------------10 7参考文献---------------------------------------------------------10 1.简介 毛细管电泳的检测方法通常采用光学方法(激光诱导荧光检测法),而毛细管电泳的三种电化学检测法即电导测定法、安培检测法、和电位测定法是非常有吸引力的一种替代方法,尽管目前开发的还相对较少。相对套色板离子法来说(其他和以前一般化的检测方法)他主要借助于电导性能而不是运用光学方法。由与针对毛细管中更小体积细胞的光学检测变得更加困难,而且事实上许多离子也不能直接由光学方法直接检测到,或许当人们意识到这些的时候会感到很惊讶。关于这一情况或许有两种解释。首先由于高性能流体套色板的广泛应用,我们在毛细管电泳中通常采用光学吸收检测法,许多毛细管电泳仪器制造商似乎已经走上
毛细管电泳法快速检测糖化血红蛋白概要
[4]郝贤 , 吴茜 , 杨丰源 . 2型糖尿病胰岛素抵抗的实验与临床研 究进展 [J]. 中国初级卫生保健 , 2006, 20(8 :60. [5]毛晓明 , 刘志民 . 氧化应激在糖尿病糖代谢中的作用 [J]. 江苏医 药 , 2005, 31(3 :212. [6]赵宝珍 , 白秀平 , 荣青峰 . 实验性 2型糖尿病大鼠模型的研究 [J]. 中国药物与临床 , 2002, 2(6 :383. [7]郭昆全 , 湛冯岚 . 硫酸镁对 2型搪尿病及糖耐量异常 (IGT 患者胰 岛素敏感性的影响 [J]. 中国糖尿病杂志 , 2001, 9(6 :355. [8]梁丽 , 李成江 . 低血镁与糖尿病的关系 [J]. 浙江医学 , 2005, 27 (12:958. [9]杨月莲 , 梁瑜祯 . 氧化应激与 2型糖尿病 [J]. 医学综述 , 2008, 14 (3 :429. [10]Firdlyand LE, Phlipson LH. Reactive s pecies and early manifes tation of ins ulin resis tance i n type 2diabetes [J ]. Di abtes Obes M etab, 2006, 8(2 :136. [11]张秋梅 . 氧化应激与 2型糖尿病的关系及 a 硫辛酸的应用 [J ]. 医学综述 , 2007, 13(24 :1984. [12]范晓岚 , 杨军 , 糜漫天 , 等 . B -胡萝卜素的抗氧化作用与疾病预 防 [J]. 中国公共卫生 , 2003, 19(4 :479. (收稿日期 :2008-11-20
高效毛细管电泳实验
高效毛细管电泳实验 一、实验目的 1. 进一步理解毛细管电泳的基本原理; 2. 熟悉毛细管电泳仪器的构成; 3. 了解影响毛细管电泳分离的主要操作参数。 二、实验原理 1.电泳淌度 毛细管电泳(CE )是以电渗流 (EOF)为驱动力,以毛细管为分离通道,依据样品中组分之间淌度和分配行为上的差异而实现分离的一种液相微分离技术。离子在自由溶液中的迁移速率可以表示为: ν = μE (1) r 6 q πημ= (2) 式中ν是离子迁移速率,μ为电泳淌度,E 为电场强度。η为介质粘度,r 为离子的流体动力学半径,q 为荷电量。因此,离子的电泳淌度与其荷电量呈正比,与其半径及介质粘度呈反比。 2.电渗流和电渗淌度 电渗流(EOF )指毛细管内壁表面电荷所引起的管内液体的整体流动,来源于外加电场对管壁溶液双电层的作用。 在水溶液中多数固体表面根据材料性质的不同带有过剩的负电荷或正电荷。就石英毛细管而言,表面的硅羟基在pH 大于3以后就发生明显的解离,使表面带有负电荷。为了达到电荷平衡,溶液中的正离子就会聚集在表面附近,从而形成所谓双电层,如图1所示。这样,双电层与管壁之间就会产生一个电位差,叫做Zeta 电势。但毛细管两端施加一个电压时,组成扩散层的阳离子被吸引而向负极移动。由于这些离子是溶剂化的,故将拖动毛细管中的体相溶液一起向负极运动,这便形成了电渗流。 电渗流的大小可用速率和淌度来表示: ()E EO F ηεξν/= (3) 或者 ηεξμ/=EO F (4) 式中νEOF 为电渗流速率,μEOF 为电渗淌度,ξ为Zeta 电势,ε为介电常数。 3.毛细管电泳的分离模式 CE 有6种常用的分离模式,其中毛细管区带电泳(CZE )、胶束电动毛细管色谱(MEKC )和毛细管电色谱(CEC )最为常用。本实验的内容为CZE 。 4.毛细管电泳的基本参数
凝胶电泳实验报告模板
凝胶电泳实验报告模板
降低了对流运动,故电泳的迁移率又是同分子的摩擦系数成反比的。已知摩擦系数是分子的大小、极性及介质粘度的函数,因此根据分子大小的不同、构成或形状的差异,以及所带的净电荷的多少,便可以通过电泳将蛋白质或核酸分子混合物中的各种成分彼此分离开来。在生理条件下,核酸分子的糖-磷酸骨架中的磷酸基因呈离子状态从这种意义上讲,D N A 和RNA多核苷酸链可叫做多聚阴离子( Polyanions ) 。因此,当核酸分子被放置在电场中时,它们就会向正电极的方向迁移。由于糖- 磷酸骨架结构上的重复性质,相同数量的双链DNA几乎具有等量的净电荷,因而它们能以同样的速度向正电极方向迁移。在一定的电场强度下,DNA分子的这种迁移速度,亦即电泳的迁移率,取决于核酸分子本身的大小和构型,分子量较小的DNA分子比分子量较大的DNA 分子迁移要快些。这就是应用凝胶电泳技术分离DNA片段的基本原理。 聚丙烯酰胺凝胶电泳,普遍用于分离蛋白质及较小分子的核酸。琼脂糖凝胶孔径较大适用于分离同工酶及其亚型,大分子核酸等应用较广。琼脂糖和聚丙烯酰胺可以制成各种形状、大小和孔隙度。琼脂糖凝胶分离DNA度大小范围较广,不同浓度琼脂糖凝胶可分离长度从200bp至近50kb的DNA段。琼脂糖通常用水平装置在强度和方向恒定的电场下电泳。聚丙烯酰胺分离小片段DNA(5-500bp)效果较好,其分辩力极高,甚至相差1bp的DNA段就能分开。聚丙烯酰胺凝胶电泳很快,可容纳相对大量的DNA,但制备和操作比琼脂糖凝胶困难。聚丙烯酰胺凝胶采用垂直装置进行电泳。目前,一般实验室多用琼脂糖水平平板凝胶电泳装置进行DNA电泳。 3.1 凝胶电泳的分类 按照分离物质来分凝胶电泳可以分为核酸凝胶电泳和蛋白质凝胶电泳;按照分离介质来分可以分为琼脂糖凝胶电泳技术和PAGE凝胶电泳。本次实验我们采用按介质的分类方法来学习的。 3.1.1琼脂糖凝胶电泳 琼脂糖凝胶电泳是用琼脂糖作支持介质的一种电泳方法。其分析原理与其他
毛细管电泳技术在检测分析中的应用
2011-12-31 毛细管电泳技术及其在检测分析中的应用分析化学毛细管电泳技术及其在检测分析中的应用 摘要:毛细管电泳技术(CE)作为现今一种主要的分析技术,凭借其高效、灵敏、快速、设备简单、广泛适用性等特点,广泛应用于各个领域。本文简要概述了CE技术的原理及特点,并简述了它在环境分析、食品分析、药物分析、生物大分子分析等各个领域的应用。 关键词:毛细管电泳;分析;应用 1.毛细管电泳技术简介 1.1 产生与发展 毛细管电泳技术(Capillary Electrophoresis, CE)是一种在电泳技术的基础上发展的一种现代分 离技术。电泳技术作为一种分离技术已有近百年历史,1937 年A.Tiselius首先提出:传统电泳最大的局限是难以克服由高电压引起的焦耳热。1967年,Hjerten最先提出了毛细管电泳的雏形,即在直径为3mm的毛细管中做自由溶液的区带电泳。但他并没有完全克服传统电泳的弊端。直至1981年Jorgenson 和Lukacs提出在75μm内径毛细管柱内用高电压进 行分离, 这时现代毛细管电泳技术真正产生。1984 年Terabe将胶束引入毛细管电泳,开创了毛细管电 泳的重要分支:胶束电动毛细管色谱(MEKC)。1987年Hjerten等把传统的等电聚焦过程转移到毛细管 内进行。同年,Cohen 发表了毛细管凝胶电泳的工作。近年来,将液相色谱的固定相引入毛细管电泳中,又发展了电色谱,扩大了电泳的应用范围。 毛细管电泳技术兼有高压电泳及高效液相色谱 等优点,其突出特点是: (1)所需样品量少、仪器简单、操作简便。 (2)分析速度快,分离效率高,分辨率高,灵 敏度高。 (3)操作模式多,开发分析方法容易。 (4)实验成本低,消耗少。 (5)应用范围极广。 自1988年出现了第一批毛细管电泳商品仪器, 短短几年内, 由于CE符合了以生物工程为代表的生 命科学各领域中对多肽、蛋白质(包括酶,抗体)、 核苷酸乃至脱氧核糖核酸(DNA)的分离分析要求, 得到了迅速的发展。 1.2 毛细管电泳技术的简单原理 毛细管电泳的基本装置是一根充满电泳缓冲液的毛细管(如图1),和与毛细管两端相连的两个小瓶。微量样品从毛细管的一端通过“压力”或“电迁移”进入毛细管。电泳时,与高压电源连接的两个电极分别浸人毛细管两端小瓶的缓冲液中。样品朝与自身所带电荷极性相反的电极方向泳动。各组分因其分子大小、所带电荷数、等电点等性质的不同而迁移速率不同,依次移动至毛细管输出端附近的光检测器,检测、记录吸光度,并在屏幕上以迁移时间为横坐标,吸光度为纵坐标将各组分以吸收峰的形式动态直观地记录下来。 图 1 图 2 1.3毛细管电泳技术的分离模式 (1)毛细管区带电泳( Capillary Zone
(安全生产)毛细管电泳分析方法在食品安全监控中的应用
毛细管电泳分析方法在食品安全监控中的应用 (华东师大化学系叶建农) 食品安全是指食品中不应含有可能损害或威胁人体健康的有毒、有害物质或因素,从而导致消费者急性或慢性毒害或感染疾病、或产生危及消费者及其后代健康的隐患。近年来,世界范围内食品安全方面的恶性和突发事件不断发生。据美国疾控中心研究报告估计,美国每年因食品中毒而死亡的人数约5000人左右。日本也先后发生出血性大肠埃希菌O157食品中毒事件,以及导致上万人中毒的雪印牛奶事件。目前我国食品安全形势不容乐观,食品中毒事件时有所闻。据不完全统计,我国每年实际发生的食物中毒例数在200万人次以上,其中有相当比例是由违禁食品添加剂引起,如2005年“苏丹红”事件,2006年“瘦肉精”事件,2008年“三聚氰氨”事件等。这类事件不仅严重危害人们身体健康,而且也对经济发展和国家形象产生及其负面的影响。客观而言,目前我国食品安全仍处于风险高发期和矛盾凸显期,有必要进行全方位的整治。其中的一个环节,就是要切实做好食品安全监控工作。 食品分析大致可分为两大类,即食品中营养成分分析,以及食品中化学添加剂、化学污染物的分析。由此可见,食品安全监控的主要内容,本质上是指能够准确分析和严格控制食品中化学添加剂及化学污染物的种类和含量。其中食品添加剂属限用品。根据我国卫生部2008年新修订的“食品添加剂使用卫生标准”
(GB2760-2007)规定,在一定前提下可合法使用的食品添加剂总数为1812种,共分为22大类。这一千多种食品添加剂虽然已经卫生部认可,但对其允许的添加范围及添加量却有严格的规定和限制。至于化学污染物则属违禁品,有时又叫禁用品,即在任何条件下均不得人为添加,如苏丹红、瘦肉精、孔雀石绿、三聚氰氨等。 从理论上讲,现有的化学分析方法都有可能在某种程度上应用于食品安全监控。如比色法、滴定法、水解法、蔡氏砷斑法、凯氏定氮法、薄层色谱法、气相色谱法、高效液相色谱法、色谱-质谱联用法、毛细管电泳法等。 毛细管电泳(Capillary Electrophoresis, CE)是近二十来发展最快的一种分离分析技术,具有分离效率高、所需样品量少、分析成本低等优点。毛细管电泳分析法是以毛细管为分离通道、以高压直流电场为驱动力,根据样品中各组分之间迁移速度的差异而实现分离的一种液相分离技术。由于食品组成的复杂性,检测前的各组分之间的分离是必不可少的。食品中各组分经毛细管分离后,即可选用合适的检测器进行检测,如紫外吸收检测(UV)、激光诱导荧光检测(LIF)、电化学检测(EC)等。 近年来,国内外化学工作者开展了大量的研究工作,探索和开发毛细管电泳分析方法在食品安全监控中的具体应用。众所周知,有机磷农药是目前使用量最大的杀虫剂,占全部农药用量的80%以上,广泛用于谷物、棉花、果树等农作物。有机磷农药
毛细管电泳及其应用
毛细管电泳及其应用 摘要:毛细管电泳技术(Capillary Electrophoresis, CE),是近二十年来发展最为迅速的新型液相分离分析技术之一。CE实际上包含电泳、色谱及其相互交叉的内容,是继高效液相色谱之后的又一重大进展,具有分离效率高、简单、经济、快速和微量、自动化程度高等优点。毛细管电泳这些特点使其成为一种极为有效的分离技术,目前已是生命科学及其它学科中一种常用的分析手段,已广泛应用于蛋白质、氨基酸、无机离子、有机化合物等的分离分析。关键词:毛细管电泳,分离效率高,生命科学 引言 毛细管电泳是在传统电泳技术的基础上逐步发展起来的。电泳技术的出现可以追溯到100多年前[1]。1807-1809年,俄国物理学家F.F.Reuss首次发现黏土颗粒的电迁移现象,并开始研究带电粒子在电场中的电迁移行为,测定它们的迁移速度。起初电泳只是作为一种物理化学现象来研究。电泳真正意义上进入分析化学被视为一种重要意义的技术,是在瑞士化学家Tiselius[2]公布了移动界面电泳技术的细节之后。他首先将电泳现象成功的应用于人血清的分离,获得了多种血清蛋白,他制成第一台电泳仪,并进行自由溶液电泳。Tisedius对电泳技术的发展和应用所做的巨大贡献,使他获得了1948年诺贝尔化学奖。但是传统电泳最大的局限是难以克服由高电压引起的焦耳热。1967年Hjerten[3]最先使用慢速旋转的内径为3 mm的石英玻璃管进行自由溶波电泳,以UV进行检测,成功地分离了蛋白质、多肽、无机离子、有机离子等,Hjerten最早证明可以把高电场用于细内径的毛细管电泳,但他没有完全克服传统电泳的弊端。1974年Virtanen提出使用细毛细管提高分离效率,阐明电渗流就像泵一样可以驱动液体流过毛细管,并说明了使用更细内径的毛细管做毛细管电泳的特点。1979年Everaerts和Mikkers[4]使用内径为200μm聚四氟乙烯毛细管,提高了毛细管的分离效率,成功分离了16种有机酸。1981年Jorgenson和Luckas[5]发表了划时代的研究工作,采用内径为75μm 石英毛细管进行实验,采用高电场电迁移进样,以灵敏的荧光检测器进行检测,使丹酞化氨基酸高效、快速分离,首次获得理论塔板数高达4x105/m的柱效。Jorgenson和Lucas等人的开创性工作,使CE发生了根本性的变革,标志着CE从此跨入高效毛细管电泳时代。 1983年Hjerten[6]将毛细管的内壁填充聚丙烯酰胺凝胶并将其用于毛细管电泳分离,发展了毛细管凝胶电泳(CGE)。CGE具有极高的分辨本领。凝胶作为支持介质的引入大大促进了电泳技术的发展,可用于蛋白质碎片的分离及DNA序列的快速分析。 1984年Terabe等[7]将胶束引入毛细管电泳,开创了毛细管电泳的重要分支—胶束电动毛细管色谱(MECC)。他首次将表面活性剂十二烷基硫酸钠(SDS)加入缓冲液中,在溶液中形成离子胶束作假固定相,实现了中性离子的分离,目前,MEKC己成为应用非常广泛的电泳模式之一。1985年Hjerten[8]等把平板等电聚焦电泳过程转移到毛细管内进行,发展了等电聚焦毛细管电泳(CIEF)。他是将带有两性基团的样品、载体两性电解质、缓冲剂和辅助添加剂的混合物注入毛细管内[9],当在毛细管两端加上直流电压时,载体两性电解质可以在管内形成一定范围的pH梯度,从而达到使复杂样品中各组分分离的目的。1987年,Karger等[10]对凝胶填充技术进行了改进,优化了CGE技术,极大提高了其分离效率并阐明了用小内径毛细管可进行毛细管凝胶电泳。同年Smith等[11]将毛细管通过电喷射接口与质谱相连,从而实现了质谱和毛细管电泳联用的检测法,毛细管电泳-电喷雾质谱联用技术以其高效及高准确性被广泛应用于很多领域。 毛细管电泳根据分离机理和介质不同,具有多种分离模式,每种模式的选择性不同。毛细管电泳现有以下六种经典分离模式:毛细管区带电泳(Capillary Zone Electrophoresis, CZE),CZE是毛细管电泳中应用最广泛的一种分离模式,CZE用以分析带电溶质,其分离机理是基
毛细管电泳法测定毛发中氨基酸
毛细管电泳电化学检测分离测定毛发中的色氨酸酪氨酸和半胱氨酸 1.试验部分 1.1仪器与试剂 毛细管电泳-电化学检测系统(CE - ED) 为自组装, 包括±30 kV 高压电源(上海原子核研究所) ;三电极工作系统(直径为300μm的碳圆盘电极为检测电极、铂丝为辅助电极、饱和甘汞电极为参比电极);三维定位调节器(上海联谊光纤激光 器械厂);BAS LC- 3D 安培检测器(Bioanalytical Systems , USA) ;HW色谱工作 站(上海千谱软件有限公司);熔融石英毛细管(长70cm,内径25μm,河北永年光导纤维厂);超声波清洗器;毛细管清洗器(上海医科大学仪器厂);分析天平色氨酸,酪氨酸,半胱氨酸;头发样品:志愿者提供;其它试剂为分析纯。 1.2标准溶液及样品溶液的制备 标准溶液:色氨酸,半胱氨酸储备液:1.0×10- 3 g/m L,酪氨酸储备液:0.5×10- 3 g/m L,用50mmol/L硼砂-20mmol/L氢氧化钠溶液配置,再用运行缓冲液稀 释至所需浓度。 样品溶液:将头发用石油醚脱脂,干燥后称取50mg置于水解管中,加入3mL6mol/L氢氧化钠(含0.5%可溶性淀粉);水解管用真空泵抽真空3min,在酒精 喷灯上封管;然后,将封好的水解管置于110o C烘箱中水解20小时。将水解液置于已 加有2.9mL6mol/L盐酸溶液的25mL容量瓶中,用蒸馏水洗涤水解管3~4次,最后用 蒸馏水定容。 1.3 试验方法 毛细管使用前依次用0.1mol/L的NaOH、二次水、缓冲液各冲洗5min、2min、10min。自制碳圆盘电极使用前要用细砂纸打磨,并用超声波清洗2min,使用自组装的CE-ED检测系统,通过三维定位调节器使工作电极与毛细管的出口在同一直线上,并尽可能靠近毛细管的末端,以50mmol/L的硼砂(pH =8.98)缓冲液为运行液,采用电动进样,检测池内为0.1mol/L的NaO H溶液,阴极电泳槽为检测端。所有溶液使用前均用0.25μm聚丙烯滤膜过滤。 2 结果与讨论 2.1 3种氨基酸的分子量及等电点的比较 3种氨基酸的分子量:色氨酸(M r=204.11)>酪氨酸(M r=181.09)》半胱氨酸(M r=121.12);等电点:色氨酸(pI=5.89)> 酪氨酸(pI=5.66)> 半胱氨酸(pI=5.07);毛细管电泳的分
毛细管电泳分析法在药物分析中的应用
毛细管电泳分析法在药物分析中的应用 摘要 毛细管电泳技术又称为高效毛细管电泳。作为一种新的分离分析技术,以其高效,快速,低实验消耗等优点,受到了广泛重视,而其在药物分析中的应用得到迅速的发展。在原料分析中的中药材鉴别和质量控制,中药有效成分的分离与测定和中成药制剂。而在西药复方制剂中,广泛用于解热镇痛药、抗组胺药、消炎药和止咳药,降压药和抗生素、合成抗菌剂及生物技术产品等药物和制剂的分离,鉴定和分析及其对手性分子的拆分,基于手性主—客体络合的毛细管电泳手性拆分,基于手性胶束增溶的毛细管电泳手性拆分和基于蛋白质亲和的毛细管电泳手性拆分,还有临床用药中,都显示了其高效,快速的特点。毛细管电泳技术正广泛用于药物分析的各个相关的部分中,正越来越受到人们的重视。 Abstract Capillary electrophoresis technology called high performance capillary electrophoresis. As a new kind of separation and analysis technology, with its rapid, efficient, low consumption advantages of experiment was Received widely attention, and its application in pharmaceutical analysis is rapid development. The analysis of Chinese herbal medicine in raw material identification and quality control, the TCM separation and determination and proprietary Chinese medicine preparations. But in western medicine compound preparations, widely used in antipyretic analgesics, the antihistamine drugs, expectorant and cough, antihypertensives and antibiotics, synthetic antibacterial agent and biotechnology product such drugs and preparation of separation, appraisal and analysis and the opponent of chiral molecule split, based on chiral Lord - object complexation of capillary electrophoresis chiral resolution, based on chiral dissociation of increase soluble adopted capillary electrophoresis chiral separation and based on protein affinitive capillary electrophoresis chiral resolution, and clinical medicine, shows its high efficiency, fast characteristic. Capillary electrophoresis technology is widely used in pharmaceutical analysis of each relevant sections, are becoming more and more attention by people. 关键词:毛细管电泳技术药物分析应用 Keywords: Capillary electrophoresis drug analysis application 前言 毛细管电泳(CE) 又称为高效毛细管电泳(high performance capillary electrophoresis,HPCE),它以弹性石英毛细血管为分离通道,以高压直流电场为驱动力,依据样品中各组分的淌度和分配行为上的差别进行分离和分析。[1] 一毛细管电泳分析的特点
毛细管电泳法
毛细管电泳法分离水杨酸、苯甲酸及阿司匹林中的 含量测定
毛细管电泳法分离水杨酸、苯甲酸及阿司匹林中的含量测定 毛细管电泳又称高效毛细管电泳( High Performance Capillary Electrophoresis, HPCE) 是一种仪器分析方法。通过施加10-40kV 的高电压于充有缓冲液的极细毛细管,对液体中离子或荷电粒子进行高效、快速的分离。现在,HPCE 已广泛应用于氨基酸、蛋白质、多肽、低聚核苷酸、DNA 等生物分子分离分析,药物分析,临床分析,无机离子分析,有机分子分析,糖和低聚糖分析及高聚物和粒子的分离分析。人类基因组工程中DNA 的分离是用毛细管电泳仪进行的。 毛细管电泳较高效液相色谱有较多的优点。其中之一是仪器结构 简单(见图1)。它包括一个高电压源,一根毛细管,紫外检测器及计算机处理数据装置。另有两个供毛细管两端插入而又可和电源相连的缓冲液池。 high-v oltage power supply Buffer V ial Buffer V ial Detector Recording dev ice capillary Electrode Electrode 图1 CE 仪器组成示意图 毛细管中的带电粒子在电场的作用下,一方面发生定向移动的电泳迁移,另一方面,由于电泳过程伴随电渗现象,粒子的运动速度还明显受到溶液电渗流速度的影响。粒子的实际流速 V 是电泳流速度 Vep 和渗流速度 Veo 的矢量和。即: V = Vep + Veo (1) 电渗流是一种液体相对于带电的管壁移动的现象。溶液的这一运动是由硅/水表面的Zeta 势引起的。 CE 通常采用的石英毛细管柱表面一般情况下(pH>3)带负电。当它和溶液接触时,双电层中产生了过剩的阳离子。高电压下这些水合阳离子向阴极迁移形成一个扁平的塞子流,如图2。毛细管管壁的带电状态可以进行修饰,管壁吸附阴离子表面活性剂增加电渗流, 管壁吸附阳离子表面活性
毛细管电泳原理及其应用
毛细管电泳原理及其应用 学院:海洋港口学院班级:14制药工程学号:1423014113 姓名:蒋佳丽时间:2015年1月7日 前言 毛细管电泳(capillary electrophoresis, CE)是近十几年来迅速发展起来的一种分离技术,虽说在上世纪六七十年代就有人对毛细管内电渗流形式做了理论探索并也开始尝试毛细管电泳技术,但都因为受到检测器灵敏度限制、电 泳过程中产生的焦耳热无法有效散失等因素的制约,影响分离效果。八十年代初,外壁涂有聚二酞亚胺,内径小于100}m 的熔融石英毛细管的使用[1]及检测器灵敏度的提高大大推动了毛细管电泳技术的发展,由于CE具有普通电泳和色谱 的优点及具有高效、高灵敏度、快速、低运行成本、犬信息量和易于自动化等特点,近年来在生物化学、临床诊断、 法医刑侦学等领域应用广泛。 一、CE设备及原理 毛细管电泳是以高压电场为驱动力,以毛细管为分离通道,根据样品各组分之间的淌度及分配上的行为差异而实现分离目的的一类液相分离技术。其仪器装置一般由以下几部分组成(见图一)1.高压电源;2.毛细管;3.在线检测器;4.电极及电极液;5.加样系统。毛细管是由熔融石英加工制成的(内径20一100}m,长度为20一100cm ),外壁涂有一层聚二酞亚胺以增加其柔韧性,内壁通常直接和溶液接触,有时也可根据需要涂上一层高聚物。与平板凝胶电泳类似的, 毛细管内也可填充支持介质,如琼脂糖,聚丙烯酞胺及甲基纤维素等。 图一毛细管电泳仪装置示意图(Tagliaro, 1998)[1] 在线检测器位于距样品盘约三分之二至五分之四毛细管总长处,对毛细管壁内部进行光学聚焦(在此处的毛细管外 壁的保护层是被烧掉或刮去的,以利于光的通透)。在线检测器通常有紫外、荧光和激光等多种检测方式。对DNA的分析通常使用紫外检测,对200bp的DNA片段的最小检测浓度是O.5mg/L。但对于生物样品中在和许多其他成分共存的痕量物质测定时,或对特殊分析(如DNA序列测定)时就要使用激光诱导的荧光检测器(laser induced fluorescence, LIF),使用LIF在非液相毛细管电泳中的检测灵敏度要比非激光诱导的荧光检测提高6倍[2],比紫外检测高100倍。另外,加入染料EB还可改善分离度,能将碱基长度相同但序列不同的DNA片段分开[3]。 毛细管中充满具有一定离子强度的缓冲液后,在其两端加上高电压,带电粒子在电场作用下以不同速度向其所带电荷反方向迁移,当pH>3时,毛细管内壁的石英分子因玫Siq分子的解离,而在表面形成一层负电荷,吸引缓冲液中的正离子,形成一个双电层。在高电压作用下,双电层水合阳离子层引起整个溶液在毛细管中向负极方向移动,形成电 渗流。带电粒子在毛细管内的电解质溶液中的迁移速度等于电泳和电渗流二者的矢量和,因此阳离子首先从负极流出;中性离子的速度等于电渗流速度,随后流出;而由于电渗流速度大于电泳速度,因此阴离子最后流出。 内壁石英分子除能造成电渗流外,还会吸附溶质中带正电荷的分子,从而影响分离效果。为了避免分析物被管壁 吸附,可选用缓冲液的pH大于样品混合物中蛋白质和多肤的等电点,或者选用pH接近pH2.0,此时毛细管内壁无解离的负电荷,但在这种酸性环境下,蛋白质容易失活,一般仅用于多肤分析。有时也可对毛细管内壁进行涂层,如中性
