原电池与电解池习题练习

原电池与电解池习题练习(3)
一、选择题
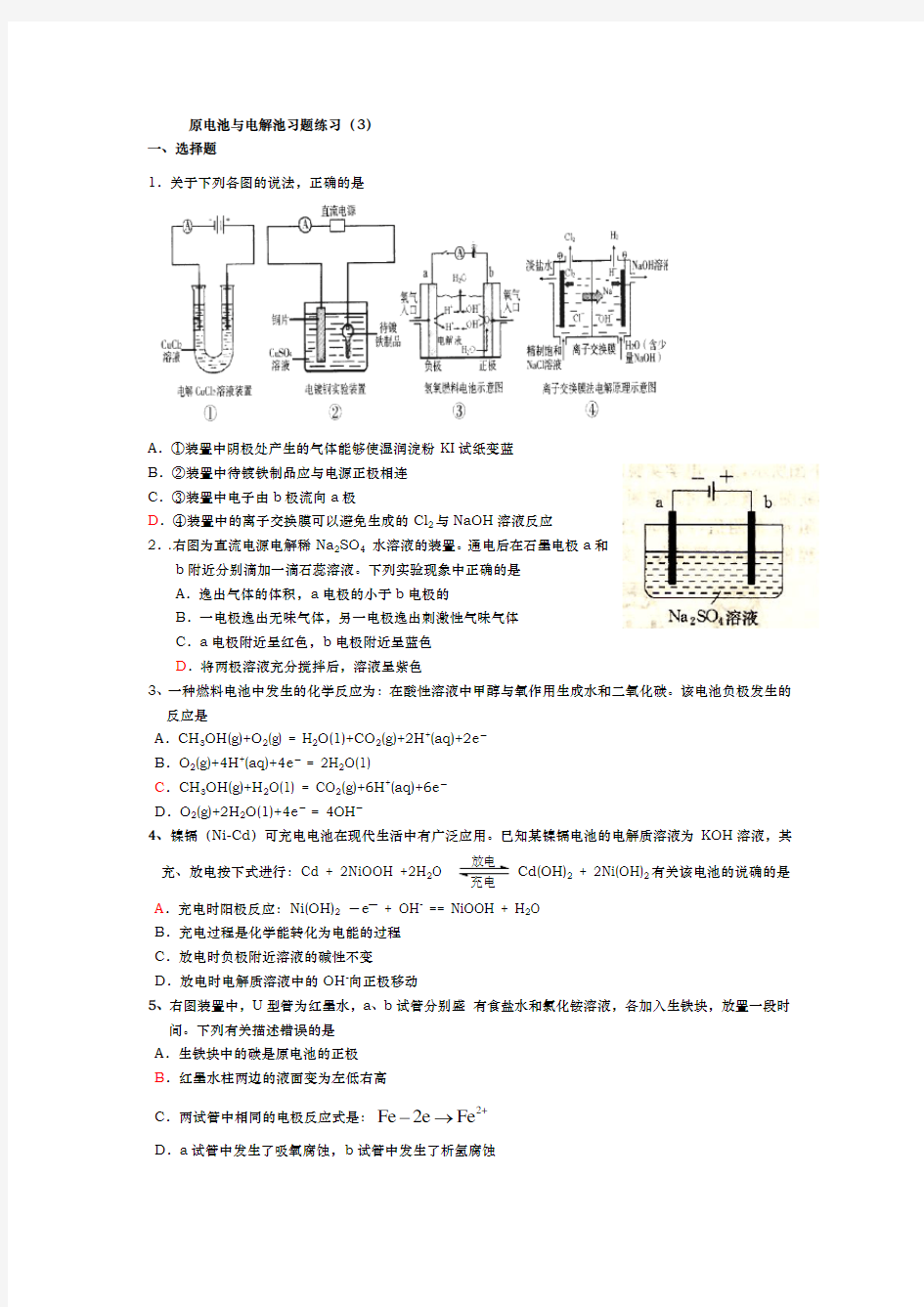
1.关于下列各图的说法,正确的是
A .①装置中阴极处产生的气体能够使湿润淀粉KI 试纸变蓝
B .②装置中待镀铁制品应与电源正极相连
C .③装置中电子由b 极流向a 极
D .④装置中的离子交换膜可以避免生成的Cl 2与NaOH 溶液反应
2..右图为直流电源电解稀Na 2SO 4 水溶液的装置。通电后在石墨电极a 和
b 附近分别滴加一滴石蕊溶液。下列实验现象中正确的是
A .逸出气体的体积,a 电极的小于b 电极的
B .一电极逸出无味气体,另一电极逸出刺激性气味气体
C .a 电极附近呈红色,b 电极附近呈蓝色
D .将两极溶液充分搅拌后,溶液呈紫色
3、一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是
A .CH 3OH(g)+O 2(g) = H 2O(1)+CO 2(g)+2H +(aq)+2e -
B .O 2(g)+4H +(aq)+4e - = 2H 2O(1)
C .CH 3OH(g)+H 2O(1) = CO 2(g)+6H +(aq)+6e -
D .O 2(g)+2H 2O(1)+4e - = 4OH -
4、镍镉(Ni-Cd )可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH 溶液,其充、放电按下式进行:Cd + 2NiOOH +2H 2O 放电充电Cd(OH)2 + 2Ni(OH)2有关该电池的说确的是
A .充电时阳极反应:Ni(OH)2 -e — + OH - == NiOOH + H 2O
B .充电过程是化学能转化为电能的过程
C .放电时负极附近溶液的碱性不变
D .放电时电解质溶液中的OH -向正极移动
5、右图装置中,U 型管为红墨水,a 、b 试管分别盛 有食盐水和氯化铵溶液,各加入生铁块,放置一段时
间。下列有关描述错误的是
A .生铁块中的碳是原电池的正极
B .红墨水柱两边的液面变为左低右高
C .两试管中相同的电极反应式是:2+Fe 2e Fe -→
D .a 试管中发生了吸氧腐蚀,b 试管中发生了析氢腐蚀
6、把a、b、c、d四块金属片浸泡在稀硫酸中,用导线两两相连可以组成各种原电池。若a、b相连时,a为负极;c、d相连时,d上有气泡逸出;a、c相连时,a极减轻;b、d相连时,b为正极。则这四种金属活泼性顺序由强到弱的顺序为
A.a>b>c>d B.a>c>b>d C.a>c>d>b D.b>d>a>c
7、取一用饱和的NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,圈为白色,外圈呈浅红色。则下列说法错误的
是
A.b电极是阴极B.a电极与电源的正极相连
C.电解过程中水是氧化剂D.b电极附近溶液的pH变小
8、右图所示装置I是一种可充电电池,装置II为电解池。离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3 Na2S4+3NaBr。闭合开关K时,b极附近先变红色。下列说确的是A.负极反应为4Na-4e-=4Na+
B.当有0.01 mol Na+通过离子交换膜时,b电极上析出标准状况
下的气体112 mL
C.闭合K后,b电极附近的pH变小
D.闭合K后,a电极上有气体产生
9、燃料电池是燃料(如CO,H2,CH4等)跟氧气(或空气)起反应
将化学能转变为电能的装置,电解质溶液是强碱溶液,下面关于甲烷燃料电池的说确的是
A.负极反应式:O2+2H2O+4e==4OH- B.负极反应式:CH4+8OH--8e==CO2+6H2O
C.随着放电的进行,溶液的pH值不变D.放电时溶液中的阴离子向负极移动
10、如图所示各容器中盛有海水,铁在其中被腐蚀由快到慢的顺序是
A.④>②>①>③ B.②>①>③>④
C.④>②>③>① D.③>②>④>①
11、500 mL KNO3和Cu(N03)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说确的是
A.原混合溶液中c(K+)为4 mol·L-1 B.上述电解过程中共转移4 mol电子
C.电解得到的Cu的物质的量为0.5 mol D.电解后溶液中c(H+)为2 mol·L-1
12、用指定材料做电极来电解一定浓度的溶液甲,然后加入物质乙能使溶液恢复为甲溶液原来的浓度,则合适的组是:
阳极阴极溶液甲物质乙
A.Pt Pt NaOH NaOH固体
B.Pt Pt H2SO4H2O
C. C Fe NaCl 盐酸
D.粗铜精铜CuSO4Cu(OH)2
13、将含有4
上析出19.2gCu,此时在另一电极上放出的气体在标准状况下的体积为
Fe C K 1
K 2 NaCl 饱和 溶液 A .5.60L B .6.72L C .4.48L D .3.36L
14、 用铂电极电解2价过渡元素硝酸盐溶液600mL ,若某极产生672mL 气体(标准状况),另一极增重3.81g ,假设溶液体积不变,且原溶液pH 值为6,正确的判断是:
①电解后溶液的pH 值为0.9,②电解后溶液pH 值的为0.7,③该金属的相对原子量为65,④该金属的相对原子量为63.5,⑤该金属的相对原子量为24。
A .①④
B .②④
C .①⑤
D .②③
15、 在蒸馏水中按物质的量之比为1∶1∶1∶2加入AgNO 3,Ba (NO 3)2,Na 2SO 4,NaCl ,使之完全溶解,以铂电极电解该混合物至溶质完全反应,则所得氧化产物与还原产物的质量比为:
A .35.5∶108
B .71∶2
C .108∶35.5
D .71∶109
16.用惰性电极电解M (NO 3)x 的水溶液,当阴极上增重a g 时,在阳极上同时产生b L 氧气(标准状况):从而可知M 的原子量为
A.b ax 4.22
B.b ax 2.11
C.b ax 6.5
D.b
ax 5.2 17.A 、B 、C 三个电解槽,A 槽是CuCl 2水溶液,纯铜片做阴极,B 、C 都是AgNO 3水溶液,纯银丝做阴极,先将A 、B 槽并联,再与C 槽串联进行电解,当B 槽中银丝质量增加0.108g ,C 槽银丝质量增加0.216g 时,A 槽中铜片质量增加为
A 0.216g
B 0.108g
C 0.064g
D 0.032g
18、将质量分数为0.052的NaOH 溶液1L (密度为1.06g ·cm -3)用铂电极电解,当溶液中NaOH 的质量分数改变了0.010时停止电解,则这时溶液中应符合的关系是
NaOH 的质量分数 阴极析出的物质的质量/g 阳极析出的物质的质量/g A
0.062 19 152 B
0.062 152 19 C
0. 1.2 9.4 D 0. 9.4 1.2
Zn+2OH --2e -=ZnO+H 2↑,Ag 2O+H 2O+2e -==2Ag+2OH -。据此判断锌是
A 、负极,并被氧化
B 、正极,并被还原
C 、负极,并被还原
D 、正极,并被氧化
20.钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:
2Fe +2H 2O +O 2 = 2Fe 2++4OH -,以下说法不正确的是
A .负极发生的反应为:Fe -2e - = Fe 2+
B .正极发生的反应为:2H 2O +O 2+4e - = 4OH -
C .铁在上述情况下发生的腐蚀称之为电化学腐蚀
D .钢柱在水下部分比在空气与水交界处更容易腐蚀
21、. 100 mL 4mol ·L-1H 2SO 4跟过量锌粉反应生成氢气,一定温度下,为了减缓反应进行的速率,但
又不影响生成氢气的总量,可向反应物中加入适量的:
A.碳酸钠(s) B . 硫酸钠水溶液 C.硫酸铜溶液 D 硝酸钾溶液.
22、用Pt 电极电解V mL 某二价金属硫酸盐溶液,当阴极有m mg 金属析出时,溶液pH 值由6.5变为
2.0(电解前后溶液的的体积变化可以忽略不计)。析出的金属的相对原子质量是
A .100m/V
B .200m/V
C .1×105m/V
D .2×105m/V
23、关于如右图所示装置的叙述中正确的是
A .若仅闭合K 2,铁极的电极反应式:Fe – 2e=Fe 2+
B .若仅闭合K 2,炭极上发生还原反应
C .若仅闭合K 1,电子由炭极沿导线流向铁极
D .若仅闭合K 1,炭极的电极反应式:2H 2O+O 2+4e=4OH -
24.下图为直流电源,为浸透饱和氯化钠溶液和酚酞试液的滤纸,为电镀槽.接
通电路后发现上的c 点显红色.为实现铁上镀锌,接通后,使c 、d 两点短
路.下列叙述不正确的是
A .a 为直流电源的正极
B .c 极发生的反应为2H ++2e -=H 2↑
C .f 电极为铁板
D .e 极发生还原反应
25.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
下列叙述不正确...
的是 (A )正极有1mol K 2FeO 4被氧化,放电时每转移3 mol 电子。
(B )充电时阳极反应为:Fe(OH)3 —3e — + 5 OH — = FeO -24 + 4H 2O
(C )放电时负极反应为:Zn —2e — +2OH —= Zn(OH)2
(D )放电时正极附近溶液的碱性增强
26、实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:负极Pb +SO -24===PbSO 4+2e -,正极PbO 2+4H ++SO -24+2e -===PbSO 4+2H 2O 。若制得Cl 2 物质的量为0.050mol ,这时电池消耗的H +的物质的量至少是
A.0.025 mol
B.0.050 mol
C.0.10 mol
D .0.20 mol 27.将Fe 片和Al 片放在盛有NaCl 溶液(其中滴入
酚酞)的表面器中,如图表示,最先观察到变
红色的区域为:
A .II 和Ⅳ
B .Ⅱ和Ⅲ
C .Ⅰ和Ⅲ
D .Ⅰ和Ⅳ 28、镍镉(Ni-Cd )可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行
:
由此可知,该电池放电时的负极材料是
A .Cd(OH)2
B .Ni(OH)2
C .Cd
D .NiO(OH)
29.锂电池是新一代的高能电池,它以质轻、能高而受到普遍重视,目前已经研制成功了多种锂电池。某种锂电池的总反应可表示为:Li +MnO 2===LiMnO 2。若该电池提供5库仑(C )电量(其他损耗忽略不计),则消耗的正极材料的质量约为(相对原子质量Li:7;MnO 2:87,电子电量取1.60×10-19C )
A.3.2×103 g
B.7×10-4 g C .4.52×10-3 g D.4.52×10-2 g
30.关于右图所示的原电池,下列说确的是
A .电子从锌电极通过检流计流向铜电极
B .盐桥中的阴离子向硫酸铜溶液中迁移
C .锌电极发生还原反应,铜电极发生氧化反应
D .铜电极上发生的电极反应是↑=+-+222H e H
二、填空:
31、按下图装置进行实验,并回答下列问题 ⑴判断装置的名称:A 池为 B 池为 ⑵ 铜极为______极,电极反应式为
石墨棒C 1为___极,电极反应式为
石墨棒C 2附近发生的实验现象为 ⑶当C 2极析出224mL 气体(标准状态时,锌的质量变化(增加或减少) g.
CuSO 4溶液的质量变化了(增加或减少了) g
31.(1)原电池 电解池 (2)正 Cu 2+ + 2e- → Cu 阳 2Cl - → Cl 2↑+ 2e- 有气泡冒出,溶液变红 (3)减少 0.65 增加 0.015
32、工业上+6价 的Cr 含量不能大于0.5mg ·L -1,为了达到废水排放标准,工业上处理含Cr 2O 72—酸性废水用以下方法: ①往工业废水中加入适量的NaCl (1~2g ·L -1);②以铁电极进行电解,经过一段时间
Zn C 2 Cu
C 1 A B CuSO 4溶液 KCl 酚酞溶液 放电
充电 3Zn + 2K 2FeO 4 + 8H 2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH
后有Cr (OH )3和Fe (OH )3沉淀生成;③过滤回收沉淀,废水达到排放标准。试回答:
(1)写出电解时的电极反应,阳极 阴极 。
(2)Cr 2O 72—转变为Cr 3+的离子方程式:
(3)电解过程中Cr (OH )3,Fe (OH )3沉淀是怎样产生的?______。(4)能否将电极改为石墨电极?为什么?______。
32、(1)阳极Fe-2e =Fe 2+,阴极2H ++2e =H 2↑。(2)Cr 2O 72—+ 6Fe 2++14H +=2Cr 3++6Fe 3+ +7H 2O
(3)因H +放电,破坏了水的电离平衡,产生的OH -与溶液中的Fe 3+,Cr 3+生成
Cr (OH )3和Fe (OH )3沉淀。(4)不能,因用石墨电极,阳极Cl -放电,不能产生还原剂Fe 2+,
33、某学生试图用电解法根据电极上析出物质的质量来验证阿佛加德罗常数值,其实验方案的要点为: ① 用直流电电解氯化铜溶液,所用仪器如图:
②在电流强度为I 安培,通电时间为ts 钟后,精确测得某电极上析出的铜的质量为mg 。
试回答:
(1)连接这些仪器的正确顺序为(用图中标注仪器接线柱的英文字母表示。下同)E 接 ,C 接 , 接F 。
实验线路中的电流方向为 → → →C → → 。
(2)写出B 电极上发生反应的离子方程式 ,G 试管中淀粉KI 溶液变化的现象为 ,相应的离子方程式是 。
(3)为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序应是 。(选填下列操作步骤的编号)
①称量电解前电极的质量②刮下电解后电极上的铜并清洗③用蒸馏水清洗电解后电极
④低温烘干电极后称量⑤低温烘干刮下的铜后称量⑥再次烘干后称量至恒重
(4)已知电子的电量为1.6×10-19C 。试列出阿佛加德罗常数的计算表达式:N A 。
33、[答案](1)E 接D 、C 接A 、B 接F ;F →B →A →C →D →E (2)2Cl --2e=Cl 2↑;变蓝色;Cl 2+2I -=2Cl -+I 2(3)①③④⑥(4)19106.1264-??=m It
N A
34、在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,
圆筒还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图所示。接通
电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取
出电极,用搅棒上下剧烈
搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。
根据上述实验完成:(1)阳极上的电极反应式为 。(2)阴极上的电极反应式
为 。(3)原上层液体是__________________。(4)原下层液体是__________________。(5)搅拌后两层液体颜色发生变化的原因是 。
(6)要检验上层液体中含有的金属离子,其方法是 ,现象是__________________。
A a X Y (1) 2I - - 2e - = I 2
(2) 2H + +2e - = H 2 (3) KI (NaI)(4) CCl 4
(5) CCl 4 萃取了电解生成的I 2 (6) 焰色反应 _透过蓝色钴玻璃观察火焰的焰色
35.已知在pH 为4~5的环境中,Cu 2+几乎不水解,而Fe 3+几乎完全水解。某学生欲用电解纯净CuSO 4 溶液的方法来测定铜的相对原子质量。其实验过程如图所示:
(1)步骤 : ①所加的A 的化学式为 ;加入A 的作用是 (2)步骤②中所用的部分仪器如图:则A 应接在直流电源的 极(填“正”或“负” )。
(3)电解开始一段时间后,在U 型管中观察到的现象有 ;石墨电极上的电极反应式 。
(4)下列实验操作中必要的是(填字母) 。
A .称量电解前电极的质量
B .电解后,电极在烘干称重前,必须用蒸馏水冲洗
C .刮下电解后电极上析出的铜,并清洗、称重
D .电极在烘干称重的操作中必须按“烘干→称重→再烘干→再称重”进行
E .在有空气存在的情况下,烘干电极必须采用低温烘干的方法
(5)如果电解一段时间有n 克铜析出,在标准状况下放出vmLO 2 ,铜的相对原子质量为 (用带有n 、V 的计算式表示)。
35、CuO ;消耗H +,调节溶液的pH 至4~5,使Fe(OH)3沉淀完全 (2)负(3)溶液的蓝色变浅,A 极变粗,B 极上有气泡产生;4OH --4e -=2H 2O+O 2↑ (4)A 、B 、D 、E (5)11200n/V(3分)
36.电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解质溶液a ;X 、Y
是两块电极板,通过导线与直流电源相连。请回答以下问题:
⑴若X 、Y 都是惰性电极,a 是饱和NaCl 溶液,实验开始时,同时在两边各滴入几滴酚酞
试液,则 ①电解池中X 极上的电极反应式是 。在X 极附近观察到的现象是 。
②Y 电极上的电极反应式是 , 检验该电极反应产物的方是是 。
⑵如要用电解方法精炼粗铜,电解液a 选用CuSO 4溶液,则
①X 电极的材料是 ,电极反应式是
②Y 电极的材料是 ,电极反应式是
(说明:杂质发生的电极反应不必写出)
36、⑴①2H + + 2e - = H 2↑ 放出气体,溶液变红。
②2Cl - - 2e - = Cl 2 把湿润的碘化钾淀粉试纸放在Y 电极附近,试纸变蓝色。
⑵①纯铜 Cu 2+ + 2e - = Cu ②粗铜Cu - 2e - = Cu 2+
37.下图中X 是直流电源。两槽中c 、d 、e 为石墨棒,f 是铜棒,e 、f 两电极的质
量相等。接通电路后,发现d 附近显红色。
(1)①电源上a 为 极;(用“正”、“负”、“阴”、“阳”填空)
②Z 槽中f 为 极(同上);
③连接Y 、Z 槽线路中,电流的方向是d e (用“→”和“←”填空);
(2)①写出d 极上反应的电极反应式 ;②写出Y 槽中总反应化学方程
