中考化学金属的化学性质培优测试卷附答案

中考化学金属的化学性质培优测试卷附答案
一、初中化学金属的化学性质选择题
1.在一定条件下,一氧化碳、木炭都能与氧化铜发生反应,下列叙述正确的是A.反应产生的气体都有毒B.反应中都有红色固体生成C.反应类型都是置换反应D.反应的生成物不同
2.下列化学反应属于复分解反应是()
A.CH4+2O2点燃
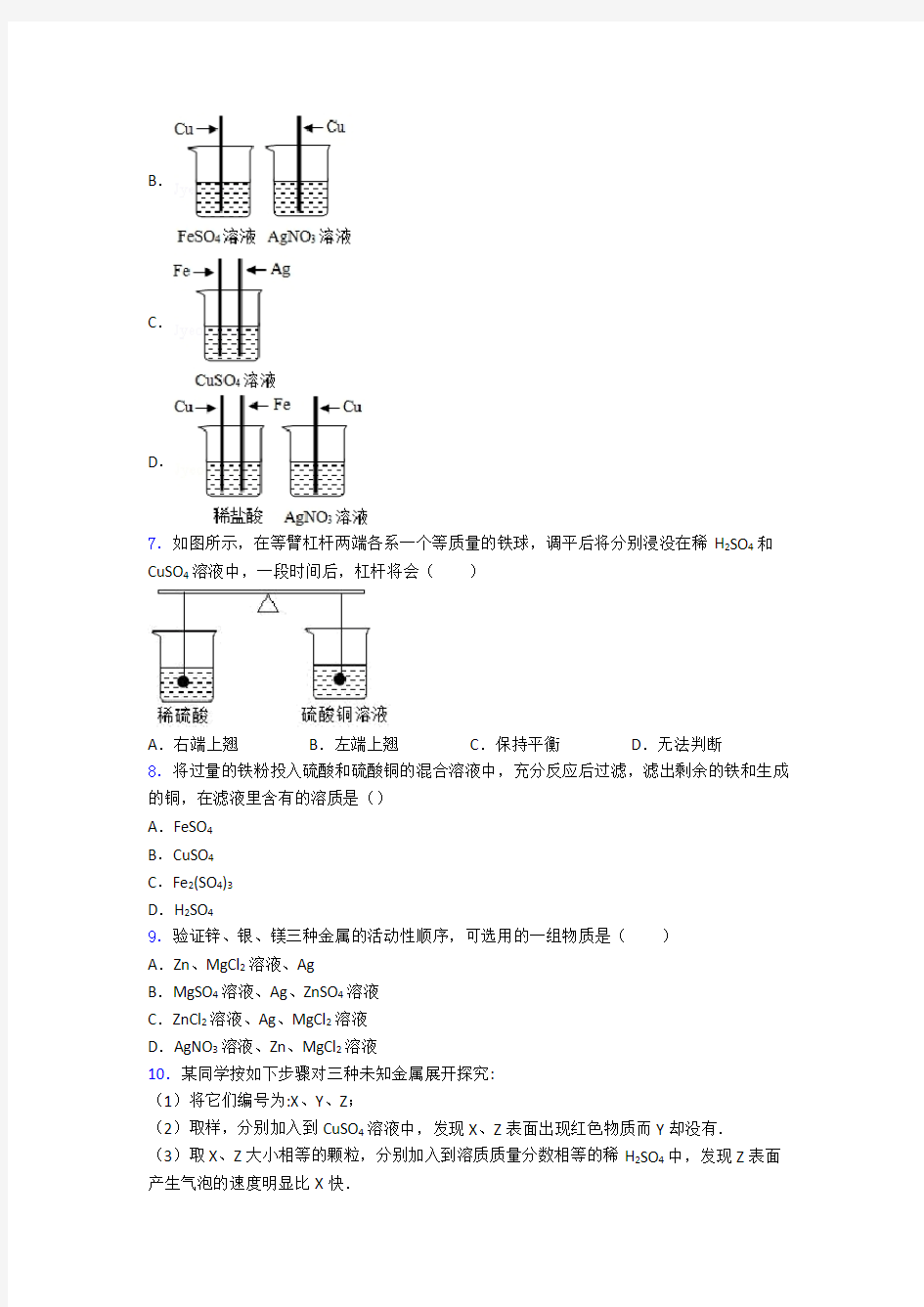
CO2+2H2O B.3Fe+2O2
点燃
Fe3O4
C.NaOH+HCl═NaCl+H2O D.H2CO3═CO2↑+H2O
3.等质量的甲、乙、丙三种金属的粉末,与足量的稀硫酸反应(反应后甲、乙、丙三种金属均显+2价),生成H2的质量与反应时间的关系如图所示,下列说法不正确的是()
A.三种金属的活泼性:乙>甲>丙
B.生成氢气的质量:甲>乙>丙
C.相对原子质量:甲>乙>丙
D.消耗硫酸的质量:甲>乙>丙
4.不法分子常用金光闪闪的“假金元宝”(铜锌合金)蒙骗百姓,下列对真假元宝的鉴别办法中错误的是
A.加盐酸B.看颜色C.用火烧D.测密度
5.为探究铁、铜、银的金属活动性顺序,下列各组试剂不可以的是( )
A.Fe、Ag、Cu(NO3)2B.Fe、Cu、AgNO3
C.Fe、CuSO4、AgNO3D.Fe、Cu、Ag、HCl
6.为探究Fe、Cu、Ag三种金属的活动性顺序,某兴趣小组设计了如图所示的四组实验方案,你认为不可行的是()
A.
B.
C.
D.
7.如图所示,在等臂杠杆两端各系一个等质量的铁球,调平后将分别浸没在稀H2SO4和CuSO4溶液中,一段时间后,杠杆将会()
A.右端上翘B.左端上翘C.保持平衡D.无法判断
8.将过量的铁粉投入硫酸和硫酸铜的混合溶液中,充分反应后过滤,滤出剩余的铁和生成的铜,在滤液里含有的溶质是()
A.FeSO4
B.CuSO4
C.Fe2(SO4)3
D.H2SO4
9.验证锌、银、镁三种金属的活动性顺序,可选用的一组物质是()
A.Zn、MgCl2溶液、Ag
B.MgSO4溶液、Ag、ZnSO4溶液
C.ZnCl2溶液、Ag、MgCl2溶液
D.AgNO3溶液、Zn、MgCl2溶液
10.某同学按如下步骤对三种未知金属展开探究:
(1)将它们编号为:X、Y、Z;
(2)取样,分别加入到CuSO4溶液中,发现X、Z表面出现红色物质而Y却没有.
(3)取X、Z大小相等的颗粒,分别加入到溶质质量分数相等的稀H2SO4中,发现Z表面产生气泡的速度明显比X快.
则X、Y、Z的金属活动性由强到弱依次为
A.X>Y>Z B.Z>X>Y C.X>Z>Y D.Z>Y>X
11.X、Y、Z、W是四种不同的金属,为比较金属活动性的强弱,某同学利用这四种金属单质、盐酸、Z的硝酸盐、W的硝酸盐,进行有关实验,结果如下表(能发生置换反应的记为“√”,不能反应的记为“一”,无标记的表示未做该实验)。这四种金属的活动性顺序为()
A.X>W>Y>Z B.X>Y>W>Z C.W>X>Y>Z D.Y>W>Z>X
12.有甲、乙、丙、丁四种金属。只有甲在自然界主要以单质形式存在。丁盐的水溶液不能用乙制的容器盛放,但可用丙制的容器盛放。这四种金属的活动性由强到弱的顺序是()
A.甲>乙>丁>丙B.丙>丁>乙>甲
C.丙>乙>丁>甲D.乙>丁>丙>甲
13.将过量的铁粉放入含AgNO3和Zn(NO3)2的混合溶液里,搅拌,使其充分反应后过滤,滤纸上留下的金属是
A.只有Ag B.Fe、Zn C.Fe、Ag D.Ag、Zn、Fe 14.向氧化铜和铁粉的混合物中加入一定量稀硫酸,充分反应后过滤,向滤渣中再滴入稀硫酸,有气泡产生,则下列判断正确的是
A.滤渣中可能含 Cu B.滤渣中只含 Fe
C.滤液中不含 CuSO4D.滤液中不一定含 FeSO4
15.金属R与CuCl2溶液反应的化学方程式为:R+CuCl2=RCl2+Cu,则下列说法错误的是A.该反应是置换反应B.金属R活动性比Cu强
C.金属R可能是铝D.该反应前后R的化合价发生了改变16.锰和镍(Ni)都是金属元素,将镍丝插入MnSO4溶液中无变化,插入CuSO4溶液中,镍丝上有红色固体析出.Mn、Ni、Cu三种金属的活动性由强到弱的顺序是()A.Cu、Mn、Ni B.Mn、Ni、Cu
C.Ni、Cu、Mn D.Mn、Cu、Ni
17.把一根洁净的铁钉放入稀硫酸中,①在铁钉表面产生气泡;②溶液由无色逐渐变为浅绿色③铁钉质量减轻;④溶液的质量增加。以上叙述正确的是()
A.①②③B.①③④C.①④D.①②③④
18.向Cu(NO3)2溶液中加入一定量的铁粉充分反应,下列情况中可能出现的是
①溶液中有Fe2+、Cu2+,不溶物为Cu ②溶液中有Fe2+、Cu2+,不溶物为Fe
③溶液中只有Cu2+,不溶物为Fe ④溶液中只有Fe2+,不溶物为Fe、Cu
A.①③B.②③C.①④D.③④19.下列图象能正确反映对应变化关系的是()
Mg、Zn、Fe与稀
盐酸反应
等质量等质量分数的
盐酸与足量的镁粉、
锌粉
将铜片加入一定量
的硝酸银溶液中
向一定质量的氯化锌
和盐酸溶液中加入锌
粒
A.A B.B C.C D.D
20.自从央行公告第四套人名币1角硬币从2016年11月1日起只收不付后,“菊花1角”身价飞涨。一个很重要的原因是,“菊花1角”材质特殊导致日渐稀少,其使用了铝锌材质。铝、锌元素的部分信息如下,则说法正确的是()
A.铝比锌的金属活泼性更弱
B.相等质量的铝和锌和足量稀硫酸反应,铝产生的氢气多
C.锌原子的最外层电子数比铝多17
D.铝的相对原子质量为
21.某溶液含有Cu(NO3)2和AgNO3,现向其中加入一定量的锌粉进行处理,并绘制参加反应的锌与溶液中溶质种类的关系图(如图所示),下列说法中不正确的是()
A.Cu的活动性比Ag强,只用盐酸无法探究两者活动性强弱
B.当溶质种类为1种时,金属单质种类可能为1种
C.c~d间(不含两点)的溶液中金属离子为Zn2+、Cu2+
D.从m1变化到m2时,溶液中硝酸铜的质量分数变大
22.金属活动性顺序表在化学学习中有重要作用。下列说法正确的是()
A.Zn不能置换出稀硫酸中的氢
B.Ag能将硫酸铜溶液中的铜置换出来
C.在Al、Mg、Fe中金属活动性最强的是Al
D.“真金不怕火炼”说明金在高温时也不与氧气反应
23.在CuCl2和AlCl3的混合溶液中,加入过量的锌粉,充分反应后过滤,留在滤纸上的物质是
A.Cu B.Cu和Al C.Zn和Cu D.Cu、Al和Zn 24.下列物质不能由金属和酸反应直接制得的是( )
A.AgCl B.FeCl2C.MgCl2D.AlCl3
25.锡(Sn)是五金之一,它的金属活动性顺序位于铁和铜之间,则下列反应不会发生的是()
A.Zn+Sn(NO3)2═Zn(NO3)2+Sn
B.Sn+2HCl═SnCl2+H2↑
C.Sn+2AgNO3═Sn(NO3)2+2Ag
D.Sn+MgSO4═SnSO4+Mg
26.“愚人金”实为铜锌合金,外观与黄金极为相似,常被不法商贩冒充黄金牟取暴利,下列关于鉴别“愚人金”与黄金的实验方案,合理的是()
①比较硬度,硬度小的是“愚人金”
②灼烧,表面变色的是“愚人金”
③浸没在稀硫酸中,表面有气泡产生的是“愚人金”
④浸没在硫酸锌溶液中,表面附着白色物质的是“愚人金”
A.①③B.②④C.①④D.②③
27.取一定量的Mg放入Cu(NO3)2和AgNO3的混合溶液中充分反应后过滤,得到固体和滤液。下列说法错误的是( )
A.固体中只有Ag时,滤液一定呈蓝色
B.固体中有Cu和Ag时,滤液一定呈无色
C.固体中一定有 Ag,滤液中可能有AgNO3
D.固体中可能有Cu,滤液中一定有Mg (NO3)2
28.下列关于金属材料的说法中正确的是( )
A.铝制品表面应常用钢刷擦洗
B.可用铁桶盛装农药波尔多液
C.焊锡(锡铅合金)的熔点低,常用来焊接金属
D.钢因为比生铁的含碳量高,所以应用范围更广
29.硬铝的组成金属有铝、镁、铜、锰等。已知:锰丝放入稀硫酸中,有气泡产生;锰丝放入硫酸铝溶液中,表面没有金属析出。结合我们所学金属再溶液中的活动性顺序,下列有关金属的活动性强弱判断错误的是
A.Mn强于Cu B.Al强于Mn
C .Mg 强于Al
D .Mn 强于Mg
30.将50克镁和铁的混合物与足量的稀硫酸反应产生3.6克氢气,将反应后的溶液蒸发结
晶,得到无水硫酸盐,其质量为( ) A .226.4克
B .222.8克
C .172.8克
D .无法计算
【参考答案】***试卷处理标记,请不要删除
一、初中化学金属的化学性质选择题 1.B 解析:B 【解析】
A 、一氧化碳和木炭都能和氧化铜反应生成铜和二氧化碳,生成的气体是二氧化碳,二氧化碳无毒,A 说法不正确;
B 、木炭、一氧化碳有还原性,能将氧化铜还原为铜.所以,反应现象中都有试管内黑色粉末变成红色.故B 正确;
C 、一氧化碳和氧化铜反应生成铜和二氧化碳,反应物是两种化合物,所以该反应不属于置换反应,碳和氧化铜反应生成铜和二氧化碳,是一种单质和一种化合物生成另一种单质和另一种化合物属置换反应,C 说法不正确;
D 、一氧化碳和氧化铜反应生成铜和二氧化碳,碳和氧化铜反应生成铜和二氧化碳,生成物相同,D 说法不正确; 故答案选B .
2.C
解析:C 【解析】 【详解】
A 、CH 4+2O 2===点燃
CO 2+2H 2O ,该反应的反应物中氧气是单质,不是两种化合物相互交换成分生成两种新的化合物的反应,不属于复分解反应,故不符合题意;
B 、3Fe+2CO 2===点燃
Fe 3O 4,该反应符合“多变一”的特征,属于化合反应,故不符合题意; C 、NaOH+HCl ═NaCl+H 2O ,该反应是两种化合物相互交换成分生成两种新的化合物的反应,属于复分解反应,故符合题意;
D 、H 2CO 3═CO 2↑+H 2O ,该反应符合“一变多”的特征,属于分解反应,故不符合题意; 故选C 【点睛】
掌握复分解反应的特征(换成分,价不变)是正确解析本题的关键。
3.C
【解析】
【分析】
【详解】
金属活动性越强,反应速率越快,那么三种金属活动性的强弱为乙>甲>丙;
依据图形,生成氢气的质量:甲>乙>丙,则消耗硫酸的质量:甲>乙>丙;
物质的质量可以用相对原子质量表示,相对原子质量越小,生成的气体的质量越多,故相对原子质量:丙>乙>甲。故选C。
4.B
解析:B
【解析】
造假者一般会参照真实物去造假的元宝,所以颜色等应该和真的差不多,造假像真.
A、加盐酸后,黄铜中的锌会与盐酸反应生成氢气,金不会与盐酸反应,现象不同,可以鉴别,故正确;
B、金和铜锌合金的颜色都是金黄色的,不能鉴别,故错误;
C、铜锌合金中的铜和氧气会生成黑色的氧化铜,而金不会与氧气反应,现象不同,可以鉴别,故正确;
D、合金的密度和纯金的密度不同,可以鉴别,故正确;
故选B.
5.D
解析:D
【解析】
D选项中铜,银都不与盐酸反应,所以不能区分铜银的活动性
6.A
解析:A
【解析】
A、铜不能将硫酸亚铁中的铁置换出来,说明铁的活动性比铜的强;银不能将硫酸亚铁中的铁置换出来,说明铁的活动性比银的强。但没有比较出铜和银的活动性强弱,错误;
B、铜不能将硫酸亚铁中的铁置换出来,说明铁的活动性比铜的强;铜能将硝酸银中的银置换出来,说明铜的活动性比银的强,故三种金属的活动性强弱顺序是铁、铜、银,正确;
C、铁能将硫酸铜中的铜置换出来,说明铁的活动性比铜的强;银不能将硫酸铜中的铜置换出来,说明铜的活动性比银的强,故三种金属的活动性强弱顺序是铁、铜、银,正确;
D、铜与稀盐酸不反应,说明铜位于氢的后面;铁能与稀盐酸反应,说明铁位于氢的前面;铜能将硝酸银中的银置换出来,说明铜的活动性比银的强,故三种金属的活动性强弱顺序是铁、铜、银,正确。故选A。
点睛:判断三种金属活动性强弱最简单的方法有两种:用中间的金属和两边金属的溶液或中间金属的溶液和两边的金属。如判断铁、铜、银的活动性顺序,方法有:硫酸亚铁溶液、铜、硝酸银溶液或铁、硫酸铜溶液、银。
7.B
【解析】
【分析】
铁和稀硫酸反应生成硫酸亚铁和氢气,和硫酸铜反应生成硫酸亚铁和铜。
【详解】
铁和稀硫酸反应生成硫酸亚铁和氢气,随着反应进行,铁球质量减小,溶液密度增大,浮力增大,铁和硫酸铜反应生成硫酸亚铁和铜,生成的铜附着在铁球表面,铁球质量增大,溶液密度减小,浮力减小,因此一段时间后,杠杆将会左端上翘。故选B。
【点睛】
金属活动顺序表中,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来。
8.A
解析:A
【解析】
【分析】
【详解】
A、在金属活动性顺序中,铁>氢>铜。过量的铁能将硫酸、硫酸铜全部反应,且都生成硫酸亚铁,所以滤液中只含FeSO4,符合题意;
B、因为铁粉过量,硫酸铜应和铁粉反应完,所以滤液中不含CuSO4,该选项不符合题意;
C、铁和硫酸、硫酸铜反应,都是生成硫酸亚铁,不是Fe2(SO4)3,该选项不符合题意;
D、因为铁粉过量,硫酸应和铁粉反应完,所以滤液中不含H2SO4,该选项不符合题意。故选A。
【点睛】
铁跟酸和盐发生置换反应时生成物中铁元素一定显+2价。
9.D
解析:D
【解析】
【详解】
验证锌、银、镁三种金属的活动性顺序,可设计方案为“中间金属两边盐,两边金属中间盐”,理论上锌、银、镁的活动性强弱顺序为镁>锌>银,故方案一为选金属锌和镁盐与银盐;方案二是金属镁和银与锌盐,故选D。
10.B
解析:B
【解析】
试题分析:将X、Y、Z分别加入到CuSO4溶液中,发现X、Z表面出现红色物质而Y却没有,说明Y的活动性最弱;再取X、Z大小相等的颗粒,分别加入到溶质质量分数相等的稀H2SO4中,发现Z表面产生气泡的速度明显比X快,说明Z的活动性比X强,故X、Y、Z
的金属活动性由强到弱依次为Z>X>Y,故选B
考点:金属的活动性
11.A
解析:A
【解析】
【分析】
排在氢前面的金属,才能置换出酸中的氢,而排在氢后面的金属不能置换出酸中的氢。【详解】
Y、Z与盐酸不反应,则Y、Z的金属活动性比氢弱,X、W的金属活动性比氢强,即X、W>H>X、Z,则只要验证Y、W、X、Z的金属活动性即可得出金属活动性顺序,Y能与Z 的硝酸盐反应,则Y的金属活动性比Z强,X能与W的硝酸盐反应,则X的活动性比W 强,则四种金属的活动性顺序为X>W>Y>Z。故选A。
【点睛】
排在金属活动性顺序中前面的金属能把排在后面的金属从其盐溶液里置换出来。
12.D
解析:D
【解析】
因为“只有甲在自然界主要以单质形式存在”可说明甲的活动性最弱。“丁盐的水溶液不能用乙制的容器盛放”但可用丙制的容器盛放。说明丁的活动性比乙弱,比丙强。因此D项正确。
点评:可根据金属与盐溶液是否反应平判断金属的活动性强弱。
13.C
解析:C
【解析】
试题分析:过量的铁粉放入含AgNO3和Zn(NO3)2的混合溶液里,搅拌,因为铁的活动性大于银小于锌属于能置换出银,滤纸上留下的金属是Fe、Ag。故选C.
考点:金属的活动性
14.C
解析:C
【解析】
反应时应是氧化铜先和酸反应,转化为铜离子,当铜离子与氢离子同时存在时,铁应该先和铜离子反应;当向滤渣中再滴入稀硫酸,有气泡产生,说明所加入的铁粉过量,说明原稀硫酸完全反应,且铜离子没有剩余,才会有氢气生成,也就说明,铜离子完全转化为铜单质而成为不溶物;A、氧化铜与硫酸反应生成硫酸铜,铁的活动性比铜强,铁能置换出硫酸铜溶液中的铜,所以不溶物中一定含有铜;故A错误;B、氧化铜与硫酸反应生成硫酸铜,铁的活动性比铜强,铁能置换出硫酸铜溶液中的铜,所以不溶物中一定含有铜,当向滤渣中再滴入稀硫酸,有气泡产生,说明所加入的铁粉过量,故B错误;C、铁的活动性比铜强,铁能置换出硫酸铜溶液中的铜,因此,所生成的硫酸铜可能会被铁粉完成反应,所得滤液中一定不含有硫酸铜,故C正确;D、铁与硫酸或硫酸铜反应都能生成可溶于水的硫酸亚铁,因此,滤液中一定含有硫酸亚铁;故D错误。故选C。
15.C
解析:C
【解析】
A、该反应是由单质与化合物反应生成新单质和新化合物,故符合置换反应的定义,故A 正确;
B、金属R能够将氯化铜中的铜置换出来,说明金属R比铜活泼,故B正确;
C、化合物中铝元素的化合价是+3,不可能生成AlCl2,故R不可能是铝,故错误;
D、反应前R是单质,化合价为0,反应后R以化合态存在,化合价不为0,故化合价一定改变了,故正确。故选C。
16.B
解析:B
【解析】
【分析】
锰和镍(Ni)都是金属元素,将镍丝插入MnSO4溶液中无变化,说明镍的金属活动性比锰弱,插入CuSO4溶液中,镍丝上有红色固体析出,说明镍的金属活动性比铜强。
【详解】
A、将镍丝插入MnSO4溶液中无变化,插入CuSO4溶液中,镍丝上有红色固体析出,镍能置换出铜,铜应该排在镍的后面,故A错误;
B、镍不能置换出锰,能置换出铜,Mn、Ni、Cu的活动性由强到弱的顺序是Mn>Ni>Cu,故B正确;
C、镍不能置换出锰,说明锰的活动性比镍强,故C错误;
D、镍丝插入硫酸铜溶液中,镍丝上有铜析出,证明镍比铜活泼,故D错误。
故选B。
17.D
解析:D
【解析】
【详解】
把一根洁净的铁钉放入稀硫酸中的反应原理:Fe+H2SO4=FeSO4+H2↑,①在铁钉表面产生气泡;②溶液由无色(稀硫酸)逐渐变为浅绿色(FeSO4)溶液③铁钉被消耗,铁钉质量减轻;④根据Fe+H2SO4=FeSO4+H2↑可知,每56份质量的铁能生成2份质量的氢气,溶液的质量增加;描述正确的是:①②③④;
故选:D。
18.C
解析:C
【解析】
【分析】
【详解】
根据金属活动性可知,铁比铜活泼,能置换出Cu(NO3)2溶液中的铜,同时生成硝酸亚铁。
①当加入的铁粉不足量时,有Cu(NO3)2剩余,溶液中有Fe2+、Cu2+,不溶物为Cu,故①正确;溶液中不能同时存在铁粉和Cu2+,因为它们能反应,故②③错误;④当加入的铁
粉过量时,溶液中只有Fe2+、不溶物为Fe、Cu,故④正确。故选C。
19.B
解析:B
【解析】
【分析】
【详解】
A、根据可
知,每24份质量的镁生成2份质量的氢气,每65份质量的锌生成2份质量的氢气,每56份质量的铁会生成2份质量的氢气, Mg、Zn、Fe与稀盐酸反应时,生成等质量的氢气,需要的镁的质量最小,需要锌的质量最多,与图像不符,故A错误;
B、根据可知,用等质量的相同质
量分数的盐酸分别与足量的镁粉和锌粉反应,最终生成的氢气的质量相等,镁的活动性强于锌,故对应的曲线是镁的比锌的斜率大,与图像相符,故B正确;
C、根据可知,铜与硝酸银生成硝酸铜和银,每64份质量的
铜和硝酸银反应生成硝酸铜和216份质量的银,反应后固体质量会增大,不会减小,与图像不符,故C错误;
D、往一定质量的ZnCl2和HC1溶液中加入锌粒,溶液的质量增加,当稀盐酸反应完全时,溶液的质量不再能增加,故D错误。故选B。
【点睛】
本题是一道图像坐标与化学知识相结合的综合题,解题的关键是结合所涉及的化学知识,正确分析各变化的过程,注意分析坐标轴表示的意义、曲线的起点、折点及变化趋势,确定正确的图像。
20.B
解析:B
【解析】
【详解】
A、铝比锌的金属活泼性更强,故A错误;
B、由产生氢气的质量=,可知,相等质量的铝和锌和足量稀硫酸反应,铝产生的氢气多,故B正确;
C、由于最外层电子数不超过8个,锌原子的核外电子数比铝多17,不是最外层电子数比铝多17,故C错误;
D、由元素周期表中一个格的含义可知,铝的相对原子质量为26.98,单位是“1”,故D错误。
故选:B。
解析:B
【解析】
【分析】
根据在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,锌>铜>银,锌能与硝酸铜反应生成硝酸锌和铜,能与硝酸银反应生成硝酸锌和银,生成的铜能与硝酸银反应生成硝酸铜和银进行分析
【详解】
锌粉加入Cu(NO3)2和AgNO3的混合液中,锌粉会先和AgNO3发生反应,后跟Cu(NO3)2发生反应。
A、由金属活动顺序表可知:铜和银都排在氢的后面,所以滴加盐酸后两者均不能与盐酸反应,所以无法无法探究两者活动性强弱,故说法正确;当溶质种类为两种时,硝酸银全部被置换为银,硝酸铜可能有部分被置换为铜,金属单质的种类可能是2种,说法正确;故不符合题意;
B、当溶质种类为1种时,表明溶液中的硝酸银和硝酸铜全部参加反应,这种溶质应该是硝酸锌,从而可知金属单质至少两种,不可能为1种,说法错误;故符合题意;
C、c~d间(不含两点)的溶液中金属离子是两种,则这两种一定是Zn2+、Cu2+,此时Ag+已经被完全置换了出来,说法正确;故不符合题意;
D、当参加反应的锌的质量为m1﹣m2时,溶液中溶质的种类为三种,表明硝酸银没有全部被置换出来,硝酸铜没有参加反应,溶液中硝酸铜的质量相等,但是溶液的质量会随着锌置换出硝酸银中的银而不断小,故硝酸铜的质量分数会逐渐升高,说法正确;故不符合题意;
故选B
【点睛】
本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行,注意金属在与两种金属的盐溶液发生置换反应时,会先置换活动性较弱的金属。
22.D
解析:D
【解析】
【分析】
【详解】
A、在金属活动性顺序中,锌位于氢的前边,Zn能置换出稀硫酸中的氢,故A错误;
B、在金属活动性顺序中,银位于铜的后边,Ag不能将硝酸铜溶液中的铜置换出来,故B 错误;
C、在Al、Mg、Fe中金属活动性最强的是Mg,故C错误;
D、“真金不怕火炼”说明金在高温时也不与氧气反应,故D正确。
故选:D。
23.C
解析:C
金属活动性铝>锌>铝,在CuCl2和AlCl3的混合溶液中只有铜排在锌的后面,所以铜全部被置换出来,而铝不会被过滤出来,由于加入过量的锌粉,所以还含有锌。
点睛:
金属与盐溶液反应时:(1)在金属活动性顺序中只要排在前面的金属就能把排在后面的金属从其盐溶液中置换出来,而与H的位置无关。但K、Ca、Na等金属例外,由于它们过于活泼,不与溶液中的盐发生置换反应,而是先与溶液中的水发生置换反应。(2)铁与盐溶液发生置换反应时,生成二价亚铁盐。(3)用同种金属置换不同的盐溶液,盐中金属排在金属活动性顺序中较后的金属首先被置换出来。用不同的金属置换同种盐溶液,盐中金属先被排在金属活动性顺序中较前的金属置换出来。另外,若有一种金属和多种混合盐溶液反应,最先反应的是最不活泼的那个金属的盐溶液。
24.A
解析:A
【解析】
【分析】
【详解】
A、在金属活动性顺序中,银位于氢的后面,不能与酸反应,故A符合题意;
B、铁和盐酸反应生成的是氯化亚铁,故B不符合题意;
C、镁和盐酸反应生成氯化镁。故C不符合题意;
D、铝和盐酸反应生成氯化铝。故D不符合题意。
故选:A。
25.D
解析:D
【解析】
【分析】
【详解】
A、由于锌位于铁的前面,锡(Sn)位于铁的后面,所以锌能置换硝酸锡中的锡,故A能发生反应;
B、锡(Sn)位于铁和铜之间,且锡位于氢的前面,能与酸反应,故B能发生反应;
C、因为锡(Sn)位于铁和铜之间,银位于铜的后面,所以锡位于银的前面,故C能发生反应;
D、因为镁位于铁的前面,锡(Sn)位于铁的后面,所以锡(Sn)位于镁的后面,所以该反应不能发生.
故选D.
【点睛】
只有排在前面的金属才能把排在它后面的金属从盐溶液中置换出来.
26.D
解析:D
【解析】
①比较硬度,合金的硬度比纯金属的硬度大,故硬度小的是纯金,故错误;
②灼烧,铜能够和氧气反应产生氧化铜,表面变黑色的是“愚人金”,故正确;
③浸没在稀硫酸中,锌能够和稀硫酸反应产生氢气,因此表面有气泡产生的是“愚人金”,故正确;
④浸没在硫酸锌溶液中,三种金属都不能和硫酸锌反应,无法鉴别,故错误;
故选D。
27.B
解析:B
【解析】镁比铜活泼,铜比银活泼。取一定量的Mg放入Cu(NO3)2和AgNO3的混合溶液中充分反应后过滤,得到固体和滤液。A、固体中只有Ag时,镁质量不足,没有与硝酸铜反应,滤液一定呈蓝色,硝酸铜溶液呈蓝色,故A正确;B、固体中有Cu和Ag时,滤液不一定呈无色,只有镁质量充足时,滤液一定呈无色,故B错误;C、固体中一定有 Ag,滤液中可能有AgNO3,如果镁质量比较少时,滤液中有AgNO3是完全有可能的,故C正
确;D、固体中可能有Cu,滤液中一定有Mg (NO3)2,这是由镁的质量决定的,故D正确。点睛∶物质发生化学反应后生成物的成分组成要成分考虑到反应物的质量以及是否过量,不足或恰好完全反应。
28.C
解析:C
【解析】
A.常温下,铝能与空气中的氧气反应生成致密的氧化铝保护膜,所以铝制品表面不能常用钢刷擦洗,以免刮掉保护膜; B.波尔多液的主要成分是硫酸铜,铁能与硫酸铜反应生成硫酸亚铁和铜,使药效降低;C.焊锡(锡铅合金),合金的熔点低,可用来焊接金属;D.钢因为比生铁的含碳量低,钢的性质与生铁不同,比生铁有很多优良的性能,所以应用范围更广;选C
29.D
解析:D
【解析】
【分析】
【详解】
锰丝放入稀硫酸中,有气泡产生;
说明锰的金属活动性强于氢;
锰丝放入硫酸铝溶液中,表面没有金属析出,说明铝的金属活动性强于锰;
结合铜的金属活动性弱于氢;镁的金属活动性强于氢铝;
所以应选D。
30.B
解析:B
【解析】
设硫酸根的质量为x,根据关系式A→ASO4→SO4→H2↑,
则2 3.6g
=
96x
,x=172.8g
所以无水硫酸盐的质量=172.8g+50g=222.8g。故选B。
点睛:已知Mg→MgSO4;Fe→FeSO4,并且可知道,在H2SO4中氢元素与硫酸根的质量比为2:96,由氢气的质量可求出硫酸根的质量,再根据质量守恒定律,可得无水硫酸盐。点睛:质量守恒定律:参加反应的各物质的质量总和等于反应后生成的各物质的质量总和,反应前后元素的种类不变。
