高二化学期末复习题

高二化学期末复习题
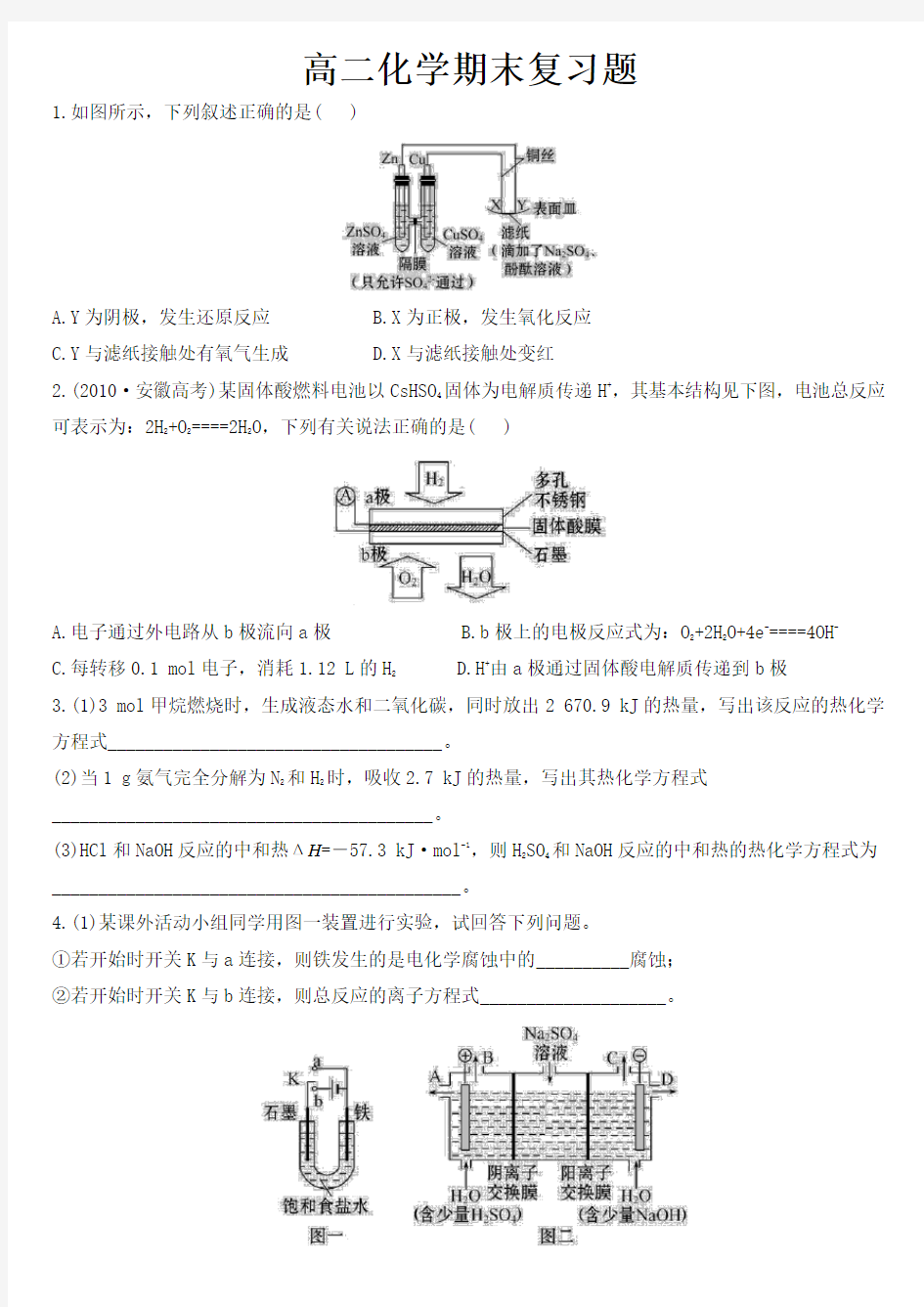
1.如图所示,下列叙述正确的是( )
A.Y为阴极,发生还原反应
B.X为正极,发生氧化反应
C.Y与滤纸接触处有氧气生成
D.X与滤纸接触处变红
2.(2010·安徽高考)某固体酸燃料电池以CsHSO
4
固体为电解质传递H+,其基本结构见下图,电池总反应
可表示为:2H
2+O
2
====2H
2
O,下列有关说法正确的是( )
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O
2+2H
2
O+4e-====4OH-
C.每转移0.1 mol电子,消耗1.12 L的H
2
D.H+由a极通过固体酸电解质传递到b极
3.(1)3 mol甲烷燃烧时,生成液态水和二氧化碳,同时放出2 670.9 kJ的热量,写出该反应的热化学方程式____________________________________。
(2)当1 g氨气完全分解为N
2和H
2
时,吸收2.7 kJ的热量,写出其热化学方程式
_________________________________________。
(3)HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H
2SO
4
和NaOH反应的中和热的热化学方程式为
____________________________________________。
4.(1)某课外活动小组同学用图一装置进行实验,试回答下列问题。
①若开始时开关K与a连接,则铁发生的是电化学腐蚀中的__________腐蚀;
②若开始时开关K与b连接,则总反应的离子方程式____________________。
(2)芒硝(化学式为Na 2SO 4·10H 2O),无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物。该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图二所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是提高原料的利用率来看都更加符合绿色化学理念。 ①该电解槽的阳极反应式为:______________________________。此时通过阴离子交换膜的离子数_____________(填“大于”或“小于”或“等于”)通过阳离子交换膜的离子数。 ②制得的氢氧化钠溶液从出口(选填“A ”、“B ”、“C ”、“D ”)___________导出。
③若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,则电池负极的电极反应式为
_____________________________________。已知H 2的燃烧热为285.8 kJ/mol ,则该燃料电池工作产生36 g H 2O 时,理论上有__________kJ 的能量转化为电能。
5.已知向一体积为2 L 的密闭容器中加入0.1 mol 碘单质和足量的钨,当温度为943 K 时,存在
()()()22W s I g WI g + ΔH <0,反应达到平衡时碘单质的转化率为20% 。
(1)求943 K 时此反应的平衡常数K =__________。
(2)若起始时向此密闭容器中再加入0.1 mol WI 2达到平衡,此时容器中I 2(g)与WI 2(g)的体积比: __________,当同时加入等物质的量I 2(g)和WI 2(g),平衡向__________方向移动(填“正反应”、“逆反应”或“不移动”)
(3)画出反应()()
()22W s I g WI g + ΔH <0在下列条件变化时的时间-速率图。一定温度下过量的
W 反应达到平衡,到t 1时降低温度,到t 2时再加压,再到t 3时加催化剂,到t 4时加I 2
6.t ℃时,将3 mol A 和1 mol B 气体通入体积为2 L 的密闭容器中(容积不变),发生如下反应:
()()()3A g B g xC g +。2 min 时反应达到平衡状态(温度不变),剩余了0.8 mol B ,并测得C 的浓
度为0.4 mol/L ,请填写下列空白:
(1)x=__________;平衡常数K =__________。
(2)从反应开始至达到平衡状态,生成C 的平均反应速率为__________。
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A 、B 、C 都不反应)后,化学平衡(填字母) __________。
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
