燃烧学 复习重点
第三章 着火和灭火理论
一、谢苗诺夫自燃理论 1. 基本思想:
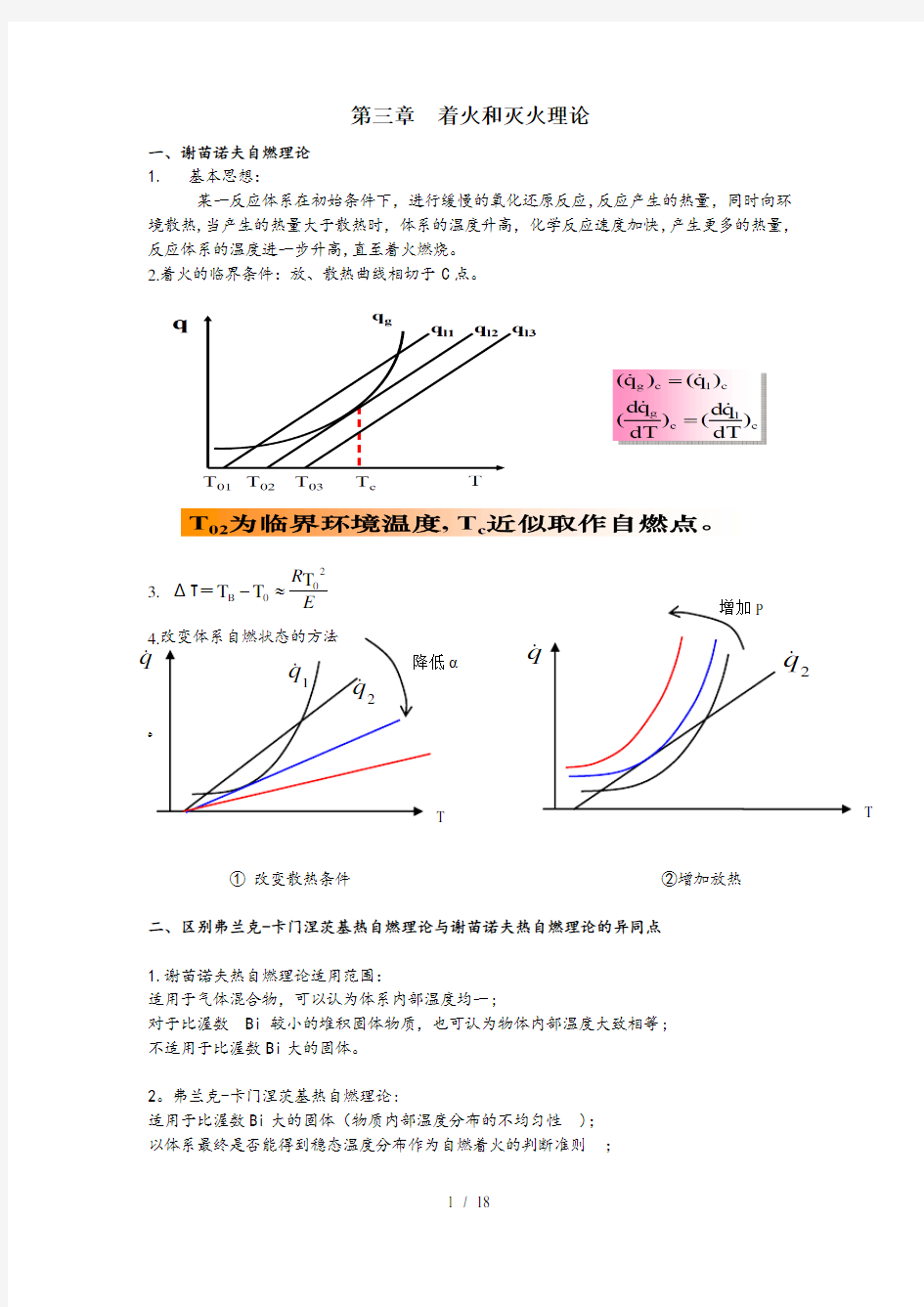
某一反应体系在初始条件下,进行缓慢的氧化还原反应,反应产生的热量,同时向环境散热,当产生的热量大于散热时,体系的温度升高,化学反应速度加快,产生更多的热量,反应体系的温度进一步升高,直至着火燃烧。 2.着火的临界条件:放、散热曲线相切于C 点。
3.?T =E
R 2
0B T T T ≈-
?
① 改变散热条件
②增加放热
二、区别弗兰克-卡门涅茨基热自燃理论与谢苗诺夫热自燃理论的异同点
1.谢苗诺夫热自燃理论适用范围:
适用于气体混合物,可以认为体系内部温度均一;
对于比渥数 Bi 较小的堆积固体物质,也可认为物体内部温度大致相等; 不适用于比渥数Bi 大的固体。
2。弗兰克-卡门涅茨基热自燃理论:
适用于比渥数Bi 大的固体(物质内部温度分布的不均匀性 ); 以体系最终是否能得到稳态温度分布作为自燃着火的判断准则 ;
T
q α
T
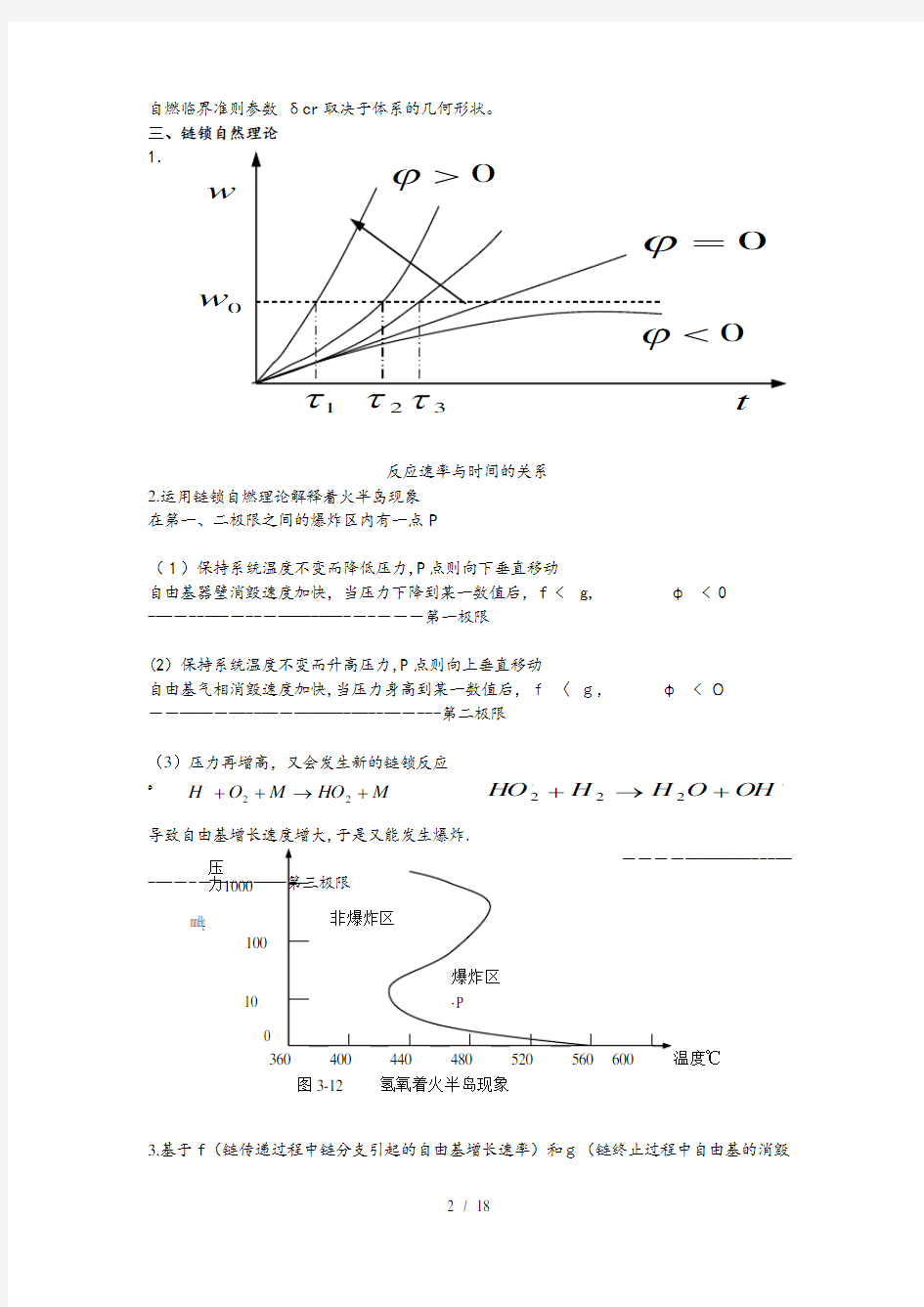
自燃临界准则参数 δcr 取决于体系的几何形状。 三、链锁自然理论 1.
反应速率与时间的关系 2.运用链锁自燃理论解释着火半岛现象 在第一、二极限之间的爆炸区内有一点P
(1)保持系统温度不变而降低压力,P 点则向下垂直移动
自由基器壁消毁速度加快,当压力下降到某一数值后,f < g, φ < 0 -—---—-----——-—-------第一极限
(2)保持系统温度不变而升高压力,P 点则向上垂直移动
自由基气相消毁速度加快,当压力身高到某一数值后,f 〈 g, φ < 0 --——-—--—-———-—--—----第二极限
(3)压力再增高,又会发生新的链锁反应
?
导致自由基增长速度增大,于是又能发生爆炸.
—
-
3.基于f (链传递过程中链分支引起的自由基增长速率)和g(链终止过程中自由基的消毁
w 0w 123M HO M O H +→++?2
2??+→+OH O H H HO 222
速率 )分析链锁自燃着火条件
a 。在低温时, f 较小(受温度影响较大)
,相比而言,g 显得较大,故: 这表明,在 的情况下,自由基数目不能积累,反应速率不
会自动加速,反应速率随着时间的增加只能趋势某一微小的定值,因此,f〈g
系统不会着火。 b 。随着系统温度升高,f 增大,g 不变,在 时
因此,随着时间的增加,反应速率呈指数级加速,系统会发生着火 C .在?时 , 反应速率随时间增加呈线性加速,系统处于临界状态
四、强迫着火
1。最小点火能:能在给定的可燃混气中引起着火的最小火花能 2。电极熄火距离
定义:不能引燃混合气的电极间的最大距离成为电极熄火距离。 五.灭火措施(注意两者差别) 1。基于热理论的灭火措施
(1)降低系统氧或者可燃气浓度; (2)降低系统环境温度;
(3)改善系统的散热条件,使系统的热量更容易散发出去。 2.灭火措施总结
1。 降低系统着火温度。 2. 断绝可燃物.
3。 稀释空气中的氧浓度。 4。 抑制着火区内的链锁反应.
第四章 :可燃气体的燃烧
1.解释缓燃与爆震(预混气两种火焰传播形式)火焰传播机理
缓燃(正常火焰传播)火焰传播机理:依靠导热和分子扩散使未燃混合气温度升高,并进入反应区而引起化学反应,导致火焰传播
爆震(爆轰)火焰传播机理:传播不是通过传热、传质发生的,它是依靠激波的压缩作用使未燃混合气的温度不断升高而引起化学反应的,从而使燃烧波不断向未燃混合气中推进. 2.缓燃与爆震的特点
在爆震区经过燃烧后气体压力增加、燃烧后气体密度增加、燃烧以超音速传播(M∞>1)
在缓燃区经过燃烧后气体压力减小或接近不变、气体密度减小、燃烧以亚音速进行(M ∞<1) 3.火焰前沿的定义
火焰前沿(前锋、波前):一层一层的混合气依次着火,薄薄的化学反应区开始由点燃的地方向未燃混合气传播,它使已燃区与未燃区之间形成了明显的分界线,称这层薄薄的化学反应发光区为火焰前沿(锋面)。 4.火焰位移速度及火焰法向传播速度
火焰位移速度是火焰前沿在未燃混合气中相对于静止坐标系的前进速度,其前沿的法向指向未燃气体。
火焰法向传播速度是指火焰相对于无穷远处的未燃混合气在其法线方向
f g ?=-<0f g ?=- >0f g ?=->f g =0?= 上的速度。 5。可燃混气爆炸压力的计算 爆炸前:n1、T1、P1、V 1, 爆炸后:n2、T2、P 2、V2(=V1) 则有:P1V1=n 1RT1,P2V1=n2RT2 两式相除得: 以乙醚为例: C4H10O +6 (O 2+3。76N2) = 4CO2 + 5H 2O + 6×3。76N2 n1 = 29。6 n 2 = 31.6 爆炸时的升压速度 P-瞬时压力,Pa ;Sl-火焰传播速度,cm/s ;Kd —系数;K —系数,Cp/C v=1.4;t —时间,s 例:某容器中装有甲烷和空气预混气,体积为9L ,甲烷的体积浓度为9。5%,爆炸前初温T1=298K ,初始压力P 1=1。01325×105 Pa ,爆炸时温度为T 2=2300K ,最大爆炸压力P2=8。0756×105 Pa ,甲烷火焰传播速度为Sl=34.7 cm/s,热容比K=1.4, 求甲烷爆炸时平均升压速度。 解:甲烷燃烧反应式为: CH 4+2O 2+7.5N2 CO2+2H2O +7.5N2 n1=n2=10.5 (kmol) 由?得: 9MPa 9.0)25273(6.29)2500273(6.311.011221 2=+?+??==T n T n P P 11 331P V t S P K P l d +=K T n T n T n T n K d ????? ??-????? ??=13411222 1122π(Pa/s) 12t P P v -=86.23454.112985.1023005.102985.1023005.1014.3341342 112221122=???? ??-?????? ??????=???? ? ??-????? ??=K T n T n T n T n K d π11 331P V t S P K P l d +=)(086.07.341001325.186.23459000)1001325.1100756.8(11)1(3355 53 3s S P K V P P t l d ≈?????-?= ??-= 平均升压速度为 第四章 爆炸极限的影响因素 (1)初始温度 爆炸性混合物的初始温度越高,则爆炸极限范围越大,即爆炸下限降低而爆炸上限增高 (2)初始压力 一般压力增大,爆炸极限扩大 ;压力降低,则爆炸极限范围缩小 待压力降至某值时,其下限与上限重合,将此时的最低压力称为爆炸的临界压力。若压力降至临界压力以下,系统便成为不爆炸 (3)惰性介质即杂质 若混合物中含惰性气体的百分数增加,爆炸极限的范围缩小,惰性气体的浓度提高到某一数值,可使混合物不爆炸 (4)容器 容器管子直径越小、爆炸极限范围越小。 (5)点火能源 火花的能量、热表面的面积、火源与混合物的接触时间等,对爆炸极限均有影响 7.莱-夏特尔公式的证明与应用 莱-夏特尔公式的证明如下: 指导思想:将可燃混合气体中的各种可燃气与空气组成一组,其组成符合爆炸下限时的比例,可燃混气与空气组成的总的混合气体为各组之和。 4.设各种可燃气体积为:V1,V2,V3,……,Vi.则总的可燃气体积为V=V1+V2+V3+……+Vi 2)设各组可燃气—空气在爆炸下限时的体积为: V ’1,V ’2,V'3,……,V ’I 则总的可燃混气—空气体积为 V ′= V ’1+V ’2+V’3,……,V ’I 3)设各种可燃气爆炸下限为:x 1下,x2下,x3下,…x i下.则 4) (4)设总的可燃混气的爆炸下限为x 下。则有 ) /(12.8286.01001325.1100756.855s Pa v =?-?=100V'V ?i i i x = 下100V'V 3 3 3?= 下x 100V'V 1 1 1?=下x 100V 'V 2 2 2?= 下x 100x V V'i i i ?下 = 100x V V'111?下=100x V V'22 2?下 = 100x V V'33 3?下 = %100 /100/100/100/100332211 ?+?+?+?+?=下下下下i i x V V x V V x V V x V V 100%' V x V ?下= (5)设 证毕 例 题 1.可燃气体含C2H6 40%,C4H10 60%,取1m3该燃气与19m 3空气混合。该混合气体遇明火是否有爆炸危险?(C2H6和C 4H10在空气中的爆炸上限分别为1 2.5%、8。5%,下限为3。0%、1.6%) 五、含有惰性气体的可燃混气爆炸极限的计算方法 如果可燃混气中含有惰性气体,如N2、CO 2等,计算其爆炸极限时,仍然利用莱—夏特尔公式,但需将每种惰性气体与一种可燃气编为一组,将该组气体看成一种可燃气体成分。 比如:H 2+N2, C O+C O2, CH4 该组在混合气体中的体积百分含量为该组中惰性气体和可燃气体体积百分含量之和. 而该组气体的爆炸极限可先列出该组惰性气体与可燃气的组合比值,再从图中查出该组气体 的爆炸极限,然后代入莱—夏特尔公式进行计算. %x P x P x P x P 100i i 332211下下下下下 =+?+++x 100V V ?i i P =100V V 11 ?=P 100V V 2 2?=P 100V V 33?=P %0.2%1.6 60340100=+ =下x %9.7%8.56012.540100=+=上 x 混合气中可燃气浓度:1/(1+19)=5% 2.0% < 5% < 9.7% 故,该混合气体遇火爆炸。 解: 乙烷:P1=40% 丁烷:P2=60% 图4-25 氢、一氧化碳、甲烷与氮、二氧化碳混合气体在空气中的爆炸极限 例4-1 求煤气的爆炸极限。煤气组成为:H2一12.4%;CO 一27.3%;CO2一6。2%;O2一0%;CH 4一0.7%;N2一53.4%。 解: 分组:CO2+H2;N2+CO;CH4 C O2+H2: 6.2%+12。4%=18。6%; N2+CO:27。3%+53。4%=80.7%; C H4:0。77%。 从图4-25查得: H2+CO2组的爆炸极限为:6.0%~70%; CO +N2组的爆炸极限为:40%~73%。 CH4的爆炸极限为:5%~15% 8。 F -S-I 体系爆炸浓度极限图 以可燃气—氧气-氮气体系为例 5.04.122.6H CO 2 2=% % =96 .13.274.53CO N 2=% % =% =下19%0 .57 .0407.800.66.18100 ++=x % =上53.70%15 7 .030.77.80706.18100 ++= x 例题:已知乙烯在氧气中的爆炸浓度极限为3~80%,氮气惰化时的爆炸临界点为(氧气10%,氮气87%,乙烯3%). (1)请绘出乙烯-氧气-氮气体系的爆炸浓度极限图。 (2)用图解法计算乙烯在空气中的爆炸浓度极限。 (3)在1m3的混合气(乙烯20%,其余为空气)中,至少掺入多少m3的氮气后遇明火不会爆炸. (4)激波的形成过程;爆轰的发生过程、形成条件 A.激波的形成过程 同理,后面的压缩波的波速都将比前面的压缩波的传播速度快,不难想象,经过一段时间后,这些压缩波将会叠加在一起,波的能量也将迅速增大,即形成所谓的“激波" 。激波前后气体的参数(压力、温度、密度等)发生了显著的变化.B.爆轰的发生过程 C。爆轰的形成条件 1.初始正常火焰传播能形成压缩扰动 2.管子要足够长或自由空间的预混气体积要足够大 3.可燃气浓度要处于爆轰极限范围内 4.管子直径大于爆轰临界直径 10.预防可燃气爆炸的方法 ①严格控制火源; ②防止预混可燃气的产生; ③用惰性气体预防气体爆炸;④切断爆炸传播的途径。 11.湍流火焰区别于层流火焰的明显特征 火焰长度短,厚度较厚,发光区模糊,有明显噪音等 12.火焰高度随流速的变化 流速比较低时,处于层流状态,火焰高度随流速增加成正比提高,在流速比较高时,处于湍流状态,火焰高度几乎与流速无关。 例题:为什么1mol可燃气完全燃烧所需氧气摩尔数越大,扩散火焰高度越高? 答:1mol可燃气完全燃烧所需氧气摩尔数越大,则对氧气的需求就更加强烈,通过增加火焰高度以获得更充足的氧气供应。 第五章总结 1。根据液体燃料蒸发与汽化的特点,可将其燃烧形式分为 液面燃烧,灯芯燃烧,蒸发燃烧,雾化燃烧 2.蒸发热:在一定的温度和压力下,单位质量的液体完全蒸发所吸收的热量。液体蒸发过程中,高能量的分子离开液面进入空间,使剩余液体的内能越来越低,液体的温度会越来越低,欲使液体的温度保持不变,液体须从外界吸收能量。也即:要使液体处于恒温恒压下蒸发,液体须从外界吸收的能量。 液体蒸发吸热的原因:主要为了增加液体分子的动能以克服分子间引力而逃逸出液面,因此,分子间力大的液体,其蒸发热也越高;此外,蒸发热还用于气化时蒸气体积膨胀对外所做的功。 3.闪燃:这种在可燃液体上方,蒸气与空气的混合气体遇火源发生的一闪即灭的燃烧现象即称之为闪燃。 液体的闪点:在规定的实验条件下,液体表面能够产生闪燃的最低温度称为闪点。 4。同系物闪点的变化规律: (1)同系物闪点随分子量增加而升高; (2)同系物闪点随沸点的升高而升高; (3)同系物闪点随比重的增大而升高; (4)同系物闪点随蒸气压的降低而升高; (5)同系物中正构体比异构体闪点高。 5.自燃着火与自然点 自燃着火:没有火源作用,而靠外界加热而引起的着火现象 同系物的自燃点有以下规律: (1)同系物自燃点随分子量增加而减少。 (2)同系物中正构体比异构体自燃点低. (3)饱和烃比相应的不饱和烃的自燃点高。 6。闪点计算(联系后面的温度极限) (1)根据波道查的烃类闪点公式计算 对于烃类可燃液体,其闪点服从波道查公式: 其中:t f为闪点,tb 为沸点。 (2)根据道尔顿公式计算 根据爆炸极限的经验公式,当液面上方的总压为 P 时,可燃液体的闪点所对应的可燃液体的蒸气压 Pf 为: 0.69473.7 f b t t =-1 4.76(1) f P P N = +-
