晶体类型的判断与比较,怎样比较熔点的高低

晶体类型的判断与比较,晶体结构的计算, 怎样比较熔点的高低, 8晶体类型的判断与比较
1、判断晶体类型的方法
(1)依据物质的分类判断
金属氧化物(如K
2O、Na
2
O
2
等),强碱(如NaCl、KOH等)和绝大多数的盐类是离子晶体。
大多数非金属单质(除金刚石、石墨、晶体硅、晶体硼外)、气态氢化物、非金属氧化物
(除SiO
2
外)、酸、绝大多数有机物(除有机盐外)是分子晶体。常见的原子晶体单质有金刚石、石墨、晶体硅、晶体硼等;常见的原子晶体化合物有碳化硅、二氧化硅等。金属单质(除汞外)与合金都是金属晶体。
(2)依据物质的性质判断
离子晶体的熔点较高,常在数百至1000余度;原子晶体熔点高,常在1000度至几千度;分子晶体熔点低,常在数百度以下至很低温度;金属晶体多数熔点高,但也有相当低的。离子晶体水溶液及熔化时能导电,晶体不导电;原子晶体一般为非导体,但石墨等导电;分子晶体为非导体,而分子晶体中的电解质(主要是酸和非金属氢化物)溶于水,使分子内的化学键断裂形成自由移动的离子也能导电,但熔化不导电,金属晶体是良导体。
2、晶体中的几个不一定
(1)离子晶体除含离子键外不一定不含其他化学键。如氨盐中除含离子键,还含极性键
和配位键;Na
2O
2
中除含离子键还含非极性键。
(2)离子晶体不一定肯定含金属阳离子,如NH
4Cl中含的阳离子是NH
4
+(凡是氨盐、肯定
同时含离子键、极性键和配位键)。
(3)离子晶体的熔点不一定肯定低于原子晶体,如MgO的熔点高于SiO
2
。
(4)含有阳离子的晶体不一定是离子晶体,如金属晶体中就含有金属阳离子。
(5)金属和非金属形成的晶体不一定都是离子晶体,如AlCl
3
就是含共价键的分子晶体(6)具有金属光泽且能导电的单质不一定就是金属,如石墨具有金属光泽且能导电,却是非金属。
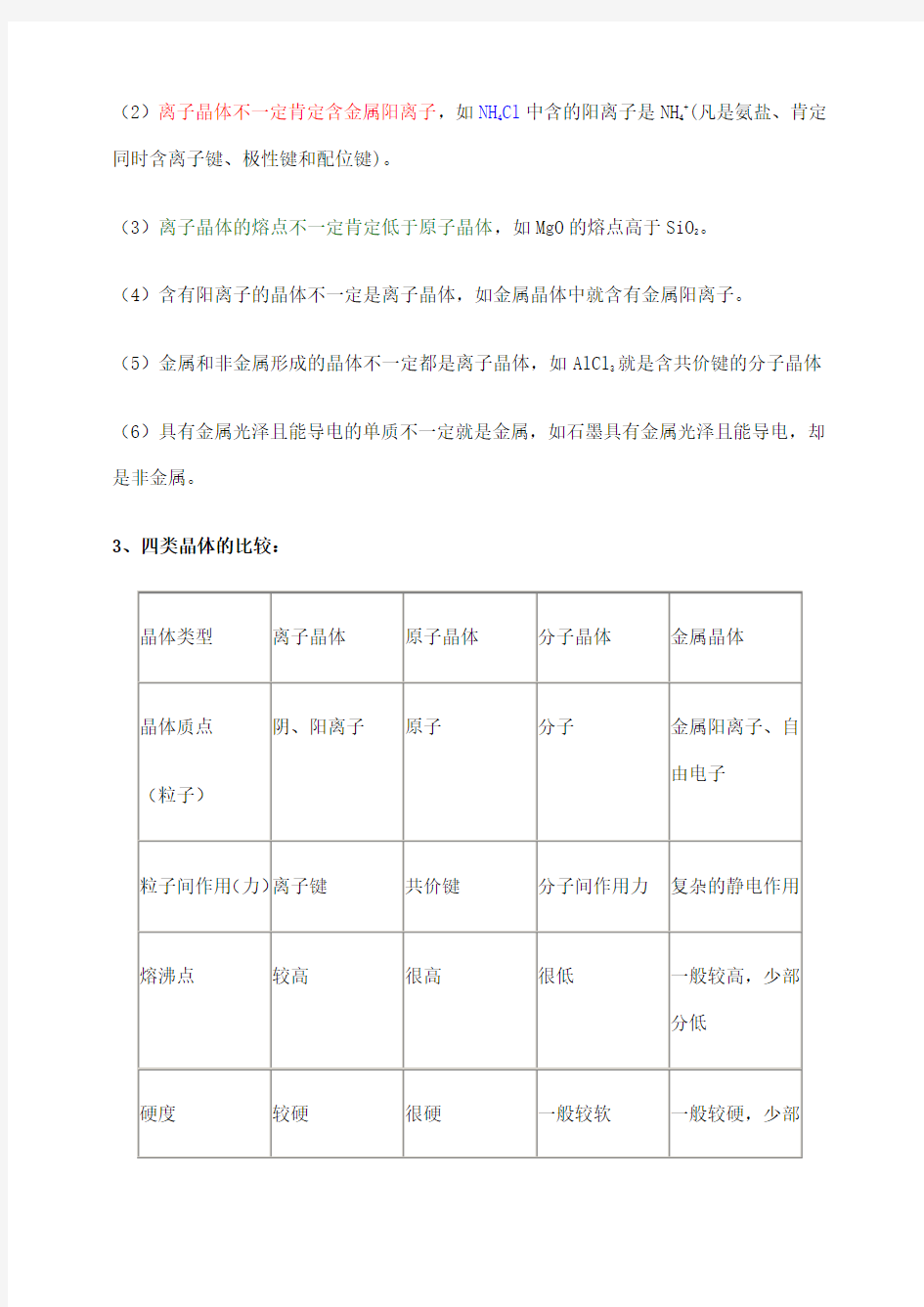
3、四类晶体的比较:
9怎样比较熔点的高低
1)先看晶体的类型。
不同晶体类型的物质其熔点的一般规律为:原子晶体>离子晶体>分子晶体;但是要注意金属晶体的熔、沸点有的很高,如钨、铂等,有的则很低,如汞、铯等。
2)同一晶体类型的物质,需比较晶体内部结构粒子间作用力,作用力越大,熔沸点越高。原子晶体:要比较共价键的强弱,一般地说,原子半径越小,形成共价键的键长越短,键能越大,其晶体熔沸点越高。如熔点:金刚石>碳化硅>晶体硅。
离子晶体:要比较离子键的强弱,一般地说,阴、阳离子的电荷数越大,离子半径越小,
则离子间作用就越强,其离子晶体熔沸点越高。如熔点:MgO>MgCl
2
>NaCl>KCl。
分子晶体:组成结构相似的物质,相对分子质量越大,熔沸点越高,但若分子中存在氢
键,则存在氢键的熔点较高。如熔沸点:O
2>N
2
, HI>HBr>HCl。组成结构不相似的物质,
分子的极性越大,其熔沸点就越高,如熔沸点:CO>N
2
。
金属晶体:要比较离子的电荷数和离子的半径,离子的电荷数越多,半径越小,其金属键就越强,金属熔沸点越高,如熔点:Al>Mg>Na。
由上述可知,同类晶体熔沸点比较思路为:
先看其为何种晶体,
若为原子晶体→共价键键能→键长→原子半径
若为分子晶体→分子间作用力→相对分子质量
若为离子晶体→离子键强弱→离子电荷、离子半径
(3)常温常压下状态:
①熔点:固体物质>液态物质
②沸点:液态物质>气态物质
