Primer 5 设计PCR引物的步骤

Primer 5 设计引物打开软件
复制基因序列
粘贴
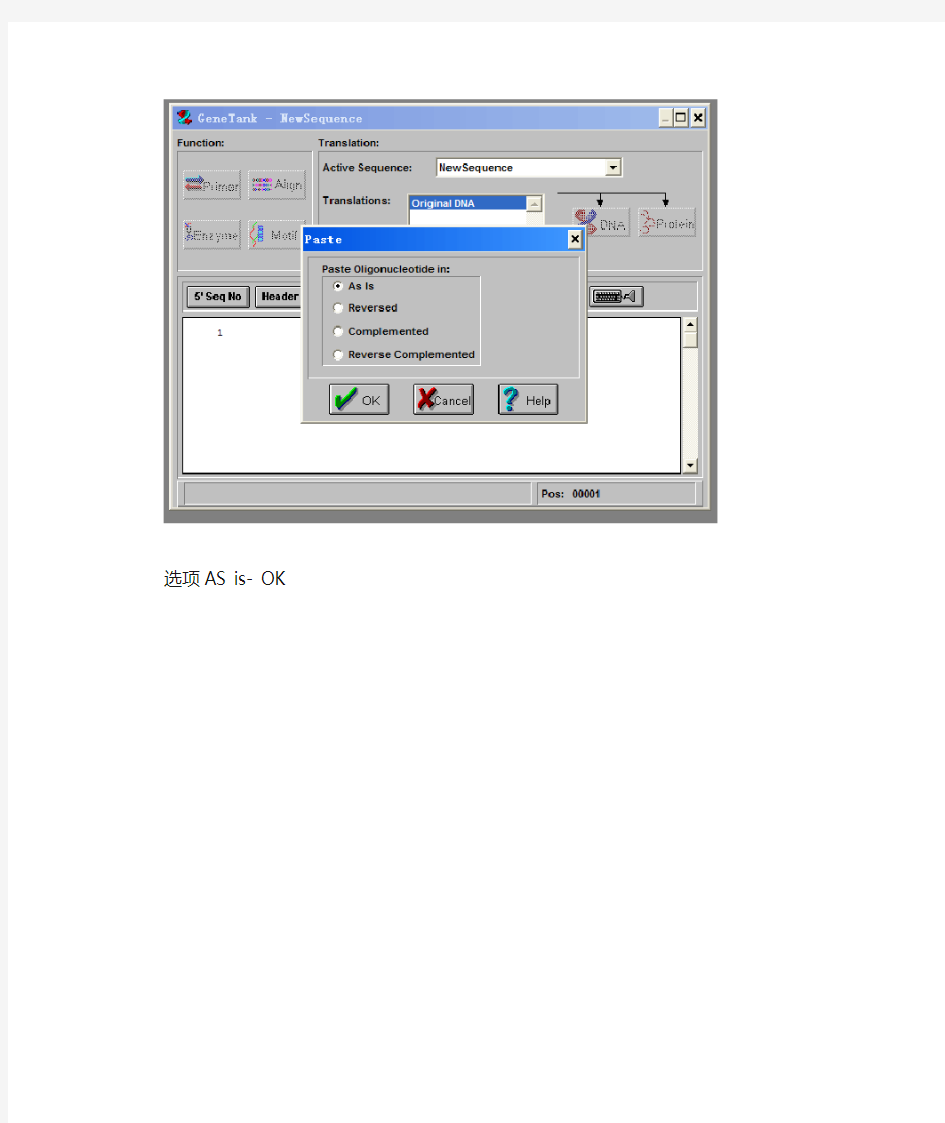
选项AS is- OK
点击primer 按钮,弹出菜单后点击search按钮
选择PCR primer,Pairs 参数,并选择所需PCR产物长度,OK
会弹出搜索结果菜单,点击OK
在搜索出的结果列表里选择TM合适、GC含量高、无各种BUG的引物,点击edit primer,将所得引物复制
而后点击S/A按钮,并继续点击edit primer,复制反向引物,引物设计达成。
引物设计基本方法
Primer 5.0搜索引物: 1.Primer Length我常设置在18-30bp,短了特异性不好,长了没有必要。当然有特殊要求的除外,如加个酶切位点什么的。 2.PCR Product size最好是100-500bp之间,小于100bp的PCR产物琼脂糖凝胶电泳出来,条带很模糊,不好看。至于上限倒也不必要求苛刻。 3.Search parameters还是选Manual吧,Search stringency应选High,GC含量一般是40-60%。其它参数默认就可以了。 4.搜索出来的引物,按Rating排序,逐个送Oligo软件里评估。当然,搜索出的引物,其扩增产物很短,你可以不选择它,或是引物3端≥2个A或T,或引物内部连续的G或C太多,或引物3端≥2个G或C,这样的引物应作为次选,没得选了就选它。对于这样的引物,如果其它各项指标还可以,我喜欢在引物末端去掉一个不满意的或加上一个碱基,看看引物的评估参数有没有变好点。 Oligo 6.0评估引物: 1.在analyze里,Duplex Formation不管是上游引物、下游引物还是上下游引物之间,The most stable 3’-Dimer绝对值应小于4.5kcal/mol, The most stable Dimer overall绝对值一般应小于多少kcal/mol跟PCR退火温度有关,我几次实验感觉在PCR退火温度在65°的时候,The most stable Dimer ove rall 6.7kcal/mol没有问题。 2.Hairpin Formation根据黄金法则 3.False priming sites: Primer的priming efficiency应该是错配地方的4倍左右,更多当然更好。 4.在PCR栏,个人感觉其所显示的optimal annealing temperature数值值得参考。在PCR摸索条件的时候,退火温度为其数值加减2的范围就可以了。 5.Internal stability很重要:我们希望引物的内部稳定性是中间高、两边低的弧形,最起码保证3端不要过于稳定。下图1引物3端过于稳定,很容易导致不适当扩增。△G参照黄金法则,这其实很好理解:把一滴水放到大海里,这滴水就会不停的扩散分布,扩散的越厉害越稳定,所以△G绝对值越大结构越稳定。 最后说一句,敢于尝试就会成功。 第二贴 --科室工作很多,小医生了,没有办法,所以肯怕不能满足很多战友的要求(qq聊或帮助设计),在此表示抱歉。就楼上的问题我试着回答一下,不一定正确,供参考吧。 --1、两个评价系统不一样,个人感觉oligo评价引物好点,primer出来的引物,我一般按效率排序,再结合退火温度和引物长度,选择引物到oligo测试。这是初步的选择,其实引物到了oligo里,退火温度也不一样。 --2、3端的二聚体应该避免,这个要看你的退火温度决定,一个50°的退火温度肯定和65°对二聚体的影响不一样了,一般来讲尽量控制在-4.5kcal/mol以下(个人观点,很多东西真得还是需要自己摸索)。 --3、个人感觉3端有A无A影响不大,3端有T的没有经验。有T是不是一定不行,个人感觉不见得。软件是评估,法则也不是没有例外,不是1+1=2那么确定。 --4、错配和二聚体谁轻谁重,个人觉得“到致命的程度”谁都重要,我也说不好。我设计的时候,尽量两个都不得罪。 --5、GC含量并非不重要,它直接影响引物各端稳定性,3端来两个G或C,稳定性就上去了,粘在模板上很牢。所以我设计的时候,尽量避免这样的情况出现。 谈一下我学这个引物设计的过程吧:
引物设计原则(必看)
mi引物设计原则 1. 引物的长度一般为15-30 bp,常用的是18-27 bp,但不应大于38,因为过长会导致其延伸温度大于74℃,不适于Taq DNA聚合酶进行反应。 2. 引物序列在模板内应当没有相似性较高,尤其是3’端相似性较高的序列,否则容易导致错配。引物3’端出现3个以上的连续碱基,如GGG或CCC,也会使错误引发机率增加。 3. 引物3’端的末位碱基对Taq酶的DNA合成效率有较大的影响。不同的末位碱基在错配位置导致不同的扩增效率,末位碱基为A的错配效率明显高于其他3个碱基,因此应当避免在引物的3’端使用碱基A。另外,引物二聚体或发夹结构也可能导致PCR反应失败。5’端序列对PCR影响不太大,因此常用来引进修饰位点或标记物。 4. 引物序列的GC含量一般为40-60%,过高或过低都不利于引发反应。上下游引物的GC含量不能相差太大。 5. 引物所对应模板位置序列的Tm值在72℃左右可使复性条件最佳。Tm值的计算有多种方法,如按公式Tm=4(G+C)+2(A+T),在Oligo软件中使用的是最邻近法(the nearest neighbor method)。 6. ΔG值是指DNA双链形成所需的自由能,该值反映了双链结构内部碱基对的相对稳定性。应当选用3’端ΔG值较低(绝对值不超过9),而5’端和中间ΔG 值相对较高的引物。引物的3’端的ΔG值过高,容易在错配位点形成双链结构并引发DNA聚合反应。 7. 引物二聚体及发夹结构的能值过高(超过4.5kcal/mol)易导致产生引物二聚体带,并且降低引物有效浓度而使PCR反应不能正常进行。 8. 对引物的修饰一般是在5’端增加酶切位点,应根据下一步实验中要插入PCR 产物的载体的相应序列而确定。 引物序列应该都是写成5-3方向的, Tm之间的差异最好控制在1度之内, 另外我觉得扩增长度大一些比较好,500bp左右。 要设计引物首先要找到DNA序列的保守区。同时应预测将要扩增的片段单链是否形成二级结构。如这个区域单链能形成二级结构,就要避开它。如这一段不能
引物设计原则
1. 引物的长度一般为15-30 bp,常用的是18-27 bp,但不应大于38,因为过长会导致其延伸温度大于74℃,不适于Taq DNA聚合酶进行反应。 2. 引物序列在模板内应当没有相似性较高,尤其是3’端相似性较高的序列,否则容易导致错配。引物3’端出现3个以上的连续碱基,如GGG或CCC,也会使错误引发机率增加。 3. 引物3’端的末位碱基对Taq酶的DNA合成效率有较大的影响。不同的末位碱基在错配位置导致不同的扩增效率,末位碱基为A的错配效率明显高于其他3个碱基,因此应当避免在引物的3’端使用碱基A。另外,引物二聚体或发夹结构也可能导致PCR反应失败。5’端序列对PCR影响不太大,因此常用来引进修饰位点或标记物。 4. 引物序列的GC含量一般为40-60%,过高或过低都不利于引发反应。上下游引物的GC含量不能相差太大。 5. 引物所对应模板位置序列的Tm值在72℃左右可使复性条件最佳。Tm值的计算有多种方法,如按公式Tm=4(G+C)+2(A+T),在Oligo软件中使用的是最邻近法(the nearest neighbor method)。 6. ΔG值是指DNA双链形成所需的自由能,该值反映了双链结构内部碱基对的相对稳定性。应当选用3’端ΔG值较低(绝对值不超过9),而5’端和中间ΔG值相对较高的引物。引物的3’端的ΔG值过高,容易在错配位点形成双链结构并引发DNA聚合反应。 7. 引物二聚体及发夹结构的能值过高(超过mol)易导致产生引物二聚体带,并且降低引物有效浓度而使PCR反应不能正常进行。 8. 对引物的修饰一般是在5’端增加酶切位点,应根据下一步实验中要插入PCR 产物的载体的相应序列而确定。 引物序列应该都是写成5-3方向的, Tm之间的差异最好控制在1度之内, 另外我觉得扩增长度大一些比较好,500bp左右。 要设计引物首先要找到DNA序列的保守区。同时应预测将要扩增的片段单链是否形成二级结构。如这个区域单链能形成二级结构,就要避开它。如这一段不能形成二级结构,那就可以在这一区域设计引物。
引物设计原则(含Realtime引物)
1.引物最好在模板cDNA的保守区内设计。 DNA序列的保守区是通过物种间相似序列的比较确定的。在NCBI上搜索不同物种的同一基因,通过序列分析软件(比如DNAman)比对(Alignment),各基因相同的序列就是该基因的保守区。 2.引物长度一般在15~30碱基之间。 引物长度(primer length)常用的是18-27 bp,但不应大于38,因为过长会导致其延伸温度大于74℃,不适于Taq DNA 聚合酶进行反应。 3.引物GC含量在40%~60%之间,Tm值最好接近72℃。 GC含量(composition)过高或过低都不利于引发反应。上下游引物的GC含量不能相差太大。另外,上下游引物的Tm值(melting temperature)是寡核苷酸的解链温度,即在一定盐浓度条件下,50%寡核苷酸双链解链的温度。有效启动温度,一般高于Tm值5~10℃。若按公式Tm= 4(G+C)+2(A+T)估计引物的Tm值,则有效引物的Tm为55~80℃,其Tm 值最好接近72℃以使复性条件最佳。 4.引物3′端要避开密码子的第3位。 如扩增编码区域,引物3′端不要终止于密码子的第3位,因密码子的第3位易发生简并,会影响扩增的特异性与效率。 5.引物3′端不能选择A,最好选择T。 引物3′端错配时,不同碱基引发效率存在着很大的差异,当末位的碱基为A时,即使在错配的情况下,也能有引发链的合成,而当末位链为T时,错配的引发效率大大降低,G、C 错配的引发效率介于A、T之间,所以3′端最好选择T。 6. 碱基要随机分布。 引物序列在模板内应当没有相似性较高,尤其是3’端相似性较高的序列,否则容易导致错误引发(False priming)。降低引物与模板相似性的一种方法是,引物中四种碱基的分布最好是随机的,不要有聚嘌呤或聚嘧啶的存在。尤其3′端不应超过3个连续的G或C,因这样会使引物在GC富集序列区错误引发。 7. 引物自身及引物之间不应存在互补序列。 引物自身不应存在互补序列,否则引物自身会折叠成发夹结构(Hairpin)使引物本身复性。这种二级结构会因空间位阻而影响引物与模板的复性结合。引物自身不能有连续4个碱基的互补。 两引物之间也不应具有互补性,尤其应避免3′ 端的互补重叠以防止引物二聚体(Dimer与Cross dimer)的形成。引物之间不能有连续4个碱基的互补。 引物二聚体及发夹结构如果不可避免的话,应尽量使其△G值不要过高(应小于4.5kcal/mol)。否则易导致产生引物二聚体带,并且降低引物有效浓度而使PCR 反应不能正常进行。 8. 引物5′ 端和中间△G值应该相对较高,而3′ 端△G值较低。 △G值是指DNA 双链形成所需的自由能,它反映了双链结构内部碱基对的相对稳定性,△G 值越大,则双链越稳定。应当选用5′ 端和中间△G值相对较高,而3′ 端△G值较低(绝对值不超过9)的引物。引物3′ 端的△G 值过高,容易在错配位点形成双链结构并引发DNA 聚合反应。(不同位置的△G值可以用Oligo 6软件进行分析) 9.引物的5′端可以修饰,而3′端不可修饰。 引物的5′ 端决定着PCR产物的长度,它对扩增特异性影响不大。因此,可以被修饰而不影响扩增的特异性。引物5′ 端修饰包括:加酶切位点;标记生物素、荧光、地高辛、Eu3+等;引入蛋白质结合DNA序列;引入点突变、插入突变、缺失突变序列;引入启动子序列等。引物的延伸是从3′ 端开始的,不能进行任何修饰。3′ 端也不能有形成任何二级结构可能。 10. 扩增产物的单链不能形成二级结构。
引物设计步骤与要点
引物设计step by step 1、在NCBI上搜索到目的基因,找到该基因的mRNA,在CDS选项中,找到编码区所在位置,在下面的origin中,Copy该编码序列作为软件查询序列的候选对象。 2、用Primer Premier5搜索引物 ①打开Primer Premier5,点击File-New-DNA sequence, 出现输入序列窗口,Copy目的序列在输入框内(选择As),此窗口内,序列也可以直接翻译成蛋白。点击Primer,进入引物窗口。 ②此窗口可以链接到“引物搜索”、“引物编辑”以及“搜索结果”选项,点击Search按钮,进入引物搜索框,选择“PCR primers”,“Pairs”,设定搜索区域和引物长度和产物长度。在Search Parameters里面,可以设定相应参数。一般若无特殊需要,参数选择默认即可,但产物长度可以适当变化,因为100~200bp的产物电泳跑得较散,所以可以选择300~500bp. ③点击OK,软件即开始自动搜索引物,搜索完成后,会自动跳出结果窗口,搜索结果默认按照评分(Rating)排序,点击其中任一个搜索结果,可以在“引物窗口”中,显示出该引物的综合情况,包括上游引物和下游引物的序列和位置,引物的各种信息等。 ④对于引物的序列,可以简单查看一下,避免出现下列情况:3’不要出现连续的3个碱基相连的情况,比如GGG或CCC,否则容易引起错配。此窗口中需要着重查看的包括:Tm 应该在55~70度之间,GC%应该在45%~55%间,上游引物和下游引物的Tm值最好不要相差太多,大概在2度以下较好。该窗口的最下面列出了两条引物的二级结构信息,包括,发卡,二聚体,引物间交叉二聚体和错误引发位置。若按钮显示为红色,表示存在该二级结构,点击该红色按钮,即可看到相应二级结构位置图示。最理想的引物,应该都不存在这些二级结构,即这几个按钮都显示为“None”为好。但有时很难找到各个条件都满足的引物,所以要求可以适当放宽,比如引物存在错配的话,可以就具体情况考察该错配的效率如何,是否会明显影响产物。对于引物具体详细的评价需要借助于Oligo来完成,Oligo自身虽然带有引物搜索功能,但其搜索出的引物质量感觉不如Primer5. ⑤在Primer5窗口中,若觉得某一对引物合适,可以在搜索结果窗口中,点击该引物,然后在菜单栏,选择File-Print-Current pair,使用PDF虚拟打印机,即可转换为Pdf文档,里面有该引物的详细信息。 3、用Oligo验证评估引物 ①在Oligo软件界面,File菜单下,选择Open,定位到目的cDNA序列(在primer中,该序列已经被保存为Seq文件),会跳出来两个窗口,分别为Internal Stability(Delta G)窗口和Tm窗口。在Tm窗口中,点击最左下角的按钮,会出来引物定位对话框,输入候选的上游引物序列位置(Primer5已经给出)即可,而引物长度可以通过点击Change-Current oligo length来改变。定位后,点击Tm窗口的Upper按钮,确定上游引物,同样方法定位下游引物位置,点击Lower按钮,确定下游引物。引物确定后,即可以充分利用Analyze 菜单中各种强大的引物分析功能了。
PCR引物设计原则
PCR引物设计原则 引物(Primer)是人工合成的两段寡核苷酸序列。 1、引物的长度一般为15-30bp,常用的是18-27bp,但不应大于38,因为过长会导致其延伸温度大于74℃,不适于Taq DNA聚合酶进行反应。 2、G十C含量:应在40%-60%之间,PCR扩增中的复性温度一般是较低Tm 值引物的Tm值减去5-10度。引物长度小于20时,其Tm恒等于4(G十C)十2(A十T)。 3、碱基分布的随机性:应避免连续出现4个以上的单一碱基。尤其是不应在其3’端出现超过3个的连续G或C,否则会使引物在G十C富集序列区错误引发. 4、引物自身:不能含有自身互补序列,否则会形成发夹样二级结构. 5、引物之间:两个引物之间不应有多于4个的互补或同源碱基,不然会形成引物二聚体,尤应避免3’端的互补重叠。引物3’端最好选T,错配的几率与A 相比大大的降低了。G、C之间错配的概率小于A、T. 6、引物的5’端可以修饰,而3’端不能进行修饰。5’端的修饰包括:加酶切位点,标记生物素,荧光,地高辛、Eu3+等,引入蛋白质结合的DNA序列,引入点突变,插入突变、缺失突变序列、引入启动子序列。因为引物的延伸是从3’端开始的,因而3’端不能进行任何修饰,另外3’端也不能有形成任何二
级结构的可能。 如何设计引物 不同的核苷酸序列表达的氨基酸氨基酸序列是相同的,所以氨基酸序列才是真正保守的。 引物最好在模板cDNA的保守区域内设计(DNA的保守区是通过物种间相似序列的比较确定的,在NCBI上搜索不同物种的同一基因,通过序列分析软件比对(Alignment),各基因相同的序列就是该基因的保守区)。 PCR引物设计 PCR反应中有两条引物,即5′端引物和3′引物。设计引物时以一条DNA单链为基准(常以信息链为基准),5′端引物与位于待扩增片段5′端上的一小段DNA序列相同;3′端引物与位于待扩增片段3′端的一小段DNA序列互补。 引物设计软件 Primer Premier5.0 (自动搜索)* vOligo6 (引物评价) vVector NTI Suit vDNAsis vOmiga vDNAstar vPrimer3 (在线服务)
引物设计的原理与方法
引物设计的原理与方法 This model paper was revised by the Standardization Office on December 10, 2020
PCR引物设计的原理及方法 阎振鑫S111666(四川大学生命科学学院细胞生物学成都 610014) 摘要:自20世纪后期发展了PCR技术以来,PCR已经改变了整个生物学研究的进程。而PCR反应的第一步就是设计引物,引物设计的好坏直接关系到PCR的成败。PCR引物设计有许多的原则必须要遵循:引物与引物之间避免形成稳定的二聚体或发夹结构,引物与模板的序列要紧密互补。引物不能在模板的非目的位点引发DNA聚合反应等。另外,引物的设计方法也越来越多,出现了许多专门的设计软件和网站,如:PrimerPremier5.0等。 关键词:PCR 引物原理方法 NCBI PrimerPremier5.0 PCR primer design principle and method YanZhenxin (sichuan Univercity, Life science college cell biology chengdu 610014 ) Abstract: When PCR technology was find, PCR has changed all of the program in research of biology. The design of primer is the frist step of PCR. It is relation to the fate of PCR. There are some principals must be obey: dipolymer and hairpin structure must be avoid between different primers. The DNA polymerization reaction should not be triggered at the wrong site. Therefore, there are more and more methods of design primer, include the professional softwares and professional web site. Key word: PCR primer principle NCBI PrimerPremier5.0 聚合酶链式反应(Polymerase chain reaction。PCR)是20世纪后期发展起来的 一种体外扩增特异DNA片断的技术。具有快速、简便及高度敏感等优点,能极大地缩短目的基因扩增时间[1]。因此,其一直是生物学者们致力于构建cDNA文库、基因克隆以及表达调控研究的必要前提和基础[2]。PCR的第一步就是引物设计。引物设计的好坏,直接影响了PCR的结果,因此这一步很关键。成功的PCR反应既要高效,又要特异性扩增产物,因此对引物设计提出了较高的要求。引物设计需要注意的地方很多,在大多数情况下,我们都是在知道已知模板序列时进行PCR扩增的。在某些情况比如构建文库的时候也会在不知道模板序列的情况下进行设计。这个时候随机核苷酸序列
引物设计原则及酶切位点选择和设计
引物设计原则及酶切位点选择和设计 [整理]:最初的时候,由于害怕设计酶切位点最后且不开,所以经常采用最通用的方法,用T载体克隆解决问题,但后来发现她也有问题,就是浓度提不上去,你需要体大量的载体来酶切,所以感到还是直接扩增好一点。但这就需要你仔细设计引物。连入质粒中的重要目的就是进行酶切和连接,当然首先就是在想要合成或者是进行PCR扩增出靶基因的时候在核酸的两端接入酶切位点,酶切位点是与你的质粒的特点相关的,可以在质粒的图谱说明书上找取相应的位点,进行设计。 (一)设计引物前应做的准备工作: 准备载体图谱,大致准备把片断插在那个部分 对片断进行酶切分析,确定一下那些酶切位点不能用 准备一本所买公司的酶的商品目录,便于查酶的各种数据及两种酶是否可以配用 (二)设计引物所要考虑的问题 两个位点应是载体上的,,所连接片断上没有这两个位点,且距离不能太近,往往导致两个酶都切不好。因此,紧挨在一起,只能切一个,除非恰好是与上面两个酶在一起的酶切位点。我看promega的说明书上说,最好隔四个。还有一种情况是:不能有碱基的交叉,比如AGATCTTAAG,这样的位点比较难切。 两个酶切点最好不要是同尾酶(切下来的残基不要互补),否则效果相当于单酶切。 最好使用酶切效率高的。 最好使用双酶切有共同buffer的酶。 最好使用较常用的酶(如hind3,bamh1,ecor1等),最好使用自己实验室有的酶,这样可以省钱。 Tm的计算,关于Tm的问题,很多的战友都有疑惑。其实园子里有很多的解释了。 Tm叫溶解温度(melting temperature, Tm),即是DNA双链溶解所需的温度。大家可以理解,这个温度是由互补的DNA区域决定的,而不互补的区域对DNA的溶解是没有作用的。因此,对于引物的Tm,只有和模板互补的区域对Tm才有贡献。计算Tm时,只计算互补的区域(除非你的酶切位点也与模板互补)。不少战友设计的引物都Tm过低,是因为他们误把保护碱基和酶切位点都计算到Tm里了,最后的结果是导致了PCR反应的诸多困难。所以,设计引物的时候,先不管5'端的修饰序列,把互补区的Tm控制在55度以上(我喜欢控制在58以上,具体根据PCR的具体情况,对于困难的PCR,需要适当提高Tm),再加上酶切位点和保护碱基,这样的引物通常都是可用的,即使有小的问题,也可以挽回。Tm温度高的引物就比较容易克服3‘发卡、二聚体及3'非特异结合等问题。简单的计算公式可以用2+4的公式。若你计算的Tm值达到了快90 ,不包括酶切位点。引物公司给你发的单子是包括酶切位点的。自己可以再估计一下。如你设计了带酶切位点的引物,总长分别为29、33个碱基,去掉酶切位点和保护碱基,分别为17、21个碱基。引物公司给的单子是70多度,实际用的只有50度,用55度扩的结果也差不多。 其它关于Tm值的计算,有用PP5.0进行评价的,需要考虑的参数包括:base number、GC%、Tm、hairpin、dimer、false priming、cross dimer。退一般退火温度为Tm-5度,退火温度的计算可以不把加入的酶切位点及保护碱基考虑进去,如上所言,PCR几个循环后,引物外侧的序列已经参入了扩增片断中,所以你可以在预变性后多加几步,温度比你Tm值低些(这样可能会增加非特异性),Tm值是你包括酶切位点及保护碱基的Primer计算出来的。1.一般在5'端加保护碱基,如果你扩增后把目的条带做胶回收转入T-VECTOR或者其它的载体的话,酶切时可以不需加保护碱基2.有人的经验加入酶切位点的引物可以和未加入时使用相同的退火温度,结果也还是令人满意。
PCR引物设计原理及原则
PCR引物设计原理及原则 PCR引物设计原理 PCR引物设计的目的是为了找到一对合适的核苷酸片段,使其能有效地扩增模板DNA序列。因此,引物的优劣直接关系到PCR的特异性与成功与否。 要设计引物首先要找到DNA序列的保守区。同时应预测将要扩增的片段单链是否形成二级结构。如这个区域单链能形成二级结构,就要避开它。如这一段不能形成二级结构,那就可以在这一区域设计引物。 现在可以在这一保守区域里设计一对引物。一般引物长度为15~30碱基,扩增片段长度为100~600碱基对。 让我们先看看P1引物。一般引物序列中G+C含量一般为40%~60%。而且四种碱基的分布最好随机。不要有聚嘌呤或聚嘧啶存在。否则P1引物设计的就不合理。应重新寻找区域设计引物。 同时引物之间也不能有互补性,一般一对引物间不应多于4个连续碱基的互补。 引物确定以后,可以对引物进行必要的修饰,例如可以在引物的5′端加酶切位点序列;标记生物素、荧光素、地高辛等,这对扩增的特异性影响不大。但3′端绝对不能进行任何修饰,因为引物的延伸是从3′端开始的。这里还需提醒的是3′端不要终止于密码子的第3位,因为密码子第3位易发生简并,会影响扩增的特异性与效率。 PCR引物的设计原则: ①引物应用核酸系列保守区内设计并具有特异性。 ②产物不能形成二级结构。 ③引物长度一般在15~30碱基之间。 ④G+C含量在40%~60%之间。 ⑤碱基要随机分布。 ⑥引物自身不能有连续4个碱基的互补。 ⑦引物之间不能有连续4个碱基的互补。 ⑧引物5′端可以修饰。 ⑨引物3′端不可修饰。 ⑩引物3′端要避开密码子的第3位。 PCR引物设计的目的是找到一对合适的核苷酸片段,使其能有效地扩增模板DNA序列。如前述,引物的优劣直接关系到PCR的特异性与成功与否。对引物的设计不可能有一种包罗万象的规则确保PCR的成功,但遵循某些原则,则有助于引物的设计。 1.引物的特异性 引物与非特异扩增序列的同源性不要超过70%或有连续8个互补碱基同源。 2.避开产物的二级结构区 某些引物无效的主要原因是引物重复区DNA二级结构的影响,选择扩增片段时最好避开二级结构区域。用有关计算机软件可以预测估计mRNA的稳定二级结构,有助于选择模板。实验表明,待扩区域自由能(△G°)小于58.6lkJ/mol时,扩增往往不能成功。若不能避开这一区域时,用7-deaza-2′-脱氧GTP取代dGTP对扩增的成功是有帮助的。 3.长度 寡核苷酸引物长度为15~30bp,一般为20~27mer。引物的有效长度:Ln=2(G+C)+(A+T+,Ln值不能大于38,因为>38时,最适延伸温度会超过Taq DNA聚合酶的最适温度(74℃),不能保证产物的特异性。 4.G+C含量
引物设计原则必看
mi引物设计原则 1、引物的长度一般为15-30 bp,常用的就是18-27 bp,但不应大于38,因为过长会导致其延伸温度大于74℃,不适于Taq DNA聚合酶进行反应。 2、引物序列在模板内应当没有相似性较高,尤其就是3’端相似性较高的序列,否则容易导致错配。引物3’端出现3个以上的连续碱基,如GGG或CCC,也会使错误引发机率增加。 3、引物3’端的末位碱基对Taq酶的DNA合成效率有较大的影响。不同的末位碱基在错配位置导致不同的扩增效率,末位碱基为A的错配效率明显高于其她3个碱基,因此应当避免在引物的3’端使用碱基A。另外,引物二聚体或发夹结构也可能导致PCR反应失败。5’端序列对PCR影响不太大,因此常用来引进修饰位点或标记物。 4、引物序列的GC含量一般为40-60%,过高或过低都不利于引发反应。上下游引物的GC含量不能相差太大。 5、引物所对应模板位置序列的Tm值在72℃左右可使复性条件最佳。Tm值的计算有多种方法,如按公式Tm=4(G+C)+2(A+T),在Oligo软件中使用的就是最邻近法(the nearest neighbor method)。 6、ΔG值就是指DNA双链形成所需的自由能,该值反映了双链结构内部碱基对的相对稳定性。应当选用3’端ΔG值较低(绝对值不超过9),而5’端与中间ΔG值相对较高的引物。引物的3’端的ΔG值过高,容易在错配位点形成双链结构并引发DNA聚合反应。 7、引物二聚体及发夹结构的能值过高(超过4、5kcal/mol)易导致产生引物二聚体带,并且降低引物有效浓度而使PCR反应不能正常进行。 8、对引物的修饰一般就是在5’端增加酶切位点,应根据下一步实验中要插入PCR产物的载体的相应序列而确定。 引物序列应该都就是写成5-3方向的, Tm之间的差异最好控制在1度之内, 另外我觉得扩增长度大一些比较好,500bp左右。 要设计引物首先要找到DNA序列的保守区。同时应预测将要扩增的片段单链就是否形成二级结构。如这个区域单链能形成二级结构,就要避开它。如这一段不
荧光定量PCR引物设计
荧光定量PCR引物设计专业的定量PCR设计软件beacon Designer 有时一对100分的引物扩增效率特别低换了一对貌似很烂的引物结果溶解曲线却长得很漂亮扩增效率也蛮高。个人认为这个跟你选择的位置有关看引物Tm值相差是否很高适当降低反应退火温度看看是否有效看所扩增片段GC含量以及产物Tm是否很高比方水稻基cDNA扩增常常用到GC buffer。看所用扩增基因是否为组织特异性表达看RNA是否完整是否降解反转录过程是否完整设好内参正对照最后所有这些都满足还是没扩增出来重新设计引物吧1设计的时候尽量靠近基因的3端这样能最大限度地保证扩增效率2尽量跨越内含子这样可以保证检测有无基因组污染3两条引物的Tm值不要相差太大4产物长度保证在80200bp之间最长300 bp。.如果想同时检测很多对基因的变化最好设计的时候记录下产物的Tm值这对你后面的实验设计读板温度很有帮助。保证在产物Tm80以上一般Tm80以下的峰都是引物二聚体对于水稻等GC含量比较高的基因组产物Tm不要高于94个人观点。如果同时检测很多对基因的表达量变化我会尽量调整所有产物的Tm值与内参产物的Tm相差不太大这样方便实验操作和最后的分析。3相对错配来说我认为dimer和harpin对realtime PCR的影响更大当然也别错配得太邪门了非来一条跟产物出峰在相同位置或者比产物峰还高的错配就死了引物的3端不要有错配。5一
般我们用Primer Premier设计软件我一般先让软件自动搜索正义链或反义链的引物找到一条评分是100的再在它左右合适的位置手动搜索有没有合适和它配对的评分也比较高的 引物一般5分钟之内可以搞定一个基因。实时定量PCR引物设计的具体要求1、引物应用核酸系列保守区设计并具有特异性。最好位于编码区5端的300-400bp区域内可以用DNAMANAlignment软件看看结果。2、不能形成2级结构。 3、引物长度一般在17-25bp之间上下游引物不能相差太大。 4、GC含量在40-60之间45-55最佳。 5、碱基要随机分布尽量均匀。 6、引物自身不能有连续4个碱基的互补。 7、引物之间不能有连续4个碱基的互补。 8、引物5?6?7端可以修饰。 9、3?6?8端不可修饰而且要避开ATGC rich 的区域避开T/C A/G连续结构2-3个。10、引物3端要避开密码子的第三位。11、引物整体设计自由能分布5端大于3?6?7端。12、定量产物长度80-150bp最好最长是300bp。实时定量PCR完全手册方法简介所谓的实时荧光定量PCR 就是通过对PCR 扩增反应中每一个循环产物荧光信号的实时检测从而实现对起始模板定量及定性的分析。在实时荧光定量PCR 反应中引入了一种荧光化学物质随着PCR 反应的进行PCR 反应产物不断累计荧光信号强度也等比例增加。每经过一个循环收集一个荧光强度信号这样我们就可以通过荧光强度变化监测产物量的变化从而得到一条
引物设计的原理与方法
引物设计的原理与方法 The latest revision on November 22, 2020
PCR引物设计的原理及方法 阎振鑫S111666(四川大学生命科学学院细胞生物学成都 610014) 摘要:自20世纪后期发展了PCR技术以来,PCR已经改变了整个生物学研究的进程。而PCR反应的第一步就是设计引物,引物设计的好坏直接关系到PCR的成败。PCR引物设计有许多的原则必须要遵循:引物与引物之间避免形成稳定的二聚体或发夹结构,引物与模板的序列要紧密互补。引物不能在模板的非目的位点引发DNA聚合反应等。另外,引物的设计方法也越来越多,出现了许多专门的设计软件和网站,如:PrimerPremier5.0等。 关键词:PCR 引物原理方法 NCBI PrimerPremier5.0 PCR primer design principle and method YanZhenxin (sichuan Univercity, Life science college cell biology chengdu 610014 ) Abstract: When PCR technology was find, PCR has changed all of the program in research of biology. The design of primer is the frist step of PCR. It is relation to the fate of PCR. There are some principals must be obey: dipolymer and hairpin structure must be avoid between different primers. The DNA polymerization reaction should not be triggered at the wrong site. Therefore, there are more and more methods of design primer, include the professional softwares and professional web site. Key word: PCR primer principle NCBI PrimerPremier5.0 聚合酶链式反应(Polymerase chain reaction。PCR)是20世纪后期发展起来的 一种体外扩增特异DNA片断的技术。具有快速、简便及高度敏感等优点,能极大地缩短目的基因扩增时间[1]。因此,其一直是生物学者们致力于构建cDNA文库、基因克隆以及表达调控研究的必要前提和基础[2]。PCR的第一步就是引物设计。引物设计的好坏,直接影响了PCR的结果,因此这一步很关键。成功的PCR反应既要高效,又要特异性扩增产物,因此对引物设计提出了较高的要求。引物设计需要注意的地方很多,在大多数情况下,我们都是在知道已知模板序列时进行PCR扩增的。在某些情况比如构建文库的时候也会在不知道模板序列的情况下进行设计。这个时候随机核苷酸序列
引物设计的原理与方法
PCR引物设计的原理及方法 阎振鑫S111666(四川大学生命科学学院细胞生物学成都610014) 摘要:自20世纪后期发展了PCR技术以来,PCR已经改变了整个生物学研究的进程。而PCR反应的第一步就是设计引物,引物设计的好坏直接关系到PCR的成败。PCR引物设计有许多的原则必须要遵循:引物与引物之间避免形成稳定的二聚体或发夹结构,引物与模板的序列要紧密互补。引物不能在模板的非目的位点引发DNA聚合反应等。另外,引物的设计方法也越来越多,出现了许多专门的设计软件和网站,如:PrimerPremier5.0等。 关键词:PCR 引物原理方法NCBI PrimerPremier5.0 PCR primer design principle and method YanZhenxin (sichuan Univercity, Life science college cell biology chengdu 610014 ) Abstract: When PCR technology was find, PCR has changed all of the program in research of biology. The design of primer is the frist step of PCR. It is relation to the fate of PCR. There are some principals must be obey: dipolymer and hairpin structure must be avoid between different primers. The DNA polymerization reaction should not be triggered at the wrong site. Therefore, there are more and more methods of design primer, include the professional softwares and professional web site. Key word: PCR primer principle NCBI PrimerPremier5.0 聚合酶链式反应(Polymerase chain reaction。PCR)是20世纪后期发展起来的一种体外扩增特异DNA片断的技术。具有快速、简便及高度敏感等优点,能极大地缩短目的基因扩增时间[1]。因此,其一直是生物学者们致力于构建cDNA文库、基因克隆以及表达调控研究的必要前提和基础[2]。PCR的第一步就是引物设计。引物设计的好坏,直接影响了PCR的结果,因此这一步很关键。成功的PCR反应既要高效,又要特异性扩增产物,因此对引物设计提出了较高的要求。引物设计需要注意的地方很多,在大多数情况下,我们都是在知道已知模板序列时进行PCR扩增的。在某些情况比如构建文库的时候也会在不知道模板序列的情况下进行设计。这个时候随机核苷酸序列就与模板不是完全匹配。我们通常指的设计引物都是在已知模板序列的情况下进行。设计的目的是在两个目标间取得平衡:扩增特异性和扩增效率。
荧光定量PCR引物设计原则
1.引物应用核酸系列保守区内设计并具有特异性。最好位于编码区5’端的300-400bp区域 内,可以用DNAman,Alignment 软件看看结果。 2. 产物不能形成二级结构(自由能小于58.61KJ/mol)。 3.引物长度一般在17-25碱基之间,上下游引物不能相差太大。 4.G+C含量在40%~60%之间,45-55%最佳。 5.碱基要随机分布,尽量均匀。 6.引物自身不能有连续4个碱基的互补。 7.引物之间不能有连续4个碱基的互补。 8.引物5′端可以修饰。 9.3′端不可修饰,而且要避开AT,GC rich的区域,避开T/C,A/G连续结构(2-3个)。 10. 引物3′端要避开密码子的第3位。 11.引物整体设计自由能分布5‘端大于3’端,且3‘端自由能最好小于9KJ/mol。 可用oligo 6 软件进行比对看结果的情况。 12.做荧光定量产物长度80-150bp最好,最长是300bp. 13.引物设计避免DNA污染,最好跨外显子接头区。 14.引物与非特异性扩增序列的同源性最好小于70%或者有8个互补碱基同源。 15.查看有无假基因的存在。假基因就是无功能的DNA序列,与需要扩增的目的片段长 度相似。 16.TM值在58-62度之间。 17.引物设计的软件Primer 5.0 有专门针对荧光的。 设计的目的是在两个目标间取得平衡:扩增特异性和扩增效率。引物分析软件将试图通过使用每一引物设计变化的预定值在这两个目标间取得平衡。设计引用有一些需要注意的基本原理: ①引物长度 一般引物长度为18~30碱基。总的说来,决定引物退火温度(Tm值)最重要的因素就是引物的长度。有以下公式可以用于粗略计算引物的退火温度。 在引物长度小于20bp时:[4(G+C)+2(A+T)]-5℃ 在引物长度大于20bp时:62.3℃+0.41℃(%G-C)-500/length-5℃ 另外有许多软件也可以对退火温度进行计算,其计算原理会各有不同,因此有时计算出的数值可能会有少量差距。为了优化PCR反应,使用确保退火温度不低于54℃的最短的引物可获得最好的效率和特异性。
手把手教你PCR引物设计来自小木虫
PCR引物设计的黄金法则 1. 引物最好在模板cDNA的保守区内设计。 DNA序列的保守区是通过物种间相似序列的比较确定的。在NCBI上搜索不同物种的同一基因,通过序列分析软件(比如DNAman)比对(Alignment),各基因相同的序列就是该基因的保守区。 2.引物长度一般在15~30碱基之间。 引物长度(primer length)常用的是18-27 bp,但不应大于38,因为过长会导致其延伸温度大于74℃,不适于Taq DNA 聚合酶进行反应。 3.引物GC含量在40%~60%之间,Tm值最好接近72℃。 GC含量(composition)过高或过低都不利于引发反应。上下游引物的GC含量不能相差太大。另外,上下游引物的Tm值(melting temperature)是寡核苷酸的解链温度,即在一定盐浓度条件下,50%寡核苷酸双链解链的温度。有效启动温度,一般高于Tm值5~10℃。若按公式Tm= 4(G+C)+2(A+T)估计引物的Tm值,则有效引物的Tm为55~80℃,其Tm值最好接近72℃以使复性条件最佳。 4.引物3′端要避开密码子的第3位。 如扩增编码区域,引物3′端不要终止于密码子的第3位,因密码子的第3位易发生简并,会影响扩增的特异性与效率。
5.引物3′端不能选择A,最好选择T。 引物3′端错配时,不同碱基引发效率存在着很大的差异,当末位的碱基为A时,即使在错配的情况下,也能有引发链的合成,而当末位链为T时,错配的引发效率大大降低,G、C错配的引发效率介于A、T之间,所以3′端最好选择T。 6. 碱基要随机分布。 引物序列在模板内应当没有相似性较高,尤其是3’端相似性较高的序列,否则容易导致错误引发(False priming)。降低引物与模板相似性的一种方法是,引物中四种碱基的分布最好是随机的,不要有聚嘌呤或聚嘧啶的存在。尤其3′端不应超过3个连续的G或C,因这样会使引物在GC富集序列区错误引发。 7. 引物自身及引物之间不应存在互补序列。 引物自身不应存在互补序列,否则引物自身会折叠成发夹结构(Hairpin)使引物本身复性。这种二级结构会因空间位阻而影响引物与模板的复性结合。引物自身不能有连续4个碱基的互补。 两引物之间也不应具有互补性,尤其应避免3′ 端的互补重叠以防止引物二聚体(Dimer与Cross dimer)的形成。引物之间不能有连续4个碱基的互补。 引物二聚体及发夹结构如果不可避免的话,应尽量使其△G值不要过
PCR引物设计基本思路
PCR引物设计基本思路 1.根据实验需要,确定需要扩增的DNA序列,并知道其CDS区序列(编码结构基因区, 即从起始密码子区至终止密码子区)ncbi网站查询 RBS 149..153 /gene="eryF" CDS 158..1372 /gene="eryF" 1 ggatcccgat cgtgtcggag g aa gaggcc a agtcgcgccg ccc cgaccag ctgctggtgc 61 tgccctggat ctaccgcgac gggttcgtcg aacgcgagca ggagttcctc gctggcggcg 121 gaaagctgat cttcccccta ccccgactgg aagtcgt atg acgaccgttc ccgatctcga 181 aagcgactcc ttccacgtcg actggtaccg cacctacgcc gagctgcgcg agaccgcgcc 241 ggtgacgccg gtgcgcttcc tcggccagga cgcgtggctg gtcaccggct acgacgaggc 301 gaaggccgcg ctgagcgacc tgcgcctgag cagcgacccg aagaagaagt acccgggcgt 361 ggaggtcgag ttcccggcat acctcggttt ccccgaggac gtgcggaact acttcgccac 421 caacatgggc accagcgacc cgccgaccca cacccggctg cgcaagctgg tgtcgcagga 481 gttcaccgtc cgccgcgtgg aggcgatgcg gccccgcgtc gagcagatca ccgcggagct 541 gctcgacgag gtgggcgact ccggcgtggt cgacatcgtc gaccgcttcg cccacccgct 601 gcccatcaag gtcatctgcg agctgctcgg cgtcgacgag aagtaccgcg gggagttcgg 661 gcggtggagc tcggagatcc tggtcatgga cccggagcgg gccgaacagc gcgggcaggc 721 ggccagggag gtcgtcaact tcatcctcga cctggtcgag cgccgccgca ccgagcccgg 781 cgacgacctg ctgtccgcgc tgatcagggt ccaggacgac gatgacggtc ggctcagcgc 841 cgacgagctg acctccatcg cgctggtgct gctgctggcc ggtttcgagg cgtcggtgag 901 cctcatcggg atcggcacct acctgctgct cacccacccg gaccagctcg cgctggtgcg 961 gcgggacccg tcggcgctgc ccaacgccgt cgaggagatc ctgcgctaca tcgctccgcc 1021 ggagaccacc acgcgcttcg ccgcggagga ggtggagatc ggcggtgtcg cgatccccca 1081 gtacagcacg gtgctggtcg cgaacggcgc ggccaaccgc gacccgaagc agttcccgga 1141 cccccaccgc ttcgacgtca cccgcgacac ccgcggccac ctgtcgttcg ggcagggcat 1201 ccacttctgc atgggccggc cgctggccaa gctggagggc gaggtggcgc tgcgggcgct 1261 gttcggccgc ttccccgctc tgtcgctggg aatcgacgcc gacgacgtgg tgtggcggcg 1321 ttcgctgctg ctgcggggca tcgaccacct accggtgcgg ctcgacgga t ga gcacctgg 1381 ctgcggcggt tcggtcctcc cgtcgagcac cgggcgcggc tggtgtgctt cccgcacgcg 1441 ggagccgcgg ccgactccta cctcgacctc gcgcgcgcct tggcgcccga gatcgacgtg 1501 cacgccgtgc agtacccggg gcgccaggac cgccgcgacg aggagcccct gggcaccgcc 1561 ggcgagatcg ccgacgaggt ggccgccgtg ctgcgcgcgt cgggcggcga cggcccgttc 1621 gccctg ttcg ggcacagcat g ggcgcg ttg atcgcctacg agacggcgcg caggctcgaa 1681 cgcgagcccg gcggcgggcc gctgcggctg ttcgtgtccg ggcagaccgc cccgcgcgtg 1741 cacgagcgcc gcaccgacct gcccggcgac gacggtctgg tggacgagct gcgccggctc 1801 ggcaccagcg aggcggcgct ggccgacgag gccctgctcg ccatgtcgct gccggtgctg 1861 cgcgccgact accgcgtgct gcgctcctac gcctgggcgg acggaccacc gctgcgggcc 1921 ggcatcaccg cgctgtgcgg cgacgccgac ccgctgaccg cgaccgggga cgccgagcgc
