2021届高考化学复习:专题三 有机制备实验(综合实验)(有答案和详细解析)
专题三有机制备实验(综合实验)
知识梳理:
“有机实验”在高考中频频出现,主要涉及有机物的制备、有机物官能团性质的实验探究等。常常考查蒸馏和分液操作、反应条件的控制、产率的计算等问题。
(1)分离液体混合物的方法
方法适用条件实例说明
萃取互不相溶的液体混合物分离CCl4和水等分液时下层液体从下口流出,上层液体从上口倒出
蒸馏两种或两种以上互溶的
液体,沸点相差较大
分离酒精和水
在蒸馏烧瓶中放少量碎瓷
片,防止液体暴沸
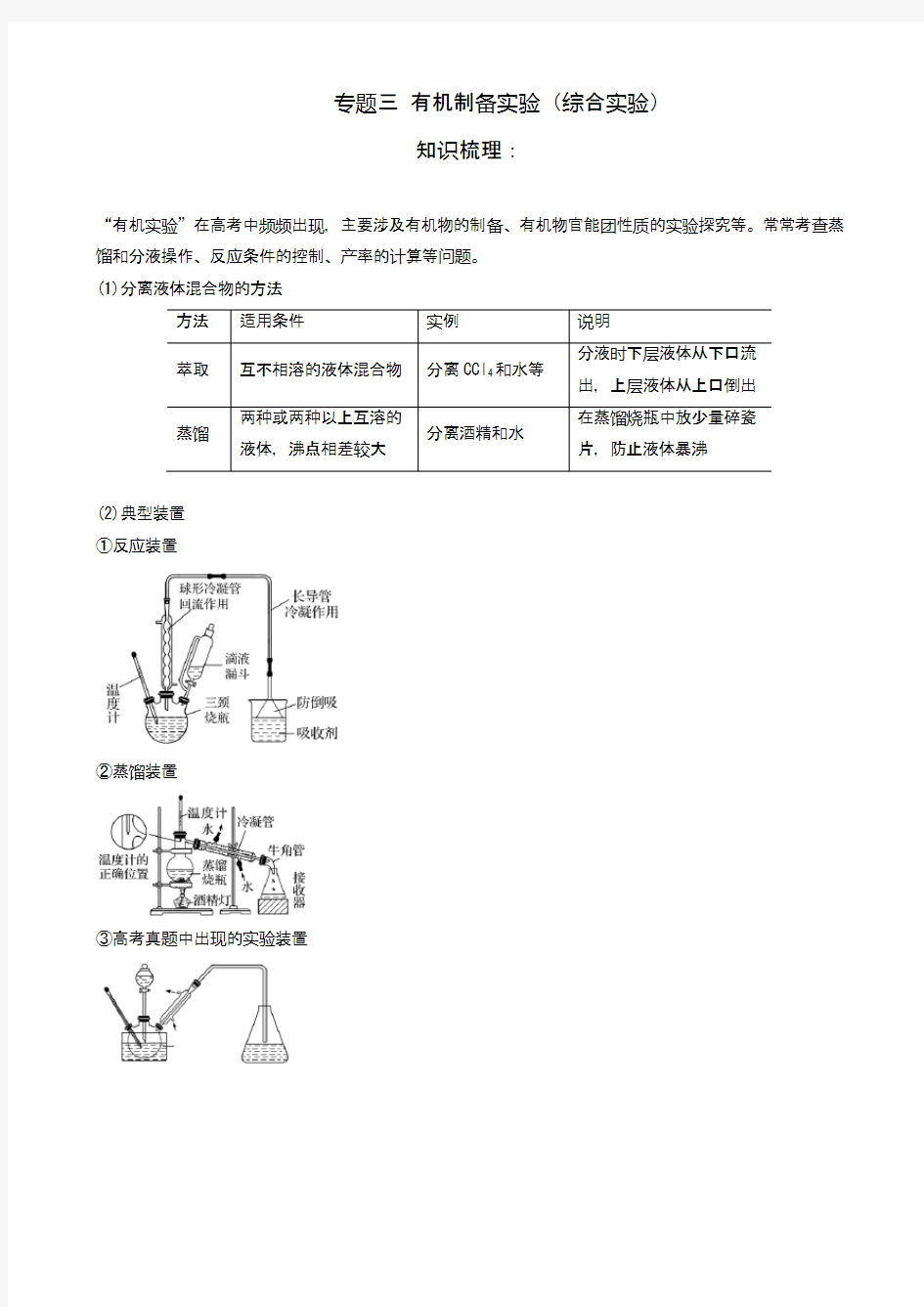
(2)典型装置
①反应装置
②蒸馏装置
③高考真题中出现的实验装置
特别提醒球形冷凝管由于气体与冷凝水接触时间长,具有较好的冷凝效果,但必须竖直放置,所以蒸馏装置必须用直形冷凝管。
强化训练
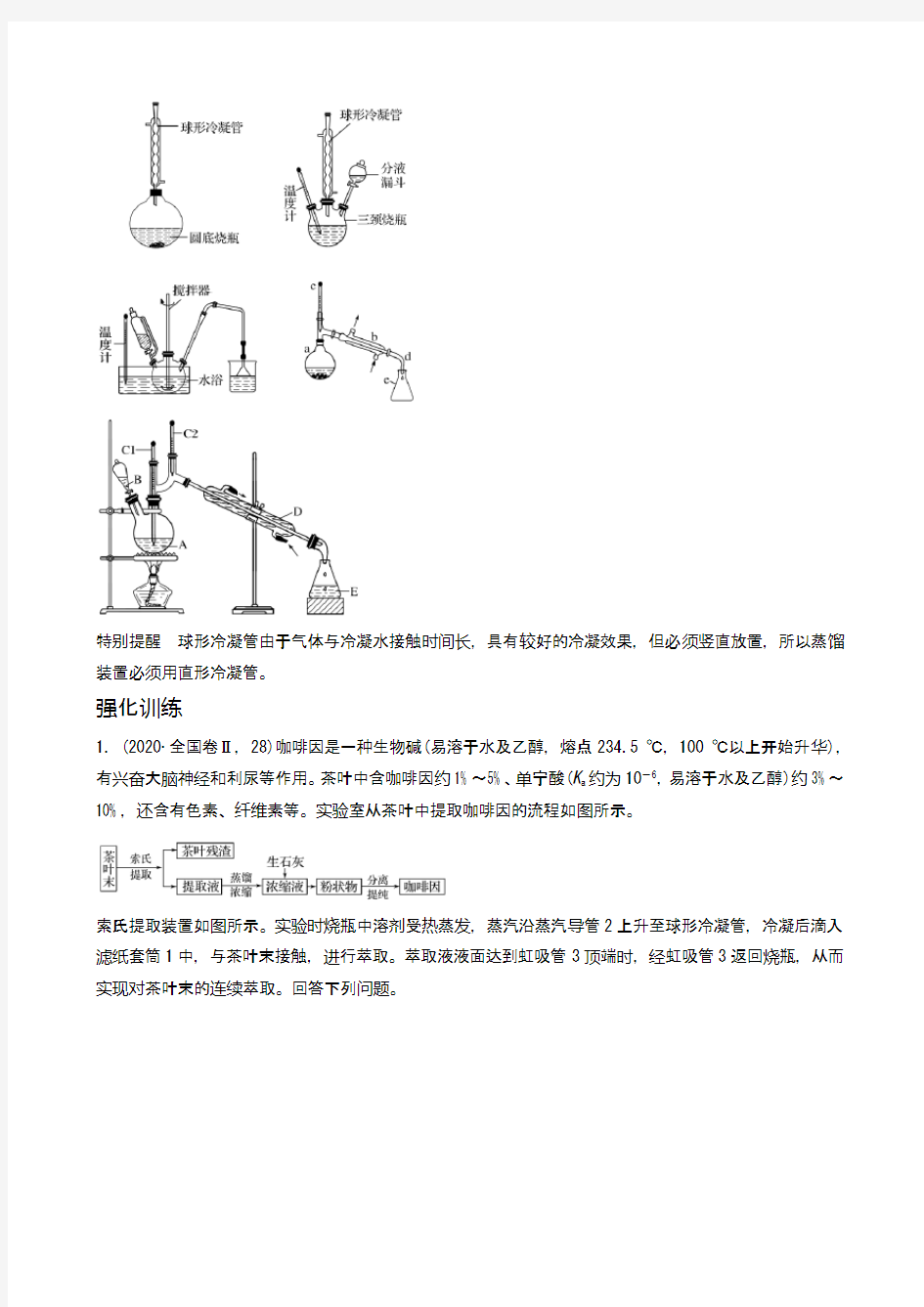
1.(2020·全国卷Ⅱ,28)咖啡因是一种生物碱(易溶于水及乙醇,熔点234.5 ℃,100 ℃以上开始升华),有兴奋大脑神经和利尿等作用。茶叶中含咖啡因约1%~5%、单宁酸(K a约为10-6,易溶于水及乙醇)约3%~10%,还含有色素、纤维素等。实验室从茶叶中提取咖啡因的流程如图所示。
索氏提取装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与茶叶末接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对茶叶末的连续萃取。回答下列问题。
(1)实验时需将茶叶研细,放入滤纸套筒1中,研细的目的是__________________。圆底烧瓶中加入95%
乙醇为溶剂,加热前还要加几粒__________。
(2)提取过程不可选用明火直接加热,原因是____________________。与常规的萃取相比,采用索氏提取
器的优点是______________________。
(3)提取液需经“蒸馏浓缩”除去大部分溶剂。与水相比,乙醇作为萃取剂的优点是____________________。“蒸馏浓缩”需选用的仪器除了圆底烧瓶、蒸馏水、温度计、接收管之外,还有________(填标号)。A.直形冷凝管
B.球形冷凝管
C.接收瓶
D.烧杯
(4)浓缩液加生石灰的作用是中和________和吸收________。
(5)可采用如图所示的简易装置分离提纯咖啡因。将粉状物放入蒸发皿中并小火加热,咖啡因在扎有小孔
的滤纸上凝结,该分离提纯方法的名称是________。
答案(1)增加固液接触面积,使萃取更充分沸石(2)乙醇易挥发,易燃使用溶剂量少,可连续萃取(萃取效率高) (3)乙醇沸点低,易浓缩AC (4)单宁酸水 (5)升华
解析(1)实验时将茶叶研细,能增加茶叶与溶剂的接触面积,使萃取更加充分。乙醇为溶剂,为防止加热时暴沸,需在加热前向乙醇中加入几粒沸石。(2)由于溶剂乙醇具有挥发性和易燃性,因此在提取过程
中不可用明火直接加热。本实验中采用索氏提取器的优点是溶剂乙醇可循环使用,能减少溶剂用量,且萃取效率高。(3)提取液需经“蒸馏浓缩”除去大部分溶剂,与水相比,乙醇作为萃取剂具有沸点低和易浓缩的优点。“蒸馏浓缩”需选用的仪器除了所给仪器外,还有直形冷凝管和接收瓶(如锥形瓶)。(4)向浓缩液中加入生石灰能中和单宁酸并吸收水。(5)结合分离提纯咖啡因的装置及将粉状物放入蒸发皿并小火
加热,咖啡因凝结在扎有小孔的滤纸上,可知该分离提纯的方法为升华。
2.(2020·全国卷Ⅲ,27)乙酰水杨酸(阿司匹林)是目前常用药物之一。实验室通过水杨酸进行乙酰化制备
阿司匹林的一种方法如下:
+(CH3CO)2O 浓H2SO4
△+CH3COOH
水杨酸醋酸酐乙酰水杨酸
水杨酸醋酸酐乙酰水杨酸
熔点/℃157~159 -72~-74 135~138
相对密度/(g·cm-3) 1.44 1.10 1.35
相对分子质量138 102 180
实验过程:在100 mL锥形瓶中加入水杨酸6.9 g及醋酸酐10 mL,充分摇动使固体完全溶解。缓慢滴加
0.5 mL浓硫酸后加热,维持瓶内温度在70 ℃左右,充分反应。稍冷后进行如下操作。
①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤。
②所得结晶粗品加入50 mL饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤得固体。
④固体经纯化得白色的乙酰水杨酸晶体5.4 g。
回答下列问题:
(1)该合成反应中应采用________加热。(填标号)
A.热水浴B.酒精灯
C.煤气灯D.电炉
(2)下列玻璃仪器中,①中需使用的有________(填标号),不需使用的有________(填名称)。
(3)①中需使用冷水,目的是_______________________________________________。
(4)②中饱和碳酸氢钠的作用是______________________________,以便过滤除去难溶杂质。
(5)④采用的纯化方法为________。
(6)本实验的产率是________%。
答案(1)A (2)BD 分液漏斗、容量瓶(3)充分析出乙酰水杨酸固体(结晶) (4)生成可溶的乙酰水杨酸钠 (5)重结晶(6)60
解析(1)由题给信息“维持瓶内温度在70 ℃左右”可知,该反应中应采用热水浴加热。
(2)①中涉及过滤操作,需要用到题给玻璃仪器中的烧杯、漏斗,不需要使用题给玻璃仪器中的分液漏斗和容量瓶。(3)乙酰水杨酸在低温下溶解度较小,使用冷水有利于充分析出乙酰水杨酸固体。(4)加入的饱和碳酸氢钠与乙酰水杨酸反应,生成可溶性的乙酰水杨酸钠,易与不溶性的物质分离。(5)乙酰水杨酸的
溶解度随温度变化改变较大,故可用重结晶的方法纯化。(6)由表中及题给数据分析可知,加入的水杨酸量少,6.9 g 水杨酸的物质的量为0.05 mol ,由方程式可知1 mol 水杨酸与过量醋酸酐反应生成1 mol 乙酰水杨酸,则0.05 mol 水杨酸参与反应得到0.05 mol 乙酰水杨酸,其质量为0.05 mol×180 g·mol -1=9.0 g ,产率为5.4 g
9.0 g
×100%=60%。
3、工业上乙醚可用于制造无烟火药。实验室合成乙醚的原理如下: 主反应 2CH 3CH 2OH ―――→浓H 2SO 4
140 ℃CH 3CH 2OCH 2CH 3+H 2O 副反应 CH 3CH 2OH ―――→浓H 2SO 4170 ℃
CH 2==CH 2↑+H 2O 【乙醚的制备】实验装置如图所示(夹持装置和加热装置略)
(1)仪器a 是________(写名称);仪器b 应更换为下列的________(填字母)。 A .干燥器 B .直形冷凝管 C .玻璃管 D .安全瓶
(2)实验操作的正确排序为________(填字母),取出乙醚后立即密闭保存。
a .组装实验仪器
b .加入12 mL 浓硫酸和少量乙醇的混合物
c .检查装置气密性
d .熄灭酒精灯
e .先通冷却水后加热烧瓶
f .拆除装置
g .控制滴加乙醇的速率与产物馏出的速率相等
(3)加热后发现仪器a 中没有添加碎瓷片,处理方法是____________________。反应温度不超过140 ℃,其目的是__________________。若滴入乙醇的速率显著超过产物馏出的速率,则反应速率会降低,可能的原因是____________________。 【乙醚的提纯】
(4)粗乙醚中含有的主要杂质为________;无水氯化镁的作用是___________。
(5)操作a 的名称是______________;进行该操作时,必须用水浴代替酒精灯加热,其目的与制备实验中将尾接管支管接室外相同,均为__________________。
答案 (1)三颈烧瓶 B (2)acbegdf (3)停止加热,将烧瓶中的溶液冷却至室温,再重新加入碎瓷片 避免副反应发生 温度骤降导致反应速率降低(其他合理答案也可) (4)乙醇(其他合理答案也可) 干燥乙醚 (5)蒸馏 避免乙醚蒸气燃烧或爆炸
解析
实验目的乙醚的制备及纯化
实验原理2CH
3
CH2OH――――→
浓H2SO4
140 ℃CH3CH2OCH2CH3+H2O
实验装置
乙醚的制备:仪器a是三颈烧瓶。球形冷凝管一般竖立放置,防止
液体残留在球泡内,仪器b为球形冷凝管,应更换为直形冷凝管。
乙醚的提纯:乙醇易挥发,因此粗乙醚中含有的主要杂质为乙醇。
无水氯化镁的作用是干燥乙醚
实验操作
实验操作顺序:先按照从左到右,从下到上的顺序组装实验仪器,
再检查装置的气密性,然后加入反应物;为了防止冷凝管受热后遇
冷破裂同时保证冷凝效果,应先通冷却水后加热烧瓶;实验过程中
控制滴加乙醇的速率与产物馏出的速率相等;实验结束后先熄灭酒
精灯后停止通冷却水,最后拆除装置。
加热后发现仪器a中没有添加碎瓷片,应停止加热,将烧瓶中的溶
液冷却至室温,再重新加入碎瓷片。
操作a是从干燥后的有机层(主要含乙醇和乙醚)中分离出乙醚,故
操作a为蒸馏
实验现象及
分析
若滴入乙醇的速率显著超过产物馏出的速率,则反应混合物的温度
会降低,从而导致反应速率降低
结论或评价
根据题给信息,反应温度为170 ℃时,有副反应发生,因此反应温
度应不超过140 ℃,其目的是避免副反应发生。
无水乙醚遇热容易爆炸,故蒸馏时应用水浴代替酒精灯加热,目的
是避免乙醚蒸气燃烧或爆炸
4、苯甲酸钠是一种常见的食品防腐剂。实验室制备苯甲酸的反应装置图和有关数据如下:
相对分子质量熔点/℃沸点/℃溶解性甲苯92 -94.9 110.6 难溶于水
苯甲酸122 122.13 249 微溶于水
苯甲酸钠144 —249.3 易溶于水
按下列合成步骤回答问题:
(1)制备苯甲酸
在三颈烧瓶中加入4 mL甲苯和20 mL稀硫酸,放入碎瓷片后,加热至沸腾,加入12.8 g高锰酸钾,加热到甲苯层消失。将三颈烧瓶在冰水浴中冷却,分离出苯甲酸。
①球形冷凝管的作用是________________________________________________,
其进水口是________(填“a”或“b”)。
②三颈烧瓶中反应的离子方程式是____________________________
_______________________________________________________。
③分离苯甲酸选用的玻璃仪器是________(填字母)。
A.分液漏斗 B.玻璃棒
C.烧杯 D.漏斗
E.蒸馏烧瓶 F.直形冷凝管
④分离出的苯甲酸晶体中可能含有的杂质是________,为进一步提纯,应采用的方法是________。
(2)制备苯甲酸钠
控制温度为70 ℃,向三颈烧瓶中加入61.0 g苯甲酸和适量的32%碳酸钠溶液,充分反应后停止加热。在深色的溶液中加入活性炭,并将混合物过滤,得到无色透明的苯甲酸钠溶液,将滤液转入蒸发皿中,加热蒸发、冷却结晶,过滤、洗涤、干燥制得苯甲酸钠晶体。
⑤控制温度为70 ℃的方法是____________________________________。
⑥加入活性炭的作用是______________________________________。
⑦若提纯得到46.8 g苯甲酸钠,则苯甲酸钠的产率是________。
解析(1)①球形冷凝管的作用是冷凝回流,减少反应物的损失;为达到较好的冷凝效果,冷凝管的进水口是b。
②本实验是制取苯甲酸,利用高锰酸钾的强氧化性,把甲苯上的甲基氧化成羧基,自身被还原成Mn2+,根据得失电子守恒配平化学方程式,即反应的离子方程式为
+6MnO-4+18H+―→+6Mn2++14H2O。
③根据表格数据,苯甲酸在此状态下是微溶于水的固体,因此采用过滤的方法进行分离,用到的仪器有:烧杯、玻璃棒、漏斗、滤纸、铁架台等,因此B、C、D项正确。
④根据②中反应的离子方程式,得出混有的杂质是K2SO4、MnSO4,这两种物质溶于水,采取重新溶解、再结晶的方法提纯,即重结晶法。
(2)⑤温度要控制在70 ℃,如果直接加热,温度很容易超过70 ℃,因此采取水浴加热,优点是受热均匀,
便于控制温度。
⑥根据信息,深色溶液中加入活性炭,得到无色透明溶液,且活性炭具有吸附性,因此活性炭的作用是吸附脱色。
⑦61.0 g 苯甲酸完全转化成苯甲酸钠时,生成苯甲酸钠的质量为61.0 g×144122=72.0 g ,则产率为
46.8 g
72.0 g ×100%=65.0%。 答案 (1)①冷凝回流 b
②+6MnO -4+18H +
―→+6Mn 2++14H 2O
③BCD ④K 2SO 4、MnSO 4 重结晶 (2)⑤水浴加热 ⑥吸附脱色 ⑦65.0%
5.醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
相对分子质量 密度/(g·cm -3) 沸点/℃ 溶解性 环己醇 100 0.961 8 161 微溶于水 环己烯
82
0.810 2
83
难溶于水
合成反应:
在a 中加入20 g 环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL 浓硫酸。b 中通入冷却水后,开始缓慢加热a ,控制馏出物的温度不超过90 ℃。 分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时
间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是________。
(2)加入碎瓷片的作用是________________________________________
___________________________________________________________;
如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填字母,下同)。
A.立即补加 B.冷却后补加
C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为___________________________。
(4)分液漏斗在使用前须清洗干净并________;在本实验分离过程中,产物应该从分液漏斗的________(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是
________________________________________________________
_____________________________________________________________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________。
A.圆底烧瓶 B.温度计
C.吸滤瓶 D.球形冷凝管
E.接收器
(7)本实验所得到的环己烯产率是________。
A.41% B.50% C.61% D.70%
解析(1)装置b为直形冷凝管,可用于冷凝回流。(2)加入碎瓷片的作用是防止有机物在加热时发生暴沸。如果在加热时发现忘记加碎瓷片,这时必须停止加热,待冷却后补加碎瓷片。(3)醇分子间最容易发生脱水反应生成醚类化合物。(4)分液漏斗在使用前必须要检漏。实验生成的环己烯的密度比水的要小,所以环己烯应从上口倒出。(5)加入无水氯化钙的目的:除去水(作干燥剂)和除去环己醇(因为乙醇可以和氯化钙反应,类比推知,环己醇和氯化钙也可以反应)。(6)观察题中实验装置图知蒸馏过程中不可能用到吸滤
瓶及球形冷凝管。(7)加入20 g环己醇的物质的量为
20 g
100 g·mol-1
=0.2 mol,理论上生成环己烯的物质的
量为0.2 mol,环己烯的质量为0.2 mol×82 g·mol-1=16.4 g,实际得到环己烯的质量为10 g,则产率为10 g
16.4 g
×100%≈61%。
答案(1)直形冷凝管
(2)防止暴沸 B
(3)
(4)检漏上口倒出
(5)干燥(或除水除醇)
(6)CD (7)C
[名师点拨]
[审题流程] 有机物制备实验一般包括制备过程和提纯过程。本题给出了详细的实验过程,可对题干信息解读如下:
