苯海索杂质列表-标准品

苯海索杂质
——孟成科技(上海)有限公司
名称信息
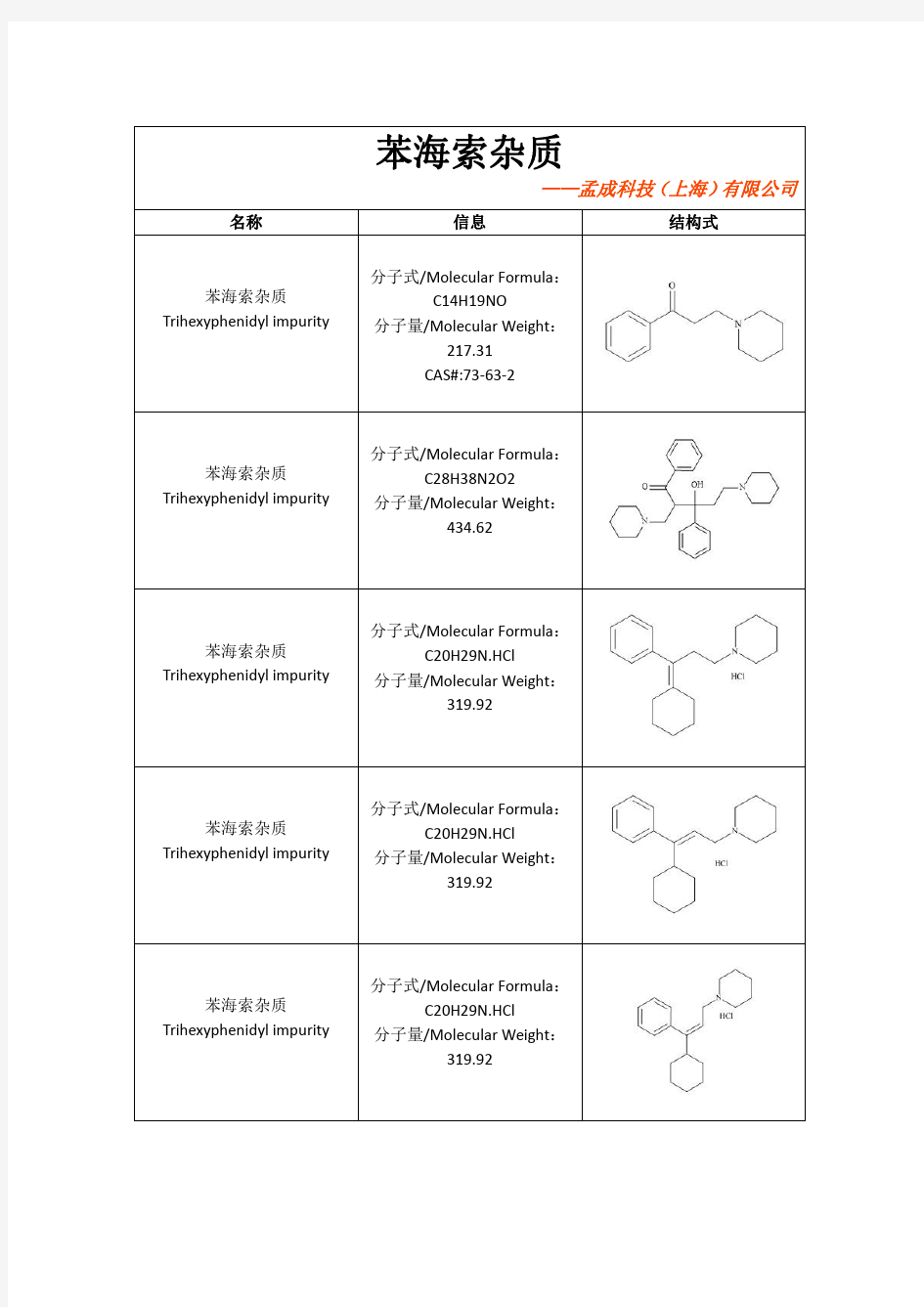
结构式苯海索杂质Trihexyphenidyl impurity
分子式/Molecular Formula :
C14H19NO
分子量/Molecular Weight :
217.31
CAS#:73-63-2苯海索杂质
Trihexyphenidyl impurity 分子式/Molecular Formula :C28H38N2O2
分子量/Molecular Weight :
434.62
苯海索杂质
Trihexyphenidyl impurity 分子式/Molecular Formula :C20H29N.HCl
分子量/Molecular Weight :
319.92
苯海索杂质
Trihexyphenidyl impurity 分子式/Molecular Formula :C20H29N.HCl
分子量/Molecular Weight :
319.92
苯海索杂质
Trihexyphenidyl impurity 分子式/Molecular Formula :C20H29N.HCl
分子量/Molecular Weight :
319.92
苯海索杂质Trihexyphenidyl impurity 分子式/Molecular Formula:
C14H20O
分子量/Molecular Weight:
204.31
CAS#:4352-39-0
【CN110123747A】苯达莫司汀的制剂【专利】
(19)中华人民共和国国家知识产权局 (12)发明专利申请 (10)申请公布号 (43)申请公布日 (21)申请号 201910342587.7 (22)申请日 2019.04.26 (71)申请人 嘉兴市爵拓科技有限公司 地址 314300 浙江省嘉兴市海盐县武原街 道盐北路211号西区2幢102室-9 (72)发明人 宋艳丽 闫淑梅 邹德双 (74)专利代理机构 北京国翰知识产权代理事务 所(普通合伙) 11696 代理人 卫翠婷 (51)Int.Cl. A61K 9/10(2006.01) A61K 31/4184(2006.01) A61K 47/10(2006.01) A61K 47/12(2006.01) A61P 35/00(2006.01) A61P 35/02(2006.01)A61P 37/02(2006.01) (54)发明名称苯达莫司汀的制剂(57)摘要本发明提供一种苯达莫司汀的制剂,属于药物制剂技术领域,含:苯达莫司汀或其药学上可接受的盐;药学上可接受的油和/或脂;和包含聚乙二醇400、苯甲酸钠和丙二醇的增溶剂。本发明还提供苯达莫司汀的制剂在制备治疗慢性淋巴细胞白血病、急性淋巴细胞白血病、慢性粒细胞白血病、急性粒细胞白血病、霍奇金病、非霍奇金淋巴瘤、多发性骨髓瘤、乳腺癌、卵巢癌、小细胞肺癌、非小细胞肺癌以及自身免疫性疾病的药物中的用途。本发明制剂所用增溶剂粘度较低,大幅度提高苯达莫司汀的溶解速率和溶解度,该制剂在25℃温度下的储存期至少30个月,具有长期储存稳定性好、杂质含量低、细胞毒性低、生物利用度高、 制剂药效高的优点。权利要求书1页 说明书7页 附图2页CN 110123747 A 2019.08.16 C N 110123747 A
药物化学知识点总结
药物化学知识点总结 第七章镇静催眠药与抗癫痫药 1、镇静催眠药的种类:巴比妥类、苯并二氮类、其他类 2、作用机制:中枢GABA受体激动剂 3、构效关系:苯并二氮类 4、代表药物举例:地西泮(合成)、艾司唑仑 5、基本概念:受体、药效团、前药 6、抗癫痫药的种类:巴比妥类、巴比妥类似物(乙内酰脲类、噁唑烷双酮类、丁二酰亚胺类)、二苯并氮杂 类、脂肪羧酸类、GABA类似物 7、代表药物:苯巴比妥(合成)、苯妥英(钠)、卡马西平 8、基本理论:结构非特异性药物、生物电子等排原理及其应用实例 第八章抗精神失常药 1、抗精神病药的种类:吩噻嗪类、硫杂蒽(噻吨)类、丁酰苯类(与哌替啶的关系)、苯酰胺类(与普鲁卡因的关系)和二苯二氮类(氯氮平)等 2、作用机制:DA受体拮抗剂。 3、构效关系及药物代谢:吩噻嗪类 4、代表药物举例:盐酸氯丙嗪 抗抑郁药的种类及代表药物: NE重摄取抑制剂(三环类):丙咪嗪阿米替林 5-HT重摄取抑制剂:氟西汀,去甲氟西汀 单胺氧化酶(MAO)抑制剂:
苯乙肼和异卡波肼(发现过程,先导化合物的发现途径之一) 第十一章阿片样镇痛药 1、吗啡的结构特征及基本化学性质 2、对吗啡进行结构修饰的主要位点,构效关系? –3-位酚羟基(可待因)6-位的羟基(异可待因、海洛因) –17-位的叔胺(纳洛酮、纳曲酮)7、8-位的双键(氢吗啡酮、羟吗啡酮)–6,14-亚乙基桥衍生物(埃托啡、二氢埃托啡) 3、具有阿片样活性的合成镇痛药的结构类型: –吗啡喃类衍生物:左啡诺、布托菲诺 –苯吗喃类衍生物:喷他佐辛 –哌啶类:哌替啶、芬太尼 –氨基酮类:美沙酮 4、合成:盐酸哌替啶、枸橼酸芬太尼 5、基本概念:治疗指数 第十二章非甾体抗炎药 1、解释非甾体抗炎药的作用机理,非甾体抗炎药长期使用有时会引起胃肠道出血,为什么? 2、解热镇痛药和非甾体抗炎药按化学结构各为几类? –水杨酸类:阿司匹林、贝诺酯 –苯胺类:对乙酰氨基酚 –芳基烷酸类:吲哚美辛、布洛芬、萘普生 –邻氨基苯甲酸类(灭酸类):甲芬那酸
标准品和对照品管理规程
目的:建立检验分析用标准品、对照品的管理规程,规范检验分析用标准品、对照品的管理,确保检验结果的准确性。 范围:适用于检验用标准品、对照品的管理。 职责:质量检验室负责人、标准品与对照品管理员对此规程的实施负责。 内容: 1. 标准品、对照品定义及类型 1.1 标准品、对照品是指国家药品标准中用于鉴别、检查、含量测定的标准物质。标准品系指用于生物检定、抗生素或生化药品中含量或效价测定的标准物质,按效价单位(或ug)计,以国际标准品进行标化,对照品除另有规定外,均按干燥品(或无水物)进行计算后使用。 1.2 企业可以选择相应的活性物质,使用法定标准品/对照品进行标化,标化后的物质作为企业自制工作标准品。 2. 标准品、对照品应用范围 标准品、对照品应用于药品鉴别、检查、含量测定等药品检验的各方面。 3. 标准品、对照品采购与接收 3.1标准品、对照品国内可以从中国药品生物制品检定所或当地药检所购买;国外购买可在国外法定认可机构的当地代理处购买或直接采购。 3.2 质量控制部门应安排有专人负责接收和管理标准品并建立标准品接收记录。 3.2.1标准品、对照品管理员应由具有一定药学或分析专业知识,熟悉标准品、对照品的性质和贮存条件,经过专门的培训合格的人员担任。 3.2.2 标准品、对照品的年度采购计划:标准品、对照品管理员每年四季度根据企业生产品种综合计划(下年度)做出品种检验计划和文字说明。内容包括:标准品及对照品名称、规格、计划购买量、价格、库存量、年需用量、检验品种、备注。由于标准品、对照品价格较贵,所以计划量要合理,做到既不浪费,又保证正常的检验工作,必须要填写标准品使用记录,并报检验室负责人审核后报质量管理部部长批准,由采购部按要求安排采购。 3.2.3 标准品、对照品的申购单,应尽量注明分子式、分子量及结构式,以免发生误购。 3.2.4 因某种原因临时需要购买标准品、对照品,经质量管理部部长批准后,标准
阿苯达唑片_兽用阿苯达唑片说明书
畜牧堂兽药说明书,更多药品请登录畜牧堂网站查询 阿苯达唑片_兽用阿苯达唑片说明书 本品含阿苯达唑(C12H15N3O2S)应为标示量的90.O%~110.0%。 【性状】本品为类白色片。 【鉴别】(1)取本品的细粉适量(约相当于阿苯达唑0.2g),加乙醇30ml,置水浴上加热使阿苯达唑溶解,滤过,滤液置水浴上蒸干,残渣照阿苯达唑项下的鉴别(1)、(2)项(96页)试验,显相同的反应。 (2)取含量测定项下的溶液,照分光光度法(附求17页)测定,在295nm的波长处有最大吸收,在277nm波长处有最小吸收。 【检查】应符合片剂项下有关的各项规定(附录5页)。 【含量测定】取本品20片,精密称定,研细,精密称取适量(约相当于阿苯达唑20mg),置100ml最瓶中,加冰醋酸10ml,振摇使阿苯达唑溶解,用乙醇稀释至刻度,摇匀,滤过,精密量取续滤液5ml,置另一100ml量瓶中,用己醇稀释至剿度,摇匀,照分光光度洁(附录17页).在295nm的波长处测定吸收度,按C12H15N3O2S的吸收系数(E)为444计算,即得。 【作用与用途】【用法与用量】同阿苯达唑。 【规格】(1)25mg (2)50mg (3)200mg (4)500mg 【贮藏】密封保存。 阿苯达唑片说明书兽用 【兽药名称】 通用名:阿苯达唑片 商品名: 英文名:Albendazole Tablets 汉语拼音:Abendazuo Pian 【主要成分】阿苯达唑 【性状】本品为类白色片。
【药理作用】药效学阿苯达唑为苯并咪唑类,具有广谱驱虫作用。线虫对其敏感,对绦虫、吸虫也有较强作用(但需较大剂量),对血吸虫无效。作用机理主要是与线虫的微管蛋白结合发挥作用。阿苯达唑与β-微管蛋白结合后,阻止其与α-微管蛋白进行多聚化组装成微管。微管是许多细胞器的基本结构单位,是有丝分裂、蛋白装配及能量代谢等细胞繁殖过程所必需。阿苯达唑对线虫微管蛋白的亲和力显著高于哺乳动物的微管蛋白,因此对哺乳动物的毒性很小。本品不但对成虫作用强,对未成熟虫体和幼虫也有较强作用,还有杀虫卵作用。 药动学阿苯达唑是内服吸收较好的苯并咪唑类药物。牛可从胃肠道吸收50%的给药剂量。9天内可从尿中回收47%内服剂量的药物代谢物。绵羊内服后,因为很快代谢为阿苯达唑亚砜(为驱虫作用的主要活性代谢物),在血中检测不到或只能短时检测到原形药。给药后20小时,代谢物阿苯达唑亚砜和阿苯达唑砜达到血浆药物峰浓度。亚砜代谢物在牛、羊、猪、兔和鸡的半衰期分别为20.5、7.7~9.0、5.9、4.1和4.3小时,砜代谢物的半衰期分别为11.6、11.8、 9.2、9.6和2.5小时。除亚砜和砜外,尚有羟化、水解和结合产物,经胆汁排出体外。 【药物相互作用】阿苯达唑与吡喹酮合用可提高前者的血药浓度。 【适应证】用于畜禽线虫病、绦虫病和吸虫病。如马的副蛔虫、尖尾线虫、圆线虫、无齿圆线虫、普通圆线虫和安氏网尾线虫等;牛的奥斯特线虫、血矛线虫、毛圆线虫、细颈线虫、库珀线虫、仰口线虫、食道口线虫、网尾线虫等成虫及第四期幼虫、肝片形吸虫成虫和莫尼茨绦虫;羊的血矛线虫、奥斯特线虫、毛圆线虫、古柏线虫、细颈线虫、仰口线虫、夏伯特线虫、食道口线虫、毛首线虫及网尾线虫成虫及幼虫;猪的红色猪圆线虫、蛔虫、食道口线虫成虫及幼虫有效;犬和猫的毛细线虫、猫肺并殖吸虫和犬的丝虫;禽的鞭毛虫。 【用法用量】内服一次量每1kg体重马5~10mg 牛、羊10~15mg 猪5~10mg 犬25~50mg 禽10~20mg 【不良反应】牛或绵羊以推荐剂量用药没有明显的不良反应。犬以50mg/kg每天2次用药,可能产生食欲不振。猫可能出现轻微嗜睡、抑郁、厌食等症状,当用本品治疗并殖吸虫病时有拒服的现象。阿苯达唑可引起犬、猫的再生障碍性贫血。妊娠早期使用阿苯达唑,可能伴有致畸胎和胚胎毒性的作用。 【注意事项】本品不应用于产奶牛;也不用于妊娠前期45天。 【休药期】牛14日,羊4日,猪7日,禽4日;弃奶期60小时。 【规格】(1)25mg (2)50mg (3)0.2g (4)0.5g (5)0.1g (6)0.3g 【包装】 【贮藏】密封保存。
2017期间核查计划
2017期间核查计划 一、核查目的 为了确保本公司仪器在两次检定/校准期间,各项性能指标满足开展工作的技术要求,并处于良好的工作状态;标准物质在使用期间保证量值的准确性,使检测分析结果准确可靠。 二、核查依据 1、《检验检测机构资质认定评审准则》 2、本公司质量体系文件 3、本公司年度质量保证计划 三、核查范围 1、检测仪器期间核查 1.1对于使用频率较高或经常携带运输到现场,以及在恶劣环境下使用的仪器设备,在两次正式校准/检定期间,进行1-2次期间核查,包括大气采样器、噪声监测仪、pH 计等,详见附表1检测仪器期间核查计划表。 1.2对于使用频率一般的仪器,在两次正式校准/检定期间,进行1-2次期间核查。包括天平、紫外分光光度计、原子吸收分光光度计等,详见附表1检测仪器期间核查计划表。 2、标准物质期间核查 2.1标准溶液:用固定试剂配制或是用购置标液稀释的标准溶液,如果保存期超过3个月时,应在有效期内根据保存时间进行1-2次期间核查。包括一般无机类、金属类和有机类标准溶液等,详见附表2标准溶液期间核查计划表。 2.2标准样品:有证标准样品、标准气体等在有限期内,应进行1-2次期间核查。详见附表3有证标准物质期间核查表。 四、核查方式和内容 1、检测仪器 期间核查的主要内容包括检测仪器设备的仪表按钮、安全性能、响应时间、检出限、重复性、漂移、示值误差等仪器主要指标。直读式检测仪器可使用标准物质直接进行核查,计算示值误差是否符合技术要求;其他检测仪器还可采取仪器比对、能力验证等方法进行期间核查。
2、标准物质 2.1标准溶液:通过测定有证标准样品来对自配或稀释的标准溶液进行期间核查,同时检查七保存条件,有效期、量值及标识,如果浓度值有明显改变,超出允许误差范围,应重新配制标准溶液。 2.2标准样品:对有证标准样品保存条件、有效期、量值及标识进行期间核查;量值可通过不同时间段,或是不同人员、不同实验室对有证标准物质进行测定,计算测定结果的误差是否在允许范围。 五、核查结论 对检测仪器和标准物质的核查结果进行分析评价,给出正确结论。 六、核查报告 各相关科室于2017年11月提交检测仪器期间核查报告和标准物质期间核查报告,质量管理室提交本公司检测仪器和标准物质期间核查总报告。 2017.1
标准品与对照品的区别
如题,请大家谈谈标准品和对照品有什么不同! 关键词:标准品区别对照品 收藏分享评分 jackcong回复于:2008-10-21 15:32:59 原文由maddog发表: 简单的说: 标准品是有国家法定标准,发出的每一份产品都带有自己的统一编号以及质量控制文件和含量指标的。 对照品多是在某一各行业内约定俗成的一类起参比对照作用的物质~也有自己的编号,但每一个独立包装中没有质控文件及含量指标。 总结得很好,标准品是有国家标准确定制作而成。 对照品可以用标准品,也可以不用标准品。 lhj63回复于:2008-10-21 16:39:07 在药检领域,对照品指能准确测知含量并以此衡量供试品的标准物质,无需量值溯源;标准品指不能准确测知含量,或仍需溯源至国际标准品以获得实际效价的标准物质。 douzi15回复于:2008-10-23 12:30:23 对照品是对相互验证的产品的称呼,两个不同厂家的标准品就可以互称为对照品。wangboxzzjs回复于:2008-10-21 12:18:17 国家药品标准品、对照品系指国家药品标准中用于鉴别、检查、含量测定、杂质和有关物质检查等标准物质,它是国家药品标准不可分割的组成部分。国家药品标准物质是国家药品标准的物质基础,它是用来检查药品质量的一种特殊的专用量具;是测量药品质量的基准;也是做为校正测试仪器与方法的物质标准;在药品检验中,它是确定药品真伪优劣的对照,是控制药品质量必不可少的工具。 目前,中国药品生物制品检定所已能提供各类国家标准物质1242种,其中中药化学对照品288种,对照药材400种,两者占总数的一半以上,国家标准品及生物参考品系指用于鉴别、检查含量或效价测定的标准物质,其制备与标定应符合“生物制品国家标准物质制备和标定规程”要求,并由国务院药品监督管理部门指定的机构分发。企业工作标准品或参考品必须经国家标准品或参考品标化后方能使用。 对照品系指用于生物制品理化等方面测定的特定物质,由生产单位采用与制品生产工艺相同的方法制备。对照品应尽可能与制品原液配方一致,稳定性较差的,可加不含对测定有干扰物质的适宜的稳定剂。对照品由国家药品检定机构审查认可,其标准应不低于制品的质量标准。 (3)标准品、对照品:是指用于鉴别、检查、含量测定的标准物质,均由国务院药品监督管理部门指定的单位制备、标定和供应。标准品系指用于生物测定、抗生素或生化药品中含量或效价测定的标准物质,一国际标准品进行标定;对照品出另有规定外,按干燥进行计算后使用。标准品和对照品均附有使用说明书,质量要求,有效期和装量等。
药店常用黄金搭档
胃食管反流病 [黄金搭配方案] 1.吗丁啉+雷尼替丁 2.吗丁啉+兰索拉唑 3.胃复安+奥美拉唑 急性胃炎 [黄金搭配方案] 1.雷尼替丁+硫糖铝+胃复安 2.吗丁啉+雷尼替丁+胶体果胶铋 3.西咪替丁+正胃片+胃复安+甲硝唑 4.胃苏颗粒+法莫替丁+替硝唑+阿莫西林 5.胶体果胶铋+654-2+甲硝唑+雷尼替丁 慢性胃炎 [黄金搭配方案] 1.枸橼酸铋钾+雷尼替丁+阿莫西林 2.硫糖铝+雷尼替丁 3.吗丁啉+硫糖铝+奥美拉唑 4.枸橼酸铋钾+雷尼替丁+克拉霉素 5.依托必利+达喜+阿莫西林+奥硝唑 6.丽珠得乐+庆大霉素普鲁卡因+莫沙比利 消化性溃疡 [黄金搭配方案] 1.丽珠得乐+克拉霉素+阿莫西林+奥美拉唑 2.达喜+兰索拉唑+替硝唑+硫酸庆大霉素片 3.蒙脱石散+维U颠茄铝胶囊Ⅲ+阿莫西林+甲硝唑 4.吗丁啉+维U颠茄铝胶囊Ⅲ+阿莫西林+克拉霉素 功能性消化不良(FD) [黄金搭配方案] 1.西沙必利+雷尼替丁+胃蛋白酶 2.吗丁啉+雷尼替丁+乳酸菌素片 3.654—2+乳酶生+安胃片 溃疡性结肠炎 [黄金搭配方案] 1.丽珠肠乐+柳氮磺胺吡啶 2.柳氮磺胺吡啶+肠炎灵+甲硝唑 慢性结肠炎 [黄金搭配方案] 1.丽珠肠乐+穿心莲软胶囊
2.双黄消炎片+甲硝唑 3.丽珠肠乐+思密达+双黄消炎片 4.阿莫西林+穿心莲软胶囊+654—2 5.甲硝唑+穿心莲软胶囊+麻仁丸 慢性腹泻 [黄金搭配方案] 1.藿香正气丸+盐酸小檗bò碱(黄连素) 2.蒙脱石散(思密达、必奇或易宁)+妈咪爱+穿心莲软胶囊 慢性胰腺炎(CP) [黄金搭配方案] 1.多酶片+雷尼替丁+布洛芬缓释片 2.金施尔康+多酶片+雷尼替丁+654—2 慢性菌痢 [黄金搭配方案] 1.头孢氨苄甲氧苄啶+乳酶生 2.小檗碱甲氧苄啶或+乳酶生+灌肠剂 脂肪肝 [黄金搭配方案] 1.复方益肝灵片+熊去氧胆酸 2.益肝灵+熊去氧胆酸 高血压病 [黄金搭配方案] 1.引达帕胺片+马来酸依那普利 2.引达帕胺片+苯磺酸氨氯地平(高适宁) 3.倍他乐克+马来酸依那普利 4.马来酸依那普利+硝苯地平或苯磺酸氨氯地平(高适宁)或非洛地平 心绞痛 [黄金搭配方案] 1.鲁南欣康+倍他乐克或普萘洛尔+阿司匹林肠溶片+银杏叶片 2.鲁南欣康+心痛定或恬尔心+阿司匹林肠溶片 3.硝酸甘油+阿司匹林肠溶片+心通口服液 4.复方丹参滴丸+阿司匹林肠溶片+硝酸异山梨脂+倍他乐克 慢性心功能不全 [黄金搭配方案] 1.鲁南欣康+氢氯噻嗪+拉美亚/马来酸依那普利 2.倍他乐克+鲁南欣康+氢氯噻嗪+安体舒通+地高辛
实验室标准物质期间核查计划(附表)
实验室标准物质期间核查计划 在环境监测领域,标准物质的期间核查应当有统一、细化、规范的操作准则。中国实验室国家认可委员会颁布了《检测和校准实验室认可准则》(ISO/IEC17025:2005),对通过实验室认可的环境监测实验室提出了标准物质期间核查的评审要求,明确规定实验室应定期对标准物质进行核查,以保持其校准状态的置信度。 期间核查是在相邻的两次校准(或检定)期间内进行核查,以验证标准物质(或设备)是否处于校准状态,确保分析结果的质量。有证标准物质还能定期用于内部质量控制。 为规范管理章程,减小实验偏差,现制定期间核查计划。此计划对核查频度、核查内容等进行合理安排,使期间核查工作具有较强的可操作性。核查对象包括有证标准物质、标准样品(或质控样),和已开封正在使用的标准物质储备液、标准气体、固体标准物质等。 1. 职责 1.1 标准物质管理员:负责严格按照以下核查规程对标准物质和由标准物质配制而成的标准储备液进行期间核查,并做好记录。 1.2 实验室负责人:负责配合期间核查的进行。 1.3 管理人员:负责定期监督期间核查,并做好记录。 2. 核查规程 2.1 核查前的准备
2.1.1 查询所使用的标准物质是否为有证标准物质或能够溯源到国家 基准的物质,满足时核查才有意义。 2.1.2 建立《标准物质入库登记表》(附件1),内容包括标准物质名称及编号、入库数量、购置日期、有效日期、浓度不确定度。 2.1.3 查询标准物质在保存条件下的物理性质,包括状态、颜色、气味、腐蚀性、毒性等,以备检查时作为参考。 2.2 核查频度 根据标准物质的有效期、对检测结果的影响程度确定核查频度: 2.2.1 有效期在6个月以下、经常使用、对检测结果影响较大的一些标准物质实行每季度一核查。如绘制工作曲线用的系列标准溶液、用于修正工作曲线的偏离的标准物质。 2.2.2 有效期在6—12个月、不常使用的标准物质实行每半年一核查。 2.2.3 有效期在12个月及以上、稳定性较好的标准物质实行每次使用前核查。 2.2.4 只用于加标回收试验的标准物质,确定在有效期内的,仅在实验前核查其不确定度。 2.3 核查项目 2.3.1 检查标准物质的包装是否完整、是否在有效期内、保存条件是否符合要求。依据物质的状态查看固体是否变色、液体是否澄清、溶液是否有沉淀等,并填写《期间核查记录》(附件2) 2.3.2 检查由标准物质配制而成的标准储备液的容器是否有损伤、是否在有效期内、保存条件是否符合要求、溶液是否被污染等。 2.4核查结论 从国家标准物质中心等单位购买的有证标准物质,在其有效期内按照要
标准品及对照品管理制度
重庆多普泰制药有限公司GMP文件Array 分发范围
目的:规定标准品及对照品的管理制度。 范围:适用于标准品及对照品的管理。 责任:物料供应部、质量控制室全体人员、质量管理部部长。 相关术语: 相关文件: 程序: 1.标准品及对照品的采购计划 1.1质量控制室主管根据企业生产品种综合计划(提前三个月)做出各品种检验所需标准品及对照品的计划。申购内容包括:标准品及对照品的名称、规格、数量、用途。由于其价格较贵,所以计划量要合理,做到既不浪费,又保证正常的检验工作,报质量管理部部长审核,再经厂部负责人批准。 2. 标准品及对照品的购买 2.1 标准品及对照品的采购计划经质量管理部部长审核,厂部负责人批准后,交物料供应部进行采购。 2.2 标准品及对照品的采购一般由采购员向中国药品生物制品检定所邮购。 2.3 因某种原因临时需要使用的标准品及对照品,经质量管理部部长审核,再经厂部负责人批准,可临时申购。 3. 标准品及对照品的接收 3.1 收到标准品及对照品,检查外包装是否完好、洁净、封口是否严密、标签是否完好、清楚。 3.2 复核与申购单的一致性,确保准确无误。 3.3 填写标准品及对照品的入库记录。内容包括:名称、规格、数量、购进日期、来源等。 4. 标准品及对照品的贮存 4.1 不同的标准品及对照品应根据其理化性质、贮存要求的不同选择适宜的贮存条件。 5. 标准品及对照品的管理 5.1 标准品及对照品的管理人员应由质量控制室指定专人负责管理。 5.1.1 管理人员每日(工作日)检查1次温度、湿度并记录。凡不符合规定要求的,应及
时采取必要措施并记录。 6. 标准品及对照品的发放 6.1 管理人员负责发放。 6.1.1 领用人员填写领用记录。内容包括:品名、规格、数量、领用日期、领用者。 6.1.2 管理人员检查即将发放的标准品与领用记录登记品种的一致性,无误后发放。 7. 标准品及对照品的剩余退库和销毁 7.1 标准品及对照品按需取用,已取出的标准品严禁倒回原瓶中。 7.2 剩余的标准品及对照品需密闭并按照标准品及对照品的储存要求进行保存。 7.3 超过有效期的标准品及对照品应申请销毁。 7.3.1 销毁申请:由管理员填写销毁申请单。内容:品名、规格、数量、销毁原因、申请人、日期等。 7.3.1 质量控制室经理根据销毁原因做必要的调查和鉴定试验,做出拒绝或批准决定并签名。质量管理部部长审核确认。 7.3.2 批准销毁的,对环境无污染的,直接处理;腐蚀性强的,经规定的程序处理;毒性强的、按毒品销毁办法执行,执行销毁应由质量保证处指派监督执行。 7.3.3 销毁应填写销毁记录,内容同销毁申请单,销毁人、监督执行人、分别签名以示负责。 8. 管理员有权对标准品及对照品的领用用途及用量等问题提出质疑,有权复核领用者的每次使用量,如果不符合要求,管理员有权拒绝其领用,并上报。 9. 任何人在使用标准品及对照品时不得人为浪费,一经发现,即按购进价的200%处以罚款。 10. 除管理员提供给本公司技术人员外,其余未经厂部负责人及质量管理部部长同意,任何人不得提供给他人使用或变卖到其他地方。违者一经发现,将按购进价的5倍处以罚款,并通报批评。情节严重者将予以开除。 记录 记录名称保存部门保存时间 附件 本规程附件四份:
2020版:苯达莫司汀治疗淋巴瘤中国专家共识(完整版)
2020版:苯达莫司汀治疗淋巴瘤中国专家共识(完整版) 摘要 苯达莫司汀是兼具烷化剂功能和抗代谢功能的双功能氮芥衍生物,在多种病理类型的淋巴瘤中均显示出很好的疗效。多项研究显示苯达莫司汀单药或联合用药可以有效治疗惰性非霍奇金淋巴瘤、慢性淋巴细胞白血病、套细胞淋巴瘤等。2008年,美国食品药品监督管理局批准苯达莫司汀用于治疗利妥昔单抗耐药的惰性非霍奇金淋巴瘤和慢性淋巴细胞白血病。然而在我国,苯达莫司汀于2018年才获得批准上市,临床医师应用经验较少。基于苯达莫司汀在我国的临床试验结果,结合国内外相关文献,共识专家组成员讨论制定了苯达莫司汀治疗淋巴瘤中国专家共识(2020年版)。 淋巴瘤是我国最常见的淋巴造血系统恶性肿瘤之一。最新流行病学资料显示,2016年我国霍奇金淋巴瘤(HL)发病率为0.46/10万,非霍奇金淋巴瘤(NHL)发病率为4.29/10万,且发病率逐年升高[1]。苯达莫司汀作为淋巴瘤治疗的重要药物,于2008年和2010年在美国和欧盟获得批准,并于2018年12月获得中国国家药品监督管理局(NMPA)的上市批准。 1 苯达莫司汀的药理特性 1.1 化学结构和作用机制 苯达莫司汀的化学结构是1-甲基-5-β-氯乙基的丁酸盐酸盐。苯达莫司汀是氮芥的双功能衍生物,包括氮芥基团(烷化剂的功能基团)、苯并咪
唑环(起嘌呤类似物的抗代谢作用)和正丁酸侧链(增加水溶性)。苯达莫司汀通过烷基化DNA,使其单链或双链发生纵横交联,干扰DNA合成和修复,从而发挥抗肿瘤细胞毒性作用。 1.2 药代动力学 苯达莫司汀的药代动力学在动物模型(大鼠)和人体中非常相似,半衰期较短(<1 h)。主要经肝脏代谢,CYP1A2催化的N-脱烷基化和γ-羟基化是其主要的代谢途径。 2 苯达莫司汀治疗淋巴瘤的关键临床研究 2.1 慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL) 2.1.1 复发难治患者 一项Ⅱ期临床试验纳入78例复发难治CLL患者,其中包括22例氟达拉滨耐药患者和14例17p缺失患者,给予苯达莫司汀+利妥昔单抗方案(BR方案)(苯达莫司汀剂量为70 mg/m2×2 d)治疗[2]。结果显示总反应率(ORR)为59.0%,其中氟达拉滨耐药患者的ORR为45.4%,氟达拉滨敏感患者的ORR为60.5%;11q缺失、第12染色体三体、17p 缺失和无IGHV突变患者的ORR分别为92.3%、100.0%、7.1%和58.7%;中位无进展生存(PFS)时间为14.7个月;严重感染的发生率为12.8%;3~4级中性粒细胞减少、血小板减少和贫血的发生率分别为23.1%、28.2%和16.6%。 2.1.2 初治患者 上海交通大学医学院附属瑞金医院沈志祥教授团队牵头开展的一项多中心临床试验纳入144例初治CLL患者,随机给予苯达莫司汀或苯丁酸
盐酸苯海索片
盐酸苯海索片说明书 【药品名称】 通用名:盐酸苯海索片 曾用名: 商用名: 英文名:Benzhexol Hydrochloride Tablets 汉语拼音:Yansuan Benhaisuo Pian 本品主要成分为盐酸苯海索,其化学名称为:α-环己基-α-苯基-1-哌啶丙醇盐酸盐。 其结构式为: N O H C 20H 31NO ·HCl 337.93 【性状】 本品为白色片。 【药理毒理】 本品为中枢抗胆碱抗帕金森病药,作用在于选择性阻断纹状体的胆碱能神经通路,而对外周作用较小,从而有利于恢复帕金森病患者脑内多巴胺和乙酰胆碱的平衡,改善患者的帕金森病症状。 【药代动力学】 口服后吸收快而完全,可透过血脑屏障,口服1小时起效,作用持续6~12小时。服用量的56%随尿排出,肾功能不全时排泄减慢,有蓄积作用,并可从乳汁分泌。 【适应症】 用于帕金森病、帕金森综合征。也可用于药物引起的锥体外系疾患。 【用法用量】 口服 帕金森病、帕金森综合征,开始一日1~2mg , 以后每3~5日增加2mg,
至疗效最好而又不出现副反应为止,一般一日不超过10 mg ,分3~4次服用,须长期服用。极量一日20mg。药物诱发的锥体外系疾患,第一日2~4mg,分2~3次服用,以后视需要及耐受情况逐渐增加至5~10 mg。 老年患者应酌情减量。 【不良反应】 常见口干、视物模糊等,偶见心动过速、恶心、呕吐、尿潴留、便秘等。长期应用可出现嗜睡、抑郁、记忆力下降、幻觉、意识混浊。 【禁忌症】 青光眼、尿潴留、前列腺肥大患者。 【注意事项】 【孕妇及哺乳期妇女用药】 慎用。 【儿童用药】 慎用。 【老年患者用药】 老年人长期应用容易促发青光眼。伴有动脉硬化者,对常用量的抗帕金森病药容易出现精神错乱、定向障碍、焦虑、幻觉及精神病样症状。应慎用。【药物相互作用】 1、本品与乙醇或其他中枢神经系统抑制药合用时,可使中枢抑制作用加强。 2、本品与金刚烷胺、抗胆碱药、单胺氧化酶抑制药帕吉林及丙卡巴肼合用时,可加强抗胆碱作用,并可发生麻痹性肠梗阻。 3、本品与单胺氧化酶抑制剂合用,可导致高血压。 4、本品与制酸药或吸附性止泻剂合用时,可减弱本品的效应。 5、本品与氯丙嗪合用时,后者代谢加快,可使其血药浓度降低。 6、本品与强心苷类合用可使后者在胃肠道停留时间延长,吸收增加,易于中毒。 【药物过量】 中毒症状:超剂量时,可见瞳孔散大、眼压增高、心悸、心动过速、排尿困难、无力、头痛、面红、发热或腹胀。有时伴有精神错乱、谵妄、妄想、幻
阿苯达唑伊维菌素预混剂说明书
兽用非处方药 【使用说明书】 【兽药名称】通用名称:阿苯达唑伊维菌素预混剂 商品名称:无 英文名称:Albendazole and Ivermectin Premix 汉语拼音:Abendazuo Yiweijunsu Yuhunji 【主要成分】阿苯达唑、伊维菌素。 【性状】本品为黑色粉末。 【药理作用】抗寄生虫药。阿苯达唑具有广谱驱虫活性,对线虫、绦虫、吸虫有较强的驱杀作用。其作用机理是通过与蠕虫体内的微管蛋白结合, 阻止其与α-微管蛋白进行多聚化组成微管,从而影响蠕虫体内的 有丝分裂、蛋白装配及能量代谢等细胞繁殖过程。伊维菌素对体内 外寄生虫特别是节肢昆虫和体内线虫具有良好驱杀作用,主要用于 驱除猪的胃肠道线虫、肺线虫和体外寄生虫。其驱虫机理在于促进 突触前神经元释放γ-氨基丁酸(GABA),从而打开GABA介导的氯 离子通道。氯离子流能降低细胞膜阻抗,引起突触后膜静止电位轻 微的去极化,从而干扰神经肌肉间的信号传递,使虫体松弛麻痹, 导致虫体死亡或被排出体外。 【适应证】用于驱除猪体内线虫、吸虫、绦虫及体外寄生虫。 【用法与用量】以本品计。混饲:每1000kg饲料,猪1000g。 【不良反应】本品主要成分阿苯达唑具有致畸胎作用。 【注意事项】1.母猪妊娠期前45日慎用。 2.伊维菌素对虾、鱼及水生生物有剧毒,残留药物的包装及容器切勿污染水源。【休药期】猪28日。 【规格】100g:阿苯达唑6g+伊维菌素0.25g 【包装】500g/袋 【贮藏】遮光,密闭保存。 【有效期】2年 【批准文号】兽药字(2015)221026205 【执行标准】农业部1435号公告《阿苯达唑伊维菌素预混剂 》质量标准 【生产日期】见喷码 【生产批号】见喷码 【有效期至】见喷码
新型HDAC抑制剂—苯达莫司汀化合物NL-101的抗白血病作用及机制研究
新型HDAC抑制剂—苯达莫司汀化合物NL-101的抗白血病作用及 机制研究 研究目的:开发具有生物活性高、毒性低等特点的新药一直是肿瘤治疗研究领域的热点,其中分子合成药物由于能够克服传统化疗药物的缺陷而备受关注。NL-101是一种连接组蛋白去乙酰化酶抑制剂SAHA以及烷化剂苯达莫司汀的活性基团而合成的化合物。 本文探讨这种化合物在体外和体内对于白血病细胞的杀伤作用以及相关分子机制。研究方法:采用MTT法检测NL-101、SAHA和苯达莫司汀对多种白血病细胞系增殖能力的影响,用SPSS软件计算半数抑制剂量(ICso),用CompuSyn软件计算SAHA和苯达莫司汀的药物联合指数(CI);用流式细胞术分析药物处理后细胞的周期和凋亡变化;Western blot检测药物处理后组蛋白H3乙酰化水平,以及蛋白凋亡和DNA损伤相关蛋白包括y-H2AX、PARP、caspase-3、Bax、Bcl-2和Bcl-xL的表达;Ficoll法分离病人原代细胞,瑞氏染色观察细胞经药物处理后的形态改变。 体内实验部分,通过逆转录病毒感染构建共表达AML1-ETO和C-KIT突变的移植白血病小鼠模型,给予NL-101、苯达莫司汀和SAHA注射治疗,动态监测小鼠体重以及体内白血病细胞浸润情况,记录各组小鼠生存期。研究结果:在体外实验中:(1)苯达莫司汀和SAHA在白血病细胞中具有协同作用。 (2)NL-101对多种白血病细胞系的生长有明显的抑制作用,其中Kasumi-1和NB4细胞的敏感性最为显著;NL-101对正常细胞系的作用较小,显示出对肿瘤细胞作用的选择性;NL-101的抗增殖能力显著高于苯达莫司汀,与SAHA没有显著差异。(3)NL-101导致白血病细胞周期阻滞于S期,以及显著的细胞凋亡。
(2020年整理)期间核查计划.doc
XXXX期间核查计划 一、核查目的 为了确保本公司仪器在两次检定/校准期间,各项性能指标满足开展工作的技术要求,并处于良好的工作状态;标准物质在使用期间保证量值的准确性,使检测分析结果准确可靠。 二、核查依据 1、《检验检测机构资质认定评审准则》 2、本公司质量体系文件 3、本公司年度质量保证计划 三、核查范围 1、检测仪器期间核查 1.1对于使用频率较高或经常携带运输到现场,以及在恶劣环境下使用的仪器设备,在两次正式校准/检定期间,进行1-2次期间核查,包括大气采样器、噪声监测仪、pH 计等,详见附表1检测仪器期间核查计划表。 1.2对于使用频率一般的仪器,在两次正式校准/检定期间,进行1-2次期间核查。包括天平、紫外分光光度计、原子吸收分光光度计等,详见附表1检测仪器期间核查计划表。 2、标准物质期间核查 2.1标准溶液:用固定试剂配制或是用购置标液稀释的标准溶液,如果保存期超过3个月时,应在有效期内根据保存时间进行1-2次期间核查。包括一般无机类、金属类和有机类标准溶液等,详见附表2标准溶液期间核查计划表。 2.2标准样品:有证标准样品、标准气体等在有限期内,应进行1-2次期间核查。详见附表3有证标准物质期间核查表。 四、核查方式和内容 1、检测仪器 期间核查的主要内容包括检测仪器设备的仪表按钮、安全性能、响应时间、检出限、重复性、漂移、示值误差等仪器主要指标。直读式检测仪器可使用标准物质直接进行核查,计算示值误差是否符合技术要求;其他检测仪器还可采取仪器比对、能力验证等方法进行期间核查。
2、标准物质 2.1标准溶液:通过测定有证标准样品来对自配或稀释的标准溶液进行期间核查,同时检查七保存条件,有效期、量值及标识,如果浓度值有明显改变,超出允许误差范围,应重新配制标准溶液。 2.2标准样品:对有证标准样品保存条件、有效期、量值及标识进行期间核查;量值可通过不同时间段,或是不同人员、不同实验室对有证标准物质进行测定,计算测定结果的误差是否在允许范围。 五、核查结论 对检测仪器和标准物质的核查结果进行分析评价,给出正确结论。 六、核查报告 各相关科室于XXXX年11月提交检测仪器期间核查报告和标准物质期间核查报告,质量管理室提交本公司检测仪器和标准物质期间核查总报告。 XXXX.1
标准品、工作对照品标准管理规程
1.目的 本管理规程规定了检验分析工作中使用的标准品、工作对照品的基本要求和管理办法,以确保检验、分析的精准,从而保证产品的质量。 2.适用围 本规程适用于检验分析所用标准品、工作对照品。 3.职责 3.1.QC主管:负责制定标准品、对照品的购买计划,负责标准品、对照品的接收、发 放、保管工作。 4.容 4.1.标准品、对照品应由QC主管负责管理,该人员应具有一定药学或分析专业知识, 熟悉标准品、对照品的性质和贮存条件。 4.2.购买 4.2.1.标准品、对照品 一般应在每年的四季度由QC主管组织本部门相关人员,依据下年度的生产计划预测标准品、对照品的用量,制定采购计划。采购计划报质量管理部部长批准后,即可组织购买。 每年的三季度,可根据生产的实际情况提出标准品、对照品的追加计划。 4.2.2.国购买一般到当地药检所或中检所购买或邮购;国外购买可在当地代理处购 买或直接求购。 4.2.3.标准品、对照品购买单应标明名称、数量、分子式、分子量及结构式等必要信 息。 4.3.标准品、对照品的接收 4.3.1.购回后,QC主管应认真核对名称,检查外包装、标签完好、清楚。复核与购买 单的一致性。 4.3.2.准确无误后填写对照品入库.使用记录。容:对照品购进日期、名称、编号、 批号、购进数量及来源。(见附表1) 4.4.工作对照品 4.4.1.工作对照品是指日常检验用的标准品(对照品),其来源可以是自制或市售的。 4.4.2.自制或购买来的样品,首先应按照法定标准(或注册标准)进行全检;全检合
格的,方可被选为工作(标准品)对照品。 4.4.3.标定采用双人标定,标定方法一般采用与该标准品(对照品)对应样品的药典 标准(或注册标准)中含量项下的方法,标定时,只标定其含量。 4.4.3.1.标定和复标应分别做三分平行操作,相对误差≤0.1%;标定与复标两者之间 的相对误差≤0.1% 。 4.4.3.2.工作对照品(标准品)的最终标定含量以6份含量(含初标与复标)的均值(有 关水分、残留溶剂或干燥失重均不带入结果的计算)计。 4.4.4.标定完毕后,将标定的工作对照品(标准品)分装于适当的容器中,密封并贴上 标签(标明品名、批号、标定含量、数量、标定日期、有效期)。 4.4. 5.出具工作对照品(标准品)的标定报告;报告经质量负责人批准后,工作对照品 (标准品)方可用于实际检验工作中。 4.5.标准品、对照品的贮存期 标准品、对照品贮存期限以新的标准品购进上年度标准品到贮存期;工作对照品(标准品)的标定有效期为一年,有效期到期后可以进行再次标定,但累计有效期不得超过工作对照品(标准品)其本身的有效期。 4.4 贮存管理 4.4.1.标准品、对照品一般置于干燥器或冰箱中有序存放,特殊品种应按其规定妥善保 存。 4.4.2.标准品、对照品用多少取多少,已取出的标准品、对照品严禁倒回原瓶中。及 时填写领用记录。(见附表1) 4.5.使用和退回 检验人员应按需领取标准品、对照品。剩余的标准品、对照品应密封好,方可放回原处并填写领用记录。
化疗药外渗
化疗药外渗后果很严重紧急时刻你需要掌握这些 外渗指任何液体偶尔泄漏至周围组织的过程。 就癌症治疗而言,外渗指化疗药物浸润至静脉或动脉穿刺部位周围的皮下或真皮下组织。药物外渗产生的损害分为发疱性损害、非发疱性损害和刺激性损害,具体见下表,根据外渗药物产生的不同损害对药物进行分类。 一些产生发疱性损害的药物进一步分为二类:DNA 结合型和非 DNA 结合型。Allwood 将药分为发疱性、去角质性、刺激性、炎症性和中性。 发疱性-DNA 结合型烷化剂:氮芥、苯达莫司汀 蒽环类药物:阿霉素、柔红霉素、表阿霉素、去甲氧柔红霉素其它:放线菌素、丝裂霉素、米托蒽醌 发疱性-非 DNA 结合型生物碱:长春新碱、长春碱、长春地辛、长春瑞滨紫杉类:多西他赛、紫杉醇 其它:曲贝他啶 刺激性烷化剂:卡莫司汀、异环磷酰胺、链脲菌素、达卡巴嗪、马法兰蒽环类:脂质体阿霉素、脂质体柔红霉素、米托蒽醌 拓普异构酶抑制剂:足叶乙甙、替尼泊苷、伊立替康、拓普替康; 其它:伊沙匹隆 抗代谢类:氟脲嘧啶 铂盐:卡铂、顺铂、奥沙利铂 非发疱性三氧化二砷、左旋门冬酰胺酶、博莱霉素、硼替佐米、克拉屈滨、阿糖胞苷、磷酸依托泊苷、吉西他滨、氟达拉滨、干扰素、白介素 2、 氨甲喋呤、单克隆抗体、培美曲塞、雷替曲塞、替西罗莫司、环磷酰 胺 化疗药外渗发生率 由于缺乏登记注册,关于药物外渗或浸润发生率的数据匮乏,不同文献报告的发生率在 0.01%~7% 之间。有数据显示由于输注程序的改善、早期识别药物外渗以及治疗技术的培训使得外渗发生率正在下降。一项单中心回顾性研究证实
2002 年总的外渗发生率较 15 年前降低了 10 倍。关于中心静脉装置(CVAD)的外渗数据非常有限。 风险因素 明确外渗的风险因素对将外渗风险降至最低至关重要。在外渗风险增加时要积极做好预防措施或是使用 CVAD。风险因素分为患者相关的和治疗程序有关的。 与患者相关的因素包括:(1)小血管;(2)多次化疗导致血管硬化;(3)突出但移动的血管,如老年人的血管;(4)已有疾病削弱局部循环;(5)易出血、血管通透性增加或凝血功能异常;(6)肥胖;(7)感觉迟钝;(8)交流困难;(9)输液时间延长。 与治疗程序相关因素包括:(1)未培训或经验不丰富的工作人员;(2)多次尝试;(3)置管位置不佳;(4)静注;(5)压力大;(6)装置的选择;(7)导管固定不佳;(8)CVAD 不佳。 预防 系统地施行细致的、标准化的、有证据支持的操作技术可以预防大多数外渗,为了使外渗风险降至最低,参与细胞毒药物输注与治疗的人员必需接受预防方案的培训。如果外渗发生,最重要的是要知道损害程度与药物类型和浓度、外渗位置以及外渗持续时间有关。 具体措施如下: 1. 最恰当的插管位置:(1)前臂大静脉;(2)避免跨越关节;(3)避免手腕内侧和下肢;(4)避免肘窝、手背的静脉,尤其使用发疱性药物时;(5)不宜在有淋巴水肿处插管;(6)行乳房切除侧置管仍有待商榷。 2. 预防措施:(1)输注发疱性药物时不使用蝶形针;(2)应当使用有弹性的导管;(3)输入发疱性药物达 12-24 小时者强烈推荐中心静脉置管。 3. 正确操作程序:(1)置管后检查回流,回冲 10 毫升生理盐水,检查有无外渗征象;(2)输注不同药物之间要冲 10-20 毫升盐水;(3)注入药物前常规检查回流,静注药物时要随时检查回流;(4)随时注意插管位置并检查有无肿胀、疼痛、发红、输注速度下降;(5)发疱性药物静注时应与能快速输注的液体同时使用。 患者应该知道静脉使用任何化疗药物出现异常感觉、症状和体征变化时应当报告,以便医护人员及早发现外渗征兆,尤其使用发疱性药物时。 出现如下比较特殊的症状体征时一定要注意外渗的可能:初起最常见的症状是刺痛感、烧灼感、不舒服或疼痛以及肿胀、注射部位发红,后期症状包括起疱、坏死和溃疡。与外渗相关的体征包括没有回血、静注药物时有阻力感或是输液
标准品与对照品管理程序
标准品与对照品管理程序 1.范围。 检验用标准品、对照品的管理。 2.职责 标准品管理员:按标准品与对照品管理程序进行管理。 QC室负责人:监督、检查执行情况。 3.内容 3.1.标准品(对照品)保管员:药品分析实验室必须设专人负责标准品的管理,该人 员应由具有一定药学或分析专业知识,熟悉标准品的性质和贮存条件。 3.2.标准品和对照品的年度计划:标准品管理员每年第四季度根据企业下年度生产品 种综合计划,作出品种检验用标准品(对照品)计划和文字说明,报QC室负责人批准。内容包括:标准品(对照品)名称、规格、数量、库存量、检验品种名称。由于标准品价格较贵,所以计划量要合理,做到既不浪费,又保证正常的检验工作。 3.2.1.标准品(对照品)的购买 3.2.2.标准品(对照品)使用计划批准后,按《物资采购管理程序》规定进行购买。 3.2.3.国内购买一般到当地药检所或中国药品生物制品检定所直接购买或邮购。 3.2. 4.请购单应尽量注明分子式、分子量及结构式,标准品(对照品)编码,以免发生 误购。 3.3.标准品(对照品)的接收 3.3.1.标准品、对照品购回后,检查外包装完好、封口严密、标签完好、清楚。 3.3.2.复核与请购单的一致性,准确无误。 3.3.3.对所买标准品、对照品编号(此编号要独一无二,便于管理)。 3.3. 4.填写标准品台帐,内容包括名称、规格、数量、购进日期、编号等。 3.4.标准品(对照品)的贮存 3.4.1.不同的标准品、对照品应根据其理化性质、贮存要求的不同选择适宜的贮存环境 和条件,分别置于规定的位置。 3.4.2.贮存环境:贮存室应尽量设置空调设施,保证室内阴凉、干燥、避光、通风,温
