培优化学反应的速率与限度辅导专题训练附答案

培优化学反应的速率与限度辅导专题训练附答案
一、化学反应的速率与限度练习题(含详细答案解析)
1.某温度下在2L密闭容器中,3种气态物质A、B、C的物质的量随时间变化曲线如图。
(1)该反应的化学方程式是________________________
(2)若A、B、C均为气体,10min后反应达到平衡,
①此时体系的压强是开始时的________倍。
②在该条件达到平衡时反应物的转化率为________%(计算结果保留1位小数)
(3)关于该反应的说法正确的是_________。
a.到达10min时停止反应
b.在到达10min之前C气体的消耗速率大于它的生成速率
c.在10min时B气体的正反应速率等于逆反应速率
【答案】2C A+3B 9
7
或1.29或1.3 66.7% b、c
【解析】
【分析】
(1)由图可知,C是反应物,物质的量分别减少2mol,A、B生成物,物质的量增加
1mol、3mol,物质的量变化比等于系数比;
(2)①体系的压强比等于物质的量比;
②转化率=变化量÷初始量×100%;
(3)根据化学平衡的定义判断;
【详解】
(1)由图可知,C是反应物,物质的量减少2mol,A、B生成物,物质的量分别增加
1mol 、3mol,物质的量变化比等于系数比,所以该反应的化学方程式为:2C A+3B;(2)①体系的压强比等于物质的量比,反应前气体总物质的量是7mol、反应后气体总物
质的量是9mol,所以此时体系的压强是开始时的9
7
倍;
②转化率=变化量÷初始量×100%=2÷3×100%=66.7%;
(3)a.根据图象,到达10min时反应达到平衡状态,正逆反应速率相等但不为0,反应没有停止,故a错误;
b.在到达10min之前,C的物质的量减少,所以 C气体的消耗速率大于它的生成速率,故b 正确;
c.在10min时反应达到平衡状态,所以B气体的正反应速率等于逆反应速率,故c正确;选bc。
【点睛】
本题考查化学反应中物质的量随时间的变化曲线、以及平衡状态的判断,注意根据化学平衡的定义判断平衡状态,明确化学反应的物质的量变化比等于化学方程式的系数比。
2.新型材料 AIN 应用前景广泛,对其制备过程的研究成为热点。
(1)将物质的量均为a mol 的 Al2O3与N2充入恒温恒容密闭容器中,控制温度发生反应:
2Al2O3(s)+2N2(g) 4AlN(s) +3O2(g) △H>0。
①下列可作为反应达到平衡的判据是_________(填序号)。
A.固体的质量不再改变
B.2v正(N2)=3v逆(O 2)
C.△H不变
D.容器内气体的压强不变
E.N2分子数与 O2分子数比为 2:3
②在起始压强为p的反应体系中,平衡时 N2的转化率为α,则上述反应的平衡常数
K p__________(对于气相反应,用某组分 B 的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作K p,如p(B) =p总·x(B) ,p总为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
③为促进反应的进行,实际生产中需加入焦炭,其原因是____________。
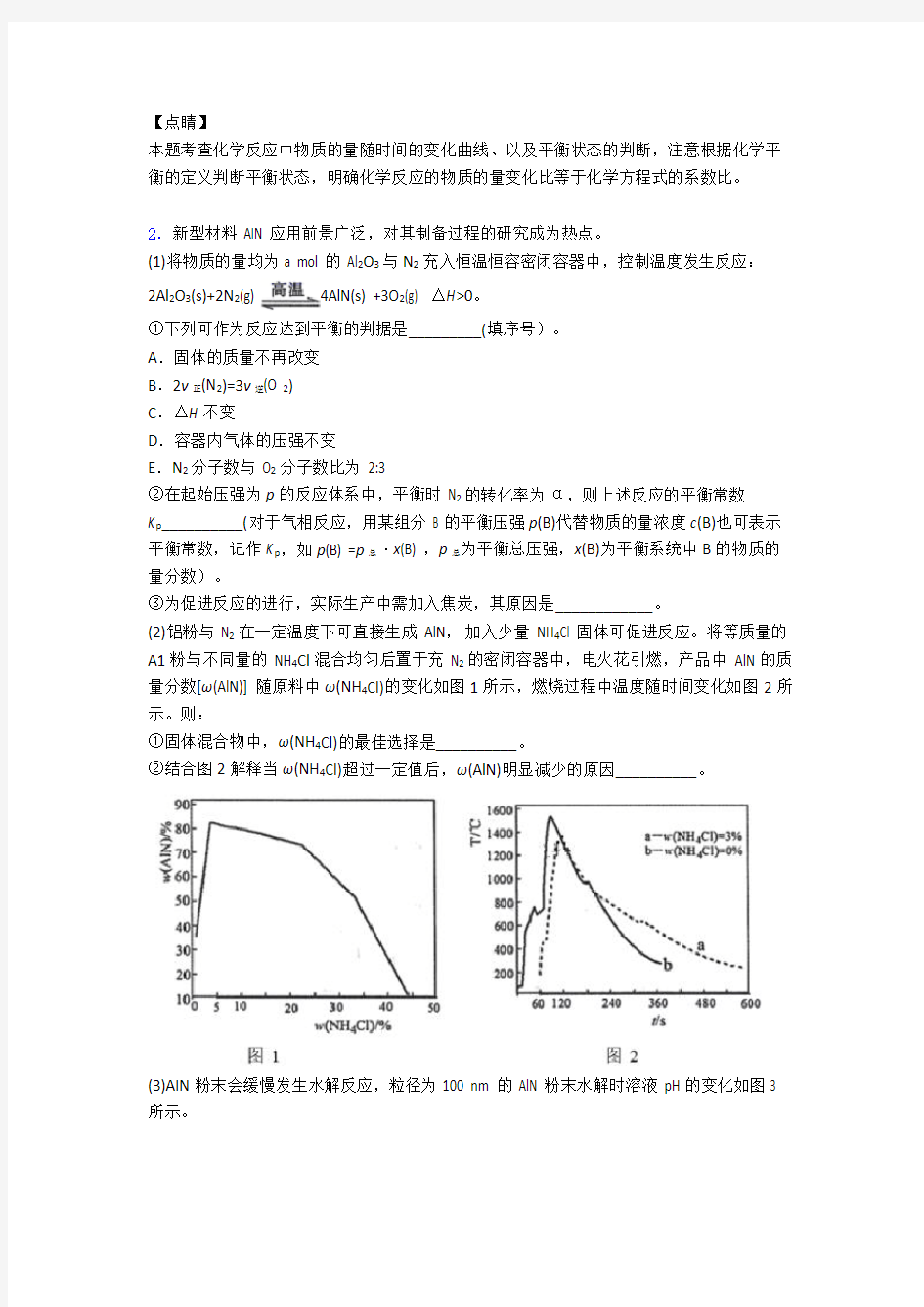
(2)铝粉与 N2在一定温度下可直接生成 AlN,加入少量 NH4Cl 固体可促进反应。将等质量的A1粉与不同量的 NH4Cl混合均匀后置于充 N2的密闭容器中,电火花引燃,产品中 AlN的质量分数[ω(AlN)] 随原料中ω(NH4Cl)的变化如图1所示,燃烧过程中温度随时间变化如图2所示。则:
①固体混合物中,ω(NH4Cl)的最佳选择是__________。
②结合图2解释当ω(NH4Cl)超过一定值后,ω(AlN)明显减少的原因__________。
(3)AIN粉末会缓慢发生水解反应,粒径为100 nm 的 AlN 粉末水解时溶液 pH的变化如图3 所示。
①AlN 粉末水解的化学方程式是______________。
②相同条件下,请在图3中画出粒径为40 nm 的AlN粉末水解的变化曲线____________。
【答案】AD
3
2
(1.5α)
(1-α)
p消耗O2、提供能量,均能使平衡向右移动 3 % NH4Cl分解吸热
造成温度降低,不利于Al 与N2反应 AlN + 4H2O Al(OH)3 + NH3?H2O
【解析】
【分析】
(1) ①根据反应达到平衡后,正逆反应速率,各成分的浓度不变及由此衍生的其它物理量进行分析;
②平衡时N2的转化率为α,由于反应物中只有N2是气体,所以起始压强p即为起始时N2的分压,列三段式求K p;
③碳在氧气中燃烧放出热量,焦炭既可以消耗氧气,使生成物浓度降低,又可以提供热量,这两方面的作用都可以使平衡右移;
(2)①根据图像分析,当ω(NH4Cl)=3%时,ω(AlN)最大;
②从图2可以看出,反应过程中温度会降低。ω(NH4Cl)=3%时的温度比ω(NH4Cl)=1%时的温度降低得更多。这是因为NH4Cl分解吸热,当ω(NH4Cl)超过一定值后,NH4Cl分解吸热造成温度降低不利于Al 与N2反应,导致ω(AlN)明显减少;
(3)①AIN粉末会缓慢发生水解反应,生成Al(OH)3和NH3;
②相同条件下,由于粒径为40nm的AlN粉末和水的接触面积更大,所以其水解速率大于粒径为100nm的AlN粉末的水解速率,由于固体不影响平衡,所以最终溶液的pH是相
同。 【详解】
(1)①A .消耗2mol Al 2O 3会生成4molAlN ,固体质量减少,当固体的质量不再改变时,反应达到了平衡状态;
B .当3v 正(N 2)=2v 逆(O 2)时,正逆反应速率相等,反应达到了平衡状态,但2v 正(N 2)=3v 逆(O 2)表示的正逆反应速率不相等,不是平衡状态;
C .△H 取决于反应物和生成物的总能量的相对大小,和是否平衡无关;
D .在恒温恒容条件下,容器内的压强和气体的物质的量成正比。该反应是反应前后气体分子数不相等的反应,在平衡建立过程中,气体总物质的量一直在改变,只有达到平衡时,气体总物质的量才不再不变,即容器内压强才不变,所以当容器内气体的压强不变时,反应达到了平衡状态;
E .N 2分子数与 O 2 分子数之比和起始投料以及转化率有关,当N 2分子数与O 2分子数比为 2:3时,反应不一定是平衡状态; 故选AD 。
②反应2Al 2O 3(s)+2N 2(g)
4AlN(s) +3O 2(g),在起始时加入的是等物质的量的Al 2O 3与
N 2,由于反应物中只有N 2是气体,所以起始压强p 即为起始时N 2的分压,列三段式求K p ,已知平衡时N 2的转化率为α,则
()()()()
23222Al O s +2N g 4AlN s +30
1.5-g 1.5O p p p p p p ααα
α
高温
起始变化平衡
K p =32(1.5)()p p p αα-=32
(1.5)(1-)
ααp 。 ③为促进反应的进行,实际生产中需加入焦炭,焦炭和氧气反应,放出热量。焦炭既可以消耗氧气,使生成物浓度降低,又可以提供热量,这两方面的作用都可以使平衡右移,从而促进反应的进行。
(2)①从图1可以看出,当ω(NH 4Cl)=3%时,ω(AlN)最大,所以最佳选择是ω(NH 4Cl)=3%。 ②从图2可以看出,反应过程中温度会降低。ω(NH 4Cl)=3%时的温度比ω(NH 4Cl)=1%时的温度降低得更多。这是因为NH 4Cl 分解吸热,当ω(NH 4Cl)超过一定值后,NH 4Cl 分解吸热造成温度降低不利于Al 与N 2反应,导致ω(AlN)明显减少
(3)①AIN 粉末会缓慢发生水解反应,生成Al(OH)3和NH 3,AlN 粉末水解的化学方程式是AlN + 4H 2O
Al(OH)3 + NH 3?H 2O 。
②相同条件下,由于粒径为40nm 的AlN 粉末和水的接触面积更大,所以其水解速率大于粒径为100nm 的AlN 粉末的水解速率,由于固体不影响平衡,所以最终溶液的pH 是相同
的。粒径为40 nm 的AlN粉末水解的变化曲线为。
3.制造一次性医用口罩的原料之一丙烯是三大合成材料的基本原料,丙烷脱氢作为一条增产丙烯的非化石燃料路线具有极其重要的现实意义。丙烷脱氢技术主要分为直接脱氢和氧化脱氢两种。
(1)根据下表提供的数据,计算丙烷直接脱氢制丙烯的反应C 3H8(g)C3H6(g) +H2(g)的
?H=___。
共价键C-C C=C C-H H-H
键能/(kJ?mol-1)348615413436
(2)下图为丙烷直接脱氢制丙烯反应中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中压强分别为1×104Pa和1×105Pa)
①在恒容密闭容器中,下列情况能说明该反应达到平衡状态的是__(填字母)。
A.?H保持不变
B.混合气体的密度保持不变
C.混合气体的平均摩尔质量保持不变
D.单位时间内生成1molH-H键,同时生成1molC=C键
②欲使丙烯的平衡产率提高,下列措施可行的是____(填字母)
A.增大压强 B.升高温度 C.保持容积不变充入氩气
工业生产中为提高丙烯的产率,还常在恒压时向原料气中掺入水蒸气,其目的是_____。
③1×104Pa时,图中表示丙烷和丙烯体积分数的曲线分别是___、____(填标号)
④1×104Pa、500℃时,该反应的平衡常数K p=____Pa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,计算结果保留两位有效数字)
(3)利用CO2的弱氧化性,科学家开发了丙烷氧化脱氢制丙烯的新工艺,该工艺可采用铬的
氧化物作催化剂,已知C3H8+CO2(g)催化剂
高温
C3H6(g)+CO(g)+H2O(l),该工艺可以有效消除催化
剂表面的积炭,维持催化剂的活性,其原因是____,相对于丙烷直接裂解脱氢制丙烯的缺点是_____。
【答案】+123 kJ?mol-1 C B 该反应是气体分子数增多的反应,恒压条件下充入水蒸气容器体积增大,平衡右移ⅳⅰ 3.3×103 C与CO2反应生成CO,脱离催化剂表面生成有毒气体CO(或其他合理说法)
【解析】
【分析】
(1)比较丙烷与丙烯的结构,可确定断裂2个C-H键和1个C-C键,形成1个C=C键和1个H-H键,利用表中键能可计算C 3H8(g)C3H6(g) +H2(g)的?H。
(2)①A.对于一个化学反应,方程式确定后,?H确定,与反应进行的程度无关;
B.混合气体的质量和体积都不变,密度始终不变;
C.混合气体的质量不变,物质的量增大,平均摩尔质量不断减小;
D.反应发生后,总是存在单位时间内生成1molH-H键,同时生成1molC=C键。
②A.增大压强,平衡逆向移动;
B.升高温度,平衡正向移动;
C.保持容积不变充入氩气,平衡不受影响。
工业生产中为提高丙烯的产率,还常在恒压时向原料气中掺入水蒸气,可增大混合气的体积,减小与反应有关气体的浓度。
③1×104Pa与1×105Pa进行对比,从平衡移动的方向确定图中表示丙烷和丙烯体积分数的曲线。
④1×104Pa、500℃时,丙烷、丙烯、氢气的体积分数都为33.3%,由此可计算该反应的平衡常数K p。
(3) CO2具有氧化性,能与催化剂表面的积炭发生反应生成一氧化碳气体,由此可确定原因及缺点。
【详解】
(1)比较丙烷与丙烯的结构,可确定断裂2个C-H键和1个C-C键,形成1个C=C键和1个H-H键,利用表中键能可计算C 3H8(g)C3H6(g) +H2(g)的?H=(2×413+348) kJ?mol-1-(615+436) kJ?mol-1=+123 kJ?mol-1。答案为:+123 kJ?mol-1;
(2)①A.对于一个化学反应,方程式确定后,?H确定,与反应进行的程度无关,A不合题意;
B.混合气体的质量和体积都不变,密度始终不变,所以密度不变时不一定达平衡状态,B 不合题意;
C.混合气体的质量不变,物质的量增大,平均摩尔质量不断减小,当平均摩尔质量不变时,反应达平衡状态,C符合题意;
D.反应发生后,总是存在单位时间内生成1molH-H键,同时生成1molC=C键,反应不一定达平衡状态,D不合题意;
故选C。答案为:C;
②A.增大压强,平衡逆向移动,丙烯的平衡产率减小,A不合题意;
B.升高温度,平衡正向移动,丙烯的平衡产率增大,B符合题意;
C.保持容积不变充入氩气,平衡不受影响,C不合题意;
故选B。答案为:B;
工业生产中为提高丙烯的产率,还常在恒压时向原料气中掺入水蒸气,可增大混合气的体积,减小与反应有关气体的浓度,其目的是该反应为气体分子数增多的反应,恒压条件下充入水蒸气容器体积增大,平衡右移。答案为:该反应是气体分子数增多的反应,恒压条件下充入水蒸气容器体积增大,平衡右移;
③升高温度,平衡正向移动,丙烷的体积分数减小,丙烯的体积分数增大,则ⅰ、ⅲ为丙烷的曲线,ⅱ、ⅳ为丙烯的曲线,1×104Pa与1×105Pa相比,压强减小,平衡正向移动,从而得出表示丙烷体积分数的曲线为ⅳ,表示丙烯体积分数的曲线为ⅰ。答案为:ⅳ;ⅰ;
④1×104Pa、500℃时,丙烷、丙烯、氢气的体积分数都为33.3%,由此可计算该反应的平
衡常数K p =
44
a a
4
a
33.3%110p33.3%110p
33.3%110p
?????
??
=3.3×103。答案:3.3×103;
(3) CO2具有氧化性,能与催化剂表面的积炭发生反应生成一氧化碳气体,其原因是C与CO2反应生成CO,脱离催化剂表面;相对于丙烷直接裂解脱氢制丙烯的缺点是生成有毒气体CO(或其他合理说法)。答案为:C与CO2反应生成CO,脱离催化剂表面;生成有毒气体
CO(或其他合理说法)。
【点睛】
利用键能计算反应热时,比较反应物与生成物的结构式,确定键的断裂与形成是解题的关键。
丙烷的结构式为,丙烯的结构式为,H2的结构式为H-H,由此可确定断键与成键的种类及数目。
4.从能量的变化和反应的快慢等角度研究反应:
222
2H+O=2H O。
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
A.使用催化剂 B.适当提高氧气的浓度
C.适当提高反应的温度 D.适当降低反应的温度
(2)已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。
(3)从断键和成键的角度分析上述反应中能量的变化。
(资料)①键能:拆开1mol 化学键需要吸收的能量,或是形成1mol 化学键所放出的能量称为键能。 ②化学键的键能:
请填写表:
(4)氢氧燃料电池的总反应方程式为2222H +O =2H O 。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol 电子,标准状况下消耗H 2的体积是__________________L 。
【答案】ABC A 吸收热量 872 吸收热量 496 放出热量 1852 放出热量 484 负 氧化 2.24 【解析】 【分析】 【详解】
(1)常用的加快化学反应速率的方法是:升高温度,加入正催化剂,增大反应物浓度,增大压强(浓度也增大)等,故选ABC ;
(2)反应物的总能量高于生成物的总能量,称为放热反应。氢气的燃烧反应属于典型的放热反应,所以能正确表示反应能量变化的是A ;
(3)拆开1mol 化学键需要吸收的能量,或是形成1mol 化学键所放出的能量称为键能。反应物化学键断裂,吸收能量,生成物形成化学键,释放能量,吸收的总能量减去释放的总能量为该反应的能量变化,若为负值,则为放热反应,反之为吸热反应。则拆开
22molH 中的化学键436×2=872kJ ,拆开21molO 中的化学键496kJ ,共吸收1368kJ ,
形成4molH-O键,放出463×4=1852kJ,反应的总能量变化为放出484kJ;
(4)氢氧燃料电池中,氢气作负极反应物发生氧化反应,氧气作正极反应物发生还原反应,根据反应式,每有2molH2参与反应,转移电子4mol电子,故每转移0.2mol电子,参与反应的氢气为0.1mol H2,标准状况下2.24L。
【点睛】
反应热的计算:1. 生成物总能量-反应物总能量;2.反应物的总键能-生成物的总键能。燃料电池注意升失氧化,负极氧化(负极失去电子发生氧化反应),燃料做负极反应物,空气或者氧气作正极反应物。
5.工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大危害,必须进行处理.常用的处理方法有两种.方法1:还原沉淀法.
该法的工艺流程为:
其中第①步存在平衡2CrO42?(黄色)+2H+?Cr2O32?(橙色)+H2O
(1)若平衡体系的 pH=2,该溶液显______色.
(2)能说明第①步反应达平衡状态的是_____(填序号)
A.Cr2O72?和CrO42?的浓度相同
B.2v(Cr2O72?)=v(CrO42?)
C.溶液的颜色不变
(3)第②步中,还原1molCr2O72?离子,需要______mol的FeSO4?7H2O.
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)?Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积
K sp=c(Cr3+)?c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至______.方法2:电解法.
该法用Fe做电极电解含Cr2O72?的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀;
(5)用Fe做电极的原因为______(用电极反应式解释).
(6)在阴极附近溶液 pH 升高,溶液中同时生成的沉淀还有______.
【答案】橙 C 6 5 阳极反应为Fe?2e?═Fe2+,提供还原剂Fe2+ Fe(OH)3
【解析】
【分析】
(1)pH=2,溶液呈酸性,有利于平衡向正反应分析移动;
(2)达到平衡时,正逆反应速率相等,各物质的浓度不变;
(3)根据氧化还原反应中得失电子守恒来计算;
(4)根据溶度积常数以及水的离子积常数来进行计算;
(5)阳极是活性电极时,阳极本身失电子,生成阳离子;
(6)溶液PH升高的原因是溶液中氢离子浓度减少,即氢离子在阴极得电子,PH升高,生成沉淀为 Cr(OH)3和Fe(OH)3。
【详解】
(1)溶液显酸性,c(H +
)较大,上述平衡右移,该溶液显橙色;综上所述,本题答案是:
橙;
(2)A .Cr 2O 72?和CrO 42?的浓度相同时,反应不一定达到平衡状态,A 错误; B .2v (Cr 2O 72?)=v (CrO 42?),没有标出正逆反应速率,无法判定反应是否达到平衡状态,B 错误;
C .平衡时各物质的浓度不再改变,即溶液的颜色不再改变,可以判断反应达到平衡状态,C 正确; 综上所述,本题选C ;
(3)根据电子得失守恒可以知道,还原1molCr 2O 72?离子,得到Cr 3+,得到电子:2×(6-3)
=6mol ,Fe 2+
被氧化为Fe 3+
,需要FeSO 4?7H 2O 的物质的量为()
6
32-=6mol ;
综上所述,本题答案是:6;
(4)当c(Cr 3+
)=10-5
mol/L 时,溶液的c(OH -
)=2
5
3
31010-- =10-9mol/L,c(H +
)=1491010--=10-5mol/L, pH =5,即要使c(Cr 3+)降至10-5mol/L ,溶液的pH 应调至5; 综上所述,本题答案是:5;
(5)用Fe 做阳极,发生氧化反应,失电子:Fe ?2e -=Fe 2+,产生的亚铁离子做还原剂; 综上所述,本题答案是:Fe ?2e -=Fe 2+,提供还原剂Fe 2+;
(6)溶液中氢离子在阴极得电子被还原为氢气,阴极极反应为:2H ++2e -=H 2↑,溶液酸性减弱,溶液pH 升高,亚铁离子被氧化为铁离子,酸性减弱,铁离子产生沉淀Fe(OH)3; 综上所述,本题答案是:Fe(OH)3。
6.有利于可持续发展的生态环境是全国文明城市评选的测评项目之一。 (1)已知反应 2NO (g )+2CO (g )
N 2(g )+2CO 2(g ) v 正=k 正·c 2(NO )·c 2
(CO ),v 逆=k 逆·
c (N 2)·c 2(CO 2)(k 正、k 逆为速率常数,只与温度有关)。一定条件下进行该反应,测得 CO 的平衡转化率与温度、起始投料比m=
n(NO)
n(CO)
的关系如图 1 所示。
①达到平衡后,仅升高温度,k 正增大的倍数________填“>”“<”或“=”)k 逆增大的倍数。 ②下列说法正确的是_______。 A 投料比:m 1 B 汽车排气管中的催化剂可提高 NO 的平衡转化率 C 当投料比 m=2 时,NO 转化率比 CO 转化率小 D 当体系中 CO2和 CO 物质的量浓度之比保持不变时,反应达到平衡状态 ③若在 1L 的密闭容器中充入 1 molCO 和 1 mol NO,在一定温度下达到平衡时,CO 的转化率为 40%,则k正︰k逆=_______(填写分数即可,不用化简) (2)在 2L 密闭容器中充入 2mol CO 和 1mol NO2,发生反应 4CO(g)+2NO2(g)N2(g)+4CO2(g)ΔH<0,如图 2 为平衡时 CO2的体积分数与温度、压强的关系。 ①该反应达到平衡后,为在提高反应速率同时提高 NO 的转化率,可采取的措施有______(填字母序号) a 增加 CO 的浓度 b 缩小容器的体积 c 改用高效催化剂 d 升高温度 ②若在 D 点对反应容器降温的同时缩小体积至体系压强增大,达到的平衡状态可能是图中 A G 点中的______点。 (3)近年来,地下水中的氮污染已成为一个世界性的环境问题。在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的 H2可高效转化酸性溶液中的硝态氮(NO3-),其工作原理如下图所示。若导电基体上的 Pt 颗粒增多,造成的后果是______。 【答案】< C D 20 81 ab C 若Pt颗粒增多,NO3-更多转化为NH4+存在溶液中,不利于 降低溶液中含氮量 【解析】 【分析】 【详解】 (1)①据图1所示,正反应为放热反应,升高温度,平衡逆向移动,则k正增大的倍数<k逆增大的倍数; ②A. 由图象可知,温度一定时,增大NO 浓度,CO 转化率增大,即起始投料比m 越大时,CO 转化率越大,所以投料比:m 1>m 2>m 3,故A 错误; B. 催化剂只改变反应速率,不改变平衡转化率,故B 错误; C. 由反应计量关系可知,反应中NO 、CO 的变化量相同,平衡转化率α=变化量 起始量×100%,所以平衡转化率与起始量成反比,即投料比m=2时CO 转化率是NO 转化率的2倍,故C 正确; D. 反应正向移动时CO 2浓度增大,CO 浓度减小,即平衡移动过程中二者浓度比值会发生变化,所以当二者比值不变时说明反应达到平衡,故D 正确; 故答案为:CD ; ③若在 1L 的密闭容器中充入 1 mol CO 和 1 mol NO ,在一定温度下达到平衡时,CO 的转化率为 40%,列三段式有: ()() ()() 212-1-1-++mol L 1100 mol L 0.40.40.20.4mol L 0.60.2NO g 2CO g N g 2CO g 60.20.4 起始()转化()平衡() 达到平衡状态时正逆反应速率相等,则k 正?c 2(NO)?c 2(CO)=k 逆?c (N 2)?c 2(CO 2), 则()()()()22 2222220.20.420===0.N CO NO C 6061 O .8k c c k c c ??正逆; (2)①a. 增加CO 的浓度平衡正向移动,NO 转化率提高,故a 正确; b. 缩小容器的体积相当于增大压强平衡正向移动,NO 转化率提高,故b 正确; c. 改用高效催化剂,只改变化学反应速率不影响平衡移动,所以NO 转化率不变,故c 错误; d. 该反应焓变小于零,正反应为放热反应,升高温度平衡逆向移动,NO 转化率降低,故d 错误; 故选ab ; ②相同压强下降低温度平衡正向移动,CO 2体积分数增大,同一温度下增大压强平衡正向移动CO 2体积分数增大,所以符合条件的为C ; (3)由原理的示意图可知,若导电基体上的Pt 颗粒增多,则NO 3-会更多的转化成铵根,不利于降低溶液中的含氮量。 7.在容积为1 L 的容器中,通入一定量的N 2O 4,发生反应N 2O 4(g)2NO 2(g),随温度升 高,混合气体的颜色变深。回答下列问题: (1)反应的ΔH _____0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示。在 0~60 s 时段, 反应速率 v (N 2O 4)为_____mol·L -1·s -1;反应的平衡转化率为:_____; 反应的平衡常数K 1为_____。 (2)100℃时达平衡后,改变反应温度为 T,N2O4以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。 a:T____________100℃(填“大于”或“小于”),判断理由是__________。 b:计算温度T时反应的平衡常数K2____________。 (3)温度T时反应达平衡后,将反应容器的容积减少一半。平衡向____________(填“正反应”或“逆反应”)方向移动,判断理由________________________。 【答案】大于 0.0010 60% 0.36 大于温度改变后,反应正向移动,由于正反应为吸热反应,所以温度改变是升高温度 1.28 逆反应对于气体分子数增大的反应,增大压强平衡向逆反应方向移动 【解析】 【分析】 (1)升高温度混合气体颜色变深,说明升高温度,化学平衡正向移动,利用温度对化学平衡 移动的影响分析判断反应的热效应;在0~60 s时段,根据v =c t 计算反应速率;根据反 应物的转化率= 转化量 开始投入量 ×100%计算N2O4的转化率;根据化学平衡常数K1= () () 2 2 24 c NO c N O 计算平衡常数; (2)根据温度对化学反应速率的影响分析判断;计算在反应达到新的平衡后各种物质的浓度,带入平衡常数表达式计算出新平衡的化学平衡常数K2; (3)温度T时反应达到平衡后,将反应容器的容积减少一半,相当于增大压强,根据压强对化学平衡移动的影响分析判断。 【详解】 (1)升高温度混合气体颜色变深,说明升高温度,化学平衡正向移动,根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,则该反应的正反应为吸热反应,故△H>0;在 0~60 s时段,反应速率v(N2O4)= () 0.1000.040mol/L c t60?s - ==0.0010 mol/(L·s);反应中 N2O4的平衡转化率=() 0.1000.040/ 0.100?/ mol L mol L - ×100%=60%;达到平衡时c(N2O4)=0.040 mol/L、c(NO2)=0.120 mol/L,化学平衡常数K1= () () 22 2 24 c NO0.120 c N O0.040 ==0.36; (2)a.在0~60 s时段,反应速率v(N2O4)= 0.001 mol/(L·s)<0.0020 mol/(L·s),可见改变温度后化学反应速率加快,说明改变的温度是升高温度,则T>100℃; b.根据a知,改变的条件是升高温度,化学平衡正向移动,改变条件后10 s内 △c(N2O4)=0.002 0mol/(L?s)×10 s=0.020 mol/L,则再次达到平衡时c(N2O4)=(0.040- 0.020)mol/L=0.020 mol/L,c(NO2)=(0.120+0.020×2)mol/L=0.160 mol/L,所以在温度T时反应 的平衡常数K2= K1= () () 22 2 24 c NO0.160 c N O0.020 ==1.28; (3)在温度T时,反应达到平衡后,将反应容器的容积减小一半,相当于增大体系的压强,由于该反应的正反应为气体体积增大的反应,所以增大压强,化学平衡向气体体积减小的方向移动,即化学平衡向逆反应方向移动。 【点睛】 本题以图象分析为载体考查化学反应速率、化学平衡移动影响因素、化学平衡计算,明确化学平衡常数计算方法、压强对化学平衡移动影响原理是解本题关键,侧重考查学生的分析判断及计算能力。 8.研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应: 反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H1=-49.6kJ/mol 反应Ⅱ:CH3OCH3(g)+H2O(g)2CH3OH(g) △H2=+23.4kJ/mol 反应Ⅲ:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) △H3 (1)△H3=___kJ/mol。 (2)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,发生反应I。下列描述能说明反应I达到平衡状态的是___(填序号)。 A.容器内的混合气体的密度保持不变 B.反应体系总压强保持不变 C.断裂3N A个H-O键同时断裂2N A个C=O键 D.CH3OH和H2O的浓度之比保持不变 (3)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的 CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下: 物质CH3OCH3(g)H2O(g)CH3OH(g) 浓度/mol.L-1 1.8 1.80.4 此时v正___v逆(填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH体积分数(CH3OH)%=___%。 (4)在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6molCO2和12molH2充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min 内的平均反应速率v(CH3OCH3)=__。 (5)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。 其中:CH3OH的选择性=×100% ①温度高于230℃,CH3OH产率随温度升高而下降的原因是__。 ②在上述条件下合成甲醇的工业条件是__。 A.210℃ B.230℃ C.催化剂CZT D.催化剂CZ(Zr-1)T 【答案】-122.6 BC > 20 0.18mol·L?1·min?1反应I的△H<0温度升高,使CO2转化为CH3OH的平衡转化率下降 BD 【解析】 【分析】 反应Ⅰ:CO 2(g)+3H2(g)CH3OH(g)+H2O(g) △H1=-49.6kJ/mol 反应Ⅱ:CH 3OCH3(g)+H2O(g)2CH3OH(g) △H2=+23.4kJ/mol 反应Ⅲ:2CO 2(g)+6H2(g)CH3OCH3(g)+3H2O(g) △H3 (1)将反应Ⅰ×2-反应Ⅱ,即可求出反应Ⅲ的△H3。 (2)A.容器内的混合气体的质量不变,体积不变,密度始终不变; B.恒温恒容条件下,反应前后气体的分子数不等,则随反应的不断进行,反应体系总压强不断发生改变; C.断裂3N A个H-O键,即有1molCH3OH(g)和1molH2O(g)发生反应;断裂2N A个C=O 键,即有1molCO2参加反应; D.CH3OH和H2O的浓度之比等于化学计量数之比。 (3)利用表中数据求出浓度商,然后与平衡常数0.25进行比较,确定平衡移动的方向,从而确定v 正与v 逆的相对大小;再设未知数,建立三段式,利用平衡常数求出CH 3OH 的平衡量及平衡时的混合气总量,从而求出混合气体中CH 3OH 体积分数CH 3OH%。 (4) 将6molCO 2和12molH 2充入2L 的密闭容器中,则投料比为2,从图中采集数据,得出CO 2的平衡转化率为60%,利用三段式可求出CH 3OCH 3的平衡量,从而可求出0~5min 内的平均反应速率v (CH 3OCH 3)。 (5)①温度高于230℃,CH 3OH 产率随温度升高而下降,说明平衡逆向移动,从温度对平衡的影响寻找原因。 ②从图中数据,可得出最佳温度与催化剂。 【详解】 反应Ⅰ:CO 2(g)+3H 2(g)CH 3OH(g)+H 2O(g) △H 1=-49.6kJ/mol 反应Ⅱ:CH 3OCH 3(g)+H 2O(g)2CH 3OH(g) △H 2=+23.4kJ/mol 反应Ⅲ:2CO 2(g)+6H 2(g) CH 3OCH 3(g)+3H 2O(g) △H 3 (1)将反应Ⅰ×2-反应Ⅱ,即可求出反应Ⅲ:2CO 2(g)+6H 2(g)CH 3OCH 3(g)+3H 2O(g) △H 3=-122.6 kJ/mol 。答案为:-122.6; (2)A .容器内的混合气体的质量不变,体积不变,密度始终不变,则反应不一定达平衡状态,A 不合题意; B .恒温恒容条件下,反应前后气体的分子数不等,则随反应的不断进行,反应体系总压强不断发生改变,当压强不变时,反应达平衡状态,B 符合题意; C .断裂3N A 个H -O 键,即有1molCH 3OH(g)和1molH 2O(g)发生反应;断裂2N A 个C=O 键,即有1molCO 2参加反应;满足反应方向相反,变化量之比等于化学计量数之比,即反应达平衡状态,C 符合题意; D .CH 3OH 和H 2O 的浓度之比等于化学计量数之比,则反应不一定达平衡状态,D 不合题意。答案为:BC ; (3)浓度商Q =2 0.41.8 1.8 ?=0.05<0.25,所以平衡正向移动,v 正>v 逆。 设参加反应的CH 3OCH 3的物质的量为x 3323CH OCH (g)H O(g) 2CH OH(g)(mol) 1.8 1.80.4(mol)2(mol) 1.8 1.80.42x x x x x x +--+起始量变化量平衡量 K = (0.42) 0.25(1.8) x x +=-,x =0.2mol , V (CH 3OH)%= 0.424 x +=20%。答案为:>;20; (4) T 1温度下,投料比为2,从表中可提取出CO 2的平衡转化率为60%。 223322CO (g)6H (g) CH OCH (g)3H O(g) (mol)61200 (mol) 3.610.8 1.8 5.4(mol) 2.4 1.2 1.8 5.4 ++起始量变化量平衡量 v (CH 3OCH 3)= 1.8mol 2L 5min = 0.18mol·L ?1·min ?1。答案为:0.18mol·L ?1·min ?1; (5)①230℃时,反应达平衡状态,此时升高温度,由于反应放热,所以平衡逆向移动, CH 3OH 产率下降。答案为:反应I 的△H <0,温度升高,使CO 2转化为CH 3OH 的平衡转化率下降; ②从图中数据可以看出,甲醇平衡转化率最高的温度为230℃;比较两种催化剂的催化效率,催化剂CZ(Zr -1)T 催化效率更高。答案为:BD 。 【点睛】 采集图中信息时,首先要弄清横坐标与纵坐标表示的意义,然后需理解图中曲线表示的意义,它的变化趋势与拐点所在的位置,还需分析反应物或生成物的热稳定性,反应的热焓变,可能发生的副反应等,然后针对问题进行分析。 9.发生炉煤气是城市管道煤气中的一种重要气源,它的主要成分是CO ,但由于CO 有毒,所以煤气厂技术人员利用以下反应,将部分CO 转换成H 2,CO +H 2O CO 2+H 2,其化 学平衡常数K 与温度t 的关系如下表: t (℃) 700 800 830 1000 1200 K 1.67 1.11 1.00 0.59 0.38 (1)该反应的化学平衡常数表达式为K =__________________,该反应为________反应(填“吸热”或“放热”)。 (2)能判断该反应是否达到化学平衡状态的依据是_____________(填选项编号)。 A .容器中的压强不变 B .V 逆(H 2)= V 正(H 2O ) C .混合气体中c (CO 2)不变 D .c (CO 2)=c (CO ) (3)上述反应的平衡混合物中,碳的氧化物中碳、氧元素的质量比可能是________。 A .3∶4 B .3∶5 C .3∶6 D .3∶8 (4)现有CO x 表示平衡混合物中碳的氧化物的组成,则表示x 与反应CO +H 2O CO 2+H 2 中H 2产率关系正确的是_________________。 【答案】K =222c(CO )c(H ) c(CO)c(H O) 放热 BC BC B 【解析】 【分析】 (1)化学平衡常数是利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到;分析图表数据,平衡常数随温度升高减小,升温平衡逆向进行,正反应是放热反应; (2)反应达到平衡的标志是正逆反应速率相同,个组分含量保持不变分析选项; (3)上述反应的平衡混合物中是CO 和CO 2的混合物,m (C ):m (O )介于CO 和CO 2之间; (4)当全为CO 时没有氢气生成,当全为二氧化碳时,氢气产率最高。 【详解】 (1)化学平衡常数是利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到, CO (g )+H 2O (g )?CO 2(g )+H 2(g ),反应的平衡常数K =222c(CO )c(H ) c(CO)c(H O) ;分析图表数据,平衡 常数随温度升高减小,依据化学平衡移动原理可知,升温平衡逆向进行,逆向为吸热反应,正反应是放热反应; (2)反应达到平衡的标志是正逆反应速率相同,各组分含量保持不变,反应是气体体积不变的放热反应; A .反应前后气体体积不变,容器中压强不变不能说明反应达到平衡状态,A 不符合; B .氢气和水的化学计量数之比为1:1,所以v 逆(H 2)=v 正(H 2O ),说明正逆反应速率相等,B 符合; C .混合气体中c (CO 2)不变,则各物质的浓度保持不变,反应达到平衡状态,C 符合; D .c (CO )=c (CO 2)和起始量消耗量有关,不能说明反应达到平衡状态,D 不符合; 故答案为:BC ; (3)上述反应的平衡混合物中是CO 和CO 2的混合物,m (C ):m (O )介于CO 和CO 2之间,即介于3:4和3:8之间,答案为:BC ; (4)当全为CO 时没有氢气生成,当全为二氧化碳时,氢气产率最高,所以B 图符合。 10.能源与材料、信息一起被称为现代社会发展的三大支柱。面对能源枯竭的危机,提高能源利用率和开辟新能源是解决这一问题的两个主要方向。 (1)化学反应速率和限度与生产、生活密切相关,这是化学学科关注的方面之一。某学生为了探究锌与盐酸反应过程中的速率变化,在400mL 稀盐酸中加入足量的锌粉,用排水法收集反应放出的氢气,实验记录如下(累计值): 时间12345 氢气体积/mL(标况)100240464576620 ①哪一段时间内反应速率最大:__________min(填“0~1”“1~2”“2~3”“3~4”或“4~5”)。 ②另一学生为控制反应速率防止反应过快难以测量氢气体积。他事先在盐酸中加入等体积的下列溶液以减慢反应速率但不影响生成氢气的量。你认为不可行的是____________(填字母序号)。 A浓盐酸B KCl溶液C蒸馏水D CuSO4溶液 (2)寻找替代能源,是化学学科一直关注的另一方面。电能是一种二次能源,电能的应用大大丰富和方便了我们的生活、学习和工作。某化学兴趣小组探究铝电极在原电池中的作用,设计了一个Mg、Al、NaOH溶液电池,请写出 ①原电池的负极电极反应:_________________________________; ②原电池的正极电极反应:___________________________________; ③原电池的总反应的离子方程式:___________________________________。 【答案】2~3min BC 2Al-6e-+8OH-=2AlO2-+4H2O 6H2O+6e-=6OH-+3H2↑ 2Al+2H2O+2OH-=2AlO2-+3H2↑ 【解析】 【分析】 【详解】 (1)①在0~1、1~2、2~3、3~4、4~5min时间段中,产生气体的体积分别为 100mL、140mL、224mL、112mL、44mL,由此可知反应速率最大的时间段为2~3min,因反应为放热反应,温度升高,反应速率增大,反应速率最小的时间段是4~5min时间段,此时温度虽然较高,但H+浓度小,答案为2~3min; ② A.浓盐酸,H+浓度增大,反应速率增大且增大产生氢气的量,选项A错误; B.加入KCl溶液溶液,H+浓度减小,反应速率减小且不减少产生氢气的量,选项B正确;C.加入蒸馏水,H+浓度减小,反应速率减小且不减少产生氢气的量,选项C正确;D.加入CuSO4溶液,Zn置换出Cu反应速度增大,但影响生成氢气的量,选项D错误;答案选BC; (2)设计了一个Mg、Al、NaOH溶液电池时,铝为电池负极,铝失电子在碱性条件下生成偏铝酸钠,溶液中水电离产生的氢离子得电子产生氢气。 ①原电池的负极上铝失电子产生AlO2-,电极反应为2Al-6e-+8OH-= 2AlO2-+4H2O; ②原电池的正极上水电离产生的氢离子得电子产生氢气,电极反应式为6H2O+6e-=6OH- +3H2↑; ③原电池的总反应的离子方程式为:2Al+2H2O+2OH-= 2AlO2-+3H2↑。 11.已知A(g)+B(g)C(g)+D(g)反应的平衡常数和温度的关系如下: 温度/℃70080083010001200 平衡常数 1.7 1.1 1.00.60.4 回答下列问题: (1)该反应的平衡常数表达式K=___,ΔH___0(填“<”“>”或“=”)。 (2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s 内A的平均反应速率v(A)=0.003mol?L-1?s-1,则6s时c(A)=___mol?L-1,C的物质的量为 ___mol;若反应经一段时间后,达到平衡时A的转化率为___,如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率为___。 (3)一定温度下,能判断该反应达化学平衡状态的是___。 ①单位时间内生成nmolA,同时消耗nmolC ②A的转化率不变 ③容器内压强不再变化 ④混合气体的密度不再变化 ⑤混合气体的平均相对分子质量不再变化 (4)1200℃时,C(g)+D(g)A(g)+B(g)的平衡常数的值为___。 【答案】 (C)(D) (A)(B) c c c c < 0.022 0.09 80% 80% ①② 2.5 【解析】 【分析】 (1)根据平衡常数定义,可写出该反应的平衡常数表达式;根据平衡常数与温度关系可判断该反应的热效应; (2)利用化学反应速率的定义,根据题给方程式和数据可计算6s时A的浓度、C的物质的量以及平衡时A的转化率;可根据是否改变了反应混合物各组分的浓度来判断充入氩气对转化率的影响; (3)根据化学平衡状态的特征和平衡移动时各量的变化情况来判断可逆反应是否达化学平衡状态; (4)互为逆反应的两个可逆反应,平衡常数的表达式互为倒数。 【详解】 (1)根据平衡常数定义,该反应的平衡常数表达式为 (C)(D) = (A)(B) c c K c c ;根据题给图表,该反 应的平衡常数随温度的升高而减小,说明该反应是放热反应,所以,ΔH<0。 答案为: (C)(D) (A)(B) c c c c ;<; (2)A的初始浓度为:0.20mol÷5L=0.04mol/L,反应初始6s内A浓度减小量为: ?c(A)=0.003mol?L-1?s-1×6s=0.018 mol?L-1,故6s时c(A)=0.04mol/L-0.018 mol?L-1=0.022mol?L-1;生成的C的物质的量等于消耗的A的物质的量,所以C的物质的量n(C)= 0.018mol?L-1×5L=0.09mol; 二次根式培优 一、知识的拓广延伸 1、挖掘二次根式中的隐含条件 一般地,我们把形如a a() ≥0 的式子叫做二次根式,其中0 a≥。 根据二次根式的定义,我们知道:被开方数a的取值范围是0 a≥,由此我们判断下列式子有意义的条件: 1 (1; 2 (4); 1 x ++ -+ + 2、 教科书中给出: (0) a a =≥,在此我们可将其拓展为: a a a a a a 2 == ≥ -< ? ? ? || () () (1)、根据二次根式的这个性质进行化简: ①数轴上表示数a 的点在原点的左边,化简 2a ②化简求值: 1 a a= 1 5 ③已知, 1 3 2 m -<< ,化简2m ④______ =; ⑤若为a,b,c ________ =; ___________ =. (2)、根据二次根式的定义和性质求字母的值或取值范围。 ①若1 m=,求m的取值范围。 4x =-,则x的取值范围是___________. ③若a= ④3,2xy 已知求的值。 二.二次根式a的双重非负性质:①被开方数a是非负数,即0 ≥ a ②二次根式a 是非负数,即0≥a 例1. 要使1 21 3-+ -x x 有意义,则x 应满足( ). A .21≤x ≤3 B .x ≤3且x ≠21 C .21<x <3 D .2 1 <x ≤3 例2(1)化简x x -+-11=_______. (2) x +y )2,则x -y 的值为( ) (A)-1. (B)1. (C)2. (D)3. 例3(1)若a 、b 为实数,且满足│a -2│+2b -=0,则b -a 的值为( ) A .2 B .0 C .-2 D .以上都不是 (2)已知y x ,是实数,且2)1(-+y x 与42+-y x 互为相反数,求实数x y 的倒数。 三,如何把根号外的式子移入根号内 我们在化简某些二次根式时,有时会用到将根号外的式子移入根号内的知识,这样式子的化简更为简单。在此我们要特别注意先根据二次根式的意义来判断根号外的式子的符号。如果根号外的式子为非负值,可将其平方后移入根号内,与原被开方数相乘作为新的被开方数,根号前的符号不会发生改变;如果根号外的式子为负值,那么要先将根号前的符号变号,再将其其平方后移入根号内,与原被开方数相乘作为新的被开方数。 (1)、 根据上述法则,我们试着将下列各式根号外的式子移入根号内: ①- ②(a -(2)、利用此方法可比较两个无理数的大小。 (2)2-—3 四,拓展性问题 1、 整数部分与小数部分 要判断一个实数的整数部分与小数部分,应先判断已知实数的取值范围,从而确定其整数部分,再由“小数部分=原数—整数部分”来确定其小数部分。 例:(1)1的整数部分为a ,小数部分为b ,试求ab —b 2的值。 (2)若x 、y 分别为 8-2xy —y 2的值。 (3 a ,小数部分为 b ,求a 2+b 2 的值。 (4)若________a a b a b ==是的小数部分,则。 5a a b -(的整数部分为a ,小数部分为b ,求的值。 2、巧变已知,求多项式的值。 32351 x x x x = +-+(1)、若的值。 第二章专题一 化学反应速率 1.(1)化学反应速率表示方法: 数学表达式: (2)用不同物质表示同一个反应的反应速率的关系 。 2.影响化学反应速率的因素 ( [1.在一定条件下,反应N 2+3H 2 2NH 3,在2L 密闭容器中进行,5min 内氨的质量增 加了1.7g ,则反应速率为 A.V(H 2)=0.03mol/(L〃mi n) B.V(N 2)=0.02mol/(L〃min ) C.V(NH 3)=0.17mol/(L〃min ) D.V(NH 3)=0.01mol/(L〃min ) 2.下列四个数据都表示合成氨的反应速率,其中速率代表同一反应中的是 ①V (N 2)=0.3mol/(L〃min ) ②V (NH 3)=0.6mol/(L〃min ) ③V (H 2)=0.6mol/(L〃min ) ④V (H 2)=0.0225mol/(L〃min ) A .①② B .①③ C .③④ D .②④ 3.已知4NH 3+5O 2=4NO+6H 2O,则正确的关系是 A.4/5V (NH 3)=V (O 2) B.5/6V (O 2)=V (H 2O) C.2/3V (NH 3)=V (H 2O) D.4/5V (O 2)=V (NO) 4.反应4A(s)+3B(g) 2C(g)+D(g),经2minB 的浓度减少0.6mol/L 。对此反应速率的表示,正确的是 A.用A 表示的反应速率是0.4mol/(L〃min) B.分别用B 、C 、D 表示反应的速率,其比值是3∶2∶1 C.在2min 末的反应速率,用B 表示是0.3mol/(L〃min) D.在这2min 内用B 和C 表示的反应速率的值都是逐渐减小的 5.把0.6molX 气体和0.4molY 气体混合于2L 容器中,发生如下反应:3X(g)+Y(g)n Z(g)+2W(g),5min 末已生成0.2molW ,若测知以Z 浓度变化来表示的平均速率为0.01mol/(L 〃min)。上述反应中Z 气体的化学计量数n 值是 A.1 B.2 C.3 D.4 二年级下册阅读理解专题训练答案 一、二年级语文下册阅读理解练习 1.阅读下文,回答问题。 燕子 一对黑色的燕子,________在我的玻璃窗上。我连忙把窗子打开,这一对小客人却又忽然不见了。窗外是一片绿色的春天…… 我在窗口等着,等待这春天的使者,这幸福的使者。我的心也在发芽,也像迎着春风的嫩叶,在枝头上眺望。 燕子终于又回来了,________着泥草,忙忙碌碌地飞来飞去,在我的房角上,造起一座白色的小房子。一会儿,它们又出去了,又回来了,并且吱吱地叫着,仿佛在向我________它们的劳动成果,向我________它们的快乐。 接着,它们又出去了,不知道从什么地方,衔来了一条又肥又绿的虫子,它们就饱饱地吃了一顿。吃完了,它们在窗外唱了一会儿歌,又朝它们那还未建成的房子飞去了。这中间也回来过一两次,不是衔着泥沙,就是抬着树枝…… 燕子,燕子,我知道你们是在劳动中,才变得如此矫捷!也知道你们是在劳动中,吸取了太阳的光亮,才使自己黑色的羽毛变得如此闪亮。甚至你们那火红的嘴唇,也是涂上了太阳的颜色,才变得如此艳丽!啊,你是春天的使者,劳动的使者! (1)把下面的字词填入短文中合适的横线上。 分享报告撞衔 ①一对黑色的燕子,________在我的玻璃窗上。 ②燕子终于又回来了,________着泥草,忙忙碌碌地飞来飞去,在我的房角上,造起一座白色的小房子。 ③一会儿,它们又出去了,又回来了,并且吱吱地叫着,仿佛在向我________它们的劳动成果,向我________它们的快乐。 (2)在等待燕子时,“我”的心情是________的。() A. 着急 B. 充满希望 C. 快乐 (3)“我”重点描写了燕子________的活动。() A. 建房子 B. 唱歌 C. 吃虫子 (4)“我”赞美了燕子怎样的精神? 【答案】(1)撞;衔;报告;分享 (2)B (3)A (4)燕子勤劳的精神。 【解析】【分析】(1)本题考查词语的运用。学生在明确语段大概意思的前提下,恰当的使用词语,使语言表达更准确,简洁,词语还要与句子所表达的感情色彩相一致。(2)(3)解答此类题目关键是抓住各项表述的要点,仔细阅读短文内容,比较判断正误。(4)考查文章的中心。“中心思想”是对一篇文章的内容和思想做出的确切、扼要的说明,简单说就是作者的写作目的或者作者要告诉人们什么。 《化学反应速率》专题复习 例1.(化学反应速率的概念、化学反应速率的计算—“三段式”法) 1.1.在体积为2L的容器中,化学反应4A(s)+3B(g)2C(g)+D(g)经2 min,B的浓度减少0.6 mol/L,下列说法正确的是(B) A.用A表示的反应速率是0.4 mol·(L·min)-1 B.物质C的物质的量增加了0.8 mol C.2 min末的反应速率用B表示是0.3 mol·(L·min)-1 D.2 min内,v正(B)和v逆(C)表示的反应速率的值都是逐渐减小的 【解析】物质A是固体,浓度不变,不能用A表示该反应的反应速率,A错误;2 min末的反应速率为即时速率,用B表示速率0.3 mol/(L·min)是2 min内的平均速率,C错误;B是反应物,浓度降低,C是生成物,浓度增大,D错误。 1.2.对于可逆反应A(g)+3B(s)2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是(D) A.v(A)=0.5mol·L-1·min-1 B.v(B)=1.2mol·L-1·s-1 C.v(D)=0.4mol·L-1·min-1 D.v(C)=0.1mol·L-1·s-1 【解析】本题可以采用归一法进行求解,通过方程式的计量数将不同物质表示的反应速率折算成同一物质表示的反应速率进行比较,B项中的B物质是固体,不能表示反应速率;C项中对应的v(A)=0.2mol·L-1·min-1;D项中对应的v(A)=3mol·L-1·min-1。 例2.(理解外界条件(浓度、温度、压强、催化剂等)对化学反应速率的影响) 2.1.在一密闭容器中充入1 mol H2和1 mol I2,压强为p(Pa),并在一定温度下使其发生反应: H 2(g)+I2(g)2HI(g),下列说法正确的是(A) A.保持容器容积不变,向其中加入1 mol H2(g),反应速率一定加快 B.保持容器容积不变,向其中加入1 mol Ar,反应速率一定加快 C.保持容器内气体压强不变,向其中加入1 mol Ar,反应速率一定加快 D.保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g),反应速率一定加快 2.2.(2018天津)室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH 的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是(D) A.加入NaOH,可增大乙醇的物质的量 B.增大HBr浓度,有利于生成C2H5Br C.若反应物增大至2 mol,则两种反应物平衡转化率之比不变 D.若起始温度提高至60℃,可缩短反应达到平衡的时间 【解析】加入NaOH,中和HBr,平衡逆向移动,可增大乙醇的物质的量,A正确。增大HBr浓度,平衡正向移动,有利于生成C2H5Br,B正确。若反应物增大至2 mol,实际上就是将反应的浓度都增大至原来的2倍,比例不变(两次实验反应物的比例都是1:1,等于方程式中的系数比),这里有一个可以直接使用的结论:只要反应物的投料比等于系数比,达平衡时反应物的转化率一定是相等的。所以两种反应物的转化率一定是1:1,C正确。若起始温度提高至60℃,考虑到HBr是挥发性酸,在此温度下会挥发出去,降低HBr的浓度减慢速率,增加了反应时间,D错误。 2.3.在一密闭容器中充入一定量的N2和O2,在电火花作用下发生反应N2+O2===2NO,经测定前3s用N2表示的反应速率为0.1mol·L-1·s-1,则6s末NO的浓度为(C) A.1.2mol·L-1 B.大于1.2mol·L-1 C.小于1.2mol·L-1 D.不能确定 【解析】本题考查化学反应速率的计算,意在考查学生对化学反应速率公式的灵活运用能力。前3s用N2表示的反应速率为0.1mol·L-1·s-1,即用NO表示的反应速率为0.2mol·L-1·s-1,如果3~6s的反应速率仍为0.2mol·L-1·s-1,则NO的浓度为1.2mol·L-1,由于随着反应进行,反应物的浓 【部编语文】二年级下册阅读理解专题训练答案及解析 一、二年级语文下册阅读理解练习 1.阅读下文,回答问题 拔萝卜 一天,小兔子来拔萝卜,它拔啊拔,就剩下一个大大的萝卜没有拔完,它就去拔那根大萝卜。可是它怎么拔也拔不上来,它急得转圈跑。小狗看见了,对它说:“我来帮你拔萝卜吧。”它们俩一起拔呀拔,还是拔不上来,这时候小熊来了,它们俩一起说:“小熊的力气大,你来帮我们拔萝卜吧。”小熊说:“好吧。”它们又一起拔啊拔,还是拔不出来,,最后小象来了,对它们说:“我来帮你们拔萝卜吧”。于是,小象就用长鼻子把一些萝卜叶子卷上,使劲拔。终于把大萝卜拔上来了。小兔高兴地说:“小狗,小熊,小象,谢谢你们帮我拔萝卜,我们晚上一起吃蜜汁大萝卜吧!” 到了晚上,小狗,小象,还有小熊都来了,小象先把大萝卜用鼻子卷到了桌子上,小狗负责把皮刮掉,小兔把大萝卜切开,小熊往上边抹了很多很多的蜜汁。这下,大萝卜成了又香又脆的蜜汁大萝卜。它们每人都咬一口,呀!这个蜜汁大萝卜实在是太甜了! (1)这篇短文共________个自然段。 (2)小兔子在拔萝卜,最后一个大萝卜拔不动,________、________、________来帮小兔子拔萝卜。 (3)这个故事告诉我们什么道理?________ A. 团结的力量大。 B. 小象的力气最大了。 C. 蜜汁大萝卜真好吃。 【答案】(1)2 (2)小狗 ;熊 ;小象 (3)A 【解析】 2.阅读下文,回答问题。 两个人玩,很好! 讲故事得有人听才行, 你讲我听,我讲你听。 还有下象棋,打羽毛球,坐跷跷板…… (1)给文段中划线的字注音。 ________ 得 (2)两个人玩时,可以做哪些游戏?用“________”画出游戏的名字。 (3)请你想一想,两个人玩时,还可以做什么游戏? 【答案】(1)děi (2)讲故事、下象棋、打羽毛球、坐跷跷板 《二次根式》培优专题之一 ——难点指导及典型例题 【难点指导】 1、如果a 是二次根式,则一定有a ≥0;当a ≥0时,必有a ≥0; 2、当a ≥0时,a 表示a 的算术平方根,因此有 ()a a =2;反过来,也可以将一个非负数写成 ()2a 的形式; 3、()2a 表示a 2的算术平方根,因此有a a =2,a 可以是任意实数; 4、区别()a a =2和a a =2 的不同: ( 2a 中的可以取任意实数,()2a 中的a 只能是一个非负数,否则a 无意义. 5、简化二次根式的被开方数,主要有两个途径: (1)因式的内移:因式内移时,若m <0,则将负号留在根号外.即: x m x m 2-=(m <0). (2)因式外移时,若被开数中字母取值范围未指明时,则要进行讨论.即: 6、二次根式的比较: (1)若,则有;(2)若,则有. 说明:一般情况下,可将根号外的因式都移到根号里面去以后再比较大小. < 【典型例题】 1、概念与性质 2、二次根式的化简与计算培优专题:二次根式
专题一 化学反应速率
二年级二年级下册阅读理解专题训练答案
《化学反应速率》专题复习
二年级【部编语文】二年级下册阅读理解专题训练答案及解析
《二次根式》培优专题之(一)难点指导与典型例题(含答案及解析)
