免疫荧光双重染色样品制备的最佳方法探讨

免疫荧光双重染色样品制备的最佳方法探讨
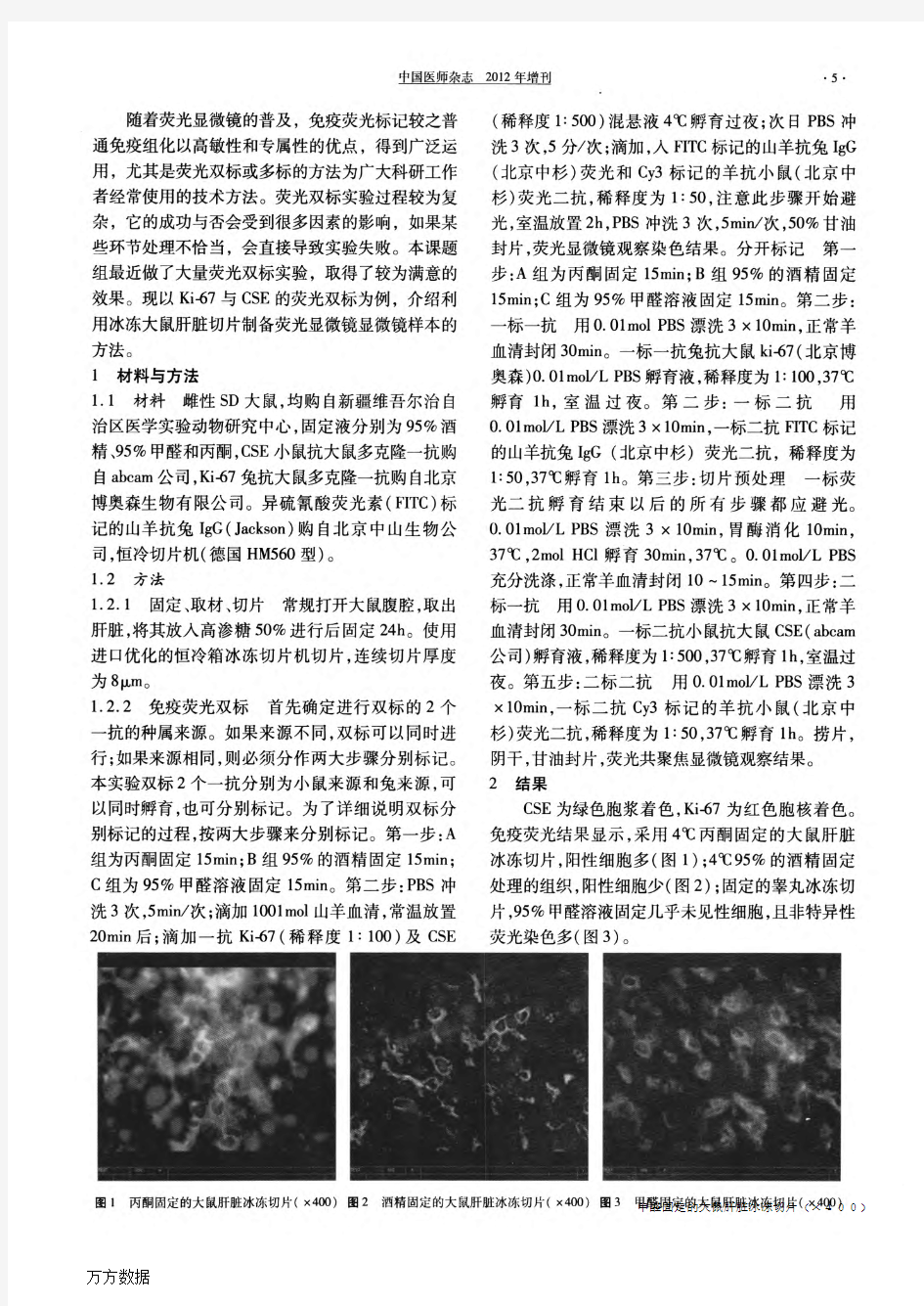
作者:阎继攀, 郑勇, 刘浩, 李睿, 张宁, 陈卫刚, YAN Ji-pan, ZHENG Yong, LIU Hao, LI Rui,ZHANG Ning, CHEN Wei-gang
作者单位:阎继攀,刘浩,YAN Ji-pan,LIU Hao(石河子大学医学院, 新疆维吾尔自治区石河子,832000), 郑勇,李睿,张宁,陈卫刚,ZHENG Yong,LI Rui,ZHANG Ning,CHEN Wei-gang(石河子大学医学院第一附属医院消化内科)
刊名:
中国医师杂志
英文刊名:Journal of Chinese Physician
年,卷(期):2012(z1)
参考文献(9条)
1.Dorman DC;Moulin FJ;McManus BE Cytochrome oxidase inhibition with tissue sulfide concentrations in the rat
brain,liver,lung,and nasal epithetlium 2002(01)
2.陈卫刚;郑勇;宋丽秀内源性H2S对大鼠实验性肝硬化门脉高压的影响[期刊论文]-世界华人消化杂志 2011(05)
3.张宁;郑勇;王于理内源性硫化氢在不同时期大鼠肝硬化中的作用[期刊论文]-世界华人消化杂志 2009(03)
4.Oretti G;Becker M;Key G Monoclonal antibodies against recombinant parts of the Ki-67 antigen (MIB1 and MIB3) detect proliferating cells in microwave-processed formalin-fixed paraffin sections 1992(04)
5.Ng IO;Na J;Lai EC Ki-67 antigen expression in hepatocellular carcinoma using monoclonal antibody MIBI,a comparison with proliferating cell nuclear antigen 1995(03)
6.孙和国;何毅民;孙莉三种固定液对冷冻组织切片固定效果的比较[期刊论文]-诊断病理学杂志 2001(02)
7.蔡文琴现代使用细胞与分子生物学实验技术 2003
8.Jackson EL;Willis N;Mercer K Analysis of lung tumor initiation and progression using conditional expression of oncogenic K 2ras 2001(24)
9.Kim CF;Jackson EL;Woolfenden AE Identification of bronchioalveolar stem cells in normal lung and lung cancer
2005(06)
本文链接:https://www.360docs.net/doc/785287711.html,/Periodical_zgyszz2012z1002.aspx
石蜡切片免疫组化及免疫荧光染色方法
石蜡切片免疫组化及免疫荧光染色方法 1、组织得采集、固定与保存: 采取组织后, 方法一:4%多聚甲醛(4%PFA)4?C固定1小时(根据组织大小与致密程度调整固定时间)或过夜 方法二:采用bouin’s固定RT 2h(6—8dtesis)or RT过夜(成年tesis) PBS缓冲液洗三次,每次5min,4?C保存于70%乙醇中。 2、组织得包埋、切片、展片及保存:: 固定后得样品经梯度乙醇脱水、二甲苯透明,52-54?C石蜡包埋,常规切片,切片厚4—10μm,贴于处理过得干净载玻片上,37?C烤片过夜,之后收集于载片盒中,RT密封保存。 石蜡包埋: 保存于4?C70%乙醇中得组织样品 ↓ 80%乙醇15min ↓ 95%乙醇15 min ↓ 100%乙醇15min? 2 ↓ 1/2乙醇1/2二甲苯15 min ↓ 二甲苯透明5-10 min ↓ 1/2二甲苯1/2石蜡30 min
↓ 石蜡(1) 1。5hr ↓ 石蜡(2) 1.5-2.5hr ↓ 石蜡(3) 包埋 ↓ RT保存 3、石蜡组织切片得免疫组化方法: 密封保存于RT得组织切片 ↓ 二甲苯(1) 20 min ↓ 二甲苯(2)20min ↓ 100%乙醇20min ↓ 95%乙醇10 min ↓ 80%乙醇10min ↓ 通风橱晾干,阻水笔在组织周围画圈 ↓ 切片在PBS中浸泡 5 min*2 ↓ 0.4%Tritonx RT10 min ↓ 切片在PBS中浸泡 5 min*3 3%H2O2 RT 10min
切片在PBS中浸泡5min*3 0、25%胰酶RT 10min 切片在PBS中浸泡 5 min*3 Blocking buffer(3%BSA+5%NGS+0、2%Tritonx—100 in PBS) RT 60min 倾去blocking buffer,勿洗 一抗4 C overnightin blockingbuffer 取出切片复温1h,切片在PBS中浸泡 5 min*3 二抗inblocking buffer GAR1:200 (GAM1:100),R T 1h 切片在PBS中浸泡5min*3 DAB显色5—10min(50微升A+50微升B+900微升PBS+5微升3%H2O2) 如果就是增强型DAB只要1min即可。 切片浸入PBS终止显色,HE衬染1s, 玻片架放入泡沫盒,流水冲洗15min,肉眼瞧到淡淡得紫色即可停止。 若颜色太深,可用0、1-0、5%盐酸乙醇分色1~2秒钟(或更久)
免疫荧光双染
免疫荧光双染 在同一组织细胞标本上需要同时检测两种抗原时,需进行双重荧光染色。双重免疫荧光标记法(double immu nofluoresce nee labeli ng method)也分为直接法和间接法。 冰冻切片荧光tunel +免疫荧光双标实验步骤 1、?冰冻切片固定:冰冻切片从冰箱拿出来复温,晾干水分,冷丙酮固 定10min,待丙酮完全干后于PBS(PH7.4)中在脱色摇床上晃动洗涤3次,每次5min。 2、?修复:切片稍甩干后用组化笔在组织周围画圈(防止液体流走), 在圈内滴加蛋白酶K工作液(蛋白酶K储存液用PBS?1:9稀释)覆盖组织, 37度温箱孵育30min。将玻片置于PBS(PH7.4)中在脱色摇床上晃动洗涤3次,每次5min。 3、?破膜:切片稍甩干后在圈内滴加破膜工作液覆盖组织,常温下孵育 20min,将玻片置于PBS(PH7.4)中在脱色摇床上晃动洗涤3次,每次5min。 4、?加试剂1,2:按片子数量和组织大小取tunel试剂盒内适量试剂1? (TdT)? 和试剂2(dUTP)按2:29混合(试剂1,2为现配现用),加到圈内覆盖组织,切片平放于湿盒内,37 C恒温孵育2小时,湿盒内加少量水保持湿度。 5、?BSA封闭:将玻片置于PBS (PH7.4)中在脱色摇床上晃动洗涤3次, 每次5min,在圈内滴加用3%BSA均匀覆盖组织,室温封闭30min。 6、?加一抗:轻轻甩掉封闭液,在切片上滴加PBS按一定比例配好的一抗, 切片平放于湿盒内4 °孵育过夜。(湿盒内加少量水防止抗体蒸发)7、?加二
抗:玻片置于PBS ( PH7.4)中在脱色摇床上晃动洗涤3次,每次5min 。切片稍甩干后在圈内滴加与一抗相应种属的二抗覆盖组织,避光室温孵育50min 。 8、?DAPI复染细胞核:切片用PBS( PH7.4)洗涤3次,每次5min。去除PBS 后在圈内滴加DAPI 染液,避光室温孵育10min。 9、封片:玻片置于PBS (PH7.4) 中在脱色摇床上晃动洗涤3次,每次 5min 。切片稍甩干后用抗荧光淬灭封片剂封片。 10、?镜检拍照:切片于尼康倒置荧光显微镜下观察并采集图像。 (紫 外激发波长330-380nm,发射波长420nm;FITC绿光激发波长465-495nm, 发射波长515-555?nm;CY3 红光激发波长510-560,发射波长590nm) 石蜡切片荧光tunel +免疫荧光双标实验步骤 1、?石蜡切片脱蜡至水:依次将切片放入二甲苯I 15- 20min-二甲苯 n 15- 20min-无水乙醇I 10min-无水乙醇n 10min-95%酒精5min-90%酒精 5min-80%酒精5min-70%酒精5min-蒸馏水洗(冬天脱蜡时间稍微延长) 。 2、?修复:切片稍甩干后用组化笔在组织周围画圈(防止液体流走), 在圈内滴加蛋白酶K工作液(蛋白酶K储存液用PBS?1:9稀释)覆盖组织, 37度温箱孵育30min。将玻片置于PBS ( PH7.4)中在脱色摇床上晃动洗涤3 次,每次5min 。 3、?破膜:切片稍甩干后在圈内滴加破膜工作液覆盖组织,常温下孵育 20min,将玻片置于PBS( PH7.4)中在脱色摇床上晃动洗涤3次,每次5min。 4、?加试剂1,2:按片子数量和组织大小取tunel试剂盒内适量试剂1?(TdT)? 和试剂2(dUTP)按2:29混合,加到圈内覆盖组织,切片平放于湿盒内, 37C恒温箱孵育2小时,湿盒内加少量水保持湿度。 5、?BSA封闭:将玻片置于PBS ( PH7.4)中在脱色摇床上晃动洗涤3次, 每次5min,在圈内滴加用3%BSA均匀覆盖组织,室温圭寸闭30min。
流式细胞术的样品制备(1)
第二节流式细胞术的样品制备 节概述 待测标本的制备是流式细胞术分析的关键,本节分别直接免疫荧光标记、间接免疫荧光标记、微量全血法免疫荧光标记、双标记、培养细胞DNA荧光标记以及细胞凋亡检测样品的制备。 知识点导航 1.直接免疫荧光标记的样品制备 用标有荧光素的特异抗体对细胞进行直接染色,然后用流式细胞仪检测,阳性者即表示有相应抗原存在。实验步骤如下: (1)每份取100 μl单细胞悬液(细胞密度约1×106个细胞)。 (2)一份加入相应量的异硫氰酸荧光素或藻红蛋白标记的特异性荧光直标单抗,另一份加入荧光标记的无关单抗,作为阴性对照样品。 (3)室温下避光反应一定时间(时间长短根据试剂说明书要求进行),一般在室温下反应15~30min 即可。 (4)加入500 μl磷酸缓冲液重悬成单细胞悬液即可上机检测。 2.间接免疫荧光标记的样品制备
(1)取1×106个细胞/100μl,先加入一抗混匀,置室温下避光反应30 min。 (2)用PBS洗涤细胞2次,离心沉淀弃掉上清液(离心转数一般为800~1000 r/min,5 min)。 (3)用100 μl PBS重悬细胞,再加入FITC或PE标记荧光二抗(用量均按说明书要求加入)混匀,室温下反应30 min。 (4)用PBS再洗涤细胞2次,加入500 μl PBS重悬成单细胞悬液,上机检测。 注意:以上两种染色方法的抗体加入量和反应时间,没有非常具体的规定,一般应根据试剂使用说明书的要求进行。若说明书上未说明,应先进行预实验,掌握好剂量与最佳反应时间后,再进行流式样品的制备。制备好的样品,若不能及时上机检测,用1%~4%的多聚甲醛固定,4℃下可保存 5d。 3.微量全血法免疫荧光标记的样品制备 目前制备全血细胞样品的方法很多,且很成熟,常用的方法是用淋巴细胞分离液分离淋巴细胞,然后进行特异性荧光染色,其染色方法与前面介绍的方法相同。下面主要介绍与流式细胞仪配套的Q PREP(免疫学样品处理器)进行快速制备微量全血样品的方法: (1)微量全血直接荧光染色法:具体方法为①取肝素或EDTA抗凝全血100 μl置12 mm×75 mm专用塑料试管中;②每份加入20 μl特异性荧光单抗,另一份加入荧光标记的无关单抗作阴性对照,室温下避光染色15 min;③置Q PREP 仪上溶解红细胞、稳定和固定白细胞,静置5 min; ④上流式细胞仪检测。 (2)微量全血间接荧光染色法:具体方法为①取肝素或EDTA抗凝全血100 μl置12×75 mm专
细胞免疫荧光实验步骤
细胞免疫荧光实验步骤 细胞免疫荧光实验步骤 简单实验步骤如下: 1.漂洗血清蛋白H7.2-7.4 37度 PBS 2小时. 2.-20度甲醇固定20分钟后,自然、干燥 10分钟 3.PBS洗净:3min*3 4.1%Triton:25min-30min.配成50ultriton+5mlpBS 5.PBS洗净:2*5min 6.羊血清封闭:37度,20分钟 7.一抗,4度过夜,一般要大于18小时或者37度1-2小时 8.4度PBS洗净,3min*5次 9.二抗37度小于一小时 10.37度PBS洗净,3*5min 凉干封片(封闭液PH8.5) 活细胞免疫荧光技术-流式细胞仪标本的制备 (一)制备活性高的细胞悬液(培养细胞系、外周血单个核细胞、 胸腺细胞、脾细胞等均可用于本法) ↓ 用10%FCS RPMI1640调整细胞浓度为 5×106~1×107/ml ↓ 取40μl细胞悬液加入预先有特异性McAb(5~50μl) 的小玻璃管或塑料离心管,再加50μl 1∶20(用DPBS 稀释)灭活正常兔血清 ↓4℃ 30min 用洗涤液洗涤2次,每次加洗涤液2ml左右 1000rpm×5min
↓ 弃上清,加入50μl工作浓度的羊抗鼠 (或兔抗鼠)荧光标记物,充分振摇 ↓4℃ 30min 用洗涤液洗涤2次,每次加液2ml左右 1000rpm×5min ↓ 加适量固定液(如为FCM制备标本,一般加入 1ml固定液,如制片后在荧光显微镜下观察, 视细胞浓度加入100~500μl固定液) ↓ FCM检测或制片后荧光显微镜下观察 (标本在试管中可保存5~7天) (二)试剂和器材 1. 各种特异性单克隆抗体。 2. 荧光标记的羊抗鼠或兔抗鼠第二抗体,灭活正常兔血清。 3. 10% FCS RPMI1640, DPBS、洗涤液、固定液(见附录)。 4. 玻璃管、塑料管、离心机、荧光显微镜等。 (三)注意事项 1. 整个操作在4℃下进行,洗涤液中加有比常规防腐剂量高10倍的NaN 3,上述实验条件是防止一抗结合细胞膜抗原后发生交联、脱落。 2. 洗涤要充分,以避免游离抗体封闭二抗与细胞膜上一抗相结合,出现假阴性。 3. 加适量正常兔血清可封闭某些细胞表面免疫球蛋白Fc受体,降低和防止非特异性染色。 4. 细胞活性要好,否则易发生非特异性荧光染色。 附: 1. DPBS (×10, 贮存液)
双标记免疫荧光染色
双标记免疫荧光染色 一、实验目的: 1.检测MT, IGF-1/FGF5与两个目的基因所表达的蛋白的共表达。 2.检测目的基因所表达的蛋白定位。 3.检测褪黑激素或细胞因子对目的基因高表达的影响以及表达规律。 二、实验材料: 1.试剂:多聚甲醛,目的基因一抗,自带荧光的二抗(地高辛-地高辛抗体,生物素-链霉亲和素)细胞核染料DAPI 2. 器材:激光共聚焦显微镜显微镜专用玻片,共聚焦专用培养皿。 三、实验步骤: 1.细胞培养: 取对数期细胞于6孔板培养24小时,放入共聚焦专用玻片,贴壁细胞爬片需要24小时,细胞数目达到4×104个细胞,设置两个以上六孔板分别为对照组和实验组; 2.实验组加药处理: 加入MT或IGF-1或FGF5处理24小时或48小时,72小时。 3.上镜前处理: 将玻片取出,PBS洗3次,4%多聚甲醛固定15min;PBS洗多次,加0.1%Triton-X100透化10min;PBS洗3次,5%FBS室温封闭一到数小时;PBS洗3次,将MT、FGF-5、IGF-1抗体(1:200)和目的基因(工作液)两两组合,共六组,按体积比1:1混匀,一起加到切片上,4℃过夜; 第二天,PBS洗3次,加入荧光二抗[加入TRITC(罗丹明)标记羊抗兔IgG(1:100);37℃孵育30 min;加人FITC标记山羊抗鼠IgG(1:100)],室温避光45min;(之后均为避光操作)PBS洗3次,加入核染料,n分钟;PBS洗3次,灭菌水洗2次; 取处理好的载玻片,写好组别,在正中央滴约30ul防猝灭剂,小心将盖玻片夹起,缓慢放下,不要产生气泡,避光晾干。 以PBs代替一抗作为阴性对照,省略一抗作空白对照。 4.镜检 四、结果预测: 1.共表达: 两个基因分别为阳性红色,绿色。共表达出现红绿重叠而呈现黄色荧光,显示蛋白定位。 2.正负表达:看荧光强弱。
荧光光谱分析实验讲义
实验荧光光谱分析 一、实验目的与要求: 1. 了解荧光分光光度计的构造和各组成部分的作用; 2. 掌握荧光分光光度计的工作原理; 3. 掌握激发光谱、发射光谱及余辉衰减曲线的测试方法。 二、基本概念 1. 发射光谱 是指发光的能量按波长或频率的分布。通常实验测量的是发光的相对能量。发射光谱中,横坐标为波长(或频率),纵坐标为发光相对强度。 发射光谱常分为带谱和线谱,有时也会出现既有带谱、又有线谱的情况。 2. 激发光谱 是指发光的某一谱线或谱带的强度随激发光波长(或频率)变化的曲线。横坐标为激发光波长,纵坐标为发光相对强度。 激发光谱反映不同波长的光激发材料产生发光的效果。即表示发光的某一谱线或谱带可以被什么波长的光激发、激发的本领是高还是低;也表示用不同波长的光激发材料时,使材料发出某一波长光的效率。 3. 余辉衰减曲线 是指激发停止后发光强度随时间变化的曲线。横坐标为时间,纵坐标为发光强度(或相对发光强度)。 三、测试仪器 激发光谱、发射光谱及余辉衰减曲线的测试采用日本岛津RF-5301PC型荧光分光光度计。 从150W氙灯光源发出的紫外和可见光经过激发单色器分光后,再经分束器照到样品表面,样品受到该激发光照射后发出的荧光经发射单色器分光,再经荧光端光电倍增管倍增后由探测器接收。另有一个光电倍增管位于监测端,用以倍增激发单色器分出的经分束后的激发光。 光源发出的紫外-可见光或者红外光经过激发单色器分光后,照到荧光池中的被测样品上,样品受到该激发光照射后发出的荧光经发射单色器分光,由光电倍增管转换成相应电信号,再经放大器放大反馈进入A/D转换单元,将模拟电信号转换成相应数字信号,并通过显示器或打印机显示和记录被测样品谱图。 四、样品制备 液体试样
免疫荧光细胞化学染色方法
免疫荧光细胞化学染色方法 一、标本制作 可制作涂片、印片、细胞单层培养物、组织切片,经适当固定或不固定,作免疫荧光染色用。 二、荧光抗体染色方法 (一)直接法 1.染色切片经固定后,滴加经稀释至染色效价如1:8或1:16的荧光抗体(如兔抗人γ-球蛋白荧光抗体或兔抗人IgG或IgA荧光抗体等),在室温或37℃染色30min,切片置入能保持潮湿的染色盒内,防止干燥。 2.洗片倾去存留的荧光抗体,将切片浸入pH7.4或 pH7.2PBS中洗两次,搅拌,每次5min,再用蒸馏水洗1min,除去盐结晶。 3.用50%缓冲(0.5mol/L碳酸盐缓冲液pH9.0~9.5)甘油封固、镜检 4.对照染色 ①正常免荧光血清染色,如上法处理切片,结果应为阴性。 ②染色抑制试验(一步法):将荧光抗体和未标记的抗体球蛋白或血清(相同)等量混合,如上法处理切片。结果应为阴性。为证明此种染色抑制不是由于荧光抗体被稀释所致,可用盐水代替
未标记抗血清,染色结果应为阳性。此法结果较二步法稳定。③类属抗原染色试验,前面已作叙述。 直接法比较简单,适合做细菌、螺旋体、原虫、真菌及浓度较高的蛋白质抗原如肾、皮肤的检查和研究。此法每种荧光抗体只能检查一种相应的抗原,特异性高而敏感性较低。 (二)间接法 (1)切片固定后用毛细滴管吸取经适当稀释的免疫血清滴加在其上,置于染色盒中保持一定的湿度,37℃作用30min。然后用0.01mol/l pH7.2PBS洗两次,10min,用吸水吸去或吹干余留的液体。 (2)再滴加间接荧光抗体(如兔抗人γ-球蛋白荧光抗体等),同上步骤,染色30min,37℃,缓冲盐水洗两次10min,搅拌,缓冲甘油封固,镜检。 对照染色:①抗体对照:用正常兔血清或人血清代替免疫血清,再用上法进行染色,结果应为阴性。②抗原对照:即类属抗原染色,亦应为阴性。③阳性对照。 间接法中上述方法称双层法(Double Layer Method)。另一种称夹心法,即用未标记的特异性抗原加在切片上先与组织中之相应抗体结合,再用该抗原之荧光抗体重叠结合其上,而间接地显示出组织和细胞中抗体的存在,方法步骤如下: ①切片或涂片固定后,置于染色湿盒内。 ②滴加未标记的特异性抗原作用切片于37℃,30min。
免疫荧光双标操作方法及注意事项
在同一组织细胞标本上需要同时检测两种抗原时,需进行双重荧光染色。双重免疫荧光标记法(double immunofluorescence labeling method)也分为直接法和间接法。 (1)直接法双重免疫荧光标记:将标记有两种不同荧光素的抗体(如抗A 和抗B)以适当比例混合,滴加在标本上孵育,然后洗去未结合的荧光抗体,在荧光显微镜下分别选择两种相应的激发滤片观察,即可对两种抗原进行定位和定量。直接法简便可靠,但灵敏度较低。 (2)间接法双重免疫荧光标记:用未标记的两种特异性第一抗体孵育组织或细胞,洗去多余的第一抗体后,再用两种不同的荧光素分别标记的第二抗体孵育组织或细胞,洗去多余的第二抗体,后在荧光显微镜下分别选择两种相应的激发滤片观察,从而对两种抗原进行定位和定量。使用此法应注意两种特异性第一抗体必须来源于不同种属,且荧光标记第二抗体的种属必须与第一抗体的种属相匹配。 免疫荧光双标技术中操作要点和注意事项 一、免疫荧光技术中标本制作的基本程序近似于酶免疫组化,不同点如下: 1、免疫荧光不需要使用双氧水处理,封闭和一抗孵育与其相同。 2、免疫荧光的二抗使用不同荧光标记的二抗孵育,孵育时间根据抗体的工作浓度确定。 3、二抗孵育之后充分洗片后即可贴片、封片和观察。 4、免疫荧光在封片时常使用专用封片剂或甘油:0.01M PBS (1:1)。条件许可,建议购买抗淬灭的封片液,使标本可以保存更久。
5、荧光抗体的孵育以及后续处理需要避光。 6、荧光抗体染色假阳性可能会多,需要分别设定阳性和阴性对照。 二、注意事项 1、荧光染色后一般在1h内完成观察,或于4℃保存4h,时间过长,可能会使荧光提前衰退。 2、每次试验均需设置以下三种对照: (1) 阳性对照:阳性血清+荧光标记物; (2) 阴性对照:阴性血清+荧光标记物; (3) 荧光标记物对照:PBS+荧光标记物。 三、免疫荧光双标的经验之谈 1、选取一抗时,要求来源于两种不同的动物,我用的是来源于家兔和大鼠的抗体,二抗则是不同荧光信号标记的,我用的是donkey anti-rabbit-FITC(绿)和donkey anti-rat-Tex-Red(红)。 2、我的做法是两种一抗同时孵育,然后两种二抗同时孵育。抗体浓度、孵育时间要自我摸索,我感觉一抗4℃孵育过夜比较好,背景比较清晰。 3、我的阳性对照采用的是阳性组织切片,阴性对照则分别是家兔和大鼠的IgG,荧光标记物对照是PBS+荧光标记物。 4、封闭血清是二抗来源动物的正常血清,我用的是10%正常donkey 血清。 5、其余事项同免疫荧光单标操作。 免疫组化双重染色方法和步骤 在生物医学和临床研究实践中,经常需要检测两种不同物质是否在同一
荧光分析
BaSiO 3 :Eu3+红色荧光粉的制备 一.实验目的 1、通过查阅文献,了解稀土离子掺杂荧光粉的发光原理 2、熟悉高温固相法制备BaSiO 3 :Eu3+红色荧光粉的过程 3、了解荧光粉体的相关性能指标,学习其表征手段 二、实验原理 三价稀土离子或三价过渡金属离子作为半导体杂质,与缺陷体形成复合体,在外界激发下,其内部产生辐射复合,发出特征光。 稀土离子最外层电子为5s2和5p6满壳层结构,形成很好的屏蔽作用,于是稀土离子的4f电子的发射基本上保持离子的特征,周围晶体场对稀土离子的作用很弱,发光起源于稀土能级间的跃迁,比较容易辨认。而过渡族离子并不存在4f电子层外的满层电子结构,所以3d电子跃迁受周围晶体场的影响较大,但考虑到晶体场的影响,仍可以找到发光跃迁与过渡金属离子能级间的关系。 本实验以BaCO 3、SiO 2 、Eu 2 O 3 为原料,用高温固相法制备BaSiO 3 :Eu3+荧光粉体, 其中稀土离子Eu3+作为发光杂质中心,预计发射红色光。 三、实验用品 实验药品:化学试剂(A.R.)、BaCO 3(A.R.)、SiO 2 、(A.R.)、Eu 2 O 3 (A.R.) 实验设备:电子分析天平,药匙,称量纸,研钵、氧化铝舟、1200o C高温度、F-4600荧光分光光度计。 四、实验步骤 1. 固体粉末的称量与研磨 计算出制备3.0g荧光粉所需要的BaCO 3,SiO 2 , Eu 2 O 3 各多少克。在分析天平称 量后在玛瑙研钵中进行研磨10分钟。 2. 样品的烧结。 将配置研磨好的粉体样品放入氧化铝坩埚或氧化铝舟中,在高温炉中进行煅烧。煅烧温度1100-1200度。(在烧结过程中应有专人看管高温炉)烧结结束如样品结块需对样品进行研磨成粉状。 3. 煅烧粉体或烧成样品荧光粉的的结构使用X射线衍射仪进行表征; 4. 发光性能的测试:可选择日立的F4600荧光分光光度计对荧光粉进行发光特性测试; 5. 利用LED点胶机将成品LED芯片和荧光粉进行组装。并进行点亮,观察荧光粉加入前后LED颜色的变化。 6. 结果分析与讨论,并撰写综合实验报告。 五、结果分析 样品的发射光谱及激发光谱如附图。 Eu2+离子的发光特性: Eu2+离子具有4f65d1→4f75d0能级跃迁发射。由于4f电子对晶格环境并不敏感而5d电子处于没有屏蔽的外层裸露状态,受晶场的影响较显著,且容易与晶格发生强烈的耦合作用,致使4f5d杂化轨道能级劈裂,并强烈地与晶格声子产生耦合,从而导致了宽带吸收且在250~420nm范围内,荧光粉都能受到有效激发,而且吸收效率主要取决于4f65d到的吸收面积,这种4f65d1→4f7d0能级跃迁收基质晶场影响较大,通常呈现宽谱发射,发射强度大,而且发射峰位可调性大。 Eu3+浓度对发光性质的影响。 掺杂浓度是荧光粉制备所必须考虑的一个重要因素,低的掺杂浓度不能给出是够强的发光,
免疫荧光检测
免疫荧光技术(检测抗核抗体(ANA)的实验方案) 荧光免疫技术是以荧光物质标记的特异性抗体或抗原作为标准试剂,用于相应抗原或抗体的分析鉴定和定量测定。荧光免疫技术包括荧光抗体染色技术和荧光免疫测定两大类。荧光抗体染色技术是用荧光抗体对细胞、组织切片或其他标本中的抗原或抗体进行鉴定和定位检测,可在荧光显微镜下直接观察结果,称为荧光免疫显微技术,或是应用流式细胞仪进行自动分析检测,称为流式荧光免疫技术。荧光免疫测定主要有时间分辨荧光免疫测定和荧光偏振免疫测定等。本次实验以荧光免疫显微技术检测抗核抗体(ANA)为例进行实习。 抗核抗体(antinuclear antibody,ANA)又称抗核酸抗原抗体,是一组将自身真核细胞的各种成分脱氧核糖核蛋白(DNP)、DNA、可提取的核抗原(ENA)和RNA等作为靶抗原的自身抗体的总称,能与所有动物的细胞核发生反应,主要存在于血清中,也可存在于胸水、关节滑膜液和尿液中。 抗核抗体实验原理 以小鼠肝细胞或某些培养细胞(如Hep-2)作抗原片,将病人血清加到抗原片上。如果血清中含有ANA,就会与细胞核成分特异性结合。加入荧光素标记的抗人IgG抗体又可与ANA结合,在荧光显微镜下可见细胞核部位呈现荧光。 试剂与器材 1.抗原片现多用商品试剂。如需自行制备,方法如下: (1)肝印片制备:取4-8周龄小鼠,断颈杀死后,剖腹取肝。将肝脏剪成平面块,用生理盐水洗去血细胞,用滤纸吸干渗出的浆液。将切面轻压于载玻片上,使其在载玻片上留下薄层肝细胞。冷风吹干,乙醇固定,冰箱可保存1周。
(2)Hep-2细胞抗原片制备:Hep-2细胞是建株的人喉癌上皮细胞。经适宜培养在载玻片上形成单层细胞抗原片,用洗涤洗去培养基。干燥后,用无水乙醇固定。 (3)肝切片制备:取小鼠肝组织作冰冻切片,厚4μl。-30℃保存备用。 2.异硫氰酸荧光素(FITC)标记的抗人IgG抗体(FITC-抗人IgG抗体)有商品供应,临用时按效价稀释。 3.L PBS 4.缓冲甘油取甘油9份加PBS 1份。 5.待测血清、阳性和阴性对照血清临床标本筛选获得。 6.器材荧光显微镜、孵箱、有盖湿盒、染色缸、吸管、试管等 操作方法 1.准备:检查加样板,生物载片恢复室温,标记。 2.稀释:PBS-Tween缓冲液稀释血清,设阴阳性对照。 3.加样:加样板放于泡沫塑料板上,加25μl稀释后血清,至加样板的每一反应区,避免气泡。加完所有标本后开始温育。 4.温育:将生物薄片盖于加样板的凹槽里,反应开始,室温温育30分钟。 5.冲洗:用烧杯盛PBS-Tween缓冲液流水冲洗生物薄片,然后立即将其浸入盛有PBS-Tween缓冲液的小杯中至少1分钟。不必混摇。 6.加样:滴加20μl荧光素标记的抗人球蛋白(结合物)至一洁净加样板的反应区,完全加完方可继续温育。荧光素标记的抗人球蛋白用前需混匀并以PBS-Tween缓冲液稀释。
免疫荧光实验步骤大全(精华版)
免疫荧光染色大全(精华版) 组织免疫荧光法 (1)将待染组织切片置于65摄氏度恒温箱烤片1h,脱蜡 (2)1×PBS 洗涤 3 次,每次 5min。 (3)0.5%Triton X-100(PBS 配制)室温通透 10min (4)1×PBS 洗涤 3 次,每次 5min。 注意:步骤(3)和(4)用于检测细胞核抗原,细胞膜抗原直接跳过此步骤(5)抗原修复:使用柠檬酸盐缓冲液进行抗原修复,微波炉微波高火3min,后转成低火 15min。 (6)1×PBS 洗涤 3 次,每次 5min。 (7)3% H2O2,室温孵育30min,目的是灭活内源性过氧化物酶。 (8)1×PBS 洗涤 3 次,每次 5min。 (9)使用1% BSA进行室温封闭 30min,用于封闭非特异性抗原表位。 (10)按抗体推荐使用说明书孵育特异性一抗,4°C 湿盒中静置过夜。(11)次日取出切片,室温下复温 30min。 (12)1×PBS 洗涤 3 次,每次 5min。 (13)选取相应的免疫荧光二抗滴加于血管组织上,37°C避光孵育30min。(14)1×PBS洗涤 3 次,每次 5min。 (15)避光条件下,DAPI 染液染细胞核,浓度和时间根据试剂说明书使用(16)1×PBS洗涤 3 次,每次5min。 (17)在血管组织上滴加抗荧光淬灭剂进行封片。 (18)使用荧光显微镜进行观察拍照。 贴壁细胞免疫荧光法 (1)在培养板中接种的带染色的细胞爬片用PBS泡洗3次×3min (2)4%多聚甲醛固定细胞爬片15min (3)1×PBS洗涤 3 次,每次5min。 (4)0.5%Triton X-100(PBS配制)室温通透10min (5)1×PBS洗涤 3 次,每次5min。 (6)1%BSA室温封闭30min (7)弃掉封闭液,细胞爬片滴加适量稀释至适当比例的一抗,4℃孵育过夜(8)1×PBS洗涤 3 次,每次5min。 (9)细胞爬片滴加稀释至适当比例的荧光二抗 (10)1×PBS洗涤 3 次,每次5min。 (11)DAPI染细胞核,浓度和时间根据试剂说明书使用 (12)1×PBS洗涤 3 次,每次5min。 (13)用抗荧光淬灭剂封片 (14)荧光显微镜下观察采集图像 细胞免疫荧光(悬浮细胞方法一) (1)收集悬浮细胞,细胞在冰浴中冷却,然后用台式离心机于4℃以800 g 离心5 min,吸去培养液并以4℃ 1×PBS重悬细胞。
免疫荧光染色
荧光免疫染色和DAPI染色实验 1.实验原理 免疫染色的实验原理类似于Western Blotting,两者都是运用抗体的特异性识别作用来显示目的蛋白,但是由于免疫染色需要在原位进行,而且蛋白没有经过富集,因此其实验难度较高。 实验的基本原理是:利用固定剂(通常是甲醛或多聚甲醛)将细胞固定,使得细胞膜的通透性大大增加,并且利用Triton-X-100使得一部分膜蛋白变性,从而使通透性进一步加强。利用正常羊血清封闭,可以令许多蛋白先与血清内的非特异性抗体结合,而特异性的抗体由于动力学的关系可以通过竞争性的反应与目的蛋白结合,这一过程可以保证抗体识别的特异性。二抗可以特异性识别一抗的Fc区域,利用二抗连接不同的荧光基团,就可以在荧光显微镜下观察到不同的荧光,从而显示目的基因的表达情况。 另外,免疫荧光实验由于其较高的敏感性可以显示出基因表达的亚细胞情况(核内,核外,膜上以及一些较大的细胞器上),所以通常被用来作为基因定位的方法。 DAPI的中文名称是4,6-联脒-2-苯基吲哚,是一种常用的荧光染料,其作用机理与溴化乙锭(EB)等染色剂的机理类似:它们与DNA双螺旋的凹槽部分可以发生相互作用,从而与DNA 的双链紧密结合。结合后产生的荧光基团的吸收峰是358nm而散射峰是461nm,正好UV (紫外光)的激发波长是356nm,使得DAPI成为了一种常用的荧光检测信号。 Jagielski M. et. Al在1976年首次运用该技术检测细胞培养中的支原体感染。后来随着技术的进步,该技术被运用于各种微生物的检测、生长监测,胚胎发育过程的检测,细胞周期的检测和各种核定位的实验。 本实验就是利用DAPI染色标记细胞核的位置。 免疫染色实验方法和步骤 免疫染色(immunol staining)包括免疫荧光(immunol fluorescence)、免疫组化(immunol histochemistry)、免疫细胞化学(immunol cytochemistry)等,可以参考如下步骤进行操作。 1. 样品准备(Sample preparation) 对于贴壁细胞: 可以直接用多孔板,例如6孔板、24孔板等,培养细胞,然后到预定时间时进行固定等后续操作。 也可以用洁净的盖玻片,70%乙醇中浸泡后,用无菌的镊子放置到6孔板内,然后用无菌的生理盐水、PBS或培养液洗去残留的乙醇。这时就可以种入细胞进行培养,待细胞贴在盖玻片上生长良好后,即可进行固定等后续操作。 对于悬浮细胞: 把细胞先在固定液中固定,然后把细胞滴加在载玻片上,干燥后细胞会紧贴在载玻片上。然后就可以进行后续操作。如果细胞的粘附能力不佳,可以在载玻片上用PDL等物质进行处理,以增强载玻片的粘附能力。 对于冷冻切片: 切片放置在载玻片上后,可以直接进行固定等后续操作。 对于石蜡切片:
免疫荧光技术的实验方法及其分类
免疫荧光技术的实验方法及其分类 一、免疫标记法及其分类 1.荧光免疫法 原理是应用一对单克隆抗体的夹心法。底物用磷酸-4-甲基伞形酮,检测产物发出的荧光,荧光强度与Mb浓度呈正比,可在8min 内得出结果。结果以Mb每小时释放的速率表示(△Mb)表示。该法重复性好,线性范围宽,具有快速、敏感、准确的特点。 以双抗夹心法为例,首先将特异性抗体与固相载体连接,形成固相抗体。除去未结合抗体,然后加受检标本,使其中的蛋白抗原与固相抗体形成抗原抗体复合物。洗涤除去未结合物,接着加入荧光标记的抗体,使之与抗原特异性结合,形成抗体—抗原—抗体复合物。最后根据荧光强度,即可对蛋白抗原进行定量。 传统的荧光免疫法受本底荧光的干扰较大,时间分辨荧光免疫测定法是以具有特长寿命的稀土金属如铕,作为标记物,加入正常液后激发测定,能有效去除短寿命本底荧光的干扰。
2.放射免疫法 放射免疫法是以过量的未标记抗原与放射性物质标记的抗原,竞争性地与抗体结合,形成有放射性的抗原—抗体复合物与无放射性的抗原—抗体复合物,并有过剩的标记抗原与未标记的抗原。然后通过离心沉淀等方法,将抗原—抗体复合物与游离抗原分离,分别测定其放射性强度与标准曲线比较,即可对未标记的待测抗原进行定量。 RIA法测定血清蛋白灵敏度高、特异性强,可准确定量到ng/ml 水平。但早期的方法操作麻烦,耗时长,且有放射性污染。近年来,随着单克隆抗体的应用,RIA的灵敏度又有了较大提高,且操作大为简化,并已有商品试剂盒供应,使用方便。 3.酶联免疫法(ELISA) ELISA法有竞争法和夹心法两种。竞争法是基于标准或血清Mb 和微孑L板上包被的Mb竞争性地与单克隆抗体相结合的原理而建立,该法的最低检测限为10μg/L,线性范围达1 000ug/L。夹心ELISA 法与EIA具有良好的相关性(r=0.92)。ELISA法具有灵敏度高,特异性强,精密度好,操作简单,适用于多份标本的检测,不需特殊仪器设备等优点,易于推广普及。但不适合急诊的快速检测。
X射线荧光光谱的样品制备与分析
X射线荧光光谱的样品制备与分析 陈老师 (杭州哲博化工科技有限公司哲博检测中心,浙江大学国家大学科技园,杭州西溪路525号,310013,Email:ceshi@https://www.360docs.net/doc/785287711.html,;zhebocs@https://www.360docs.net/doc/785287711.html,) X射线是一种电磁辐射,其波长介于紫外线和γ射线之间。它的波长没有一个严格的界限,一般来说是指波长为0.001-50nm的电磁辐射。对分析化学家来说,最感兴趣的波段是0.01-24nm,0.01nm左右是超铀元素的K系谱线,24nm 则是最轻元素Li的K系谱线。1923年G. Von Hevesy提出了应用X射线荧光光谱进行定量分析,但由于受到当时探测技术水平的限制,该法并未得到实际应用,直到20世纪40年代后期,随着X射线管和分光技术的改进,X荧光分析才开始进入蓬勃发展的时期,成为一种极为重要的分析手段。X射线荧光光谱法有如下特点: 1.分析的元素范围广,从4Be到92U均可测定; 2.荧光X射线谱线简单,相互干扰少,样品不必分离,分析方法比较简便; 3.分析浓度范围较宽,从常量到微量都可分析。重元素的检测限可达ppm量级,轻元素稍差; 4.分析样品不被破坏,分析快速,准确,便于自动化。 下面就X荧光光谱的方法分别阐述: 一、样品制备 进行X射线荧光光谱分析的样品,可以是固态,也可以是水溶液。无论什么样品,样品制备的情况对测定误差影响很大。对金属样品要注意成份偏析产生的误差;化学组成相同,热处理过程不同的样品,得到的计数率也不同;成分不均匀的金属试样要重熔,快速冷却后车成圆片;对表面不平的样品要打磨抛光;对于粉末样品,要研磨至300目-400目,然后压成圆片,也可以放入样品槽中测定。对于固体样品如果不能得到均匀平整的表面,则可以把试样用酸溶解,再沉淀成盐类进行测定。对于液态样品可以滴在滤纸上,用红外灯蒸干水份后测定,也可以密封在样品槽中。总之,所测样品不能含有水、油和挥发性成分,更不能
石蜡切片免疫荧光染色方法
石蜡切片免疫荧光染色方 法 Prepared on 22 November 2020
对于石蜡切片: 1、烤片:60℃ 60分钟 2、脱蜡:二甲苯中Ⅰ脱蜡15分钟→二甲苯Ⅱ脱蜡15分钟→无水乙醇Ⅰ5分钟→无水乙醇Ⅱ5分钟→90%乙醇Ⅰ5分钟→90%乙醇Ⅱ5分钟→70%乙醇5分钟 →蒸馏水5分钟→蒸馏水5分钟。 3、抗原修复:高压修复,事先烧开锅中的水,修复盒中加入l柠檬酸钠,(柠檬酸三钠 3g,柠檬酸 0.4g加入1000ml蒸馏水中),上汽后加热10分钟,关火。修复盒取出,放入装有自来水的瓷缸中缓慢冷却至室温。 2. 去除内源性酶:玻片取出放入湿盒,加3%H 2O2 2 (2ml H 2 O2 2 加入18ml蒸馏 水中,现配现用,避光),室温孵育10分钟,PBS洗3次,每次5分钟。(也可不用去除内源性酶)。 3. 封闭(Blocking) 加10%正常驴血清(原液100ul+900ulPBS,1ml够用30张片子),室温孵育封闭30分钟。如果背景较高,可以4℃封闭过夜。不用洗,用滤纸吸干周边水分。从封闭开始所有的步骤,一定要注意样品的保湿,避免样品的干燥,否则极易产生较高的背景。 4. 一抗孵育(Primary antibody incubation) 参考一抗的说明书,按照适当比例用(10%山羊血清PBS或1%BSA-PBS)稀释一抗。 立即加入稀释好的一抗, 4℃过夜,第二天取出复温45分钟。PBS洗3次,每次5分钟。 5. 二抗孵育(Secondary antibody inucubation) 按照适当比例用稀释荧光标记的二抗,立即加入稀释好的二抗,室温或4℃在侧摆摇床上缓慢摇动孵育一小时。
XRF 射线荧光制样方法浅谈
X 射线荧光制样方法浅谈 导言: 第13期的论坛线上讲座还未结束,第14期的线上讲座又接踵而至,本期讲座我们邀请了XRF 版面的专家ljzllj先生就XRF制样的方法与大家一起交流切磋。ljzllj先生一直从事XRF仪器的应用等各方面的研究工作。对XRF的仪器比较熟悉。欢迎大家就X 射线荧光制样方法的问题前来提问,也欢迎XRF方面的高手前来与ljzllj先生交流切磋~ X 射线荧光光谱法是一个相对分析方法,任何制样过程和步骤必须有非常好的重复操作可能性;用于制作校准曲线的标准样品和分析样品必须经过同样的制样处理过程。X 射线荧光实际上又是一个表面分析方法,激发只发生在试样的浅表面,必须注意分析面相对于整个样品是否有代表性。此外,样品的平均粒度和粒度分布是否有变化,样品中是否存在不均匀的多孔状态等。样品制备过程由于经过多步骤操作,还必须防止样品的损失和沾污。 目录: 一、概论 二、固体样品 三、粉末样品 1.压片法 2.熔融法 坛友提问的问题:(不断更新中...) 1、我们是用粉末压片法制样的,有时样品和蜡粉混合不是特别均匀,压成的片片表面上会有些许斑点,请问这样会不会对结果造成影响 2、制样方法那种较好,如何能最大的确保分析精度? 3、熔融法制备颗粒灰试样时,容易在样品表面有气泡,怎么办?注:样品和熔剂是1:10 4、熔融法用铂黄坩埚使用一段时间后容易变形,而且样品表面出现划痕或者容易出现爆片现象,一般是重新回炉加工铂黄坩埚,或者用抛光机在铂黄坩埚表面抛光,有好的建议吗?一般多久需要回炉一次较好? 5、制备合金样品除了用高频感应重熔样品外,有没有好的办法使用压片法分析?或者怎么能实现熔融法? 6、熔融法制样中,如果更换熔剂批次或厂家,需要重新制作工作曲线,还是重新制备标准化样品,怎么做即省事有准确? 7、熔融法制备样品时,如果对分析元素加入了内标物质,熔剂还需要准确称量吗?有没有好的建议? 8、熔融法分析轻元素(例如做保护渣中F),准确性一直不太好,有什么好的建议或方法? 9、压片法制样过程中,利用PVC直接制样,样品量需要定量吗?有什么好的建议和方法? 10、熔融法制样中,除了用铂黄坩埚,还有别的方法吗?我曾试验过用锆刚玉坩埚分析合金,但一直没能试验成功,有好的建议和方法吗? 11、请问高岭土怎么制样比较适合XRF分析,现在的情况是高岭土的要从原矿到精矿再做分析,其中精矿中还含有较多的石英砂,用锆制的研钵都研坏了,还有
免疫荧光双标技术中操作要点和注意事项
免疫荧光双标技术中操作要点和注意事项 来源:生物谷 2008-6-27 访问量:9826 评论(0)分享 一、免疫荧光的标本制作的基本程序同DAB显色的免疫组化,不同点如下: 1、免疫荧光不需要使用双氧水处理,封闭和一抗孵育与其它相同。 2、免疫荧光的二抗使用不同荧光标记的二抗孵育,孵育时间根据抗体的工作浓度确定。 3、二抗孵育之后充分洗片后即可贴片、封片和观察。 4、免疫荧光在封片使用专用封片剂或甘油:0.01MPBS (1:1)。 5、条件许可可以购买防淬灭的试剂加入封片剂中,标本可以保存更久。 6、荧光抗体的孵育以及后续处理需要闭光。 7、荧光抗体染色假阳性可能会多,需要设定阳性和阴性对照。 二、注意事项 1、荧光染色后一般在1h内完成观察,或于4℃保存4h,时间过长,会使荧光减弱。 2、每次试验时,需设置以下三种对照: (1)阳性对照:阳性血清+荧光标记物 (2)阴性对照:阴性血清+荧光标记物 (3)荧光标记物对照:PBS+荧光标记物 三、免疫荧光双标的经验之谈 1、选取primary antibodies时要来源于两种不同的动物,我用的是来源于rabbit和rat的抗体,secondary antibodies则是不同荧光信号标记的,我用的是donkey anti-rabbit-FITC(绿)和donkey anti-rat-Tex-Red(红)。
2、我的做法是两种primary antibodies同时孵育,然后两种secondary antibodies同时孵育。抗体浓度、孵育时间要认真摸索,我感觉primary antibodies 4度孵育过夜比较好,背景比较干净。 3、我的阳性对照采用的是阳性组织切片,阴性对照则分别是rabitt和rat的IgG,荧光标记物对照是PBS+荧光标记物。 4、Block用的血清使secondary antibody来源动物的血清,我的是10%正常donkey血清。 5、其余同一般操作。 原代培养胚胎14天大鼠端脑细胞:在骨发生形态蛋白—{诱导下,乙酰胆碱转移酶(呈绿色荧光)和同源域蛋白Islet—1(呈红色荧光)共存于细胞质内(激光扫描共 聚焦显微镜观察) 1.一步双染色法先将两种荧光标{己抗体按适当比例混合(A+B),按直接法进行染色。 2.二步双染色法先用TRITC标记的A抗体进行免疫荧光染色,再用FITC标记的B抗体染色,根据两种抗体的动物种属不同,可用直接法也可用间接法,结果A抗原呈现橘红色荧光,而B抗原呈现黄绿色荧光。在应用中,常用的方法是免疫荧光组织化学中间接法和SABC-Cy3法相结合。例如,在实验设计时,选择小鼠抗大鼠A和兔抗大鼠B作为两种不同的特异性一抗,相匹配的二抗分别为FITC-抗小鼠IgG和生物素化—抗兔IgG。进行双重染色时,由于两种一抗种属来源不同,可把一抗混合使用。孵育结束后洗涤未结合的一抗,滴加二抗时,先加人生物素化—抗兔IgG(二抗)孵育,洗涤后,滴加SABC-Cy3复合物,经荧光显微镜下观察已出现特异性荧光,再进行FITC—抗小鼠IgG(二抗)的孵育,最后封片观察。其结果A抗原呈现绿色荧光,B抗原呈现红色荧光。此法应注意两种一抗在混合稀释时,抗体的终浓度应为每一种抗体的工作浓度。换言之,混合后的液体要同时满足两种一抗的工作浓度。若两种一抗种属来源相同,必须分两次进行双重染色,即先用第一种一抗和第一种荧光二抗对A抗原进行染色,洗涤后,用第二种一抗和第二种荧光二抗对B抗原进行染色,否则会出现交叉反应而使染色无特异性。 双重免疫荧光标记法 在同一组织细胞标本上需要同时检测两种抗原时,需进行双重荧光染色。双重免疫荧光标记法(double immunofluorescence labeling method)也分为直接法和间接法。
