物质的分离和除杂(2)

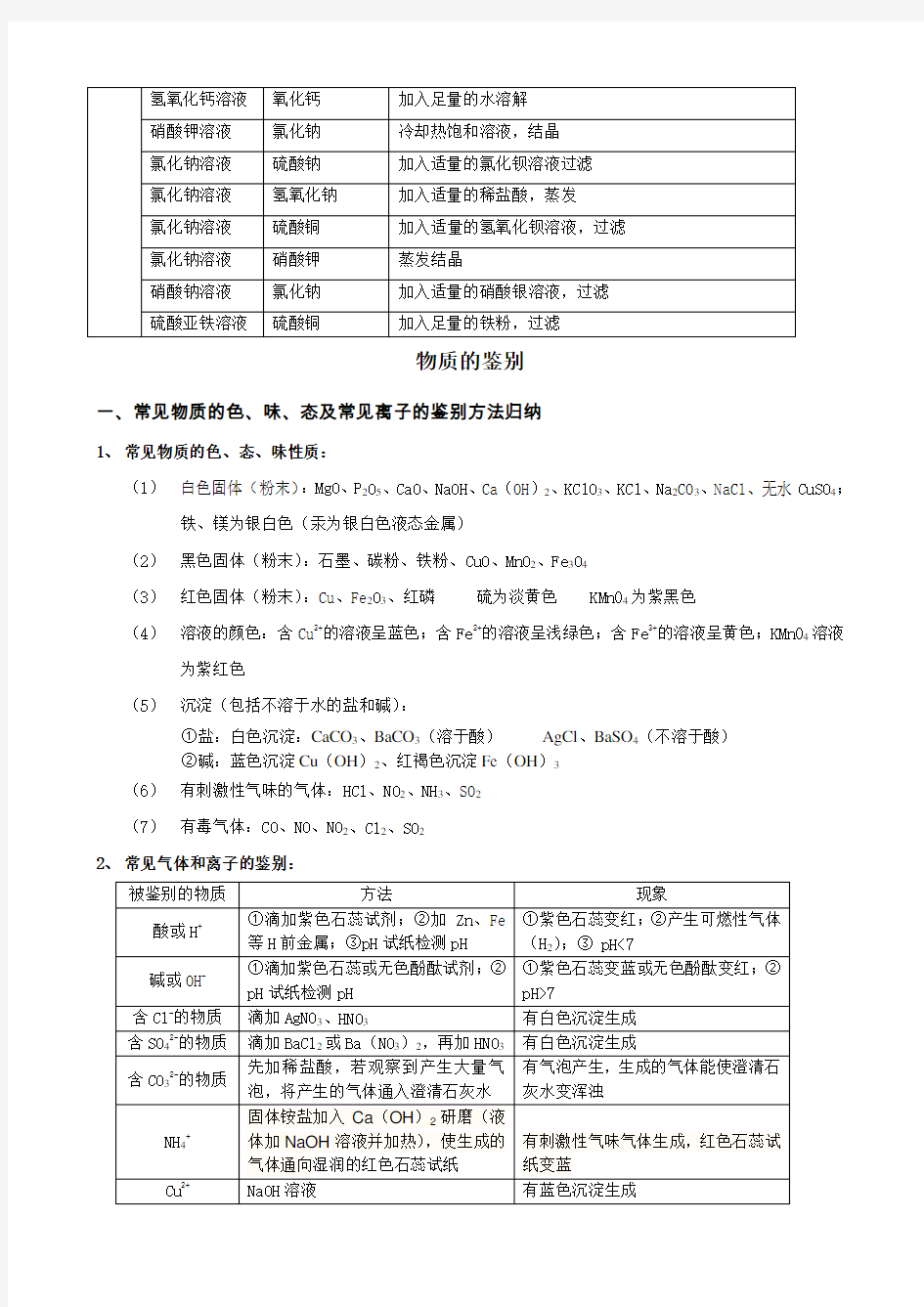
物质的分离和除杂
三原则:①不引入新杂质;②不减少被提纯物质的质量;③杂质便于分离。
三要领:①根据物理性质或化学性质的差异;②确定除杂质方法;③选择适宜试剂。
溶液中除杂试剂的选择:
(1)确定杂质离子;(2)选择除杂试剂的离子,使杂质离子转化为水、气体或沉淀;(3)根据主体成分,确定除杂试剂的另一离子。
除杂质思路分析方法:
(1)沉淀法:加入一种试剂将被除去的杂质变为沉淀,再用过滤法除去。
(2)化气法:加热或加入一种试剂将杂质变为气体逸出。
(3)置换法:利用置换反应的原理将杂质除去。
(4)转纯法:将被除去的杂质变为提纯的物质。
(5)吸收法:常用于气体的提纯。
在掌握了以上除杂质的原则、要领、方法后,解答题目时要审清题目要求,分析理顺思路且与题目要求吻合,才能准确解题。
物质的鉴别
一、常见物质的色、味、态及常见离子的鉴别方法归纳
1、常见物质的色、态、味性质:
(1)白色固体(粉末):MgO、P2O5、CaO、NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;
铁、镁为银白色(汞为银白色液态金属)
(2)黑色固体(粉末):石墨、碳粉、铁粉、CuO、MnO2、Fe3O4
(3)红色固体(粉末):Cu、Fe2O3、红磷硫为淡黄色 KMn04为紫黑色
(4)溶液的颜色:含Cu2+的溶液呈蓝色;含Fe2+的溶液呈浅绿色;含Fe3+的溶液呈黄色;KMn04溶液为紫红色
(5)沉淀(包括不溶于水的盐和碱):
①盐:白色沉淀:CaCO3、BaCO3(溶于酸)AgCl、BaSO4(不溶于酸)
②碱:蓝色沉淀Cu(OH)2、红褐色沉淀Fe(OH)3
(6)有刺激性气味的气体:HCl、NO2、NH3、SO2
(7)有毒气体:CO、NO、NO2、Cl2、SO2
2、常见气体和离子的鉴别:
离子的共存
物质的共存的涵义
(1)若某些物质之间不能发生反应,则它们能够共存;若某些物质之间能发生反应,则它们不能够共存。回忆:哪些物质之间能发生反应(即不能共存)?
(1)酸与某些金属、某些金属氧化物、碱、某些盐能发生反应(即不能共存);
(2)碱溶液与某些非金属氧化物、某些盐溶液能发生反应(即不能共存);
(3)盐溶液与某些金属、某些盐溶液能发生反应(即不能共存)
回忆:溶液中哪些离子之间能发生反应(即不能共存)?
(1)H+:OH-、CO32-、HCO3-
(2)OH-:H+、NH4+、Ag+、Fe3+、Cu2+、Mg2+、Al3+
(3)Cl-:Ag+
(4)CO32-:H+、Ag+、Ca2+、Ba2+
(5)SO42-:Ba2+
注意:
