HER2突变肺癌的靶向治疗

HER2突变肺癌的靶向治疗
人表皮生长因子受体2 (HER2)是受体酪氨酸激酶(RTK)的重要成员之一,其它还包括EGFR(HER1)、HER3和HER4。HER2受体通过与其他ERBB家族受体形成同源或异源二聚体而被激活,尤其与EGFR的异二聚体最稳定,因此,能够导致EGFR信号传导增强,促进肿瘤细胞不断分化、增殖和转移。HER2的致癌性激活可由HER2蛋白过表达、基因扩增或基因突变引起,能在多种恶性肿瘤中发生,包括乳腺癌、胃癌、肺癌、膀胱癌、卵巢癌和胰腺癌。目前,HER2突变在肺癌中的产生机制仍不明确,HER2突变型IV期NSCLC患者的中位总生存时间仅为1.6-1.9年,临床用于治疗HER2突变型NSCLC 的药物疗效有限。
HER2突变在NSCLC中以酪氨酸激酶域的18-21外显子多见,其中以外显子20的插入突变(A775_G776insYVMA)最常见。发生率约为2%-4%,而在EGFR/ALK/ROS1均阴性的NSCLC 中,突变率高达6.7%。HER2突变型NSCLC的临床特征为女性、非吸烟和肺腺癌较多见,通常不与其它驱动基因变异(EGFR/ALK)同时出现。中国人群HER2突变频率约2.4%~5.94%,略高于高加索人群。一项来自东亚人群的大样本研究提示,非吸烟肺腺癌患者的HER2突变频率约为4%。
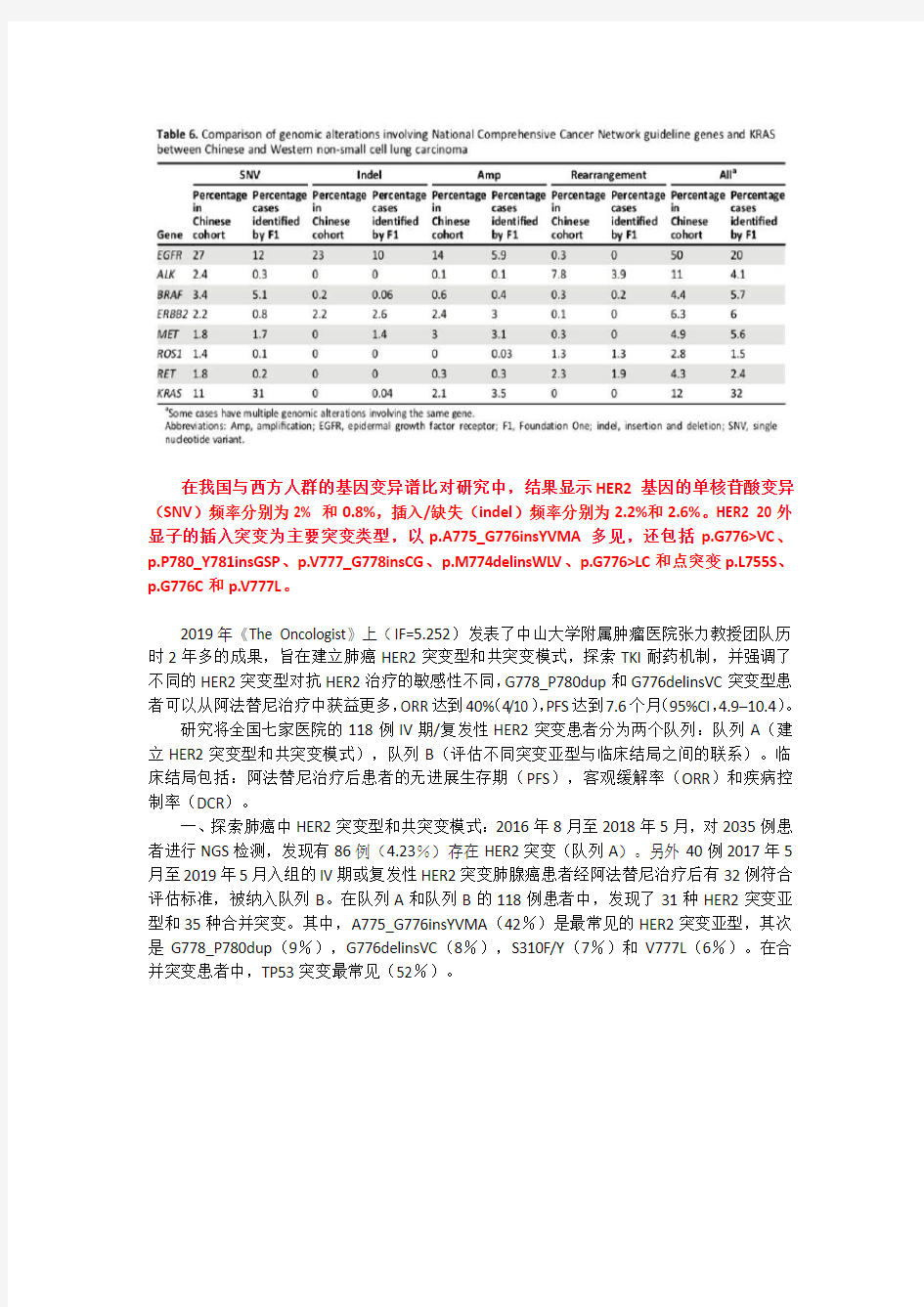
在我国与西方人群的基因变异谱比对研究中,结果显示HER2基因的单核苷酸变异(SNV)频率分别为2% 和0.8%,插入/缺失(indel)频率分别为2.2%和2.6%。HER2 20外显子的插入突变为主要突变类型,以p.A775_G776insYVMA多见,还包括p.G776>VC、p.P780_Y781insGSP、p.V777_G778insCG、p.M774delinsWLV、p.G776>LC和点突变p.L755S、p.G776C和p.V777L。
2019年《The Oncologist》上(IF=5.252)发表了中山大学附属肿瘤医院张力教授团队历时2年多的成果,旨在建立肺癌HER2突变型和共突变模式,探索TKI耐药机制,并强调了不同的HER2突变型对抗HER2治疗的敏感性不同,G778_P780dup和G776delinsVC突变型患者可以从阿法替尼治疗中获益更多,ORR达到40%(4/10),PFS达到7.6个月(95%CI,4.9–10.4)。
研究将全国七家医院的118例IV期/复发性HER2突变患者分为两个队列:队列A(建立HER2突变型和共突变模式),队列B(评估不同突变亚型与临床结局之间的联系)。临床结局包括:阿法替尼治疗后患者的无进展生存期(PFS),客观缓解率(ORR)和疾病控制率(DCR)。
一、探索肺癌中HER2突变型和共突变模式:2016年8月至2018年5月,对2035例患者进行NGS检测,发现有86例(4.23%)存在HER2突变(队列A)。另外40例2017年5月至2019年5月入组的IV期或复发性HER2突变肺腺癌患者经阿法替尼治疗后有32例符合评估标准,被纳入队列B。在队列A和队列B的118例患者中,发现了31种HER2突变亚型和35种合并突变。其中,A775_G776insYVMA(42%)是最常见的HER2突变亚型,其次是G778_P780dup(9%),G776delinsVC(8%),S310F/Y(7%)和V777L(6%)。在合并突变患者中,TP53突变最常见(52%)。
肺癌分子靶向治疗
肺癌分子靶向治疗 一肿瘤靶向治疗的基本概念 随着生物技术在医学领域的快速发展和从细胞分子水平对发病机制的深入认识,肿瘤生物治疗已进入了一个全新的时代。肿瘤分子靶向治疗是利用具有一定特异性的载体,将药物或其他杀伤肿瘤细胞的活性物质选择性地运送到肿瘤部位,把治疗作用或药物效应尽量限定在特定的靶细胞、组织或器官内,而不影响正常细胞、组织或器官的功能,从而提高疗效、减少毒副作用的一种方法。 所谓“靶向治疗”,通俗地讲,就是有针对性的瞄准一个靶位,在肿瘤分子治疗方面指的就是针对某种癌细胞,或者是针对癌细胞的某一个蛋白、某一个分子进行治疗。它分为三个层次,第一种是针对某个器官,例如某种药物只对某个器官的肿瘤有效,这个叫器官靶向;第二种叫细胞靶向,故名思义,指的是只针对某种类别的肿瘤细胞,药物进入体内后可选择性地与这类细胞特异性地结合,从而引起细胞凋亡;第三种是分子靶向,它指的是针对肿瘤细胞里面的某一个蛋白家族的某部分分子,或者是指一个核苷酸的片段,或者一个基因产物进行治疗。分子靶向治疗是目前肿瘤治疗的一个“闪光点”,凭着它的特异性和有效性,已取得很大成功,是目前国内外治疗的“热点”。 传统化疗可以理解为“枪打出头鸟”,主要是针对生长快速的肿瘤细胞。可是除了肿瘤细胞外,正常人体内的某些正常细胞生长繁殖
也较快,比如①血液细胞,由于自我更新活跃,也成为化疗药物打击的对象,所以化疗后会出现白细胞降低、血小板下降、贫血等。②毛囊细胞、粘膜的细胞更新也很快,所以化疗后出现的脱发、恶心、呕吐等,就是毛囊细胞、粘膜细胞受化疗药物的攻击而引起的。③肝脏细胞,被称为体液化工场,要代谢很多药物。因此化疗后也会造成严重的肝功损害。④生殖细胞,像精子、卵子这些细胞也会受到化疗药物的攻击。因此,化疗药物在针对体内肿瘤细胞的同时,不可避免的会对体内生长旺盛的正常细胞造成不同程度的损害。这样,肿瘤细胞灭亡的同时会造成体内很多细胞的“陪葬”,长此以往只会造成“两败俱伤”。然而,随着机体免疫力被摧跨,肿瘤细胞势必“抬头”,所以,这化疗的盲目性不利于肿瘤的长期治疗,不是真正意义上的靶向治疗。同样,如所谓的靶向化疗、靶向放疗、靶向手术、氩氦靶向及射频靶向等治疗,不可避免也存在对正常组织有较大损伤或治疗不彻底性及问题。 细胞靶向这种治疗又称为“导弹治疗”,它主要利用肿瘤细胞与正常细胞在生物学特性上的不同,具有高选择性,能稳、准、狠地打击肿瘤细胞。rAAV-BA46/her2-DC/CTL治疗乳腺癌就是一例很好的细胞靶向治疗的例子。BA46 几乎在所有的乳腺癌体细胞上表达,而且表达在细胞膜上,而在乳腺以外的正常组织内不表达或少量表达,以BA46抗原肽免疫转基因鼠,可在转基因鼠身上诱导出特异的细胞免疫,它是乳腺癌DC治疗非常理想的肿瘤抗原。腺相关病毒(AAV)以其无致病性及能与特异位点整合等优点而成为目前人类基因治疗
肺癌的靶向治疗进展
肺癌的靶向治疗进展 北京协和医院呼吸内科 李龙芸 葛 楠 肺癌已成为发病率和死亡率增长最快,严重危害人类健康和生命的恶性肿瘤。2006年报告,每年全世界新增肺癌病例达130万,每年死亡病例为120万。我国肺癌病死率在城市已居肿瘤死亡首位,达60万。尤其青年和女性人群发病率和死亡率迅速增长。预计2025年肺癌每年死亡数将达100万。非小细胞肺癌约占肺癌的80%以上,多数患者确诊时已属晚期,因此化疗仍是肺癌的主要治疗方法。但化疗后一般生存期仅8~10个月,5年存活率仅10%~15%。以铂为基础的联合化疗失败后,再次治疗的一般生存期仅5~7个月。为提高疗效,肺癌多学科综合治疗模式将是21世纪肺癌治疗的方向,为提高治愈率,延长生存期,保障患者生存质量,必须根据肺癌的组织学类型、分期、个体生活状态、分子生物学特性等制定最佳治疗方案,并希望涌现更多的新药,但10年来化疗的疗效并未获得突破性进展。靶向治疗的建立,为肺癌病人新生获得了新的希望。 21世纪分子靶向治疗(molecular targeted therapy)已取得了飞跃的进展,对癌症的治疗已能针对其特异分子变化进行靶的治疗,减少了对正常细胞的毒副作用。复发期病人一般状况随着多种化疗的进行会不断恶化,为了改善病人的临床症状,提高生活质量,延长生存时间,迫切需要有新的有效的治疗措施。许多新的靶向性治疗的研究将为晚期NSCLC的治疗提供新的治疗途径。 一、 非小细胞肺癌新的靶向治疗药物(表1) (一) 表皮生长因子受体酪氨酸激酶抑制剂吉非替尼 表皮生长因子受体酪氨酸激酶抑制剂吉非替尼(Gefitinib、ZD1839、Iressa)已成为复发性晚期NSCLC 治疗中的热点。因NSCLC中EGFR表达率高达30%~80%。EGFR是一种糖蛋白受体,为原癌基因c-erbB-1(HER-1)的表达产物,定位于细胞膜上,配体与受体的胞外部分结合后,受体胞内部分的酪氨酸残基即磷酸化,使EGFR激活,进一步活化ras,将表面细胞信号转至细胞核内,介导DNA合成及细胞增殖,导致肿瘤细胞增殖和血管生成,细胞周期G1→S期失控。其他大量信息也可通过本通路转导,使肿瘤发生转移,化疗疗效不佳,复发率高,存活期短。因此EGFR酪氨酸激酶(EGFR-TKI)是肿瘤治疗的重要靶分子。吉非替尼为苯胺喹唑啉化合物,可选择性抑制酪氨酸激酶活化,从而抑制EGFR激活,抑制细胞周期进程的失控,加速细胞凋亡,抑制血管生成、肿瘤侵袭及转移等。FDA批准吉非替尼作为NSCLC新型靶向治疗药物。参加临床试验中的病人均为晚期NSCLC病人,并对标准化、放疗和激素治疗无效及预后甚差。IDEAL-1,IDEAL-2的试验结果证实,吉非替尼250mg1次/日,口服,对晚期NSCLC 的有效率为12%~18.4%。中位生存期6.5~6.56个月。病人症状有明显改善。在CR+PR患者中症状改善为69.2%,SD患者中为70%,PD中为11.8%。女性疗效优于男性,分别为19%及3%。腺癌的有效率为13%,其中肺泡癌有效率达25%~35%。非吸烟者疗效也较好。副作用主要为皮疹和腹泻。3~4度不良反应占7%,因药物相关副作用停药者<2%。 吉非替尼在中国临床注册的临床试验中,显示对曾接受化学治疗失败者接受吉非替尼治疗有效率27%,中位生存期11.1月,安全性良好,国际多中心INTEREST Ⅲ期临床研究比较了吉非替尼与多西他赛治疗既往接受过含铂化疗的局部晚期或复发、转移的NSCLC疗效,参加研究患者达1466例,其中21%为亚裔人群,主要终点:总生存期两组相似,分别为7.6月及8个月,1年存活率32%及34%,证实了吉非替尼和化疗药物多西他赛疗效相当,但药物安全性和生活质量改善方面吉非替尼显著优于多西他赛,且病人总的治疗费用也明显低下,再次确定了吉非替尼是晚期NSCLC二线标准治疗方案。并可适用于各
肺癌靶向治疗新规范
近10年来,以表皮生长因子受体(epidermal growth factor receptor,EGFR)作为IE点所代表的非小细胞肺癌(non-small cell lung cancer,NSCLC)个体化治疗,取得了极大的成功,EGFR突变的晚期NSCLC接受EGFR TKI治疗,中位总生存时间已达2430个月。目前的研究热点在于如何克服 EGFR靶向治疗的耐药。EGFR-TKI耐药机制包括:20外显子T790M突变、原癌基因MET扩增和过表达等。本文就 EGFR突变NSCLC 中原发和继发性c-MET信号通路改变所引起的耐药研究进展进行综述。 1.HGF/c-MET 的结构 c-MET是一类具有自主磷酸化活性的跨膜受体,属于酪氨酸激酶受体(receptor tyrosine kinases,RTKs)超家族成员。编码该受体的基因位于7号染色体q21-31区,大小约llOkb,包括21个外显子。c-MET受体由50kD的a链和145kD的 P 链组成的异二聚体,包括 sema(semaphorins),PSI(plexins, semaphorins,integrins), 4 IPT 重复区域(immunoglobulins,plexins, transcription factors),TM (transmembrane), JM (juxtamembrane), 和TK (tyrosine kinase)保守蛋白区域。胞外氨基末端500个残基折叠成一个大的senrn区域,为与配体结合及受体二聚化 所必需的重要结构。PSI区域紧接在serrm区域后面,大约有 50个残基和4个二硫键,这个区域通过四个IPT区连接到跨膜螺旋。在细胞内,c-MET受体包含一个酪氨酸激酶催化域,有4个关键的调节酶活性的酪氨酸残基,形成几个信号传导蛋白的停泊位点,进而导致生物应答。c-MET最先是从人骨肉瘤衍生出的细胞系中分离出来的,随后发现主要是在上皮细胞上表达。在胚胎发育和成年时期,很多器官上皮细胞表面表达c-MET受体,包括肝、胰腺、前列腺、肾脏、肌肉和骨髓。 HGF是c-MET的唯一配体,最先作为促进肝细胞分裂的物质被发现,随后证实其和分散因子是同一种物质(scatter factor,SF),可以诱导上皮细胞分裂。HGF主要来源于间质细胞,以旁分泌的形式作用于表达c-MET受体的上皮细胞。编码HGF的基因位于7号染色体q21区,大小约70kb,包括18个外显子和17个内含子。HGF前体是由间质细胞分泌,由728个氨基酸残基组成的单链,在蛋白水解酶的作用下产生活性形式,成熟的HGF是由96kDa的a链和34kDa的P 链经二硫键连接组成的异二聚体。HGF含6个结构域,分别为氨基末端结构域、4个Kringle结构域及SPH结构域(serine proteinase homology,SPH)。HGF/c-MET 具有多种生物学功能,可以促进细胞增殖、生长、运动、分散、分化和形态发生。 2.HGF/c-MET信号通路 当c-MET与其配体HGF结合后,触发受体二聚化和转移磷酸基,胞质中酪氨酸残基(Tyrl234、Tyr1235)可发生自身磷酸化,从而激活c-MET胞质内蛋白激酶结构域中酪氨酸激酶 (phosphotyrosine kinase,PTK),激活的 PTK 可引起 c-MET 竣基末端酪氨酸(Tyrl349、Tyrl356)的自身磷酸化。c-MET激活招募衔接蛋白Gabl和Grb2、激活Shp2、Ras和ERK/MAPK,细胞质中的多种效应蛋白募集到磷酸化的羧基末端并被快速磷酸化,最后激活细胞内多种信号通路,如phosphoinositide 3-3-kinase
(完整版)肺癌靶向治疗药物(按作用机制划分)
肺癌靶向药物(靶点机制划分) EGFR 突变 EGFR又叫 HER1 或者 ErbB1,是 ErbB 受体家族四大成员之一。EGFR 过分频繁表达能激活下游重要的信号通路(如 ALK),从而导致细胞增殖,存活,转移及血管生成等。因此,在 NSCLC 的研究中,EGFR 一直是一个热点。像吉非替尼和厄洛替尼这样早期的小分子 EGFR 酪氨酸激酶抑制剂(TKI)在刚问世时是面向所有既往接受过化疗的 NSCLC 患者的。而像阿法替尼(afatinib)和达克替尼(dacomitinib)这样新推出的 EGFR TKI 则在此基础上有了长足的发展。回顾性研究显示,亚裔、女性、腺癌、既往少量 / 无吸烟史等临床特点可以增加 EGFR TKI 治疗的敏感率。这个结论的分子基础是,18-21 号外显子突变(最常见的是 19 号外显子的缺失和 21 号外显子上的 L858R 位点突变)能编码出大量 EGFR 酪氨酸激酶,上述突变分别占总突变情况的 45% 和 40%。另外还有18 号外显子的突变及 20 号外显子的插入突变,占总突变情况的 5%-10%。18 号外显子的突变能增加 EGFR TKI 的敏感性,而 20 号外显子的突变却会导致EGFR TKI 原发耐药。EGFR 突变在拥有前述临床特征的患者中更加常见。肺腺癌患者中,大约有 15% 的白种人和 30-50% 的东亚人拥有 EGFR 基因突变。而对于那些无吸烟史的东亚人,这项比例高达 50-60%。多项研究表明,对于初发的敏感性 EGFR 突变的 NSCLC 患者,应用 TKI 治疗在反应率(ORR)、无进展生存期(PFS)和生活质量上均优于化疗。易瑞沙泛亚洲研究(IPASS)结果表明,对于经选择的 NSCLC 患者,吉非替尼效果优于紫杉醇 + 卡铂的化疗。但对于EGFR 野生型患者,TKI 治疗效果并不理想,1.5 个月的 PFS 完败于化疗组的6.5 个月。在其他随机研究中,吉非替尼、厄洛替尼及阿法替尼均能改善有 EGFR 基因突变患者的 ORR 和 PFS。这些研究为晚期 NSCLC 的合理治疗提供了依据。因此,晚期 NSCLC 患者应常规进行 EGFR 基因检测,并根据突变情况选择是否行 EGFR TKI 一线治疗。一般情况下患者对 EGFR TKI 耐受性良好。EGFR TKI 常见的副作用包括痤疮形式皮疹,皮肤瘙痒和腹泻。相比化疗,很少出现 3 级 -4 级不良反应,故较少出现调整剂量和停药。坏消息是,所有接受 TKI 治疗的患者最终会出现耐药,并最终导致肿瘤进展和死亡。好消息是,人们经过反复活检已经发现了 TKI 治疗耐药的部分分子机制。比如,大约有 50% 的获得性耐药患者身上出现了前文提及的 20 号外显子(T790M)变异。此外,MET 扩增(5%)、HER-2 扩增(8%)、PI3K 突变(5%)及 NSCLC 转变为小细胞肺癌(18%)等也是常见的耐药机制。基于此,新一代的分子靶向治疗药物开始针对上述获得性耐药的途径,如 T790M、HER2、MET 及 PI3KCA 等。比如第二代的不可逆 EGFR TKI 阿法替尼和达克替尼是泛 ErbB 抑制剂。这意味着他们能在抑制 EGFR 突变表达的同时还能抑制 T790M 耐药变异。虽然临床前研究显示成果喜人,不过阿法替尼和达克替尼治疗一代 EGFR TKI 耐药的临床研究却并不尽如人意。一项随机研究表明阿法替尼对经一代 EGFR TKI 治疗过的晚期非小细胞肺癌患者 OS 与安慰剂相当。另一项研究证明达克替尼也一样。但在最新的指南中,阿法替尼已被推荐作为 EGFR 突变的非小细胞肺癌一线治疗方案。第三代 EGFR TKI(CO-1686 和 AZD9291)对 T790M 的选择性更高,临床效果更佳且毒性更小。早期的研究表明,CO-1686 和 AZD9291 对经一代 EGFR TKI 治疗过,且 T790M 变异的晚期非小细胞肺癌患者,ORR 分别达到 58% 和 64%。这些结果进一步证明了在疾病进展阶段及时的进行分子分析以选择最佳治疗方案的重要性。
靶向治疗肺癌早期
靶向治疗肺癌早期 第一类: 为表皮生长因子抑制剂。常用药物为特罗凯、易瑞沙。其主要机理是通过与特定的靶点表皮生长因子受体,EGFR结合,启动相应的信号通路,最终达到控制肺癌生长的作用。 第二类: 为抗血管生成抑制剂,如阿瓦斯丁。其主要机理是阻断肿瘤新生血管的生成,从而使肿瘤生长缺乏足够的营养,最重达到饿死肿瘤的目的。目前这两类药物都在临床得以广泛应用,被美国癌症综合治疗机构确立为标准治疗方案的药物之一。 肺癌靶向药物疗效显著: 有临床研究数据显示,应用靶向药物治疗非小细胞肺癌,在普通肺癌患者中的有效率肿瘤缩小50%以上,疗效保持4周以上超过20%,而在经过基因分析的优势人群中,有效率能达到70%~80%。 除此以外还有约40%的患者,药物能对他们的肿瘤起稳定作用肿瘤没有缩小,但也没有扩大和转移,靶向治疗药物对非小细胞肺癌的疾病控制率达到60%~70%。 专家提醒: 具体应该选用何种分子靶向药物,一定要在肿瘤科医生的指导下应用,切忌自己在网络上随便买药应用。因为,一方面药物的质量难以保证,更重要的一点是一旦药物无效,反而具有一定的不良反应。特别的例子如:部分病人有肺间质性病变的病史,可是病人应用靶向药物没有经过基因检测,疗效不佳并且出现间质性病变加重。 肺癌是属于人体呼吸系统的疾病,肺癌是常见的恶性肿瘤之一,肺癌的致病原因比较复杂,至今都不能确定到底哪一种致癌因子导致的肺癌,肺癌一般全身症状并不明显。肺癌的治疗方法也有很多,下面我们就来讲解一下癌症的治疗方法: 肺癌的治疗方法其实没有固定的,肺癌的治疗方法的选择取决于肿瘤的大小,就相比消化系统癌症而言,肺癌的患者饮食是比较好解决的,肺癌病人应少吃油腻跟辛辣、烟、酒等有刺激性的食物。 肺癌的治疗方法还有当病人经过手术切除,或中西医放射治疗,病情达到完全缓解或部分缓解之后因注意完全禁止吸烟,注意生活环境空气的质量,保证空气新鲜,肺癌的治疗方法还有采用放射治疗和化学治疗,从而促使肿瘤变小,控制癌症症状。
肺癌的个体化治疗
吉非替尼在非小细胞肺癌治疗中对于EGFR激活突变的影响以及与化疗的对比酪氨酸激酶抑制剂吉非替尼的作用目标是表皮生长因子受体(EGFR)。表皮生长因子受体(EGFR)是一种跨膜单链糖蛋白,参与细胞内信息传递,是一种实用性较强的肿瘤标志物。EGFR突变是癌症患者是否对酪氨酸激酶抑制剂敏感的强预测因子,因此EGFR基因突变的检测能为肿瘤靶向治疗提供依据。虽然一些非小细胞肺癌患者对吉非替尼没有反应,不过,约10%的病人却有快速而显著的临床疗效[1]。这一作用的分子机制在于未知详细作用原理的敏感性吉非替尼。所以我们着重论述吉非替尼在非小细胞肺癌治疗中对于ERFR的影响。 目前临床应用较多的是EGFR抑制剂,其代表性药物包括抗EGFR单克隆抗体和EGFR酪氨酸激酶抑制剂。在20世纪80年代初,门德尔松等人,提出了旨在阻止EGFR信号来治疗癌症的设想。门德尔松等人设计了两个单克隆抗体,这些抗体抑制活化的表皮生长因子受体,通过与EGFR和TGF-α以同样的亲和力结合,从而阻断TK活性受体的激活及其下游信号[2]。但是现在,对于治疗晚期非小细胞肺癌,EGFR酪氨酸激酶抑制剂的代表性药物为吉非替尼。 吉非替尼是一种新型的,低分子量的,合成的苯胺喹唑啉化合物。它的发现是基于研究EGFR-TK抑制剂的作用机制发现的。它是一种强有力的选择性酪氨酸激酶抑制剂。有研究表明,EGFR的体细胞突变与非小细胞肺癌患者对吉非替尼的敏感性相关。在体内,吉非替尼广泛抑制异种移植于裸鼠的人肿瘤细胞衍生系的肿瘤生长,并提高化疗、放疗及激素治疗的抗肿瘤活性[2]。在临床实验中,已证实吉非替尼对局部晚期或转移性非小细胞肺癌具有强的抗肿瘤疗效并可改善疾病相关的症状。 吉非替尼的作用机制是:(1)竞争EGFR-TK催化区域上Mg-ATP结合位点,阻断其信号传递;(2)抑制有丝分裂原活化蛋白激酶的活化,促进细胞凋亡;(3)抑制肿瘤血管生成。西妥昔单抗是目前运用较多的抗EGFR的单抗,可与表达于正常细胞和多种癌细胞表面的EGF受体特异性结合,并竞争性阻断EGF和其他配体,如α转化生长因子(TGF-α)的结合。 我们已经知道,突变的表皮生长因子受体EGFR基因在吉非替尼的作用下,在原发性肿瘤患者的非小细胞肺癌中治疗有效。但是,那些没有响应、和那些没有被暴露在吉非替尼作用下的EGFR需要进一步确定吉非替尼对其基因水平的影响。于是,我们要先确定突变类型与位点。确定突变后,便可以在突变体蛋白的表达水平来评估培养的细胞。 试验结果显示,8/9的肺癌患者对吉非替尼有响应,调查的所有患者中,只有仅仅7例对此无反应[2]。试验也确定了EGFR的突变类型。它们有这样一些共同特点:所有的突变均为杂合子;突变或者是小的读码框架的缺失,或者是酪氨酸激酶结构域中的某些氨基酸被替换了。结果显示,检测到大多数原发性非小细胞肺癌患者有发生类似的突变,而没有发生这些突变的,即没有响应、没有被暴露在吉非替尼作用下的只有8%[2]。由此可见,在体外,EGFR突变在响应于吉非替尼时,表现出增强的酪氨酸激酶活性和增加的对吉非替尼这一抑制剂的敏感性。 我们看到,试验中,非小细胞肺癌患者的表皮生长因子受体EGFR普遍有标志性的、特异性的基因突变。所以,试验结果不仅显示,这些突变对酪氨酸激酶抑制剂吉非替尼存在敏感性,而且说明由于这些突变,也导致了增加的生长因子信号转导和对抑制剂的易感性。在肺癌中筛查这种突变,即可确定患者将对吉非替尼gefitinib治疗有效。这一发现指导了我们对小细胞肺癌的临床治疗。
现代肺癌靶向治疗常见治疗位点
现代肺癌靶向治疗常见治疗位点 靶向治疗为针对已明确的致癌位点(该位点可以是肿瘤细胞内部的一个蛋白分子,也可以是一个基因片段,被称为靶点,常为引致癌症的特异性突变基因),来设计相应的治疗药物,药物进入体内会特异地选择致癌位点来相结合发生作用,使肿瘤细胞特异性死亡,而不会波及肿瘤周围的正常组织细胞。 靶向治疗中的靶点常为肺癌的驱动基因。驱动基因,是与癌症发生发展相关的重要基因,找到驱动基因后癌症的治疗就事半功倍。 通过开发靶向癌症特异基因突变的药物,近年来非小细胞肺癌(NSCLC)的诊断和治疗发生了重大的变革。对肺癌活检组织的体细胞突变常规基因测试正成为提供最佳患者医疗护理的标准。确定特异的突变类型例如EGFR突变、KRAS突变或ALK突变等为使用FDA批准的靶向治疗提供指导,有可能使临床获益。发现其他的基因突变也可以引导患者和医生往新靶向药物的临床试验做出努力。 许多目前还正在开发当中的靶向治疗方案主要是靶向激活的受体酪氨酸激酶(PTKs)或相关下游信号通路,尤其是RAS-RAF-MAPK和PI3K-AKT信号通路。还有大量的临床试验目前正在开展,以评估包含特异性突变(包括EGFR突变、KRAS突变或ALK突变)的癌症最佳治疗方案。 NSCLC驱动基因:EGFR 活化EGFR突变位于酪氨酸激酶域,可导致组成性的EGFR信号。EGFR突变激活的PI3K-AKT 和RAS-MEK-ERK信号对癌细胞的生长、生存和迁移起至关重要的作用。最常见的激活突变是19号外显子的框内缺失(in-frame deletion)同突变和858密码子的一个错义突变(导致精氨酸被亮氨酸取代,L858R)。带有EGFR突变的肺癌EGFR酪氨酸激酶抑制剂(TKIs)高度敏感。当前,EGFR突变的基因型筛查常被用于筛选患有IV期NSCLC、一线治疗方案为接受EGFR—TKIs治疗的患者。目前的研究重点集中在延长反应持续时间,找到有效的途径靶向在疾病进程中形成的耐药机制。最常见的耐药机制就是EGFR T790M突变,存在约50%的耐药肿瘤中。此外还有一些其他的例如MET扩增,PIK3CA突变以及向SCLC转化也曾得到描述。 NSCLC驱动基因:KRAS KRAS是肺癌中一种最常见的突变基因,发生在大约25%的肺腺癌中。肺癌KRAS突变主要定位在第12和13号密码子。肺癌中的KRAS突变似乎与EGFR和ALK易位互不相容,而患者通常都有吸烟史。KRAS突变通常抵抗EGFR-TKI治疗。虽然KRAS的发现比EGFR早二十多年,但由于研发难度大,目前针对KRAS的靶向药物少之又少,在临床实验阶段的仅有Antroquinonol(安卓健)和AZD6244。其中AZD6244主要作用于RAS基因下游调控因子MEK1/2,而Antroquinonol(安卓健)直接作用于RAS基因,为该通路中讯息传递上游因子,调控整个RAS通路。其I期临床结果被证实有效且事直接作用于RAS的抑制剂,Antroquinonol (安卓健)有望在2017年作为非小细胞肺癌的常规治疗用药。 NSCLC驱动基因:ALK
肺癌靶向治疗失败后的选择
龙源期刊网 https://www.360docs.net/doc/7a18424704.html, 肺癌靶向治疗失败后的选择 作者:章必成 来源:《大众健康》2011年第03期 何女士确诊晚期非小细胞肺癌(以下均简称肺癌)已经一年余。2009年初,她首先接受 了化疗,疗效差强人意。她拒绝继续化疗,于是选择了分子靶向治疗(易瑞沙)。 一个月后,奇迹出现了,不仅肺部的原发病灶消失得无影无踪,而且肺内、淋巴结、骨转移灶全部消失殆尽! 可惜好景不长,这样的疗效仅仅维持了5个月。之后,她又服用了另外一种分子靶向治疗药物——特罗凯,结果令人失望:无效。 万不得已,医师再次对其实施了化疗。可是,连续更换了3种化疗方案,不仅肺部原发肿瘤越长越大,而且远处转移灶越来越多。 万般无奈之下,医师建议何女士再次服用易瑞沙。 奇迹再次出现了!刚刚过去了半个月,何女士各种症状明显减轻;一个月后复查肺部CT,肺部原发肿瘤及转移灶都在逐渐缩小,部分病灶已经消失。 近5年来,分子靶向治疗(主要是易瑞沙、特罗凯)开始大量应用于肺癌的治疗,不仅延长了很多患者的生命,而且因为具有使用方便、副作用小等优势,使得很多年老体弱、难以耐受放化疗的患者获得了新生。毫不夸张地说,分子靶向治疗的出现是肿瘤治疗史上一个重大的里程碑,从此,肺癌进入个体化治疗时代。各种治疗指南和专家共识推荐的分子靶向治疗范围涵盖了晚期肺癌的一线、二线、三线甚至维持治疗。但是,无论患者近期疗效如何,最终可能都会不可避免地遇到耐药或治疗失败。此时,肿瘤患者和肿瘤内科医师该何去何从? 一线分子靶向治疗失败后的治疗 虽然目前普遍认为晚期肺癌应该首选双药方案化疗,但对于表皮生长因子受体突变阳性的肺癌患者,美国国立综合癌症网络(NCCN)指南认为分子靶向治疗也可以作为一线选择。如
晚期非小细胞肺癌靶向治疗进展
晚期非小细胞肺癌靶向治疗进展 化疗对晚期NSCLC的疗效已达到平台期,患者很难再从化疗中进一步获益。随着肿瘤分子生物学研究的深入,靶向治疗的研究和临床应用已成为当前肺癌领域的热点,对接受EGFR-TKI治疗的EGFR突变的NSCLC患者,无论是有效率还是生存期以及生活质量都远远超过当前单纯化疗的水平,又一新的靶点EML4-ALK阳性的靶向药物Crizotinib治疗晚期NSCLC患者的有效率高达80%以上,肺癌的新的驱动基因EGFR-1、ROS1、mTOR、DDR2、PIK3CA、MEK 等的发现,相应的靶向治疗药物不断开发成功,肺癌的治疗才是真正的走向基因指导下的个体化治疗新时代。现对当前晚期NSCLC靶向治疗的现状总结如下。 标签:晚期非小细胞肺癌;靶向治疗;基因;进展 在世界范围内,无论是发病率还是死亡率,肺癌均居恶性肿瘤首位,一旦发现,约80%肺癌为晚期,失去了手术机会,并且非小细胞肺癌(NSCLC)约占肺癌的80%。第三代新药联合铂类二药化疗方案是治疗晚期NSCLC的标准方案,但疗效达到一个平台期,其总体有效率(RR)为25%~35%,至疾病进展时间(TTP)4~6个月,中位总生存期(OS)8~10个月,患者似乎很难再从化疗中进一步获益。随着肿瘤分子生物学研究的深入,靶向治疗的研究和临床应用已成为当前肺癌领域的热点,包括表皮生长因子受体-酪氨酸激酶抑制剂(EGFR-TKI)、抑制肿瘤血管生成药物、抗EGFR单克隆抗体以及棘皮动物微管相关蛋白样4-间变淋巴瘤激酶(EML4-ALK)抑制剂等等。2009年Jackman 等[1]分析了5项临床试验,旨在研究EGFR和K-RAS突变对晚期NSCLC患者的影响,结果表明:无论是有效率还是生存期,TKI都远远超过当前单纯化疗的水平,EGFR突变的NSCLC患者接受TKI治疗的RR达67%,OS约为24个月。这使我们相信,靶向治疗正在引领肺癌走向真正个体化治疗的时代。基于此,现对当前晚期NSCLC靶向治疗的现状总结如下。 1?EGFR-TKI EGFR-TKI是目前NSCLC中最成熟和最重要的靶向治疗手段,目前临床正在应用的有吉非替尼、厄洛替尼以及我国自主研发的埃克替尼。如上所述,TKI 对EGFR突变的患者疗效显著,统计显示:高加索人种肺癌EGFR突变率大约为10%,而亚裔人种EGFR突变率超过50%[2]。 美国国家癌症综合网(NCCN2012.2)指南推荐:厄洛替尼适用于EGFR突变患者的一线治疗,这是基于IPASS研究的结论。Mok TS等[3]在这项三期随机临床研究中,将吉非替尼与紫杉醇/卡铂方案对照用于一线治疗晚期NSCLC,结果显示EGFR突变患者接受吉非替尼治疗,无论是无进展生存期(PFS)(24.9% versus 6.7%)还是有效率(71.2% versus 47.3%)均明显优于化疗,而且副作用明显减少。由于吉非替尼在美国没有上市,作用机制相似的厄洛替尼被推荐用于EGFR突变的晚期NSCLC患者的一线治疗。2011年周彩存等[4]在OPTIMAL研究中也得出了相似的结论:EGFR突变的晚期NSCLC患者一线接受厄洛替尼治疗较接受吉西他滨/卡铂方案化疗明显延长PFS(13.1个月versus 4.6个月)。EURTAC[5]是第一项比较EGFR-TKI与化疗一线治疗高加索裔EGFR突变阳性NSCLC患者的前瞻性、多中心、随机的三期临床研究,174例EGFR突变的肺癌患者随机分为厄洛替尼组和标准化疗组,结果证实厄洛替尼组的PFS显著优于标准化疗组(9.7个月versus 5.2个月,P<0.0001),高加索裔和亚洲人群中
晚期非小细胞肺癌的靶向治疗(综
晚期非小细胞肺癌的靶向治疗(综述)题库
晚期非小细胞肺癌的靶向治疗(综述) 2015-03-10 来源:丁香园作者:张波 曾几何时,晚期非小细胞肺癌(NSCLC)患者只能接受化疗。但是,其疗效已经到了一个瓶颈期,无法再进一步。可喜的是,随着人们对分子遗传学认识的不断增强,NSCLC 被细分为各种不同的分子亚型,并由此诞生了各类分子靶向治疗药物。靶向药的应用,明显改善 了 NSCLC 患者的预后。 带有表皮生长因子受体(EGFR)突变和间变性淋巴瘤激酶(ALK)重排的肿瘤患者的一线治疗中,化疗并没有一席之地,除非该患者的“可药化驱动基因(druggable driver oncogene)”缺失。2015 年 2 月17 日Kumarakulasinghe 等在respirology 上发布综述,全面讨论临床相关的驱动基因突变的情
况、肺腺癌和鳞癌的最新分子分型、分子靶向药物在治疗中的地位及其耐药机制。 肺癌是肿瘤世界的头号杀手。在 2014 年,预计将有 224210 名新确诊的肺癌患者,而且其中大部分为晚期NSCLC。在很长一段时间里,人类面对晚期 NSCLC 只能使用“含铂类药物 的化疗”这一招。这招与最佳支持治疗相比,虽然一定程度上增加了患者总生存期(OS),但它的上限也仅限于 20% 的反应率和 8-10 个月的中位生存期。 随着分子遗传学研究的不断进展,人们慢慢尝试识别导致 NSCLC 的关键基因突变。这些存在于癌基因上的遗传变异能编码调控细胞增殖 和存活的信号蛋白。癌基因依赖这个概念应运而生,而它存在的基础,是“肿瘤的生存非常依赖
肺癌靶向治疗总结
一、抗血管生成 恩度:重组人血管内皮抑素,联合化疗用于初治或复治非小细胞肺癌。2005年被中国FDA推荐用于晚期非小细胞肺癌一线用药。 15mg溶于500ml生理盐水中,输注3-4h。连续使用14天,休7天。第5天使用化疗。 贝伐珠单抗:重组人源化抗VEGF-A单克隆抗体。可阻断VEGF-A与其受体(VEGFR-1及VEGFR-2)的结合,是第一种被证明联合化疗能够延长非小细胞肺癌患者生存的抗 血管生成药物。2015年被批准用于晚期、转移性或复发性非鳞非小细胞肺癌等一线治疗。可联合化疗、EGFR-TKI类、免疫治疗。 鳞癌细胞类型及既往有咯血(>2级)史为贝伐珠单抗的最主要禁忌症。 雷莫芦单抗:以VEGFR-2为靶点的人源化单克隆抗体。一线治疗效果并不理想。可用于鳞癌及非鳞癌细胞类型NSCLC患者二线治疗的抗血管生成药物。 阿帕替尼:新型小分子酪氨酸激酶抑制剂,其与血管内皮生长因子受体2(VEGFR-2)结合并将其抑制。 安罗替尼:新型多靶点酪氨酸激酶抑制剂。2017中国批准其用于晚期NSCLC患者的 三线治疗。口服2周,休1周。 二、酪氨酸激酶抑制剂(TKI)类 表皮生长因子受体(EGFR)突变(EGFR基因突变通常发生于18~21 号外显子,其 中19 号外显子缺失及21 号外显子L858R 点突变是最常见的敏感突变。G719X、 L861Q和S7681、20号外显子插入突变等是罕见突变) 第一代TKI类:埃克替尼、吉非替尼、厄洛替尼。 第二代:阿法替尼、达克替尼。 第三代:奥希替尼(T790M突变) 第一、二代靶向药耐药(中位使用时间约10月,会出现耐药),最常见的耐药机制:T790M突变(60%)。HER2和MET扩增占耐药机制的20%。 奥希替尼:晚期EGFR突变一线首选。可用于EGFR罕见突变(20号外显子插入突变) 奥希替尼耐药机制:一线使用奥希替尼,不会出现T790M突变,主要以C797S的单发突变及MET的扩增为主,处理起来换用其他一代二代靶向药或联合MET抑制剂。一 线使用一代耐药后出现T790M突变后使用奥希替尼,即二线用药后耐药,机制比较复杂。
肺癌靶向治疗药物使用原则
肺癌靶向治疗药物使用原则 一、吉非替尼 【通用名】:吉非替尼片 【制剂与规格】:片剂:250mg 【适应证】:EGFR基因具有敏感突变的局部晚期或转移性非小细胞肺癌(NSCLC)。 【合理用药要点】: 1.用药前必须明确有经国家药品监督管理局批准的EGFR基因检测方法检测到的EGFR敏感突变。 2.肿瘤组织和血液均可用于EGFR基因突变检测,但组织检测优先。 3.治疗期间因药物毒性不可耐受时,可在同一代药物之间替换,如疾病进展则不能在同一代药物之间替换。 4.治疗过程中影像学显示缓慢进展但临床症状未发生恶化的患者,可以继续使用原药物;发生局部进展的患者,可以继续使用原药物加局部治疗;对于快速进展的患者,建议改换为其他治疗方案。 5.用药期间必须注意常见的皮肤反应和腹泻;应特别注意间质性肺炎、肝脏毒性和眼部症状的发生。 6.避免与CYP3A4诱导剂(如:苯妥英、卡马西平、利福平、巴比妥类或圣约翰草)联合使用。避免与CYP3A4酶抑制剂(如:
酮康唑、异烟肼)等联合使用,其联合使用可能导致血药浓度升高而增加不良反应。服用华法林的患者应定期监测凝血酶原时间或INR的改变。能显著且持续升高胃液pH值的药物有可能会降低吉非替尼的血药浓度,从而降低吉非替尼疗效。 ※7.在某些肿瘤急症的情况下如脑转移昏迷或呼吸衰竭,在充分知情的情况下,对不吸烟的肺腺癌患者可考虑使用。一旦病情缓解,必须补充进行EGFR突变的组织检测。 ※注:本指导原则“合理用药要点”带※部分为特殊情况下的药物合理使用专家共识。 二、厄洛替尼 【通用名】:盐酸厄洛替尼片 【制剂与规格】:片剂:150mg 【适应证】:EGFR基因具有敏感突变的局部晚期或转移性非小细胞肺癌(NSCLC)。 【合理用药要点】: 1.厄洛替尼一线或维持使用于晚期或转移性NSCLC患者的治疗时,必须对患者EGFR突变进行评估,选用经过国家药品监督管理局批准的检测方法检测到敏感突变。 2.有脑转移的EGFR基因突变的NSCLC患者可考虑使用厄洛替尼。 3.治疗过程中影像学显示缓慢进展但临床症状未发生恶化的患
[2015AZOS]吴一龙教授谈肺癌靶向治疗、免疫治疗和多学科个体化治疗
[2015AZOS]吴一龙教授谈肺癌靶向治疗、免疫治疗和多学科 个体化治疗 ?——访广东省人民医院吴一龙教授2015阿斯利康肿瘤高峰论坛今天在上海卓美亚喜马拉雅酒店顺利拉开帷幕。本届肿瘤高峰论坛以“精准·定义未来”为主题,明确了“精准医学“的真正含义并展示了“精准医学”的独特魅力。论坛上,广东省人民医院吴一龙教授介绍了肿瘤治疗如何从临床选择走向精准医疗,并就肺癌的靶向治疗、免疫治疗以及多学科个体化治疗接受了我们的专访。一代/二代/三代EGFR TKI的差异经过近十几年的发展,已出现不同的EGFR-TKI药物,以及所谓的不同代的EGFR-TKI。第一代EGFR-TKI的代表性药物为吉非替尼和厄洛替尼;第二代EGFR-TKI有阿法替尼;第三代EGFR-TKI有目前针对耐药研发的AZD9291等。这些药物的差异主要体现在每个药物引领的方向不同。如,第一代TKI让我们知道了什么是精准治疗,其对EGFR突变是非常有效的;第二代TKI尽管在疗效上没有超越一代TKI,但是给我们一个非常大的重要发现,在EGFR突变人群中,19外显子突变患者的疗效会更好,总生存率会更高;第三代TKI更大的作用体现在克服耐药上。综合比较一代/二代/三代EGFR TKI,既有很大的不同,又有很多相似之处。
如何选择合适的TKI一线治疗临床实践中应如何来选择TKI?主要需要考虑两个因素:药物的有效性和毒性。从有效性来看,一代和二代TKI尽管有差别,但差别并不大。就毒性而言,显然第一代要比第二代的小。综合考虑疗效和毒性,对于初诊为EGFR突变的患者,非常强烈地推荐在大多数情况下选择第一代EGFR-TKI;但如果患者存在19外显子突变,为获取更长的总生存,可以选择第二代EGFR-TKI。第一代和第二代EGFR-TKI治疗失败了之后,才根据耐药机制考虑是否选择第三代EGFR-TKI。在遵循以上用药顺序基础上,如果能集三代药物于一身,将使一代/二代/三代EGFR-TKI的疗效发挥到最大。 未来精准治疗的新靶点目前在靶点方面的工作,主要集中在寻找比较少见的靶点,因为较为常见的靶点都已被发现。因为需要探索的靶点在人群中的发生率可能只占1~2%,甚至<1%,所以研究过程会非常困难。但幸运的是,现在的基因测序技术比较先进,新靶点的发现也是可以实现的。就目前来看,有两个方面是非常有前途的。第一,是在原来有效的药物的基础上,出现的耐药基因突变靶点。针对这些耐药的基因突变,来进行药物的选择,如前面提到的第三代AZD9291。而今天可以看到,AZD9291的耐药又有新的突变,这时可以回过头来,用第一代药物来进行治疗。
非小细胞肺癌的分子靶向治疗进展
血管内皮生长因子抑制剂也是在N SCLC治疗中得到肯定的靶向药物,抗血管生成剂贝伐单抗联合化疗作为进展期N SCLC的一线方案已显示出其优势。ECOG4599和AVA I L 的临床研究显示,与单独化疗比较,贝伐单抗联合标准一线化疗能显著改善非鳞癌进展期NSCLC患者的O S;说明将VEG F抑制剂作为进展期N SCLC的维持治疗很有必要。 5中药 5医宗必读6云:/积之成者,正气不足,而后邪气踞之。0此说明恶性肿瘤一旦形成,其显著特点就是大量消耗人体正气,迅速耗气伤阴。因此,治疗应从整体出发,调节人体机能。中医药治疗中晚期肺癌的特点是带瘤生存,辨证与辨病相结合,以个体化治疗为特色,其对延长患者生命、提高其生活质量有明显优越性。南京军区福州总医院研制的中药复方肺泰胶囊具有补肺益气、化痰消瘀等功用,其前期临床试验结果证实,治疗组PFS较对照组明显延长,提示该药既可改善临床证候,且有控制肿瘤病情发展作用。 总之,维持治疗作为延长肺癌患者长期生存的新的重要手段,已引起临床医生的极大重视。无论是化疗、以靶向治疗作为维持治疗,还是以化疗+靶向药物一线治疗后采用贝伐单抗+厄洛替尼或贝伐单抗单药维持治疗,其目的均是使患者OS更长,生活质量更好。 非小细胞肺癌的分子靶向 治疗进展 刘世青,毕建伟 (山东大学附属千佛山医院,济南250014) 近年来,很多有关分子靶向治疗的研究证明,分子靶向治疗药物在晚期非小细胞肺癌(NSCLC)治疗中具有重要作用。目前,临床应用最广泛的分子靶向治疗药物有表皮生长因子受体家族抑制剂、血管生成抑制剂、多靶点抑制剂等,此类靶向治疗药物因具有较好的安全性和耐受性,成为N SCLC巩固维持治疗的主要方法。 1以表皮生长因子为靶点的药物 1.1吉非替尼(易瑞沙)易瑞沙是一种专门针对EGFR的小分子酪氨酸激酶抑制剂(TK I),通过阻断EGFR信号传导通路而抑制肿瘤细胞的生长、增殖。由于分子靶向治疗药物和化疗药物的作用机制不同,分子靶向治疗的疗效不受患者是否用过化疗药物的影响。因此,在治疗N SCLC中,分子靶向治疗药物常作为二线、三线甚至四线药物使用,而化疗药物在二线使用时其疗效往往已经下降。2003年获美国食品药品管理局批准,易瑞沙用于既往化疗失败的晚期N S CLC 患者的治疗,研究发现,不管患者曾接受过多少次化疗药物治疗,易瑞沙仍可发挥作用,特别是对亚洲女性、不吸烟的肺腺癌患者。Cu fer等对含铂化疗方案治疗失败的晚期N S CLC 患者采用易瑞沙进行ò期临床试验,结果其疗效与多西紫杉醇标准二线治疗的疗效相当。此外,易瑞沙的疗效与患者的种族有很大关系,其对亚洲人群的作用较欧洲人群强。近期一项评价易瑞沙治疗晚期N SCLC疗效的研究发现,其平均有效率为18%,其中对日本人群的有效率为27%,而对欧洲人群的有效率仅11%,二者差异非常悬殊。当时,研究人员对此结果大感惊讶,甚至怀疑研究的可信性。后来有学者对各种族人群的EGFR基因突变进行研究,发现亚洲人群的EGFR基因突变率明显高于欧洲人群,从而找到二者差异的原因。储大同等研究发现,易瑞沙治疗晚期NSCLC患者的有效率为26%~27%。由此提示,患者种族不同,其分子靶向治疗药物的疗效各异。易瑞沙的最佳剂量为250m g/d,增加剂量虽不增加疗效,但其不良反应增加,该药与其他化疗药物联用亦不增加疗效。易瑞沙的主要不良反应为皮疹和腹泻,多为可逆的?~ò级反应。 1.2厄罗替尼(特罗凯)特罗凯是一种针对EGFR的小分子TK I,可作为化疗失败后的二、三线治疗药物。ó期特罗凯单药治疗晚期N SCLC的研究显示,特罗凯组的生存率比安慰剂组提高45.1%,与易瑞沙类似。有研究发现,特罗凯与一线化疗药物联合治疗晚期NSCLC,其疗效并不增加,所以不推荐二者联用。特罗凯主要适用于EGFR突变、基因扩增或不吸烟的N SCLC患者,其主要不良反应是皮疹、腹泻、瘙痒、皮肤干燥等,皮疹的持续时间预示特罗凯有效性的持续时间。 1.3西妥西单抗(爱必妥)爱必妥是一种针对EGFR的IgG 1 单抗隆抗体。研究证实,将爱必妥联合含铂化疗方案作为表达EGFR的NSCLC患者的一线治疗,有明显疗效。2004年ASCO会议公布了K ell y等进行的ò期临床试验结果,作者对86例表达EGFR的进展期N SCLC患者采用去甲长春碱+顺铂(DDP)+爱必妥一线治疗,结果与单用DDP 治疗者比较,DDP+爱必妥治疗者的有效率、疾病进展时间均明显改善。爱必妥的主要不良反应是痤疮样皮疹、斑丘疹、脂溢性皮炎、乏力等。 2以抑制血管生长为靶点的药物 NSCLC的肿瘤血管生长受促血管生长因子和抗血管生长因子的双重作用,因此,抑制血管生长因子可拮抗肿瘤血管生长。血管内皮生长因子(VEG F)及其受体是血管内皮细胞增殖分化和血管生长的重要刺激因子,VEGF可增加血管通透性,使肿瘤易于扩散,其过度表达提示N SCLC患者预后不良。 2.1VEGF抑制剂A v asti n A vasti n是一种重组人源化的抗VEGF抗体,是首个进入临床的抑制血管生长的药物。A vas-ti n通过与VEG F结合,阻止和减弱VEGF与血管内皮细胞表面受体结合,从而抑制内皮细胞增殖和新生血管生长,起到抗肿瘤作用。在一项ECOG4599的研究中,研究人员分别采用泰素)卡铂方案加A vasti n方案与泰素)卡铂方案治疗NSCLC患者,结果发现两组患者的肿瘤无进展生存期(PFS)分别为6.4、4.5个月,其中位生存期分别为12.5、10.2个月;由于泰素)卡铂加A vasti n方案疗效明显,故ECOG将该方案推荐为一线治疗非鳞癌N SCLC患者的标准方案。之所以排除鳞癌,是因为鳞癌患者采用该方案治疗后,其致命性出 102 山东医药2010年第50卷第21期
常见的肺癌分子靶向治疗靶点
常见的肺癌分子靶向治疗靶点 近年来,随着分子生物学技术的提高和在细胞受体及增殖调控的分子水平对肿瘤发病机制的进一步认识,人们开始了针对细胞受体、关键基因和调控分子为靶点的治疗,并称之为“分子靶向治疗”。 分子靶向性药物不是将杀伤肿瘤细胞作为目标,而是将肿瘤细胞膜上或细胞内特异性表达或高表达的分子为作用靶点,这不仅能更加特异地作用于肿瘤细胞,阻断其生长、转移或诱导其凋亡,而且还同时降低了对正常细胞的杀伤作用。近年来,在肺癌治疗中针对信号转导、生长因子及其受体的新型分子靶向药物,已经展现出值得期待的疗效。 一、以EGFR为靶点的肺癌靶向治疗 表皮生长因子受体(EGFR)是原癌基因C-erbB-1(HER-1)的表达产物。40%~80%的非小细胞肺癌(NSCLC)过度表达EGFR。EGFR与配体形成二聚体能激活酪氨酸激酶(TK),使肿瘤细胞增殖分裂和永生化,因此目前针对EGFR的靶向治疗在肺癌治疗领域中运用广泛。 吉非替尼(易瑞沙,gefitinib) 吉非替尼是一种可口服的EGFR TK小分子抑制剂,主要使癌细胞阻滞于G1期。两项多中心双盲随机对照Ⅱ期临床试验:IDEAL 1和IDEAL2在2003年完成。正是这两项Ⅱ期临床试验的结果促使美国食品与药物管理局(FDA)在Ⅲ期临床试验尚未完成的时候就迅速批准了吉非替尼作为NSCLC的三线治疗药物。 但是两项关于吉非替尼与标准一线化疗方案联用的多中心、随机、双盲对照Ⅲ期临床试验——INTACT 1及INTACT 2却带来令人失望的结果。2项Ⅲ期研究的结果均显示,吉非替尼与化疗药物同期联用,其效果并不优于单纯化疗,有学者认为这可能是由于该药与化疗药物作用于同一周期的细胞,其作用被化疗药物所掩盖。 Thatcher等发表ISEL研究的结果显示,吉非替尼与安慰剂相比未能延长化疗失败NSCL C患者的生存期。虽然研究显示在肿瘤缩小及缓解率方面吉非替尼具有优势,但并未能转化为有统计学差异的生存期延长。 SWOG0023研究对晚期不可手术的Ⅲ期NSCLC患者同步使用顺铂加足叶乙甙(VP16)方案化疗+胸部放疗,接下来给予多西他赛巩固化疗,再使用吉非替尼维持治疗,结果提示维持使用吉非替尼未能延长患者生存期。 Lynch等及Paez等的研究显示EGFR突变与TK抑制剂疗效相关。研究显示,EGFR突变是一种活化性突变,使TK对吉非替尼更为敏感;并且突变的频率与吉非替尼治疗相对敏感的人群相一致:女性>男性、腺癌>非腺癌,非吸烟者>吸烟者,日本患者>白种人患者;突变与客观缓解而不是与稳定或症状改善相关。这一结果可以帮助临床医师选择那些适合进行吉非替尼治疗的患者,而且符合肿瘤个体化治疗的理念。 同时引起人们兴趣的还有皮疹。许多临床研究发现皮疹的发生率、严重程度与患者接受吉非替尼治疗后的缓解率、生存情况有一定的相关性。因此,将皮疹作为监测预后指标有一定可行性,需进一步研究。 吉非替尼治疗中最常见的不良反应为座疮样皮疹和腹泻,日裔患者皮疹、腹泻发生率较非亚裔患者(71%、59%对46%、39%)高,但是严重皮疹与腹泻(≥3度)的发生率类似(3%、5%对4%、3%)。并发症中最严重的是间质性肺病(ILD)。
