植物细胞组织培养的基本技术(总结版)
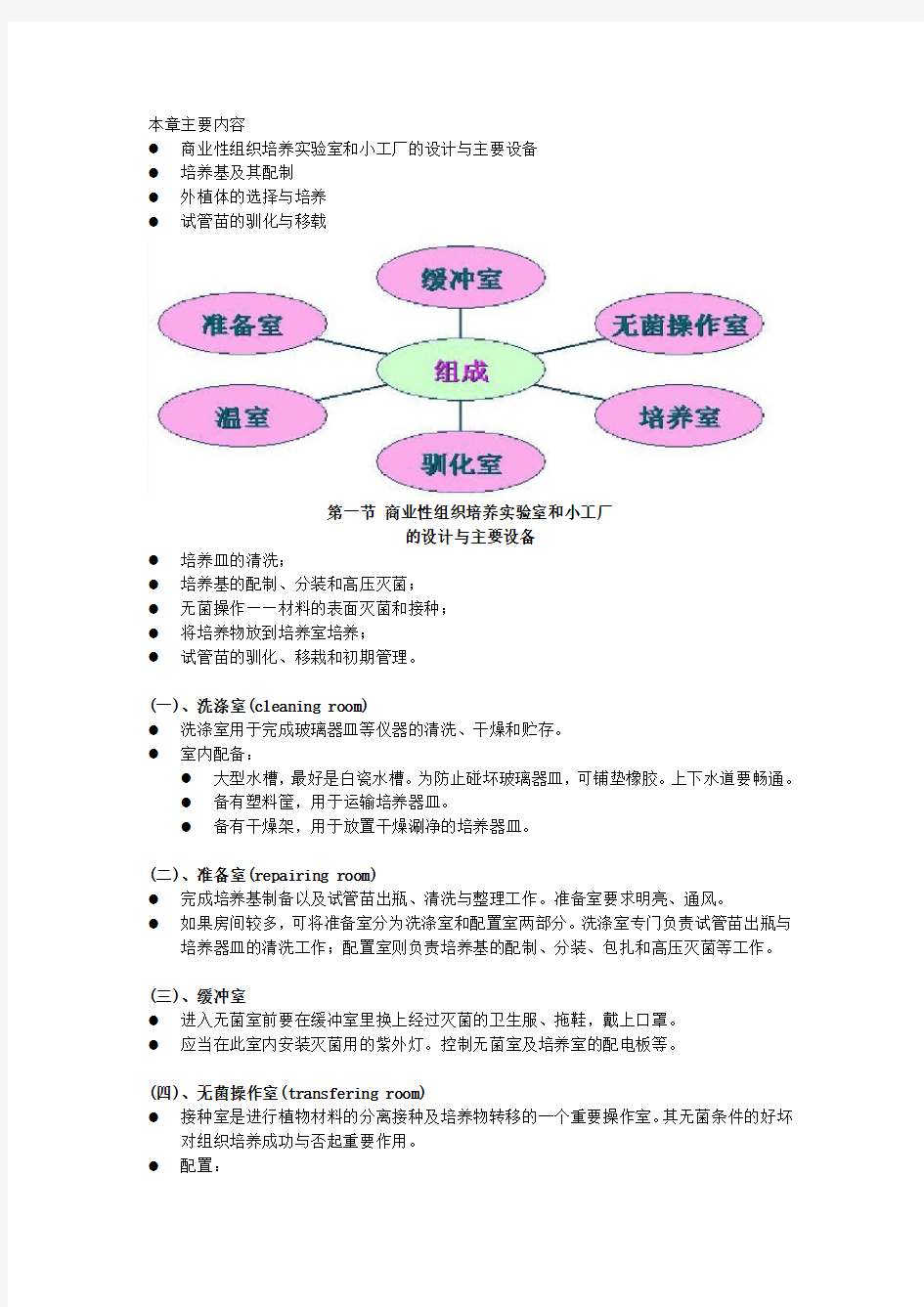

本章主要内容
●商业性组织培养实验室和小工厂的设计与主要设备
●培养基及其配制
●外植体的选择与培养
●试管苗的驯化与移载
第一节商业性组织培养实验室和小工厂
的设计与主要设备
●培养皿的清洗;
●培养基的配制、分装和高压灭菌;
●无菌操作——材料的表面灭菌和接种;
●将培养物放到培养室培养;
●试管苗的驯化、移栽和初期管理。
(一)、洗涤室(cleaning room)
●洗涤室用于完成玻璃器皿等仪器的清洗、干燥和贮存。
●室内配备:
●大型水槽,最好是白瓷水槽。为防止碰坏玻璃器皿,可铺垫橡胶。上下水道要畅通。
●备有塑料筐,用于运输培养器皿。
●备有干燥架,用于放置干燥涮净的培养器皿。
(二)、准备室(repairing room)
●完成培养基制备以及试管苗出瓶、清洗与整理工作。准备室要求明亮、通风。
●如果房间较多,可将准备室分为洗涤室和配置室两部分。洗涤室专门负责试管苗出瓶与
培养器皿的清洗工作;配置室则负责培养基的配制、分装、包扎和高压灭菌等工作。
(三)、缓冲室
●进入无菌室前要在缓冲室里换上经过灭菌的卫生服、拖鞋,戴上口罩。
●应当在此室内安装灭菌用的紫外灯。控制无菌室及培养室的配电板等。
(四)、无菌操作室(transfering room)
●接种室是进行植物材料的分离接种及培养物转移的一个重要操作室。其无菌条件的好坏
对组织培养成功与否起重要作用。
●配置:
●在工作方便的前提下,接种室宜小不宜大,一般7-8m2,要求地面、天花板及四壁
尽可能密闭光滑,易于清洁和消毒。配置拉动门,以减少开关门时的空气扰动。
●接种室要求干爽安静,清洁明亮。在适当位置吊装1-2盏紫外线灭菌灯,用以照射
灭菌。最好安装一小型空调,使室温可控,这样可使门窗紧闭,减少与外界空气对
流。
(五)、培养室(culturing room)
●培养室是将接种的材料进行培养生长的场所。培养室的大小可根据需要培养架的大小、
数目、及其他附属设备而定。
●设计原则:
●充分利用空间和节省
●能源
●高度比培养架略高为
●宜
●周围墙壁要求有绝热
防火的性能。
(五)、培养室(culturing room)
●培养架大多由金属制成。
●规格:
●一般设5层,最低一层离地高约10 cm,其他每层间隔30cm左右,培养架即高1.7m左
右。培养架长度都是根据日光灯的长度而设计,如采用40W日光灯,则长1.3 m,30 W 的长1m,宽度一般为60cm。
●培养室最重要的因子是温度,一般保持在20-27℃左右,具备产热装置,并安装窗式或
立式空调机。由于热带植物和寒带植物等不同种类要求不同温度,最好不同种类有不同的培养室。室内湿度也要求恒定,相对湿度以保持在70%-80%为好,可安装加湿器。
●控制日光照时间可安装定时开
关钟,一般需要每天光照10-16h。也有的需要连续照明。现代组培实验室大多设计为采用天然太阳光照作为主要能源,这样不但可以节省能源,而且组培苗接受太阳光生长良好,驯化易成活。
(六)、驯化室
●驯化室要求清洁无菌,配有空调机、加湿器、恒温恒湿控制仪、喷雾器、光照调节装置、
通风口以及必要的杀菌剂。
(七)、温室
●应配有空调机、通风口、加湿器、恒温恒湿控制装置、喷雾装置、光照调节装置以及必
要的杀菌杀虫装置及相应药剂。
二、仪器设备和器皿用具
●常见仪器设备
●1、超净台
●2、无菌箱
●3、空调机
●4、除湿机
●5、恒温箱
●6、烘箱
●7、高压灭菌锅
●8、冰箱
●9、电子分析天平和托盘天平
●10、显微镜及解剖镜
●11、水浴锅
●12、摇床与转床
●13、磁力搅拌器
●14、电蒸馏水器
●15、酸度计
●16、离心机
1、超净台和无菌箱
●1、超净台,优点是操作方便自如,比较舒适,工作效率高,准备时间短。开机10分钟
即可操作,可进行长时间使用。在工厂化生产中,接种工作量很大,需要经常长久地工作时,超净台是很理想的设备。
●2、无菌箱,在投资少的情况下,可以用接种箱来代替超净台。接种箱依靠密闭、药剂
熏蒸和紫外灯照射来保证内部空间无菌。但操作活动受限制,准备时间长,工作效率低。
工作原理
●超净台功率在145-260W左右,它装有小型鼓风机,使空气穿过一个前置过滤器,在这
里把大部分空气尘埃先过滤掉,然后再使空气穿过一个细致的高效过滤器,它除去了大于0.3um的尘埃、细菌和真菌孢子等,最后以较洁净的气流吹到工作台面。超净空气的流速为每分钟24-30m,这已足够防止附近空气袭扰而引起的污染,这样的流速也不会妨碍采用酒精灯对器械等的灼烧消毒。在这样的无菌条件下操作,就可以保证无菌材料在转移接种过程中不受污染。
●根据风幕形成的方式,超净台可分为水平式和垂直式二种型号。
(二)各类玻璃器皿
1、培养器皿
2、分注器
3、离心管
4、刻度移液管
5、细菌过滤器
6、实验器皿
1、培养器皿
●1、培养器皿:在组织培养中配制培养基和进行培养需大量的玻璃器皿。要求由碱性溶
解度小的硬质玻璃制成,以保证长期贮存药品及培养的效果;培养用的还要求透光度好,能耐高压高温,能方便放入培养基和培养材料的器皿,根据培养的目的和要求,可以采用不同种类、规格的玻璃器皿。其中以试管、三角瓶、培养皿等使用较多。
●最常使用的是
●三角瓶
●培养皿(9、12cm直径)用于:游离细胞、原生质体、花粉等的静置培养、看护培养、
无菌种子的发芽、植物材料的分离等都需采用。
●试管(18mmXl80mm或20mmX200mm)用于:培养较高的试管苗。
●工厂化生产可采用广口的200ml罐头瓶,加盖半透明的塑料盖,由于瓶口大,所以大量
繁殖时操作方便、工作效率高,也减少了培养材料的损伤。但缺点是易引起污染。
瓶口封塞
●瓶口封塞可用多种方法,要具有一定的通气性和密闭性,以防止培养基干燥和杂菌污染。
●以前封口常用棉塞。但这种封口办法夏季极易污染,且不易保持培养基的湿度。现在多
采用聚丙烯塑料薄膜作为封口,以线绳结扎或橡皮圈箍扎。为了增加通气性,可在里面衬一层硫酸纸或牛皮纸。这样经济方便,且通气好。也可采用专用的封口膜。
5、细菌过滤器
●用于除去不能采用湿热灭菌法的液体中的细菌。一般采用0.22um微孔滤膜进行抽滤灭
菌。包括滤头,注射器或采用抽滤装置:真空泵、吸滤瓶、滤气玻璃管等。
6、实验器皿
●在组织培养中配制培养基,贮藏母液,材料的消毒等需要各种化学实验用的玻璃器皿,
包括:
●100ml、250ml、500ml、1000ml烧杯;
●l0ml、l00ml、1000ml量筒;
●l00ml、1000ml试剂瓶(棕色)等等。
(三)、器械用具(P13)
●1.镊子类:尖头和枪形
●2.剪刀类
●3.解剖刀
●4.解剖针
●5、接种工具:接种针、接种钩及接种铲(由白金丝或镍丝制成)
●6、钻孔器
●7、其它:酒精灯,电炉,试管架,搪瓷盘等
第二节培养基及其配置
●目的要求:
●(1)一般掌握培养基的种类、特点;
●(2)掌握基本培养基的配方;
●(3)一般掌握培养基的组成成分和适宜的剂量;
●(4)掌握培养基母液和常用培养基的配制方法和步骤;
●(5)熟练掌握培养基的灭菌方法;
●(6)一般掌握培养基的筛选办法。
培养基及其配制
●培养基的种类
●培养基的成分
●培养基配制
1.培养基的种类
●按成分分类:
● MS,B5,White,NT,KM-8P,N6等。
●按状态:
液体,固体。
(1)MS培养基(Murashige and Skoog Medium)
MS培养基(Murashige and Skoog Medium)
●Toshio Murashige, Folke Skoog. A Revised Medium for Rapid Growth and Bio Assays
with Tobacco Tissue Cultures. Physiol. Plant. 1962,15:473-497.
●植物组织培养中常用的一种培养基。
●离子浓度较高,硝酸盐含量较其他培养基高。
●器官,花药,细胞,原生质体培养。
(2)B5培养基(B5 Medium)
●Gamborg, O. L.; Miller, R. A.; Ojima, K. Nutrient requirements of suspension
cultures of soybean root cells. Exp. Cell Res. 50:151–158; 1968.
B5培养基(B5 Medium)
●铵含量较低
●木本植物,十字花科植物
(3)White培养基(White Medium)
●White, P. R. Handbook of plant tissue culture. New York: The Ronald Press Co.;
1943. White, P. R.; Grove, A. R. Proceedings, International Conference on Plant ●Tissue Culture (1963: University Park, PA). Berkeley, CA: McCutchan Pub. Corp.;
1965:553 pp.
●无机盐含量低
●生根培养
(4)NT培养基(NT Medium)
●1970
●烟草叶肉原生质体培养
(5)KM-8培养基(KM-8 Medium)
●1974
●有机成分复杂,包括所有单糖和维生素,呼吸代谢主要有机酸
●原生质体和融合体培养
(6)N6培养基(N6 Medium)
●1974,朱至清等。
植物组织培养复习资料.doc
1.植物组织培养按培养对象分为______ 、 _______ 、________ 、 ________ 、________ 等几种类型。 2.一个己停止分裂的成熟细胞转变为分生状态,并形成耒分化的愈伤组织的现象称为 n tv 3.不同的灭菌剂其灭菌的机理一般不一样,次氯酸钙和次氯酸钠都是利用分解产生 _________ 来杀菌的;升汞是靠 ________ 来达到灭菌日的。 4.去除植物病毒的主耍方法是 _____ 和_______ 两种方法,当把二者结合起來脱毒效 果最好 5.在通过微茎尖培养脱毒时,外植体的大小应以成苗率和脱毒率综合确定,一般以 __________ mm、带 ________ 个叶原基为好。 6.White培养基________ 浓度低,适合生根培养。 7.一个已停止分裂的成熟细胞转变为_________ 状态,并形成_________ 的现象称为“ 脱分化”。 8.BA/NAA的高低决定了外植体的发育方向,比值低时促进 ________ 的生长,这时 _________ 占主导地位;比值高促进_________ 的生长,这时 _________ 占主导地位。 9.进行植物组织培养最基本的前提条件是 _____ 。 1、植物组织培养的理论基础是植物细胞全能性。 2、组织培养实验室必要的设备有超净工作台、高压灭菌器、空调机、夭平、显微镜、蒸饱水发生器等。 3、糖在植物组织培养中是不可缺少的,它不但作为离体组织赖以生长的碳源,而且还能维持培养菇渗透压 4、培养基灭菌一般在-108 kPa的压力下,锅内温度达121 °C ,维持20-30 min o 5、在离体叶培养中,6?BA和KT利于芽的形成:24D利于愈伤纟FI织的形成 6、在离体叶组织脱分化和再分化培养屮,茎和芽的分化主要有4个途径:方?接产生不泄芽、由愈伤组织产工不定芽、胚状体形成、形成球状体或小鳞茎等途径。 7、目前培育无病毒苗最广泛和最重要的一个途径是茎尖培养脱毒。 8、花药培养前的预处理:低温冷藏是最常用的方法。 1、植物组织培养的发展分为三个阶段:萌芽阶段、奠基阶段和快速发展和丿、'、/「用阶段。 2、培养基最常用的碳源是蔗糖,使用浓度在1%?5%常用 _3_%o 3、培养基的种类按其态相不同分为固体培养基与液体培养基,其火菌方法一般采用壷热消毒灭菌方法。 4、 pll的大小会影响琼脂的凝固能力,一般当pll大于6.0时,,培养基将会 ___________ ,低于5.0时,琼脂不能很好地凝同。 5、一般情况下,生长索/细胞分裂素的比值高,有利于根的形成和愈伤组织的形成:比值低有利于芽的形成。
实验总结细胞培养方法
实验总结细胞培养方法公司内部档案编码:[OPPTR-OPPT28-OPPTL98-OPPNN08]
一、培养细胞常用配置培养基的配置:基础培养基500ml+胎牛血清50ml+双抗5ml 冻存液的配置:10 % DMSO + 90%胎牛血清 依次比例酌量配置。 超净工作台常规配置 移液器1套(2.5μl、20μl、200μl、1ml),酒精灯1盏,液器1 台,斜架1台,酒精喷壶1个,酒精棉球缸1个,污缸1个, 常规耗材:培养瓶(50㎝2),定量移液管(5ml、10ml),枪头 (1ml、200μl、10μl),培养皿,6/24/48/96孔板,医用脱脂棉球,冻存管 所需试剂:培养基,胎牛血清,双抗,DMSO,胰酶,75%酒精…… 实验前准备:所需的各项高压后的耗材及污物缸放于超净工作台内,用酒精喷壶喷洒实验台面,并关闭工作台打开紫外灯照射30min后开始实验操作。培养基及胰酶恢复常温后使用,可37℃水浴5-10min 二、细胞复苏 步骤:
1. 紫外消毒30min后关闭紫外灯,开启超净台正常工作状态,用酒精消毒操作者的双手。 2. 培养液(DMEM),恒温水浴箱37℃预热20min,备用。超净台内准备一支15ml离心管备用。 3.将所需的培养基确保瓶身干净后酒精消毒放于工作台面内,点燃酒精灯,再将瓶口对准在酒精灯上消毒2-3次,旋开瓶盖后需再次分别消毒瓶口和瓶盖。 4. 从液氮保存罐中取出冻存管,立即放入37℃水浴中,快速摇晃,直至冻存液融化至黄豆粒大小后迅速取出。 5. 将细胞悬液移入15ml离心管,缓慢加入4ml培养液,离心 (1000r/min,5min)。 6. 取出2个培养皿并做好标记(复苏日期等),提前加入5-10ml培养液;离心结束后用1ml培养液悬液混悬沉淀细胞后分别加入培养皿内。 7. 将培养基瓶口和瓶盖消毒2-3次后拧紧,熄灭酒精灯,整理实验台面,取出实验试剂及污缸等,关闭超净工作台。 8. 将培养瓶放入培养箱内培养 注意事项:
植物细胞培养
植物细胞培养 一、定义 ●在离体条件下,将愈伤组织或其他易分散的组织置于液体培养基中进行振 荡培养,得到分散成游离的悬浮细胞,通过继代培养使细胞增殖,从而获得大量细胞群体的一种技术。 ●植物中含有数量极为可观的次生代谢物质,是各种色素、药物、香精、酶等天然 产物的主要来源。 ●植物细胞培养具有以下优点: 1、提高产率 2、缩短周期 3、提高产品质量 4、易于管理,减轻劳动强度 因此主要用于生产色素、药物、食品、酶、精细化工产品等次生代谢物。 二、培养基 常用MS培养基,另外还有B5、N6、NT、AA、KM8p等培养基 三、单细胞培养 1、制备方法 (1)机械法(机械磨碎、切割) (2)酶解法(目前最有效的获得单细胞方法) (3)愈伤组织诱导法(高频振动愈伤组织) 2、培养方法 (1)平板法(似微生物平板培养) (2)看护培养与饲养层培养法 看护培养:将单个细胞接种到滤纸上再置于愈伤组织之上进行培养。 饲养层培养:用处理过(如X射线)的无活性的或分裂很慢、不具分裂能力的细胞来饲养细胞。 (3)液体浅层静置培养法:将一定密度的悬浮细胞在培养皿中形成浅薄层,封口静止培养。
(4)细胞同步化:同一悬浮培养体系的所有细胞都同时通过细胞周期的某一特定时期。植物细胞在悬浮培养中的游离性较差,容易团聚进入不同程度的分化状态,因此要达到完全同步化相当困难。 ①低温法:冷处理可提高培养体系中细胞同步化程度。 ②分选法:通过细胞体积大小分级,直接将处于相同周期的细胞进行分选,然后将同一状态的细胞继代培养于同一培养体系中。 ③饥饿法:在一个培养体系中,如果细胞生长的基本成分丧失,则导致细胞因饥饿而分裂受阻,从而停留在某一分裂时期。 ④抑制剂法:通过一些DNA合成抑制剂处理细胞,如尿苷等,使细胞滞留在DNA 合成前期,当解除抑制后,即可获得处于同一细胞周期—G1期的同步化细胞。 3、保存 (1)继代培养(高等植物、海藻等) (2)低温( 5℃~10℃) (3)冷冻( -20℃或液氮) 植物细胞冷冻保存方法: 在冰浴条件下加入预冷的冰冻保护剂,密封,继续冰浴15min,在-40℃停留2h后投入-196℃液氮罐中保存。 植物细胞冷冻保护剂组成: 7.5%二甲基亚砜(DMSO)+0.5mol/L山梨醇+5%甘油+5%蔗糖 四、植物细胞培养的应用 1、生产药用植物代谢产物(紫杉醇、苷类等) 2、生产天然食品、食品添加剂(可可碱等) 3、生产杀虫剂、杀菌剂(鱼藤酮、除虫菊脂) 4、生产饲料、精细化工产品(桑叶、橡胶等) 五、植物细胞的生物反应器大规模培养 1、培养特性 (1)细胞本身特性(生长慢、易结团、易损伤、易污染) (2)培养液流变特性(黏度增高) (3)气体传递与影响(O2与CO2需平衡)
1plant实验1 植物细胞组织培养
实验1 植物细胞组织培养 1.1 相关基础知识 细胞分化(cell diferentiation)指细胞后代在形态、结构和功能等发生变化的过程,归根结底是某些功能基因的开启或者关闭。一般说来,终端分化细胞已经失去分化潜能,只具有单能性;而大部分细胞只保留了部分分化潜能,称为多能性。对于动物而言,只有部分干细胞仍保留了分化的全能性。而植物体的任何一个细胞都具有生长分化成为一个完整植株的能力,称为植物细胞的全能性(totipotency)。 植物组织培养就是利用植物的全能性进行离体无菌植物培养的一门技术。植物组织培养最原始的意义是指愈伤组织培养,但发展至今,其范围已经扩展至植物和它的离体器官、组织、细胞和原生质体的离体无菌培养: 1)植株培养。指以具备完整植株形态的材料(如幼苗和较大的植株)作为外植体的无菌培养。 2)胚胎培养。指以从胚珠中分离出来的成熟或未成熟胚为外植体的离体无菌培养。 3)器官培养。指以植物的根,茎,叶,花,果等器官为外植体的离体无菌培养,如根的根尖和切段, 茎的茎尖,茎节和切段,叶的叶原基,叶片,叶柄,叶鞘和子叶,花器的花瓣,雄蕊(花药,花丝),胚珠,子房,果实等的离体无菌培养。 4)组织培养。指以分离出植物各部位的组织(如分生组织,形成层,木质部,韧皮部,表皮,皮层, 胚乳组织,薄壁组织,髓部等),或已诱导的愈伤组织为外植体的离体无菌培养。这是狭义的组织 ..... 培养 ..。 5)细胞培养。指以单个的游离细胞(如用果酸酶从组织中分离的体细胞,或花粉细胞,卵细胞)为 接种体的离体无菌培养。 6)原生质体培养。指以除去细胞壁的原生质体为外植体的离体无菌培养。 植物组织培养的成功与否取决于外植体的制备、无菌操作和人工培养环境。外植体的制备是能否建成离体繁殖系要过的第一关。所谓的外植体是指将外界生长的植物的细胞和组织经过一系列的无菌处理形成的有活性的无菌组织和细胞。习惯上我们经常使用化学药剂处理,例如氯化汞、次氯酸盐或者抗生素等。将从母株上取下的组织进行一定的剥离和分割,经过流水冲洗数分钟,再浸入适宜浓度的化学药剂中一段时间,最后经无菌水冲洗并适当分割即成外植体。制备外植体的原则是无菌和有活
植物细胞组织培养的基本技术(总结版).
本章主要内容 ●商业性组织培养实验室和小工厂的设计与主要设备 ●培养基及其配制 ●外植体的选择与培养 ●试管苗的驯化与移载 第一节商业性组织培养实验室和小工厂 的设计与主要设备 ●培养皿的清洗; ●培养基的配制、分装和高压灭菌; ●无菌操作——材料的表面灭菌和接种; ●将培养物放到培养室培养; ●试管苗的驯化、移栽和初期管理。 (一)、洗涤室(cleaning room) ●洗涤室用于完成玻璃器皿等仪器的清洗、干燥和贮存。 ●室内配备: ●大型水槽,最好是白瓷水槽。为防止碰坏玻璃器皿,可铺垫橡胶。上下水道要畅通。 ●备有塑料筐,用于运输培养器皿。 ●备有干燥架,用于放置干燥涮净的培养器皿。 (二)、准备室(repairing room) ●完成培养基制备以及试管苗出瓶、清洗与整理工作。准备室要求明亮、通风。 ●如果房间较多,可将准备室分为洗涤室和配置室两部分。洗涤室专门负责试管苗出瓶与 培养器皿的清洗工作;配置室则负责培养基的配制、分装、包扎和高压灭菌等工作。 (三)、缓冲室 ●进入无菌室前要在缓冲室里换上经过灭菌的卫生服、拖鞋,戴上口罩。 ●应当在此室内安装灭菌用的紫外灯。控制无菌室及培养室的配电板等。 (四)、无菌操作室(transfering room) ●接种室是进行植物材料的分离接种及培养物转移的一个重要操作室。其无菌条件的好坏 对组织培养成功与否起重要作用。 ●配置:
●在工作方便的前提下,接种室宜小不宜大,一般7-8m2,要求地面、天花板及四壁 尽可能密闭光滑,易于清洁和消毒。配置拉动门,以减少开关门时的空气扰动。 ●接种室要求干爽安静,清洁明亮。在适当位置吊装1-2盏紫外线灭菌灯,用以照射 灭菌。最好安装一小型空调,使室温可控,这样可使门窗紧闭,减少与外界空气对 流。 (五)、培养室(culturing room) ●培养室是将接种的材料进行培养生长的场所。培养室的大小可根据需要培养架的大小、 数目、及其他附属设备而定。 ●设计原则: ●充分利用空间和节省 ●能源 ●高度比培养架略高为 ●宜 ●周围墙壁要求有绝热 防火的性能。 (五)、培养室(culturing room) ●培养架大多由金属制成。 ●规格: ●一般设5层,最低一层离地高约10 cm,其他每层间隔30cm左右,培养架即高1.7m左 右。培养架长度都是根据日光灯的长度而设计,如采用40W日光灯,则长1.3 m,30 W 的长1m,宽度一般为60cm。 ●培养室最重要的因子是温度,一般保持在20-27℃左右,具备产热装置,并安装窗式或 立式空调机。由于热带植物和寒带植物等不同种类要求不同温度,最好不同种类有不同的培养室。室内湿度也要求恒定,相对湿度以保持在70%-80%为好,可安装加湿器。 ●控制日光照时间可安装定时开 关钟,一般需要每天光照10-16h。也有的需要连续照明。现代组培实验室大多设计为采用天然太阳光照作为主要能源,这样不但可以节省能源,而且组培苗接受太阳光生长良好,驯化易成活。 (六)、驯化室 ●驯化室要求清洁无菌,配有空调机、加湿器、恒温恒湿控制仪、喷雾器、光照调节装置、 通风口以及必要的杀菌剂。 (七)、温室 ●应配有空调机、通风口、加湿器、恒温恒湿控制装置、喷雾装置、光照调节装置以及必 要的杀菌杀虫装置及相应药剂。 二、仪器设备和器皿用具 ●常见仪器设备 ●1、超净台 ●2、无菌箱 ●3、空调机
细胞培养技术个人总结
总结---细胞培养 一.基本理论概论 原代培养: 也叫初代培养,指直接从体内取出的细胞、组织和器官进行的第一次的培养。 传代培养:将细胞从一个培养瓶转移到另外一个培养瓶即称为传代或传代培养。 细胞系:原代培养物成功传代后,则称之为细胞系。(如细胞系的生存期有限,则称之为有限细胞系;已获无限繁殖能力能持续生存的细胞系,称连续细胞系或无限细胞系。) 细胞株:通过选择法或克隆形成法从原代培养物或细胞系中获得具有特殊性质或标志物称为细胞株。 培养类型:细胞培养,组织培养,器官培养。 细胞生长的方式:贴附生长,悬浮生长 培养细胞的形态(形态不一定,环境改变形态可能改变):成纤维性型细胞,上皮型细胞(单层膜样生长),游走性细胞(游散生长,常有伪足跟突起) 二.培养过程及要点(切记无菌操作) (一)工作环境的处理 1. 实验进行前,无菌室及无菌操作台以紫外灯照射30-60 分钟灭菌,以70 % 酒精擦拭无菌操作抬面,并开启无菌操作台风扇运转10 分钟后,才开始实验操作。每次操作只处理一株细胞株,且即使培养基相同亦不共享培养基,以避免失误混淆或细胞间污染。实验完毕后,将实验物品带出工作台,以70 % 酒精擦拭无菌操作抬面。操作间隔应让无菌操作台运转10分钟以上后,再进行下一个细胞株之操作。 2. 实验用品以70 %酒精擦拭后才带入无菌操作台内。实验操作应在台面之中央无菌区域,勿在边缘之非无菌区域操作。无菌操作工作区域应保持清洁及宽敞,必要物品,例如试管架、吸管吸取器或吸管盒等可以暂时放置,其它实验用品用完即应移出,以利于气流之流通。 3. 小心取用无菌之实验物品,避免造成污染。勿碰触吸管尖头部或是容器瓶口,亦不要在打开之容器正上方操作实验。容器打开后,以手夹住瓶盖并握住瓶身,倾斜约45°角取用,尽量勿将瓶盖盖口朝上放置桌面。吸管口切勿碰到容器瓶口 4. 工作人员应注意自身之安全,须穿戴实验衣及手套后才进行实验。对于来自人类或是病毒 感染之细胞株应特别小心操作,并选择适当等级之无菌操作台(至少Class II)。操作过程中,应避免引起aerosol 之产生,小心毒性药品,例如DMSO 及TPA 等,并避免尖锐针头之伤害等。 5. 定期检测下列项目: CO2 钢瓶之CO2 压力。CO2 培养箱之CO2 浓度、温度、及水盘是否有污染(水盘的水用无菌水,每周更换)。无菌操作台内之airflow 压力,定期更换紫外线灯管及HEPA 过滤膜,预滤网(300 小时/预滤网,3000 小时/HEPA)。 6. 水槽可添加消毒剂(Zephrin 1:750),定期更换水槽的水。 (二)试验用玻璃塑料用品清洗及其消毒灭菌 清洗: (1)玻璃器皿的清洗(酸液由重铬酸钾,浓硫酸,蒸馏水配置) 浸泡—刷洗—浸酸—冲洗 (2)胶塞的清洗 刚买回的常含滑石粉等杂质,先用自来水冲洗后再按常规方法处理。2%NaoH或洗衣粉煮沸10-20分钟---1%稀Hcl浸泡30分钟或蒸馏水冲洗后再煮沸10-20分钟—晾干备用 (3)塑料制品的清洗 2%NaoH浸泡过夜—自来水冲洗--5%稀Hcl浸泡30分钟—自来水和蒸馏水冲干备用。
细胞培养总结
细胞培养学习总结 --贴壁细胞培养技术 一、细胞培养一般流程: ㈠、复苏: 1、实验前做好相关准备工作(水浴锅37℃;超净工作台的无菌环境;准备 好实验相关仪器和试剂)。 2、把冻存管从液氮灌中取出来,立即投入37℃(≦40℃)水浴锅中,晃动 冻存管,使液体在1min以内全部融解(关键步骤),用酒精棉擦拭其外壁,放到超净工作台里。 3、把上述细胞悬液吸到15ml的离心管中,加入适量培养基,(用培养基把 冻存管洗一遍,把粘在壁上的细胞都洗下来,转移时不要直接倒,以防污染),1000转离心1-3min(可根据所培养细胞调整)。 4、吸弃上清液,加适量培养基把细胞吹散成细胞悬液,转移到培养瓶中, 加适量完全培养基(常为覆盖培养瓶底面即可)。 5、标好细胞种类和日期、培养人名字等,放到CO2培养箱中培养,细胞贴 壁后再换培养基。 6、注意观察细胞生长状态,及时换液或传代。 ㈡、换液: 1、实验前做好相关准备工作(超净工作台的无菌环境;准备好实验相关仪 器和试剂)。 2、取出培养瓶,用75%酒精消毒后放入超净实验台。 3、吸弃旧培养液,用适量(如2ml)PBS(磷酸盐缓冲液)清洗细胞(可根 据细胞状态洗1-2遍,一般从没有细胞的那一侧倒掉)。 4、加入适量新鲜完全培养基,放回培养箱继续培养。 ㈢、传代:
1、实验前做好相关准备工作(超净工作台的无菌环境;准备好实验相关仪 器和试剂)。 2、取出培养瓶,用75%酒精消毒后放入超净实验台。 3、吸弃旧培养液,用适量(如2ml)PBS(磷酸盐缓冲液)清洗细胞(可根 据细胞状态洗1-2遍)。(前面步骤同换液) 4、加适当的胰蛋白酶(0.05%)(能覆盖细胞就行),放入细胞培养箱中消化 1-2min(根据不同类型细胞而定)。 5、细胞都变圆后加如入等体积的完全培养基终止消化。 6、用滴管缓慢吹打细胞,使细胞都悬浮起来成细胞悬液,吸到15ml的离心 管中,1000转离心1-3min。 7、倒掉上清液,加1-2ml完全培养基,将细胞吹散成单个细胞。 8、根据细胞浓度把细胞传到几个培养瓶中,加入适量完全培养基(一般癌 细胞一个培养瓶分2个),放回培养箱中继续培养。 ㈣、冻存: 1、实验前做好相关准备工作(预先配置好冻存液放入4℃保存,常为 10%DMSO+90%血清,配制过程中加入DMSO要缓慢,且边滴边摇;超净工作台的无菌环境;准备好实验相关仪器和试剂)。 2、取出培养瓶,用75%酒精消毒后放入超净实验台。 3、吸弃旧培养液,用适量(如2ml)PBS(磷酸盐缓冲液)清洗细胞(可根 据细胞状态洗1-2遍)。 4、加适当的胰蛋白酶(0.05%)(能覆盖细胞就行),放入细胞培养箱中消化 1-2min(根据不同类型细胞而定)。 5、细胞都变圆后加入等体积的完全培养基终止消化。 6、用滴管缓慢吹打细胞,把细胞都悬浮起来成细胞悬液,吸到15ml的离心 管中,1000转离心1-3min。(同细胞传代中步骤) 7、倒掉上清液,加入预制的冻存液制成细胞悬液,分装到灭菌的冻存管中, (注意不要加满,预留其结冰后的空间,一般1.8ml的冻存管加入≦1.5ml 的细胞悬液)。
《植物组织培养》试题及答案教学教材
试卷编号NO: 高等函授教育《植物组织培养》试题 学号:姓名: 一名词解释:(10*2分=20分) 1、植物细胞组织培养 2、细胞全能性 3、脱分化 4、外植体 5、试管苗驯化 6、间接不定芽发生 7、双极性 8、微体嫁接 9、人工种子 10、体细胞无性系变异 二填空:(30*1分=30分) 1、目前植物组织培养应用最广泛的方面是 和。 2、由脱分化的细胞再分化出完整植株有两种途径,一种叫做,另一种叫做。 3、培养用具的常用灭菌方法有、、 。 4、某些生长调节物质及抗生素、酶类物质遇热不稳定,对其灭菌时不能进行,而要进行。 5、一般来说,黑暗条件下有利于的增殖,而往往需要一定的光照。 6、植物离体授粉技术通常包括、、 三个方面。 7、一般液体培养的继代时间较短,继代一次;而固体培
养继代时间可以长些,继代一次。 8、外植体器官发生的三种途径包括、、。 9、从再生植株倍性来看,小孢子培养通常产生植株,胚 培养通常产生植株,通常产生三倍体植株。 10、脱毒苗鉴定与检测的主要方法有、、 、。 11、在生长素中,对于许多作物花粉的启动、分裂、形成愈伤组织和胚状体起着决定性作用,但是对却有抑制作用。 12、用平板培养法培养单细胞或原生质体时,常用 来衡量细胞培养效果。 13、用药剂处理是诱导染色体加倍的传统方法。 三计算题(1*10分=10分) 某培养基的配方是MS+BA 2.0mg/L+NAA 0.5mg/L+2.5%蔗糖+0.7%琼脂粉。MS母液的浓度分别是:大量元素20倍,微量元素500倍,铁盐100倍,有机物50倍;BA母液浓度1.0 mg/ml ,NAA母液浓度0.1mg/ml。要配制400ml 该培养基,需要吸取各种母液各多少ml?分别称取蔗糖、琼脂粉各多少克?(要求写出计算步骤)四简答题(5*5分=25分) 1、造成组织培养过程中发生污染的原因有哪些?如何有效控制污染? 2、简述外植体消毒的一般步骤。
国内外植物组织培养技术的差距
国内外植物组织培养技术的差距 姓名:*** 学号:********* 指导教师:*** 专业班级:生物工程2009级1班 完成日期:2012-06-05
摘要 植物组织培养技术是农业生物技术中最早实现产业化并取得显著经济效益和社会效益的领域,在理论研究和生产实践中具有广泛的应用价值。通过对国内外植物组培的发展概况以及技术差距的分析,指出了我国植物组织培养技术的发展现状、目前存在的主要问题和应采取的措施,并对植物组织培养技术的发展作了展望。 关键词:组织培养概况差距展望 Abstract The plant tissue culture technology is agricultural biotechnology as the first realized industrialization and get a remarkable economic and social benefits of the field, in the theoretical research and production practice has wide application value. Through the domestic and international plant tissue and the development situation of the technology gap analysis, and pointed out the plant tissue culture technology's development present situation, the existing problems and the measures should be taken, and the development of plant tissue culture technology are discussed. Key words:Tissue culture situation gap looking
HUVEC细胞培养心得
HUVEC 培养交流讨论: 各位仁兄,我查了一下,关于HUVEC 的贴子有几千篇,不知有那位知道的多的能给总结一下?我想应该有以下几 1、讲清HUVEC 与ECV304区别 2、HUVEC 原代与细胞株的关系、区别问题 3、能否总结一下国内有哪些单位可以买到HUVEC ?是原代还是细胞株? 4、培养中到底添加ECGS 还是ECGF ? 5、有些推荐细胞的应该讲清自己的是原代还是细胞株,能养多少代。 希望能抛砖引玉。 票数+收藏2回帖16浏览2686我也要发帖 举报 ? 浙江医院招聘浙江省老年医学研究所(临床医学) ? 请教关于HUVEC 细胞的培养 ? 求购HUVEC ? 【互助小组】正在养或已经养过HUVEC 的请进。 docter_zhao ? 0 2004-08-03 15:14 消息 引用 分享 huvec 必需加ECGS 及肝素,否则很难生长增殖 举报 ? zjqlucky ? 15 ? 5 ? 7 2004-08-03 17:27 消息 引用 分享 docter_zhao wrote: huvec 必需加ECGS 及肝素,否则很难生长增殖 这个好像也未必吧,我养的原代的huvec 只用20%胎牛血清的RPMI1640也长的很好呀,只是传ecgs 能传这么多代吧 票数+收藏1 举报 ? 2004-09-08 00:20 消息 引用 分享 我们曾试过用m199或DMEM 加20%胎牛血清原代培养,感觉效果不佳,后来加了ECGS 及肝素,发现细胞长得能有改变 票数+收藏1 举报 引用 分享 huvec 是脐静脉内皮细胞,不是那么难养,细胞可以从脐带自己提取,卖现成的细胞株也不贵,用内皮细胞的配套培email-sinian19988@https://www.360docs.net/doc/7b15646195.html,
植物细胞悬浮培养技术
植物细胞悬浮培养技术 一、基本原理 利用固体琼脂培养基对植物的离体组织进行培养的方法在某些方面还存在一些缺点,比如在培养过程中,植物的愈伤组织在生长过程中的营养成分、植物组织产生的代谢物质呈现一个梯度分布,而且琼脂本身也有一些不明的物质成分可能对培养物产生影响,从而导致植物组织生长发育过程中代谢的改变而利用液体培养基则可以克服这一缺点,当植物的组织在液体培养基中生长时,我们可以通过薄层震荡培养或向培养基中通气用以改善培养基中氧气的供应。植物细胞的悬浮培养是指将植物细胞或较小的细胞团悬浮在液体培养基中进行培养,在培养过程中能够保持良好的分散状态。这些小的细胞聚合体通常来自植物的愈伤组织。 一般的操作过程是把未分化的愈伤组织转移到液体培养基中进行培养。在培养过程中不断进行旋转震荡,一般可用100~12Or/min 的速度进行。由于液体培养基的旋转和震荡,使得愈伤组织上分裂的细胞不断游离下来。在液体培养基中的培养物是混杂的,既有游离的单个细胞,也有较大的细胞团块,还有接种物的死细胞残渣。 在液体悬浮培养过程中应注意及时进行细胞继代培养,因为当培养物生长到一定时期将进入分裂的静止期。对于多数悬浮培养物来说,细胞在培养到第18~25d 时达到最大的密度,此时应进行第一次继代培养。在继代培养时,应将较大的细胞团块和接种物残渣除去。若从植物器官或组织开始建立细胞悬浮培养体系,就包括愈伤组织的诱导、继代培养、单细胞分离和悬浮培养。目前这项技术已经广泛应用于细胞的形态、生理、遗传、凋亡等研究工作,特别是为基因工程在植物细胞水平上的操作提供了理想的材料和途径。经过转化的植物细胞再经过诱导分化形成植株,即可获得携带有目标基因的个体。 二、器材 超净工作台、高压蒸汽灭菌器、恒温培养箱、磁力搅拌器、恒温空气摇床、镊子、锥形瓶、水稻种子 三、操作步骤 1.配制培养基 按照培养基配方取各种药品,最后用蒸馏水定容到所需体积。所配制的培养基经高压蒸汽灭菌后备用,固体琼脂培养基分装在250mL 的锥形瓶内,每瓶约分装30mL。 2.水稻种子的消毒 (1)将种子置于无菌的培养皿内,以体积分数95%的酒精消毒1~2min。 (2)取出后用无菌水冲洗2~3 遍。 (3)将种子放入25.0g/L 的次氯酸钠溶液中轻轻摇动后,浸泡60min 。 (4)取出后用无菌水冲洗,将次氯酸钠溶液充分洗净。 3. 接种 在超净工作台内,将灭菌后的水稻种子接到诱导愈伤组织的固体培养基上,每个培养瓶接5~10 粒种子。接种完毕后用封口膜将培养瓶封好,放在26℃的恒温培养箱中进行黑暗培养。 4.悬浮培养的开始: 当得到愈伤组织后,将其转人到AA 液体培养基中。注意愈伤组织块应小于3mm . 若组织块较大可用无菌解剖刀将其分割成小块。液体培养基分装在250mL 的锥形瓶内.接种完毕后将瓶口用封口膜封好,把培养瓶放到恒温摇床上进行震荡培养。调整摇床的旋转速度,使之为120r/min。培养温度为26℃,在黑暗中培养。 5.悬浮培养物的保持 进行悬浮培养后要不断进行观察,由于培养物的继代培养与培养瓶内培养物的密度及细胞
植物组织培养
第一章植物的快速繁殖技术 一、快速繁殖的概念 植物一般通过有性繁殖和无性繁殖两种方式繁衍后代。很多花卉、果树林木和一部分粮食作物,由于它们的高度杂合性,常通过扦插、埋条、压条、嫁接或种植特殊的营养器官等方法进行营养繁殖,从而得到和亲本遗传性一致的后代;有些种子休眠期特别长的作物,用营养繁殖可以加快繁殖的速度;某些多年生作物用种子繁殖时要经过一个很长的幼年期,如用成年植物材料进行营养繁殖,常可大大缩短生长期。这些都是无性的营养繁殖。用组织培养繁殖植物的技术是一种特殊的营养繁殖方式,现在一般称之为“快速繁殖技术”(rapid propagation)或“微繁殖技术”(mic-ropropagation)。它是在无菌条件下,利用植物体的一部分,包括细胞、组织或器官,在人工控制的营养和环境条件下繁殖植物的方法。这可以看作是常规营养繁殖方式的一种扩展和延伸,它不但保持了常规方法的特点,而且还具有以下几个明显的优点:(1)使用的植物材料极少,往往只要少量的茎尖、叶片、剪切段或其他器官就能在试管中建立起反复增殖的系统。这样就可以节省常规营养繁殖时所需要的大量母本植株和因栽培和保持这些母株所需的土地和人力,对于珍贵稀有的植物材料还可能做到不毁坏原有的植株。(2)由于每个外植体产生的芽或胚状体常多于常规繁殖方法,每一个繁殖周期又比常规繁殖短得多,一般只要1一2个月,加上可以不受季节和气候条件的影响进行周年生产,所以繁殖速度往往比常规方法要高得多,繁殖的数量在一年中常可达几万、几十万甚至上百万倍。另外,由于试管中芽、植株或胚状体的小型化和利用多层的集约化培养架,可以在有限的空间生产大量的植株。在实际应用中,某些技术较完善的作物,每平方米培养面积一年约可生产一万到几万株,一个熟练工人一年约可生产数试管苗。如萱草,从30个外植体开始,在1.8平方米的培养面积上,8个月可以生产二万棵试管苗。(3)由于快速繁殖是在无菌的容器中进行的,在繁殖过程中不受病虫的侵害。如果和去病源技术相结合,可以大量生产高质、均一的无病苗木,而这一点用常规方法是很难做到的。这样的无菌无病的试管苗在远距离的运输中和国际交流中都是极安全和方便的,既可以防止病害的传播又可以免去复杂的检疫手续。(4)对于某些植物,组织培养产生的植株的表现型和从种子或常规营养繁殖方法得到的植株会有所不同,其性状要优于原植株。如波士顿蕨的试管植株由于不表现强烈的顶端优势而能形成更多的分枝,使植株形态更美观。非洲紫罗兰的试管植株呈莲座状,而用常规叶插方法得到的植株,叶柄长,整个植株更为直立,园艺性状也较差。 快速繁殖技术除了有上述明显的优点之外,和常规的营养繁殖方法相比也有其固有的一些特点,这方面常常容易被人们忽视而造成工作的失败或资金的浪费。首先,和常规方法相比较,要建立一个比较完整的组织培养实验室,需要相当的投资。在发达国家目前约要几万美元,在我国如建立一个包括实验室、培养室和有一定温室面积的系统也要投资几万、十几万以至几十万元,而且如完全使用电能调控光照和温度的话,运转费用也是相当可观的(我国大部分地区夏天需要降温,冬天需要升温,潮湿地区又需去温,以及培养的光照,都要消耗大量的电)。其次,此项工作对人员的要求比较高,除了要求能熟练和严格地进行无菌操作之外,对培养物的生长、分化和它的控制方法要有所了解。在探索一种新的植物的快速繁殖时需要进行大量的系统研究,这就要求有一定的理论知识和实践经验。另外,由于这种方法有可能在短时期内从极少量的外植体产生大量的新植株,所以在材料的选择、工艺流程稳定性的控制、周年生产中的各个环节的安排和衔接上要作精心的组织,否则常可能由于某一环节的失误而导致整个工作的失败。如由于选择了不良的原始材料(不良的基因型、未发现的变异体等),或在培养过程中由于培养方法不当,或因其他原因产生的遗传变异未能及早发现等,而导致最后产生大量的具有严重缺陷的植株。这一点在多年生木本植物中的后果 些性状要经过几年以至几十年的时间才表现出来。在某些培养系统中还会出现对于生产不利的遗传变异,如试管苗中残留的细胞分裂素效应常使分枝过多而影响某些作物的经济性状。 二、快速繁殖技术发展史简略
植物组织培养技术
楚雄师范学院化学与生命科学系 生物技术专业《植物组织培养技术》课程教学大纲 一、课程基本信息 课程代码:031106014 课程中文名称:植物组织培养技术 课程英文名称:Plant Tissue Culture Technology 课程性质:专业选修课 使用专业:生物技术专业、葡萄与葡萄酒工程专业 开课学期:第7学期 总学时:36+27 总学分:3 预修课程:植物学、植物生理学 课程简介 植物组织培养技术是将植物的离体材料(器官、组织、细胞、原生质体等)无菌培养,使其生长、分化,进而再生完整植株的无性繁殖技术,是实践性较强的专业课之一。本课程在介绍了组织培养的含义、特点及其意义;组织培养的概念、类型、特点;组织培养技术的基本原理及操作规范;组织培养的发展简史、发展趋势及其应用。通过本课程的学习,使学生掌握组培实验室、家庭组培室、组培育苗工厂的组成、设计原则与设计要求;熟练掌握各种培养基的特点与应用;熟练掌握茎尖、茎段、叶及花器官培养消毒灭菌、接种及培养的技术;理解种质资源离体保存的意义,掌握种质资源离体保存常用方法;掌握一些常见植物的组培脱毒与快繁技术的应用。 教材建议 《植物组织培养原理与技术》,李胜、李唯主编,化学工业出版社,2008年。 参考书 《植物细胞组织培养》,刘庆昌编著,北京:中国农业大学出版社,2002年,标准书号:7-81066-529-4。 《植物组织培养(第三版)》,潘瑞炽编著,广州:广东高等教育出版社,2003年,标准书号:7-5361-2501-1。 《植物组织培养教程》,李浚明编著,北京:中国农业大学出版社,1996年,标准书号:7-81066-466-2。
南方医科大学研究生细胞培养技术考试重点总结
一. 细胞培养技术的概念,简史在体外对细胞培养并进行研究的技术, 也叫细胞克隆技术. 细胞培养技术是生物技术中最核心、最基础的技术。细胞培养技术主要包括二大方面内容: 1.微生物细胞培养技术 2.动, 植物细胞培养技术:1) 器官培养技术 2) 组织培养技术 3) 细胞培养技术二. 细胞培养的优点 1.得到的是活细胞:能长时间、直接观察、研究活细胞的形态、结构、生命活动 2.可控制:(1)可控制-选择对象:类型:上皮?间质?性质:正常?肿瘤?(2)可控制-调节条件:各种因素:物理、化学、生物等因素(3)可控制-利用方法。采用各种研究技术、记录方法:研究:倒置生物显微镜、荧光显微镜、电子显微镜、流式细胞术、激光共焦显微镜、免疫组织化学、原位杂交、同位素标记-- 记录:摄影照片、缩时电影、电视-- 3. 应用广(1)学科多:(2)对象广:各种动物:低等动物--高等动物--人类;一种动物:不同年龄;不同组织: 正常或异常(肿瘤)4.较经济:花钱较少但可得到大量、同时、重复性好的生物学性状相似的实验对象 5. 不易污染环境三、细胞培养的缺点 1. 现人工无法完全模拟体内环境: a. 失去彼邻关系b.失去神经体液的调节和细胞相互间的影响 2. 细胞趋向单一化 3.失去原有组织结构和细胞形态 4.分化减弱或不显:要正确认识体外培养细胞是一种特定条件下生长的细胞群体。 5. 某些类型细胞还很难培养 6.大规模培养难度大四. 体外细胞培养的方式 1.粘附型培养: 附着在某一固相支持物表面才能生长的细胞。粘附是大
多数有机体细胞在体内外生存和生长发育的基本存在方式 2.悬浮型培养: 不必附着于固相支持物表面,而在悬浮状态下即可生长的细胞。来源:来自血,脾或骨髓,尤以血中白细胞.癌肿细胞也可以. 特点:在悬浮中生长良好,细胞圆形,单个或小细胞团优点: 生存空间大,提供数量大,传代方便(不需消化),易于收获可获得稳定状态. 缺点:观察不方便, 很多细胞不能悬浮生长(尤以正常细胞) 五.体外培养细胞的生长形态分类根据形态大致的不同,主要2类: 1.上皮样:来源:来源于外胚层,内胚层细胞如:皮肤及其衍生物, 消化道,乳腺,肺泡, 上皮性肿瘤形态:类似体内的上皮细胞,扁平,不规则多角形,中有圆形核易相连成片相靠—紧密相连—成薄层—铺石状 2.成纤维细胞样:培养中形态与成纤维细胞类似。来源:中胚层间充质组织起源的组织如:真正的成纤维细胞:心肌,平滑肌,成骨细胞,血管内皮形态:似体内成纤维细胞的形态,胞体梭形或不规则三角形,胞质向外伸出2—3个长短不等的突起,中有卵圆形核。 3.其它,不定型 六. 常用术语1.细胞系(cell line):原代培养物首次传代后,就可以称细胞系。不能或有限传代下去称有限细胞系。能连续传代的称连续细胞系。 2.细胞株:某类细胞经传代克隆并保持了该类细胞理化特征的细胞群体。 3.原代培养:直接取自生物体的组织细胞并进行培养 4.传代培养:将细胞从一个培养物内分散到另一个培养物的过程。 5.转染(transfection):将某个基
植物细胞组织培养技术
植物细胞组织培养技术实验指导书 生物实验教学中心 主编:杨卫民 2009-06-01
目录 实验一、植物组织培养培养基母液的配制 (1) 实验二、植物组织培养的培养基配制 (5) 实验三、康乃馨的离体快繁 (9) 实验四、胡萝卜愈伤组织的建立 (14) 实验五、组织培养物的继代培养 (18)
实验一组织培养基母液的配制 一、仪器及药品 冰箱、天平(0.0001g) 容量瓶:1000ml,500ml、250ml、100ml、25ml 广口储液瓶:500ml、250ml、50ml、25ml 烧杯:1000ml、500ml、250ml、100ml、50ml 数十根玻璃搅棒、大药勺、小药勺或挖耳勺 标签纸、胶水、50%酒精、95%酒精、1mol/L盐酸、1mol/L NaOH 几种常用的培养基所需的大量元素、微量元素、有机物、激素、铁盐等药品 蒸馏水 二、方法和步骤: 按照培养基配方,把大量元素、微量元素、铁盐、有机物、植物激素分类,每一类 中各种药品分别称量,如N6培养基各种母液的配制步骤如下: 大量元素母液:包括用量较大的几种化合物〈见N6培养基配方〉,按表中排列顺序,将每种药品的用量扩大10倍,分别称取,分别溶解,然后按照顺序混合在一起。如钙盐等易发生沉淀的药品不能混合,应单位定容,最后加上蒸馏水,定容至1升或500毫升。在定容时注意用蒸馏水洗净烧杯和玻璃搅棒以减少误差。定容后的溶液为大量元素母液,配制培养基时,每配1L培养基需吸取该母液l00ml或50ml。 微量元素母液:因用量少,为了称量精确和方便,常配成100倍或1000倍的母液,即每种药品扩大l00倍或者l000倍。逐个溶解,混合在一起成为微量元素母液,每配1L N6培养基需吸取该母液10ml或者1ml。 铁盐:在N6培养基中需要单独配制,它是由硫酸亚铁(FeSO4?7H2O)2.78g和乙二氨四乙酸二钠(Na2-EDTA)3.73g,分别溶解,混合后,用酒精灯加热半小时以上,冷却后定容至1L。冰箱过夜贮藏无结晶析出,否则重新配制。每配l升N6培养基需加该铁盐母液5 ml。 有机物质:主要指氨基酸,维生素类物质。它们大都是扩大1000倍,分别称量,分别定容和储存,配制培养基时按需要的量加入。 植物激素:常用的有生长素类如:2,4-D、萘乙酸(NAA)、吲哚乙酸(IAA)、吲
植物组织培养习题及答案
0.填空 1.根据培养的材料,植物组织培养分:愈伤组织培养、(器官培养、细胞格养、原生质体培养(悬浮培养 2.植物组织培养的发展分为三个阶段:萌芽阶段、奠基阶段,快速发展和快速发展和应用阶段 3,1902年,Haberlandt提出了植物细胞“全能性”学说,1934年, White出版了《植物组织培养手册》培养等类型从而使植物组织培养为一门新兴学科。 一.填空、 1,组织培养实验室必要的设备有超净工作台、高压灭菌器、调机、_天平、显微镜、_蒸馏水,发生器,酸度计 养基成分主要包括①无机营养成分、②有机营养成分)、_③植物生长调节物质、_④碳水化合物、⑤其它物质 3、培养基最常用的碳源是_蔗糖,使用浓度在1%-5%常用3% 4、糖在植物组织培养中是不可缺少的,它不但作为离体组织棱以生长的碳源而且还能维持培养基渗透压 5、在固体培养时琼脂是使用最方便、最好的凝固剂和支持物般用量6-10g/L之间 6.驯化的目的:在于于提高试管苗对外界环境条件的适应性,提高其光合作用的能力,促使试健壮,提高苗的移裁成活 7、生长素/细胞分裂素的高低决定着外植体的发育方向,其比值高:有利于根的形成和愈伤组织的形成:低:有利于芽的形成 8、培养基灭菌一般在108kPa的压力下,锅内温度达_121℃C,维持_20-30min、 9.选择外植体时应选择①选择优良的种质、②选健壮的植株、③选最适的时期和④选取适宜的大小。 10、诱导胚状体比诱导芽的优点:(1)数量多、(2)速度快、_(3)结构完整 11、试管苗的生态环境:高温且恒温、高湿、弱光、无菌 12、培养基中加入活性炭的目的:利用其吸附能力,减少一些有害物质的影响大 13、筛选培养基的方法:单因子试验法、多因子试验法、广谱实验法 14、植物培养技术:灭菌、接种种、培养、驯化四个环节 15、试管苗的驯化注意:基质、温、光、水、肥、气的综合管理 二.填空 1.绝大多数培养植物再生植株时都先经过愈伤组织阶段 2.愈伤伤组织形成大致经历诱导期、分裂期一和分化期三个时期 3、愈用植物生长调节物质时要注意:种类和浓度生长素和细胞分裂素的比值4.愈伤组织的形态发生方式主要有不定芽方式和胚状体方式 5.组织培养细胞再分化包括四个水平:细胞水平的再分化、组织水平的再分化、器官水平的再分化(器宣发生)和植株水平的分化 三.填空: 1.植物器官培养主要是指植物的根、茎、叶、花器和幼小果实的无菌培养。 2、茎尖培养根据培养目的和取材大小分为茎尖分生组织培养和普通茎尖培养两种类型。前者主要是对茎尖长度不超过,最小只有几十微米的茎尖进行培养,目的是获得无病毒植株:后者是对几毫米乃至几十毫米长的茎尖、芽尖及侧芽的培养,目的是离体快繁 3.不定芽产生的途径一是从外植体上直接产生二是从由外植体诱导产生的愈伤组织上产生 4.离体叶培养是指包括叶原基、叶栖、叶鞘、叶片、子吐等叶组织的无菌培养 5.在离体叶培养中,6-BA和KT利于芽的形成;24D利于愈伤组织的形成 四.填空 1、胚胎培养包括幼胚培养、成熟胚培养、胚乳培养、胚珠培养以及子房培养 2、离体胚的培养分为二种类型:。成熟胚培养和_幼胚培养六
细胞培养集锦(一个培养300多种细胞人的经验总结)
细胞培养集锦(一个培养300多种细胞人的经验总结) 一、消化与吹打 版上很多朋友讨论细胞培养问题,见到很多很好的经验总结,这里说一些我个人的经验,因为一些比较特殊的原因,我自己培养接触过近300种细胞,常用于做实验的,累积有百余种,可以说遇到过许多各式各样古怪的细胞。这里挑细胞消化开始做我的第一篇专题,并不是因为细胞消化最重要,而是近期看到大家频繁讨论这个话题,我就抛砖引玉,下面几点拙见,可能与其它朋友总结的一些经验有点出入,仅供大家参考。 许多同学对细胞消化做了许多研究,得出了很多有价值的经验,也见到很多人的困惑。其实细胞培养,尤其是细胞系的培养,就消化而言,不是太难,做得多了,善于总结经验,就能把细胞越养越好。一般的程序步骤,细节操作,我这里就不讲了,只讲一些基本操作背后的知识,如果不对之处,欢迎指正,一起讨论: 1,其实绝大部分细胞消化的时候是只要用胰酶润洗一遍即可,吸去胰酶后,残留的那些无法计算体积的附着在细胞表面的微量胰酶在37度一般不到2min足够消化细胞(绝大部分1min不到)。对于这些细胞原则上不要用胰酶孵育细胞,连续这样传代,对细胞伤害很大。简单的程序是PBS润洗吸去,胰酶润洗吸去,然后37度消化。 2,什么算是消化好了呢?不是细胞全部成间隔分布很离散的单个圆形才算消化好了,一般你肉眼观察贴壁细胞层,只要能移动了,多半呈沙壮移动,其实已经可以了,很多人喜欢把细胞消化或者吹打成完全分离细胞,这是没有必要的。一般能移动了,说明细胞与培养基质材料的附着已经消失了,细胞之间的附着也已经消失了,细胞已经独立分布了(虽然没有呈现很广的离散分布)。这个时候应该停止消化,不要等到看到镜下所有细胞都分离得非常好,间隙很大,才停止。细胞就是完全成单个细胞悬液,之后在贴壁的过程中仍然会聚集,这个是贴壁培养的细胞,尤其是肿瘤细胞的一个特性,无论死活的细胞都是如此,你可
