培养基和试剂技术性验收记录
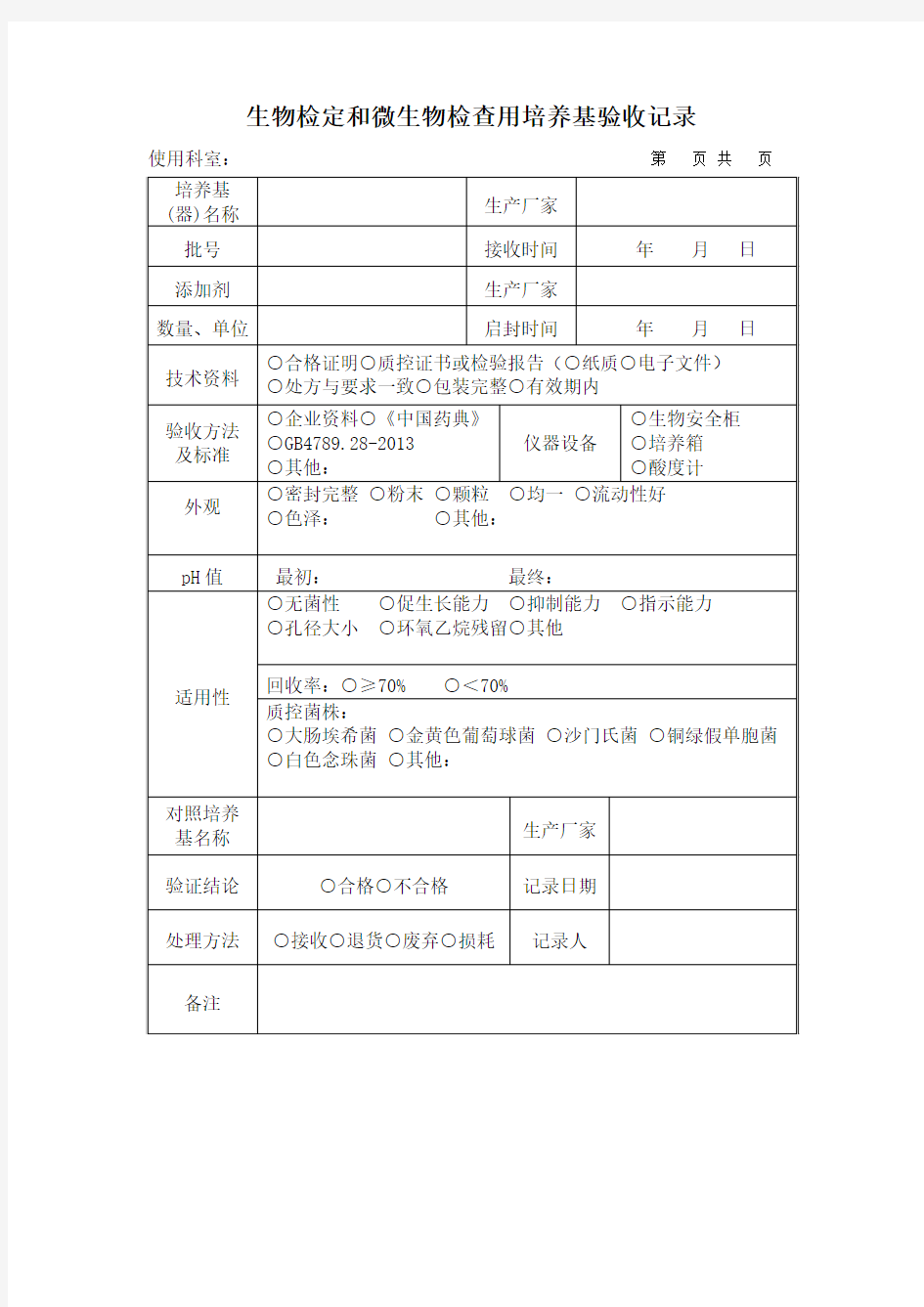
生物检定和微生物检查用培养基验收记录
使用科室:第页共页
培养基验收作业指导书删减版
培养基质量控制作业指导书 1、目的: 为加强我微生物实验室的工作管理,保证实验室的检测质量,特制定此作业指导书; 2、范围: 本规范适用于实验室微生物检测中所使用培养基的质量控制。 3、职责: 3.1 检验人员:按照本规程规对培养基使用前及使用过程中进行质量控制,确保培养基符合相关标准的要求。 3.2 科室负责人:负责指导、监督检验人员对培养基进行质量控制。 4、控制措施: 4.1培养基的购置和验收 4.1.1 培养基的购置 试剂管理员在接到批准的采购信息后,从合格供应商中选择厂商采购,同时要求厂商提供每批培养基的批号、使用前的pH值、储藏信息、有效期、性能评价记录(包括测试菌株、技术数据清单、质控证书及必要的安全危害数据)。 4.1.2 培养基的验收 购买培养基到货后,由试剂管理员和微生物检测人员共同核对生产企业提供的资料、培养基名称、规格数量、外观特征、批号、保质期是否符合要求。同时应填写“培养基验收检查记录单”验收符合要求后,交由检测人员接受保管,填写培养基入库记录和建立试剂台帐。 4.2培养基的储存 干粉培养基应保存在阴凉干燥处,要避免阳光直射;开瓶后的干粉培养基易吸湿,应注意防潮并在有效期或6个月内用完。应每月对储存中的培养基进行常规检查,如容器密闭性复查、首次开封日期、内容物的感官检查,如果培养基发生结块、颜色异常和其他变质迹象就不能再使用。开封的脱水培养基,每次使用前应对其质量进行检查,通过粉末的流动性、均匀性、结块情况和色泽变化等判断培养基的质量变化。若发现培养基受潮或物理性状发生明显改变则不应再使用。即用性培养基按照产品标识要求进行储存。 4.3培养基的使用 4.3.1 配制培养基用水和玻璃器皿 培养基制备用水应使用电阻率不小于30万Ωcm的蒸馏水或与其同质的水,每周检测电阻率,每三个月检测一次重金属离子含量。制备培养基所用的玻璃器皿(如吸管、试管、烧杯等)新的
药品购进、验收、储存、养护、和出入库复核管理制度
药品购进、验收、储存、陈列、养护 出库工作的管理制度 元江县人民医院 进货与验收 1 购进药品应按照可以保证药品质量的进货质量管理程序进行。应包括: (一)确定供货企业的法定资格及质量信誉。 (二)审核所购入药品的合法性和质量可靠性。 (三)对与本企业进行业务联系的供货单位销售人员,进行合法资格的验证。 (四)对首营品种,填写“首次经营药品审批表”,并经企业质量管理工作的负责人审核批准。 (五)签订有明确质量条款的购货合同。 (六)购货合同中质量条款的执行。 2 对首营品种合法性及质量情况的审核: 1) 药品的批准文号和取得质量标准; 2) 药品的包装、标签、说明书应符合规定; 3) 了解药品的性能、用途、检验方法、储存条件以及质量信誉等内容。 3 在签定的购销合同中应明确的质量条款: (一)在工商购销合同中: (1)、药品质量符合质量标准和有关质量要求; (2)、药品附产品合格证; (3)、药品包装符合有关规定和货物运输要求。 (二)商商间购销合同中应明确:
(1)、药品质量符合质量标准和有关质量要求; (2)、药品附产品合格证; (3)、购入进口药品,供应方应提供符合规定的证书和文件; (4)、药品包装符合有关规定和货物运输要求。 4 建立完整的药品购进记录 1)记录内容应包括:药品的品名、剂型、规格、有效期、生产厂商、供货单位、购进数量、购货 日期等项; 2)药品购进记录保存时间:应保存至超过药品有效期1年,但不得少于3年。 5 购进特殊管理的药品,应严格按照国家有关管理规定进行。 6 药品验收与检验环节的质量管理 到货质量验收检验是一项管理制度,是分清质量责任、把好质量关的关键环节。 1、药品质量验收 1) 质量验收内容: ⑴药品外观性状检查; ⑵药品内外包装及标识的检查,其主要内容包括: ① 每件包装中,应有产品合格证; ② 药品包装标签和所附说明书,有生产企业的名称、地址、药品的品名、规格、批准文号、生产日期、有效期等。标签或说明书上还应有药品的成分、适应症或功能主治、用法、用量、禁忌、不良反应、注意事项以及贮藏条件等; ③ 特殊管理药品、外用药品的标签或说明书上应有规定的标识和警示说明。处方药和非处方药按分类管理要求,标签、说明书上有相应的警示语或忠告语;非处方药的包装有国家规定的专有标识。
培养基适用性检查记录
培养基适用性检查记录 质量部
培养基名称:沙氏葡萄糖琼脂培养基来源:批号: 对照培养基:来源:批号: 检验依据:检验人:检验日期: 一、实验菌种: 白色念珠菌[CMCC(F)98 001]第代 黑曲霉[CMCC(F)98 003]第代 二、菌液制备 将白色念珠菌接种于沙氏葡萄糖琼脂培养基上,20~25℃培养5~7天;取上述培养物用0.9%无菌氯化钠溶液稀释至10-5~10-7,制成50~100cfu/ml的菌悬液。将黑曲霉接种于沙氏葡萄糖琼脂培养基上,20~25℃培养5~7天。加入3-5ml含0.05%(ml/ml)聚山梨酯80的0.9%无菌氯化钠溶液稀释至10-5~10-7,制成50~100cfu/ml的菌悬液。 三、培养基适用性检查 取5个无菌平皿,分别接种白色念珠菌、黑曲霉各2皿,每皿接种1ml菌液(含 菌适宜浓度),另一皿接种1ml PH7.0氯化钠-蛋白胨缓冲液作为空白对照,倾注对照沙 氏葡萄糖琼脂培养基,混匀。凝固后倒置培养,20-25℃培养5天计数。被检培养基同 法操作。 四、结果判断 五、结论 本品按《中国药典》2015年版“非无菌产品微生物检查:微生物计数法”及培养基适用性检验操作规程检验,结果:□符合规定□不符合规定。
培养基名称:胰酪大豆胨琼脂培养基来源:批号: 对照培养基:来源:批号: 检验依据:检验人:检验日期: 一、实验菌种: 金黄色葡萄球菌[CMCC(B)26 003]第代 铜绿假单胞菌[CMCC(B)10 104]第代 枯草芽孢杆菌[CMCC(B)63 501]第代 白色念珠菌[CMCC(F)98 001]第代 黑曲霉[CMCC(F)98 003]第代 二、菌液制备 将金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌分别接种于胰酪大豆胨液体培养基中,30~35℃培养18~24 小时;取上述培养物用0.9%无菌氯化钠溶液稀释至10-5~10-7,制成50~100cfu/ml的菌悬液。将白色念珠菌接种于沙氏葡萄糖琼脂培养基上,20~25℃培养5~7天;取上述培养物用0.9%无菌氯化钠溶液稀释至10-5~10-7,制成50~100cfu/ml的菌悬液。将黑曲霉接种于沙氏葡萄糖琼脂培养基上,20~25℃培养5~7天。加入3-5ml含0.05%(ml/ml)聚山梨酯80的0.9%无菌氯化钠溶液制成稀释至10-5~10-7,制成50~100cfu/ml 的菌悬液。 三、培养基适用性检查 取11个无菌平皿,分别接种金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌、黑曲霉各2皿,每皿接种1ml菌液(含菌适宜浓度),另一皿接种1ml PH7.0氯化钠-蛋白胨缓冲液作为空白对照,倾注对照胰酪大豆胨琼脂培养基,混匀。凝固后倒置培养,金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌皿30-35℃培养3天计数;白色念珠菌、黑曲霉20-25℃培养5天计数。被检培养基同法操作。 四、结果判断
医院药品入库验收制度
鄂尔多斯市第四人民医院 药品入库验收制度 一.药品验收制度 1.验收员必须核对购入药品是否与发出的药品采购计划中药品信息一致,确认无误 后依照药品的法定标准所规定的质量条款以及配送商签定的质量保证协议,对所购进的药品进行逐批逐项验收。 2.药品入库必须有发票和随货同行单;各种收发凭证,应分类按月保存备查。应建 立完整的药品购进验收记录,注明药品的通用名称、剂型、规格、批号、有效期、生产厂商、供货单位、购货数量、价格、入库日期、验收结果等,并由验收人员签字。验收记录应保存至超过药品效期后一年,但不少于三年。 3.药品验收入库应在待验区内按规定验收比例抽取样品,检查验收到最小包装。 4.国产药品必须验收其提供的药品质量检验报告是否与购入药品的批号一致。 5.进口药品须有《进口药品注册证》及《进口药品检验报告书》复印件(加盖供货 单位公章)。并核对检验报告书中的药品名、规格、批号、效期与购入药品一致。 6.特殊管理药品验收(麻醉药品、精神药品、毒性药品、高危药品等)应双人“即 收即验”,合格药品及时置于相应库区存贮。 7.验收血液制剂、生物制剂时,除按“特殊管理药品”验收外,还应查验药品是否
在冷链条件下配送,如不符合相关要求,不得验收入库。 8.验收过程中若发现原包装破损、药品数量短缺,应及时向配送企业提出退药、换 药或补足短缺数量要求并做好相应记录。 9.库管员对购进手续不全或资料不全的药品不得验收入库,验收时若发现质量不合 格或有疑问的药品应拒收,并及时上报科主任。 10.药品经验收合格并与原始单据或凭证核对无误后,库管员方可将药品置于相应的 库区。 11.二.药品验收程序 1.购入药品的检查验收程序 2.药品入库应按照数量查点、包装检查、标签说明书检查、注册商标检查、批 准文号核实、批号、效期检查、检验报告或合格证检查、外观性状检查等步骤进行验收,合格品方可入库;对数量、质量有疑问的,拒绝收货,交采购员与供货单位联系,做相应处理。 1、药品验收合格后,药库保管人员应及时办理入库手续,并于每月底与药品会计核 对后,将发票、随货同行单、入库单、出库单转交给药品会计建账。
采购、收货、验收的规定
采购、收货、验收的规定 采购员购进产品 1.坚持按需进货,择优选购,把好进货第一关。 2.制定采购计划,采购过程中比价,议价的处理事宜。 3.对首营企业、品种的填报审核承担直接责任。 4.了解供货单位的质量状况,及时反馈信息,为质管员开展质量控制提供依据。 5.签订购货合同时,必须按规定明确,必要的质量条款。 6.购进产品应开有合法票据,并按规定建立购进记录,做到票、帐、货相符。7、做好用户访问工作。 验收、储存、养护 1.负责按法定标准和合同规定的质量条款对购进及销后退回的医疗器械逐批进行检查验收。 2.验收保管员凭入库凭证(合同、运单、有关证明文件等)对入库医疗器械逐批按《质量检查验收管理制度》和有关医疗器械质量标准进行验收。 3.规范填写入库验收记录,做到字迹清楚、内容真实、项目齐全、批号数量准确,并签名负责,按规定保存备查。医疗器械的验收记录应真实完整。验收记录应有:到货与验收日期、名称、数量、生产单位、型号规格、生产批号、有效期、验收人员等。 一、医疗器械的采购必须严格贯彻执行《医疗器械监督管理条例》、《经济合同法》、《产品质量法》等有关法律法规和政策,合法经营。 二、采购人员须经培训合格上岗。 三、采购业务: (一)采购医疗器械应选择具有法定资格的供货单位。 (二)进口医疗器械必须由国家药品监督管理局出具的《医疗器械注册证》、《医疗器械产品注册登记表》等复印件。以上批准文件应加盖有供方单位的原印章。 (三)坚持“按需进货、择优采购”的原则,注重医疗器械采购的时效性和合理性,做到质量优、费用省、供应及时,结构合理。(四)签定医疗器械购销合同应明确以下质量条款: 1、医疗器械的质量符合规定的质量标准和有关质量要求; 2、附产品合格证; 3、包装符合有关规定和货物运输要求; 4、购入进口产品时,供应方应提供符合规定的证书和文件。 首营企业和首营品种按本公司医疗器械首营企业和首营品种质量审核制度执行。 购进医疗器械要有合法票据,购进医疗器械必须建立完整的医疗器械购进记录。购进记录必须记载:购货日期、供货单位、购进数量、单价、品名、规格(型号)、生产厂商、质量情况、经办人等。医疗器械购进记录必须保存至超过有效
细胞培养基质量标准及检验方法
细胞培养基质量标准及检验方法 中国医药生物技术协会 二0一一年四月
编写说明 一、根据中国医药生物技术协会2010年9月20日组织召开的《动物细胞培养基生产管 理及质量控制学术研讨会》纪要,结合我国的实际情况制定本标准。 二、本标准以《中国药典》2010版和《哺乳类动物细胞培养基》(HG/T 3935-2007)行业 标准为依据,结合生物制品对细胞培养基原材料的特殊要求制定,增加了牛血清白蛋白残留量、抗生素残留量等检测项目。 三、本标准分为细胞培养基检验项目和每个项目的检验方法两部分,为评判细胞培养基产 品质量提供了依据和方法,从而规范我国细胞培养基行业健康发展。 四、结果评定 依据本标准和方法对细胞培养基样品进行全项检验,所有项目均符合标准要求,判定该样品为合格;若有一项不符合标准要求,则判定样品为不合格。
细胞培养基质量标准及检验方法一、细胞培养基质量标准 细胞培养基质量应符合表1所示的技术要求。 表1 技术要求
二、检验方法 除非另有说明,检验中仅使用确认为分析纯的试剂和中华人民共和国药典2010年版中规定的纯化水。澄清度的测定 称取每升标示量的实验室样品,置于1 000ml烧杯中,加水950ml,搅拌至溶解,补加水至1000ml, 搅拌均匀。按中华人民共和国药典2010年版二部附录Ⅸ B进行。 pH值的测定 称取每升标示量的实验室样品,置于1 000ml烧杯中,加水950ml,搅拌至溶解,补加水至1000ml, 搅拌均匀。按中华人民共和国药典2010年版三部附录ⅤA进行。 干燥减量的测定 按中华人民共和国药典2010年版三部附录Ⅶ L 干燥失重测定法进行。 渗透压的测定 称取每升标示量的实验室样品,置于1 000ml烧杯中,加水950ml,搅拌至溶解,补加水至1000ml, 搅拌均匀。按中华人民共和国药典2010年版三部附录ⅤH渗透压摩尔浓度测定法进行。 取两次平行测定结果的算术平均值为测定结果,两次平行测定结果的绝对差值不大于这两个测定值的算术平均值的5%。 细菌内毒素的测定 按中华人民共和国药典2010年版三部附录Ⅻ E 细菌内毒素检查法中的凝胶法进行。 微生物限度的测定 按中华人民共和国药典2010年三部附录Ⅻ G微生物限度检查法进行,检查项目为细菌数、霉菌数。检查法采用平皿法。 细胞生长试验 贴壁型细胞生长试验 方法提要
采购收货与验收管理
采购、收货和验收管理 1.目的:规范职能部门在采购、收货与验收环节的质量把关。 2.依据 2.1《医疗器械监督管理条例》。 2.2《医疗器械经营监督管理办法》。 3.适用范围:适用于本公司质量管理部、行政财务部。 采购管理 一、医疗器械的采购必须严格贯彻执行《医疗器械监督管理条例》、《经济合同法》、《产品质量法》等有关法律法规和政策,合法经营。 二、采购人员须经培训合格上岗。 三、采购业务: (一)采购医疗器械应选择具有法定资格的供货单位。获取加盖供货者公章的相关证明文件或复印件。包括: 1、营业执照; 2、医疗器械生产或者经营的许可证或者备案凭证; 3、医疗器械注册证或者备案凭证; 4、销售人员身份证复印件,加盖本企业公章的授权书原件。授权书应当载明授权销售的品种、地域、期限,注明销售人员的身份证号码。 必要时,企业可以派员对供货者进行现场核查,对供货者质量管理情况进行评估。
(二)进口医疗器械必须由国家药品监督管理局出具的《医疗器械注册证》、《医疗器械产品注册登记表》等复印件。以上批准文件应加盖有供方单位的原印章。 (三)坚持“按需进货、择优采购”的原则,注重医疗器械采购的时效性和合理性,做到质量优、费用省、供应及时,结构合理。 (四)签定医疗器械购销合同应明确以下质量条款: 1、医疗器械的质量符合规定的质量标准和有关质量要求; 2、附产品合格证; 3、包装符合有关规定和货物运输要求; 4、购入进口产品时,供应方应提供符合规定的证书和文件。 首营企业和首营品种按本公司医疗器械首营企业和首营品种质量审核制度执行。 购进医疗器械要有合法票据,购进医疗器械必须建立完整的医疗器械购进记录。购进记录必须记载:购货日期、供货单位、购进数量、单价、品名、规格(型号)、生产厂商、质量情况、经办人等。医疗器械购进记录必须保存至超过有效期或保质期满后2年。 四、每年年底对供货单位的质量进行评估,并保留评估记录。 质量验收的管理 一、根据《医疗器械监督管理条例》等有关规定,为保证入库医疗器械质量完好,数量准确,特制定本制度。 二、验收人员应经过培训,熟悉医疗器械法律及专业知识,考试合格上岗。 三、医疗器械验收应根据《医疗器械监督管理条例》等有关法规的规定办理。对照商品和送货凭证,进行品名、规格、型号、生产厂家、批号(生产批号、灭菌批号)、有效期、产品注册证号、数量等的核对,对货单不符、质量异常、包装不牢固、标示模糊等问题,不得入库,并上报质管部门。 四、进口医疗器械验收应符合以下规定: (一)进口医疗器械验收,供货单位必须提供加盖供货单位的原印章《医
药品验收记录表
药品购进检验验收记录(201)采购日期通用名称制造商规范批号有效期购买数量购买单位验收结论检验结论接受方药品购进检验验收记录(2014)购买日期通用名称制造商规范批号有效期购买单价供应商外观检验测试结论接受方1月2日清开灵注射液河北神威药业有限公司10mi * 5件131108a2 2016-10 1208.75元,云南铜丰普成县1月2日5%葡萄糖注射液昆明南强250i /瓶a131111a2 2015 -10 240 1.641元云南同峰无异常可接收普增县1月20日云南白药云南白药集团4G * 6瓶zca1307 2017-02 1 63.132元,云南同峰无异常,可接收普增县2015年1月20日1.508元,云南铜丰无异常可收集普增县1月20日,吉兹喜糖浆太极集团,200mi /瓶,2016-07-516.173元,云南铜凤无异常可采集普增县1月20日,阿莫西林片,昆明远瑞药业,0.25g * 24粒,2015-09-20 3.55元云南铜凤无异常可以接受普增县1月20日四环素片昆明振华药业0.25g * 100粒2015-08-104.29元云南通丰无异常可采集普增县1月20日醋酸泼尼松片重庆科瑞药业5mg * 1000片693004 2016-08-1 22.86元云南通峰没有异常可以接受普赞庚1月20日荣盛地塞米松钠注射液1mi:2mg2015-1020 1.05元,云南同丰没有异常可以收集普赞庚1
月20日葡萄糖酸钙钙昆明玉石药10mi:1g * 5丸2015-11-101.49元云南普丰没有普赞gyen 1月20日注射用青霉素钠注射剂哈尔滨医药集团400万* 50片装a131**** ****-10100.68元nnan桐丰无异常可收集普赞庚恩1月20日小柴胡颗粒四川丰春药业云南神凤科仙注射液于2015年5月10日收到硫酸庆大霉素西南药业1mi * 40000 130606 2016-06-10 1.19元云南桐丰无异常可收集普增仙1月20日甲硝唑氯化钠昆明南强250mi / 1瓶a131111a2 2015-10 240 1.641元云南通丰普abnormal县1月20日5%葡萄糖注射液昆明南强250mi /瓶a131211c2 2016-11 2001.641普P县1月20日0.9%氯化钠昆明南强250mi / 1瓶a131210a1 2016-11 200 1.55元,云南铜丰无异常收费普增县药品采购检验验收记录(2014年)采购日期通用名称生产厂家说明书批号有效期采购数量采购单价供应商外观检验结论验收人3月5日清飞化痰丸昆明传统的中药厂6G * 10袋131244 2018-11 10 10.80云南桐峰无异常采集,普增县3月5日,安林巴比妥注射液西南药业公司2mi * 10片131002 2015-09-30 1.03云南桐峰无异常可采集普赞霉素3月5头孢他啶哈尔滨医药集团注射剂1g * 10片b131030 2015-09 300 2.80云南同丰无异常可接收普赞
制药企业微生物限度控制菌检查培养基适用性检查记录表式样
控制菌检查培养基适用性检查记录 一、菌液制备(需要的菌种在□内划“√”): □(1)大肠埃希菌新鲜肉汤培养物1ml ,9ml0.9%无菌NaCl溶液,10倍递增稀释; □(2)金黄色葡萄球菌新鲜肉汤培养物1ml,9ml0.9%无菌NaCl溶液,10倍递增稀释; □(3)乙型副伤寒沙门菌新鲜肉汤培养物1ml,9ml0.9%无菌NaCl溶液,10倍递增稀释; □(4)铜绿假单胞菌新鲜肉汤培养物1ml,9ml0.9%无菌NaCl溶液,10倍递增稀释; □(5)生孢梭菌新鲜硫乙醇酸盐流体培养物1ml,9ml0.9%无菌NaCl溶液,10倍递增稀释; 二、每ml菌液含菌量的计数测定。 测定方法:取稀释后的菌液1ml(剩余的菌液冷藏保存),置直径90mm的无菌平皿中,注入15-20ml已经过适用性检查确正的温度不超过45℃的溶化的营养琼脂培养基(细菌类别计数选用该培养基)或玫瑰红钠琼脂培养基(霉菌、酵母菌类别计数选用该培养基),混匀,凝固,倒置培养。每稀释级每种培养基至少制备2个平板。细菌类别培养温度为30℃~35℃;霉菌、酵母菌类别培养温度为23℃~28℃。细菌类别培养3天,霉菌、酵母菌类别培养5天。 三、检查结果:需做的检查在□内划“√”。 □ 1. 增菌培养基促生长能力检查
分别接种不大于100cfu的试验菌于被检培养基和对照培养基中,在相应控制菌检查规定的培养温度及最短培养时间下培养。与对照培养基管比较,被检培养基管试验菌。 检验标准:与对照培养基管比较,被检培养基管试验菌应生长良好。 结论: □ 2. 固体培养基促生长能力检查 检验标准:被检培养基的菌落数与对照培养基菌落数相比大于70%,且菌落形态大小应与对照培养基上的菌落一致。判该培养基的适用性检查符合规定。 结论: □ 3. 培养基抑制能力检查 分别接种试验菌于被检培养基中,在相应控制菌检查规定的培养温度和时间下培养,试验菌。 检验标准:试验菌应不得生长。 结论: □ 4. 培养基指示能力检查 分别接种少量试验菌于被检培养基和对照培养基中,在相应控制菌检查规定的培养温度和时间下培养。被检培养基中试验菌生长的菌落形态、大小、指示剂反应情况等。 检验标准:被检培养基中试验菌生长的菌落形态、大小、指示剂反应情况等应与对照培养基一致。 结论: 结论: 检验人:复核人:
食品采购索证索票 进货验收和台账记录制度
食品采购索证索票、进货验收和台账记录制度 1、根据《中华人民共和国食品卫生法》和《国务院关于加强食品等产品安全监督管理的特别规定》,做好食品采购索证和验收卫生管理工作。 2、把好食品采购关,采购的食品应符合国家有关卫生标准和规定的有关要求,不得采购《中华人民共和国食品卫生法》第九条规定禁止生产经营的食品。采购的食品及其原料应当无毒、无害,符合应当有的营养要求,具有相应的色、香、味等感官性状。 3、采购食品及其原料应当按照国家有关规定索证。采购时应索取发票等购货凭据,并做好采购记录,便于溯源;向食品生产单位、批发市场等批量采购食品的,或向供货商直接批发采购的食品还应索取食品卫生许可证、检验(检疫)合格证明或者化验单。? 4、食品定点采购,蔬菜等食品防止受到农药等有毒有害物质污染,肉类采购放心品牌并索取检疫证明,确保食品原料新鲜卫生。各类定型包装食品尽可能选用知名度高的大型企业的产品,保证安全卫生。 5、不采购质量不新鲜、腐败变质、发霉、生虫、虫蛀、有毒有害、掺假掺杂、超过保持期限及其他不符合食品卫生标准和卫生要求的食品。 6、、采购的定型包装食品和食品添加剂,必须在包装标识上按照规定标出品名、产地、厂名、生产日期、批号或者代号、规格、配方或者主要成份、保质期限、食
用或者使用方法等。食品包装标识必须清楚,容易辨识。在国内市场销售的食品必须有中文标识。 7、、采购食品添加剂必须选购国家允许使用、定点厂生产的食用级食品添加剂。 8、采购的食品容器、包装材斜、食品用工具、没备、用于清洗食品和食品用工具、设备的洗涤剂、消毒剂必须符合相应的卫生标准,对人体安全、无害。 9、建立食品索证、进货验收台帐并进行记录,指定专(兼)职人员负责食品索证、验收以及台帐记录保管等工作。 10、负责食品索证、验收和台帐记录的人员应掌握餐饮业常用食品卫生法规规定和食品卫生基本知识及感官鉴别常识。 11、在采购食品时,应到证照齐全的生产经营单位或市场采购,采购时应现场查验供货单位的资质。 12、在采购食品时应按下列要求进行现场查验和索证: (1)从食品生产企业或批发市场批量采购食品时,应按照生产批次向供货商索取符合法定条件的检验机构出具的检验报告复印件并经供货商签字或盖章。非批量采购食品时,应索取购物凭证。 从固定供货基地或供货商采购食品的,应索取并留存供货基地或供货商的资质证明,签订采购供货合同,并按相关规定进行索证。
培养基的配制及使用记录
培养基的配制及使用记录 序号操作指导操作参数记录数据签名 1 检查天平是否在校验有效期 内;检查天平是否正常、完好; 使用前对天平进行调零。 天平编号 是否在校验有效期内 是否正常、完好 是否调零 口是/ 口否 口是/ 口否 口是/ 口否 操作者 ______ 2 按右表配方比例,在天平上分 别称取培养基于洁净的烧杯 中,并记录称重与批号,将纯 化水加入上述烧杯中并搅 拌均匀,再定容至规定体积。 名称比例称重批号操作者 ______ 复核者 ______ 3 平板培养基的配制: 将上述定容好的培养基,分装 于500ml规格的三角瓶中或者 小试管中,塞上硅胶塞,用牛 皮纸包扎紧。 配制量ml 操作者 ______ 复核者 ______ 4 将包扎好的培养基,温度 121~125℃湿热灭菌15--20 分钟。待压力和温度下降后取 出,适当冷却。 灭菌锅编号 设定温度 灭菌时间 ℃ 操作者 _______ 5 进无菌室时,按要求更换上无 菌服,更衣穿戴完毕。 着装是否符合规范口是/ 口否操作者 ______ 6 将上述已灭菌的培养基经传递 窗转移至无菌室。在净化操作 台上,无菌操作下倒平板 (15--20ml/90mm皿)。 倒平皿数 试管斜面 副 个 操作者 ______ 7 空白培养实验 将已经冷却的培养基放入培养 箱中空白培养48小时。检测是 否无菌。 培养箱编号 培养箱温度 培养时间 是否无菌 ℃ 口是/ 口否 操作者 ______
8 废弃培养基及培养物在锅内加 热煮沸灭活,收集于废液桶中 定期处理。 煮沸、灭活口是/ 口否 操作者 _______ 复核者 _______ 附:培养基使用记录 使用日期使用去处使用数量(副) 使用者
采购设备验收规定
采购验收规定
沈阳东大阿尔派软件股份有限公司(版权所有,翻版必究)
文件修改控制
目录 1.目的 2.适用范围 3.术语及缩略语 4. 规定内容 4.1验收 4.2验收方式 4.3标识 4.4设备检验规程 5. 引用文件 5.1 NW607101《采购供方评定办法》 5.2 NW607103《采购流程管理》 5.3 NW607105《库房管理规定》 6. 质量记录 6.1 NW607104A“验收不合格记录”
1.目的 规范公司采购产品的验收活动,明确采购验收的标准,保证公司的软件开发和质量管理工作使用合格的产品。 2.适用范围 2.1 采购产品的验收 2.2 借用设备返还的验收 2.3 调拨设备的验收 2.4 返修返还设备的验收 3.术语及缩略语 本程序采用NQ402100《质量手册》中的术语和缩略语及其定义。 4.规定内容 4.1 验收 4.1.1 现场验收 4.1.1.1 实施条件 a) 用户要求在现场开箱 b) 合同执行的需要实施紧急放行 c) 直发用户的设备 4.1.1.2 现场验收的实施
由技术支撑部门、驻外分支机构或委托授权技术人员进行现场验收,然后返回NW607103E“设备自发(自采)验收单”,并由检验员签署处理意见,作为入库设备的检验结果,验收方式和抽样比例应采取不低于4.2规定的原则。4.1.2常规验收 4.1.2.1 采购产品的验收 检验员对收货区内的采购产品要进行验收,并将验收结论填写在NW607103D“送货验收单”上。若合格,由采购员办理入库手续,若不合格,应将产品存放在库房的不合格区,通知采购员处理。 4.1.2.2 借用设备的验收 检验员对收货区内的借出设备返还时,要进行验收,并将验收结论填写在JT“借条”上。若合格,由库房管理员办理借用返还手续,若不合格,应将产品存放在库房的不合格区,通知经手人处理。 4.1.2.3 调拨设备的验收 检验员对收货区内的调入受控库房内的设备要进行验收,并将验收结论填写在NW607105H“商品内部调拨单”上。若合格,由库房管理员办理调入手续。若不合格,应将产品应存放在库房的不合格区,通知调出库房管理员办理退货手续。 4.1.2.4返修返还设备的验收 检验员对收货区内的返修返还设备要进行验收,并将验收结果填写在“故障设备测试报告单”上。若合格,通知返修申
附二医院药品购进验收管理制度
内部管理制度系列 附二医院药品购进验收管 理制度 (标准、完整、实用、可修改)
FS-QG-87360 编 号: 附二医院药品购进验收管理制度 Attached sec ond hospital drug purchase in spect ion man ageme nt system 说明:为规范化、制度化和统一化作业行为,使人员管理工作有章可循,提高工作效率和责任感、归属感,特此编写。 第三医院药品购进、验收管理制度 1. 购进药品必须严格执行《中华人民共和国药品管理法》、《中华人民共和国产品质量法》、《中华人民共和国合同法》等有关法律法规,依法购进。 2. 购进药品应以质量为前提,从具有合法资格的供货单位进货。 3. 购进药品时,必须严格审核供货单位、购进药品及销售人员的资质,建立供货单位档案。 4. 购进药品,必须建立并执行进货检查验收制度,验收人员要逐批验明药品的包装、规格、标签、说明书、合格证明和其他标识;不符合规定要求的,不得购进。 5. 购进药品应有随货同行,并对照实物,依据随货同行 填写购进记录,做到帐、货相符。购进记录应载明供货单位、购货数
量、购货价格、购货日期、生产企业、药品通用名称、剂型、规格、批准文号、生产批号、有效期等内容,购进中药饮片,必须标明品名、规格、产地、生产企业、产品批号、购进数量、购进价格、购进日期等内容。票据和购进记录保存至超过药品有效期一年,但不得少于三年。 6. 对验收过程中发现的质量不合格或可疑药品,不得自行使用或作退、换货处理。对出现货单不符、质量异常、包装不牢或破损、标志模糊的药品,有权拒收。 7. 购进麻醉药品、精神药品、医疗用毒性药品、放射性药品等特殊管理的药品,应当从具有相应资格的药品生产或经营企业购进。并单设专用验收记录簿。必须做到货到即验收,不得拖延。清点验收到最小包装,并按有关规章制度与规范执行。 8. 购进需要保持冷链运输条件的疫苗等药品,应当检查运输条件是否符合要求并作好记录;对不符合运输条件要求的,应当拒绝接收。 9. 验收进口药品,其包装的标签应以中文注明药品的名 称、主要成份和注册证号,并附有中文说明书。 10. 验收中药饮片应符合规定,并附有质量合格的标志。 11. 凡验收合格的药品,必须详细填写验收记录,验收人员应签字
菜品采购流程与验收标准
菜品类采购流程及验收标准 一、目的 为规范食堂作业区原材料采购、验收标准,使食堂原材料采购、验收达到安全、卫生、节约的目的以及为员工提供安全、营养的工作餐,特制定本标准。 二、适用范围 适用于食堂后厨作业区,包含菜品采购人员进行菜品原材料采购工作;食堂后厨管理 人员、厨师、仓库管理人员协同验收入库等相关工作规范。 三、原材料分类 3.1、蔬菜类:主要包括叶菜类、茎菜类、根菜类、果菜类、花菜类和食用菌类等。 3.2、冷冻品:主要包括新鲜或冷冻的鱼、虾、虾仁及各种冻鸡鸭配件 3.3、肉产品类:主要包括新鲜或冷冻的猪肉、牛肉、羊肉、及其相关附属品。 3.4、家禽类:主要包括现宰鸡鸭及其附属品 3.5、米、面类:主要包括大米、面粉、玉米面等。 3.6、食用油类:主要包括花生油、花生调和油等。 3.7、调味品类:主要包括白糖、味精、豆腐乳、盐、酱油、食用醋等。 3.8、豆制品类:主要包括豆腐、豆干、豆果、豆腐皮等。 3.9、干货类:主要包括木耳、紫菜、香菇、大料、花椒等。
四、流程图 五、过程描述 5.1编制菜品计划单 厨师根据仓库管理员(需明确人员)统计的次日就餐人数结合当周菜谱提前一天列出次日需要的食材、原材料、辅料、物品等,并拟定《菜品计划单》, 由厨师长审核后按需按
量下单并将其提交至采购人员处(厨师长备份留档)。请购物资均以最小单位(斤、包、袋、件)填写,保证采购量的精确性。 5.2菜品供应商开发及年度合作确定 5.2.1供应商资质要求:企业合法三证;有合法经营资格许可证;食品卫生安全许可证;不同类别食品其他必要许可证等(出具全部资质证明) 5.2.2资格要求:产品质量合格;产品来源正规;满足我公司对于供货时间以及供货量的需求;能按时开具全额发票(出具全部相关证明) 5.2.3供应商考核以及下一年度供应商确定方式见《供应商管理制度》 5.3采购 5.3.1比价定价:对满足以上资质资格要求的供货商进行不同菜品(常用)三家或三家以上询比价并出具《比价议价表》(见《非产品类采购流程管理制度》)(特殊情况需提交情况说明),单类70%以上价格具有优势的可确定为拟合作单位并签订年度合作单位。原则上单类产品合作单位应该达2家或以上。 5.3.2调价:属于经常使用、变化不大的品种每月进行一次定价,月度定价品种包括酒水、调味副食品、干货海味、粮油糖、海鲜、水产品、冻品、蛋禽肉、肉类、蔬菜、水果等。市场价格变动供应商可申请重新调整供货价格,采购人员需根据市场价格行情核实价格合理性,每月需出具价格变动表或报告说明由部门领导审批后方可继续执行采购工作。若出现市场价格临时性变更且幅度达5%及以上,采购人员需出具市场调研表经审批后方可进行调价。 5.3.3属不常用、季节性较强、价格易变或特殊品种,不是急用的非常规品种,事前要了解市场价格,经三家对比价格,并征询主管经理意见后再落实供货单位。 5.3.4采购之前对供应商要经过松鼠廉署的廉政培训,并签订《公平公正交易承诺涵》。
GSP认证药品验收操作规程
药品验收操作规程 1.药品到货时,验收人员应当检查运输工具是否密闭,如发现运输工具内有雨淋、腐蚀、污染等可能影响药品质量的现象,应当通知采购人员并报质量管理人员处理。 2.验收人员根据运输单据所载明的启运日期,检查是否符合协议约定的在途时限,对不符合约定时限的,应当报质量管理人员处理。 3.供货方委托运输药品的,企业采购人员应当提前向供货单位索要委托的承运方式、承运单位、启运时间等信息,并将上述情况提前告知验收人员。 4.验收人员在药品到货后,要逐一核对承运方式、承运单位、启运时间等信息,不一致的应当通知采购部门并报质量管理人员处理。 5.药品到货时,验收人员应当查验随货同行单(票)以及相关的药品采购记录。 6.药品到货时,无随货同行单(票)或无采购记录的应当拒收。 7.药品到货时,随货同行单(票)记载的供货单位、生产厂商、药品的通用名称、剂型、规格、批号、数量、收货单位、收货地址、发货日期等内容与采购记录以及本企业实际情况不符的,应当拒收,并通知采购人员处理。 8.应当依据随货同行单(票)核对药品实物。随货同行单(票)中药品的通用名称、剂型、规格、批号、数量、生产厂商等内容与药品实物不符的,应当拒收,并通知采购人员进行处理。 9.收货过程中,对于随货同行单(票)内容中除数量以外的其他内容与采购记录、药品实物不符的,经采购部门向供货单位核实确认后,由供货单位提供正确的随货同行单(票)后,方可收货。 10.收货过程中,对于随货同行单(票)与采购记录、药品
实物数量不符的,经供货单位确认后,应当按照采购制度由采购人员确定并调整采购数量后,验收人员方可收货。 11.收货过程中,供货单位对随货同行单(票)与采购记录、药品实物不相符的内容不予确认的,到货药品应当拒收,存在异常情况的,报质量管理部人员处理。 12.验收人员应当拆除药品的运输防护包装,检查药品外包装是否完好,对出现破损、污染、标识不清等情况的药品,应当拒收。 13.企业应当按照国家有关法律法规及《规范》要求,制定药品收货与验收标准。 14.对药品收货与验收过程中出现的不符合质量标准或疑似假、劣药的情况,应当交由质量管理部门按照有关规定进行处理,必要时上报药品监督管理部门。 15.企业应当根据不同类别和特性的药品,明确待验药品的验收时限,待验药品要在规定时限内验收,验收合格的药品,应当及时入库,验收中发现的问题应当尽快处理,防止对药品质量造成影响。 16.验收记录包括药品的通用名称、剂型、规格、批准文号、批号、生产日期、有效期、生产厂商、供货单位、到货数量、到货日期、验收合格数量、验收结果等内容。 17.验收记录包括验收人员姓名和验收日期。 18.验收不合格的药品,需注明不合格事项及处置措施。 19.冷藏、冷冻药品到货时,查验冷藏车、车载冷藏箱或保温箱的温度状况,核查并留存运输过程和到货时的温度记。 20.对未采用规定的冷藏设备运输或温度不符合要求的,应当拒收,同时对药品进行控制管理,做好记录并报质量管理部门处理。 21.验收药品应当按照批号逐批查验药品合格证明文件。 22.对于相关证明文件不全或内容与到货药品不符的,不得入库,并交质量负责人处理。 23.验收药品应当按照药品批号查验同批号的检验报告书。
培养基配制及适用性检查标准操作规程
目的: 建立培养基配制及适用性检查的标准操作规程,规范实验人员的操作流程。范围: 适用于微生物检验人员对培养基的规范管理。 依据: 《药品生产质量管理规范(2010年修订)》、《中华人民共和国药典》2015年版第四部 职责: 1.微生物检验员:负责实验室所需求的培养基管理工作,使日常检验可以顺利进行。 2.微生物检验主管:负责对日常配制培养基的规范操作进行监督。 内容 1 培养基的申购 根据检验项目、工作量和工作进度的需求,提前一个月进行所需的培养基申购。申购时需指定培养基供应商,必要时进行供应商审计。
2 培养基的验收 培养基到货后,微生物室检验员应进行验收。验收内容包括核对品名、数量、规格、生产厂商,应与申购单一致;检查培养基包装有无破损、包装是否完整、产品是否在有效期内。 验收合格后,登记于《培养基领用台账》(附记录文件编号:SMP-10-QC-009-02(00))。 3 培养基的贮藏 未开封的脱水培养基贮存于阴凉室,使培养基处于低温、干燥、和避光条件下。已开封的脱水培养基应盖紧,贮存于阴凉库。 灭菌好的培养基应进行预培养72h检查无菌后,置4~8℃冷藏保存待用。灭菌后培养基储存期为7天。 4 培养基的配制 培养基的配制和使用应填写《培养基配制及使用记录》(附记录文件编号:SMP-10-QC-009-02(00))。 培养基配制批号原则:原材料批号-配制日期:比如2011年1月1日配制的培养基,培养基干粉批号000000,配制批号为:000000-110101。配制好的培养基贴《培养基标签》(附记录文件编号:R-SMP-10-QC-009-03)。(注:同一天同一培养基配置多次的,在原批号后加“-”加“数字”表示,如000000-110101-01)培养基配制方法 使用商品化脱水合成培养基时,应严格按照厂商提供的使用说明配制,如重量/体积、pH、灭菌条件和操作步骤等。实验室使用各种基础成分制备培养基时,应按照配方准确配制,并记录相关信息如:培养基名称和类型及试剂级别,每
培养基配制及适用性检查标准操作规程
目得: 建立培养基配制及适用性检查得标准操作规程,规范实验人员得操作流程。 范围: 适用于微生物检验人员对培养基得规范管理。 依据: 《药品生产质量管理规范(2010年修订)》、《中华人民共与国药典》2015年版?第四部 职责: 1、微生物检验员:负责实验室所需求得培养基管理工作,使日常检验可以顺利进行。 2、微生物检验主管:负责对日常配制培养基得规范操作进行监督。 内容 1培养基得申购 根据检验项目、工作量与工作进度得需求,提前一个月进行所需得培养基申购。申购时需指定培养基供应商,必要时进行供应商审计。 2 培养基得验收 2、1 培养基到货后,微生物室检验员应进行验收。验收内容包括核对品名、数量、规格、生产厂商,应与申购单一致;检查培养基包装有无破损、包装就就是否完整、产品就就是否在有效期内。 2、2 验收合格后,登记于《培养基领用台账》(附记录文件编号:SMP-10-QC-0
09-02(00))。 3培养基得贮藏 3、1未开封得脱水培养基贮存于阴凉室,使培养基处于低温、干燥、与避光条件下。已开封得脱水培养基应盖紧,贮存于阴凉库。 3、2灭菌好得培养基应进行预培养72h检查无菌后,置4~8℃冷藏保存待用。灭菌后培养基储存期为7天。 4培养基得配制 4、1培养基得配制与使用应填写《培养基配制及使用记录》(附记录文件编号:SMP-10-QC-009-02(00))。 4、2培养基配制批号原则:原材料批号-配制日期:比如2011年1月1日配制得培养基,培养基干粉批号000000,配制批号为:000000-110101。配制好得培养基贴《培养基标签》(附记录文件编号:R-SMP-10-QC-009-03)。(注:同一天同一培养基配置多次得,在原批号后加“-”加“数字”表示,如000000-110101-01) 4、3培养基配制方法 4、3、1 使用商品化脱水合成培养基时,应严格按照厂商提供得使用说明配制,如重量/体积、pH、灭菌条件与操作步骤等。实验室使用各种基础成分制备培养基时,应按照配方准确配制,并记录相关信息如:培养基名称与类型及试剂级别,每个成分物质含量、制造商、批号,pH值,培养基体积/分装体积,灭菌条件(灭菌方式、温度及时间),配制日期、人员等,以便溯源。 4、3、2 水、容器具要求:培养基配制均采用纯化水,特殊说明时采用去离子水与蒸馏水。培养基配制所用容器与配套器具应洁净。对热敏感得培养基如糖发酵培养基其分装容器应先进行预灭菌,以保证培养基得无菌性。 4、3、3 称量与分装: 快速称量所需量得脱水合成培养基(必要时佩戴口罩或在通风柜中操作,以防吸入含有有毒物质得培养基粉末)。以免吸潮。先加入适量得水,充分混合。注意避免培养基结块,然后加水至所需得量。根据说明书要求选择就就是否加热。分装体积不超过容器体积得2/3。配制斜面等含琼脂得培养基也需加热煮沸至完全溶解后分装。 4、4 pH 值得测定与调整 pH值采用pH计进行检测,温度25±2℃。取配后培养基10ml进行灭前pH测定。另取20ml于50ml三角瓶与同批配制培养基同时灭菌冷却至25±2℃检测灭后PH。灭菌前后pH应按下表进行控制。灭菌前可使用浓度约为40g/L(约1mol/L)得氢氧化
培养基适用性验证方案
培养基适用性验证方案
培养基适用性验证第 2 页共 9 页 培养基适用性 验证 方案起草人:日期:年月日方案审核人:日期:年月日方案批准人:日期:年月日
目录 1. 验证目的 (3) 2. 参照标准 (3) 3. 验证项目 (3) 4. 验证小组人员及职责……………………………………………………………3-4 5. 验证可接受的标准 (4) 6. 验证材料…………………………………………………………………………4-5 7. 菌液制备 (5) 8. 适用性检查………………………………………………………………………5-6 9. 控制菌检查 (7)
1. 验证目的: 需氧菌、霉菌及酵母菌计数用的培养基及控制菌培养基应进行培养基的适用性检查。本次验证的目的是确认胰酪大豆胨琼脂培养基和沙氏葡萄糖琼脂培养基、麦康凯液体培养基和麦康凯琼脂培养基适合需氧菌、霉菌及酵母菌、大肠埃希菌的测定和控制菌适用性检查。 2. 参照标准:2015版中国药典微生物限度检查法。 3. 验证项目:胰酪大豆胨琼脂培养基和沙氏葡萄糖琼脂培养基、麦康凯液体培养基和麦康凯琼脂培养基的适用性检查 4.验证小组人员及职责: 4.1验证小组人员: 小组人员职务姓名所在部门职务 组长刘秀质量管理部经理 组员郝枝桃质量管理部QC主任 组员王和霞质量管理部检验员 组员兰丹质量管理部检验员 4.2验证人员职责及要求 4.2.1按验证方案及相关文件实施验证。 4.2.2认真观察并做好验证原始记录。
4.2.3对实施验证的结果负责。 4.3验证中各部门的职责 4.3.1验证领导组职责 4.3.1.1制订验证总计划,负责全公司验证工作的管理。 4.3.1.2确定验证项目及验证项目负责人。 4.3.1.3负责验证方案的批准工作。 4.3.1.4负责验证资料及结果的审核工作。 4.3.1.5负责验证报告的批准工作。 4.3.2验证工作小组职责 4.3.2.1负责验证方案的起草工作。 4.3.2.2参与验证方案的讨论、确认工作。 4.3.2.3负责验证方案的实施。 4.3.2.4负责验证结果的分析、统计、报告工作。 4.3.2.5参与验证结果的评价工作。 4.3.3质量部职责 4.3.3.1负责验证方案的审核工作。 4.3.3.2负责验证过程中仪器、仪表、计量器具的校验工作。 4.3.3.3负责验证中各项检测工作,提供验证的检验记录、检验报告,对验证过程中的各项检验工作负责。 4.3.3.4负责验证资料和报告的审核工作。 4.3.3.5负责验证文件回收、归档管理工作。 5. 合格标准:被检培养基上的菌落平均数不小于对照培养基上的菌落平均数的70%,且菌落形态大小与对照培养基上的菌落一致。 6. 试验材料: 6.1. 被验证培养基:沙氏葡萄糖琼脂培养基、麦康凯琼脂培养基、胰酪大豆胨琼脂培养基、麦康凯液体培养基 6.2. 仪器设备: 6.2.1.YX280B手提式不锈钢蒸锅
