不饱和醛酮选择性加氢汇编

不饱和醛酮选择性加氢
第一部分背景介绍
不饱和醇应用于大量的工业生产中,药物合成、香料、聚合物、除草剂等。目前一种合成不饱和醇的方法是将不饱和醛酮进行催化加氢。但是由于C=C键比C=O键在加氢过程中在热力学中更加有利。所以研发新型催化剂对不饱和醛酮选择性加氢十分重要。
这里,介绍了五种新型催化剂催化不同的不饱和醛酮加氢,希望为今后的研究提供新的基础。
第二部分文献综述
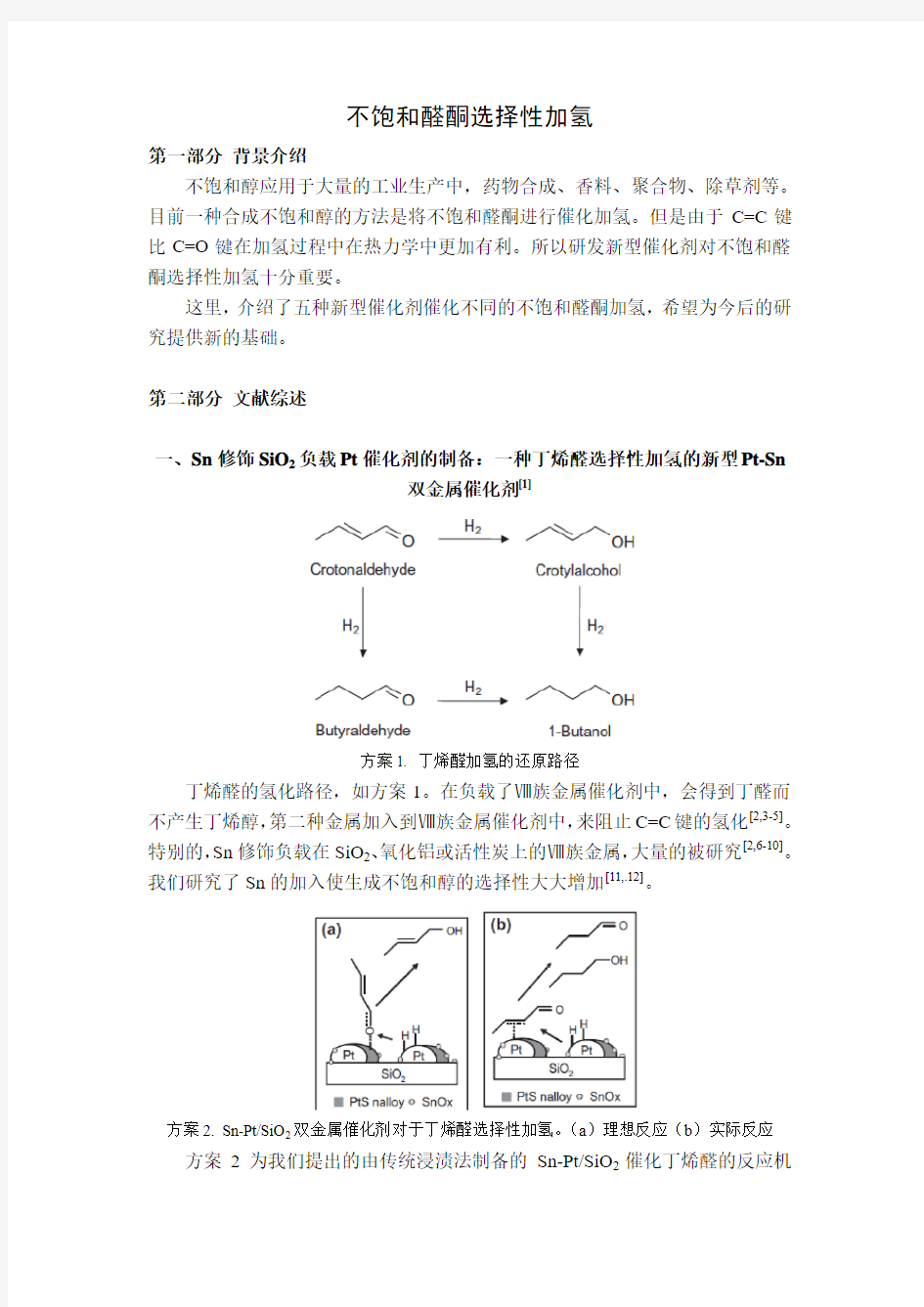
一、Sn修饰SiO2负载Pt催化剂的制备:一种丁烯醛选择性加氢的新型Pt-Sn
双金属催化剂[1]
方案1. 丁烯醛加氢的还原路径
丁烯醛的氢化路径,如方案1。在负载了Ⅷ族金属催化剂中,会得到丁醛而不产生丁烯醇,第二种金属加入到Ⅷ族金属催化剂中,来阻止C=C键的氢化[2,3-5]。特别的,Sn修饰负载在SiO2、氧化铝或活性炭上的Ⅷ族金属,大量的被研究[2,6-10]。我们研究了Sn的加入使生成不饱和醇的选择性大大增加[11,.12]。
方案2. Sn-Pt/SiO2双金属催化剂对于丁烯醛选择性加氢。(a)理想反应(b)实际反应方案2为我们提出的由传统浸渍法制备的Sn-Pt/SiO2催化丁烯醛的反应机
理。Sn n+例如SnO和SnO2提高了对C=O的活性,然而SnPt合金的形成或通过金属Sn进行Pt表面原子的稀释,会抑制C=C的氢化[13]。对于理想状态(方案2a),不饱和醛通过C=O基团的O原子,吸附在SnO x(例如SnO或SnO2)上。然后,活化的C=O基团被通过Pt表面活化的H攻击形成不饱和醇。由于C=C键会与Pt相互作用,所以C=C键的氢化不可避免。然而,如果Pt区域完全被Sn 覆盖,由于H分子不能被活化,则氢化反应不会发生。
为了不在活性明显下降的情况下,进一步提高对不饱和醇的选择性,需要两个条件。一个不饱和醛的是C=C键不直接与Pt表面接触,来抑制C=C氢化。另一个是H分子在Pt表面上被活化。有两个策略来避免Pt区域和不饱和醛的直接接触。一个是形成足够均匀的SnPt合金。正如之前提到的,金属Sn形成SnPt 可以抑制C=C键和Pt的相互作用。因此,为了制备足够均匀的SnPt合金,C=C 键的氢化被抑制。另一个是通过SnO2层来避免Pt和C=C键的相互作用,活化C=O基团的SnO x存在在Pt金属附近,尽管SnO x通过SiO2层与Pt完全分离。
根据前面的方案,我们尝试制备SiO2包裹在SnPt内部的纳米粒子[14]。这种纳米粒子(摩尔比Sn/Pt=1.0)用多元醇工艺来制备。在这种方法,形成均一的SnPt合金纳米粒子。这些催化剂具有高选择性(66.7%,转化率为41.1%),由于SnPt合金中心和反应物方向的控制的协同效应。
方案3. Sn/SP催化丁烯醛加氢
对于后者策略,这种催化剂是Pt纳米粒子覆盖到多孔的SiO2层,Sn在SiO2层的外表面。目前,包裹在SiO2壳内部的金属或金属氧化物纳米粒子,在很多领域进行了研究[15-23]。很多研究报道了Ni[16,17],Pt[18,19],FePt[20]和Rh[21-23]纳米粒子包裹到介孔SiO2壳中。报道了SP催化剂通过金属醇盐在反相胶束溶液中水解作用来合成,SiO2层是微孔和介孔。把Sn加入到SP催化剂中,控制孔的尺寸使H2可以进入Pt孔,然而不饱和醛不能进入Pt孔,我们提出了新的概念如方案3。由于不饱和醛不能进入Pt纳米粒子孔,C=C键的氢化被抑制,在SiO2外表面Sn位点的C=O键被活化。由中心Pt粒子活化的溢流氢通过Sn的吸附攻
击C=O键形成不饱和醇。
目前,SiO2负载Pt催化剂用微乳液制备,SP催化剂用浸渍法和Sn制备Sn 修饰SiO2负载Pt(Sn/SP)催化剂。为了证实Pt和Sn的分离,SP和Sn/SP催化剂的形态和物理性能通过TEM,EXAFS,H2和CO的化学吸附。Sn/SP的氢化丁烯醛的性能与传统的催化剂作对比。除此之外,我们提出了新的概念在Sn/SP 催化剂上选择性加氢。
2.实验
2.1.催化剂的制备
2.1.1 SiO2负载Pt(SP)
SiO2负载Pt纳米粒子根据文献用油包水微乳液制备[19]。为了形成微乳液,十六烷基聚乙二醇(15),一种非离子型表面活性剂,环己烷作为溶剂。表面活性剂在溶剂中的浓度是0.5mol/L。H2PtCl6的水溶液在323K注射入溶液中。为了稳定Pt纳米粒子,包含CTABr和1-己醇的溶液加入到微乳液中,CTABr在1-己醇中的浓度是0.3mol/L。TEOS(0.86mol/L),作为SiO2的来源加入到微乳液中,然后加入稀释的氨水溶液(28%)。TEOS的水解反应在323K下进行1h。为了终止水解作用,通过加入2-丙醇来破坏SiO2覆盖Pt纳米粒子溶液的胶束结构。溶液离心来与沉淀分离,然后得到的沉淀用2-丙醇完全洗涤,在353K下过夜干燥,在623-823K的空气流中煅烧2h来移除表面活性剂。在空气中煅烧后,样品浸入王水溶液24h来移除未覆盖在SiO2上的Pt纳米粒子。最后,样品在393K 下干燥过夜,在相同的温度下煅烧2h,在573K的H2流下还原2h。通过XRF 分析,Pt的负载量约4%。
2.1.2 Sn修饰SiO2负载Pt(Sn/SP)
Sn修饰SiO2负载Pt催化剂通过浸渍法SP和SnCl2?2H2O的乙醇溶液来制备,用王水处理并干燥。Sn/Pt的摩尔比一致。浸渍后,样品在393K下干燥过夜并在相同的温度下在空气流中煅烧2h,来除去表面活性剂。最后,在573-773K的H2气流下还原2h得到样品。
2.1.3 负载型Pt或Sn单金属催化剂
这里使用的SiO2载体在制备催化剂之前在773K空气下煅烧5h。Pt/SiO2和Sn/SiO2通过将SiO2载体和H2PtCl6的水溶液或SnCl2?2H2O(15mL)的乙醇溶液来制备。Pt和Sn在载体上的负载量是4wt%和2.5-5.1wt%。然后,样品在393K 下干燥过夜,在823K的空气流中煅烧2h。然后,Pt/SiO2在573K的H2下还原2h。在Sn/SiO2情况下,为了XRD测试,样品在573-773K下还原2h。
2.1.4 负载Sn/Pt双金属催化剂
负载Sn/Pt双金属催化剂继续用浸渍法来制备。煅烧后的Pt/SiO2,在SnCl2?2H2O的乙醇溶液中浸渍,393K下干燥过夜,在823K的空气中煅烧2h,
573K的H2下还原2h。Sn/Pt的摩尔比为1.0-1.5。
3. 结果与讨论
3.1 SP和Sn/SP催化剂的形态和物理性能
图1. (a)SP (b)Sn/SP催化剂XRD图。823K空气焙烧并且573K氢气还原图1为SP和Sn/SP催化剂的XRD图,823K空气下煅烧、573K氢气下还原。在两个催化剂中,观察到2θ=39°和47°有明显的衍射线,分别表示Pt(111)和(200)的衍射峰[24]。证实了SP和Sn/SP催化剂上的Pt的存在。对于Sn/SP 催化剂,出现了27°、34°和52°的2θ峰,是SnO2的存在[25]。
图2. (a)SP和(b)Sn/SP催化剂TEM图。823K空气焙烧并且573K氢气还原图2为SP和Sn/SP的催化剂的TEM图,823K空气下煅烧、573K氢气下还原。在SP中(图2a),发现Pt粒子负载在球形SiO2粒子的中心,Pt和SiO2粒子的尺寸均一。Pt在SP催化剂的负载量通过XRF测试为3.9wt%。Pt粒子和整个SiO2负载Pt的尺寸约为5nm和50nm。SiO2层厚度为20-25nm。在Sn/SP 中(图2b),Sn氧化物粒子继续通过浸渍出现在SiO2的外表面。此外,在Sn/SP 中,没有观察到SP催化剂的核壳结构的坍塌。表明了核壳结构在Sn的浸渍过程中稳定存在。
图3. k3-加权Sn K-吸收边EXAFS傅里叶变换图。
(a)SnO2,(b)Sn/SiO2,(c)Sn/SP,(d)Sn/Pt/SiO2(Sn/Pt=1.5)
EXAFS数据如图3。SnO2作为参考,1.6?的峰是氧原子(Sn-O)配位层位于距离Sn2.06 ?。2.9和3.5?的峰分别是位于距离3.18?和3.72?的第一和第二近的Sn的贡献[26,27]。
对于Sn/Pt/SiO2催化剂,图3d中观察到2.5?的峰。这在SnO2和Sn/SiO2中未观察到。此外,由于次最近Sn(Sn-O-Sn)的贡献3.5?的峰没有在Sn/Pt/SiO2(Sn/Pt=1.5)中观察到。因此,2.5?的峰是与Pt配位的Sn原子。在Sn-Pt双金属催化剂中,例如,Sn/Pt/SiO2通过继续浸渍法制备,Sn前躯体可以容易的吸附在Pt表面,并发生Sn和Pt的相互作用,形成SnPt合金[28,29]。此外,Sn-Pt距离为2.72?符合文献的报道(2.5-2.8?)[30,31]。因此,Sn-Pt这个峰存在与SnPt合金中。
Sn/SP在823K煅烧和在573K氢气还原,显示了与SnO2和Sn/SiO2相同的结构函数,如图3c。在这种情况下,没有观察到Sn-Pt在2.5?处的峰,表明Sn 和Pt没有相互作用。这一结果表明了Sn和Pt在一个催化剂粒子上达到完全分离。
表1. Sn K-吸收边EXAFS振荡曲线分析数据
为了评价Sn在每个样品的结构参数,进行了EXAFS振荡拟合曲线,具体参数如表1。在Sn/SiO2和Sn/SP中,Sn-O和Sn-Sn的配位数和原子间距离与标
准样品SnO2基本一致。结果也表明了Sn元素作为SnO2存在于Sn/SiO2和Sn/SP 催化剂中。对于Sn/Pt/SiO2催化剂,配位数比SnO2小。这一结果表明一部分Sn 与Pt之间无相互作用,它们在Sn/Pt/SiO2中形成SnO2小颗粒。
图4. H2和CO在SP和Sn/SP的化学吸附能力
H2和CO在SP和Sn/SP的化学吸附能力如图4。H2和CO的不可逆吸附可以在所有情况下观察到。在这些催化剂中,H2和CO的化学吸附只发生在Pt上,这一结果证明了H2和CO通过带孔的SiO2层到达Pt纳米粒子。
在SP催化剂中,H2化学吸附的数量在任何煅烧温度下均保持一致。另一方面,CO的化学吸附具有不同的倾向。CO化学吸附的数量随着煅烧温度直到823K 增加而减小,CO在823K几乎不在SP吸附。这可能是因为CO与Pt中心的相互作用通过SiO2层来阻止。这些结果表明了,由于不饱和醛比CO分子大很多,SiO2层阻止不饱和醛与Pt的相互作用。
823K时的H2和CO对于SP和Sn/SP吸附作用几乎没有观察到不同。在Sn-Rh 和Sn-Pt[32,33]双金属催化剂中,相对于CO,H2不可逆的化学吸附量随着Sn负载量的增加而大大减少。CO吸附量随着Sn增加缓慢降低,但未降低到零。这一结果归因于H2分子需要至少与Rh相邻的两个分子来吸附解离。因此,H2分子的解离吸附随着Sn的增加而强烈被抑制。在Sn/SP催化剂中,如果Sn前体到达中心Pt纳米粒子,Pt吸附H2解离就会减少,因此H2的吸附量相对于CO来说大大降低。然而在Sn/SP中,没有观察到H2吸附量的减少。这一结果表明Sn前体浸渍SP没有到达中心Pt纳米粒子,Sn和Pt没有相互作用的发生。
3.2 中心Pt的氢溢流到达SiO2外表面的Sn氧化物
图5 Sn/SiO2和Sn/SP在823K煅烧后和不同温度下H2还原的XRD图图5为Sn/SiO2和Sn/SP在823K煅烧后和不同温度下H2还原的XRD图。2θ为30°、32°、44°和45°的峰是Sn金属。
在Sn/SiO2催化剂中,SnO2的峰完全消失而Sn的峰出现在773K的还原温度下。相对来说,Sn/SP中Sn元素在673K下从SnO2还原到Sn。在Sn/SP中,SnO2完全还原为Sn的还原温度下降,是由于中心Pt粒子形成的氢溢流。因此,这表明氢溢流在氢化反应时通过SiO2层的孔,可以达到SiO2外表面的SnO2。3.3 丁烯醛的选择性氢化
表2. 每种催化剂对于丁烯醛选择性加氢
表2表示所有催化剂对于丁烯醛的氢化情况。用于此反应的催化剂在823K 空气下煅烧,573K氢气下还原,由XRD和EXAFS,Sn元素作为SnO2出现在Sn/SiO2和Sn/SP催化剂中。在传统的Pt/SiO2催化剂中,丁醛是主要产物,生成丁烯醇的选择性为2.4%。在加入Sn后,选择性增加到10.0%。表明了Sn 的加入可以活化C=O基团。对于Sn/SiO2,由于缺乏氢的活化位点,反应不发生。
在核壳催化剂中,SP和Sn/SP催化剂,相比于负载单金属和双金属催化剂,丁烯醛的转化率降低。SP催化剂823K煅烧和573K还原,丁烯醛几乎不发生氢化,丁醛和1-丁醇少量产生。
在Sn/SP中,得到了对于丁烯醇的高选择性(100%)和4.1%的产率。基于TEM、EXAFS、H2和CO化学吸附结果,SnO2负载在了SP粒子的外表面,中心Pt纳米粒子和SnO2无相互作用。从化学吸附结果来看,证实了SP催化剂的SiO2层的多孔结构并且表明了丁烯醛比CO分子大而不能到达SiO2层的孔中。此外,由H2的化学吸附量表明,氢气活性位点在Pt/SiO2和Sn/SP催化剂中几乎相同。然而,氢化率大大的提高。这一结果表明了C=C键被抑制,不是由于Sn
醛和酮 亲核加成反应附加答案
醛和酮 亲核加成反应 一、基本要求 1.掌握醛酮的命名、结构、性质;醛酮的鉴别反应;不饱和醛酮的性质 2.熟悉亲核加成反应历程及其反应活性规律;醛酮的制备 二、知识要点 (一)醛酮的分类和命名 (二)醛酮的结构: 醛酮的官能团是羰基,所以要了解醛酮必须先了解羰基的结构。 C=O 双键中氧原子的电负性比碳原子大,所以π电子云的分布偏向氧原子,故羰基是极化的,氧原子上带部分负电荷,碳原子上带部分正电荷。 (三)醛酮的化学性质 醛酮中的羰基由于π键的极化,使得氧原子上带部分负电荷,碳原子上带部分正电荷。氧原子可以形成比较稳定的氧负离子,它较带正电荷的碳原子要稳定得多,因此反应中心是羰基中带正电荷的碳。所以羰基易与亲核试剂进行加成反应(亲核加成反应)。 此外,受羰基的影响,与羰基直接相连的α-碳原子上的氢原子(α-H )较活泼,能发生一系列反应。 亲核加成反应和α-H 的反应是醛、酮的两类主要化学性质。 1.羰基上的亲核加成反应 醛,酮亲核加成反应的影响因素:羰基碳上正电性的多少有关,羰基碳上所连的烃基结构有关,亲核试剂的亲核性大小有关。 (1)与含碳的亲核试剂的加成 ○ 1氰氢酸: ○2 炔化物 C O C O H C H O 121.8116.5。。sp 2 杂化键 键近平面三角形结构πσC C R O H H ( )δδ 酸和亲电试剂进攻富电子的氧碱和亲核试剂进攻缺电子的碳 涉及醛的反应 氧化反应( ) αH 的反应羟醛缩合反应卤代反应C O C OH + HCN CN 羟基睛 α
○3 有机金属化合物: (2)与含氮的亲核试剂的加成 ○ 11o 胺 ○ 2 2o 胺 ○ 3氨的多种衍生物: (3)与含硫的亲核试剂的加成-------亚硫酸氢钠 产物α-羟基磺酸盐为白色结晶,不溶于饱和的亚硫酸氢钠溶液中,容易分离出来;与酸或碱共热,又可得原来的醛、酮。故此反应可用以提纯醛、酮。 反应范围: 醛、甲基酮、八元环以下的脂环酮。 反应的应用:鉴别化合物,分离和提纯醛、酮。 (4)与含氧的亲核试剂的加成 ○1水 ○ 2醇 醛较易形成缩醛,酮在一般条件下形成缩酮较困难,用12二醇或13-二醇则易生成缩酮。有机合成中用来保护羰基。 2.α-H 的反应(羟醛缩合、交叉缩合、卤仿反应) 醛、酮分子中由于羰基的影响,α-H 变得活泼,具有酸性,所以带有α-H 的醛、酮具有如下的性质: (1)羟醛缩合 有α-H 的醛在稀碱(10%NaOH )溶液中能和另一分子醛相互作用,生成β-羟基醛 ,故称为羟醛缩合反应。 (2)交叉缩合 C O δδ+ R MgX δδC OMgX R H 2O R C OH +HOMgX 无水乙醚C O NaO-S-OH C OH SO 3Na C ONa SO 3H +O 醇钠 强酸强酸盐 白( )R C H ( R' )R C OH H O ( R' ) O +R'' R''OH R C O H O ( R' ) R''OH R''R'' HCl HCl 无水干+H 2O 半缩醛 酮不稳定 一般不能分离出来缩醛 酮 ,双醚结构。 对碱、氧化剂、还原剂稳定,可分离出来。酸性条件下易水解 ( ) ( )NH 2-OH NH 2-NH 2NH 2-NH NH 2-NH-C-NH 2O NH 2-NH O 2N NO 2羟氨 肼苯肼二硝基苯肼氨基脲2,4
高二化学 常见的醛酮羰基的加成反应 练习
《常见的醛酮羰基的加成反应》习题 一、选择题(每个选项只有一个正确选项) 1.下列关于醛的说法中正确的是() A.甲醛是甲基跟醛基相连而构成的醛 B.醛的官能团是—COH C.甲醛和丙醛互为同系物 D.饱和一元脂肪醛的分子组成符合通式C n H2n+2O 2.橙花醛是一种香料,其结构简式如下:(CH3)2C===CHCH2CH2C(CH3)===CHCHO。下列说法正确的是() A.橙花醛不可以与溴发生加成反应 B.橙花醛可以发生氧化反应和还原反应 C.1 mol橙花醛最多可以与2 mol氢气发生加成反应 D.橙花醛是乙烯的同系物 3. 扑热息痛是一种优良的解热镇痛剂,结构简式为,它不可能具有的化学性质是() A.能与烧碱溶液反应 B.能与溴水发生加成反应 C.能被氢气还原 D.遇FeCl3溶液呈现紫色 4. 不能由醛加氢还原制得的醇是() A.HOCH2CH2OH B. C. D. 5.已知某有机物的分子式为C8H8O,其中含有一个苯环、一个羰基。则该有机物可能的结构有() A.2种 B.3种 C.4种 D.5种
6.β-紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1。 下列说法正确的是() A.β-紫罗兰酮可使酸性KMnO4溶液退色 B.1 mol中间体X最多能与2 mol H2发生加成反应 C.维生素A1易溶于NaOH溶液 D.β-紫罗兰酮与中间体X互为同分异构体 二、选择题(每个小题有1~2个正确选项) 7. 科学家研制出多种新型杀虫剂代替DDT,化合物A是其中的一种,其结构如图。下列关于A的说法正确的是() A.化合物A的分子式为C15H22O3 B.与FeCl3溶液发生反应后溶液显紫色 C.1 mol A可以与1 mol NaOH反应 D.1 mol A最多与1 mol H2加成 8. 丙烯醛的结构简式为CH2===CHCHO,下列有关其性质的叙述中错误的是() A.能使溴水退色,也能使酸性高锰酸钾溶液退色 B.在一定条件下与H2充分反应生成2-丙醇 C. 在一定条件下能发生加聚反应 D. 与HCN反应后的产物中有两种官能团
(完整word版)醛和酮
第十一章醛和酮 课时:8课时 教学目的要求:掌握醛酮与亲核试剂的加成反应及其历程,醛酮的氧化-还原反应,各类醛酮的鉴别,醛酮制法,α,β-不饱和醛酮的性质。 含羰基。 第一节醛、酮的分类,同分异构和命名 一、分类 烃基的类别:脂肪族醛、酮;芳香族醛、酮。 羰基的数目:一元醛、酮;二元醛、酮。 二、同分异构现象 醛:碳链异构。 酮:碳链异构和羰基位置异构。 三、命名 1 系统命名法 选择含羰基的最长链。 编号从靠近羰基的一端开始。 CH3CHCHO CH3C6H5CHCHO CH3 HC CCH2CH2CHCH2CHO CH3 2-甲丙醛2-苯丙醛3-甲基-6-庚炔醛 CH3CO(CH2)3CH3 COCH3COCH2CH3 2-己酮1-苯-1-乙酮1-环己基-1-丙酮 碳原子的位置有时也用希腊字母表示: 2酮的取代基命名法 CH3CCH2CH3 O COCH3 甲基乙基酮甲基苯基酮 CHO OH CHO CHO 3-羟基苯甲醛1,2-萘二甲醛 111
CHO 2COOH CHO O 4-甲酰苯基乙酸2,3-环氧苯甲醛 COCH2CH2CH3CH 2COCH3 1-( -萘基)-1-丁酮1-苯基-2-丙酮 萘基丙基酮苄基甲基酮 第二节醛、酮的结构、物理性质和光谱性质 一、醛和酮的结构 羰基碳原子sp2杂化。氧原子上带部分负电荷,碳原子上带部分正电荷。羰基是极化的,分子有偶极矩。 二、物理性质 沸点比相应的烷烃和醚高(极化度大),低于相应的醇(不能形成分子间氢键)。低级的醛、酮可溶于水(与水形成氢键),中级醛(九到十个碳)具果香味液体,用于香料工业,低级酮是液体,具有令人愉快的气味。 三、光谱性质 红外光谱:碳氧双键的伸缩振动,醛在1730cm-1, 酮在1715cm-1, 形成共轭体系时,吸收的波数减小。醛在2750cm-1处有醛氢与羰基碳之间的碳氢伸缩振动峰。 核磁共振谱:醛氢的化学位移为9-10, 与羰基相连的甲基或亚甲基的化学位移在2-2.5, 紫外光谱:非共轭醛、酮在200 nm以上无强烈吸收,共轭的醛、酮则有强烈吸收。 乙醛和苯乙酮的IR图见P316图11-2,NMR图见P317图11-3 问题:用光谱法区别下列各组化合物: (1)CH3CHO, CH3COCH2CH3 (2)CH3CH2CH2COCH3, CH3CH2CH=CHCOCH3 112
选修五 2.3.1 常见的醛、酮(附解析)
第3节 醛和酮 糖类 第1课时 常见的醛、酮 [学习目标定位] 1.熟知醛、酮的分子结构特点,会写简单醛、酮的结构简式。2.知道醛、酮的分类、命名及常见醛、酮的物理性质。 1.写出下列有机物具有的官能团的名称 答案 醛基、羰基、羟基、羧基、碳碳双键 2.写出下列反应的化学方程式 (1)乙醇与浓硫酸共热170 ℃:_________________。 答案 CH 3CH 2OH ――→浓H 2SO 4 170 ℃ CH 2===CH 2↑+H 2O (2)乙醇催化氧化:____________________________。 答案 2CH 3CH 2OH +O 2――→催化剂 △2CH 3CHO +2H 2O (3)乙二醇催化氧化:___________________。 答案 探究点一 醛、酮的结构 1.分子式为C 3H 8O 的有机物,有两种醇类同分异构体,写出它们的结构简式。 (1)写出上述两种醇发生催化氧化反应的化学方程式。 答案 ①2CH 3CH 2CH 2OH +O 2――→△ 催化剂 2CH 3CH 2CHO +2H 2O (2)上述两反应中有机产物分子结构上的相同点是什么?它们有什么共同的性质?
答案都含有碳氧双键,因此它们都能与H2发生加成反应生成醇。 (3)上述两反应中有机产物分子结构上的不同点是什么? 答案产物为醛类,分子中与羰基相连的分别是烃基和氢原子; 产物为酮类,分子中与羰基相连的为两个烃基。 (4)两种有机产物的关系是互为同分异构体。 2.相同碳原子数的醛和酮(碳原子数大于3),因官能团类型不同,互为同分异构体,同时还存在官能团位置异构及碳链异构等同分异构现象。试写出分子式为C5H10O的有机物的同分异构体(只写属于醛类或酮类的)。 (1)属于醛类的: (3)结合醇的系统命名知识对上述醛、酮进行命名。 醛:①戊醛__②3-甲基丁醛__③2-甲基丁醛__④2,2-二甲基丙醛。 酮:①2-戊酮__②3-甲基-2-丁酮__③3-戊酮。 [归纳总结] (1)醛、酮在自然界中存在广泛。醛和酮具有相同的官能团羰基,区别是醛中羰基上连有氢原子,所以醛的官能团为醛基,结构简式写为—CHO而不能写成—COH。相同碳原子数的醛和酮互为同分异构体。 (2)醛、酮命名与醇的命名类似,选主链应选含官能团的最长碳链作主链,编号也是从距官能团最近端开始编号,除写出取代基外,也应写出官能团的位置。 [活学活用] 1.下列说法正确的是() A.醛和酮都含有相同的官能团羰基,因此它们性质相同
醛酮化学性质教案
醛酮化学性质教案 【课堂引入】 装修引起的室内污染已经越来越受到人们的重视,其中的一种重要的污染源就是——(学生回答:甲醛);这两幅图片是形像逼真的生物标本,同学们知道它们是浸泡在什么中吗,(学生回答:福尔马林溶液)福尔马林溶液就是——甲醛的水溶液。同学们想知道为什么甲醛具有这样的性质吗,(学生回答:)本节课我们就共同来探讨“醛酮的化学性质”,学习完“醛酮的化学性质”,你就会了解甲醛为什么具有这样的性质。 (板书:二、醛酮的化学性质) 【师】:首先,我们来完成导学案上的“复习回顾”,给同学们1—2分钟的时间,小组内交流你的答案,整理出正确答案。(实物展台:展示2个小组的4题的答案,让其他组的同学找错)。【复习回顾】中的四道题 1、研究有机物化学性质的一般程序是什么, 2、有哪些类别的物质能发生加成反应, 3、醛和酮的结构中含有什么官能团,官能团中的碳原子是否饱和, 4、试着注明以下物质的带“—”C原子的氧化数。 CHCHOH CHCHO CHCOOH 3233 【师】:评价:同学们的掌握情况不错。 【过渡】:下面我们就开始学习“醛酮的化学性质”。 【师】:小组讨论:
要求:每个小组讨论出方案,并作出记录,然后班内交流。 (我的想法:让学生能讨论出两点:?因为存在C=O,所以醛酮能发生加成反应。?因为羰基中C原子的氧化数分别为+1和+2,所以可以发生氧化反应和还原反应) 【师】:总结并展示课件 【师】我们首先来学习第一种反应类型:加成反应。加成反应的原理,我们在第一节已经学习了,下面请同学们用2-3分钟时间把导学案上关于“乙醛和丙酮与一些极性试剂发生加成反应的方程式”交流讨论,并整理出正确答案。 (实物展台:展示2个小组答案,让其他组的同学找错)。 【师】总结,并展示大屏幕:醛酮加成反应的规律动画。 【师】:思考:醛酮与氢气的加成反应还可以归为那种反应类型, (学生回答:还原反应,加氢的反应就是还原反应) 【师】甲醛为什么有毒,实际上就是和蛋白质发生了加成反应,并进一步转化,从而使蛋白质失去了活性,甲醛能防腐也是基于这个原因,有兴趣的同学请课后阅读课本P72页的“身边的化学”。【师】:下面我们接着看醛酮的氧化反应。醛和酮都能发生氧化反应。请同学们思考:醛和酮都能被哪些氧化剂给氧化呢?(学生回答:氧气、酸性高锰酸钾溶液、新制的氢氧化铜悬浊液等。引导学生:我们在第一节氧化反应部分学到常见的氧化剂有哪些,)
醛,酮结构对羰基亲核加成反应活性的影响
大学化学 第15卷 第2期2000年4月 醛、酮结构对羰基亲核加成反应活性的影响 许 申 鸿 (青岛大学化学系 山东266071) 醛、酮分子中都含有活泼的羰基,亲核加成是醛酮最重要、最典型的反应之一。其反应历程为: 式中R为H或烃基,Nu为亲核试剂。这两种历程,决定反应速率的关键步骤均为Nu对羰基的进攻[1~3]。因此,羰基化合物的结构以及Nu的性质对加成反应进行的难易程度均有影响。但在相同的条件下,同一亲核试剂对不同羰基化合物的加成反应,影响反应活性的因素就只有羰基化合物的结构了。国内有机化学教科书[3~7]一般都是从两方面论述羰基反应活性的:①电子因素:当羰基碳上连有给电性基团(如烷基、芳基等)时,由于中心碳原子的电正性减小,从而降低了它的亲电能力,使反应活性下降。另一方面,给电作用还强化了过渡态中氧上发展出来的负电荷,使过渡态能量增加而不利于反应的进行。相反的,当羰基碳上连有吸电基团(如F3C—等)时,则会使反应速度加快。②空间因素:由于从反应物到过渡态及产物,羰基碳由sp2杂化变为sp3杂化,反应中存在着明显的空间特性。在反应过程中,R基会被越来越近地挤在一起,非键张力使过渡态内能增加,不利于反应的进行。故当R基的体积增大时,反应速率迅速下降。当然,Nu体积增大,同样也会降低反应速率。综合上述两方面的影响,可以得出一般醛、酮亲核加成反应的活性次序: 以上论述,对于一般脂肪醛酮的亲核加成反应活性的比较是足够的。例如根据上述讨论,很容易给出下列各组醛酮的亲核加成反应活性:①CF3CH2CH O>CH3CH2CH O>CH3C OCH2CH3 >CH3CH2C OCH2CH3;②ArCH2C OR>ArC OR>Ar2C O。 可是对于环酮来说,前面的讨论就显得有些单薄、不完善。例如,如何比较下两组酮①环己酮与CH3C OCH2CH2CH3;②环己酮与环丁酮的反应活性呢?对此,学生在解答习题时常会感到困难,不知该如何去分析解答。因为仅从上述两方面的影响因素去考虑,显然是不够的,无法做出正确判断。我们先来讨论例①。由于烷基的供电子能力差别甚小,因此,这两个 54
高中化学 醛和酮 糖类(第1课时)常见的醛酮 醛酮的化学性质教案 鲁科版
第二章第3节醛和酮糖类 第一课时常见的醛、酮醛酮的化学性质(1) 教材分析: 醛和酮是含有羰基的两类重要化合物,在官能团的转化和有机合成中占有核心地位,是有机合成的“中转站”。学生已对有机物结构与性质的关系有所了解,故要应用结构推测性质的思想方法研究醛和酮的化学性质。本节教材选取的反应依据两个方面:一与生产、生活相关;二与有机化合物的相互转化有关。糖类与生命现象、人类生活相关,而结构与醛、酮相关,故放在本节中介绍,这样可以使学生更深刻地认识糖,也加深对羰基的认识。 学情分析: 学生通过学习,掌握了烃、醇的命名方法,认识到有机化合物结构与性质的密切联系,并初步建立了分类观。第二章第1节引导学生多角度的认识有机化学反应,学生通过自我构建的有机化学理论预测醇可能发生的化学反应类型。常见醛、酮的重要性质及其在生产生活中的广泛应用是本节课学习的基本要点,根据醛、酮的结构准确预测其性质是学生的提高点。 教学目标: 一、知识与能力: 1.了解醛、酮在自然界的存在,能列举几种简单的醛、酮,并能写出其结构简式,了解其在实际生产和生活中的应用。 2.能够用系统命名法对简单的醛、酮命名。 3.了解醛、酮的结构特点,比较官能团的相似和不同,能预测醛、酮可能发生的化学反应。 二、过程与方法: 通过交流研讨,培养比较、分析、演绎等思维能力及参与交流研讨活动的能力。 三、情感、态度与价值观: 了解醛、酮对环境和健康可能产生的影响,增强环境意识,关注有机物的安全使用。 重点难点: 重点:醛、酮在生产、生活的应用; 难点:醛、酮的物理性质及其结构特点。 教学方法:合作探究,讲练结合,训练建构 教学手段:多媒体课件辅助教学 设计思路: 【教学过程】
2.3.1 常见的醛和酮 学案(含答案)
2.3.1 常见的醛和酮学案(含答案) 第第3节节醛和酮醛和酮糖类糖类 第第1课时课时常见的醛和酮常见的醛和酮核心素养发展目标 1.宏观辨识与微观探析,通过醛基.酮羰基的官能团的不同,知道醛和酮结构的差异.命名,理解醛.酮的物理性质。 2.科学态度与社会责任了解甲醛对环境和健康的影响,知道常见醛.酮的物理性质,关注有机化合物安全使用的问题。 一.醛.酮的结构和命名1醛.酮的组成与结构醛酮结构特点羰基碳原子分别与氢原子和烃基或氢原子相连羰基的碳原子与两个烃基相连官能团名称醛基酮羰基官能团结构简式或CHO组成通式饱和一元醛CnH2nOn1饱和一元酮CnH2nOn3 2.醛.酮的命名1系统命名选主链选含醛基或羰基且最长的碳链做主链。 编位号从靠近醛基或羰基的一端开始编号_________。 写名称醛基碳是一号碳,支链以取代基的形式标明,位号写在名称前面。酮分子中的羰基碳必须标明其位号。 例如命名为3-甲基丁醛。 命名为2-戊酮。 2习惯命名命名为甲醛,命名为苯甲醛。
3醛.酮的同分异构体1官能团类型异构饱和一元醛.酮的通式都是CnH2nO,即含相同数目碳原子的饱和一元醛与饱和一元酮互为同分异构体,如CH3CH2CHO和。 饱和一元醛和等碳原子数的一元烯醇互为同分异构体,如 CH3CH2CHO和烯醇CH2CHCH2OH羟基不能连接碳碳双键。 饱和一元醛还与同碳数环状化合物互为同分异构体,如 CH3CH2CHO与.和。 2官能团位置异构醛基一定在1号位上,故醛不存在此类异构。 酮存在官能团位置异构,如与。 3碳骨架异构分子中碳原子数较多时,醛和酮均存在碳骨架异构,如CH3CH2CH2CHO和。 甲醛结构的特殊性1甲醛分子中连接两个氢原子,没有烃基,结构式为,1molHCHO相当于含2molCHO。 2由于羰基中的碳原子与氧原子之间以双键连接,所以甲醛分子中所有原子共面。 例1下列关于醛的说法正确的是A甲醛是甲基跟醛基相连而构成的醛B醛的官能团是COHC饱和一元醛的分子式符合CnH2nO 的通式D甲醛.乙醛.丙醛均无同分异构体 【考点】 醛的组成与结构 【题点】
第十三章不饱和醛酮及取代醛酮
第十三章 不饱和醛酮及取代醛酮 (Unsaturated Aldehydes and Ketones) (Substituted Aldehydes and Ketones) 一 α, β– 不饱和醛酮 (α,β- Unsaturated Aldehydes 、Ketones) 分类: 双键与羰基共轭 α,β—不饱和醛酮 双键与羰基相隔较远 n 双键与羰基相连烯 酮 C C C O C C C C O n ≥1 C C C O 制备: CH 3CHO CH 3CHO 32CH 3CH CHCHO -H 2O △+取代醛 α,β—不饱和醛OH OH O CH CHC CHO O C CH 3 + α,β— 不饱和酮 OH 反应: C C 1.CH CH C O 2. 亲电加成 共轭加成 (1, 4–加成) 2 1 3 4 1 加HCN CH CH C δ δ δδO α,β-不饱和酮主要发生1 , 4-加成 α,β-不饱和醛发生1 , 2 -加成 R , CH CH C O R HCN R , C O RCH CH H , RCH
例: HX R , C O RCH CH X R , CH CH C O R R H(R ,) CH CH C O H 2NOH 3 H(R , ) CH CH C O R H(R ,) CH CH C O R N H R H(R ,) CH CH 2C O NHOH R H(R ,) CH CH 2C O SO 3Na R H(R ,) CH CH 2C O N 例: O C 6H 5CH CHC 25C 6H 5 C O CN CH 2C 6H 5CH 93~96% C 6H 5 KCN , CH 3COOH 例: O HCN (C H )Al O + 85% 2 加RMgX 格氏试剂与α, β– 不饱和醛、酮发生反应,1 , 2 -加成,1 , 4-加成产物均有,哪种产物为主,取决于α, β– 不饱和醛、酮的结构。 CH O CH 3C 6H 5CH C CH CH 3C 2H 5OH C 6H 5CH C O CH 3 C 2H 5 C 6H 5CH C CH 2252. H 3O 1,2—加成 40%1,4—加成 60% + CH O H CH H OH C 6H 5 C 6H 5CH C 6H 5MgX 2C 6H 5CH C CH CH 3O C 6H 5CH C CH CH 3 OH C 6H 5 C 6H 5CH C C 6H 5MgX 2+ 1. Et 2O 1,2—加成 100% + 21,2—加成 88%
不饱和醛酮选择性加氢汇编
不饱和醛酮选择性加氢 第一部分背景介绍 不饱和醇应用于大量的工业生产中,药物合成、香料、聚合物、除草剂等。目前一种合成不饱和醇的方法是将不饱和醛酮进行催化加氢。但是由于C=C键比C=O键在加氢过程中在热力学中更加有利。所以研发新型催化剂对不饱和醛酮选择性加氢十分重要。 这里,介绍了五种新型催化剂催化不同的不饱和醛酮加氢,希望为今后的研究提供新的基础。 第二部分文献综述 一、Sn修饰SiO2负载Pt催化剂的制备:一种丁烯醛选择性加氢的新型Pt-Sn 双金属催化剂[1] 方案1. 丁烯醛加氢的还原路径 丁烯醛的氢化路径,如方案1。在负载了Ⅷ族金属催化剂中,会得到丁醛而不产生丁烯醇,第二种金属加入到Ⅷ族金属催化剂中,来阻止C=C键的氢化[2,3-5]。特别的,Sn修饰负载在SiO2、氧化铝或活性炭上的Ⅷ族金属,大量的被研究[2,6-10]。我们研究了Sn的加入使生成不饱和醇的选择性大大增加[11,.12]。 方案2. Sn-Pt/SiO2双金属催化剂对于丁烯醛选择性加氢。(a)理想反应(b)实际反应方案2为我们提出的由传统浸渍法制备的Sn-Pt/SiO2催化丁烯醛的反应机
理。Sn n+例如SnO和SnO2提高了对C=O的活性,然而SnPt合金的形成或通过金属Sn进行Pt表面原子的稀释,会抑制C=C的氢化[13]。对于理想状态(方案2a),不饱和醛通过C=O基团的O原子,吸附在SnO x(例如SnO或SnO2)上。然后,活化的C=O基团被通过Pt表面活化的H攻击形成不饱和醇。由于C=C键会与Pt相互作用,所以C=C键的氢化不可避免。然而,如果Pt区域完全被Sn 覆盖,由于H分子不能被活化,则氢化反应不会发生。 为了不在活性明显下降的情况下,进一步提高对不饱和醇的选择性,需要两个条件。一个不饱和醛的是C=C键不直接与Pt表面接触,来抑制C=C氢化。另一个是H分子在Pt表面上被活化。有两个策略来避免Pt区域和不饱和醛的直接接触。一个是形成足够均匀的SnPt合金。正如之前提到的,金属Sn形成SnPt 可以抑制C=C键和Pt的相互作用。因此,为了制备足够均匀的SnPt合金,C=C 键的氢化被抑制。另一个是通过SnO2层来避免Pt和C=C键的相互作用,活化C=O基团的SnO x存在在Pt金属附近,尽管SnO x通过SiO2层与Pt完全分离。 根据前面的方案,我们尝试制备SiO2包裹在SnPt内部的纳米粒子[14]。这种纳米粒子(摩尔比Sn/Pt=1.0)用多元醇工艺来制备。在这种方法,形成均一的SnPt合金纳米粒子。这些催化剂具有高选择性(66.7%,转化率为41.1%),由于SnPt合金中心和反应物方向的控制的协同效应。 方案3. Sn/SP催化丁烯醛加氢 对于后者策略,这种催化剂是Pt纳米粒子覆盖到多孔的SiO2层,Sn在SiO2层的外表面。目前,包裹在SiO2壳内部的金属或金属氧化物纳米粒子,在很多领域进行了研究[15-23]。很多研究报道了Ni[16,17],Pt[18,19],FePt[20]和Rh[21-23]纳米粒子包裹到介孔SiO2壳中。报道了SP催化剂通过金属醇盐在反相胶束溶液中水解作用来合成,SiO2层是微孔和介孔。把Sn加入到SP催化剂中,控制孔的尺寸使H2可以进入Pt孔,然而不饱和醛不能进入Pt孔,我们提出了新的概念如方案3。由于不饱和醛不能进入Pt纳米粒子孔,C=C键的氢化被抑制,在SiO2外表面Sn位点的C=O键被活化。由中心Pt粒子活化的溢流氢通过Sn的吸附攻
醛酮总结
一.醛酮羰基上的亲核加成反应 影响因素:电子效应、空间效应和亲核试剂的亲核能力 1. 与氢氰酸的加成 反应条件:碱催化,醛、脂肪族甲基酮和8个碳以下的环酮。 应用:制备多一个C 的 -羟基酸 2.与NaHSO3 加成 产物:白色结晶物 反应物条件:醛(芳香醛、脂肪醛)脂肪族甲基酮8个碳以下的环酮。 应用:醛或甲基酮的分析 醛或甲基酮的纯化 鉴别醛脂肪族甲基酮8个碳以下的环酮 3. 与醇和水的加成 (1) 与醇的加成 注意:可逆反应 条件:干燥HCl 常用于:保护醛基,抗氧化、抗还原、抗碱 (2)与醛的加成 与醛相比,酮与醇反应生成缩酮的反应比较困难。但醇易于乙二醇作用,生成具有五元环状结构的缩酮。
条件:干燥HCl 应用:保护酮基或连二醇结构 4. 与Grignard试剂的加成 条件:乙醚 应用:制备各种醇(碳链增长) 5. 醛酮与胺类化合物的缩合 (1)与2, 4-二硝基苯肼反应(羰基化试剂)生成2, 4-二硝基苯腙(黄色固体) 注意:可逆反应 条件:所有醛类,酮类物质 酸性条件 应用:鉴别醛酮类物质 (2)羰基化合物与伯胺加成产生希夫碱 注意:可逆反应 可从羰基的正电性、试剂的亲核性、反应物的空间位阻分析亲核反应二、α-碳和α-氢的反应 醛、酮分子中,与羰基直接相连的碳原子称α-碳,α-碳上的氢成为α-氢。含α-H的醛、酮,其α-H受C=O影响,可发生离解。(①羰基的吸电子作用增大了C-H键的极性,α-氢易离去②α-氢离去后,醛,酮可通过形成负电荷离域化氧原子和α-碳上,趋于稳定)α-H 的反应主要有两种:卤代(醛酮合成羧酸)、缩合(醛酮合成醇)Ⅰ.卤代(卤仿)
(完整版)羰基的亲核加成及相关反应
羰基的亲核加成及相关反应 羰基化合物包括醛、酮、羧酸及衍生物和 5.1羰基的结构 CO 2。 C O 亲电中心羰基碳的活性较大,易被亲核试剂进攻而发生亲核加成反应和亲核取代反应。 5.2亲核加成反应的历程及影响因素 5.2.1 HCN 的加成 反应为碱催化。 v k[ CO ][CN ] 快 OH - + HCN CN - + H 2O 、f 慢 \ H 2O \ /OH CNJ / = O — /C 、b +0H - / CN / CN 酮正向反应的趋势较小(空阻大) 二、亲核加成反应的一般特点 1 .反应可以被酸或碱催化 酸催化可提高羰基的亲电活性。 碱催化提高亲核试剂的亲核性。 活性.Nu - > Nu — H 2?多数醛酮的亲核加成为可逆反应,用于分离与提纯。 5.2.2影响羰基亲核加成反应活性的因素 一、羰基化合物的结构 1 .电子效应 羰基碳的正电性越大,亲核加成速度越大,反应活性越大。羰基碳所连的吸电基( 加成反应的活性增加,而供电基( +I , +C )则使其活性降低。 活泼顺序: Nu —H + OH Nu - + H 2O C=O + C = O H — C +—OH -I , -C )使其亲核
50% ClCHO > HCHO > RCHO > CH 3COR > RCOOR' > RCONR' 2 > RCOO (1)-共轭效应(增加其稳定性);(2) +C 效应(降低羰基碳的正电性);(3)加成产物失去共轭 能,反应活化能高;(4 )产物的张力大幅增加。 2.立体效应 、试剂的亲核性 对同一羰基化合物,试剂的亲核性越大,平衡常数越大,亲核加成越容易。 1 .带负电荷的亲核试剂比起共轭酸(中性分子)的亲核性强。 OH ->H 2O, RO ->ROH 。 2?极性大的分子比极性小的分子亲核性强。 HCN>H 2O (极性与电负性)。 3?同周期元素的负离子的亲核性与碱性大小一致; R 3C ->R 2N ->RO ->F - 4?同一主族元素的负离子的亲核性与可极化度大小一致。 l ->Br ->CI ->F - 5.2.3亲核加成反应的立体化学 一、非手性的羰基化合物的加成 前(潜)手性分子 结果得外消旋化产物 、手性羰基化合物的亲核加成方向遵守 Cram 规则,得立体选择性的非对称异构体产物。 -I > +C 什C ) 什C,空阻) (+C > -I) 什 C) 活性极低 O II H > CH 3—C —H O II >CH 3—C —CH 3 > O O II II O >CH 3CH 2-C-CH 2CH 3> Ph-C —Ph R Nu R#、o - R Nu R'/ OH 50% dl R R ,Z Q C x Nu R R'Z OH C ? Nu R O ) 张力增加 O
