必修一第一章物质的量知识点归纳
专题一 物质的量
【知识回顾】
一、第一章知识结构框架图:
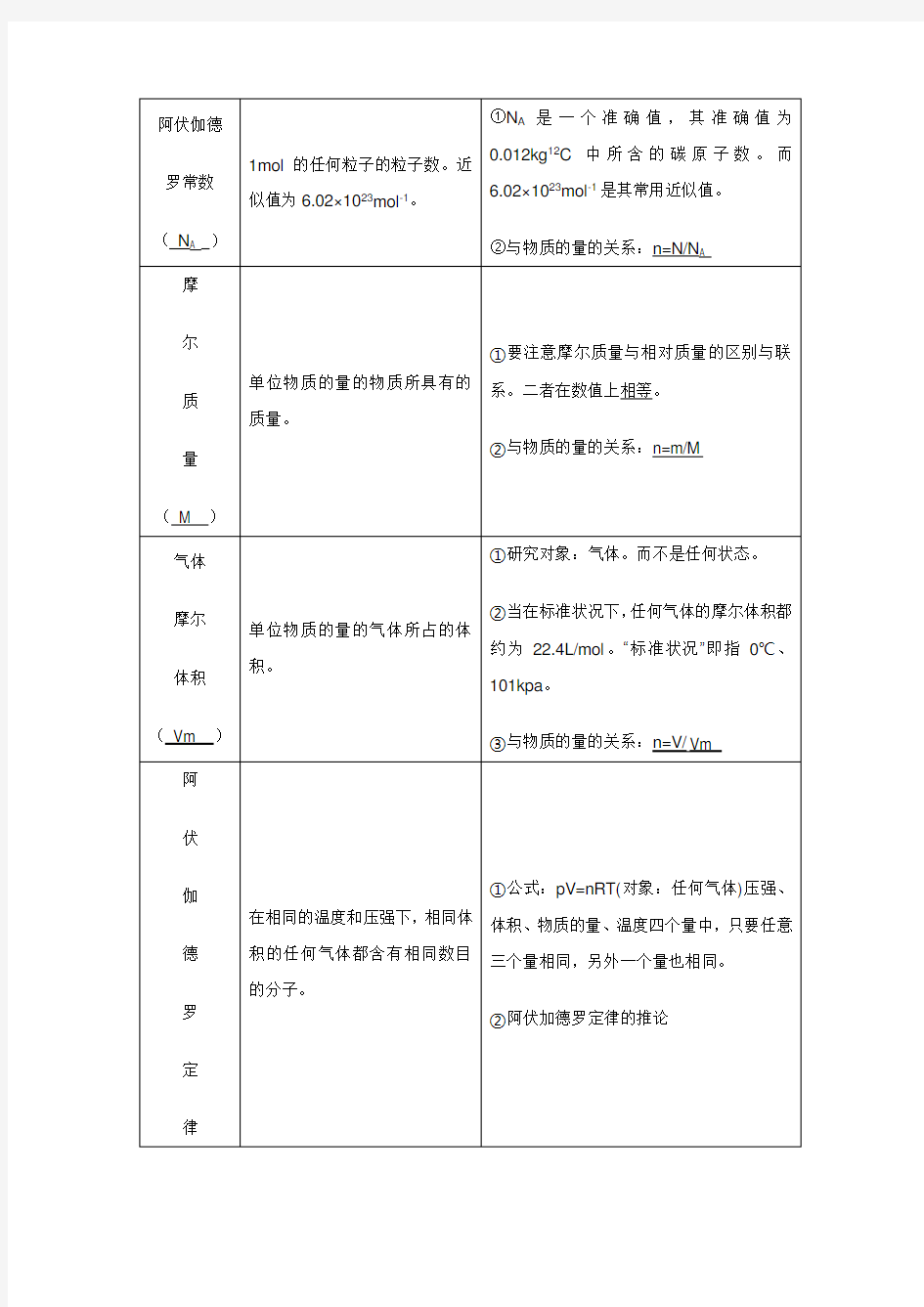
二、物质的量相关知识点 1、基本概念
【即时练习】
判断正误。(概念理解)
1 1mol大米
2 1mol氧
3 水的摩尔质量等于N A个水分子质量之和。
4 1mol CH4和1mol CO所含分子数目相同。
【答案与解析】
1(X)物质的量是用来描述微观粒子的物理量,不能描述宏观物体。
2(X)使用物质的量一定要指明具体的微粒。例如1mol氧分子(O2)或1mol氧原子(O)。3(X)摩尔质量不等于质量,摩尔质量的单位是g/mol,质量的单位是g。
4(√)1mol的任何粒子的粒子数都相等,为N A个。
2、知识网络:
3、阿伏加德罗定律
1)同温同压下相同体积的任何气体都具有相同的分子数:PV =nRT
说明:
(1)阿伏加德罗定律依然是忽略了气体分子本身的大小 (2)阿伏加德罗定律比气体摩尔体积的应用更为广泛:
① 主要是应用于不同气体之间的比较,也可以同一种气体的比较 ② 被比较的气体既可以是纯净气体又可以是混合气体 2) 阿伏加德罗定律的重要的四个推论
(1)同温同体积时,任何气体的压强之比都等于其物质的量之比,也等于其分子数之比
2
1
2121N N n n P P == (2)同温同压时,任何气体的体积之比都等于其物质的量之比,也等于其分子数之比
2
1
2121N N n n V V == (3)同温同压同体积时,任何气体的质量之比都等于其摩尔质量之比,也就是其式量之比
2
1
21M M m m = (4)同温同压同体积时,任何气体的密度之比都等于其摩尔质量之比,也就是其式量
之比
2
1
2121M M m m ==ρρ
4、分子量的有关计算
(1)标准状况下mgA 气体的体积为V 升,求A 的相对分子质量M=
4
.22V m
(2)标准状况下A 气体的密度为ρg/L ,求A 的相对分子质量ρ4.22=M 使用说明:
① 适用于所有的物质,不受物质状态的限制,也适用于所有的混合物 ② 所有物质:ρm V M =,标准状况下气体ρ4.22=M
③ 某有机物气体在同温同压下对氢气的相对密度为2.69,求该气体的式量。
2
1
21M M D ==
ρρ 使用说明:
A. 相对密度是在同温同压下两种气体的密度之比
B. 既可以用于纯净气体之间的计算,也可以用于混合气体之间
(3)平均相对分子质量
有a mol A 气体,与b mol B 气体混合,则混合气体的平均式量为 M —
总
总n m =
=
i
i
M n %∑=i
i
M V %∑
5、一定物质的量浓度溶液的配制
C 1V 1=C 2V 2
【课堂练习】 相对原子质量:H-1 C-12 O-16 Na-23 P-31 S-32
一、 选择题
1、用1 g NaOH 固体配制成0.5 mol/L NaOH 溶液,所得溶液的体积是 ( ) A .0.5ml
B .5ml
C .50ml
D .500ml
2、设N A 表示阿伏加得德罗常数的数值,下列叙述中正确的是 ( ) A .1 mol NH 3所含有的原子数为N A
B .常温常压下,22 .4 L 氧气所含的原子数为2N A
C .常温常压下,48 g O 3所含的氧原子数为3N A
D.1 L 0.1 mol/LNaCl溶液中所含的Na+为N A
3、设N A表示阿伏加德罗常数,下列说法正确的是()
A.1 mol氦气中有2N A个氦原子
B.14 g氮气中含N A个氮原子
C.2 L 0.3 mol·L-1 Na2SO4溶液中含0.6 N A个Na+
D.18 g水中所含的电子数为8N A
4、科学家已发现一种新型氢分子,其化学式为H3,在相同条件下,等质量的H3和H2相同
的是
A.原子数B.分子数C.体积 D.物质的量
5、同温同压下,等质量的下列气体所占有的体积最大的是
A.O2B.CH4C.CO2D.SO2
6、在标准状况下,将某X气体VL溶于水中,得到12mol·L-1的溶液500mL,则气体的体积V是()
A.134.4L B.67.2L
C.44.8L D.537.6L
7、体积为V mL,密度为d g·cm-3的溶液,含有相对分子质量为M的溶质mg,其物质的量浓度为c mol·L-1,质量分数为w,下列表达式正确的是()
A.c=(w×1000×d)/M
B.m=V×d×(w/100)
C.w=(c×M)/(1000×d)%
D.c=(1000×m)/(V×M)
8.在一定温度下,已知有关某饱和溶液的一些数据:①溶液的质量,②溶剂的质量,③溶液的体积,④溶质的摩尔质量,⑤溶质的溶解度,⑥溶液的密度,利用下列各组数据计算该
饱和溶液的物质的量浓度,不能
..算出的一组是()
A.④⑤⑥B.①②③④
C.①④⑥D.①③④⑤
9、一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.1000mol·L -1的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L-1)为()
提示:①H2C2O4是二元弱酸
②10[KHC2O4·H2C2O4]+8KMnO4+17H2SO4===8MnSO4+9K2SO4+40CO2↑+32H2O
A.0.008889 B.0.08000
C.0.1200 D.0.2400
10、下列说法正确的是()
A .1mol 物质的质量叫做摩尔质量
B .两个等容容器,一个盛一氧化氮,另一个盛N 2、H 2混合气,同T 、同P 下两容器内气体原子总数一定相同,分子总数和质子总数也相同
C .将98g H 2SO 4溶于500mL 水中所得到的溶液浓度为2mol/L
D .等质量的O 2和O 3中所含的氧原子数相等
11、同温同压下,A 容器中H 2和B 容器中的NH 3所含氢原子数相等,则两个容器的体积比是 ( )
A .3∶2
B .1∶3
C .2∶3
D .1∶2
12、下列叙述中正确的是 ( )
A .镁的原子质量就是镁的相对原子质量
B .一个氧原子的实际质量约等于16
6.02×1023
g
C .水的相对分子质量等于18g
D .二氧化硫的摩尔质量是64g
13、下列说法正确的是 ( )
A .200mL 1mol/L 的Al 2(SO 4)3溶液中,Al 3+和SO 2-4离子总数为6.02×1023
B .标准状况下,22.4L Cl 2和HCl 的混合气体中含分子总数为2×6.02×1023
C .0.1mol 8135Br 原子中含中子数为3.5×6.02×1023
D .30g 甲醛中含共用电子对总数为4×6.02×1023
14、用N A 表示阿伏加德罗常数,下列叙述中正确的是 ( )
A .100mL 0.1mol/L 的稀硫酸中含有硫酸根的个数为0.1N A
B .1mol CH +
3(碳正离子)中含有电子数10N A
C .2.4g 金属镁与足量的盐酸反应,转移电子数为2N A
D .12.4g 白磷中含有磷原子数为0.4N A 15、由14CO 和12CO 组成的混合气体与同温、同压下空气(平均相对分子质量为29)的密度相同,则下列关系正确的是 ( )
A .混合气体中14CO 与12
CO 的分子数之比为14∶15 B .混合气体中14CO 与12CO 的物质的量之比为1∶1 C .混合气体中14CO 与12CO 的质量之比为14∶15 D .混合气体中14CO 与12CO 的密度之比为1∶1
16、由CO 、H 2和O 2组成的混合气体,在一定条件下恰好完全反应,测得生成物在101kPa 、120℃下对空气的相对密度为1.293,则原混合气体中H 2所占的体积分数为 ( )
A.16
B.23
C.14
D.13
17、若以ω1和ω2分别表示浓度为a mol·L -1和b mol·L -
1氨水的质量分数,且知2a =b ,则下列推断正确的是(氨水的密度比纯水的小) ( )
A .2ω1=ω2
B .2ω2=ω1
C .ω2>2ω1
D .ω1<ω2<2ω1
18有一稀硫酸和稀硝酸的混合酸,其中H 2SO 4和HNO 3的物质的量浓度分别是4mol/L 和2mol/L ,取10mL 此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体的体积为(设反应中HNO 3被还原成NO) ( )
A .0.448L
B .0.672L
C .0.896L
D .0.224L
二、填空题
1、右图是用自来水制取少量蒸馏水的简易装置,(加热及固定仪器略),其原理与教材中的实验完全相同。回答下列问题:
⑴左边大试管中要加入几片碎瓷片,其作用是
;
⑵该装置中使用的玻璃导管较长,其作用是;
⑶烧杯中还要盛有的物质是。
2、为除去粗盐中的Ca2+、Mg2+、Fe3+、SO2-4以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
(1)判断BaCl2已过量的方法是__________________________________。
(2)第④步中,相关的化学方程式是_______________________________________。
(3)配制NaCl溶液时,若出现下列操作,其结果偏高还是偏低?
A.称量时NaCl已潮解()
B.天平的砝码已锈蚀()
C.定容摇匀时,液面下降又加水()
D.定容时俯视刻度线()
3.现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂出去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液。相应的实验过程可用下图表示:
请回答下列问题:
⑴写出实验流程中下列物质的化学式:试剂X_________,沉淀A________,沉淀
B___________。
⑵上述实验流程中加入过量的Na2CO3的目的是____________________________
______________________________________________________。
(加热)
⑶按此实验方案得到的溶液3中肯定含有__________(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的___________,之后若要获得固体NaNO3需进行的实验操作是___________(填操作名称)。
5、已知标准状况下1体积水溶解了560体积氨气,所得氨水的密度为0.9g/cm3,试求该氨水的质量分数和物质的量浓度。
高一数学必修一知识点整理归纳
高一数学必修一知识点整理归纳 【集合与函数概念】 一、集合有关概念 1.集合的含义 2.集合的中元素的三个特性: (1)元素的确定性如:世界上的山 (2)元素的互异性如:由HAPPY的字母组成的集合{H,A,P,Y} (3)元素的无序性:如:{a,b,c}和{a,c,b}是表示同一个集合 3.集合的表示:{…}如:{我校的篮球队员},{太平洋,大西洋,印度洋,北冰洋} (1)用拉丁字母表示集合:A={我校的篮球队员},B={1,2,3,4,5} (2)集合的表示方法:列举法与描述法。 注意:常用数集及其记法:https://www.360docs.net/doc/7d2371054.html, 非负整数集(即自然数集)记作:N 正整数集:N*或N+ 整数集:Z 有理数集:Q 实数集:R 1)列举法:{a,b,c……} 2)描述法:将集合中的元素的公共属性描述出来,写在大括号内表示集合{x?R|x-3>2},{x|x-3>2} 3)语言描述法:例:{不是直角三角形的三角形}
4)Venn图: 4、集合的分类: (1)有限集含有有限个元素的集合 (2)无限集含有无限个元素的集合 (3)空集不含任何元素的集合例:{x|x2=-5} 二、集合间的基本关系 1.“包含”关系—子集 注意:有两种可能(1)A是B的一部分,;(2)A与B是同一集合。 反之:集合A不包含于集合B,或集合B不包含集合A,记作AB或BA 2.“相等”关系:A=B(5≥5,且5≤5,则5=5) 实例:设A={x|x2-1=0}B={-1,1}“元素相同则两集合相等” 即:①任何一个集合是它本身的子集。AíA ②真子集:如果AíB,且A1B那就说集合A是集合B的真子集,记作AB(或BA) ③如果AíB,BíC,那么AíC ④如果AíB同时BíA那么A=B 3.不含任何元素的集合叫做空集,记为Φ 规定:空集是任何集合的子集,空集是任何非空集合的真子集。 4.子集个数: 有n个元素的集合,含有2n个子集,2n-1个真子集,含有2n-1个非空子集,含有2n-1个非空真子集 三、集合的运算 运算类型交集并集补集 定义由所有属于A且属于B的元素所组成的集合,叫做A,B的交集.记作AB(读作‘A交B’),即AB={x|xA,且xB}.
物质的量知识点小结
物质的量知识点小结(一) 有关概念: 1、物质的量(n) ①物质的量是国际单位制中七个基本物理量之一。 ②用物质的量可以衡量组成该物质的基本单元(即微观粒子群)的数目的多少,它的单位是摩尔,即一个微观粒子群为1摩尔。 ③摩尔是物质的量的单位。摩尔是国际单位制中七个基本单位之一,它的符号是mol。 ④“物质的量”是以摩尔为单位来计量物质所含结构微粒数的物理量。 ⑤摩尔的量度对象是构成物质的基本微粒(如分子、原子、离子、质子、中子、电子等)或它们的特定组合。如1molCaCl2可以说含1molCa2+,2molCl-或3mol阴阳离子,或含54mol质子,54mol电子。摩尔不能量度宏观物质,如果说“1mol氢”就违反了使用准则,因为氢是元素名称,不是微粒名称,也不是微粒的符号或化学式。 ⑥使用摩尔时必须指明物质微粒的名称或符号或化学式或符号的特定组合。 2.阿伏加德罗常数(N A): ①定义值(标准):以0.012kg(即12克)碳-12原子的数目为标准;1摩任何物质的指定微粒所含的指定微粒数目都是阿伏加德罗常数个。 ②近似值(测定值):经过科学测定,阿伏加德罗常数的近似值一般取6.02×1023,单位是mol-1,用符号N A表示。 3.摩尔质量(M): ①定义:1mol某微粒的质量 ②定义公式:, ③摩尔质量的单位:克/摩。 ④数值:某物质的摩尔质量在数值上等于该物质的原子量、分子量或化学式式量。⑤注意:摩尔质量 有单位,是克/摩,而原子量、分子量或化学式的式量无单位。 物质的量练习题(一) 一、选择题(每小题1~2个正确答案) 1、下列关于摩尔质量的说法正确的是 A、氯气的摩尔质量是71克 B、氯化氢的摩尔质量为36.5 g/moL C、1摩氢气的质量为2克 D、O2的摩尔质量为16g/moL。 2、对于相同质量的二氧化硫和三氧化硫来说,下列关系正确的是 A、含氧原子的个数比为2∶3 B、含硫元素的质量比是5∶4 C、含氧元素的质量比为5∶6 D、含硫原子的个数比为1∶1 3、1克氯气含有n个Cl2分子,则阿佛加德罗常数可表示为 A、71n B、(1/71)n C、35.5n D、(1/35.5).n 4、将a g氯化钾溶于1.8L水中,恰使K+离子数与水分子数之比为1∶100,则a值为 A.0.745 B.0.39 C.39 D.74.5 5、在一定体积的容器中加入1.5mol氙气(Xe)和7.5mol氟气,于400℃和2633kPa压强下加热数 小时,然后迅速冷却至25℃,容器内除得到一种无色晶体外,还余下4.5mol氟气,则所得无色
高一历史必修一知识点汇总.
第1课从内外服联盟到封邦建国 知识结构: 1.夏:出现公共权力,但保留氏族公社特点。 2.商:政治制度是内服与外服制度,具有浓厚的神权色彩。 3.西周: 分封制定义: 目的:巩固周的统治(奴隶主的统治 主体:同姓亲族 宗法制目的:巩固分封制形成的统治秩序,解决贵族之间在权力、财产和土地继承上的矛盾。 核心:嫡长子继承制 内容:确立大宗、小宗体系 作用:利于凝聚宗族,防止内部纷争,强化王权 工具:礼乐制度 第2课中央集权制度的确立 知识结构: 1.统一 (1群雄割据 A.春秋争霸 B.战国变法:秦国商鞅变法。 (2统一:时间:前221年;人物:赢政。 2、中央集权的确立
(1确立: A. “皇帝制”:皇权至上、皇位继承制 B. 三公九卿制:三公是丞相、御史大夫、太尉(中央 C. 郡县制(地方 (2加强皇权的措施:制定官吏选拔和考核制度;制定细苛、严密的法律。 (3影响:打破分封制,奠定大一统王朝制度基础。 第3课中央集权与地方分权的斗争 知识结构: 1. 汉初郡国并行,导致诸候尾大不掉,引发七国之乱。 2. 汉武帝集权措施:建中朝、设刺史、颁布推恩令。 3. 藩镇割据与五代十国:唐朝中后期,地方势力增强,出现藩镇割据局面;唐灭亡后,中国进入五代十国的分裂时期,五代十国是藩镇割据的继续和发展;这一时期,南方经济得到较大发展;后周世宗改革,为北宋结束五代十国分裂局面奠定了基础。 4. 宋加强中央集权 (1措施①收精兵:“三衙”、枢密院、原则; ②削实权:设通判、文臣任州郡长官; ③制钱谷:财赋大部分运往京师; (2影响利:改变藩镇割据分裂局面,加强中央集权; 弊:造成“积贫积弱”的后患。 第4课专制皇权的不断加强
人教版高中化学必修一物质的量一
第一单元物质的量(一) 教学目的 1.使学生初步理解摩尔的意义,了解物质的微粒数、物质的质量、摩尔质量之间的关系,了解摩尔质量与式量的联系与区别,并能较熟练地进行摩尔质量的计算。 懂得阿伏加德罗常数的涵义。 2.了解引进摩尔这一单位的重要性和必要性, 3.培养学生演绎推理、归纳推理和运用化学知识进行计算的能力。 教学重难点1.对摩尔概念的内涵的理解; 2.运用摩尔进行有关计算。 教学过程 讲授新课 点燃 引入:问学生反应 C + O2 ===== CO2所表达的意义? 一个碳原子一个氧分子一个二氧化碳分子 -------微观粒子(1)在实验室里,拿一个原子和一个分子反应,容易做到吗? 一般用质量:1克 1克 2克是否容易做到呢? 反应是按比例: 12克 32克 44克 --------宏观质量 (2)怎样知道一定质量的物质里含有多少个微粒? (3)微观粒子和宏观质量之间有什么联系?科学家统一确定了一个新的 物理量-----物质的量,它将微粒与质量联系起来了。 【板】一、物质的量: 【投影】物理量单位符号 长度米 m 质量千克 Kg 时间秒 s 电流安培 A 热力学温度开尔文 K 发光强度坎德拉 cd 物质的量摩尔(mol) n 学生阅读:摩尔的概念。(请看书本第6页最后一节。) 分析讲解:(比喻)一打铅笔---12支;一箱易拉罐可乐---24瓶;一盒粉笔---50支。 为什么要定12克---数值与原子量同阿伏加德罗常数 12克C-12 所含原子数。 学生计算得出NA--- 12/1.997×10-26 6.02×1023 阿伏加德罗常数(精确值)与6.02×1023(近似值)的关系就象π与3.14一样。 引导学生看书:P7(图1-5)1摩尔碳;1摩尔硫;1摩尔P;1摩尔K2Cr2O7的体积。 【提问1】1摩尔金刚石约含碳原子数?1摩尔O2中约含分子数?1摩尔H2O中约含分子数?【板】1、物质的量:表示物质微粒集体的物理量。 2、摩尔(mol):物质的量的单位。简称摩,符号为mol。 3、阿伏加德罗常数:6.02×1023mol-1 (近似值) 【强调】使用摩尔应注意:1摩尔碳原子约含有6.02×1023个碳原子。 每摩尔碳原子含有阿伏加德罗常数个碳原子。 【提问2】1摩尔氯气中含有多少个微粒?个氯分子。 【强调】一般说多少摩尔物质,指的是构成该物质的微粒。
物质的量知识点总结
物质的量知识点复习 1、摩尔 物质的量是国际规定的七个基本物理量之一,用来表示含一定数目粒子的集体,符号是n,单位是mol。 摩尔是计量原子、分子、或离子等微观粒子的物质的量的单位。 阿伏伽德罗常数是任何粒子的粒子数,符号是N A,常用×1023这个近似值。 2、摩尔质量 1mol任何粒子或物质的质量以克为单位时,在数值上都与相对原子质量或相对分子质量相等。 摩尔质量是指单位物质的量的物质所具有的质量,符号是M,常用单位是g·mol-1 3、- 4、 5、使用摩尔这个概念时应注意的事项 (1)摩尔是物质的量单位,每摩尔物质含有阿伏伽德罗常数个粒子,摩尔简称摩,符号mol。 (2)摩尔的量度对象是构成物质的基本粒子,这里的“粒子”是指“基本单元”,这个基本单元可以是分子、原子、离子、电子、质子、中子等单一粒子,也可以是这些粒子的特定组合。如 1molCaCl2可以说含1molCa2+,2molCl-或3mol阴、阳离子,或 含54mole-等。 (3)摩尔概念只适用微观不适用于宏观。
(4) 使用摩尔表示物质的量时,应该用化学式指明粒子种类,而不 是使用该粒子的中文名称。 6、 气体摩尔体积 当分子数目相同时,气体体积大小主要决定于气体分子间的距离。要比较一定质量的气体体积,必须在相同温度和压强下进行。 ; 气体摩尔体积:单位物质的量气体所占的体积,符号为Vm,单位是L/mol 或m 3/mol 。 标准状况下气体的摩尔体积:标准状况下,即温度为0℃,压强为101Kpa 时,1mol 任何气体所占的体积都约是。 5阿伏伽德罗定律及推论: 根据气体状态方程PV =nRT =RT M m 可以得到以下定律和推论: (1) 同温同压下,相同体积的任何气体都含有相同数目的分子。(阿 伏伽德罗定律) (2)同温同压下的不同气体,其体积之比等于物质的量之比,等于所含粒子数目之比。2 12121N N n n V V == (3) 同温同压下的不同气体,其密度之比等于相对分子质量之比,等于相对密度。2121ρρ=M M =D 12 (4)同温同压下同质量的不同气体,其密度之比等于物质的量的比。2121 ρρ= n n @ (5)同温同压下同质量的不同气体,其体积之比等于相对分子质量
高中地理必修一知识点总结完整版
高中地理必修一知识点总结完整版 第一部分地球的宇宙环境 ★考点1:了解不同级别的天体系统,说明地球在太阳系中的位置。 (1)天体系统的含义:宇宙中的各种天体之间相互吸引、相互绕转,形成天体系统。 (2)天体系统由高到低的层次: (3)地球在太阳系中的位置: 太阳系成员:太阳、行星及卫星、小行星、彗星、流星体、行星际物质;中心天体是太阳。八大行星按距日由近到远依次是水星、金星、地球、火星、木星、土星、天王星、海王星。 ★考点2:知道地球是太阳系中一颗既普通又特殊的行星,理解地球上存在生命的条件。 (1)普通性体现在: ①八大行星绕日公转运动的特征:同向性、共面性、近圆性; ②八大行星根据距日远近、质量、体积等特征分为三类:类地行星(水星、金星、地球、火星)、巨行星(木星、土星)、远日行星(天王星、海王星) (2)特殊性体现在:地球存在生命物质 ★考点3:了解太阳辐射对地球的影响。 (1)太阳直接为地球提供了光、热资源,地球上生物的生长发育离不开太阳。
(2)太阳辐射能维持着地表温度,是促进地球上的大气、水运动和生物活动的主要动力。 (3)为人类生产、生活提供直接和间接的能源。(石油、天然气).太阳辐射影响因素(三个) 我国太阳能资源分布特点及原因 太阳能风能开发条件评价 能源丰富,市场大小距离,资金,技术,政策 新能源的优点:清洁无污染,可再生。缺点:能量密度小,变化大不稳定。 ★考点4:了解太阳活动对地球的影响。 (1)太阳大气层由内至外可以分为光球、色球、日冕层。 (2)太阳活动最主要的类型是黑子和耀斑,分别出现在太阳大气层的光球和色球,其活动的平均周期为11年。 (3)太阳活动对地球的影响主要有: ①影响无线电短波信号,导致通讯衰减或中断。②产生“磁暴”现象,指南针不能正确指示方向。③两极地区高空大气产生极光现象。④地球上许多自然灾害的发生与太阳活动有相关性。 ★考点5:知道地球自转和公转的方向、周期和速度 ★考点6:理解昼夜更替和地方时产生的原因,能够进行简单的区时计算。 (1)昼夜更替现象产生的原因:地球是不透明的球体,因此有昼半球和夜半球之分;地球持续不停地自转,因此昼、夜半球所处部分不停地变化,就有了昼夜更替现象。昼夜更替的周期是1个太阳日。(2)地方时产生的原因:地球自转使得同纬度地区不同地点见到太阳的时刻会有早晚。地方时的确定与经度的对应关系:太阳直射的那条经线地方时为12点,晨线与赤道相交点所在经线的地方时为6点,昏线与赤道相交点所在经线的地方时为18点。同一条经线上的地方时相同,经线(经度)不同地方时不同。经度每隔15°,地方时相差1小时;经度每隔1°,地方时相差4分钟。 (3)时区与区时 时区:为了统一标准,国际上把经度15°划分为一个时区,全球划分为24个时区。
高一化学必修一物质的量讲解大全
物质的量讲义 (一) 一、概念 1.物质的量 (1)概念:表示物质所含微粒数目多少的物理量 (2)符号:n (3)单位:摩尔(mol) 2.摩尔 (1)概念:摩尔是物质的量的单位,每1mol物质含有阿伏加德罗常数个结构微粒。 (2)符号:mol (3)说明:①必须指明物质微粒的名称,不能是宏观物质名称,例:不能说1摩氢、1摩氧,因这样说指哪种微粒不明确。 ②常见的微观粒子有:分子、原子、离子、电子、质子、中子或它们特定的组合 ③当有些物质的微观粒子只有一种时,可以省略其名称 3.阿伏加德罗常数 (1)含义:实验测定12g12C中碳原子的个数 (2)符号:N A (3)单位:个/mol (4)说明:①N A的基准是12g碳-12中的原子个数 ②12C不仅是摩尔的基准对象,而且还是相对原子质量的基准 ③N A是一个实验值,现阶段常取6.02×1023作计算 ④要注意N A与6.02×1023的区别 4.摩尔质量 (1)概念:单位物质的量的物质的质量 (2)符号:M (3)单位:g·mol-1 (4)说明:①使用范围:A.任何一种微观粒子 B.无论是否纯净 C.无论物质的状态 ②与式量的比较:式量无单位 ③与1mol物质的质量的比较: 5.气体摩尔体积 (1)概念:单位物质的量的气体的体积 V (2)符号: m (3)单位:L·mol-1 (4)标准状况下的气体摩尔体积 ①标准状况:0℃、1atm即1.01×105Pa ②理想气体:A.不计大小但计质量 B.不计分子间的相互作用 ③标准状况下的气体摩尔体积:约22.4L·mol-1 (5)影响物质体积大小的因素: ①构成物质的微粒的大小(物质的本性) ②结构微粒之间距离的大小(温度与压强来共同决定) ③结构微粒的多少(物质的量的大小) 6.物质的量浓度 (1)概念:用单位体积的溶液中溶解溶质的物质的量的多少来表示溶液的浓度 (2)符号:c (3)单位:mol·L-1
物质的量的浓度知识点整理
完美格式整理版 第八讲物质的量的浓度 1.复习重点 1.物质的量浓度的概念及有关计算; 2.溶解度的概念及有关计算; 3.物质的量浓度、质量分数和溶解度之间的相互换算; 4.配制一定物质的量浓度溶液的方法和技能。 5.高考的热点是物质的量浓度的概念及其计算,一定物质的量浓度的溶液的配制方法。 2.难点聚焦 1.物质的量浓度。 浓度是指一定温度、压强下,一定量溶液中所含溶质的量的多少。常见的浓度有溶液中溶质的质量分数,溶液中溶质的体积分数,以及物质的量浓度。物质 的量浓度是以单位体积溶液里所含溶质 B 的物质的量来表示溶液组成的物理量。符号用c表示, (2) 表达式: C单位常用 mol/L3 或 mol/m ,注意:①单位 B B 体积为溶液的体积,不是溶剂的体积。②溶质必须用物质的量来表示。计算公式为概念中的单位体积一般指 1 升,溶质 B 指溶液中的溶质,可以指单质或化合物, 2, c(NaCl ) =2.5mol/L ;也可以指离子或其它特定组合,如2+42-) =0.01mol/L 等。 如 c(Cl ) =0.1mol/L c( Fe ) =0.5mol/L, c(SO 2.溶液的稀释与混合(1) 溶液的稀释定律 由溶质的质量稀释前后不变有:m B =m 浓×ω浓=m稀×ω稀 % 由溶质稀释前后物质的量不变有:C B =c 浓×V浓 =c 稀×V稀 % (2)溶液在稀释或混合时,溶液的总体积不一定是二者混合的体积之和。如给出溶液混合后的密度,应根据质量和密度求体积。 3.物质的量浓度与溶质质量分数ω%的换算(ρ为该溶液的密度) 4.一定物质的量浓度溶液的配制 (1)仪器:容量瓶,容量瓶有各种不同的规格,一般有 100mL、250mL、 500mL和 1000mL等几种。 (2) 步骤:①计 算:计算所需固体溶质质量或液体溶质的体积。②用托盘天平称量固体溶质或用量筒量取液体体积。 ③溶解:将溶质加入小烧杯中,加适量水溶解。④移液洗涤:将已溶解而且冷却的溶液转移到容量瓶中,并用玻璃棒引流,再洗涤烧杯和玻璃棒2— 3 次,将洗涤液倒入容量瓶中。⑤定容:缓缓向容量瓶中注入蒸馏水,直到容量瓶液面接近刻度线1cm-2cm 时,改用胶头滴管滴加蒸馏水至溶液的凹液面正好与刻度线相切, 盖好,反复上下颠倒,摇匀。最后将容量物质的量浓度dream第1页5/11/2019瓶中溶液转移到试剂瓶中备用。
高中数学必修一知识点总结(全)
第一章集合与函数概念 课时一:集合有关概念 1.集合的含义:集合为一些确定的、不同的东西的全体,人们能意识到这些东 西,并且能判断一个给定的东西是否属于这个整体。 2.一般的研究对象统称为元素,一些元素组成的总体叫集合,简称为集。 3.集合的中元素的三个特性: (1)元素的确定性:集合确定,则一元素是否属于这个集合是确定的:属于或不属于。 例:世界上最高的山、中国古代四大美女、教室里面所有的人…… (2)元素的互异性:一个给定集合中的元素是唯一的,不可重复的。 例:由HAPPY的字母组成的集合{H,A,P,Y} (3)元素的无序性:集合中元素的位置是可以改变的,并且改变位置不影响集合 例:{a,b,c}和{a,c,b}是表示同一个集合 3.集合的表示:{…} 如:{我校的篮球队员},{太平洋,大西洋,印度洋,北冰洋} (1)用大写字母表示集合:A={我校的篮球队员},B={1,2,3,4,5} (2)集合的表示方法:列举法与描述法。 1)列举法:将集合中的元素一一列举出来 {a,b,c……} 2)描述法:将集合中元素的公共属性描述出来,写在大括号内表示集合。 {x R| x-3>2} ,{x| x-3>2} ①语言描述法:例:{不是直角三角形的三角形} ②Venn图:画出一条封闭的曲线,曲线里面表示集合。 4、集合的分类: (1)有限集:含有有限个元素的集合 (2)无限集:含有无限个元素的集合 (3)空集:不含任何元素的集合例:{x|x2=-5} 5、元素与集合的关系: (1)元素在集合里,则元素属于集合,即:a A (2)元素不在集合里,则元素不属于集合,即:a A 注意:常用数集及其记法: 非负整数集(即自然数集)记作:N 正整数集 N*或 N+ 整数集Z 有理数集Q 实数集R
化学必修一《物质的量》计算
高一化学第一章计算能力题专项训练 一:单项选择: 1、下列溶液中,物质的量浓度为1mol/L 的是() A.将40gNaOH溶于1L水所得的溶液B.将80gSO3溶于水并配成1L的溶液 C.将0.5mol/LNaNO3溶液100ml 加热蒸发掉50g 水的溶液 D.含K+2mol 的K2SO4溶液2L 2、下列条件下,两瓶气体所含原子数一定相等的是()A.同质量,不同密度的N2和CO B.同温度,同体积的H2和N2 C.同体积,同密度的C2H4和C2H6 D.同压强,同体积的N2O和CO2 3、一定量的质量分数为14%的KOH 溶液,若将其蒸发掉50g水后,其溶质质量分数恰好扩大一倍,体积变为62.5ml,则浓缩后溶液的物质的量浓度为() A.2.2mol/L B.4.0mol/L C.5.0mol/L D.6.25mol/L 4、标准状况下的aLHCl(g)溶于1000g 水中,得到的盐酸密度为bg/cm3,则该盐酸的物质的量浓度是() A.a /22.4 mol/L B.ab/22400 mol/L C.ab/(22400+36.5a ) mol/L D.1000ab/(22400+36.5a) mol/L 5、在标准状况下,与12gH2的体积相等的N2的() A.质量为12g B.物质的量为6mol C.体积为22.4L D.物质的量为12mol 6、两个体积相同的容器,一个盛有NO,另一个盛有N2 和O2,在同温、同压下,两容器内的气体一定具有相同的() A.原子总数B.氧原子数C.氮原子数D.质量 7、在标准状况下,由CO和CO2组成的混合气体13.44L,质量为20g。此混合气体中C和O 两种原子的物质的量之比() A.3:4 B.4:3 C.2:1 D.1:2 8、20gA 物质和14gB物质恰好完全反应,生成8.8gC物质、3.6gD 物质和0.2molE 物质,则E 物质的摩尔质量为() A.100 g/mol B.108 g/mol C.55 g/mol D.96 g/mol 9、实验室里需用480mL0.1 mol/L 的硫酸铜溶液,现选用500mL 容量瓶进行配制,以下操作正
高中语文必修一知识点归纳总结
高中语文必修一知识点归纳总结 1、字音:沁(qǐn)园春百舸(gě)峥(zhēng)嵘寥廓(kuò)挥斥方遒(qíu)漫(màn)江携(xié)来浪遏(è)飞舟 2、词义: 峥嵘:本义形容山势高峻突出,引申为不平常。 挥斥方遒:热情奔放,劲头十足。遒,强劲有力。 激扬:激浊扬清,批评坏的,褒扬好的。 3、近义词辨析: 寥廓:(天空)高原空旷。 辽阔:(土地海洋等)辽远广阔。 意气:意志和气概,志趣和性格。也指因主观偏激而产生的情绪,如意气用事。 义气:由于私人关系而甘于承担风险或牺牲自己利益的气概。如讲义气。 遏制:制止,控制(一般只能是一定程度上的效果)。 遏止:用力阻止住。如滚滚洪流,不可遏止。 4、文学常识: 1字音:彷(páng)徨寂寥(liáo)惆怅(chàng)凄婉(wǎn)颓圮(pǐ) 青荇(xǐng)浮藻(zǎo)长篙(gāo)漫溯(sù)斑斓(lán)笙(shēng)箫 2、词义: 彷徨:(心事重重)地走来走去,犹疑不决。
颓圮:坍塌,毁坏。 3、近义词辨析: 沉淀:指沉到溶液底层的难以溶解的物质,比喻凝聚,积累。 积淀:指长时间积累起来的习俗、文化。 彷徨:犹疑不决的走来走去。 倘佯:自由自在地走来走去。 4、文学常识: 徐志摩(1896-1931),笔名云中鹤、南湖,浙江海宁人。诗人、 学者。新月社的主要发起人和主要成员之一。诗集有《志摩的诗》《翡冷翠的一夜》《猛虎集》等,名篇有《再别康桥》《沙扬娜拉》《在病中》等。 一、通假字 1、无能为也已(矣) 2、共其乏困(供) 3、秦伯说,与郑人盟(悦) 4、失其所与,不知(智) 5、何厌之有(餍) 6、若不阙秦(缺) 二、古今异义(古/今) 1、贰于楚也(从属二主、有二心/数词二的大写) 2、以为东道主(东方道路上的主人/泛指主人) 4、今有急而求子(您,多指男子/儿子) 5、越国以鄙远(边远的地方/粗鄙、低下) 6、以烦执事(婉指秦穆公/掌管某事的人) 7、亦去之(离开、距离/到达) 8、微夫人之力(那个人/尊称人的妻子) 三、词类活用 (一)名词作动词
物质的量知识点讲解讲解学习
五、物质的量知识点复习 一、有关概念: 1、物质的量(n) ①物质的量是国际单位制中七个基本物理量之一。 ②用物质的量可以衡量组成该物质的基本单元(即微观粒子群)的数目的多少,它的单位是摩尔,即一个微观粒子群为1摩尔。 ③摩尔是物质的量的单位。摩尔是国际单位制中七个基本单位之一,它的符号是mol。 ④ “物质的量”是以摩尔为单位来计量物质所含结构微粒数的物理量。 ⑤摩尔的量度对象是构成物质的基本微粒(如分子、原子、离子、质子、中子、电子等)或它们的特定组合。如1molCaCl2可以说含1molCa2+,2molCl-或3mol阴阳离子,或含54mol质子,54mol电子。摩尔不能量度宏观物质,如果说“1mol氢”就违反了使用准则,因为氢是元素名称,不是微粒名称,也不是微粒的符号或化学式。 ⑥使用摩尔时必须指明物质微粒的名称或符号或化学式或符号的特定组合。2.阿伏加德罗常数(N A):①定义值(标准):以0.012kg(即12克)碳-12原子的数目为标准;1摩任何物质的指定微粒所含的指定微粒数目都是阿伏加德罗常数个。 ②近似值(测定值):经过科学测定,阿伏加德罗常数的近似值一般取6.02×1023,单位是mol-1,用符号N A表示。 3.摩尔质量(M): ①定义:1mol某微粒的质量 ②定义公式:, ③摩尔质量的单位:克/摩。 ④数值:某物质的摩尔质量在数值上等于该物质的原子量、分子量或化学式式量。⑤注意:摩尔质量有单位,是克/摩,而原子量、分子量或化学式的式量无单位。 4.气体摩尔体积(V m) ①定义:在标准状况下(0℃,101kPa时),1摩尔气体所占的体积叫做气体摩尔体积。 ②定义公式为: ③数值:气体的摩尔体积约为22.4升/摩(L/mol)。 ④注意:对于气体摩尔体积,在使用时一定注意如下几个方面:一个条件(标准状况,符号SPT),一个对象(只限于气体,不管是纯净气体还是混合气体都可),两个数据(“1摩”、“约22.4升”)。如“1mol 氧气为22.4升”、“标准状况下1摩水的体积约为22.4升”、“标准状况下NO2的体积约为22.4升”都是不正确的。 ⑤理解:我们可以认为22.4升/摩是特定温度和压强(0℃,101kPa)下的气体摩尔体积。当温度和压强发生变化时,气体摩尔体积的数值一般也会发生相应的变化,如273℃,101kPa时,气体的摩尔体积为44.8升/摩。 5.阿伏加德罗定律 ①决定物质体积的三因素:物质的体积由物质的微粒数、微粒本身体积、微粒间的距离三者决定。气体体积主要取决于分子数的多少和分子间的距离;同温同压下气体分子间距离基本相等,故有阿伏加德罗定律:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。反之也成立。 ②阿伏加德罗定律:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。 ③阿伏加德罗定律及推论适用的前提和对象:可适用于同温、同压的任何气体。 6.阿伏加德罗定律的有关推论: (其中V、n 、p、ρ、M分别代表气体的体积、物质的量、压强、密度和摩尔质量。) ①同温同压下:; ②同温同体积:。 7.标准状况下气体密度的计算 根据初中所学知识,密度=质量÷体积,下面我们取标准状况下1mol某气体,则该气体的质量在数值上等于摩尔质量,体积在数值上等于摩尔体积,所以可得如下计算公式: 标况下气体的密度(g·L-1)=气体的摩尔质量(g·mol-1)÷标况下气体的摩尔体积(L·mol-1)。 8.物质的量浓度 浓度是指一定温度、压强下,一定量溶液中所含溶质的量的多少。常见的浓度有溶液中溶质的质量分数,溶液中溶质的体积分数,以及物质的量浓度。 ①定义:物质的量浓度是以单位体积(1升)溶液里所含溶质B的物质的量来表示溶液组成的物理量。 ②定义公式为: ③单位:常用mol/L
人教版高中英语必修一知识点归纳总结
高中必修一到必修五主要语法点 必修一:直接引语和间接引语(宾语从句);现在进行时表将来;定语从句 必修二:定语从句(非限定定从、定从中的介词前提);被动语态(一般将来时、现在完成时及现在进行时的被动语态) 必修三:情态动词;名词性从句(主语从句、宾语从句、表语从句及同位语从句) 必修四:主谓一致;非谓语动词(V-ing) ;构词法 必修 2 第一单元,非限制性定语从句的第二单元一般将来时的主被动第三单元现在完成时的主被动第四单元 现在进行时的主被动第五单元介词+which/whom的用法 必修 3 一二单元情态动词的用法三单元宾语从句和表语从句四单元主语从句 五单元同位语从句 必修4 第一单元主谓一致第二单v-ing作主语和宾语的用法第三单元v-ing作表语,定语和宾语补足语第四单 元v-ing作状语第五单元构词法 必修5 第一单元过去分词作定语和表语第二单元过去分词作宾语补足语第三单元过去分词作状语第四单元 倒装句第五单元省略句 必修一各单元知识点总结 Unit One Friendship 一、重点短语 1.go through 经历,经受get through 通过;完成;接通电话 2. set down 记下,放下 3. a series of 一系列 4 on purpose 有目的的 5. in order to 为了 6. at dusk 傍晚,黄昏时刻 7. face to face 面对面 8. fall in love 爱上 9. join in 参加(某个活动);take part in 参加(活动) join 加入(组织,团队,并成为其中一员) 10. calm down 冷静下来 11. suffer from 遭受 12. be/get tired of…对…感到厌倦 13. be concerned about 关心 14. get on/along well with 与…相处融洽 15. be good at/do well in 擅长于… 16. find it + adj. to do sth. 发现做某事是…
化学必修一《物质的量》计算
高一化学第一章计算能力题专项训练 一:单项选择: 1 、下列溶液中,物质的量浓度为 1mol/L 的是( ) A. 将40gNaOH 溶于1L 水所得的溶液 B .将80gS θ3 溶于水并配成1L 的溶液 C.将0.5mol∕LNaNO 3溶液IOOmI 加热蒸发掉 50g 水的溶液 D .含 K +2moI 的 K 2SO 4 溶液 2L 2、 下列条件下,两瓶气体所含原子数一定相等的是( ) A. 同质量,不同密度的 N 2和CO B.同温度,同体积的 H 2 和N 2 C.同体积,同密度的 C 2H 4和C 2H 6 D.同压强,同体积的 N 2O 和CO 2 3、 一定量的质量分数为 14% 的 KOH 溶液, 若将其蒸发掉 5Og 水后, 其溶质质量分数恰好扩 大一倍,体积变为 62.5ml ,则浓缩后溶液的物质的量浓度为( ) A. 2.2mol∕L B . 4.Omol∕L C . 5.Omol∕L D . 6.25mol∕L 4、 标准状况下的 aLHCl ( g )溶于1000g 水中,得到的盐酸密度为 bg/cm 3,则该盐酸的物质 的量浓度是( ) A. a /22.4 mol/L B . ab/224OO mol/L D . 1OOOab/(224OO+36.5a) mol/L 5、在标准状况下,与 12gH 2的体积相等的N 2的( ) A. 质量为12g B .物质的量为6mol C .体积为22.4L 的气体一定具有相同的( ) A .原子总数 B ?氧原子数 C 氮原子数 D ?质量 7、在标准状况下,由 CO 和CO 2组成的混合气体13.44L ,质量为20g 。此混合气体中C 和O 两种原子的物质的量之比( ) A . 3:4 B . 4:3 C . 2:1 D . 1:2 8、 2OgA 物质和 14gB 物质恰好完全反应,生成 8.8gC 物质、 3.6gD 物质和 O.2molE 物质, 则 E 物质的摩尔质量为( ) A . 1OO g/mol B . 1O8 g/mol C . 55 g/mol D . 96 g/mol 9、实验室里需用 48OmLO.1 mol/L 的硫酸铜溶液,现选用 5OOmL 容量瓶进行配制,以下操 作正确的是( ) A .称取7.68g 硫酸铜,配成 500mL 溶液 B .称取12.0g 胆矶,配成500mL 溶液 C.称取8.0g 硫酸铜,加入 500mL 水 D .称取12.5g 胆矶,配成500mL 溶液 C . ab/(224OO+36.5a ) mol/L D .物质的量为 12mol 6、两个体积相同的容器,一个盛有 NO ,另一个盛有 N 2和O 2,在同温、同压下,两容器内
物质的量知识点总结
、物质的量及其单位: 1、物质的量:与质量、长度等一样,是科学上来研究微粒的物理量。它的单位是摩尔。即:摩尔是表示物质的量的单位。(mol) 2、摩尔的基准:科学上以12克12C所含的原子数作为摩尔的基准。即每摩尔物质含有阿伏加德罗常数个微粒,近似值为 6.02 >1023o 小结:物质的量 n ( mol) =N/N A 二、摩尔质量:1mol物质中,微粒数是确定的,因而其总质量也随之确定。 定义:1mol物质的质量叫该物质的摩尔质量。单位: I厶+ ■砧曰 ,、物质的质量(g) 小结:物质的量 n( mol)= ----- 型一 摩尔质量(g/mol) 例:33g二氧化碳的物质的量是?与多少克氢气所含的分子数相等? 三、气体摩尔体积: 1固体和液体的摩尔体积: 2、气体的摩尔体积: 气体体积由分子间的平均距离决定,在相同条件下分子间平均距离相等,则体积相等。 定义:在标准状况下,1mol的任何气体所占的体积都约是22.4升,这个体积叫做气体 摩尔体积。单位升/摩”。 小结:物质的量 n (mol) =V/Vm 四、阿伏加德罗定律及其应用: 定义:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子, 伏加德罗定律(即三同和一同)。 PV=nRT 该定律的推论 2:同温同体积时,气体的压强之比等于物质的量之比,即 3:同温同压下,同体积的任何气体的质量之比,等于分子量之比,也等于密度之这就是阿 推论1同温同压下,气体的体积之比等于其物质的量之比,即V i n i — 推论 推论 比,即M i d m2M 2 d2 推论4:同温同压下,同质量的气体体积之比等于摩尔质量之反比,即 V1M2 V2 _ M1O 推论5:混和气体平均分子量的几种计算方法: (1)标准状况下,平均分子量—M M =22.4d (??? d= --- ) (1mol的物质所具有的质量 ) 22.4
高一语文必修一知识点总结
高一语文必修一知识点总结: 第一单元 1 《沁园春》 重要字音:沁(qǐn)园春百舸(gě) 峥(zhēng)嵘寥廓(kuò)挥斥遒(qíu) 漫(màn)江携(xié)来浪遏(è)飞舟 多音字:汗水可汗数字数典忘祖数见不鲜 重要字形:沁香分泌谩骂漫江惆怅为虎作伥苍茫沧桑阻遏碣 重要词义:峥嵘:本义形容山势高峻突出,引申为不平常。 挥斥遒:热情奔放,劲头十足。遒,强劲有力。 激扬:激浊扬清,批评坏的,褒扬好的。 近义词辨析: 寥廓:(天空)高原空旷。辽阔:(土地海洋等)辽远广阔。
意气:意志和气概,志趣和性格。也指因主观偏激而产生的情绪,如意气用事。 义气:由于私人关系而甘于承担风险或牺牲自己利益的气概。如讲义气。 遏制:制止,控制(一般只能是一定程度上的效果)。遏止:用力阻止住。如滚滚洪流,不可遏止。 2.《诗两首》 重要字音:彷(páng)徨寂寥(liáo) 惆怅(chàng)凄婉(wǎn)颓圮(pǐ)青荇(xǐng) 浮藻(zǎo)长篙(gāo) 漫溯(sù)斑斓(lán) 笙(shēng)箫 多音字:看守看见遒劲有劲着迷执著装载记载悄悄悄然重要字形:彷徨惶然惋惜哀婉彷徨牌坊惆怅稠密丝绸追溯朔风挑衅河畔斑斓无耻谰言波澜颓圮祭祀杞人忧天重要词义:彷徨:(心事重重)地走来走去,犹疑不决。颓圮:坍塌,毁坏。 近义词辨析: 沉淀:指沉到溶液底层的难以溶解的物质,比喻凝聚,积累。
积淀:指长时间积累起来的习俗、文化。 彷徨:犹疑不决的走来走去。倘佯:自由自在地走来走去。 3.《大堰河——我的保姆》 【基础知识】 重要字音:青苔(tāi)荆棘(jí)火钵(bō)忸(niǔ)怩麦糟(zāo) 炖(dùn) 肉 团箕(jī) 凌侮(wǔ) 叱(chì)骂 多音字:瓦菲菲薄泥巴拘泥漂泊湖泊青苔舌苔 重要字形:碾碎辗转堤堰揠苗助长偃旗息鼓凌侮陵墓棱角忸怩纽扣枢纽 重要词义:典押:把土地和房屋押给别人,换取一笔,到期还款,收回原物。 天伦:指父子、兄弟等关系。瓦菲:生长在瓦缝中的野草。凌侮:欺凌,侮辱。 近义词辨析:养育:抚养和教育。养活:供给东西使生活。 第二单元(《烛之武退师》《荆轲刺》《鸿门宴》)
物质的量知识点测试题带答案
物质的量知识点测试题 带答案 集团文件发布号:(9816-UATWW-MWUB-WUNN-INNUL-DQQTY-
必修1知识:物质的量&物质量的浓度&气体摩尔体积(一)物质的量基础知识 物质的量及单位(摩尔) 1. 物质的量以________中所含的_________数为标准来衡量其他微粒集体所含微粒数目多少的物理量,符号为________,单位是________.当使用该单位时,应指明对象是___________包括_______________________. 2. 阿伏伽德罗常数 ________所含的________称为阿伏伽德罗常数,符号为________,其值约为________,单位是________. 3. 物质的量、阿伏伽德罗常数与微粒数目(N)之间的数学表达式 为。 4. 摩尔质量 ________的物质所具有的质量叫摩尔质量,符号为 ________,单位为________或________.当摩尔质量的单位用________表示时,其数值等于该粒子的________. 5. 摩尔质量、物质的量与物质的质量之间的关系可用数学表达式表示为________. 答案: 1、0.012kg12C 碳原子 n mol 微观粒子离子、分子、原子、电子、质子、中子 6.02×1023 mol-1 2、1mol 任何粒子集体粒子数 N A 3、 n=N/N A 4、单位物质的量 M g?mol-1 g/mol 相对原子质量或相对分子质量 n=m/M
一、选择题 1.下列对于“摩尔”的理解正确的是() A.摩尔是国际科学界建议采用的一种物理量 B.摩尔是物质的量的单位,简称摩,符号为mol C.我们把含有6.02×1023个粒子的任何粒子的集合体计量为1摩尔 D.1mol氧含6.02×1023个O 2 【答案】B 2.下列名词中,哪个名词不属于物理量() A.长度 B.摩尔 C.质量 D.时间 【答案】B 【解析】长度、质量和时间都是物理量,在国际单位制中,长度的单位是米,质量的单位是g,时间的单位 是s;物质的量是物理量,其单位是摩尔,故选B。 3.下列说法正确的是() A.物质的量是一个基本物理量,表示物质所含粒子的多少 B.1mol氢中含有2mol氢原子和2mol电子 C.1molH 2O的质量等于N A 个H 2 O质量的总和(N A 表示阿伏加德罗常 数) D.摩尔表示物质的量的数量单位 【答案】C 【解析】A.物质的量是一个基本物理量,表示含有一定数目粒子集合体的物理量,故A错误;B.物质的
化学必修一物质的量的计算知识点总结
有关物质的量的计算知识点总结 1.物质的量 (1)定义:物质的量是量度一定量粒子的集合体中所含粒子数量的物理量。符号为n ,它是把微观粒子与宏观可称量物质联系起来的一种物理量。是国际单位制中规定的7个基本物理量之一。说明:物质的量是描述物质属性的一个物理量,与质量长度等一样。 (2)物质的量的单位:摩尔,简称摩,符号为mol 适用对象:“摩尔”这个单位不适用于宏观物理,只适用于微观粒子,如,分子、原子、离子、质子、中子、电子等以及他们的特定组合(缔合分子、原子团、官能团等)说明:使用摩尔量度微观粒子时,一定要指明微粒的种类,一般加化学式或微粒符号。如1molS 是正确的,但1mol 氢是错误的。 好多学生不理解物质的量的概念,在授课过程中要注意语言简洁,不用冗余的语言去解释它的概念。 2.阿伏加德罗常数 (1)定义:国际上规定1mol 任何粒子集合体所含的粒子数,称为阿伏加德罗常数,其准确数值与0.012kg 12C 中所含原子数相同,约为6.02×1023。 (2)表示:用符号N A 来表示,同上使用6.02×1023mol -1这个近似值表示,单位mol -1。 (3)物质的量(n )与粒子数(N )、阿伏加德罗常数(N A )之间的关系: A A nN N N N n ==, 3.摩尔质量 (1)定义:单位物质的量的物质所具有的质量,符号M ,常用单位g/mol 或g.mol -1,具体物质的物质的量为常数,不随物质的量的多少而改变。 说明:表示某物质的摩尔质量时,要指明具体粒子种类。如,氮分子(原子)的摩尔质量是正确的,但氮的摩尔质量是错误的。 (2)任何微粒的摩尔质量若以“g/mol ”为单位时,在数值上等于其相对原子(分子)质量,但二者单位不同。 (3)摩尔质量与物质的量之间的关系 物质的质量(m )、物质的量(n )、摩尔质量(M )之间的关系: n m N M m n ==, 4.气体摩尔体积 (1)定义:单位物质的量的气体所占的体积叫作气体摩尔体积。
人教版政治必修一知识点总结(最新整理)
第一单元 1、揭开货币的神秘面纱 1、商品 ①含义:用于交换的劳动产品 ②基本属性:使用价值(商品能够满足人们某种需要的属性)和价值(凝结在商品中的无差别的人类劳动) 2、货币的含义及本质 ①含义:从商品中分离出来固定充当一般等价物的商品(所以说货币是商品交换发展到一定阶段的产物) ②本质:一般等价物含义:货币具有表现和衡量其他一切商品价值大小的职能 3、货币的职能 (1)基本职能 ①价值尺度原因:货币本身有价值形式:观念上的货币含义:货币充当商品交换媒介的职能 ②流通手段形式:现实的货币商品流通:以货币为媒介的商品交换,公式是W-G-W (2)其他职能:贮藏手段、支付手段、世界货币 4、货币流通规律——流通中实际所需要的货币量受货币流通规律支配 ①其内容是:流通中所需要的货币量同商品的价格总额成正比,与货币的流通次数成反比 ②其公式: 商品价格总额=待售商品数量×商品价格水平 流通中所需要的货币量= 货币流通次数=货币流通次数 5、纸币 ①含义:由国家(或某些地区)发行的、强制使用的价值符号(国家能决定纸币的发行量、纸币的面值,但不能决定纸币的购买力或者纸币代表的价值) ②优点:制作成本低,易于保管、携带和运输,避免磨损减少贵金属的无形流失 ③限度:发行量要以流通中实际所需要的货币量为限度。过多易导致通货膨胀,过少易导致通货紧缩
6、电子货币:用电子计算机进行贮存、转账、购买、支付的 7、货币的发展:金属货币(金银条块——铸币)——纸币——电子货币 二、信用工具和外汇现金结算:用纸币来完成经济往来的收付行为 1、结算方式 转账结算:通过银行转账来完成经济往来的收付行为 现金结算:用纸币来完成经济往来的收付行为 2、常用的信用工具——信用卡、支票 ①信用卡(含义:具有消费、转账结算、存取现金、信用贷款等部分或全部功能的电子支付卡。银行信用卡是商业银行对资信状况良好的客户发行的一种信用凭证。优点:功能多、方便、节省、安全等) ②支票(含义:是活期存款的支付凭证,是出票人委托银行等金融机构见票时无条件支付一定金额给受款人或者持票人的票据。种类:转账支票和现金支票) 3、外汇含义:用外币表示的用于国际间结算的支付手段 4、汇率:又称汇价,是指两种货币之间的兑换比率(如果用100 单位外币可以兑换成更多的人民币,说明外币的汇率升高,外币升值;反之,则说明外币汇率跌落,外币贬值)人民币升值有利于进口,不利于出口。反之,相反。 5、保持人民币币值稳定 ①含义:对内保持物价总水平稳定,对外保持人民币汇率稳定 ②意义:对人民生活安定、国民经济持续快速健康发展,对世界金融的稳定、经济的发展,具有重要意义。 3、影响价格的因素 1、各种因素对商品价格的影响,是通过改变商品的供求关系来实现的。 2、供求影响价格 ①供不应求,价格升高——卖方市场(卖方起主导作用,处于有利地位) ②供过于求,价格降低——买方市场(买方起主导作用,处于有利地位) 3、价值决定价格 ①价值与价格的关系:价值是价格的基础,价格是价值的货币表现(一般情况下,商品价值量与价格成正比)
